Descrição
Abordagem dos principais métodos laboratoriais empregados na imunologia clínica.
PROPÓSITO
Compreender os principais métodos laboratoriais empregados na imunologia clínica, bem como sua importância e aplicabilidades na rotina laboratorial para auxiliar na escolha da melhor metodologia para um diagnóstico confiável, rápido, de baixo custo e que possibilite um tratamento eficaz e cuidadoso ao paciente.
OBJETIVOS
Módulo 1
Descrever os principais métodos laboratoriais imunológicos com reagentes não marcados
Módulo 2
Explicar os métodos laboratoriais imunológicos com reagentes marcados
Introdução
Neste tema, vamos explorar um pouco mais sobre a metodologia dos principais testes imunológicos empregados em um laboratório de análises clínicas.
Você sabe o que é um teste imunológico?
Os testes imunológicos são metodologias amplamente empregadas para detectar anticorpos contra os microrganismos. Isto é, antígenos que podem ser o próprio patógeno que causou a enfermidade ou qualquer substância que se comporte como um antígeno em uma interação com o anticorpo, como:
- Hormônios
- Drogas
- Ácidos nucléicos
- Receptores das células.
A partir desses testes, podemos fornecer uma confirmação diagnóstica, o diagnóstico precoce, a fim de acompanhar a evolução e o tratamento de uma doença, além de confirmar a presença de uma substância no organismo.
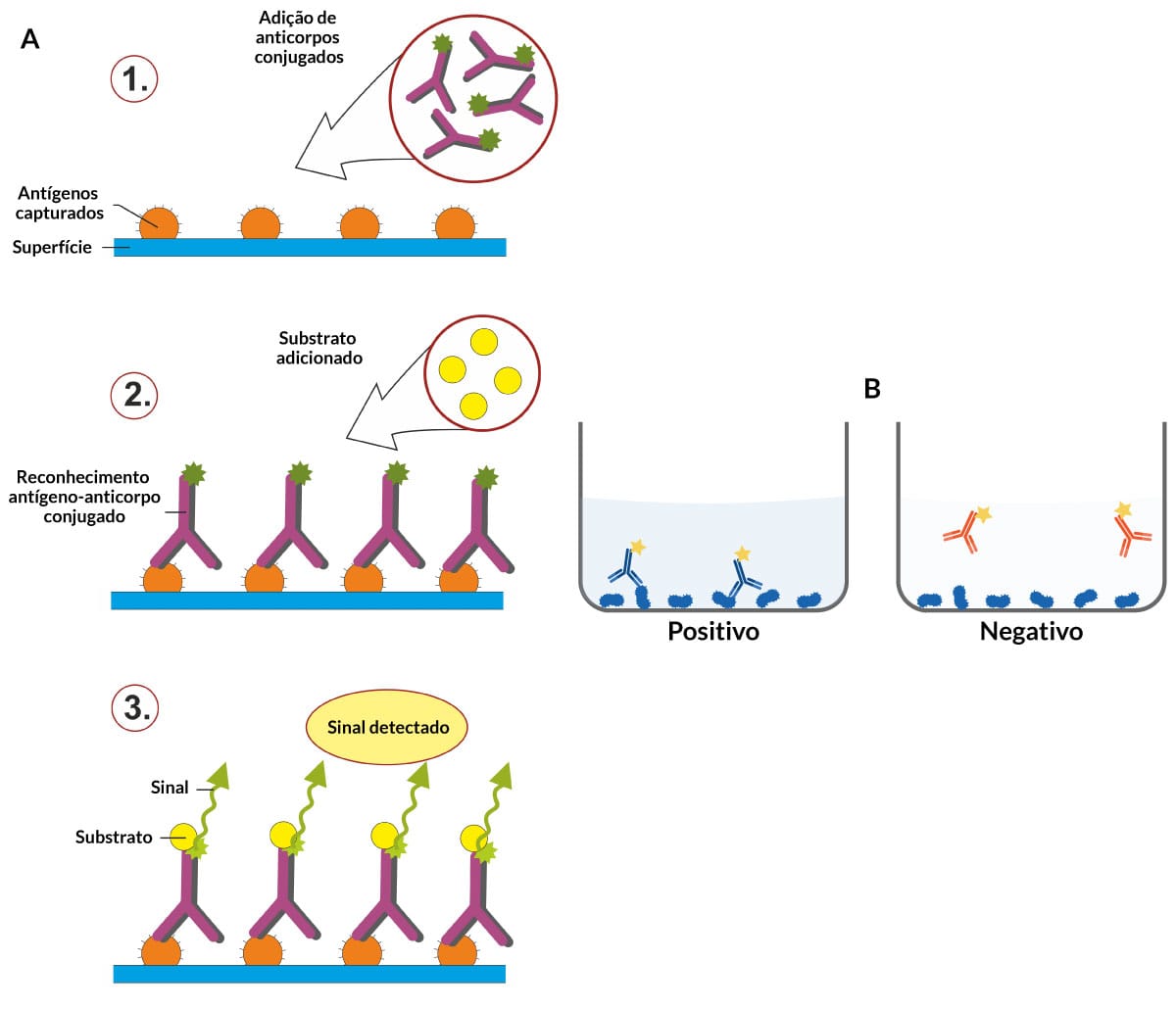
Atualmente, existe uma enorme variabilidade de testes imunológicos, como, por exemplo, as reações de precipitação, reações de aglutinação, reações de fixação de complemento, ensaios imunocromáticos, imunoenzimáticos, dentre outros. Todas essas técnicas são baseadas no reconhecimento antígeno-anticorpo e podem ser feitas a partir de reagentes marcados com algum corante fluorescente ou quimioluminescentes, radioisótopos, enzimas que geram uma coloração ao final da reação ou reagentes não marcados, gerando uma interação que é visível a olho nu.
Dica
Imunosorologia é a detecção quantitativa e qualitativa da interação antígeno e anticorpo que visa o diagnóstico.
Você certamente já ouviu falar em ELISA, ensaios de precipitação e teste rápido. Sabe qual a diferença entre eles? Ao longo desta jornada, vamos entender como esses testes são realizados e como cada técnica pode ser empregada, compreendendo a diferença entre eles e as principais vantagens e desvantagens. Para melhor entendimento, vamos dividir esses testes em dois grandes grupos:
- Métodos que usam reagentes não marcados
- Métodos que usam reagentes marcados.
MÓDULO 1
Descrever os principais métodos laboratoriais imunológicos com reagentes não marcados
Métodos laboratoriais imunológicos com reagentes não marcados
Como mencionamos, os métodos laboratoriais imunológicos que utilizam imunorreagentes livres de marcação são técnicas que possibilitam uma interação antígeno e anticorpo que podemos visualizar. Nesse tipo de reação, ocorre o reconhecimento de anticorpos com antígenos solúveis e a formação de precipitados insolúveis.
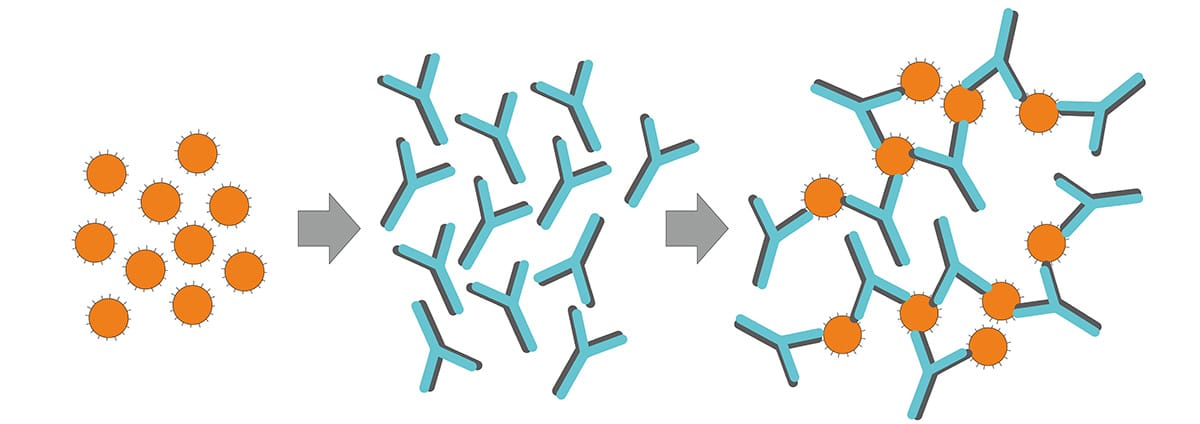
Quando o antígeno pesquisado é um microrganismo, como uma bactéria, um protozoário, uma hemácia, ou seja, um antígeno particulado, os anticorpos, ao reconhecerem o antígeno, irão se aglutinar (Figura 1). De modo diferente, quando o antígeno está ligado à superfície celular, o resultado da interação com o anticorpo pode ser a lise celular.
Precipitados
São produtos que não são capazes de se dissolver.
Dentre as técnicas imunológicas com reagentes não marcados, destacam-se:
Reações de precipitação
Aglutinação
Fixação do complemento
Reações de precipitação
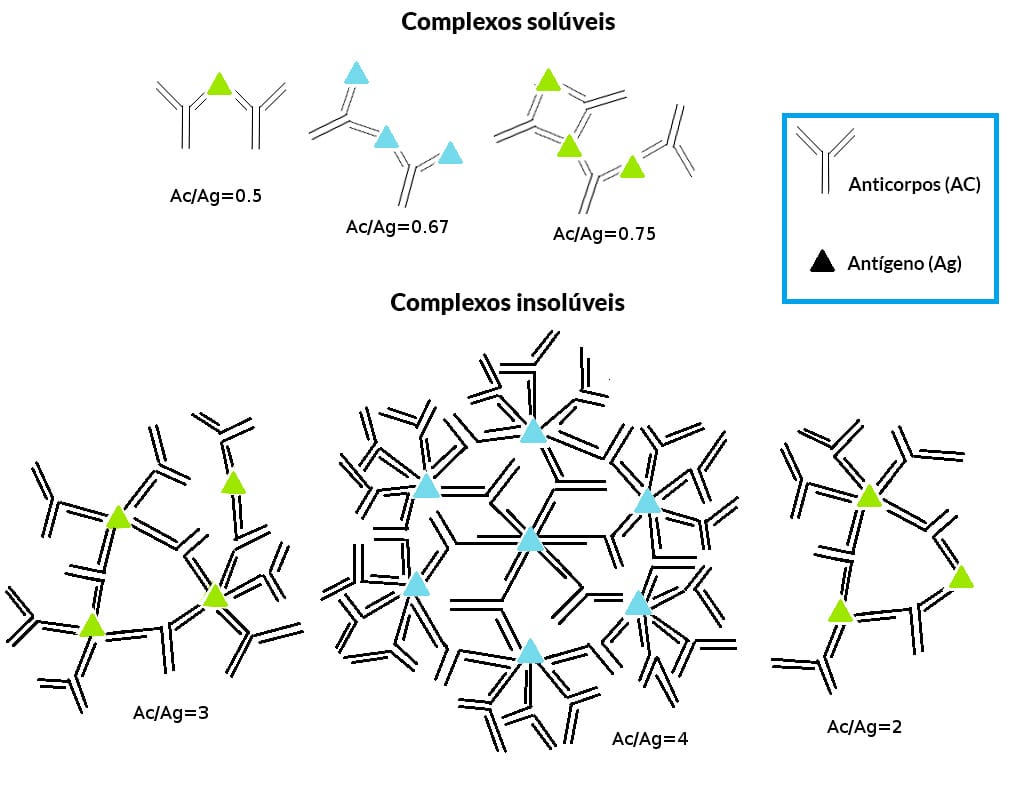
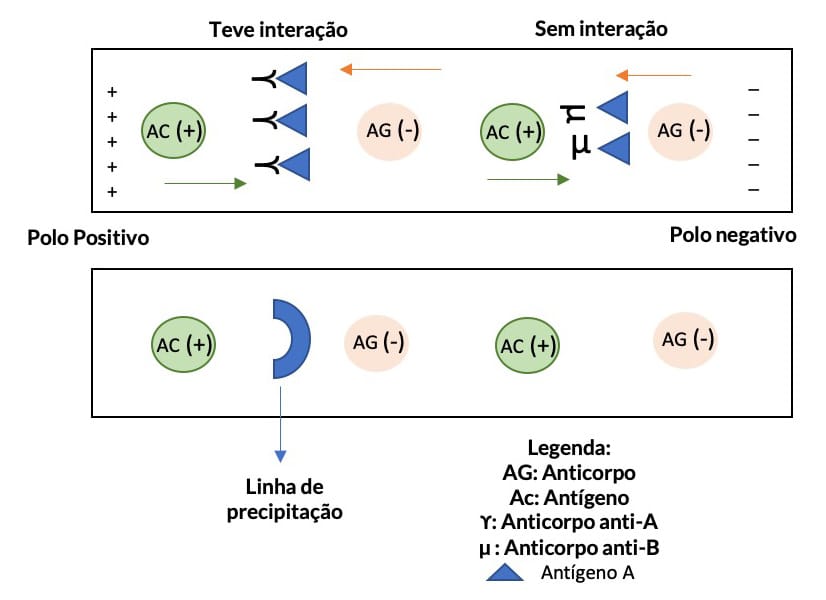
São técnicas que consistem no reconhecimento de antígenos solúveis com seus anticorpos complementares que também estão em solução, originando um agregado que não se solubiliza e é visível (Figuras 2 e 3).
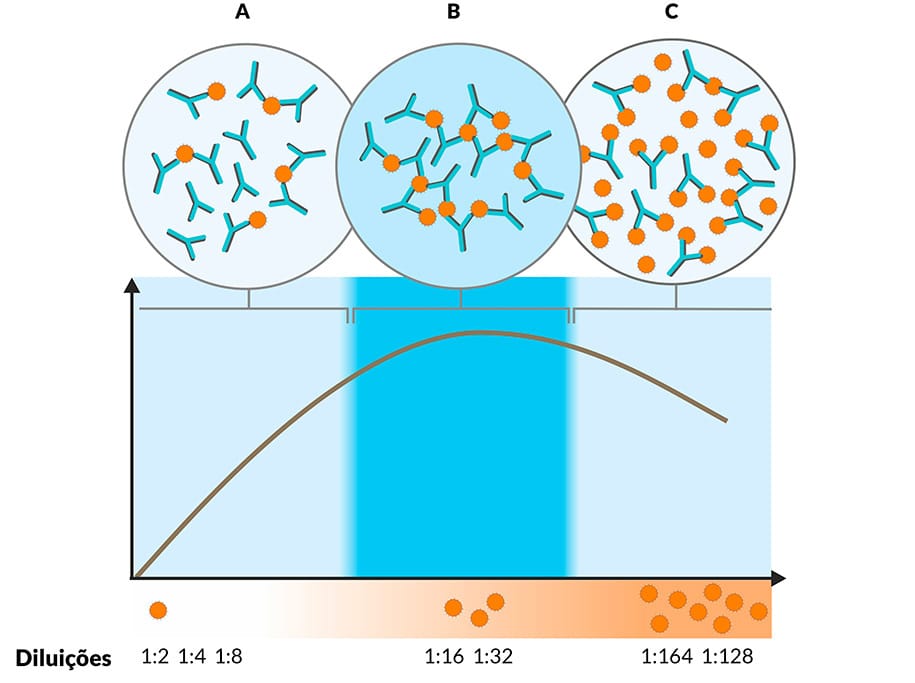
É importante ressaltar que, para que a reação de precipitação seja visível, um fator determinante é a concentração de antígeno e anticorpo presentes. Quando as concentrações dessas duas moléculas são equivalentes, ocorre uma precipitação máxima e, assim, é possível visualizar a precipitação. Chamamos esse fenômeno de zona de equivalência. De forma diferente, quando existe excesso de antígeno ou anticorpo, a interação diminui e a formação de precipitado também, gerando resultados falso-negativos. Quando temos excesso de anticorpos, ocorrem reações que não são visíveis a olho nu, esse fenômeno é chamado de prozona (Figura 4).
Prozona
Esse efeito pode ser observado em outros testes sorológicos, como aglutinação. Durante os exames, a partir dessa técnica, são realizadas diferentes diluições para evitar resultados falhos.
Entenda melhor a figura:
Na figura, temos em (A) excesso de anticorpos, o que resulta em precipitados pequenos que não são visíveis a olho nu, efeito prozona.
Representa a zona de equivalência, com concentrações de antígeno e anticorpo equivalentes e precipitação máxima e visível.
Em (C), o excesso de antígeno também gera precipitados pequenos, não visíveis a olho nu, efeito pós-zona.
Nas reações de precipitação, para verificar a interação antígeno e anticorpo, são utilizados diferentes meios reacionais, como, por exemplo, o meio líquido ou semissólido. Quando realizadas em meio semissólido, essas reações são dividias em imunodifusão e imunoeletroforese. As principais vantagens dessa técnica são rapidez, fácil execução, baixo custo, podem ser testadas diferentes amostras e boa especificidade. No entanto, elas apresentam uma baixa sensibilidade.
Agora vamos conhecer as peculiaridades de cada técnica de precipitação:
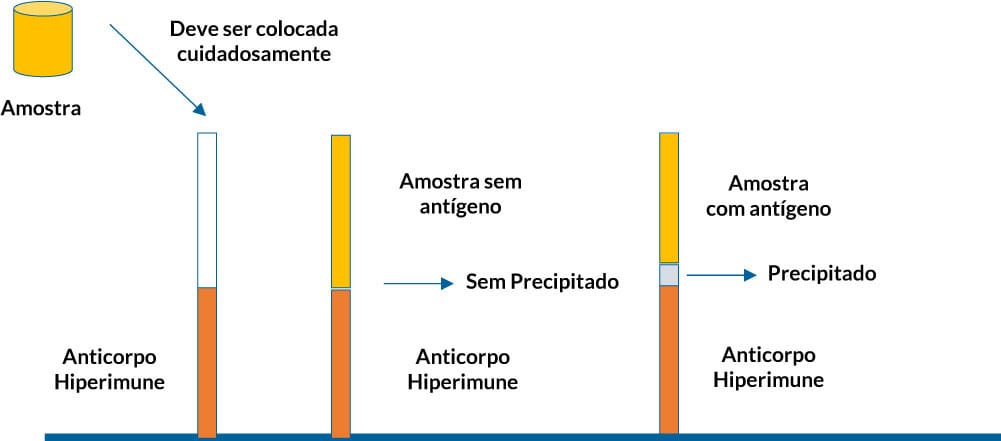
Reação de precipitação em meio líquido, técnica de precipitina e/ou do anel
A precipitação ocorre em tubos de ensaio ou em capilares e visa pesquisar a presença de antígenos. Para isso, os tubos apresentam uma solução de anticorpos já conhecida, também chamada de soro hiperimune e nele, cuidadosamente, é adicionado uma amostra, para formar duas fases: uma inferior, com o soro hiperimune, e outra superior, com a amostra. Se o antígeno pesquisado estiver presente na amostra, este migrará em direção ao soro, formando um gradiente de concentração. Quando ocorrer a interação antígeno e anticorpo e esta estiver na zona de equivalência, é possível verificar a formação de um precipitado visível (Figura 5). Tal técnica é mais utilizada em laboratórios de pesquisa.
Antes de estudarmos as técnicas de precipitação em meio semissólido, devemos conhecer mais um pouco sobre imunodifusão.
Imunodifusão
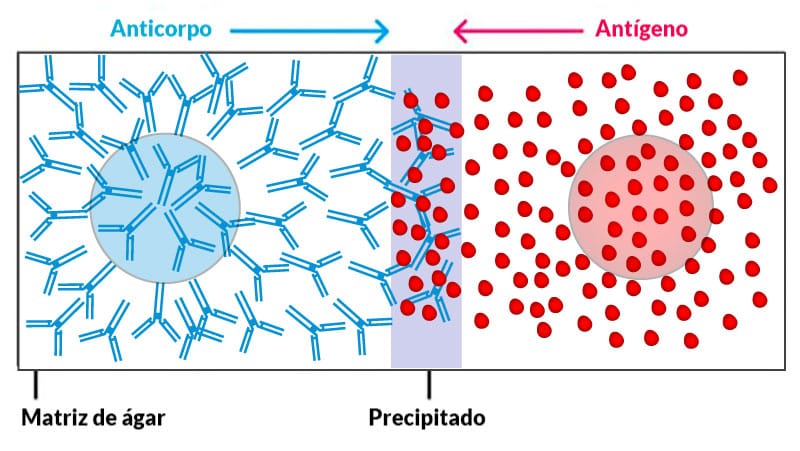
Consiste na migração de antígenos solúveis em uma matriz gelatinosa (ágar ou um gel de agarose) que contém um anticorpo em sua composição. É importante ressaltar que algumas técnicas podem pesquisar anticorpos solúveis em uma matriz que apresente o antígeno correspondente. Quando as moléculas estão livres, a difusão permanece constante, mas, quando ocorre a interação de antígenos solúveis com os anticorpos, o precipitado formado fica preso no gel de acordo com o peso molecular desse complexo e assim, podem ser visualizados.
As técnicas de imunodifusão dependem de alguns parâmetros, são eles: concentração, pureza e tamanho dos poros do gel, concentração dos antígenos e anticorpos, tempo de difusão, temperatura, especificidade e avidez da interação antígeno e anticorpo.
Dependendo do tipo de migração do antígeno e do anticorpo sobre a matriz, a imunodifusão pode ser dividida em simples, dupla ou radial.
Especificidade
Capacidade de um anticorpo apenas reconhecer o seu antígeno específico.
Avidez
Força de interação total do antígeno com o anticorpo.
Quando um dos componentes (Ag ou Ac) fica fixado ao gel, enquanto o outro vai migrando até que se forme os imunocomplexos.
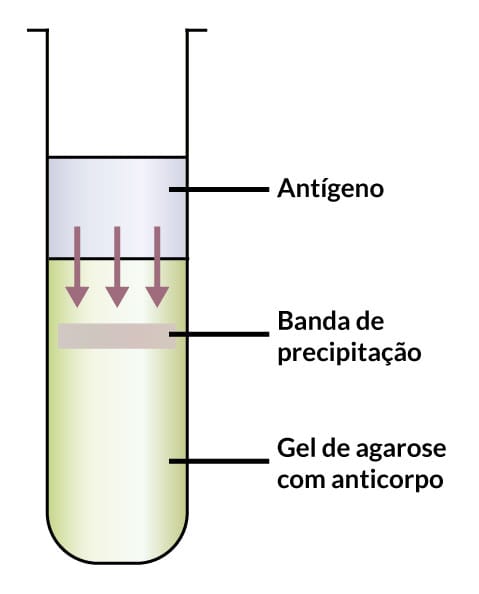
O antígeno é colocado sobreposto a uma coluna de ágar, contendo o soro hiperimune. As moléculas do antígeno irão penetrar no ágar e se difundirem com uma velocidade diferente para cada substância, dependendo do peso molecular. Após o tempo de incubação de normalmente uma semana, será possível observar o que chamamos de disco (banda) ou zona de precipitação (Figura 06).
Quando o antígeno e o anticorpo migram ao mesmo tempo, um em direção ao outro para a formação do imunocomplexos. Esse teste é realizado em uma lâmina de vidro ou placa de Petri, que é coberta por uma camada fina de gel, com dois orifícios, onde em um é colocado o antígeno e no outro o anticorpo, caso haja formação de imunocomplexos, há o aparecimento de bandas ou linhas de precipitação (Figura 7). Essa é uma técnica semiqualitativa, que pode ser utilizada para o diagnóstico de doenças infectocontagiosas, como candidíase, histoplasmose e aspergilose.
Após a imunodifusão, podemos utilizar um corante para marcar as proteínas, a fim de visualizar melhor as linhas de precipitação. A utilização desses corantes é preconizada quando temos uma baixa concentração de antígenos e anticorpos, o que torna as bandas não visíveis.
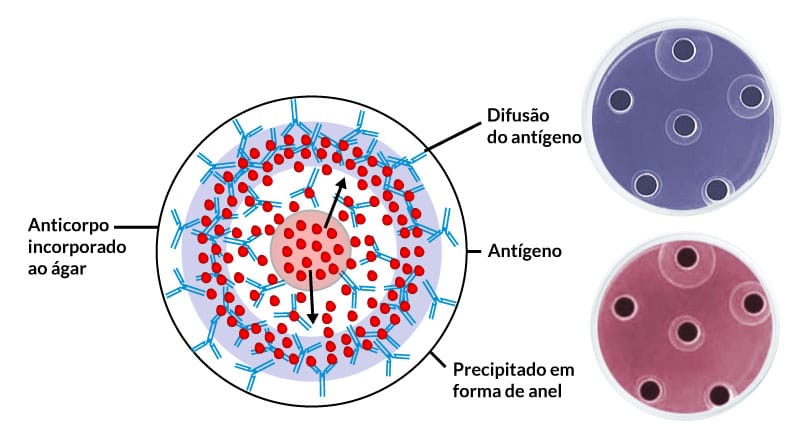
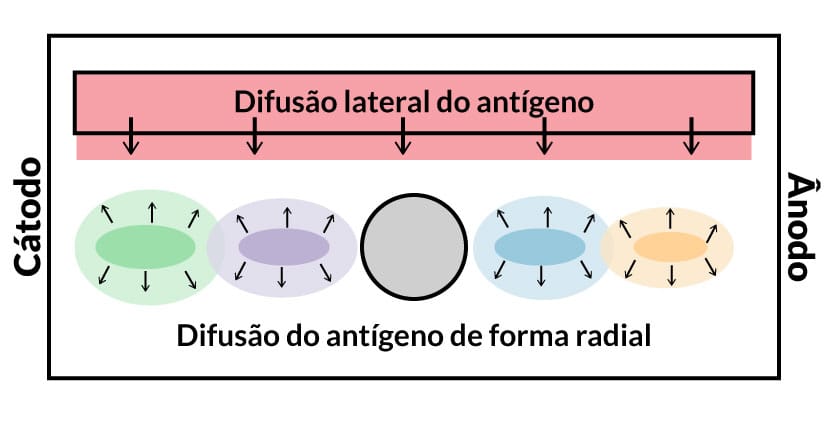
Quando o movimento do antígeno ocorre em todas as direções em um meio semissólido. Para isso, uma lâmina de vidro ou uma placa de Petri é coberta com um gel impregnado de anticorpo distribuído uniformemente, em seguida, as amostras em investigação são colocadas em pequenos orifícios. Os antígenos presentes na amostra irão se difundir de forma radial e, à medida que vão encontrando os anticorpos, há formação de imunocomplexos e de um halo de precipitação ao redor do orifício (na forma de anel). Quanto maior a concentração do antígeno, maior é o tamanho do halo (Figura 8).
Além das amostras testes, nessa técnica, são utilizadas soluções padrões com concentrações conhecidas de antígenos. A partir do tamanho dos halos de precipitação obtidos com os antígenos controles (padrão), podemos originar uma curva padrão e descobrir a concentração de antígenos presentes em amostras de soros de pacientes, possibilitando uma análise quantitativa. Essa técnica pode ser utilizada para quantificação de proteínas, como:
- Imunoglobulinas
- Proteínas séricas
- Fatores do complemento
- Proteínas de fase aguda (PCR)
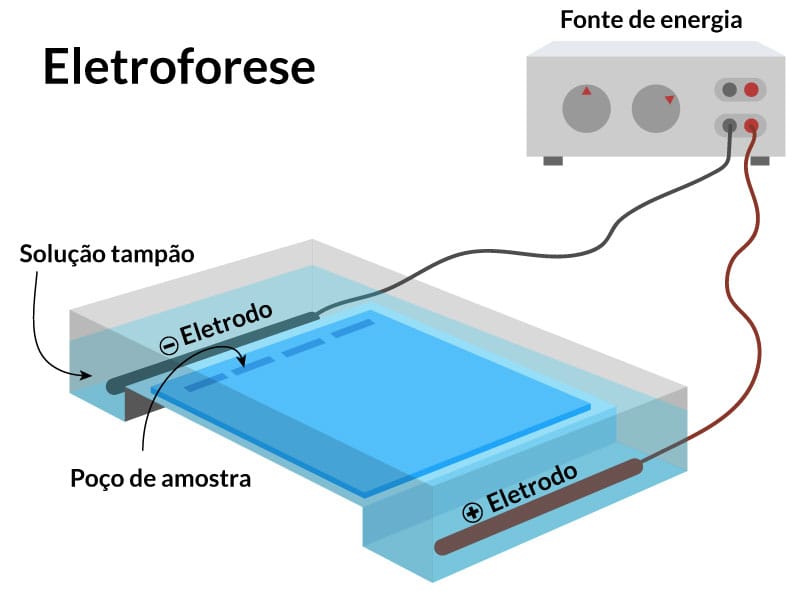
Imunoeletroforese (método de Grabar e Williams)
A imunoeletroforese é uma técnica de imunopreciptação em meio semissólido (gel) que associa as técnicas de imunodifusão e a eletroforese. Como vimos, a imunodifusão verificará a difusão do antígeno (ou anticorpo) sobre uma superfície gelatinosa composta de anticorpos (ou antígeno) e a formação de zona de precipitação, indicando o reconhecimento antígeno-anticorpo.
Mas e a eletroforese, você conhece?
A eletroforese é uma técnica que consiste na migração e separação de moléculas de acordo com a carga após a geração de um campo elétrico. Ela utiliza diferentes meios de suporte, como fitas ou membranas de poliacetato de celulose e géis de agarose.
No nosso organismo, diversas moléculas, como proteínas, aminoácidos, polipeptídios, nucleotídeos e ácido nucleico, apresentam grupos funcionais ionizáveis que adquirem cargas (positiva ou negativa) em um determinado pH. Assim, quando um campo elétrico é gerado, as moléculas migrarão para o polo positivo ou negativo de acordo com a sua carga líquida. Para verificação de proteínas, normalmente, é utilizado um tampão com pH entre 8,2 e 8,6 e, nessa solução, as moléculas são carregadas negativamente e migram em direção ao ânodo. As imunoglobulinas, em média, têm pouca carga neste pH e, portanto, migram pouco desde o ponto de aplicação da amostra (origem). Além disso, a migração também depende do tamanho e conformação das moléculas, proteínas de alto peso molecular migram menos que as de baixo peso molecular.
Essa técnica é amplamente utilizada para:
- Verificação analítica, como na avaliação de proteína sérica
- Análises preparatórias, ou seja, na purificação de proteína que depois será estudada
- Para a detecção específica de enzimas e suas isoformas (por meio de sua atividade particular)
- Detecção de antígenos (em combinação com uma variedade de técnicas imunológicas)
Saiba mais
As proteínas separadas por eletroforese podem ser fixadas e coradas com vários tipos de corantes, como o preto de amido 10 B (azul escuro); Ponceau-S (vermelho); Coomassie G-250 (azul claro) ou Coomassie R-250 (violeta azul).
Agora que conhecemos mais sobre a eletroforese, vamos entender a técnica de imunoeletroforese.
A imunoeletroforese é realizada em duas etapas:
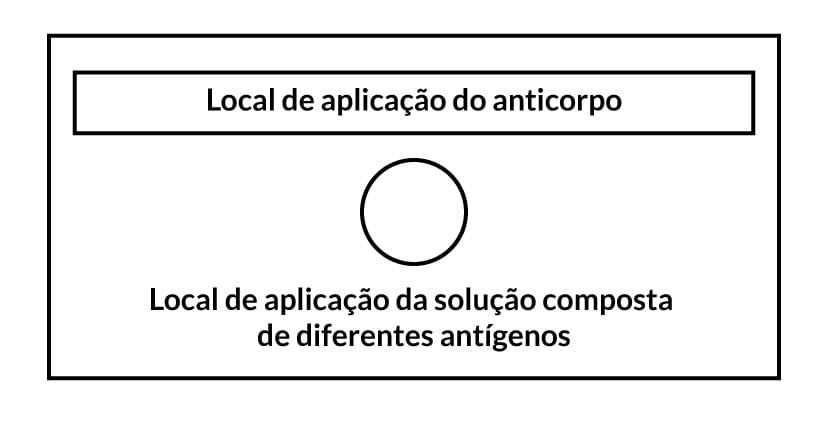
A primeira separa as proteínas através da eletroforese. Para isso, um gel é preparado, colocado em uma cuba de eletroforese, e o tampão é escolhido para que as partículas a serem analisadas fiquem com as cargas negativas e migrem para o polo positivo. As amostras a serem testadas (misturas de anticorpos ou antígenos) são aplicadas no gel (Figura 9A).
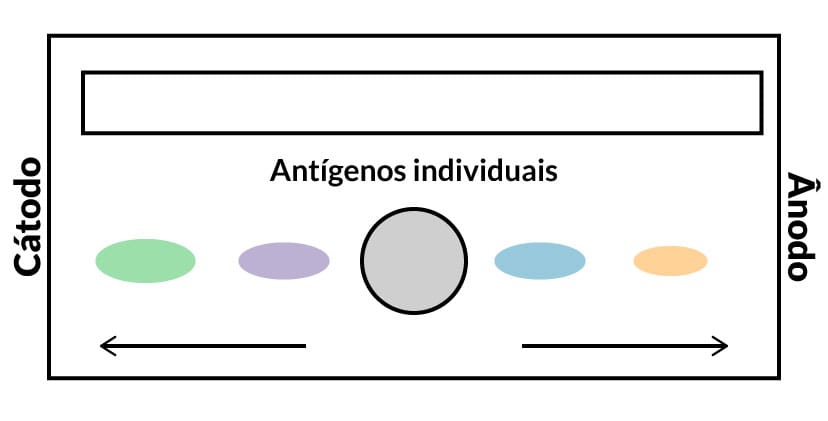
Nesse aparato, é aplicada uma diferença de potencial, que será responsável pela migração e separação das moléculas de acordo com a carga, tamanho e conformação (Figura 9B).
Após a corrida eletroforética, é feita a imunodifusão de cada componente que foi separado no gel. Para isso, é cortada uma canaleta entre os poços onde é colocado o antígeno ou anticorpo correspondente (figura 9C).
À medida que ocorre uma interação antígeno-anticorpo, vamos ter uma linha de precipitação em forma de arco na região de equivalência. Cada banda formada representa a formação de um complexo imune específico (Figura 9D).
Essa é uma técnica qualitativa e semiquantitativa que possibilita distinguir substâncias de acordo com suas cargas elétricas, seus pesos moleculares, tamanhos, sua conformação espacial, concentração e suas propriedades antigênicas. Ela é muito empregada no diagnóstico de gamopatias monoclonais, como o mieloma múltiplo e macroglobulinemia.
Saiba mais
O mieloma múltiplo é uma neoplasia da medula óssea que leva à proliferação das células B e ao aumento descontrolado da produção de anticorpos monoclonais (normalmente, do tipo IgG ou IgA) e fragmentos deles, chamados de proteína M. Nessa doença, as proteínas monoclonais de IgM, IgA, IgD e IgE podem estar presentes em quantidades relativamente pequenas quando comparadas à IgG. Um resultado de imunoeletroforese que não detecta a porção da cadeia leve das imunoglobulinas não-IgG, mostra uma alteração no padrão de produção desses anticorpos, o que é indicativo de gamopatias como o mieloma.
A partir da técnica de Grabar e Williams, outras metodologias foram desenvolvidas, são elas:
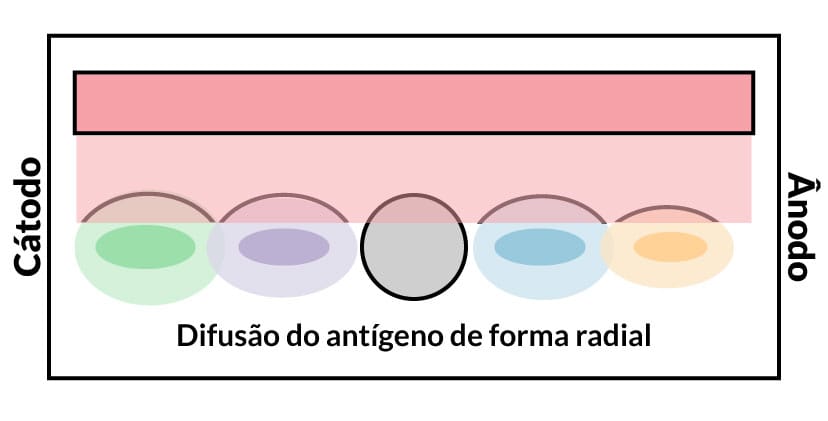
É uma adaptação da técnica de Graber e Williams, onde a eletroforese e a imunodifusão ocorrem ao mesmo tempo com o deslocamento apenas da substância que se deseja analisar. Para isso, uma pequena camada de gel incorporada com o anticorpo ou antígeno é preparada sobre uma lâmina de vidro. As amostras são aplicadas em poços pré-formados, o tampão é escolhido para que as partículas a serem analisadas fiquem com as cargas negativas e migrem para o polo positivo e esse conjunto é submetido à eletroforese. Durante a eletroforese, à medida que a substância vai migrando a partir do orifício de aplicação, ocorre a separação das moléculas e o reconhecimento do antígeno-anticorpo , com a formação das linhas de precipitação em formato de cone ou foguete. Isto porque, no início, há uma grande concentração da substância de interesse, que ao longo da corrida eletroforética vai diminuindo até que se esgote. É importante ressaltar que, durante a técnica, não ocorre a migração da substância que está incorporada ao gel.
Nesta técnica, antígenos e anticorpos migram ao mesmo tempo por eletroforese, no mesmo eixo, mas em direções opostas, resultando na precipitação no local onde ocorre o reconhecimento antígeno e anticorpo. A reação de contraimunoeletroforese só é possível quando antígenos e anticorpos migram em sentidos opostos durante a eletroforese, ou seja, os anticorpos migram para o polo negativo (cátodo), enquanto os antígenos migram para o polo positivo (ânodo). Nesse método, podemos realizar várias análises em somente uma lâmina, é uma metodologia rápida e mais sensível que a imunodifusão, além de poder ser realizado em membranas de acetato de celulose.
Antígenos migram para o polo positivo
Esse fenômeno pode ser estimulado com o uso de tampões alcalinos.
Reações de aglutinação
As reações de aglutinação consistem na formação de um agregado visível após a interação de anticorpos específicos com partículas insolúveis que contêm diferentes determinantes antigênicos (local de ligação do anticorpo, ou epítopo) ligados à superfície dessas partículas. Diferente da precipitação, onde os anticorpos e antígenos são solúveis, nessa técnica, pelo menos uma substância deve ser insolúvel.
Mas o que são essas partículas insolúveis?
As partículas insolúveis podem ser um antígeno insolúvel, antígenos expressos na superfície das membras plasmáticas, como os antígenos presente na membrana dos eritrocitários, ou então partículas cobertas com os antígenos (exemplo: látex).
Essa técnica apresenta alta especificidade e reprodutibilidade, é de fácil execução, simples e barata, mas apresenta baixa sensibilidade. É amplamente utilizada para tipagem sanguínea, provas de compatibilidade transfusional, detecção de hormônios, detectar patógenos e no diagnóstico das doenças autoimunes. Essas reações são divididas em: reações de aglutinação direta, indireta, reações de inibição da aglutinação.
Aglutinação direta
Como o nome diz, é a interação direta entre antígenos presentes na superfície de uma célula com o anticorpo correspondente. Os antígenos podem estar na sua forma integra ou fragmentada. No entanto, para ocorrer uma aglutinação visível, é necessário que o anticorpo reconheça pelo menos dois sítios antigênicos (bivalente), o que permite a ligação simultânea com mais de um antígeno formando interações cruzadas e um agrupado de partículas visíveis (rever a Figura 1).
Figura 1
Exemplo
Classificação sanguínea, prova de compatibilidade, teste de Coombs direto e indireto e sorotipagem bacteriana são exemplos dessa técnica.
Quando desejamos encontrar um anticorpo específico, devemos fazer diluições seriadas das amostras frente a uma concentração fixa e conhecida do antígeno correspondente. Após o tempo de incubação, o resultado é expresso como título do anticorpo, ou seja, a última diluição em que é possível verificar a aglutinação.
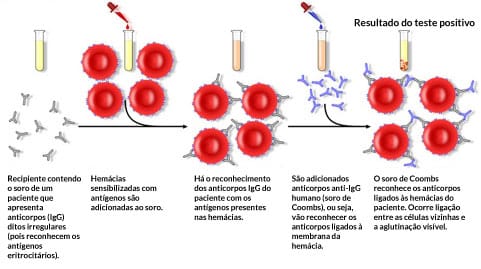
Aglutinação passiva ou indireta
Essa reação consiste no reconhecimento de anticorpos presentes no soro com antígenos presentes artificialmente em partículas inertes (látex ou gelatina) ou então hemácias, que são sensibilizadas por adsorção passiva e desempenham uma função de suporte. Quando uma amostra de soro ou plasma apresenta um anticorpo que reconheça os antígenos correspondentes nas hemácias ou nas partículas inertes que formem pontes entre as partículas vizinhas, irá ocorrer a aglutinação (Figura 10). Esse teste apresenta diversas aplicabilidades.
Látex
Partículas de látex são esferas de poliestireno que desempenham um papel de suporte, e é possível adsorver antígenos.
Adsorção passiva
Adesão de moléculas fluidas a uma superfície sólida.
O teste de Coombs indireto é um exemplo desse teste quando se utiliza hemácias como suporte.
Você sabia
A reação de aglutinação indireta com o látex como partícula inerte é amplamente utilizada para a detecção do fator reumatoide. A artrite reumatoide é uma doença autoimune que leva à inflamação crônica nas articulações, à ativação desregulada de células B e T e à produção de autoanticorpos, moléculas que reconhecem a região Fc das imunoglobulinas produzidas no nosso organismo, chamado de fator reumatoide que normalmente é uma variante de IgM. Na pesquisa do fator reumatoide, o látex é sensibilizado com anticorpo do tipo IgM, IgG, IgM e IgA, e essa partícula é reagida com o soro do paciente. Se o soro apresentar o fator reumatoide, teremos a aglutinação.
Reações de inibição da aglutinação
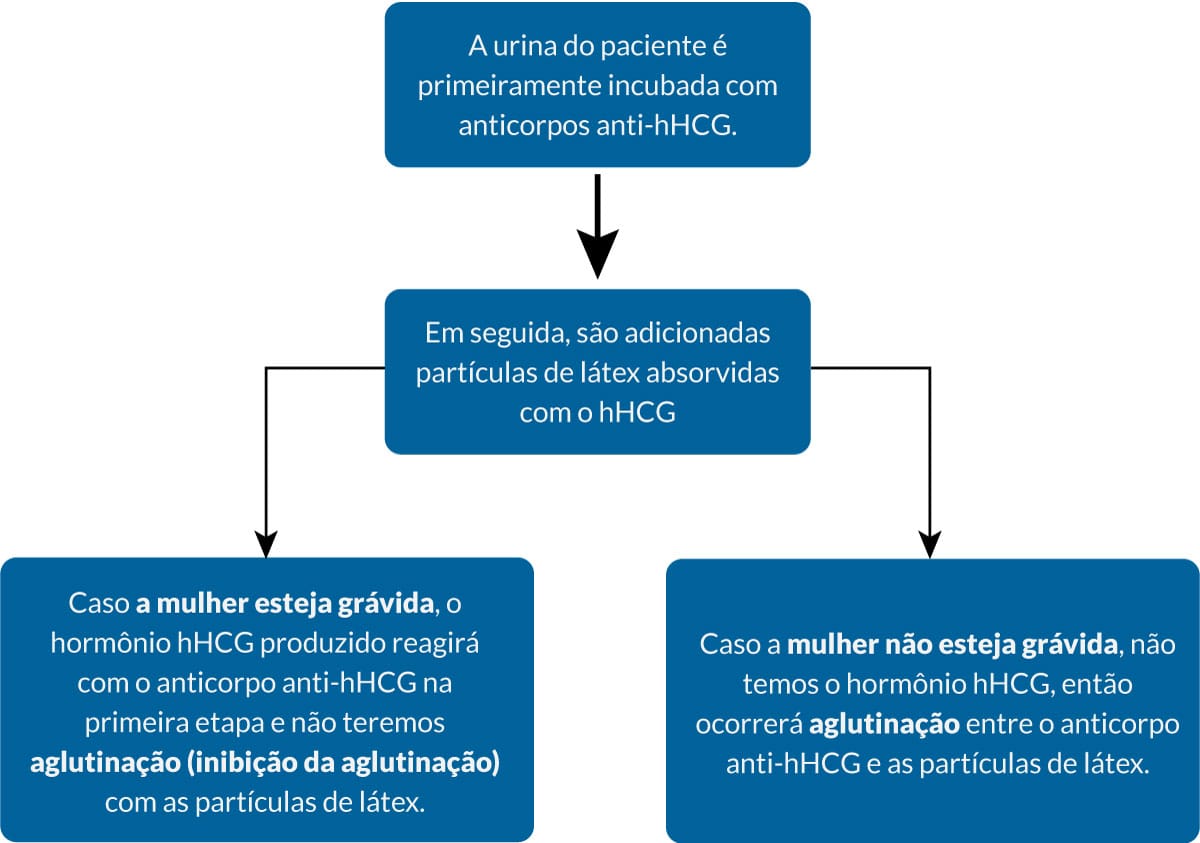
Nessas reações, ocorre uma competição entre os antígenos presentes na superfície de hemácias ou de partículas inertes e antígenos solúveis pelo sítio de ligação com o anticorpo, diminuindo assim a capacidade de interação e aglutinação. Dessa forma, a reação é positiva quando não temos aglutinação. A competição acontece entre dois antígenos semelhantes, pelo local de ligação com o anticorpo, ou entre dois anticorpos diferentes pela ligação ao mesmo antígeno. A interação acontecerá entre o antígeno e o anticorpo que apresente uma reação mais estável.
Durante uma infecção viral, alguns vírus apresentam a capacidade de se ligar a receptores localizados na superfície de hemácias danificadas. Assim, essa propriedade é utilizada para a dosagem de anticorpos contra os vírus durante a evolução de uma doença.
Um paciente com uma suspeita de infecção viral faz um exame de sangue para confirmar a presença de anticorpos contra esse vírus. O soro desse paciente é então diluído e colocado em contato com quantidades fixas de antígenos virais e hemácias. Teremos uma competição da ligação dos anticorpos aos antígenos livres e os que estão ligados a hemácias. À medida que ocorre a ligação antígeno livre e anticorpo, a aglutinação diminui. Em seguida, verificamos qual foi a diluição que não houve mais a aglutinação das hemácias, ou seja, a inibição da propriedade aglutinante, e esse representa o título do anticorpo .
Ocorre pela inibição da ligação entre antígenos ancorados na sua superfície do látex e seus anticorpos correspondentes, quando existem anticorpos solúveis que competem inibindo a aglutinação.
Uma paciente está com suspeita de gravidez e realiza a coleta da urina para o teste. Normalmente, o teste de gravidez detecta o hormônio da gonodotrofina coriônica (hHCG) em uma reação de inibição de aglutinação.
Vamos entender melhor:
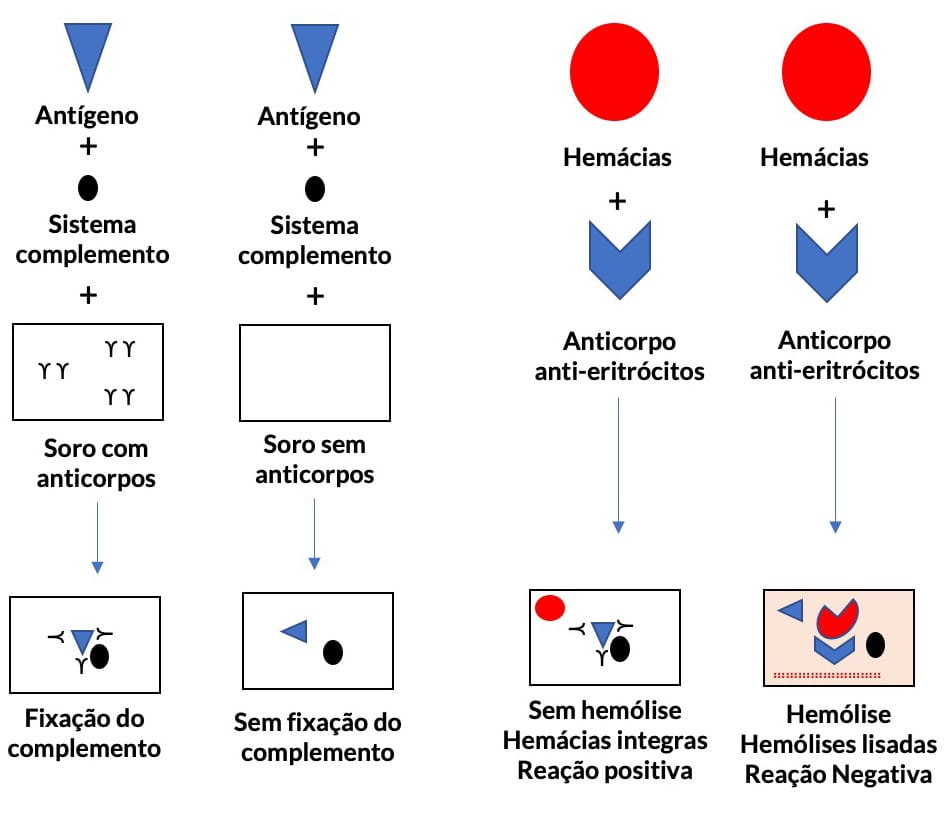
Reação de fixação do complemento
Podemos identificar e quantificar a presença de antígenos e anticorpos em uma amostra através da formação de imunocomplexos e a avaliação da capacidade desses complexos em fixar e consumir as moléculas do sistema complemento in vitro.
Essa técnica é barata, simples e utilizada para o diagnóstico de alguns agentes infecciosos como a histoplasmose e a coccidioidomicose. No entanto, esses testes estão sendo substituídos pelos ensaios enzimáticos, que são mais sensíveis, e são empregados apenas como testes confirmatórios.
O teste é realizado em duas etapas.
Na primeira etapa, ocorre a formação dos imunocomplexos (interação antígeno e anticorpo) e a ligação (fixação) com as moléculas do sistema complemento.
Na segunda etapa, as hemácias ligadas aos anticorpos antieritrócitos (hemolisinas) são adicionadas e, após um período, observamos se ocorreu ou não a hemólise.
A presença de hemólise indica que, na primeira etapa, não houve a formação do imunocomplexo e a fixação do complemento, ficando as moléculas do sistema complemento livres e capazes de interagir com o complexo hemácias-hemolisinas. De forma diferente, a ausência de hemólise informa que houve a formação do imunocomplexo e a fixação das moléculas do sistema complemento, ou seja, uma reação positiva. É importante ressaltar que, nessa reação, os antígenos e anticorpos isolados não podem ativar o sistema complemento, pois geraria resultados falhos.
O sistema hemácia-hemolisina funciona como um sistema revelador.
Imunofixação, Nefelometria e Floculação
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Explicar os métodos laboratoriais imunológicos com reagentes marcados
Métodos laboratoriais imunológicos com reagentes marcados
Estudamos que as técnicas de precipitação, aglutinação e de fixação do complemento são os principais ensaios imunológicos que utilizam reagentes não marcados. Agora, vamos conhecer alguns métodos onde a verificação da presença de um antígeno e o anticorpo é realizado com algum dos elementos (antígeno ou anticorpo) marcados com um corante fluorescente ou quimioluminescentes, radioisótopos, enzimas, entre outros marcadores.
Vamos juntos estudar um pouco sobre o ELISA, testes de fluorescência, testes imunocromatográficos, radioimunoensaios e algumas técnicas de imuno-histoquímica. Além disso, vamos entender a importância dos testes de hipersensibilidade celular cutânea tardia na avaliação geral da imunidade celular.
Imunofluorescência
Em 1941, uma equipe de pesquisadores liderados por Albert H. Coons, desejando analisar as técnicas imunológicas com auxílio de corantes, utilizou radicais fluorescentes, pois a coloração com os reagentes comuns conferia uma fraca intensidade. Nessa época, já era conhecida a capacidade dos anticorpos de ligar-se aos radicais químicos sem alterar sua conformação e capacidade de interagir com os antígenos. Foi desenvolvido assim o teste de imunofluorescência.
O desenvolvimento desse teste só foi possível pela capacidade de algumas substâncias em armazenar energia luminosa e liberá-la depois, fenômeno esse conhecido como luminescência.
Quando a substância consegue armazenar energia luminosa por longos períodos até a sua emissão.
Quando a substância armazena energia luminosa por curto período até sua emissão.
Os corantes fluorescentes mais utilizados são a rodamina e a fluoresceína.
Após a coloração, essas amostras podem ser analisadas:

No microscópio óptico de fluorescência

No citômetro de fluxo
A imunofluorescência representa um grande avanço na imunologia clínica, pois permitiu a detecção de substâncias de forma direta, mesmo que em pequenas concentrações, e utilizando pequenas quantidades de corantes fluorescentes, uma vez que esses corantes emitem grande quantidade de energia. Antes, a detecção de um antígeno ou anticorpo era realizado através de Reações secundárias, ou seja, após a formação de um imunocomplexo, sendo necessária grandes quantidades de antígenos e anticorpos para sua visualização.
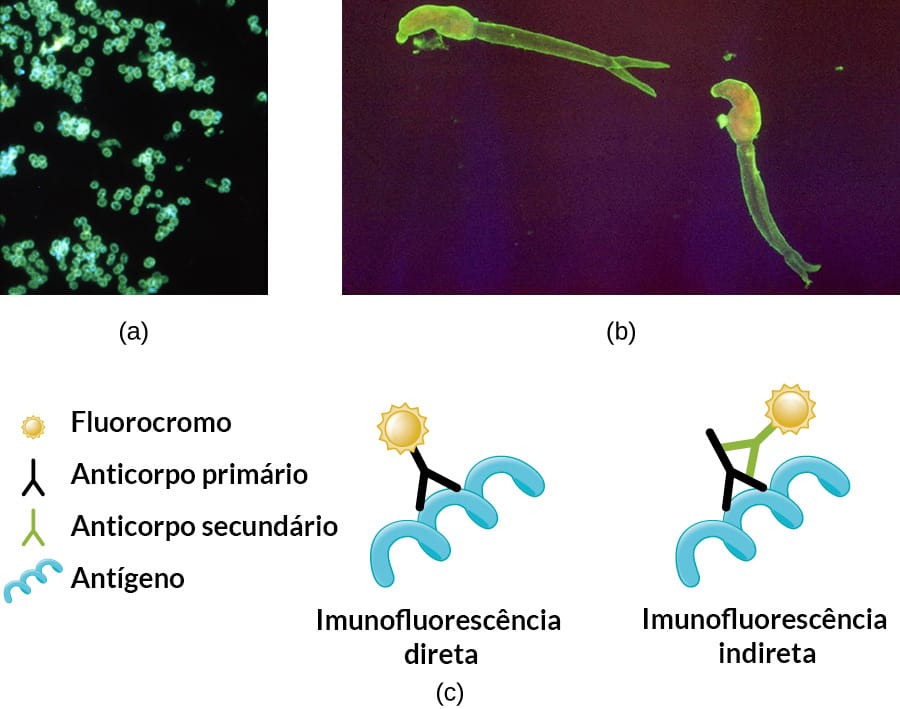
A partir dessa técnica, diferentes métodos foram descritos, como a imunoflorescência direta e indireta.
Esta técnica é utilizada para detectar antígenos em biopsias de tecidos, como também a presença de células, bactérias, vírus, fungos e protozoários. Ela consiste no reconhecimento de antígenos por anticorpo correspondente que está conjugado com uma substância fluorescente. A presença de fluorescência indica que a amostra tem a substância pesquisada. A análise por esse método costuma ser qualitativa (Figura 11).
Nesta técnica, utiliza-se um anticorpo secundário conjugado com o radical fluorescente, ou seja, um anticorpo anti-imunoglobulina que é capaz de reconhecer diferentes imunoglobulinas ligadas a um antígeno específico. A principal vantagem desse método é a diminuição dos custos, uma vez que o anticorpo secundário pode ser empregado para o reconhecimento de qualquer anticorpo humano e utilizado para diferentes análises. Além disso, é um método mais sensível e específico quando comparado à imunofluorescência direta. É utilizado para o diagnóstico e o acompanhamento de diferentes doenças (Figura 12).
Ensaio imunoenzimático (ELISA-Enzyme Linked Immunosorbet Assay)
Em 1971, foi introduzido pelos pesquisadores Van Weermen e Schurs e Engvall e Perlmann o método imunoenzimático para detecção e quantificação de antígenos e anticorpos específicos. Esses pesquisadores verificaram que a interação antígeno e anticorpo poderia ser detectada e quantificada utilizando como substância reveladora um conjunto enzima-substrato, que, na presença de uma espécie doadora de elétrons (cromógeno), forma produtos coloridos. Além disso, observaram que as proteínas poderiam ser imobilizadas em superfícies sólidas como a de poliestireno. Essa foi a base para o desenvolvimento dessa técnica.
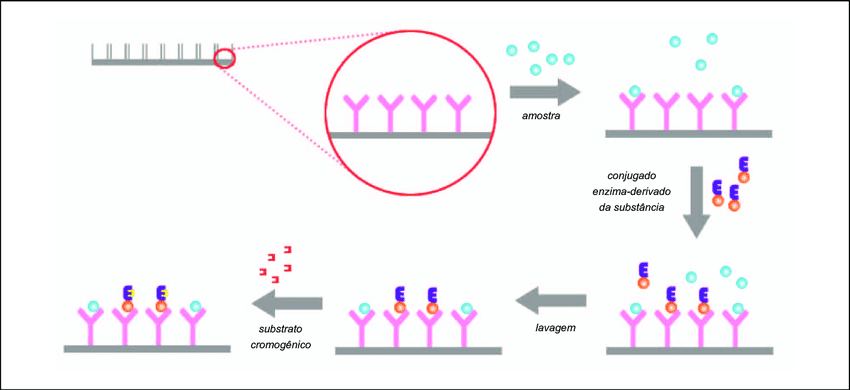
O método de ELISA é capaz de detectar antígenos ou anticorpos. Ele é realizado em placas plásticas de 96 poços (placas de microdiluições) formadas de poliestireno e que seguem uma sequência de procedimentos.
Inicialmente, a placa é previamente sensibilizada com a substância (antígeno e anticorpo) específica que é complementar à molécula que desejamos identificar.
Sensibilizada
Processo de revestimento da placa com o reagente adequado. Normalmente, utiliza-se um pH alcalino, mantendo os reagentes com carga negativa e garantindo que ocorra a adsorção na placa, pois essa apresenta carga positiva, devido ao poliestireno.
Após a sensibilização, nem todos os espaços da placa são cobertos, restando alguns espaços vazios que podem ser ocupados por qualquer outra molécula gerando ligações inespecíficas e resultados falso positivos. Assim, é feito um bloqueio com soro albumina bovina (BSA), a ovalbumina, a caseína ou um complexo proteico, como o soro de cobaia dos espaços vazios da placa.
Durante a execução do método, são realizadas várias lavagens (manual, por meio automático ou por um sistema a vácuo) importantes para a retirada dos excessos de reagentes que não estão ligados a nenhuma molécula, impedindo assim qualquer tipo de ligação cruzada e interferências.
Dependendo do que queremos analisar, podemos utilizar antígenos conjugados com enzimas e anticorpos ou anti-anticorpos conjugados com enzimas. As enzimas mais empregadas são a fosfatase alcalina e peroxidase. Para revelar e verificar se ocorreu interação antígeno-anticorpo conjugado com a enzima ou anticorpo-antígenos conjugados com a enzima, é oferecido o substrato dessa enzima e um componente doador de elétrons (cromógeno).
Quando a enzima está presente no meio reacional, ou seja, quando houve interação e reconhecimento antígeno-anticorpo conjugado, a enzima quebra o substrato e o produto formado atua no cromógeno, gerando uma cor. Agora, quando a alteração de cor não é verificada, indica que a interação não ocorreu, não tendo assim no meio reacional a enzima para agir no substrato
A leitura pode ser qualitativa, apenas verificando a alteração de cor, ou então pode ser realizada a leitura em espectrofotômetro, o que converte as diferentes intensidades de cor em valores numéricos (valores de densidade óptica). Quanto maior a cor obtida, maior é a concentração da enzima conjugada e assim, maior a concentração da substância na amostra investigada.
O método de ELISA, quando realizado em condições excelentes (enzimas ativas, antígenos puros e anticorpo conjugado), é capaz de apresentar uma sensibilidade muito similar à do radioimunoensaio, porém com vantagem de não se utilizar elementos radioativos. Ele consegue detectar quantidades muito pequenas de antígenos ou anticorpos. No entanto, alguns reagentes utilizados são teratogênicos e podem ter interferentes de enzimas endógenas quando utilizadas como antígenos células inteiras e íntegras.
O método de ELISA pode ser classificado em direto, indireto ou competitivo, são eles:
ELISA direto
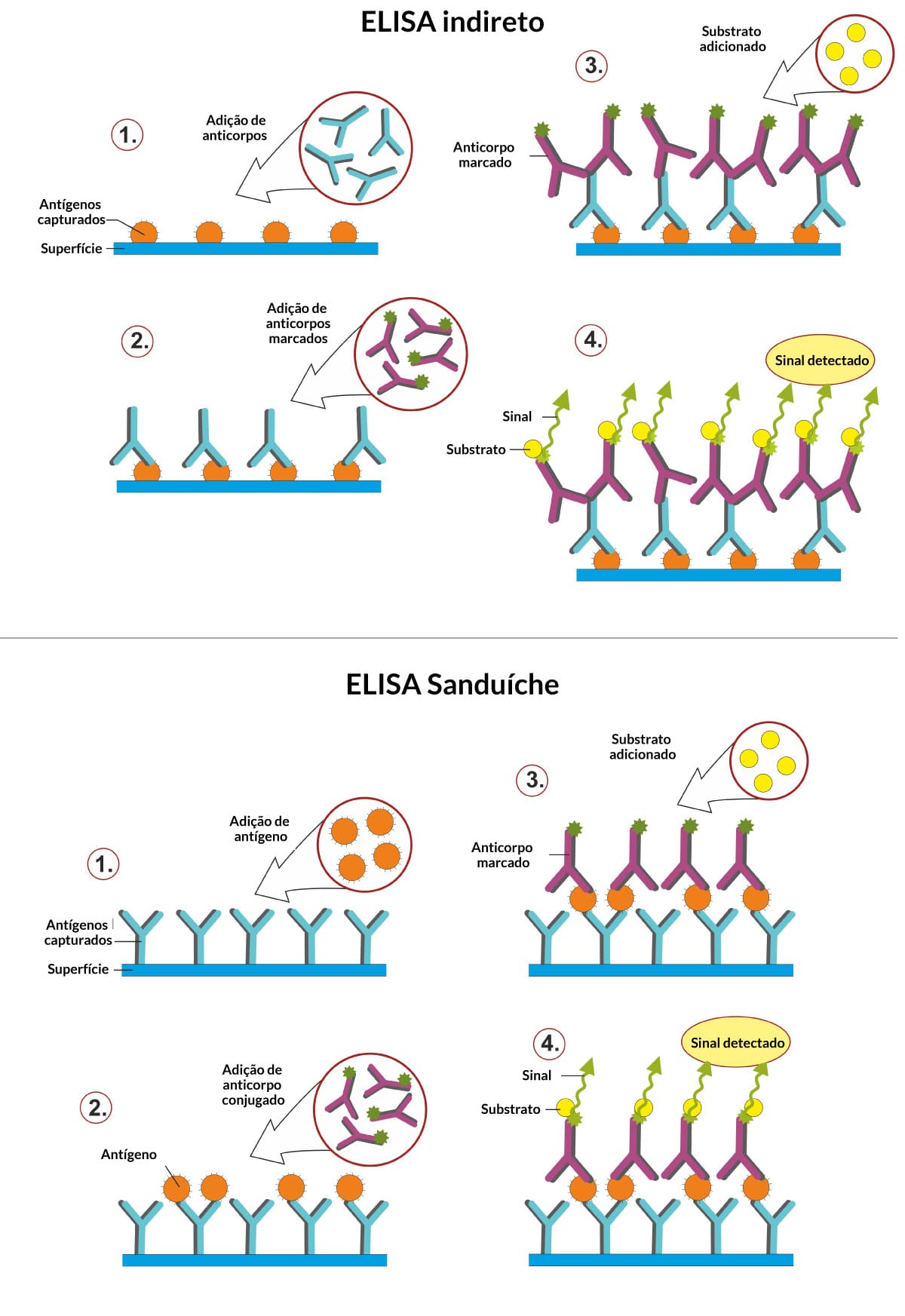
Método utilizado para pesquisar a presença de antígenos. É amplamente empregado em testes imuno-histoquímicos, que buscam em amostra de tecidos obtidas por biopsias detectar proteínas, enzimas, receptores, alterações celulares etc. Para isso, o tecido ou amostra (com os antígenos pesquisados) é fixado a uma superfície e, em seguida, é adicionado um anticorpo conjugado com uma enzima (anticorpos primários) correspondente ao antígeno que investigamos. Quando temos a presença do antígeno, há o reconhecimento com o anticorpo-conjugado e, ao adicionar o substrato da enzima, teremos uma coloração (Figura 13).
ELISA Indireto
Método utilizado para pesquisar a concentração de anticorpos presentes em uma amostra de soro ou plasma. Para isso, os antígenos são imobilizados na fase sólida. A interação antígeno-anticorpo será evidenciada pela utilização de um segundo anticorpo que está conjugado com a enzima e reconhece o anticorpo ligado ao antígeno (Figura 14). A reação será visualizada após a adição do substrato da enzima. É empregado no diagnóstico de doenças infectocontagiosas como AIDS e doença de chagas.
Essa técnica pode ser adaptada para a pesquisa de antígenos em uma amostra biológica e é chamada de ELISA Sanduíche. Para isso:
A placa é sensibilizada com o anticorpo (anticorpos de captura).
Depois, o anticorpo de captura reconhece o antígeno presente na amostra biológica.
Em seguida, a reação é revelada com um anticorpo-conjugado que reconhece o antígeno ligado ao anticorpo de captura (Figura 14).
Saiba mais
É empregado no teste de gravidez para detecção do hormônio gonodotrofina coriônica no soro.
ELISA Competitivo
Nessa técnica, pesquisamos antígenos nas amostras através da competição com antígenos conjugados com a enzima. Para isso:
Etapa 1
A placa é sensibilizada com o anticorpo de captura.
Etapa 2
São adicionados ao mesmo tempo a amostra em investigação e quantidades fixas de antígenos conjugados em que ambos competirão pela ligação ao anticorpo, que se liga àquela molécula que estiver em maior concentração.
Etapa 3
Após a adição do substrato da enzima, a interação anticorpo de captura e antígeno marcado gera uma cor, quanto maior a intensidade de coloração, mais antígenos conjugados estão ligados e menor é a concentração de antígenos na amostra. Agora, quanto menor a intensidade de cor, maior é a concentração de antígenos na amostra em investigação e menor a ligação dos antígenos conjugados ao anticorpo de captura.
O ELISA Competitivo pode ser:
Ocorre através de uma competição simultânea, quando a substância marcada e a investigada são adicionadas ao mesmo tempo, ou uma saturação sequencial, quando a substância em investigação é adicionada primeiro e depois é adicionado o antígeno ou o anticorpo conjugado (Figura 15).
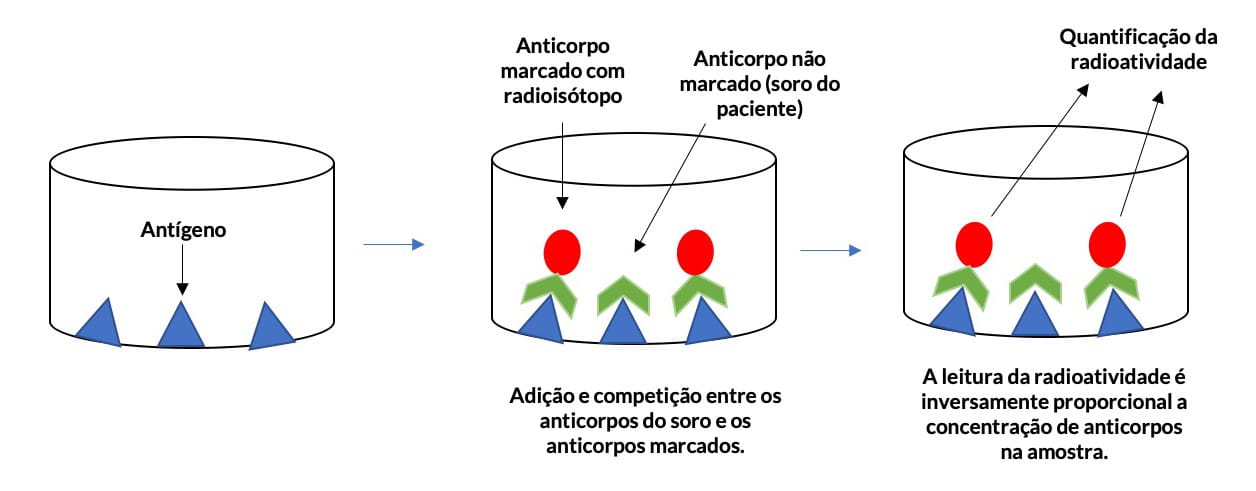
Radioimunoensaio
Em 1956, foi desenvolvida a técnica radioimunoensaio para a detecção da insulina. Essa representa a primeira metodologia padronizada que utiliza reagentes marcados para a detecção de moléculas na ordem de nano e picogramas. O RIE é semelhante ao ELISA competitivo, no entanto, utiliza substâncias marcadas com o radioisótopo. O radioisótopo mais empregado é o iodo-125.
Saiba mais
O termo Radioimunoensaio (RIE) é usado apenas quando a substância marcada é o antígeno, e ensaio imunorradiométrico (IRMA) quando o anticorpo que está marcado.
A detecção de antígenos ou anticorpos ocorre pela competição pelo sítio de ligação entre a substância marcada com radioisótopo e a substância que se deseja analisar. Os antígenos ou anticorpos são adicionados à fase sólida e acrescentados às moléculas marcadas com radioisótopo junto com a amostra do paciente. A quantificação é realizada em aparelho específico para a detecção da radioatividade.
Quanto maior for a leitura da radioatividade, maior a formação de imunocomplexos com a substância marcada e menor é a concentração do antígeno ou anticorpo investigado (Figura 16).
Vantagens desse teste
- Alta especificidade e sensibilidade.
- É rápido, barato.
- Requer pouco volume de amostra para testagem.
- Permite dosagem de substâncias em pequenas concentrações.
Desvantagem desse teste
- Apresenta um alto risco ao operador.
- É necessário um grande investimento em biossegurança e descarte de material radioativo.
- Grande instabilidade dos radioisótopos.
E amplamente empregado para dosar polipeptídeos, catecolaminas, esteroides, hormônios, drogas, vitaminas, verificar a presença de vírus como o da hepatite B e a presença de alguns marcadores tumorais.
Testes imunocromatográficos
Os testes imunocromatográficos realizam a detecção da interação antígeno-anticorpo pela difusão cromatográfica, onde o complexo formado gera uma cor, e a partir deles, podemos detectar antígenos ou anticorpos. Os testes rápidos são um exemplo clássico de imunocromatografia e são muito utilizados para a detecção de várias doenças, como: HIV, Hepatite, COVID. Essa metodologia é de fácil execução, baixo custo, que conferem resultados rápidos, versáteis, dispensa equipamentos e que podem ser realizados em diferentes amostras, como o soro, plasma, sangue total, saliva, swab de nasofaringe e orofaringe, urina e fezes. Entretanto, apresentam baixa sensibilidade.
Você já realizou um teste rápido?
Sabe por que aparecem duas bandas, uma chamada de “T” e a outra de “C”, vamos entender?
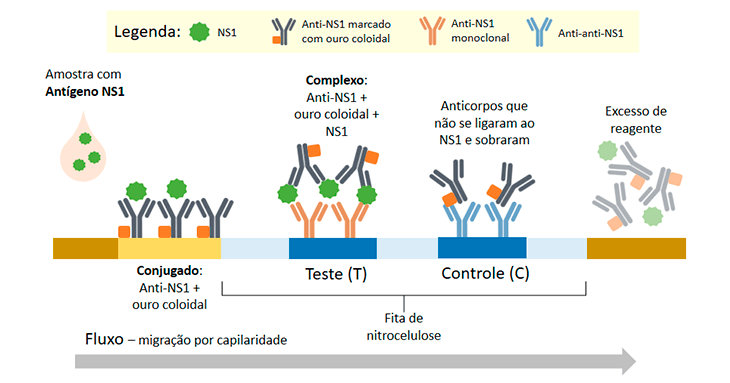
O teste rápido é realizado em um cassete constituído por uma membrana porosa de celulose modificada e membranas absorventes de fibra de vidro. Envolvendo a membrana, temos um dispositivo plástico que contém os locais de aplicação das amostras e verificação dos resultados. Ele é constituído por uma fase sólida, onde ocorre a interação antígeno-anticorpo e é o local onde estão presentes os elementos de captura fixados na membrana e uma fase móvel com o deslocamento das substâncias por capilaridade.
Inicialmente, para a detecção de antígenos, a amostra é colocada em uma região pré-determinada da membrana. Nessa área, estão presentes anticorpos conjugados normalmente com ouro coloidal (coloração rosa) ou prata coloidal (azul marinho), que serão responsáveis pela revelação da interação antígeno-anticorpo.
Após aplicação, a amostra migra em direção as regiões testes (T) e controle (C).
Caso haja reconhecimento entre o antígeno-anticorpo conjugado, esse complexo será retido pela ligação com os anticorpos presentes na região T, que reconhecem os epítopos do antígeno em investigação e gera uma linha colorida. Caso não haja interação, essa linha colorida não aparecerá.
É importante ressaltar que, após a região teste, temos uma região controle, com anticorpos anti-IgG que são capazes de se ligar a todos os anticorpos livres presentes na amostra. O aparecimento da linha controle é essencial, pois indica que houve migração da amostra e deve estar presente nos resultados positivos e negativos. O não aparecimento da linha controle invalidada o teste (Figura 17).
Imuno-histoquímica
O teste de imuno-histoquímica é uma técnica que combina a imunologia, histologia e química e tem como finalidade o reconhecimento de proteínas de alta afinidade durante os exames histopatológicos. Esse teste é empregado em cortes de tecidos obtidos após a biópsia para a detecção de doenças degenerativas ou parasitárias, identificação de substâncias e análises de estruturas dos tecidos normais e alteradas durante a evolução da doença. Atualmente, existe uma série de anticorpos capazes de reconhecer com alta especificidade proteínas do tecido e que garantem um diagnóstico mais fidedigno.
Existem dois tipos de técnicas que podem ser aplicadas para a imuno-histoquímica:
Técnica que reconhece os antígenos presentes em um corte de tecido a partir de anticorpos ligados a um marcador (anticorpos primários). Os cortes de tecidos são colocados em contato com os anticorpos primários e, após um tempo de incubação, é realizada a leitura em microscópios adequados. Os antígenos pesquisados no tecido serão observados pelo aparecimento de uma cor, indicando que houve reconhecimento pelo anticorpo. Os anticorpos não ligados são removidos por lavagens realizadas durante a técnica.
Técnica que reconhece proteínas pela ligação com um anticorpo (primário não marcado) específico ao antígeno em investigação e depois essa interação é revelada pela utilização de um anticorpo anti-IgG marcado (anticorpo secundário) e a amostra é observada em um microscópio adequado.
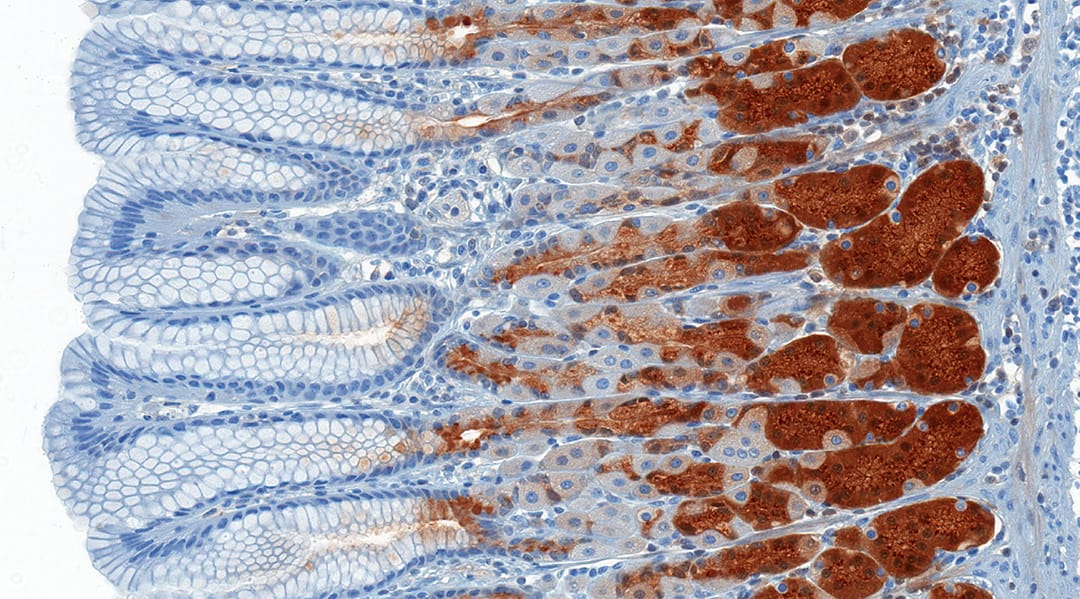
Normalmente, em sistemas reveladores na IHQ, são utilizadas reações enzimáticas, com destaque para o sistema avidina-biotina-enzima-cromógeno. Vamos entender como isso acontece?
Nessas reações, o anticorpo secundário é complexado à biotina, e é adicionado ao meio reacional à estreptavidina ligada a uma peroxidase. A estreptavidina tem afinidade à biotina e liga-se a ela e, consequentemente, ao anticorpo secundário. Em seguida, é adicionado ao meio reacional a 3,3-diaminobenzina, que reage com a peroxidase, reduzindo o DAB que se precipita no local de reação e gera uma cor marrom- ferruginosa. A coloração marrom indica que houve interação antígeno-anticorpo (Figura 18).
Teste de hipersensibilidade celular cutânea tardia
Todas as técnicas que verificamos até aqui estudam a imunidade humoral, com a interação antígeno e anticorpo. Mas e a imunidade celular? Quais são as técnicas que avaliam in vitro ou in vivo esse tipo de imunidade?
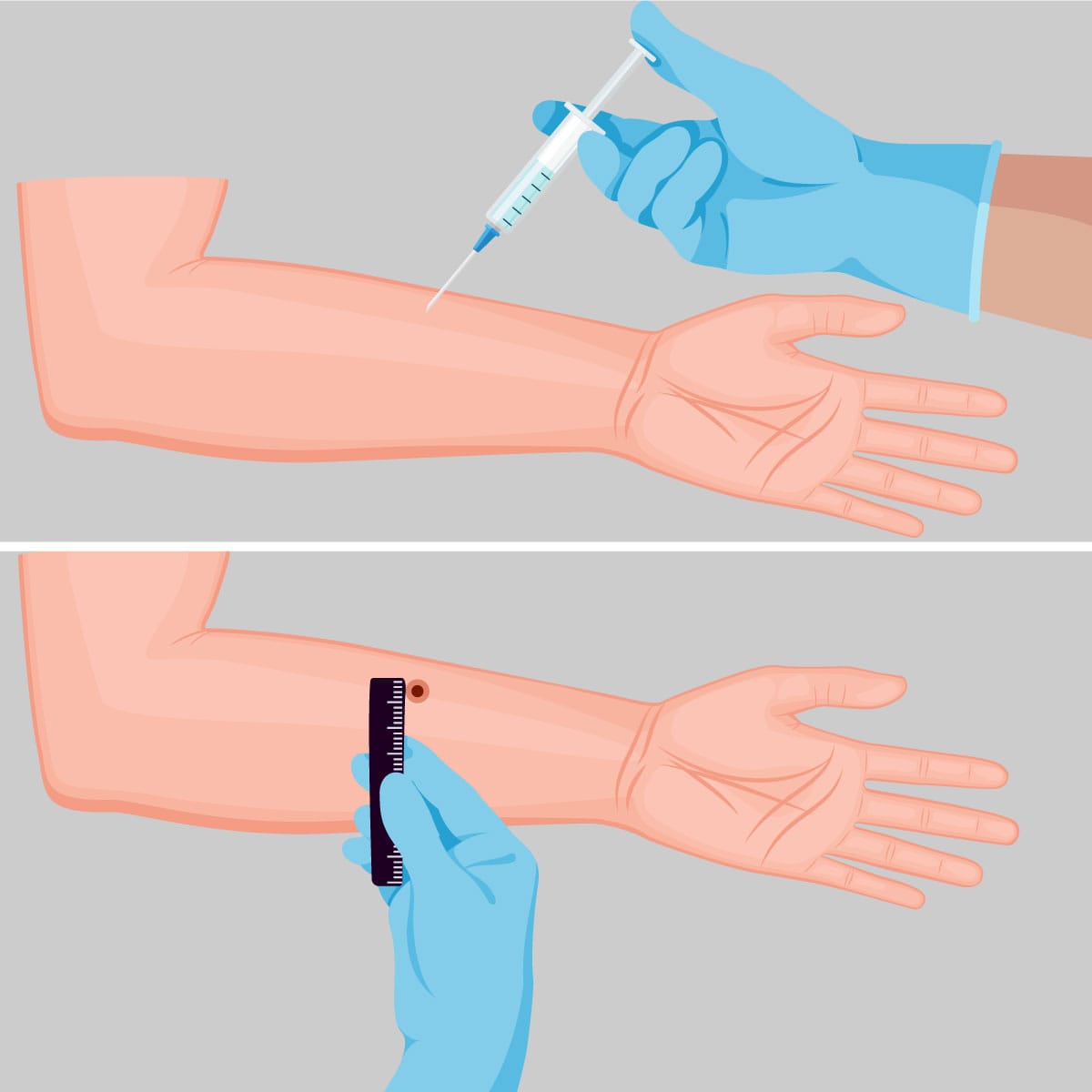
A análise da imunidade celular in vitro é feita pela linfoproliferação e citometria de fluxo e in vivo a partir do teste de hipersensibilidade celular cutânea tardia. O teste de hipersensibilidade tardia é um método simples e pode ser empregado para confirmar exposição prévia a alguns agentes infecciosos, como Mycobacterium tuberculosis, Hanseníase, Leishmania, Candida albicans, Paracoccidioides brasiliensis, dentre outros. Para isso:
Etapa 1
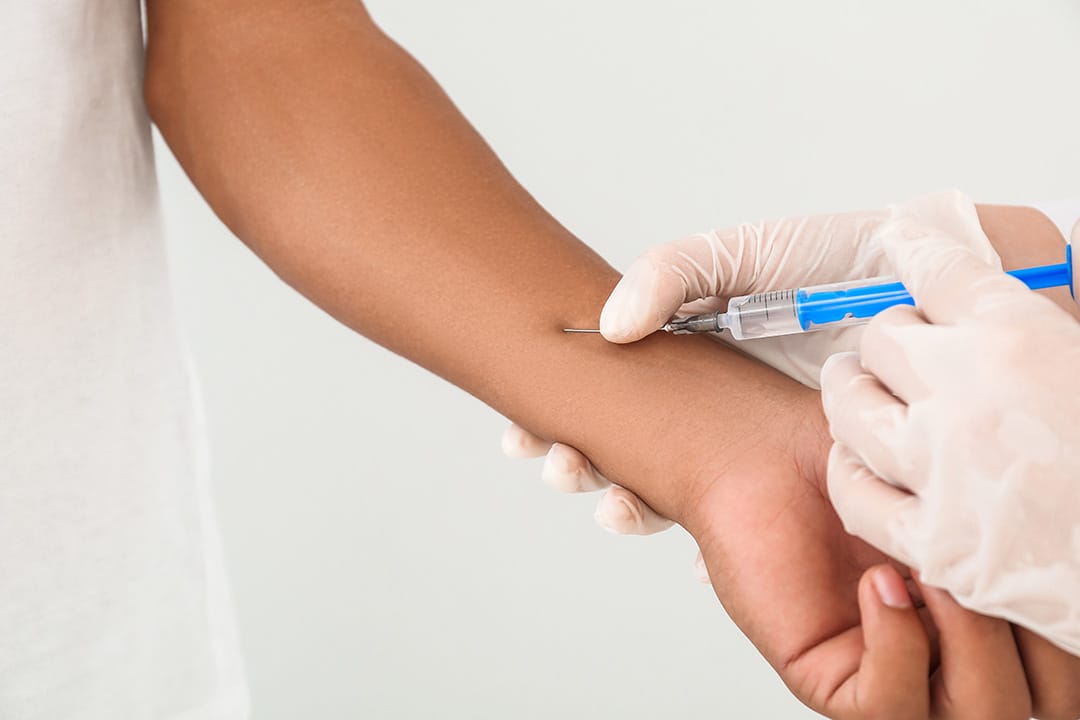
São aplicados no antebraço do paciente 0,1 mL de antígeno específico com agulhas e seringas estéreis, por via intradérmica.
A via subcutânea não é recomendada, pois diluiu os antígenos inoculados, levando a resultados falso negativos.
Etapa 2
No outro antebraço, é aplicado a mesma quantidade de Soro fisiológico 0,9% estéril (salina) como controle.
Etapa 3
Após 48-72 horas, é realizada a leitura, onde é medido o diâmetro do endurecimento. Normalmente, caroços superiores a 5 mm são indicativos de uma reação imune celular no local e da exposição ao antígeno pesquisado, mas o tamanho depende do tipo de antígeno (Figura 19).
Um teste positivo não indica que o paciente esteja doente ou que obrigatoriamente tenha tido uma infecção. O aparecimento do eritema e do endurecimento indica a presença de células de memória do tipo Th1, por uma doença que já foi curada ou uma infecção assintomática, onde o participante não apresentou sintomas. O teste negativo indica a ausência de contato com aquele agente infeccioso.
Alguns exemplos do emprego do teste hipersensibilidade celular cutânea tardia, ou teste de PPD (derivado proteico purificado):
- Pesquisa a exposição ao Mycobacterium tuberculosis, com o antígeno tuberculina, conhecido como teste de Mantoux.
- Pesquisa a exposição à hanseníase com o antígeno lepromina, ou antígeno de Mitsuda.
- Pesquisa a exposição a Candida albicans com os antígenos candidina ou oidiomicina.
- Pesquisa a exposição a Paracoccidioides brasiliensis com o antígeno paracoccidioidina.
- Pesquisa de Leishmaniose tegumentar com o extrato de protozoário como antígeno, o famoso teste de Montenegro.
Além disso, essa metodologia é indicada para avaliar a diminuição da imunidade celular do tipo th1 (anergia) em indivíduos que não respondem mais a microrganismos não patogênicos, situação que é observada em pacientes imunossuprimidos pelo uso de drogas e doenças, como neoplasias, AIDS, doenças autoimunes. Alguns produtos químicos quando aplicados ao antebraço provocam uma sensibilização e uma reação imune no local. Essa propriedade tem sido utilizada para analisar casos de anergia e a droga mais empregada é o DNCB. Esse é um teste que não é de rotina e deve ser feito apenas com pacientes com suspeita de ausência de resposta imune celular.
Citometria de fluxo e quimioluminescência
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Ao longo desta jornada, conhecemos os diferentes testes imunológicos empregados para a confirmação diagnóstica, o diagnóstico precoce, acompanhar a evolução e o tratamento de uma doença, além de confirmar a presença de uma substância no organismo. Vimos que a maioria dos testes utilizados consistem na interação antígeno-anticorpo. Essa interação pode ser visível a olho nu (teste de precipitação, aglutinação ou fixação de complemento) ou então um dos componentes da interação deve estar marcado com corante fluorescente ou quimioluminescentes, radioisótopos, enzimas, entre outros marcadores, para que essa interação seja visível (ELISA, radioimunoensaio, teste de fluorescências).
Ao final, foi verificado que o teste de hipersensibilidade cutânea tardia é uma forma de verificação in vivo da imunidade celular, sendo essencial para confirmar a exposição prévia a alguns agentes infecciosos e estudar casos de diminuição da imunidade celular do tipo th1 (anergia).
Juntos podemos entender a metodologia de cada teste, aplicabilidade, sua vantagem e desvantagem, ampliando ainda mais o conhecimento sobre imunologia clínica.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Lorem ipsum dolor sit amet, consectetur adipiscing elit
Ut enim ad minim veniam, quis nostrud exercitation ullamco
Duis aute irure dolor in reprehenderit in voluptate velit esse