Descrição
O metabolismo de lipídios e aminoácidos e a integração dessas vias metabólicas para o funcionamento do corpo humano.
PROPÓSITO
Compreender como o metabolismo de lipídios e aminoácidos e a integração de todas as vias metabólicas é importante para facilitar o entendimento de como o organismo funciona de forma harmônica.
OBJETIVOS
Módulo 1
Reconhecer as vias metabólicas relacionadas com a metabolização das gorduras em geral, bem como a sua biossíntese
Módulo 2
Discutir o metabolismo dos aminoácidos
Módulo 3
Reconhecer a integração metabólica em diferentes estágios e a regulação hormonal dessa integração
Módulo 4
Discutir a origem metabólica do diabetes, da obesidade e da síndrome metabólica
Introdução
Neste tema iremos aprender sobre o metabolismo dos lipídios e aminoácidos, e como as vias que levam à biossíntese e degradação dessas moléculas energéticas se integram em diferentes estágios, como o jejum, o jejum prolongado, o pós-prandial e no exercício intenso. Da mesma forma, veremos como essa integração é regulada.
Vamos ainda discutir sobre a origem metabólica de algumas doenças do metabolismo energético, como o diabetes, a síndrome metabólica e a obesidade.
MÓDULO 1
Reconhecer as vias metabólicas relacionadas com a metabolização das gorduras em geral, bem como a sua biossíntese
METABOLISMO DOS LIPÍDIOS
Você já deve ter ouvido falar em gorduras e colesterol. Muitas informações duvidosas sobre essas duas moléculas são disseminadas na cultura popular, como, por exemplo, que gordura engorda e que devemos eliminá-la da dieta. Mas os lipídios, termo bioquímico para gordura, são extremamente importantes, assim como os carboidratos, as proteínas, os ácidos nucleicos, dentre outras moléculas.
Na verdade, esse e outros “mitos” sobre a gordura, principalmente quando se trata de sua relação com a forma física, têm origem em uma premissa:
Todo e qualquer excesso que você coma – seja gordura, açúcar (carboidratos) ou proteínas – é armazenado na forma de lipídios.
Nosso corpo é programado para transformar os excessos de macromoléculas que ingerimos em triglicerídeos (ou triglicérides ou triacilglicerol, terminologias para a mesma molécula).
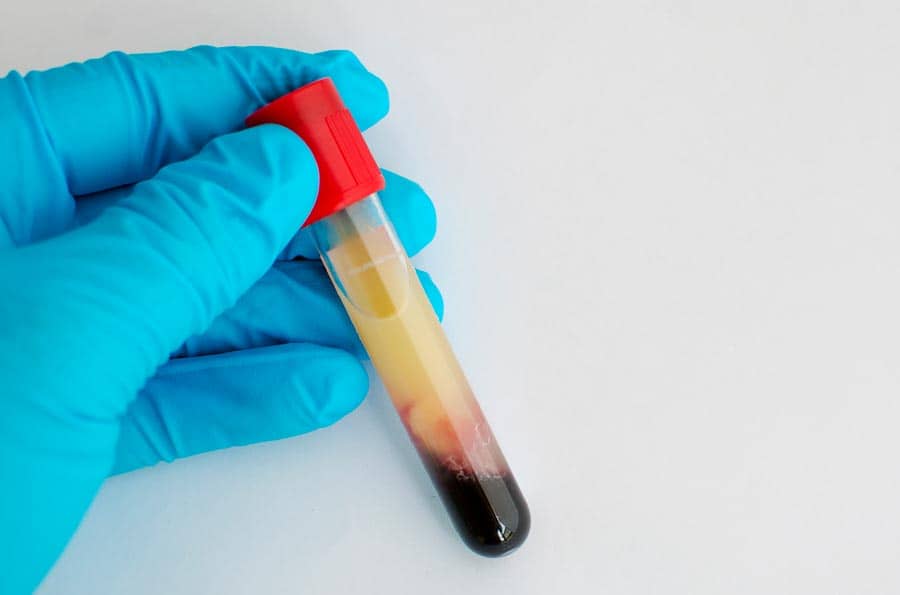
Quando o médico solicita um exame chamado lipidograma, é para ele verificar, entre outras coisas, a concentração de triglicerídeos na corrente sanguínea. A alteração da concentração desses lipídios no sangue é uma condição chamada dislipidemia. O plasma sanguíneo com dislipidemia fica turvo, como podemos ver na figura 1. O problema de grandes concentrações de gordura no sangue é que ele pode se acumular nas paredes dos vasos sanguíneos, em uma condição chamada aterosclerose, causando o entupimento dos vasos. No caso do coração, este entupimento leva ao infarto agudo do miocárdio.
Neste módulo iremos aprender como os lipídios adquiridos na alimentação são degradados para a obtenção de energia, e como eles são sintetizados para armazenamento.
CATABOLISMO DOS LIPÍDIOS
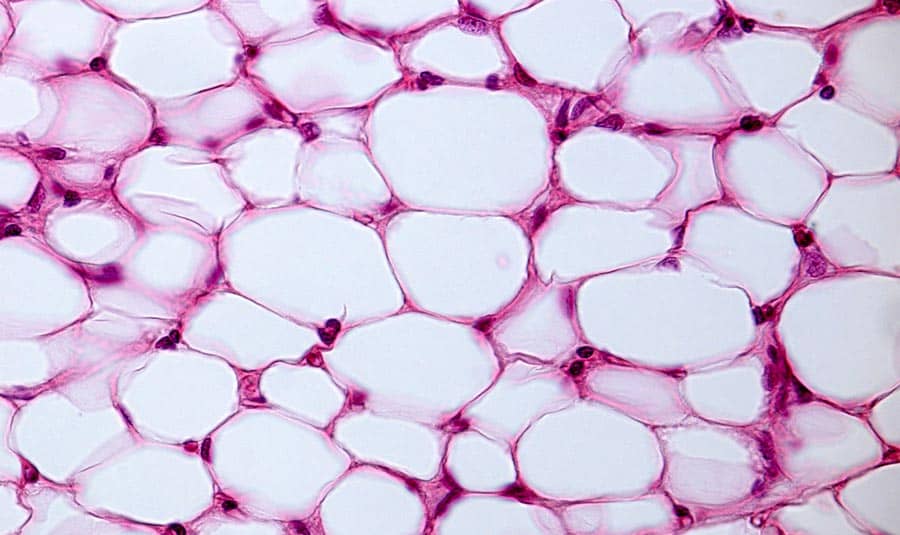
Nos mamíferos, os lipídios são armazenados no tecido adiposo (figura 2), na forma de triglicerídeos, ou triacilglicerol. Os triglicerídeos representam até 95% do volume do adipócito, que é a célula do tecido adiposo, e 20% do peso corpóreo total.
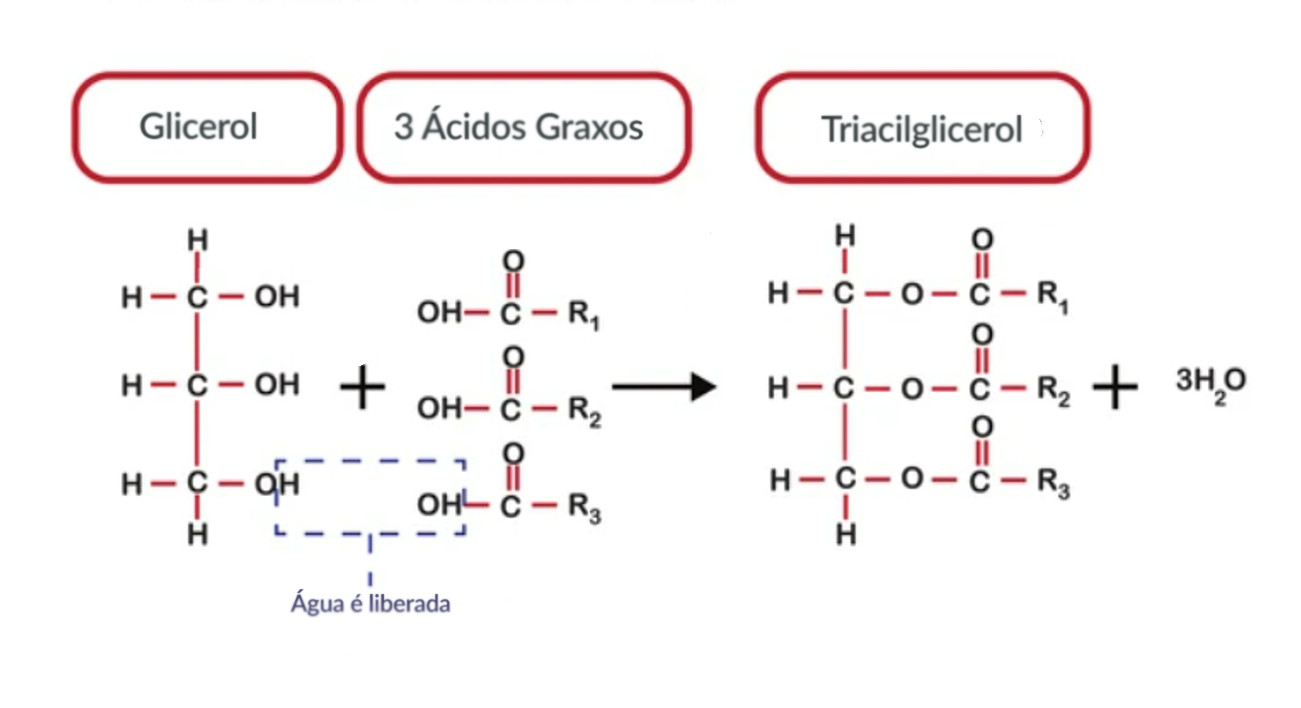
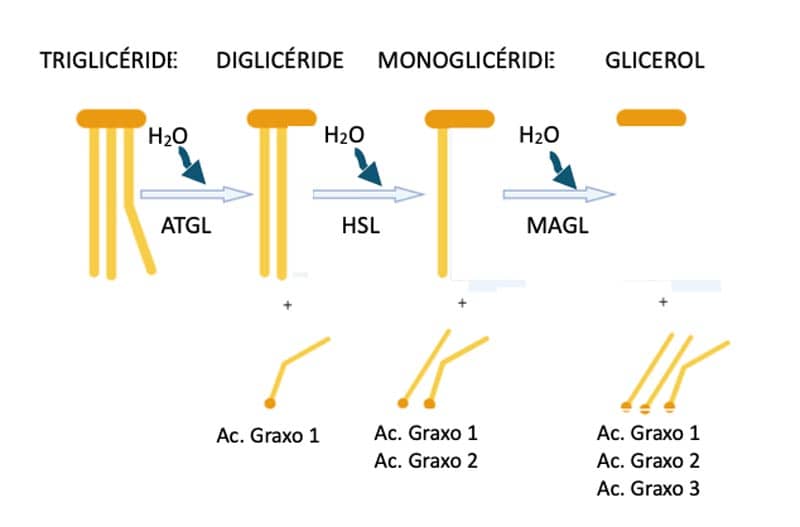
O triacilglicerol é uma molécula formada por três moléculas de ácidos graxos (lipídio) e uma de glicerol, que é um álcool (figura 3).
São duas as fontes de lipídios: a reserva no tecido adiposo e o que é ingerido na dieta.
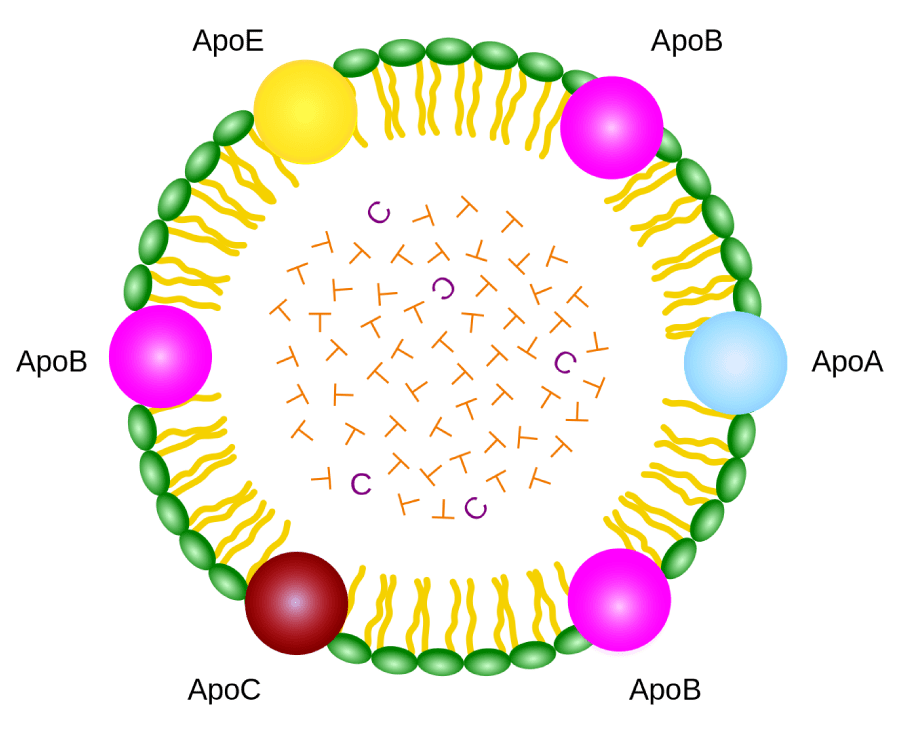
Os triglicerídeos ingeridos na dieta são transportados por lipoproteínas, como os quilomícrons (figura 4), e por VLDL. Os quilomícrons são grandes moléculas de lipoproteínas sintetizadas pelas células intestinais, formadas por triglicerídeos (de 85 a 95%), colesterol e proteínas (1 a 2%). Uma das proteínas do quilomícron é capaz de ativar a lipase lipoproteica presente nos capilares sanguíneos dos órgãos, permitindo a degradação em ácidos graxos e a entrada destes nas células.
Já o VLDL também apresenta a mesma composição dos quilomícrons, porém com concentrações diferentes: 50% de triglicerídeos, 40% de colesterol e 10% de proteínas.
A degradação dos lipídios se dá por controle hormonal, em função da demanda energética do organismo. O que está estocado será acionado para gasto, se houver demanda energética, caso contrário, eles permanecem estocados no adipócito. Se houver necessidade energética, o glucagon liberado pelo pâncreas – e que está na corrente sanguínea – se liga à membrana do adipócito, ativando as lipases presentes dentro da célula.
Assim, os triglicerídeos armazenados no adipócito serão hidrolisados a ácidos graxos e glicerol (figura 5). Essa hidrólise se dá na presença de moléculas de água, catalisadas por enzimas específicas: lipase de triglicéride de tecido adiposo (ATGL), lipase hormônio sensível (HSL) e lipase de monoacilglicerol (MAGL).
O glicerol é processado dentro do adipócito pelas enzimas glicerol quinase, formando o glicerol 3 fosfato. Nessa etapa há o consumo de uma molécula de ATP. Na segunda etapa, o glicerol 3 fosfato é oxidado à dihidroxicetona fosfato pela enzima glicerol-3-fosfato desidrogenase (figura 6).
O balanço energético do processamento do glicerol (tabela 1) é o seguinte: é gasto 1 ATP para a fosforilação do glicerol; porém, produz-se 1 NADH para a produção de dihidroxicetona fosfato, e cada NADH gera 3 ATP. Além disso, a dihidroxicetona é convertida em piruvato, por sua vez convertido em acetil-CoA, e entra no ciclo de Krebs.
Na conversão para piruvato, são formados 1 NADH e 2 ATP, totalizando 5 ATP. Na conversão para Acetil-CoA, mais 1 NADH, convertido em mais 3 ATP. Por fim, no ciclo de Krebs, há a formação de 3 NADH, 1 FADH2 e 1 ATP, totalizando mais 12 ATP. Somando tudo, são produzidos 23 ATP no processamento do glicerol. Com o gasto de 1 ATP, o saldo final é de 22 ATP.
| Natureza | Gasto | Produção | Saldo |
|---|---|---|---|
| Processamento do glicerol | 1 ATP | 1 NADH | 2 ATP |
| Dihidroxicetona à piruvato | - | 1 NADH e 2 ATP | 5 ATP |
| Piruvato à acetil-CoA | - | 1 NADH | 3 ATP |
| Ciclo de Krebs | - | 3 NADH, 1 FADH2 e 1 ATP | 12 ATP |
| Saldo Final | 1 ATP | 23 ATP | 22 ATP |
Já os ácidos graxos não são degradados nos adipócitos. Eles saem dos adipócitos e se ligam à albumina sanguínea; como são insolúveis no sangue, não podem viajar livremente na corrente sanguínea. Assim, o ácido graxo é distribuído em todos os tecidos do corpo. Quando ele chega às células, passa pela membrana e é levado para a mitocôndria. Porém, para entrar na mitocôndria, ele deve ser ativado, acoplado a uma CoA na sua estrutura.
A adição da CoA ao ácido graxo é feita pela enzima acil-CoA sintetase, mas, para que isso aconteça, há o consumo de uma molécula de ATP, utilizando duas ligações de alta energia e liberando AMP e pirofosfato (PPi) (figura 7).
Ácidos graxos
Os ácidos graxos são formados por longas cadeias de carbono, e podem ser moléculas saturadas (ligações simples) ou insaturadas (ligações duplas). No corpo humano, quando precisamos de energia, o ácido graxo a ser degradado é o palmitato, que possui 16 carbonos. Por isso, os exemplos que usaremos a seguir, falaremos deste ácido graxo.
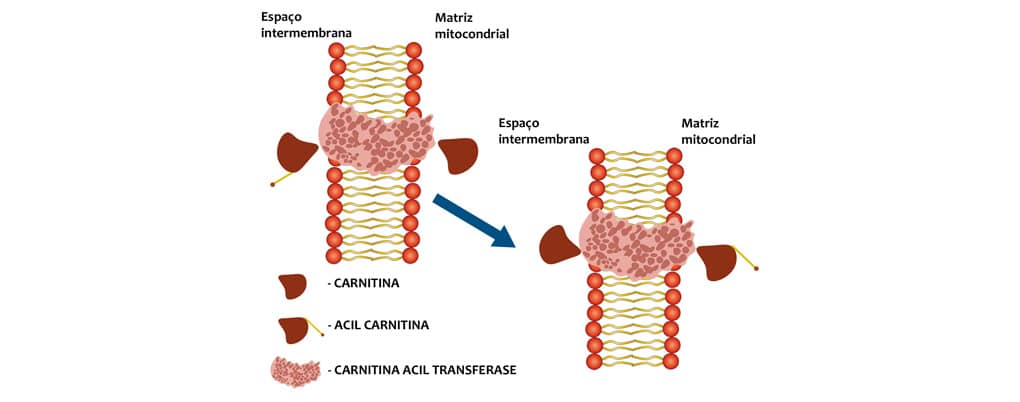
Depois de ativado no citoplasma, o acil-CoA pode entrar na mitocôndria para ser degradado. Ele atravessa a membrana externa da mitocôndria, mas não atravessa a interna. Para ser transportado para a matriz mitocondrial, o Acil-CoA se liga a um aminoácido, a carnitina, e é transferido para a matriz mitocondrial por uma proteína que está presente na membrana interna da mitocôndria, chamada carnitina acil transferase.
Essa enzima promove a translocação da acil-carnitina do espaço intermembrana para a matriz mitocondrial, levando uma carnitina livre para o espaço intermembrana (figura 8).
β-Oxidação do ácido graxo ou Ciclo de Lynen
Uma vez na matriz mitocondrial, o ácido graxo irá sofrer sucessivas reações para formar moléculas de acetil-CoA. Essas reações são chamadas de β-oxidação ou ciclo de Lynen. São quatro reações sucessivas que formam, ao final, uma molécula de acetil-CoA e um outro acil-CoA (n-2). Portanto, o ácido graxo permanece nesse ciclo dependendo do tamanho da molécula.
O palmitato, que possui 16 carbonos, fica neste ciclo por sete voltas. Isso porque, na última volta, ele forma duas moléculas de acetil-CoA (figura 9).
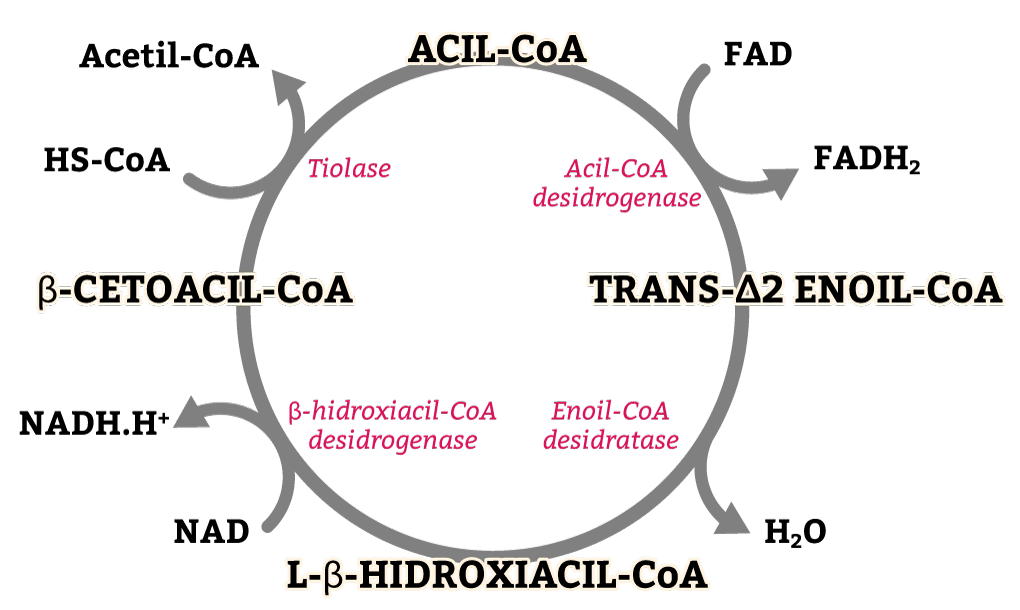
Assim se forma a molécula de acetil-CoA e o que restou do ácido graxo permanece no ciclo até formar as duas últimas moléculas de acetil-CoA. As moléculas de Acetil-CoA entram no ciclo de Krebs e as moléculas de FADH2 e NADH vão para a cadeia transportadora de elétrons.
| Natureza | Gasto | Produção | Saldo |
|---|---|---|---|
| Ativação do ácido graxo | 1 ATP à AMP | - | - 2 ATP |
| Ciclo de Lynen - 1 NADH e 1 FADH2 por volta – 5 ATP | |||
| 7 voltas para o palmitato | - | 7 NADH e 7 FADH2 (5 x 7) | 35 ATP |
| Ciclo de Krebs – 12 ATP por volta | |||
| 8 Acetil-CoA | - | 96 ATP (12 x 8) | 96 ATP |
| Saldo final | 129 ATP | ||
Saiba mais
Se levarmos em conta o ácido esteárico (18 C), a produção energética é de 146 ATP. A glicose tem seis carbonos e sua degradação forma 38 ATP. Três moléculas de glicose são os mesmos 18 carbonos do ácido esteárico, e a produção de ATP da degradação completa dessas três moléculas de glicose seria de 114 ATP. Portanto, a molécula de gordura é mais eficiente na produção de energia do que a quebra de moléculas de carboidratos.
Os ácidos graxos de cadeia longa, com mais de 20 carbonos ou com cadeias ramificadas, não iniciam o processo de degradação na mitocôndria. Os peroxissomos são organelas que iniciam a β-oxidação em ácidos graxos de cadeia muito longa e conseguem reduzir essas moléculas em até 18, 20 carbonos. Em seguida, esses ácidos graxos menores vão para a mitocôndria, para continuar a redução.
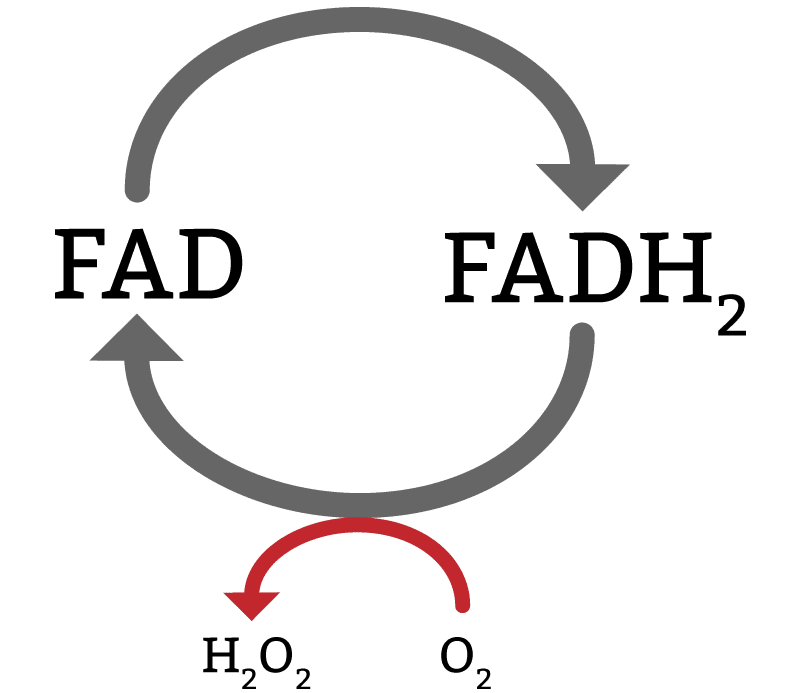
Os peroxissomos realizam a β-oxidação da mesma forma que a mitocôndria, porém eles não possuem a cadeia transportadora de elétrons. Portanto, o NADH sai do peroxissomo (assim como a acetil-CoA) e vai para a mitocôndria. Já o FADH2 é processado pelo próprio peroxissomo, que utiliza o O2 para produzir peróxido de hidrogênio (H2O2) (figura 10). Como essa molécula é extremamente tóxica, o peroxissomo possui uma outra enzima, a catalase, que degrada esse peróxido de hidrogênio em água e meio mol de oxigênio.
Existe uma doença genética, a adrenoleucodistrofia, que é causada pela a falta de uma molécula na membrana do peroxissomo.
ADRENOLEUCODISTROFIA
Assista ao vídeo em que será apresentado um trecho do filme O óleo de Lorenzo e uma discussão sobre a importância da descoberta do conceito bioquímico da doença.
Biossíntese dos ácidos graxos
Quando a ingestão de alimentos é maior que a necessidade energética, o ciclo de Krebs começa a ocorrer mais lentamente e o acetil-CoA fica acumulado dentro da mitocôndria. Esse acetil-CoA acumulado reage com o oxaloacetato, formando citrato, que também começa a acumular dentro da mitocôndria.
O acúmulo de citrato faz com que ele seja carreado para o citosol. A saída do citrato da mitocôndria se dá por uma molécula translocadora. Quando chega no citoplasma, o citrato é degradado novamente em oxaloacetato e acetil-CoA, pela enzima citrato liase (figura 11).
A biossíntese dos ácidos graxos ocorre a partir de uma molécula com três átomos de carbono, o malonil-CoA. Sendo assim, o acetil-CoA é convertido em malonil-CoA pela ação da enzima acetil-CoA carboxilase. Ela carboxila o acetil-CoA, que passa de dois para três carbonos (figura 12).
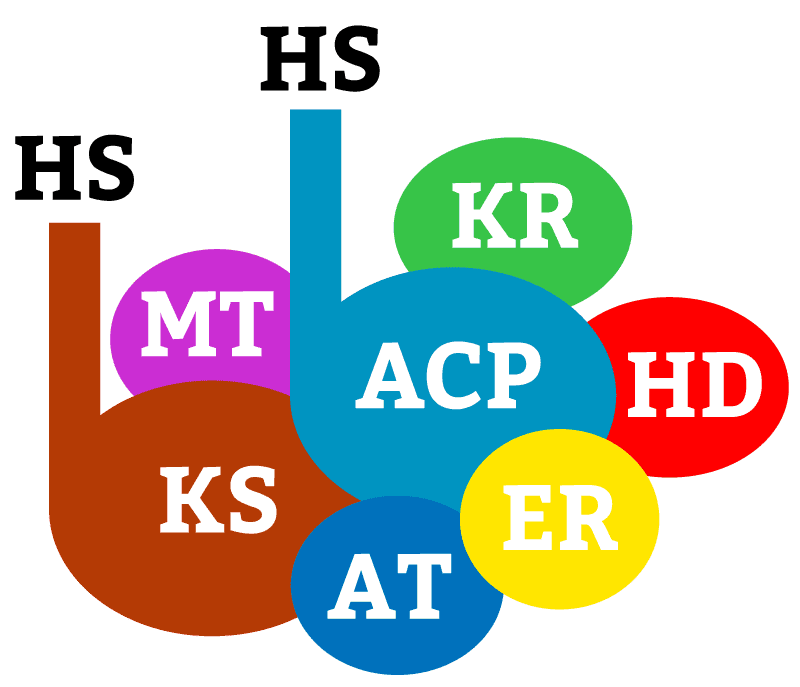
Após essa conversão inicia-se a formação do ácido graxo. Isso ocorre pela ação da enzima complexo do ácido-graxo sintase (figura 13).
Essa enzima contém diversas subunidades, cada uma com uma função. A primeira subunidade, proteína carreadora de grupos acila (ACP), apresenta um radical SH, assim como a β-ceto-ACP-sintase (KS). Esse grupo SH tem afinidade por receber coenzima A.
As outras subunidades são: acetil-CoA-ACP-transacetilase (AT), malonil-CoA-ACP-transferase (MT), β-cetoacil-ACP-redutase (KR), β-hidroxiacil-ACP-desidratase (HD) e enoill-ACP-redutase (ER).
Veja, a seguir, as reações da biossíntese de lipídios.
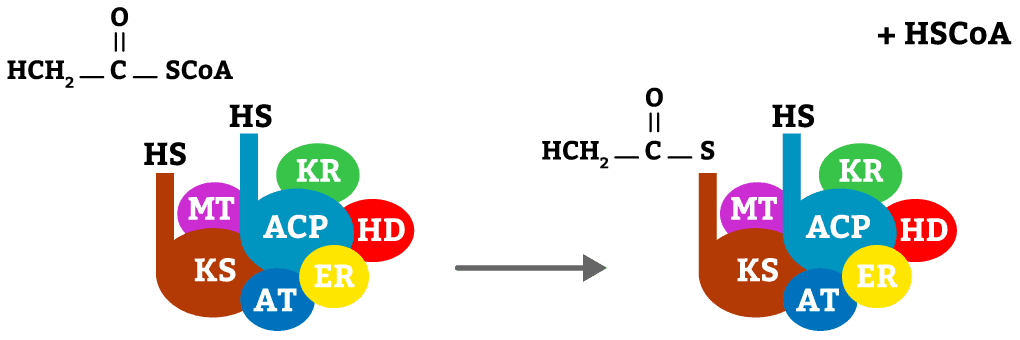
1ª reação da biossíntese de lipídios. A Acetil-CoA, com o auxílio da enzima AT, se liga ao radical HS da enzima KS, liberando CoA.
A partir do momento que existe um acúmulo de acetil-CoA e malonil-CoA, essas moléculas serão atraídas pelo complexo enzimático e farão a biossíntese de lipídios. A primeira enzima, a acetil-CoA-ACP-transacetilase (AT) muda sua conformação e permite que a acetil-CoA se ligue ao complexo na enzima β-ceto-ACP-sintase (KS), perdendo a CoA e permanecendo grudada ao complexo. Em seguida, a enzima volta à conformação inicial (figura 14).
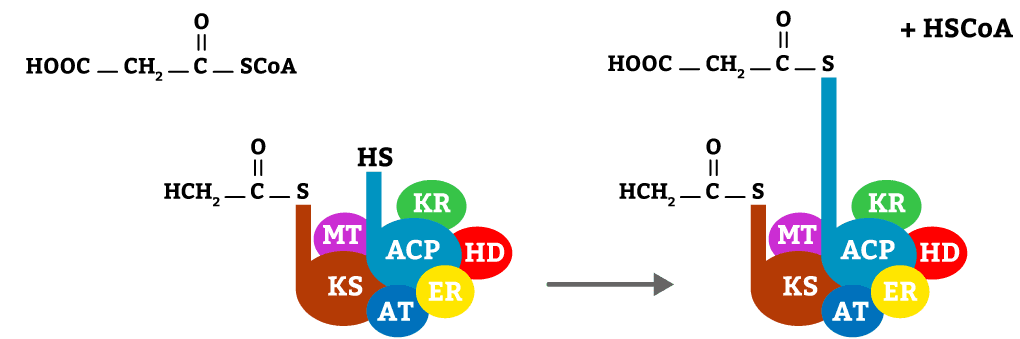
Da mesma forma que a enzima do primeiro passo, esta muda a sua conformação para transferir um malonil-CoA para o radical SH da ACP, permanecendo grudada ao complexo.
O malonil-CoA, com o auxílio da enzima MT, se liga ao radical HS da enzima ACP, liberando CoA.
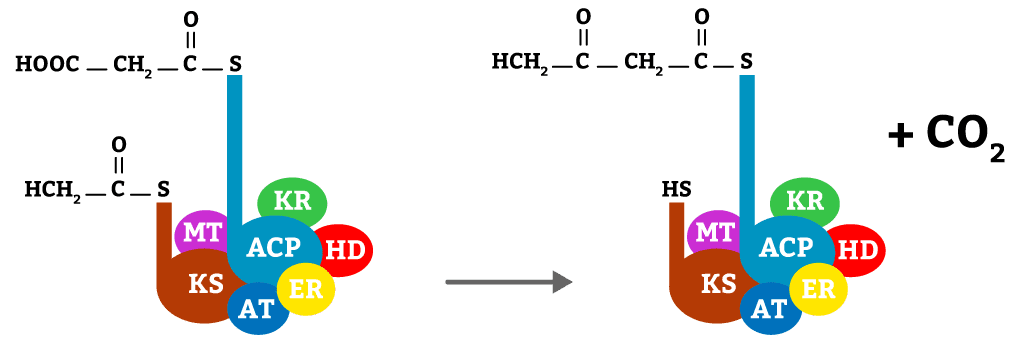
Nessa reação o acetil se funde com o malonil, liberando CO2 (figura 16).
Nessa reação, o malonil e o acetil se fundem, com o auxílio da enzima KS, formando butiril e liberando CO2.
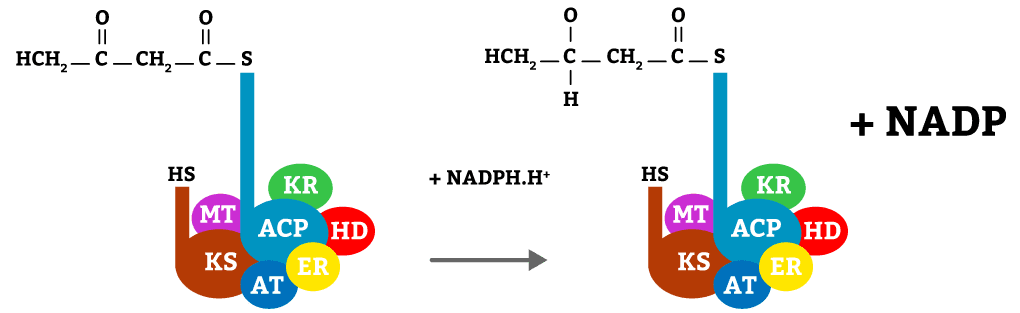
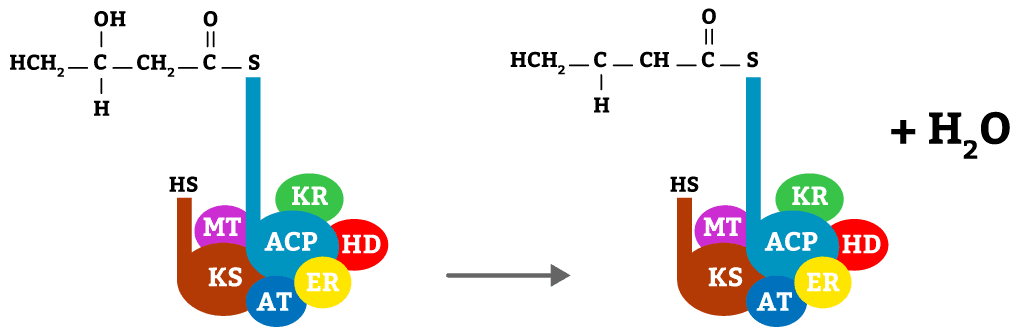
Nesta etapa o butiril é reduzido com o auxílio da enzima KR e o cofator NADPH, transformando o cetoácido em álcool.
Nesta etapa ocorre a desidratação da molécula com o auxílio da enzima HD.
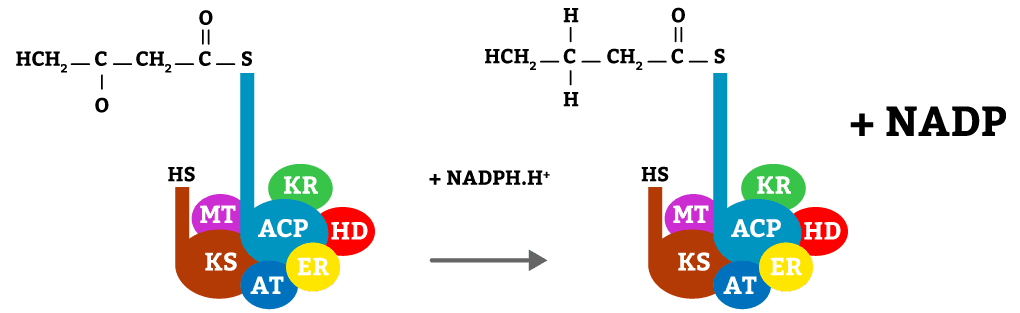
Nesta etapa, mais uma vez com o auxílio de um cofator NADPH, a molécula será reduzida, adicionando hidrogênios à molécula, reação catalisada pela enzima ER.
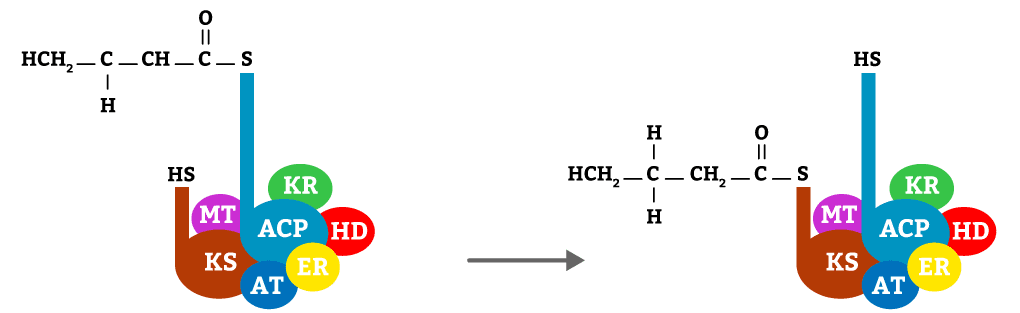
Nesta etapa vai ocorrer a translocação do butiril para o sítio da KS, liberando o sítio da ACP e permitindo a ligação de mais uma molécula de malonil-CoA.
Após a translocação, continua o alongamento da molécula, a partir da 2ª etapa, alongando-a até 16 carbonos. Portanto, tudo o que for excesso na alimentação, vai se transformar em piruvato, que irá se transformar em acetil-CoA e será utilizado para sintetizar ácido graxo.
Quando comparamos degradação e síntese de ácidos graxos, temos reações contrárias. Na degradação, o acetil-CoA é oxidado, hidratado e oxidado novamente. Na síntese, depois da condensação do acetil-CoA com o malonil-CoA, a molécula é reduzida, desidratada e reduzida novamente.
Já vimos mais acima que na degradação do palmitato (16 carbonos) temos um saldo energético de 129 ATP. Na síntese de uma molécula de palmitato, temos também três etapas de gasto de ATP (tabela 3).
| Natureza | Gasto |
|---|---|
| Transferência do acetil-CoA da mitocôndria para o citoplasma | |
| Produção de citrato – deixa de produzir 12 ATP por acetil-CoA | |
| Produção de acetil-CoA – gasta 1 ATP | |
| Uso do Oxaloacetato – gasta 1 ATP | |
| Palmitato – precisa de 8 Acetil-CoA | 96 ATP |
| Produção de malonil-CoA – gasta 1 ATP | |
| Palmitato – precisa de 7 Acetil-CoA | 7 ATP |
| 2 NADPH por volta – deixa de produzir 6 ATP | |
| São 7 voltas | 42 ATP |
| Saldo Final | 145 ATP |
Resumindo
Para degradar o ácido graxo há um saldo positivo de 129 ATP, mas para produzir a molécula, são gastos 145 ATP.
A cadeia é sintetizada no citoplasma até a formação do palmitato. O resto do alongamento é realizado no retículo endoplasmático, onde também é realizada a dessaturação. Nos animais, o processo de insaturação é feito até o carbono 9 pela palmitoil-CoA-dessaturase. No caso de outras insaturações, elas são realizadas a partir da ingesta de alimentos. Esses ácidos são o que conhecemos como w6 e w3.
Lipídios especiais
O colesterol é uma gordura sintetizada pelo fígado, intestino, adrenal e gônadas. Encontramos a forma livre, adquirida pela alimentação, e a esterificada, que é a forma de armazenamento, representada pela molécula de colesterol ligada a um ácido graxo. Ele é transportado por lipoproteínas e utilizado para a produção de sais biliares, hormônios esteroides, membrana plasmática e lipoproteínas sanguíneas.
O colesterol só é produzido no estado alimentado, pois são necessárias moléculas de acetil-CoA para a produção dele. Ou seja, a insulina deve estar circulante na corrente sanguínea.
A biossíntese do colesterol é realizada em quatro estágios:

O aumento de moléculas do cofator NADH diminui a velocidade do ciclo de Krebs. Assim, ocorre o acúmulo de acetil-CoA, que vai para o citoplasma na forma de citrato. Mas tudo isso nós vimos na biossíntese de ácidos graxos. A questão é que o excesso de acetil-CoA gera tanto a produção de ácidos graxos como a de colesterol.
A etapa 1 consiste na produção de melavonato a partir de três moléculas de acetil-CoA. Primeiro ocorre a fusão de 2 moléculas de acetil-CoA, formando o acetoacetil-CoA. Depois, mais uma molécula se liga, formando o β-hidroxi-β-metilglutaril-CoA (HMG-CoA), que é reduzido pela HMG-CoA redutase a melanovato. Uma vez que ocorra a produção de melavonato, todas as outras fases ocorrem naturalmente.
Um pouco do acetil-CoA dá origem aos corpos cetônicos. Em condições de jejum prolongado e de diabetes pode ocorrer um aumento de corpos cetônicos, que irão se acumular e acidificar o sangue. Os corpos cetônicos vão para a corrente sanguínea e são utilizados por outros tecidos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Discutir o metabolismo dos aminoácidos
PROTEÍNAS
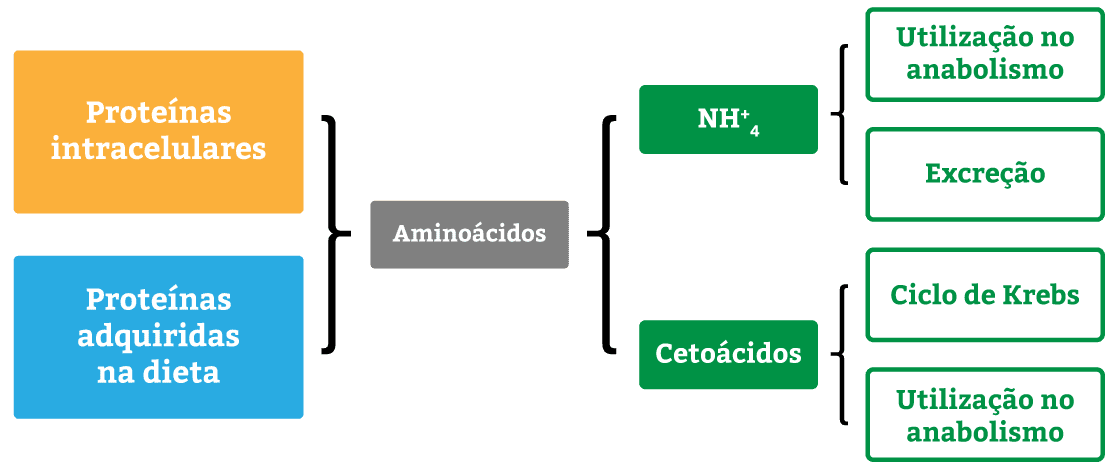
Nosso organismo obtém proteínas de duas formas: aquelas presentes na dieta (a carne, por exemplo), que são degradadas no trato digestório por enzimas específicas a aminoácidos, e as proteínas que constituem nosso organismo. Estas têm período de meia-vida variável, ou seja, sua vida útil varia e depende de uma série de fatores. Temos proteínas que duram apenas alguns minutos, mas outras chegam a durar meses, como é o caso da hemoglobina na hemácia.
Um adulto saudável e com dieta apropriada elimina nitrogênio suficiente para formar 100 gramas de proteínas. Além disso, ele necessita renovar 400 gramas de suas proteínas/dia e, desse modo, deve consumir cerca de 100 gramas de proteína/dia.
Atenção
Todo o excesso consumido vai ser excretado na forma de aminas, e o excesso dos esqueletos carbônicos será armazenado na forma de gordura.
Os animais estocam carbonos na forma de carboidratos (glicogênio – pequena quantidade) e lipídios, mas não estocam nitrogênio. Sendo assim, o excesso de nitrogênio deve ser excretado. Além disso, nem toda a proteína consumida é degradada, uma parte é eliminada nas fezes de forma íntegra (figura 14).
Reações de transaminação
As reações que iniciam a captação dos grupos amina dos aminoácidos são reações de transaminação, como se pode ver no esquema geral a seguir.
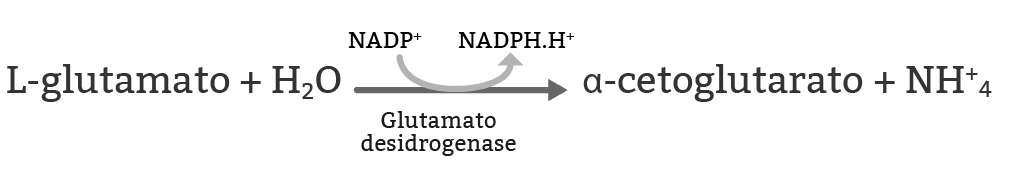
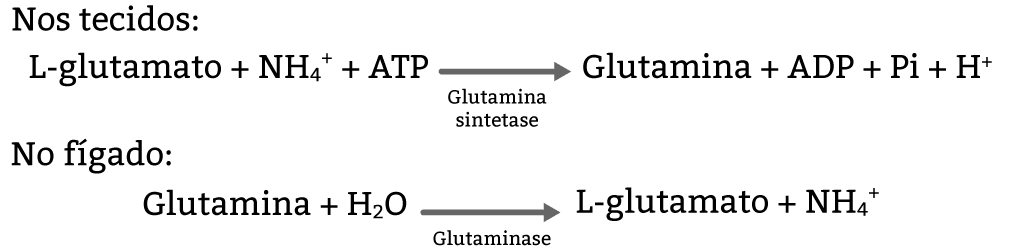
O L-glutamato é formado dentro da mitocôndria, sob processo de desaminação (figura 15), gerando amônia, um veneno metabólico, e deve ser rapidamente processada. Por isso ela é produzida dentro da mitocôndria e logo entra no ciclo da ureia, assunto que veremos mais adiante neste módulo.
METABOLISMO DOS AMINOÁCIDOS
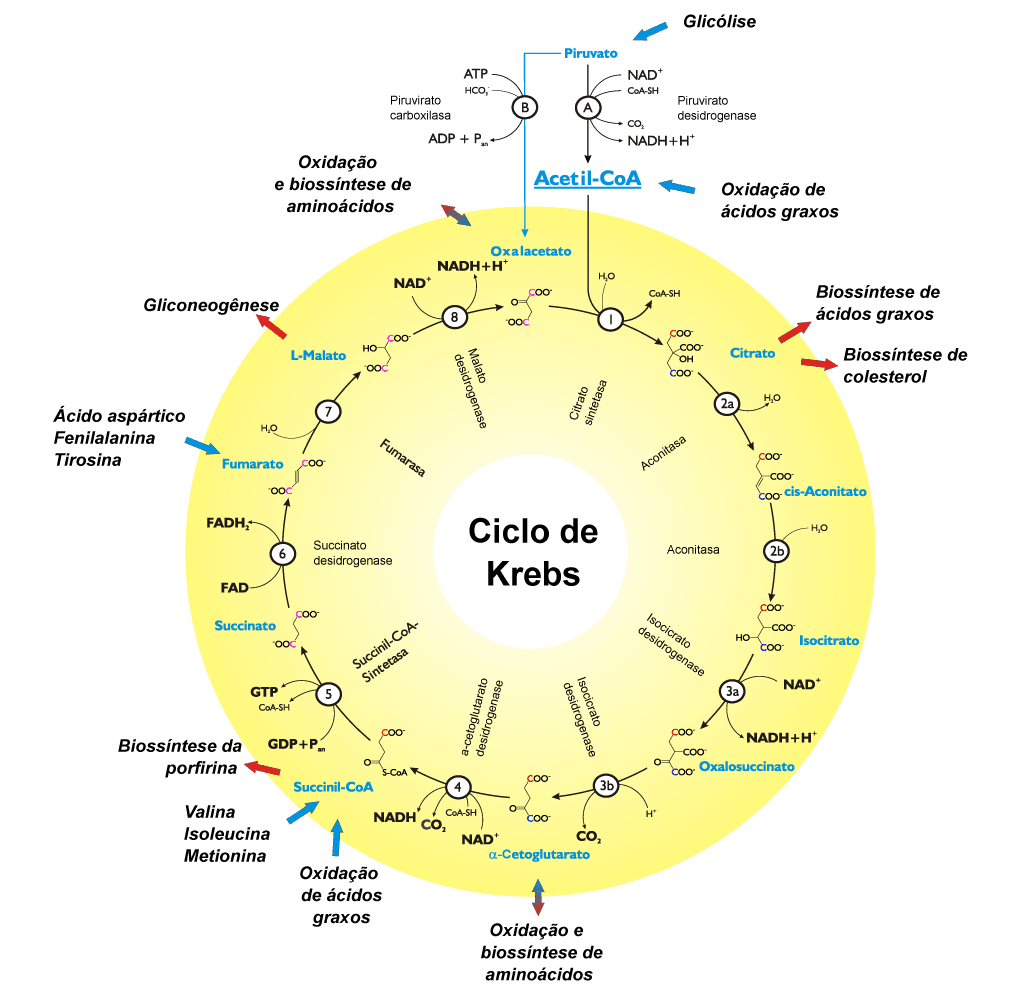
Quando se retira os grupamentos amina nas reações de transaminação, sobram os esqueletos carbônicos. Vimos que o glutamato gera a-cetoglutarato. Já o aspartato gera oxaloacetato. Essas moléculas são conhecidas nossas como moléculas do ciclo de Krebs, que, por isso, acaba sendo o centro do metabolismo energético.
O consumo de esqueletos carbônicos a mais e sem necessidade de energia pelo organismo, faz com que não haja necessidade de produção de NADH e, assim, o ciclo de Krebs vai parando, não descarboxilando o citrato. Consequentemente, com o acúmulo de citrato, ácidos graxos serão gerados e armazenados.
Uma situação oposta é a falta de glicose. Quando o ácido graxo entra no ciclo de Krebs, até ele chegar ao precursor da gliconeogênese, que é o oxaloacetato, já perdeu carbonos. Sendo assim, ácidos graxos não viram açúcar. Porém, alguns aminoácidos conseguem entrar no ciclo de Krebs e gerar glicose. É por isso que, em situação de jejum prolongado, existe a quebra de proteínas para formar glicose para as hemácias e o cérebro.
Dietas muito radicais, em que a pessoa não se alimenta direito, e muitas vezes sem carboidrato, fazem com que haja o consumo de proteínas musculares para a produção de glicose. Uma vez que a pessoa volte a se alimentar adequadamente, ela irá recuperar o peso.
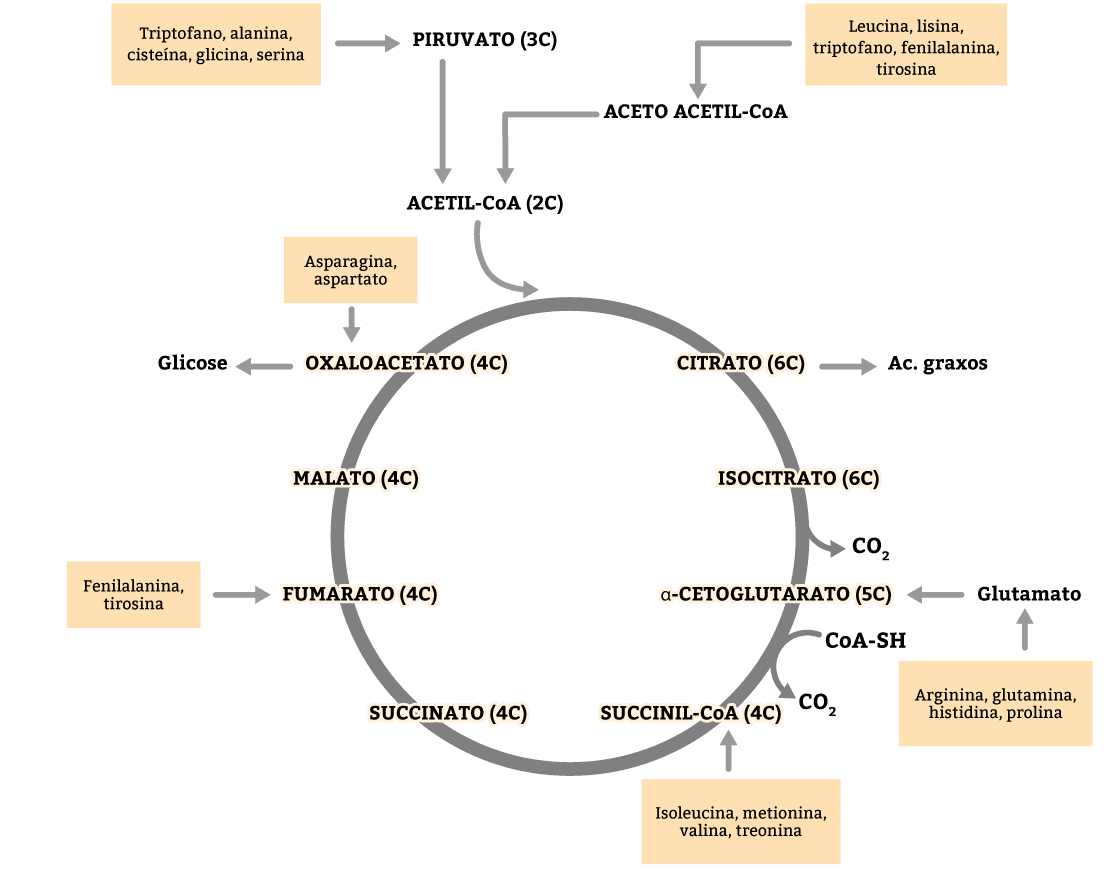
Existem grupos de aminoácidos, como veremos a seguir, que geram acetil-CoA, acetoacetil-CoA, piruvato, α-cetoglutarato, entre outros intermediários do ciclo de Krebs. Alguns aminoácidos possuem esqueleto carbônico grande e são capazes de produzir dois intermediários, como é o caso da fenilalanina e da tirosina, que geram acetoacetil-CoA e fumarato (figura 15). Os aminoácidos podem ser classificados da seguinte forma:
Aminoácidos cetogênicos
São incapazes de produzir glicose. Só produzem cetoácidos.
Aminoácidos glicogênicos
Podem produzir glicose no caso de necessidade energética.
Aminoácidos mistos
São aqueles que geram piruvato e, assim, podem seguir no ciclo de Krebs ao virar acetil-CoA, ou participar da gliconeogênese, ao ser carboxilado e gerar oxaloacetato.
Corpos cetônicos
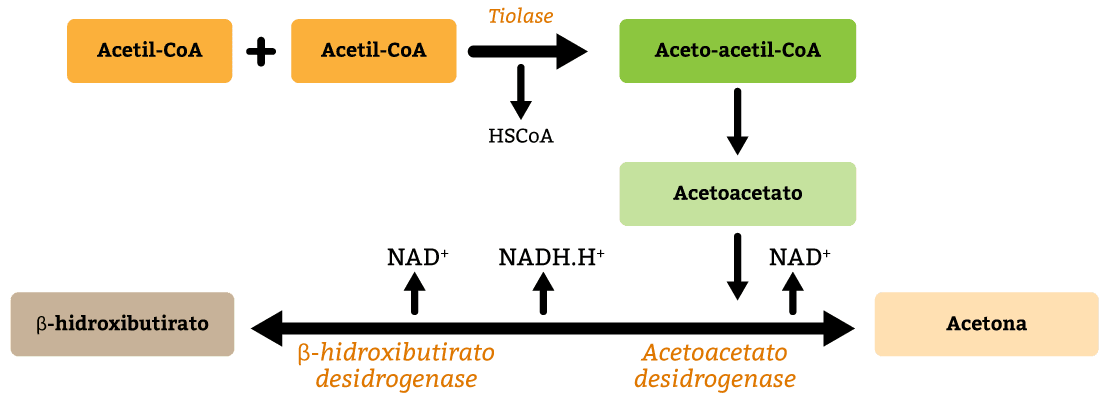
Os corpos cetônicos são moléculas produzidas a partir do acetil-CoA, principalmente na matriz mitocondrial das células do fígado. Essa produção acontece de forma espontânea em pequena quantidade. Porém, quando os carboidratos estão escassos, a energia deve ser obtida através da quebra dos ácidos graxos, e assim temos a produção dos corpos cetônicos.
A acetona é formada a partir da descarboxilação espontânea do acetoacetato. Os níveis de acetona são muito menores do que os níveis dos outros dois tipos de corpos cetônicos. Além disso, a acetona não pode ser convertida de volta a acetil-CoA, então ela é excretada na urina e exalada (por ser um composto altamente volátil, ela evapora facilmente). A exalação de acetona é responsável por um odor característico na respiração de pessoas em estados cetóticos.
Os corpos cetônicos são formados principalmente pela oxidação de ácido graxo (figura 18). Porém, uma rota alternativa para a produção de corpos cetônicos é o catabolismo dos aminoácidos fenilalanina, isoleucina, leucina, lisina, tirosina, triptofano e treonina, fornecendo energia de forma imediata ao ciclo de Krebs, uma vez que a Acetil-CoA produzida não pode ser convertida em glicose. Dentre esses aminoácidos, apenas a leucina e a lisina são exclusivamente cetogênicos e, como já vimos, serão catabolizados em acetoacetil-CoA ou acetil-CoA, podendo se inserir na rota de síntese de corpos cetônicos no fígado.
Excreção do nitrogênio
Como dito anteriormente, o nitrogênio é muito tóxico para o organismo e não deve permanecer na forma livre. Dependendo do tipo de organismo, ele é eliminado sob três formas diferentes:
Organismos amoniotélicos
Excretam a amônia diretamente. São os invertebrados aquáticos, peixes ósseos, larvas de anfíbios.
Organismos ureotélicos
Excretam a amônia sob a forma de ureia. São os anelídeos, peixes cartilaginosos, anfíbios e mamíferos.
Organismos uricotélicos
Excretam a amônia sob a forma de ácido úrico. São os insetos, répteis e aves.
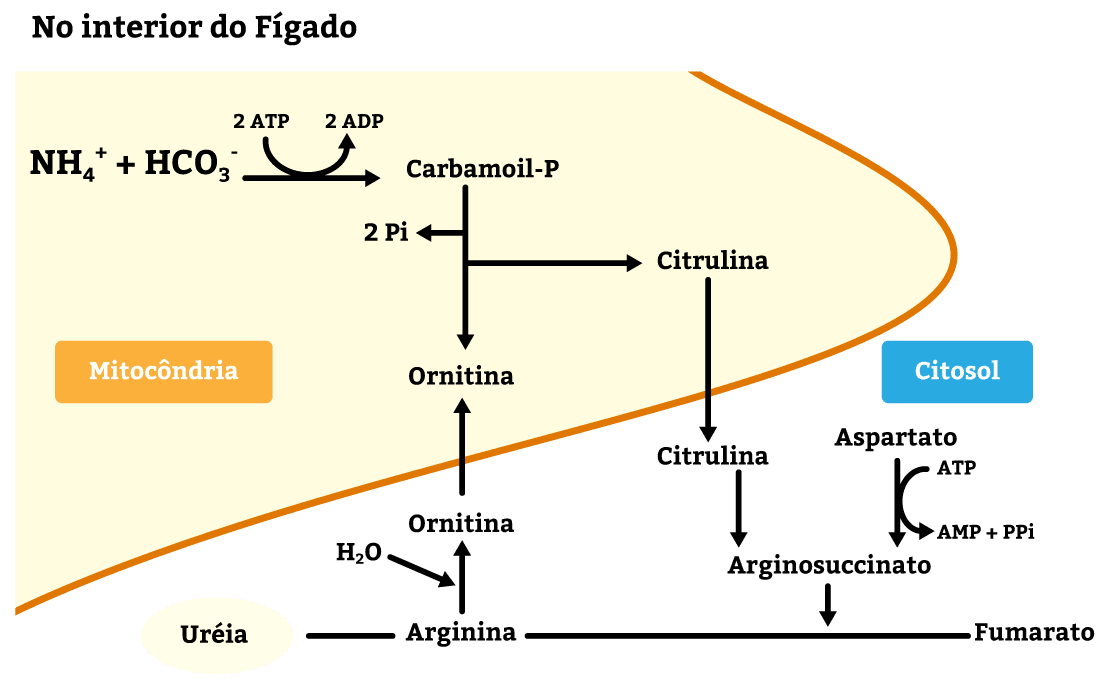
Veremos agora como a ureia é formada (figura 19). Nos hepatócitos, mais precisamente dentro da mitocôndria, a amônia se combina com o bicarbonato, formando carbamoil-fosfato. Este se combina com a ornitina, que vem do citoplasma para dentro da mitocôndria através de canais presentes na membrana da mitocôndria.
A combinação do carbamoil com a ornitina gera citrulina, que sai da mitocôndria para o citoplasma e se combina com aspartato, formando argininosuccinato. Esse comporto se quebra em fumarato, que pode voltar para o ciclo de Krebs, e arginina.
Por fim, a arginina se decompõe em ornitina e ureia. A ornitina volta para o ciclo da ureia e a ureia é excretada pelos rins na urina.
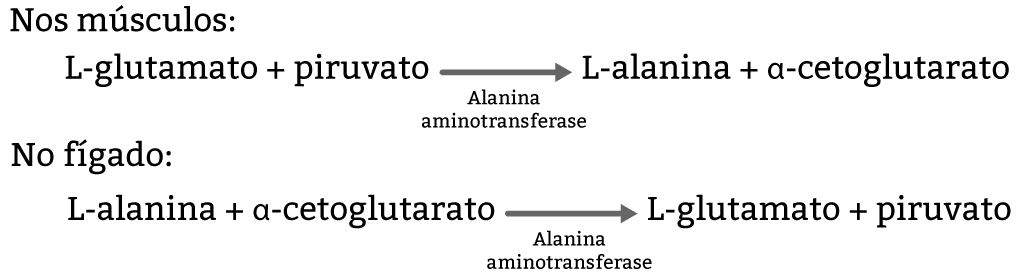
Toda a ureia é produzida no fígado. Os grupamentos amônia produzidos nos tecidos (figura 20) e nos músculos (figura 21) são transportados para o fígado em aminoácidos transportadores desses grupos amina: a glutamina e a alanina.
Existem mais de 100 doenças descritas decorrentes de problemas do catabolismo de aminoácidos e ciclo da ureia. Muitas delas levam à morte, em geral por acúmulo de substâncias tóxicas no cérebro ou amônia no sangue e tecidos.
Uma das doenças, a fenilcetonúria, ocorre porque não existe a enzima que catalisa a reação de fenilalanina para tirosina e daí para acetoacetato e fumarato. Assim, há o acúmulo de fenilpiruvato na entrada para a mitocôndria, e produção de energia no cérebro. O tratamento consiste em controlar a ingestão de fenilalanina.
Atenção
Outro aspecto importante a se discutir é sobre dietas constituídas por muita proteína. Como vimos, o metabolito gerado é a ureia, que é eliminada pela urina. Assista ao vídeo para entender um pouco melhor o que acontece com o organismo na dieta das proteínas.
DIETA DAS PROTEÍNAS
Assista ao vídeo que trata da dieta das proteínas e sua eficácia.
BIOSSÍNTESE DE AMINOÁCIDOS
São 20 os aminoácidos que compõem as nossas proteínas. Eles podem ser classificados como aminoácidos essenciais e aminoácidos não essenciais.
Os aminoácidos essenciais são aqueles que só podem ser produzidos pelos organismos autotróficos e devem ser ingeridos pelos seres humanos por meio da alimentação. A histidina também é um aminoácido que precisa ser suplementado no início da vida humana.
Além dela, mais oito aminoácidos são considerados essenciais:
Aminoácidos com grupo “R” apolares
Valina, leucina, isoleucina, triptofano, fenilalanina, metionina.
Aminoácidos com grupo “R” polares
Treonina.
Aminoácidos com grupo “R” aminado
Lisina.
Os aminoácidos não essenciais, em número de 12, são aqueles que podem ser sintetizados pelo homem:
Aminoácidos com grupo “R” apolares
Glicina, alanina, prolina.
Aminoácidos com grupo “R” polares
Cisteína, serina, tirosina, asparagina, glutamina.
Aminoácidos com grupo “R” aminados
Arginina e histidina.
Aminoácidos com grupo “R” carboxilado
Aspartato e glutamato.
No catabolismo, vimos que esses aminoácidos geram acetil-CoA, piruvato e outros compostos que são pré ou estão presentes no ciclo de Krebs e, assim que o grupamento amônia é eliminado, o esqueleto carbônico será utilizado para a geração de energia. Mas, no anabolismo, nós estamos “cuidando” do excesso de alimentação.
Os aminoácidos serão construídos a partir de aminoácidos existentes (para isso é necessária a demanda de algum aminoácido específico) ou pela incorporação de grupamentos amônia a esqueletos carbônicos.
Atenção
Importante lembrar que o anabolismo gasta energia. E cada vez que é utilizado um intermediário do ciclo de Krebs para produzir um aminoácido, a célula deixa de produzir uma quantidade significante de ATP. É claro que com uma alimentação saudável pouco aminoácido será produzido, diminuindo consideravelmente o gasto energético.
Alguns aminoácidos são precursores de moléculas importantes, a saber:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer a integração metabólica em diferentes estágios e a regulação hormonal dessa integração
UM POUCO MAIS SOBRE METABOLISMO
Como já vimos, o metabolismo pode ser definido como um conjunto de interações celulares extremamente ordenadas e estruturadas, em que vários complexos enzimáticos catalisam diversas reações químicas, a fim de degradar ou sintetizar macromoléculas necessárias à vida. Normalmente, essas interações são organizadas em sequências de múltiplos passos, denominadas vias, que se classificam como catabólicas (de degradação) ou anabólicas (de síntese).

Portanto, o metabolismo é a junção de todas as reações químicas estimuladas por enzimas, presentes dentro de um corpo celular, estabelecendo as vias metabólicas. Todas as fases que se sucedem continuamente em uma integração metabólica fornecem uma reação própria, que, usualmente, consiste na extração, na movimentação ou no aumento de uma partícula ou um grupo funcional. O agente é transformado em um elemento resultante de uma cadeia de reações metabólicas interpostas, denominadas metabólitos.
Atenção
É importante salientar que essas reações são cadenciadas: uma depende da anterior para que possa ocorrer.
Depois de tudo o que discutimos até agora, você deve ter reparado no seguinte: todas as vias metabólicas, sem exceção, convergem para a produção de ATP. E todas elas têm etapas em comum, indo finalizar no ciclo de Krebs e na cadeia transportadora de elétrons. Só que nosso organismo passa por diversos “momentos”:
Jejum;
Jejum intenso;
Pós-alimentação (que chamaremos pelo termo técnico pós-prandial);
Exercício intenso.
Em cada momento teremos uma “configuração”: são hormônios diferentes regulando as diferentes fases do metabolismo no nosso organismo. Além disso, temos também órgãos diferentes, que geram preferências nutricionais diferentes.
ESPECIALIZAÇÃO DOS ÓRGÃOS
Cada tecido do corpo humano se caracteriza por atividades próprias e específicas, reagindo diferentemente às reações metabólicas, da mesma forma, eles têm “preferências” energéticas. Vamos ver, então, como cada tecido se comporta.
No processo de digestão, o organismo processa os nutrientes ingeridos na dieta – proteínas, carboidratos e gorduras –, quebrando-os pela ação de enzimas específicas. Essas moléculas menores são absorvidas pelo trato gastrointestinal e caem na corrente sanguínea até chegar no fígado, onde serão processados. Esse caminho é feito de forma direta pela veia porta, de onde sai todo o sangue que circula pelos vasos do trato gastrointestinal.
No fígado, os hepatócitos convertem as partículas nutritivas em energia e em precursores para os outros tecidos. O tipo e a quantidade de nutrientes que são destinados ao fígado vão oscilar de acordo com diversos aspectos, como dieta e disponibilidade de alimentos. Devido a essa oscilação, o fígado é capaz de apresentar uma maleabilidade em relação ao metabolismo.
Processamento e distribuição de açúcares
Os hepatócitos trazem, na sua membrana, o transportador GLUT2, que possibilita a entrada de glicose
rapidamente na célula, de forma que a quantidade de açúcar dentro dela seja a mesma no sangue. A glicose que
entra no fígado é fosforilada pela glicoquinase, possibilitando a produção da glicose-6-fosfato. A presença
dessa enzima permite que os hepatócitos continuem fosforilando a glicose, mesmo quando sua quantidade no
fígado aumenta a ponto de sobrepesar outras hexoquinases. Além disso, no momento em que se reduz a quantidade
de glicose no sangue, o hepatócito reduz também o seu metabolismo, permitindo que a glicose seja poupada para
os outros tecidos.
Processamento e distribuição de aminoácidos
Existem várias rotas para os aminoácidos que ingressam nos hepatócitos. O fígado é o órgão responsável por
proceder às transformações metabólicas dos aminoácidos que derivam, de forma inconstante, de outros tecidos.
O sangue, por sua vez, é abastecido devidamente com glicose assim que os carboidratos são absorvidos depois
da digestão – ou no intervalo da alimentação – pela transformação do glicogênio, existente no fígado, em
glicose sanguínea.
Processamento e distribuição de lipídios
Os lipídios são um amplo grupo de compostos químicos orgânicos naturais que podem ser subdivididos em vários
tipos, entre eles os ácidos graxos. Estes, por sua vez, entram no fígado e passam a exercer diversas funções
no organismo. Além disso, o fígado também é responsável por promover a destoxificação de compostos orgânicos
externos – por exemplo, conservantes alimentares, aditivos e fármacos –, bem como de outros compostos
perigosos em potencial e ausentes de nutrientes.
O tecido adiposo se subdivide em duas partes: o tecido adiposo branco e o marrom. Cada um deles exerce papéis bem distintos durante o processo metabólico, os quais serão apresentados a seguir.
Tecido adiposo branco: armazena e provê ácidos graxos
Esse tecido não tem forma determinada; é amplamente espalhado pelo corpo, sendo encontrado embaixo da pele,
em torno dos vasos sanguíneos e no espaço abdominal. As células desse tecido branco são chamadas de
adipócitos e seu metabolismo é extremamente intenso, reagindo de maneira vigorosa a estímulos corporais, em
nítida ação compartilhada com os hepatócitos, o coração e o músculo esquelético. O tecido branco adiposo é
responsável pela reserva de triglicerídeos no corpo.
Tecido adiposo marrom: termogênico
Esse tecido diferencia-se do branco por ter células menores, com forma poligonal. As células, além de
conterem mais mitocôndrias e capilares, são mais inervadas. Além disso, os adipócitos marrons são peculiares
no que se refere à realização da termogênese.
O metabolismo energético no músculo esquelético se destaca pelo fornecimento de ATP como fonte de energia direta no momento de contração. Além disso, esse tecido está preparado para efetuar atividades mecânicas ininterruptas, que cessam e recomeçam, a depender da exigência corporal. Em alguns casos, a musculatura esquelética precisa atingir seu rendimento mais alto em pouco tempo.
O metabolismo energético que ocorre no cérebro é excepcional por múltiplas razões: os neurônios do sistema nervoso de um mamífero adulto, em geral, utilizam apenas a glicose como fonte de energia; os astrócitos, que são células do SNC, podem promover a oxidação dos ácidos graxos; seu processo metabólico respiratório é extremamente ativo, pois utiliza oxigênio de forma continuada e sem interrupção, totalizando 20% do total desse elemento usado pelo corpo quando em inatividade. O cérebro possui pequena reserva de glicogênio e, por isso, necessita sempre da concentração da glicose no sangue.
Apesar de os neurônios só utilizarem a glicose como fonte de energia, eles são capazes também de usar, se preciso, os corpos cetônicos (β hidroxibutirato) originados no fígado por meio de ácidos graxos. Essa capacidade é fundamental quando o corpo está em jejum prolongado ou inanição, após a quebra integral do glicogênio, possibilitando que o cérebro utilize a gordura armazenada como combustível.
A corrente sanguínea é responsável por deslocar os nutrientes provenientes do intestino delgado em direção ao fígado, e deste e do tecido adiposo em direção aos demais órgãos. Desloca, ainda, os resultados de excreção dos tecidos extra-hepáticos para que o fígado realize o devido processamento, e, depois, sejam eliminados pelos rins.
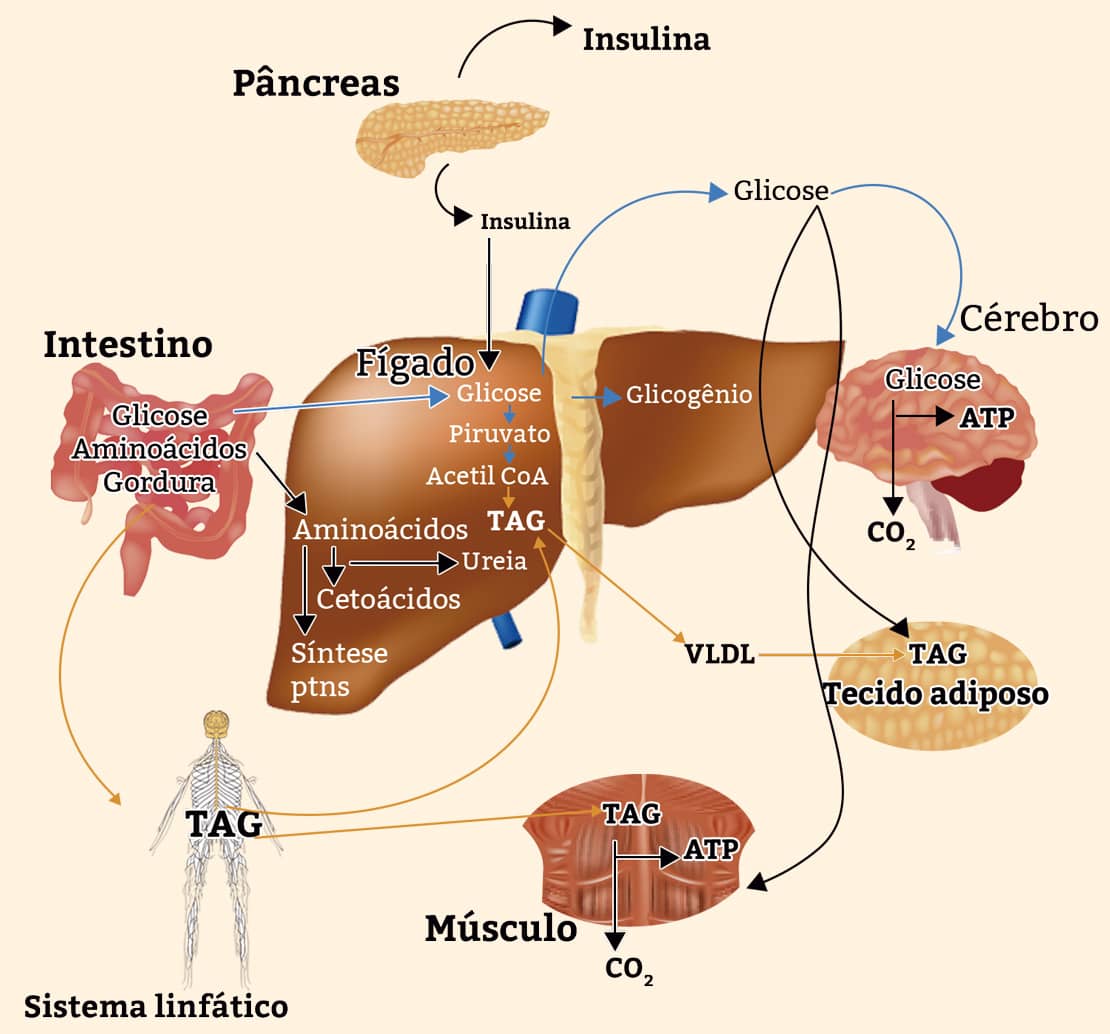
INTEGRAÇÃO METABÓLICA NO ESTADO ALIMENTADO
Quando fazemos uma refeição, insulina é liberada para a corrente sanguínea. Esse hormônio indica que a glicose no sangue está em nível mais elevado do que o normal, fazendo com que o tecido muscular o absorva para que seja transformado em glicogênio muscular. No hepatócito, essa substância também ativa a glicogênio-sintase e promove a inativação da glicogênio-fosforilase, de forma que considerável quantidade de glicose-6-fosfato é dirigida à produção de glicogênio.
Saiba mais
A insulina também impulsiona o estoque do excedente de energia nas células adiposas no formato de gordura. No fígado, provoca a oxidação da glicose-6-fosfato em piruvato, por meio do processo de glicólise, e sua oxidação em acetil-CoA. A quantidade de acetil-CoA não utilizada como combustível servirá para a produção de ácidos graxos, conduzidos do fígado para as células adiposas como triacilgliceróis. Por meio desse processo, será estimulada a produção de triacilgliceróis também nos adipócitos.
As consequências provocadas pela insulina consistem em estimular a transformação do excedente da glicose do sangue pelo armazenamento de glicogênio no fígado e no tecido muscular, bem como pelo armazenamento dos triacilgliceróis no tecido adiposo (figura 22).
Secreção de insulina em resposta às modificações de glicose
No momento em que a quantidade de glicose no sangue se torna mais elevada, depois da ingestão de uma alimentação rica em carboidratos, há um incremento na secreção de insulina e diminuição da secreção de glucagon pelo pâncreas. Com o aumento da glicose no sangue, os receptores de insulina GLUT2 conduzem a glicose para o interior das células, local em que será transformada em glicose-6-fosfato por meio da glicoquinase (hexoquinase IV), ingressando na glicólise.
O cérebro, que também exige combustível, manda sinais para a produção de insulina por meio dos sistemas nervosos simpático (negativos) e parassimpático (positivos). Um ciclo básico de retroalimentação demarca a secreção do hormônio, pois a insulina provoca a diminuição de glicose no sangue pela sua absorção nos tecidos. E essa diminuição é identificada nas células β pela redução do fluxo na hexoquinase, o que diminui ou encerra a produção de insulina.
Atenção
Todo esse processo tem como finalidade a conservação da quantidade de glicose sanguínea, que se mantém estável (com pequenas variações), embora haja uma intensa modificação na assimilação dietética.
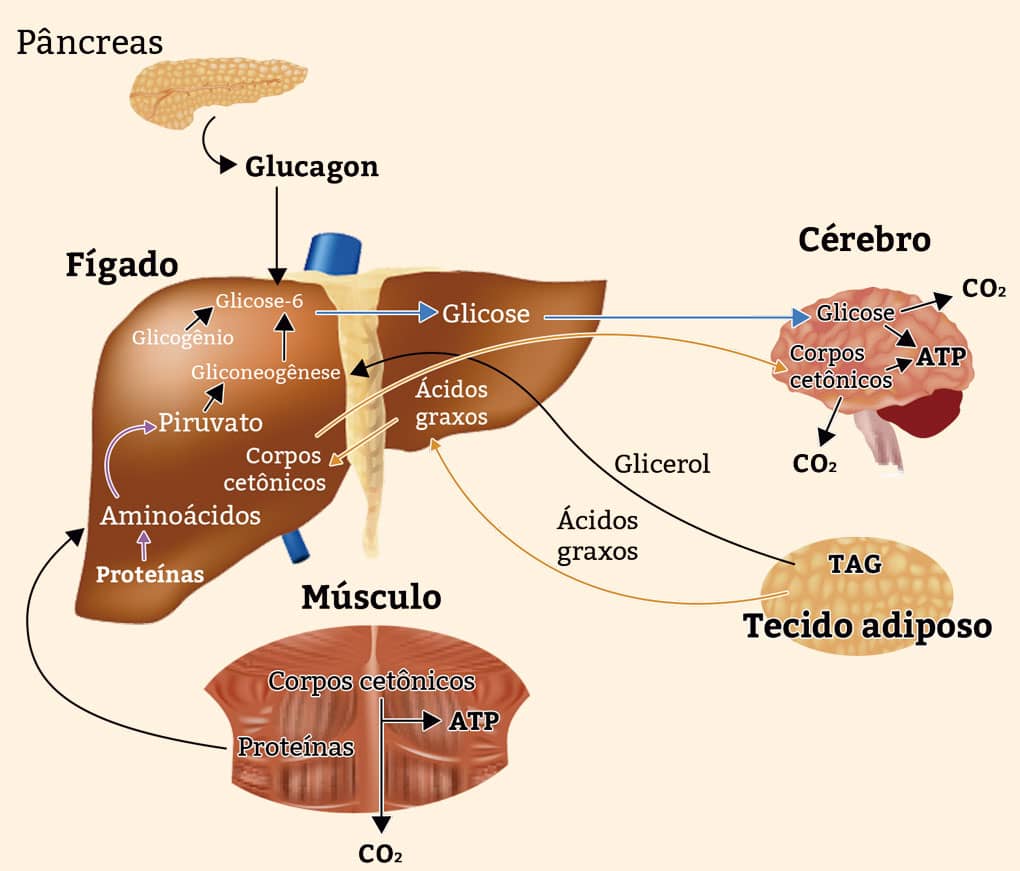
INTEGRAÇÃO METABÓLICA DURANTE O JEJUM
Algum tempo depois da realização de uma dieta rica em carboidratos, as taxas de glicose no sangue se tornam mais baixas, pois o cérebro e outros tecidos continuam a realizar a oxidação da glicose como fonte de energia. Essa diminuição provoca a liberação de glucagon e restringe a de insulina.

O glucagon, que também é produzido pelo pâncreas, promove uma elevação na quantidade de glicose de diversas formas. Da mesma maneira que a adrenalina, esse hormônio fomenta a quebra do glicogênio do fígado por promover a glicogênio-fosforilase e por suspender a glicogênio-sintase. Ambas as ações são consequência da fosforilação de enzimas, cujo desencadeamento se dá pelo cAMP.
Além disso, o glucagon impede o consumo de glicose, no fígado, pela glicólise; ao mesmo tempo, ativa a sua produção pela gliconeogênese. Essas duas ações são produtos da diminuição da quantidade de frutose-2,6-bifosfato, hormônio que também impede a atuação da piruvatoquinase, impossibilitando a transformação do fosfoenolpiruvato em piruvato e, consequentemente, a oxidação do último no ciclo do ácido cítrico. Como resultado do aumento de fosfoenolpiruvato, a gliconeogênese é favorecida, o que também ocorre por causa da ativação pelo glucagon. Portanto, a partir da intensificação da quebra de glicogênio, da suspensão da glicólise e do favorecimento da gliconeogênese no fígado, o glucagon possibilita que esse órgão libere glicose para o sangue, restabelecendo seu regular percentual.
Apesar de ter o fígado como destino principal, o glucagon produz alterações no tecido adiposo, impulsionando a quebra de triacilgliceróis por provocar a fosforilação. As lipases em atividade exportam ácidos graxos livres para serem utilizadas pelo fígado e por outros tecidos como fonte de energia, visando conservar glicose para ser utilizada pelo cérebro (figura 23).
Resumindo
A finalidade da secreção do glucagon é incentivar a síntese e a exportação da glicose pelo fígado e utilizar os ácidos graxos do tecido adiposo, em vez da glicose, como fonte de energia para outros sistemas do corpo, com exceção do cérebro.
INTEGRAÇÃO METABÓLICA DURANTE O JEJUM PROLONGADO
O armazenamento de energia por um adulto pode ocorrer de três formas:
Por meio do glicogênio guardado no fígado e nos músculos (em pequena quantidade).
Por triacilgliceróis conservados no tecido adiposo em significativas concentrações.
Por proteínas teciduais, quebradas, caso seja necessário.
Entenda a seguir como funciona o jejum prolongado:
Primeira etapa:
Passadas duas horas da alimentação, a taxa de glicose no sangue se torna um pouco mais baixa, fazendo com que
o fígado a exporte para outros tecidos a partir do glicogênio armazenado. Nesse momento, a quebra de
triacilgliceróis é muito reduzida ou até inexistente.
Segunda etapa:
Passadas mais duas horas (totalizando quatro horas depois da ingestão), a taxa de glicose no sangue se torna
ainda mais baixa, restringindo a liberação de insulina e aumentando a do glucagon. Essas indicações hormonais
ativam os triacilgliceróis, que passam a ser, a priori, a fonte de energia utilizada pelo fígado e
pelos músculos.
Entraria na segunda etapa:
Assim, quando não há ingestão de alimento por um período mais longo, com o intuito de abastecer o cérebro com
glicose, o fígado utiliza as proteínas menos indispensáveis para o corpo como um todo. Da mesma forma, os
aminoácidos que não são fundamentais sofrem a transaminação ou desaminação, e os grupos amino extras são
transformados em ureia, que é liberada através do sangue para o sistema renal e excretada na urina.
Ainda no fígado e um pouco nos rins, a estrutura interna das moléculas de carbono dos aminoácidos glicogênicos é transformada em piruvato ou intermediários do ciclo do ácido cítrico. Esses intermediários, da mesma forma como o glicerol dos triacilgliceróis do tecido adiposo, fornecem os substratos iniciais para a realização da gliconeogênese no fígado, produzindo glicose para o cérebro.
Além disso, os ácidos graxos exportados do tecido adiposo passam pelo processo de oxidação, gerando a acetil-CoA no fígado; entretanto, como o oxaloacetato é reduzido pela utilização de intermediários do ciclo do ácido cítrico na gliconeogênese, o ingresso da acetil-CoA no ciclo é prejudicado e, por consequência, sua quantidade começa a se concentrar. Tal processo facilita a produção de acetoacetil-CoA e corpos cetônicos. Depois de dias sem alimentação, as taxas de corpos cetônicos na corrente sanguínea se intensificam, uma vez que estes são liberados pelo fígado para serem levados ao músculo esquelético, coração e cérebro, que passam a usá-los como fonte de energia em lugar da glicose.
Saiba mais: O estoque de triacilgliceróis no tecido adiposo de um adulto, em uma faixa de peso considerada regular, pode sustentar o corpo durante aproximadamente três meses, se a regulação metabólica tiver dispêndio mínimo de energia. Em relação a uma pessoa obesa, o corpo é capaz de se manter sem ingestão de alimento por aproximadamente um ano.
Terceira etapa:
No momento em que o armazenamento de gordura termina, inicia-se a quebra de proteínas essenciais, o que afeta
a atividade do coração e do fígado e pode causar, na inatividade prolongada, a morte. Esse armazenamento
confere o combustível necessário para o corpo (fonte de calorias), enquanto a pessoa estiver em jejum ou em
uma alimentação restritiva. Porém, outros nutrientes, como vitaminas e mineirais, devem ser providos ao corpo
por meio de uma refeição rica em aminoácidos glicogênicos para que eles possam repor aqueles usados na
gliconeogênese. Portanto, na preparação de dietas que visem a redução de peso, em geral, deve-se atentar para
a necessidade de ingerir alimentos ricos em vitaminas, minerais e aminoácidos ou proteínas.
INTEGRAÇÃO METABÓLICA DURANTE ATIVIDADE FÍSICA INTENSA
Em situações que demandam ação intensa, o cérebro libera sinais neuronais que ativam a produção de adrenalina e noradrenalina da medula suprarrenal. Essas duas substâncias dilatam as vias aéreas para auxiliar na assimilação de oxigênio, aceleram a frequência cardíaca e, também, intensificam a pressão arterial, para que o deslocamento de oxigênio e energia para os tecidos seja feito mais facilmente.
Atenção
A adrenalina atua, em essência, nos músculos, no fígado e no tecido adiposo, pois impulsiona a glicogênio-fosforilase e limita a glicogênio-sintase por sua fosforilação (dependente de AMP cíclico), promovendo a transformação do glicogênio presente no fígado em glicose sanguínea (essencial para a atividade muscular anaeróbia).
Além disso, a adrenalina incentiva a quebra anaeróbica do glicogênio presente no músculo, por meio da fermentação em ácido láctico, promovendo a produção glicolítica de ATP. Esse hormônio também é capaz de estimular a ação de gordura, que intensifica a secreção de glucagon e impede a de insulina, acentuando sua atuação em busca da produção de combustível e da redução de sua conservação.
INTEGRAÇÃO DO METABOLISMO
Assista ao vídeo a seguir, que aborda a integração do metabolismo, suas principais características e aporte enzimático.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Discutir a origem metabólica do diabetes, da obesidade e da síndrome metabólica
ALIMENTOS X DISTÚRBIOS DO METABOLISMO
Atualmente, com diversos tipos de alimentos – nem sempre saudáveis – cada vez mais pessoas desenvolvem algum distúrbio do metabolismo. São doenças atuais, causadas, na maior parte das vezes, por ingesta de alimentos de forma exagerada ou não saudável, que leva a diversas complicações. Aqui iremos discutir sobre obesidade, síndrome metabólica e diabetes mellitus.
OBESIDADE
A obesidade é o mais antigo distúrbio metabólico – há registros disso em esculturas gregas e em múmias. Atualmente é considerada a desordem metabólica mais importante em países desenvolvidos. Trata-se de uma epidemia mundial que afeta ambos os sexos.
Uma das causas do aumento de casos de obesidade é a mudança dos hábitos alimentares ocorrida no último século, em que alimentos com maiores índices de gordura animal, açúcares, e alimentos refinados foram introduzidos na dieta, com a diminuição de carboidratos complexos e fibras. Além disso, existe também uma redução das atividades físicas dos indivíduos, o que contribui para as alterações da composição corporal.
Causas da obesidade
Embora não seja uma considerada uma desordem singular, apresenta diversas causas que resultam no fenótipo de obesidade. Podemos considerar como as causas:

Fatores alimentares
O excesso de consumo de energia, principalmente de lipídios, favorece o aumento das células adiposas. Outro aspecto importante é a frequência alimentar, com o consumo de várias refeições diárias.

Prática de exercícios físicos
Conforme a sociedade se torna mais desenvolvida e mecanizada, a atividade física diminui, diminuindo assim o gasto energético diário.

Influência genética
O controle do apetite e o comportamento alimentar, apesar de os mecanismos ainda não estarem esclarecidos, são influenciados geneticamente.

Envelhecimento
O declínio da taxa metabólica basal em consequência da perda de massa muscular, a diminuição das atividades físicas e o aumento do consumo alimentar também levam à obesidade.
Desordens endócrinas
Problemas de hipotálamo, hipotireoidismo, metabolismo de corticosteroides, hipogonadismo em homens, retirada dos ovários nas mulheres, síndrome do ovário policístico podem provocar o distúrbio.

Problemas psicológicos
Estresse, ansiedade e depressão influenciam diretamente no comportamento alimentar.
Morbidade e mortalidade associadas à obesidade
A obesidade está associada a várias doenças, como a síndrome metabólica e o diabetes mellitus, que iremos discutir mais adiante. Mas, além destas, diversas outras aumentam o risco de morbidade e mortalidade quando associadas com a obesidade. As doenças coronarianas são as principais, porém existem ainda aquelas do trato digestivo e neoplasias.
A ocorrência de complicações não está relacionada apenas à quantidade de peso, mas também à distribuição da gordura corpórea, que pode estar localizada na região abdominal ou na região inferior do quadril. Essas complicações são:
Tratamentos para a redução da obesidade
A redução da quantidade de massa corporal melhora a qualidade de vida e diminui a morbidade e a mortalidade de pacientes obesos.
| Problemas | Benefícios |
|---|---|
| Mortalidade |
Queda de 20-25% na mortalidade total Declínio de 30-40% nas mortes por diabetes 40-50% de diminuição nas mortes por neoplasias da obesidade |
| Pressão arterial |
Queda de 10 mmHg na pressão sistólica Diminuição de 20 mmHg na pressão diastólica |
| Angina |
Redução nos sintomas em 91% Aumento em 33% na tolerância ao exercício |
| Lipídios |
Diminuição de 10% no colesterol total Declínio de 15% no LDL Diminuição de 30% nos triglicerídeos circulantes Aumento em 8% no HDL |
| Diabetes |
Redução no risco de desenvolvimento de diabetes maior do que 50%. Diminuição de 30-50% na glicemia de jejum Declínio de 15% em HbA1C (hemoglobina glicada) |
Algumas formas de redução da massa corporal podemos ver a seguir:
Muitos tratamentos para a obesidade envolvem a restrição da ingestão energética total, uma das formas de alcançar o déficit energético e reduzir o peso corporal.
O exercício físico regular melhora a capacidade cardiovascular e respiratória, diminui a pressão arterial, ajuda na tolerância à glicose e na ação da insulina. O exercício regular está associado à diminuição da mortalidade em geral e a longo prazo.
O tratamento medicamentoso para redução da obesidade utiliza as seguintes drogas: anfetaminas, fenfluraminas, fenterminas, dietilpropriona, mazindol, pemolina, fenilpropanolamina e os antidepressivos fluoxitena e sertralina, entre outras.
O automonitoramento faz parte do programa de mudança comportamental e consiste em auto-observação dos fatos, sentimentos, pensamentos e atitudes que ocorrem antes, durante e após as tentativas de manter um comportamento prudente ao alimentar-se e na prática de exercícios físicos.
SÍNDROME METABÓLICA (SM)
A síndrome metabólica é um conjunto de fatores de risco que se manifestam em uma pessoa e que aumentam as chances de ela desenvolver uma série de outras doenças, como as cardíacas, derrames e diabetes.
A base dessa síndrome é a resistência à insulina, que age menos nos tecidos em função de uma menor quantidade do receptor de insulina GLUT 4, fazendo com que a célula fique dessensibilizada ao hormônio. Assim, o pâncreas produz mais insulina e eleva o nível de hormônio no sangue.
Como já vimos, a insulina é um hormônio anabólico que estimula a absorção de glicose pela ativação dos receptores de glicose intracelulares (GLUT4) em quase todos os tecidos, exceto o nervoso, os testículos e as hemácias. Sabe-se também que a ação desse hormônio está ligada à degradação de gordura.
O quadro de resistência insulínica consiste na ineficiência desse hormônio nos tecidos e na consequente superprodução dele. Com os tecidos menos sensíveis à ação do hormônio, eles absorvem menos glicose, gerando o quadro de hiperglicemia; realizam menos lipólise do que lipogênese, provocando elevação das taxas de colesterol do tipo VLDL e triglicerídeos e promovem acúmulo de gordura visceral.
Essa síndrome se desenvolve por fatores genéticos, por sedentarismo e obesidade. Embora os dois últimos contribuam significativamente, não são determinantes, pois nem todos os indivíduos que apresentam essas características desenvolvem a síndrome metabólica.
Os fatores de risco da síndrome metabólica são estes:
Grande quantidade de gordura abdominal
Em homens, cintura com mais de 102 cm e nas mulheres, maior que 88 cm.
Baixo HDL
("bom colesterol")
Em homens, menos do que 40mg/dL e nas mulheres, menos do que 50mg/dL.
Triglicerídeos elevados (nível de gordura no sangue)
150mg/dL ou superior.
Pressão sanguínea alta
135/85 mmHg ou superior, ou se o indivíduo usa algum medicamento para reduzir a pressão.
Glicose elevada
110 mg/dL ou superior.
Para que a pessoa seja diagnosticada com síndrome metabólica é necessário reunir três ou mais dos fatores listados acima, o que significa a existência de um quadro de resistência insulínica instalado. O grande problema das pessoas que têm síndrome metabólica é que elas se sentem bem e não apresentam sintomas. Porém, estão na faixa de risco para o desenvolvimento de doenças mais graves.
Atenção
Como na obesidade, o aumento da atividade física e a perda de peso são as melhores formas de controle da síndrome, porém alguns medicamentos podem ser utilizados para tratar os fatores de risco.
DIABETES MELLITUS (DM)
Trata-se de uma síndrome metabólica de origem múltipla, decorrente da falta de insulina e/ou da incapacidade de a insulina exercer adequadamente seus efeitos. É caracterizada por altas taxas de açúcar na corrente sanguínea de forma permanente (hiperglicemia constante).
São estes os tipos de dm:
Tipo 1
Causado pela destruição das células β do pâncreas, as que são responsáveis pela produção de insulina. Normalmente essa destruição é autoimune e as manifestações ocorrem desde muito cedo. Atinge de 5 a 10% das pessoas com diabetes.
Tipo 2
Resulta da resistência insulínica e da deficiência da secreção de insulina. Ocorre em cerca de 90% dos pacientes diabéticos.

Diabetes gestacional
Ocorre durante a gestação e é causada por uma diminuição na tolerância à glicose. Normalmente não persiste após o parto, mas aumenta o risco de desenvolvimento do tipo 2 mais à frente.
Existem outros tipos decorrentes de defeitos genéticos associados a outras doenças ou ao uso de medicamentos.
Principais sintomas do diabetes:
DM tipo 1 – vontade de urinar diversas vezes; fome frequente; sede constante; perda de peso; fraqueza; fadiga; nervosismo; mudanças de humor; náusea; vômito.
DM tipo 2 – infecções frequentes; alteração visual (visão embaçada); dificuldade na cicatrização de feridas; formigamento nos pés; furúnculos.
TIPOS DE DIABETES
Assista ao vídeo a seguir sobre os diferentes tipos de diabetes.
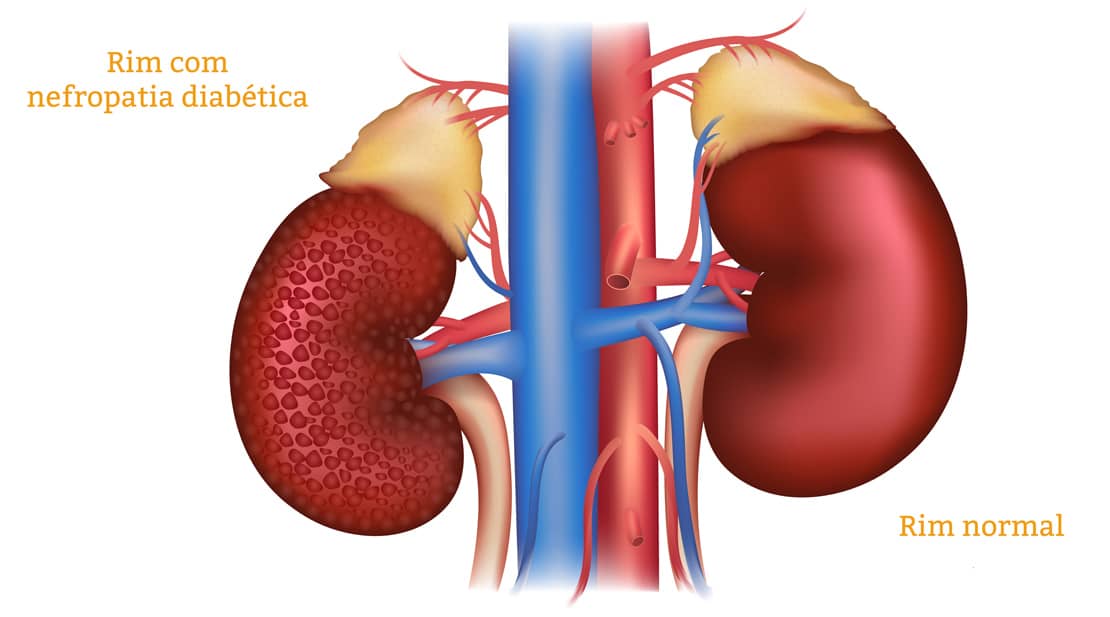
O DM pode trazer complicações. Veja a seguir:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste tema estudamos o metabolismo dos lipídios e aminoácidos, e como ocorre sua degradação e biossíntese. Isso é importante para entendermos como os maus hábitos alimentares aliados à falta de exercícios físicos e a outros fatores podem gerar distúrbios que aumentam muito a probabilidade de morbidades e mortalidade. Conhecemos com mais detalhes doenças como a obesidade, a síndrome metabólica e o diabetes mellitus. Enfim, tivemos uma visão bem abrangente do papel fundamental que a bioquímica desempenha nos estudos sobre saúde.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Reconheceu as vias metabólicas relacionadas com a metabolização das gorduras em geral, bem como a sua biossíntese.
Discutiu o metabolismo dos aminoácidos.
Reconheceu a integração metabólica em diferentes estágios e a regulação hormonal dessa integração.
Discutiu a origem metabólica do diabetes, da obesidade e da síndrome metabólica.