Descrição
Coleta de amostras e principais métodos e técnicas empregados em parasitologia clínica.
PROPÓSITO
Compreender como é feita a coleta de amostra e as principais técnicas para realização dos exames parasitológicos é de extrema importância para a qualidade de um exame eficaz que garanta um resultado seguro, pensando sempre no bem-estar do paciente.
OBJETIVOS
Módulo 1
Descrever a coleta de amostras para as análises parasitológicas
Módulo 2
Reconhecer os métodos diretos empregados nos exames parasitológicos de fezes
Módulo 3
Identificar as técnicas parasitológicas do sangue e os métodos indiretos
Introdução
A parasitologia é o campo da Biologia que estuda as relações entre os parasitas (protozoários, nematódeos, platelmintos e artrópodes) com outro organismo (hospedeiro), humano ou não. Os parasitas precisam dessa associação para a retirada de nutrientes e a garantia de seu crescimento e de sua sobrevivência.
Você sabia que um homem tanto pode viver anos com parasitas e ser assintomático como apresentar os primeiros sintomas em instantes? Esses organismos podem entrar em contato com o hospedeiro de diversas formas, entre elas: ingestão de alimentos contaminados; contato direto; picada de um vetor (como o mosquito) e sangue
De acordo com o tipo de contato, os parasitas podem ser classificados como ativos ou passivos.
Os parasitas podem ter apenas um hospedeiro (homoxenos) ou vários (heteroxenos). Além disso, podem existir de forma livre ou parasitária – nesse caso, são classificados como facultativos .
Uma vez no organismo, eles podem parasitar um hospedeiro:
- Externamente (ectoparasitas, como o piolho).
- Internamente (endoparasitas, como a Leishmania).
- Também podem ficar alojados no tecido hematopoiético (os famosos hemoparasitas, como o Plasmodium).
Os hospedeiros também recebem classificações: definitivos, intermediários, transportes, acidentais.
Uma vez no organismo humano, esses parasitas são capazes de gerar uma série de doenças que podem evoluir para a morte do hospedeiro. Todas as manifestações clínicas causadas por esses patógenos são estudadas na parasitologia clínica. Dentro dessa área, temos uma gama de metodologias que podem ser empregadas visando ao diagnóstico e ao tratamento eficaz do paciente. Dessa forma, é de suma importância conhecer as diferentes técnicas, suas aplicabilidades, vantagens e desvantagens.
Assim, vamos iniciar nossa jornada estudando as principais técnicas empregadas no diagnóstico das parasitoses.
Ativos
Os parasitas ativos são aqueles que têm a capacidade de romper barreiras, como o Schistosoma mansoni, parasita causador da esquistossomose, que penetra geralmente pelos pés de pessoas que andam descalças em regiões contaminadas.
Passivos
Os parasitas passivos são aqueles que invadem o organismo por meio de vetores, como os do gênero Leishmania, causadores da leishmaniose, que é transmitida pela picada dos insetos flebotomíneos infectados. Os parasitas passivos também podem invadir o hospedeiro pela ingestão de alimentos, como a carne de porco contaminada com larvas de tênia e as hortaliças mal lavadas.
Facultativos
Um exemplo de parasita facultativo é o Ascaris lumbricoides.
Definitivos
Quando abrigam parasitas na fase adulta com reprodução sexuada.
Intermediários
Quando os parasitas se alojam no hospedeiro na fase larval ou assexuada.
Transportes
Hospedeiros que não são essenciais ao ciclo de vida do parasita, que não evolui nesse organismo, servindo apenas como uma ponte até o hospedeiro definitivo.
Acidentais
O parasita não infecta aquele organismo, mas por algum motivo causou a parasitose.
MÓDULO 1
Descrever a coleta de amostras para as análises parasitológicas
COLETA DE AMOSTRAS PARA OS EXAMES PARASITOLÓGICOS
Provavelmente, você já realizou um exame parasitológico de fezes , o famoso exame de fezes. O EPF tem como objetivo diagnosticar parasitoses intestinais, por meio da pesquisa de diferentes formas parasitárias eliminadas nas fezes. No entanto, os parasitas não se encontram somente no intestino e podem viver em outros sítios do organismo. Assim, amostras de urina, sangue e escarro, além de biópsia, podem ser empregadas para o diagnóstico.
A escolha da técnica se inicia quando surge a suspeita clínica de parasitose. A partir dos sintomas apresentados, o médico consegue direcionar a melhor técnica, o tipo de amostra a ser coletado e a busca desses organismos durante a execução do exame.

Para o diagnóstico e o tratamento corretos, são necessárias a detecção e a análise morfológica dos parasitas. Estes, por sua vez, podem ser encontrados no organismo de diversas formas e em diferentes estágios de desenvolvimento:
Trofozoíto
Estágio adulto ou forma ativa dos protozoários.
Cisto
Oocistos
Apresentam uma parede resistente.

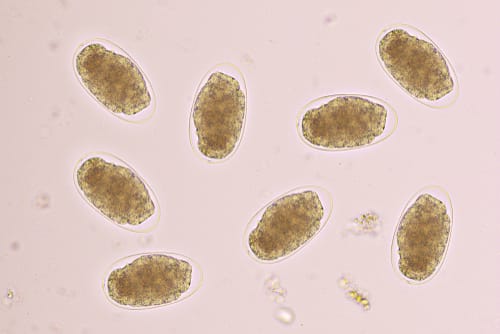
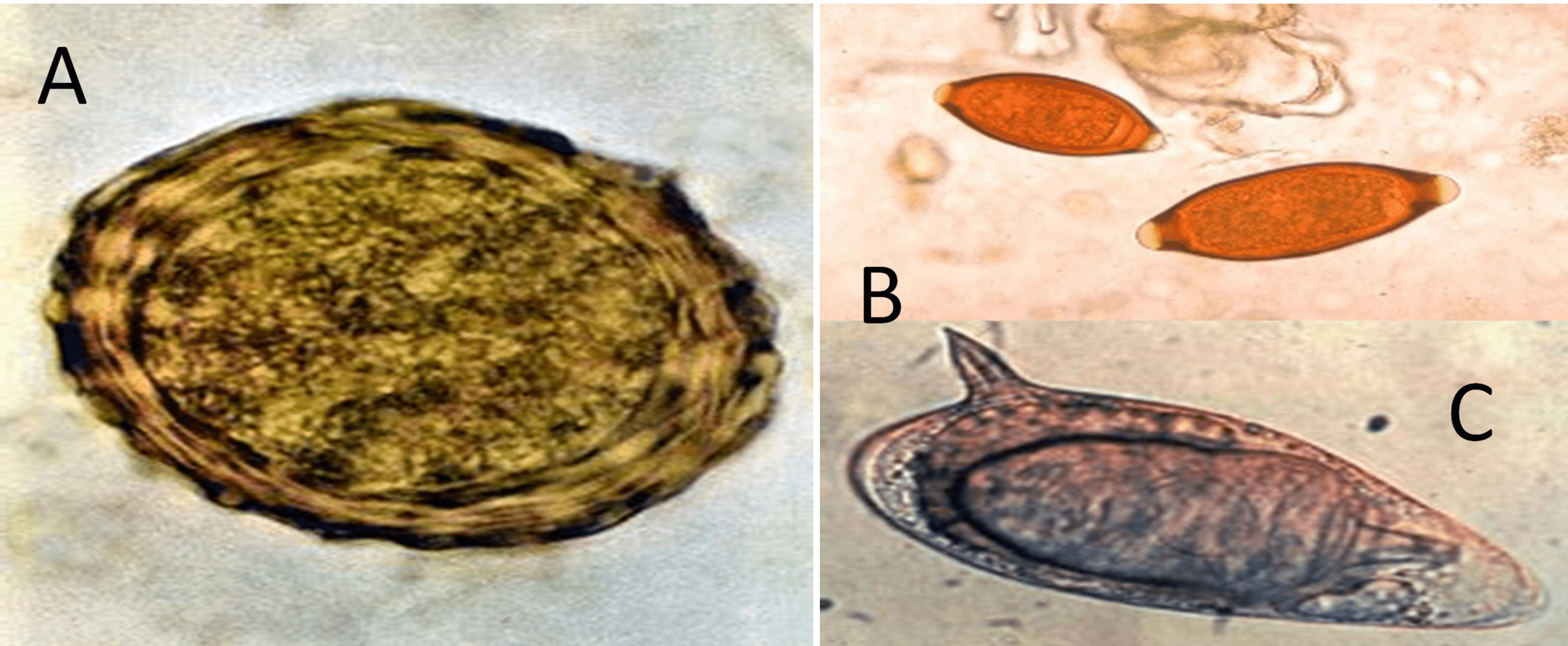
Ovo

Larvas ou proglotes de helmintos
Proglote é uma parte dos segmentos de Taenia que são eliminados nas fezes.
Coleta de fezes
De todas as amostras coletadas para os testes parasitológicos, os exames realizados a partir das fezes são os mais conhecidos e solicitados. A partir dessa amostra, além dos parasitas, podemos identificar outros patógenos e a presença de muco, sangue e pus, assim como gordura em excesso e até mesmo sinais de um processo inflamatório ou de câncer.
As fezes correspondem ao resíduo de alimentos que não foi absorvido pelo organismo após a passagem pelo trato gastrointestinal.
Qualquer alteração durante a digestão e absorção dos alimentos, lesões nas células que compõem o trato digestório ou a presença de patógenos podem ser observadas nas fezes. Assim, esse espécime espelha o TGI e pode ser o responsável por alertar que existe alguma desordem no organismo.
A absorção dos alimentos no TGI afeta diretamente a consistência e a tonalidades das fezes. O aspecto delas é importante no momento de uma avaliação clínica de um paciente e corresponde à primeira avaliação feita no laboratório.
A queixa de um paciente que relata fezes diarreicas durante longo período pode ser indicativo da presença de helmintos intestinais. Somente parasitas que apresentam estágio de evolução na mucosa ou têm contato direto com a mucosa intestinal podem causar diarreias. Nesse cenário, destacam-se Trichuris trichiura, Ancylostoma duodenale, Strongyloides stercoralis e Schistosoma mansoni.
No entanto, é importante ressaltar que, mesmo em fezes que apresentem um aspecto firme, é possível detectar gordura, muco, sangue, ovos e parasitas no estágio mais evoluído.
Como é feita a coleta?
O exame é realizado a partir de fezes coletadas em um único dia.
No exame com fezes de única amostra, a possibilidade de encontrar parasitas diminui, pois os protozoários são encontrados no hospedeiro em diferentes estágios, não sendo liberados todos os dias (os ovos de helmintos apresentam uma liberação irregular, como acontece com o gênero Schistosoma). As chances também diminuem devido às limitações das técnicas parasitológicas. Entretanto, esse tipo de exame é essencial para a análise quantitativa de ovos de helminto e para verificar os elementos macroscópicos (cor, consistência, presença de muco e gordura).
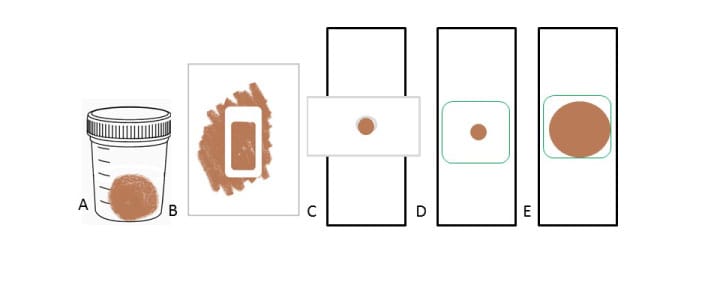
O frasco de coleta para amostras frescas deve ser limpo e seco e ter uma tampa com rosca de plástico e boca larga. Não é necessário frasco estéril, mas, de preferência, deve-se utilizar um recipiente fornecido pelo laboratório ou adquirido em locais que comercializam materiais hospitalares ou farmácias.
O exame é realizado a partir de três ou cinco amostras de fezes coletadas em dias diferentes, consecutivos ou alternados, e mantidas em líquido conservante. Os dias alternados aumentam as chances de se encontrar as formas evolutivas dos parasitas.
O frasco para coleta seriada vem com um líquido conservante composto de mertiolate-iodo-formaldeído (MIF) e deve ser comprado ou solicitado ao laboratório.
Coletas seriadas devem ser preferencialmente realizadas no mesmo horário, e todas as amostras coletadas devem ser colocadas no mesmo frasco.
A coleta pode ser realizada em um penico limpo e seco ou em cima de uma folha de papel limpa, e a amostra deve ser transferida para o tubo coletor para evitar contaminação cruzada e resultados falso-positivos. A quantidade necessária para uma análise é de 20 g a 30 g (o que corresponde a uma pazinha que vem com o frasco, ou, caso não tenha, deve-se usar como referência uma colher de sobremesa), não sendo preciso encher o pote até sua capacidade total.
Quando as fezes estão diarreicas, deve ser coletada a porção mais líquida, e, quando há presença de gordura, sangue ou porções com elementos não identificáveis, essas partes devem ser priorizadas.
Para o exame, não é necessário que o paciente esteja em jejum nem que faça dieta, a menos que seja recomendação médica. Não é recomendada a coleta de fezes em mulheres que estejam no período menstrual nem em pacientes com sangramentos decorrentes de hemorroidas, pois isso pode levar à detecção equivocada de sangue nas fezes. Todos os medicamentos ou as substâncias químicas que tenham sido usados no período de sete a dez dias antes do exame precisam ser relatados ao laboratório.
Atenção
Os pacientes não devem fazer o uso de purgativos ou laxantes para auxiliar na coleta, pois isso inviabiliza a verificação dos parasitas. Além disso, medicamentos como antidiarreicos, antibióticos (tetraciclina), antiácidos e derivados de bismuto (usado em exames radiológicos) tornam a amostra insatisfatória para análise.
As amostras coletadas devem ser encaminhadas ao laboratório nos frascos de coleta envoltos em sacolas plásticas. Sobre o tempo entre coleta e análise:
Devem ser analisadas no mesmo dia, mas, na impossibilidade de realização do exame, devem ser conservadas à temperatura de 2°C a 8°C por, no máximo, 24 horas. Isso preserva a morfologia dos protozoários e evita o desenvolvimento de algumas larvas e de ovos de helmintos.
Devem ser examinadas em até 30 minutos após a coleta.
Devem ser examinadas em até uma hora.
Podem permanecer à temperatura ambiente, mas não é recomendado ultrapassar a temperatura de 30°C.
Uma vez no laboratório, as amostras devem ser identificadas com nome e idade do paciente, número de identificação do laboratório, horário da coleta e horário da chegada ao laboratório. Todas as amostras devem estar acompanhadas do pedido médico.
Atenção
Durante a coleta de fezes com a utilização de conservantes, os pacientes devem ser orientados a não desprezar, substituir ou misturar o líquido com água e, o mais importante, devem ser informados de que o líquido é tóxico e não pode ficar ao alcance de crianças.
Falamos em amostras coletadas em frascos com líquido conservante, mas você sabe por que utilizá-lo?
Os conservantes são indicados para os pacientes que têm dificuldade de evacuação, que não podem levar a amostra ao laboratório no tempo adequado ou que precisam coletar mais de uma amostra, para aumentar a chance de encontrar as formas parasitárias. Esses líquidos garantem a conservação, preservação e fixação dos parasitas e impedem a interferência de outros microrganismos e a evolução da forma parasitária.
Essas substâncias podem ser adicionadas a fezes frescas, ou, então, as amostras podem ser coletadas em frascos que já contêm esse líquido, sempre na proporção três partes de conservante para uma parte de fezes. No momento da adição, devemos sempre homogeneizar bem, para permitir a ação de preservação em toda a amostra coletada. Entre os conservantes, destacam-se os que serão descritos a seguir.
O MIF é amplamente difundido e permite a conservação de ovos e larvas de helmintos, cistos e trofozoítos de protozoários. Antigamente, o MIF era composto de mercúrio e iodo, responsáveis pela coloração, e por formaldeído, utilizado na conservação. Pela grande toxicidade do mercúrio, este foi trocado pela formulação mertiolate ou mercurocromo, iodo e formol. Pode ser utilizado nos exames diretos, pois, além de preservar, pode corar os organismos. No entanto, dependendo do tempo de contato, pode alterar a morfologia desses organismos.
O formaldeído a 10% tem a mesma finalidade de preservar (cistos e oocistos de protozoários e ovos e larvas de helmintos). Mantém a morfologia dos organismos por longo período e é uma opção para substituir o MIF.
O acetato de sódio-ácido-acético-formaldeído (SAF), o álcool polivinílico (PVA) e o líquido de Schaudinn são utilizados para conservação permanente de trofozoítos.
O fixador fenol-álcool-formaldeído (PAF) é usado para a preservação de trofozoítos, cistos de protozoários e ovos e larvas de helmintos.
Atenção
Esses conservantes não são utilizados quando se deseja visualizar o parasita vivo, como acontece no exame de direto de Baermann-Moraes, nem nos exames quantitativos (Kato-Katz), pois diluem a amostra.
Coletas de outros materiais
Como vimos, além das amostras de fezes, outras podem ser utilizadas no diagnóstico de parasitoses. Destacam-se as amostras de sangue, escarro e urina e a biopsia de tecidos. Agora, vamos conhecer as peculiaridades da coleta de cada uma dessas amostras.
Sangue
Os exames parasitológicos de sangue são muito solicitados. Possibilitam identificar parasitas dentro e fora das células e podem ser utilizados na avaliação da parasitemia do paciente, medida dada pela relação entre o número de leucócitos e o número de parasitas.
Esses exames permitem investigar a presença de protozoários que têm tropismo e que apresentam seu ciclo de vida nas células sanguíneas. São eles: Plasmodium sp, Tripanosoma cruzi, Leishmania sp e microfilárias. Para isso, as amostras de sangue são obtidas a partir da punção venosa ou da polpa digital. Quando a coleta for por punção venosa, o sangue é coletado em tubo com anticoagulante EDTA. Esse tubo pode ser consercado por até 72 horas na temperatura de 2°C a 8°C.
Saiba mais
Pode ser realizado a coleta de sangue para análise de anticorpos presentes nos pacientes pelos métodos imunológicos. Para isso, é preconizado a coleta de sangue no tubo seco ou com gel.
Escarro
As amostras de escarro auxiliam no diagnóstico de larvas de Ascaris lumbricoides, Strongyloides stercoralis, ancilostomídeos, ovos de Paragonimus westermani, escólex de Echinococcus granulosus, trofozoítos de Entamoeba histolytica, Entamoeba gingivalis e Trichomonas tenax e oocistos de Cryptosporidium parvum.
É preconizada a coleta no horário de maior secreção; o paciente não precisa estar em jejum e a amostra é coletada após a higienização bucal com frasco fornecido pelo laboratório e uma expectoração profunda. É importante orientar bem o paciente no momento da coleta para que as amostras sejam representativas e para evitar a presença de saliva, que atrapalha o diagnóstico.
Saiba mais
A análise macroscópica do escarro de um paciente com parasitose revela um aspecto viscoso, com presença de sangue e manchas marrons, coloração obtida pela presença de ovos, larvas e oocistos dos parasitas.
Urina
As amostras de urina são coletadas em frascos estéreis, após assepsia. Não é necessário que seja a primeira urina da manhã, mas é recomendado que o paciente fique pelo menos duas horas sem urinar e colete o primeiro jato com volume mínimo de 10 mL. Não é recomendado o uso de duchas na região genital antes do exame; mulheres no período menstrual não devem realizar o exame; e não é permitido o uso de cremes e sabonetes íntimos nas últimas 48 horas antes da coleta. Esse exame é indicado para diagnóstico de Trichomonas vaginalis, de Schistosoma haematobium e de certas filárias.
Tecidos
As amostras de tecidos podem ser obtidas por meio de biópsia e da raspagem ou aspiração de lesões cutâneas. A partir desse material, são preparadas lâminas para exames diretos, pelos métodos de imprint (oposição) e preparação prensada, ou os tecidos são fixados em formol para análise histopatológica, por exemplo. Além disso, amostras de tecidos sem conservação podem ser trituradas e inoculadas em meios de cultura apropriados ou incubadas em animais de laboratório, ou encaminhados para testes moleculares, como a reação da cadeia da polimerase (PCR).
Saiba mais
As amostras de escarro e material para biópsia geralmente são solicitadas quando os exames de rotina não apresentam uma conclusão diagnóstica, sendo necessário pedir exames mais específicos, ou então quando o parasita já está alojado nos órgãos.
Biossegurança no laboratório parasitológico
A biossegurança é um conjunto de normas e medidas que tem a função de minimizar, reduzir e controlar os riscos à saúde dos profissionais das diversas áreas da ciência e da saúde, do meio ambiente e da comunidade. Os riscos são minimizados com o uso correto dos Equipamentos de Proteção Individual (EPIs), que são indispensáveis em um laboratório, assim como os Equipamentos de Proteção Coletiva (EPCs).
Os laboratórios, em geral, são divididos segundo níveis de biossegurança (NB), de acordo com o nível individual de proteção dos profissionais, do ambiente e da comunidade. O nível 1 corresponde aos laboratórios que necessitam de uma contenção mais simples. Já o nível 4 corresponde àqueles que precisam de maior contenção, tendo, além dos requisitos físicos e operacionais dos níveis 1, 2 e 3, barreiras de contenções e procedimentos especiais de segurança.

Além dos níveis de biossegurança, temos, ainda, a divisão por classes de risco, que é realizada de acordo com o tipo de microrganismo manipulado e o risco que esse microrganismo apresenta para o profissional e a comunidade.
Assim como os níveis de biossegurança, a classe de risco representa uma categorização de 1 a 4, em que a classe 1 engloba microrganismos que apresentam baixo risco individual e para a comunidade e a classe 4 corresponde aos patógenos que apresentam alto risco individual e para a comunidade, com mecanismos de transmissão desconhecidos que causam doenças em pessoas e animais, oferecem risco de morte e não apresentam profilaxia ou terapias conhecidas.
O laboratório de parasitologia clínica é classificado como NB2 e se enquadra na classe de risco 2, pois os parasitas encontrados nas amostras de fezes apresentam um risco de disseminação limitado para o indivíduo e a comunidade e profilaxia e terapias conhecidas. Além disso, as amostras podem ser manipuladas em bancadas, não sendo necessária uma cabine de segurança, uma vez que a produção de aerossol é baixa. No entanto, a manipulação deve ser feita usando-se adequadamente todos os EPIs e seguindo-se as normas de boas práticas do laboratório.
É importante ressaltar que os riscos para a saúde e o bem-estar do profissional em um laboratório não se devem apenas à presença de microrganismos, mas também à utilização de substâncias químicas que podem causar queimaduras, lesões e intoxicação. Todos os corantes e fixadores usados nas técnicas parasitológicas apresentam altos riscos para a saúde se forem ingeridos ou inalados.
Exemplo
Uma gota de lugol (corante utilizado para facilitar a visualização de ovos, cistos e larvas) equivale a mais de 60 vezes a dose diária de iodo que se deve ingerir.
Limpeza do material de trabalho
Boa parte dos materiais usados nas técnicas de parasitologia é de vidro e reutilizável. Dessa forma, esses materiais precisam ser lavados e descontaminados com auxílio de substâncias químicas que ajudam a reduzir os microrganismos a níveis considerados aceitáveis, diminuindo os riscos para os técnicos e evitando a contaminação cruzada entre os exames.
Os métodos aplicados podem variar de acordo com o laboratório e o trabalho desempenhado.
Normalmente, a limpeza (remoção da sujidade) é feita em etapas. São elas:
Utiliza métodos físicos ou químicos para a eliminação de microrganismos em equipamentos, com ação de desinfetantes como álcool, cloro, formaldeído, glutaraldeído, iodóforos, fenóis sintéticos e amônio, em diferentes composições e porcentagens.
Destrói todas as formas de vida microbiana, processo que ocorre durante a autoclavação do material.
O Ministério da Saúde recomendada que toda a vidraria seja mantida em hipoclorito de sódio a 2% antes da limpeza e esterilização. As bancadas também devem ser limpas com essa solução.
Gerenciamento de resíduos
Atualmente, no Brasil, a RDC n° 222, de 28 de março de 2018, regulamenta as Boas Práticas de Gerenciamento de Resíduos dos Serviços de Saúde. Segundo essa legislação, todo lixo gerado em um serviço de saúde é considerado um resíduo e precisa ser gerenciado seguindo-se um plano de gerenciamento de descarte de resíduos da instituição, que deve estar de acordo com as regulamentações municipais, estaduais, federais ou do Distrito Federal.
Segundo essa legislação, os resíduos dos laboratórios de análises clínicas são resíduos da Classe A, pois:
Possivelmente têm a presença de agentes biológicos, que, por suas características, podem apresentar risco de infecção.
(RDC n° 222)
Estão no subgrupo A1, pois:
São sobras de amostras de laboratório contendo sangue ou líquidos corpóreos, recipientes e materiais resultantes do processo de assistência à saúde, contendo sangue ou líquidos corpóreos na forma livre.
(RDC n° 222)
Esses “resíduos devem ser identificados, no mínimo, pelo símbolo de risco biológico, com rótulo de fundo branco, desenho e contornos pretos, acrescido da expressão resíduo infectante”.
Assim, os resíduos biológicos sem conservantes devem ser colocados em sacos brancos com símbolo de material infectante e encaminhados para a autoclavagem. Após o resfriamento, os sacos devem ser etiquetados e armazenados em recipiente rígido até a coleta pela instituição competente.
Resíduos que apresentam amostras com agentes químicos precisam ser armazenados separadamente em vidros, de acordo com a substância encontrada.
Neste vídeo, a Professora Mariana Ribeiro explica a técnica conhecida como Método de Graham e sua importância na rotina de um laboratório de parasitologia clínica.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Módulo 2
Reconhecer os métodos diretos empregados nos exames parasitológicos de fezes
INTRODUÇÃO
Os métodos utilizados no laboratório de parasitologia são inúmeros e são divididos em:

Métodos diretos
São aqueles realizados em amostras de fezes (preservadas com conservantes ou não) ou de sangue e que procuram ovos, larvas, cistos e oocistos.
Métodos indiretos
Verificam a resposta imunológica do hospedeiro por meio de reações de reconhecimento antígeno-anticorpo e são empregados nos casos de dificuldade de diagnóstico. Podem ser empregados para detectar anticorpos no soro ou a presença de parasitas (antígenos), nos métodos histopatológicos.
Os métodos direto e indireto auxiliam na confirmação do diagnóstico, pois, muitas vezes, apenas pelo exame clínico do paciente, o médico não consegue chegar a um diagnóstico definitivo.
Em um primeiro momento, vamos estudar os diferentes métodos diretos empregados para os exames de fezes. Os métodos diretos em amostras de sangue e os indiretos serão estudados no próximo módulo.
MÉTODOS DIRETOS UTILIZADOS NO LABORATÓRIO DE PARASITOLOGIA
Como mencionamos, os métodos diretos indicam a presença ou ausência de determinado parasita (análise qualitativa) ou, então, conseguem quantificar esses parasitas (análise quantitativa). Esses métodos podem ser realizados a partir de exames macroscópicos e microscópicos. Além disso, as fezes também podem passar por algum procedimento de enriquecimento para auxiliar na concentração, no isolamento e na visualização dos parasitas.
Exame macroscópico
O exame é feito a partir da análise visual das fezes, observando-se, primeiro, a superfície a fim de verificar a presença de proglotes de tênia, ancilostomídeos ou oxiúros adultos. Com o auxílio de um palito, examinamos o bolo fecal para verificar a presença de outros helmintos. Além disso, verificamos cor, odor, presença de sangue, muco, gordura, ovos e cistos e a consistência das fezes.
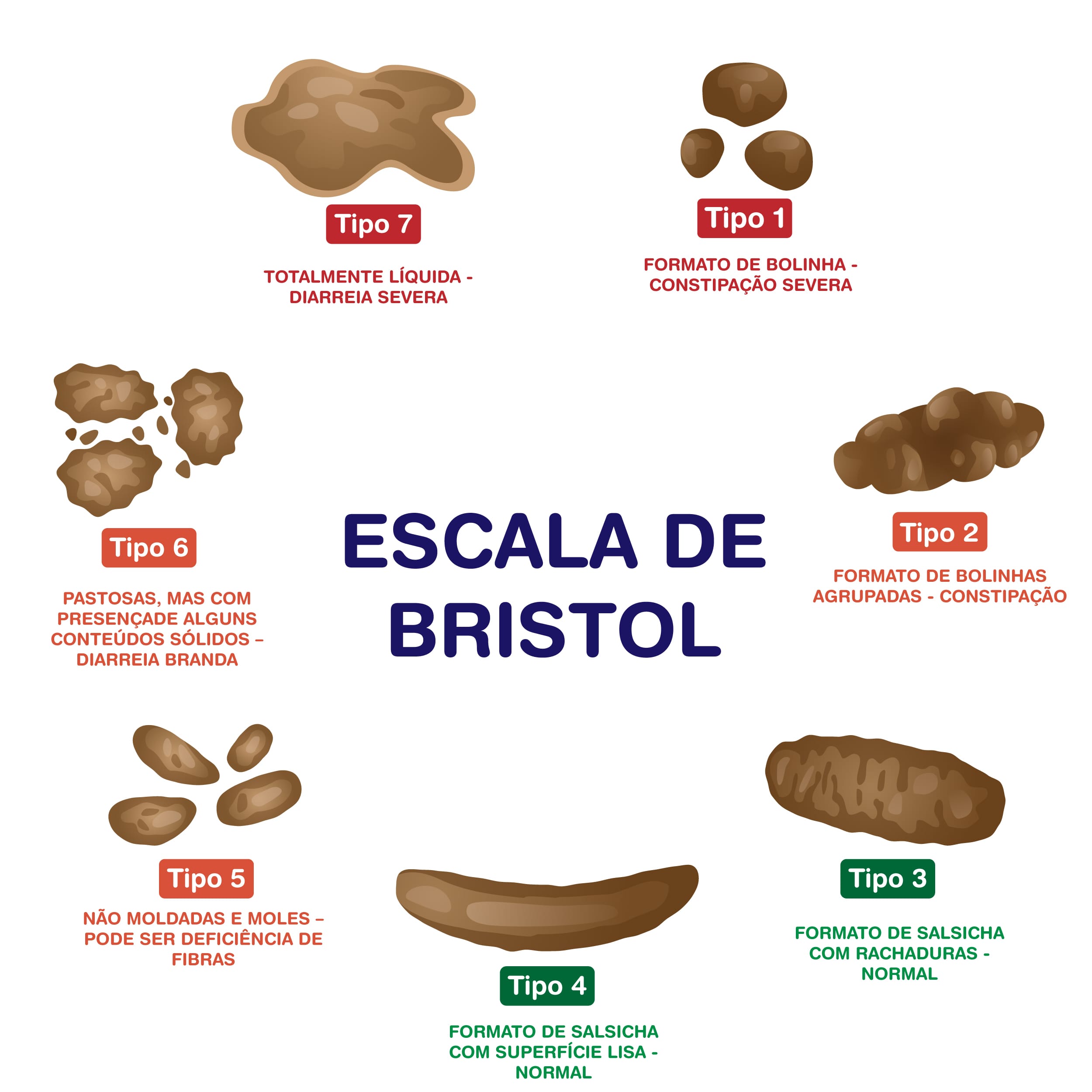
A consistência é avaliada de acordo com a escala de Bristol, que categoriza a consistência das fezes em uma escala de 1 a 7. Vamos conhecê-la?
Número 1
As fezes são duras e com formato de bolinhas, conhecidas como “fezes de cabrito”, e podem ser indicativo de constipação crônica.
Número 2
As fezes são duras em formatos de bolinhas unidas, que também indicam constipação.
Número 3
As fezes são duras no formato de salsicha e apresentam rachaduras na sua superfície; são consideradas fezes normais.
Número 4
As fezes têm formato de salsicha, mas apresentam a superfície lisa, considerada normal.
Número 5
As fezes são não moldadas e moles, o que pode ser indicativo de deficiência de fibras.
Número 6
As fezes são pastosas, sem apresentar conteúdos sólidos, o que é considerado uma diarreia branda.
Número 7
As fezes são líquidas, o que indica uma diarreia severa.
A consistência pode indicar o tipo de protozoário presente: nas fezes mais líquidas, os trofozoítos são geralmente encontrados; cistos de protozoários são achados com mais frequência em fezes formadas; ovos e larvas de helmintos podem ser encontrados em fezes líquidas e formadas.
Atenção
Como vimos anteriormente, alguns helmintos intestinais, como o Trichuris trichiura, Ancylostoma duodenale, Strongyloides stercoralis e Schistosoma mansoni, influenciam diretamente na consistência das fezes, normalmente causando fezes diarreicas.
Fezes com coloração vermelha intensa são indicativos de hemorragia no TGI; fezes sanguinolentas com a presença de muco podem indicar ulcerações no epitélio intestinal. A visualização de gotículas de gordura pode indicar desordens na absorção dos alimentos, o que deve ser investigado com exames mais específicos!
Saiba mais
A presença de gordura em excesso nas fezes (esteatorreia) é indicativo de má absorção e pode ser causada por doenças no intestino delgado, trato biliar ou hepático e pela insuficiência pancreática. Macroscopicamente, as fezes tendem a ser espumosas, ter odor fétido e flutuar na água do vaso sanitário. Existe uma gama de exames que avaliam a presença de gordura fecal de forma qualitativa e quantitativa. Para conhecer mais sobre esse assunto, visite o artigo do Professor Charles M. Mansbach, indicado no Explore +.
É importante ressaltar que essa avaliação macroscópica deve ser feita a partir de fezes frescas. Assim, quando o médico solicitar a coleta de MIF e a análise macroscópica das fezes, o paciente deve fazer duas coletas diferentes (MIF e EPF).
Exames microscópicos
Após a análise macroscópica, as fezes frescas são submetidas a uma
Exame direto a fresco
Amplamente utilizado nas rotinas de laboratório, é um método eficiente, simples e recomendado para a visualização de ovos, cistos e parasitas vivos. Além disso, é o método de escolha para a visualização de trofozoítos de protozoários em fezes diarreicas recém-emitidas.
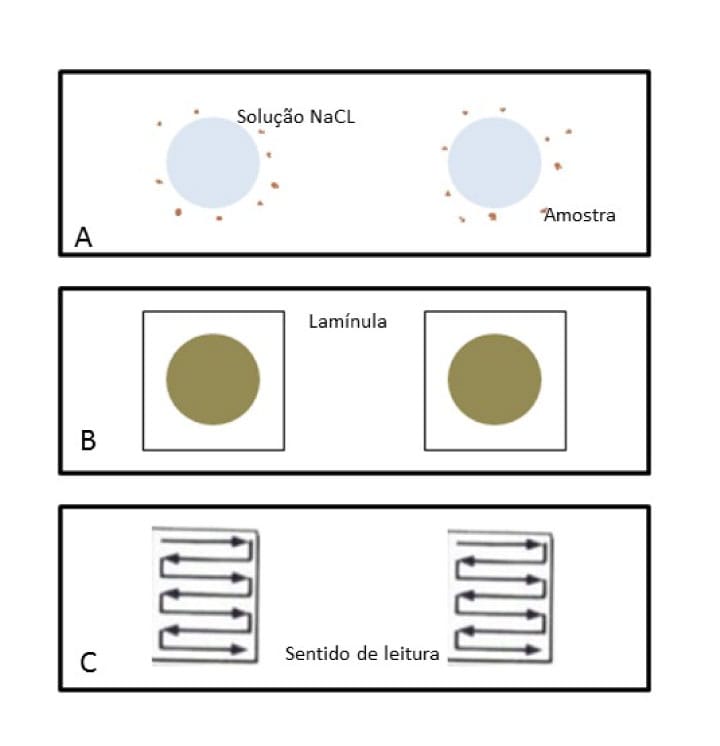
O método é realizado com uma quantidade pequena de amostras (no mínimo, 2 mg), que são transferidas para a lâmina com o auxílio de um palito. Em seguida, duas gotas de solução NaCl (concentração de 0,85% a 0,9%) são adicionadas sobre a amostra fecal, homogeneizadas e espalhadas para formar um esfregaço. Sobre o esfregaço, colocamos uma lamínula e, assim, já podemos observar no microscópio.
No microscópio, nossa análise começa com a objetiva de 10X varrendo todos os campos da lâmina. A objetiva de 40X só deve ser utilizada para confirmação e avaliação da morfologia dos parasitas.
Atenção
Um bom esfregaço é aquele que apresenta uma transparência e não impede a passagem de luz.
Devemos sempre coletar diferentes porções de fezes e escolher a região que apresente muco ou sangue para análise. No exame, nunca devemos utilizar água destilada ou corrente, pois os trofozoítos são distorcidos e podem ser deformados e rompidos. Quando o exame é realizado com fezes frescas preservadas ou coletadas com o MIF, deve ser feito sem a adição de solução de NaCl, pois a amostra já está diluída.
Dica
O uso da lamínula é opcional!.
Essa técnica é simples e apresenta baixa sensibilidade, pois é utilizada uma pequena quantidade de amostra fecal, o que dificulta a identificação dos parasitas. Além disso, é difícil a diferenciação do núcleo dos trofozoítos, das amebas e dos cistos, o que atrapalha a análise morfológica e a conclusão do diagnóstico.
Colorações
As colorações são usadas para complementar o método direto a fresco, permitindo a visualização dos diferentes estágios parasitários e conferindo uma análise morfológica mais detalhada e a identificação correta do parasita. Os corantes utilizados conferem colorações temporárias, como o lugol, ou permanentes, como a hematoxilina férrica, que cora os núcleos de parasitas e permite evidenciar estruturas nucleares muito delicadas.
Os principais corantes, com informações adaptadas de Neves, Melo e Vitor (2016), estão resumidos a seguir:
Indicado para larvas de helmintos, trofozoítos e cistos de parasitas.
É utilizado na parasitologia após o método direto a fresco ou após os métodos de concentrações (acrescentando-se duas gotas do corante). A coloração permite observar os cistos com uma cor castanho-avermelhada, e o citoplasma tem cor amarela, tornando a visualização bem distinta. A concentração do corante é fundamental; a alta concentração dificulta a visualização, pois torna a amostra marrom-escura; na baixa concentração, o corante não é absorvido, e os cistos apresentam uma coloração parecida com a dos detritos.
Indicado para trofozoítos e cistos de amebas e Giardia lamblia.
Pesquisa de trofozoítos em fezes diarreicas. Pouco utilizado por ser trabalhoso, dispendioso e demorado, embora permita visualizar detalhes da morfologia, facilitando a identificação. Na coloração com hematoxilina férrica, os organismos apresentam o citoplasma de cor azulada ou acinzentada e as estruturas do núcleo na cor preta, bem como os corpos cromatoides dos cistos de amebas e as inclusões citoplasmáticas, como bactérias e hemácias.
Indicado para oocistos de coccídeos: Cryptosporidium parvum, Cyclospora cayetanensis e Isospora belli.
Sempre que houver suspeita de um desses parasitas, é necessário executar uma dessas colorações, após a concentração das fezes pelos métodos indicados. Os coccídios intestinais são evidenciados pelas propriedades álcool-ácido resistência dos oocistos.
Indicado para oocistos de coccídios: Cryptosporidium parvum, Cyclospora cayetanensis e Isospora belli.
Mais dispendioso e menos específico que os anteriores; necessita de microscópio de imunofluorescência para o exame da lâmina. Essa coloração consiste na capacidade dos oocistos de serem álcool-ácido resistentes. Os oocistos de Cryptosporidium spp. e de Cyclospora cayetanensis apresentam-se como estruturas arredondadas, emitindo fluorescência amarelo-esverdeada. Os oocistos de Isospora belli são estruturas maiores e elípticas e emitem também fluorescência amarelo-esverdeada.
Atenção
Como nas fezes conservadas não é feita a análise macroscópica, as amostras são submetidas diretamente à análise microscópica. Quando utilizamos o MIF, o mertiolate e o iodo coram as estruturas, mas os trofozoítos da ameba e Giardia sp. não coram com esse conservante.
Técnicas de concentração
Como os testes diretos a fresco apresentam baixa sensibilidade, foram desenvolvidas técnicas de concentração para auxiliar na recuperação e identificação dos parasitas. Vamos conhecê-las?
Técnicas de flutuação
As técnicas de flutuação consistem na recuperação de ovos, cistos e oocistos dos parasitas pela diferença de densidade entre os parasitas e o líquido em que estão contidos. É importante lembrar que o corpo flutua quando tem menor densidade em relação ao líquido e afunda quando apresenta maior densidade.
Existem diferentes técnicas de flutuação que utilizam soluções diferentes, como cloreto de sódio, cloreto de sacarose (Sheather), sulfato de zinco e sulfato de magnésio, com densidades que variam de 1,18 a 1,26 g/mL. Além disso, as técnicas podem ser de:
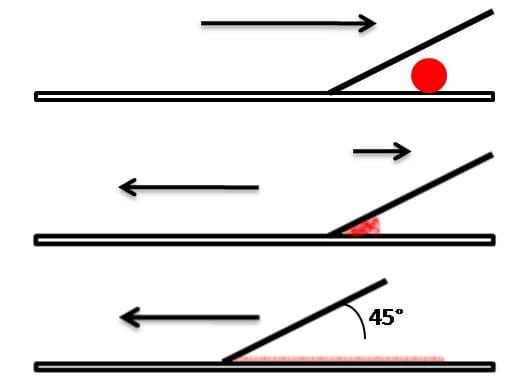
A técnica de flutuação espontânea mais usada para diagnóstico de helmintos é conhecida como Técnica de Willis, em que é utilizada solução de NaCl saturada com alta densidade. Nessa técnica, os ovos menos densos tendem a flutuar até a superfície da solução e têm a capacidade de grudar sobre uma superfície sólida, como uma lâmina de vidro, após o contato, característica conhecida como tigmotropismo.
A técnica é aplicada a partir de 1 a 2 g de fezes, que são obtidos com auxílio de um palito e transferidos para um tubo de ensaio. No tubo, é acrescentada a solução de cloreto de sódio até ¼ da sua capacidade. Essa solução é homogeneizada e, depois, mais solução é adicionada completando o volume do tubo até a borda. Para finalizar, uma lamínula é colocada em contato com o menisco positivo do tubo por, aproximadamente, 15 minutos. Após esse tempo, a lamínula é retirada, e colocada molhada sobre uma lâmina e é verificada no microscópio.
Essa técnica é amplamente empregada para a pesquisa de ovos leves de helmintos, principalmente de ancilostomídeos mas também pode ser observado cistos e oocistos de protozoários. NO entanto, não é recomendada para diagnóstico de protozoários, pois os cistos se retraem em contato com o NaCl, o que dificulta o seu reconhecimento.
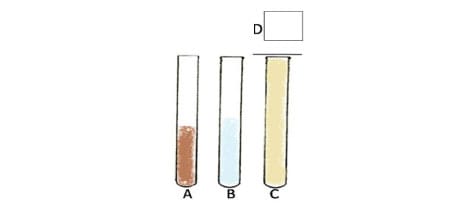
A técnica conhecida como Método de Faust (Centrífugo-flutuação em Solução de Sulfato de Zinco) consiste na centrifugação seguida da flutuação em sulfato de zinco. Esse método permite a detecção de cistos e oocistos de protozoários, de ovos e larvas de helmintos, em uma solução de sulfato de zinco a 33% com densidade de 1,180 g/mL. Os ovos pesados de trematódeos, de cestoides e ovos inférteis de Ascaris lumbricoides não são concentrados por esse método.
A técnica é realizada com homogeneização de 2 g de fezes em um Becker contendo 10 mL de água. Em seguida, essa suspensão é filtrada em gazes, dobradas quatro vezes, e o filtrado é recolhido em um tubo Wassermann , ou tubo similar, e centrifugado por dois minutos a 2500 rpm. Após a centrifugação, o sedimento é ressuspendido em 10 mL de água. Esse processo é repetido três ou quatro vezes até a água ficar límpida.
Na última centrifugação, o material é ressuspendido com sulfato de zinco (aproximadamente 3 mL ou até a boca do recipiente) e levado novamente à centrífuga. Após centrifugação, o tubo deve ser cuidadosamente colocado em uma estante, e devemos aguardar a formação de uma película na superfície (onde estão os parasitas), que será coletada com auxílio de uma alça de platina e depositada em uma lâmina.
A recuperação também pode ser feita com o contato do líquido direto com a lâmina. Nesse caso, o sulfato de zinco deve ter sido colocado até a boca do tubo na última etapa do método. Na lâmina, acrescenta-se a solução de lugol. Depois, é colocada a lamínula (opcional), e o material é analisado no microscópio. É recomendada a leitura rápida, pois o sulfato de zinco pode deformar algumas estruturas.
Tubo Wassermann
Tubo que mede 13 mm de diâmetro por 10 cm de comprimento.
Técnicas de sedimentação
As técnicas de sedimentação são muito simples, baratas e amplamente utilizadas em laboratórios. Podem ser realizadas de forma espontânea ou após a centrifugação. Vamos conhecê-las?
A técnica de sedimentação espontânea de Hoffmann, Pons e Janer ou de Lutz é baseada na sedimentação pela ação da gravidade e é eficaz para a detecção de ovos e larvas de helmintos e cistos de protozoários. Além disso, é valiosa para a detecção de ovos pesados, especialmente os de Schistosoma mansoni. Pode ser realizada a partir de amostras frescas ou conservadas. No entanto, é necessária grande quantidade de amostras.
Para a realização da técnica, 2 g de fezes são colocados em um Becker de vidro com cerca de 5 mL de água e homogeneizados bem com o auxílio de um palito ou bastão de vidro. Com uma gaze dobrada em duas partes, filtramos a solução, recolhendo o filtrado em um copo cônico (cálice). Os detritos retidos na gaze são lavados com 20 mL de água. Completamos o volume do cálice com água e o deixamos em repouso de 1 a 24 horas.
Após o repouso, o sobrenadante é desprezado cuidadosamente, e a porção obtida é transferida para uma lâmina. Em seguida, adiciona-se o lugol, coloca-se a lamínula (opcional) e verifica-se a amostra no microscópio.
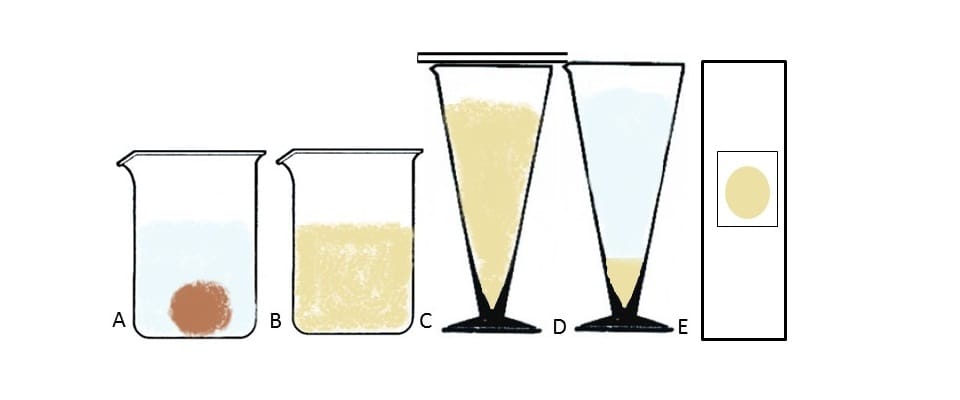
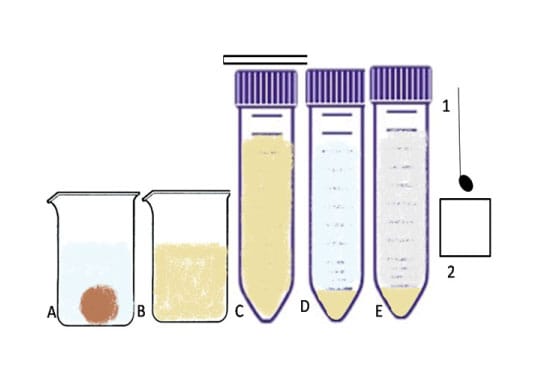
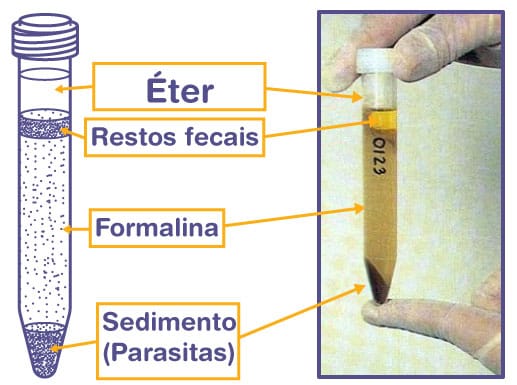
A técnica pode ser feita com fezes frescas ou com material conservado e apresenta os melhores resultados para a procura de oocistos, mas também podem ser encontrados ovos e larvas de helmintos. Essa técnica consiste na concentração dos parasitas a partir da utilização de éter, formol e centrifugação. A principal desvantagem é a toxicidade dos reagentes utilizados.
Para isso, 5 g de fezes são dissolvidos em 2 mL de água dentro de um Becker. Então, a solução é filtrada em uma gaze dobrada em duas partes, e o filtrado é recolhido em um tubo cônico, que é centrifugado por dois minutos a 2500 rpm. Após a centrifugação, o sobrenadante é descartado, e o sedimento é ressuspendido em 10 mL de água.
O processo é repetido até que o sobrenadante esteja límpido. Na última centrifugação, o sedimento é ressuspendido com 2 mL de solução formalina a 10% e deixado em repouso de dois a dez minutos. Então, são adicionados 2 mL de éter. Nesse momento, devemos agitar o Becker vigorosamente. Em seguida, o tubo é centrifugado por três minutos a 1.500 rpm.
Ao fim da centrifugação, são formadas quatro camadas (1ª: sedimento do fundo com parasitas; 2ª: formalina; 3ª: tampão com restos fecais; 4ª: éter). As três camadas superiores devem ser cuidadosamente descartadas, restando somente o sedimento no fundo. Ao fim, com o sedimento, é montada a lâmina para leitura no microscópio utilizando-se o lugol.
Método de sedimentação por centrifugação que utiliza material preservado com o conservante MIF, sem que ocorram alterações morfológicas nas formas parasitárias encontradas. Usado para detecção de trofozoítos, cistos de protozoários e ovos e larvas de helmintos. Nessa técnica, as fezes conservadas são homogeneizadas e filtradas com auxílio de gazes dobradas em duas partes.
A solução é transferida para um tubo de centrífuga. São acrescentados de 4 a 5 mL de éter sulfúrico, e a solução é novamente centrifugada por um minuto a 1.500 rpm. Caso surja gordura na parede do tubo, deve-se retirá-la com ajuda de um bastão. Depois, o sobrenadante é descartado, e são acrescentadas no tubo gotas de salina e lugol. Em seguida, é feita a montagem das lâminas para leitura microscópica.
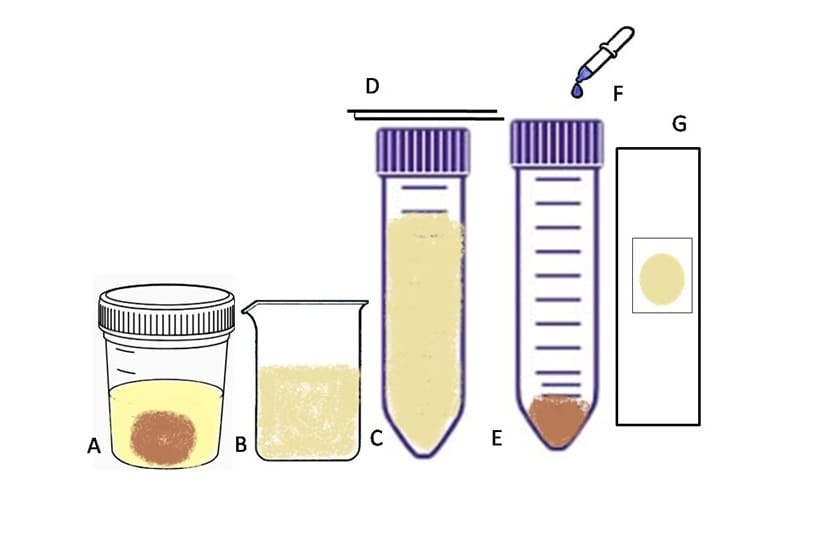
Métodos quantitativos
Todas as técnicas vistas até aqui são qualitativas: verificam apenas a presença ou ausência do parasita. Existem também as técnicas que fazem a contagem dos parasitas, permitindo inferir sobre a carga parasitária, conforme veremos a seguir.
Técnica de Stoll-Hausheer
Técnica aplicada a pacientes com histórico de fezes diarreicas por mais de três dias. É utilizada para o diagnóstico quantitativo, principalmente de infecções por ancilostomídeo. É um método simples, porém demorado.
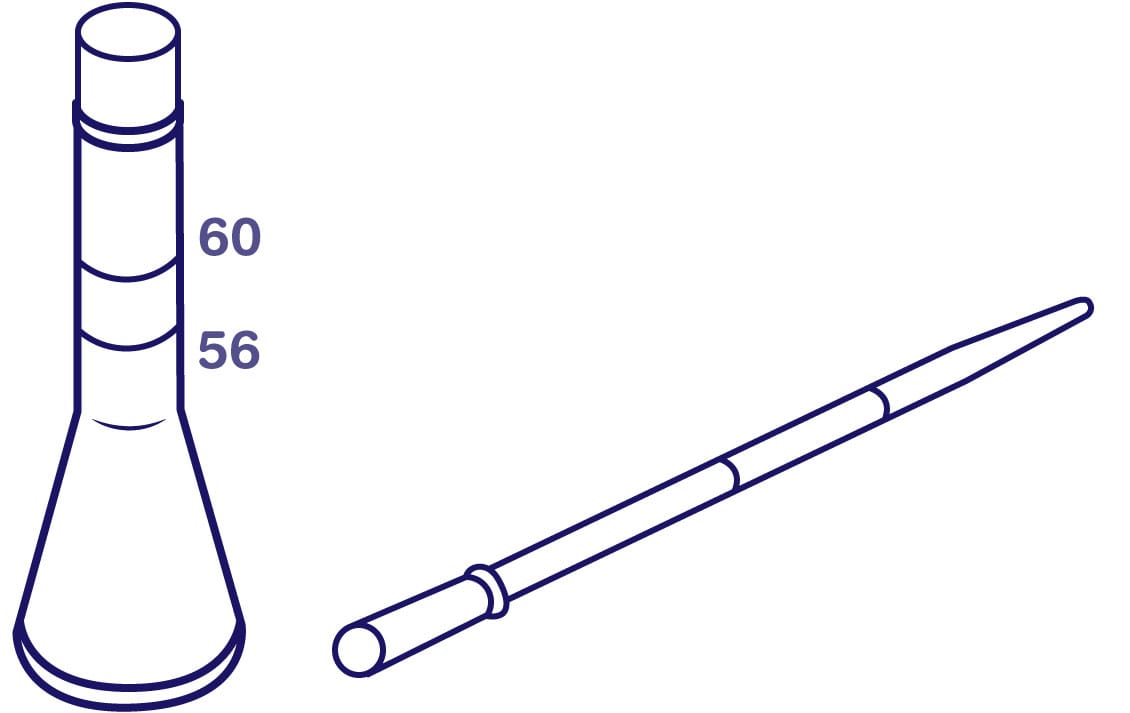
A técnica é realizada em um frasco de Stoll, no qual são acrescentados 56 mL de solução de hidróxido de sódio (NaOH) e uma quantidade de fezes até que o volume alcance 60 mL. Em seguida, são inseridas de 10 a 20 esferas de vidro de 3 a 4 mm de diâmetro. Então, o vidro é fechado com uma rolha de borracha. O conjunto é agitado até ocorrer a total homogeneização e deixado em repouso por 12 horas.
Após a incubação, uma amostra é coletada (volume de 0,75 mL ou 0,15 mL) do centro da suspensão e é colocada no meio da lâmina, que é coberta com a lamínula. No microscópio, é contado o número de ovos, e a quantidade encontrada é multiplicada por 100 (se a amostra coletada for de 0,15 mL) ou por 200 (se a amostra coletada for de 0,075 mL). O resultado é dado em ovos/mL ou ovos/g (OPG).
Técnica de Kato-Katz
Técnica qualitativa-quantitativa que permite a identificação e a contagem de ovos de helmintos, como:
Ascaris lumbricoides
Schistosoma mansoni
Ancilostomídeos
Trichuris trichuria
Também permite determinar a carga parasitária. No entanto, é indicada especialmente para o estudo de Schistosoma mansoni, pois representa o padrão-ouro para o diagnóstico da esquistossomose, segundo a Organização Mundial da Saúde. Além disso, é amplamente utilizada em inquéritos epidemiológicos. A vantagem dessa técnica é a sensibilidade na identificação e contagem dos ovos; a desvantagem é o tempo necessário para realização.
Na maioria das vezes, a técnica é feita com kits comercializados. Antes de iniciar a técnica, devemos cortar papéis celofane semipermeáveis (isso mesmo: aquele que você conhece!) e mergulhá-los em uma solução de verde malaquita a 3%. Essa solução conserva e clarifica os ovos durante 24 horas. Uma pequena quantidade de amostras de fezes frescas (essa técnica não é realizada com amostras conservadas nem diarreicas) é espalhada em um papel absorvente e, em seguida, coberta com uma tela metálica.
As fezes que passam pela tela são recolhidas e transferidas, com auxílio de um palito, para o orifício (6 mm) de um cartão plástico que se encontra sobre uma lâmina de vidro. Quando o orifício está cheio de amostras (42 mg), é retirado cuidadosamente. As fezes da lâmina são cobertas com o papel celofane, e a lâmina é invertida para comprimir. Após uma hora da clarificação, essas lâminas já podem ser verificadas.
Tela metálica
Tela marca IBRAS N°2 120 (fios, urdume e trama 0,09 mm) ou similar de náilon. Por essa malha, passam ovos de helmintos e detritos.
No microscópio, o número de ovos é contado, e o resultado encontrado é multiplicado por 24. Esse resultado corresponde ao número de ovos por grama de fezes.
Quando a técnica for usada apenas para a análise qualitativa, as fezes que passarem na tela metálica devem ser transferidas para uma lâmina, agora sem o cartão, e cobertas com papel celofane embebido no verde malaquita. Então, deve-se esperar de uma a duas horas e, em seguida, verificar no microscópio a presença de ovos.
Saiba mais
A preparação obtida não permite a visualização de cistos ou oocistos de protozoários, apesar de estes passarem através da tela.
Um único método parasitológico não é capaz de diagnosticar todas as formas parasitárias. Dessa forma, faz-se necessária a utilização de mais de um método na rotina do laboratório.
Neste vídeo, a Professora Mariana Ribeiro apresenta o método de Bermann-Moraes e rugai como técnica parasitológica.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Identificar as técnicas parasitológicas do sangue e os métodos indiretos
TÉCNICAS PARASITOLÓGICAS SANGUÍNEAS
Os parasitas podem ser encontrados no sangue periférico em diferentes formas evolutivas. São elas:
Trofozoítos e gametócitos de Plasmodium falciparum
Trofozoítos, gametócitos e esquizontes de Plasmodium vivax
Tripomastigotas de Trypanosoma cruzi
Amastigotas de Leishmania donovani
Microfilárias de Wuchereria bancrofti
Esses parasitas são capazes de se alojar em diferentes elementos sanguíneos, como hemácias (Plasmodium sp. e Babesia spp.) e monócitos (Leishmania), na forma amastigota.
Exame de sangue a fresco
O exame de sangue a fresco, assim como o de fezes, baseia-se na pesquisa direta do parasita na amostra clínica. A técnica é realizada a partir de duas gotas do sangue total (obtidas por punção venosa ou digital), que são colocadas sobre uma lâmina, cobertas com uma lamínula e levadas ao microscópio para pesquisa de possíveis parasitas.
Esse método é indicado para pacientes com suspeita de infecção aguda e que necessitem de um resultado rápido, mas a distinção das diferentes formas parasitárias sem uma coloração específica é difícil e apresenta baixa sensibilidade.
Dessa forma, um resultado positivo deve ser confirmado com os métodos que utilizam corantes e, no caso de um resultado negativo, são necessárias novas coletas, feitas de forma periódica, para confirmação diagnóstica.
Esfregaço sanguíneo
O esfregaço sanguíneo é uma técnica que consiste na distensão do sangue total sobre uma lâmina de vidro, com o objetivo de contagem, verificação de alterações morfológicas das células sanguíneas e identificação, contagem e análise das formas evolutivas de possíveis parasitas. Existem duas formas de realização da técnica de distensão: o esfregaço estirado e o espesso (gota espessa). Ambas podem ser realizadas com sangue obtido a partir de punção venosa ou digital.
As lâminas utilizadas precisam estar devidamente limpas com detergentes e higienizadas com álcool 70%, no caso das que são reutilizadas. No caso de lâminas novas, devemos apenas higienizá-las.
Esfregaço estirado
Para essa técnica, uma gota do sangue é colocada sobre uma lâmina e, com auxílio de outra lâmina, o sangue é distendido. É necessário um ângulo de aproximadamente 45°C entre as duas lâminas para que se tenha um esfregaço fino. A distensão deve ser feita com tamanho de 2 mm. Após a confecção da lâmina, esta deve ser seca, fixada e corada.
Essa é a técnica utilizada em hematologia para detecção de diferentes fases evolutivas do Plasmodium sp. É aplicada para o diagnóstico no caso de suspeita de infecção aguda. Nessa técnica, as células ficam mais espaçadas, melhorando a visualização e análise da morfologia dos parasitas.
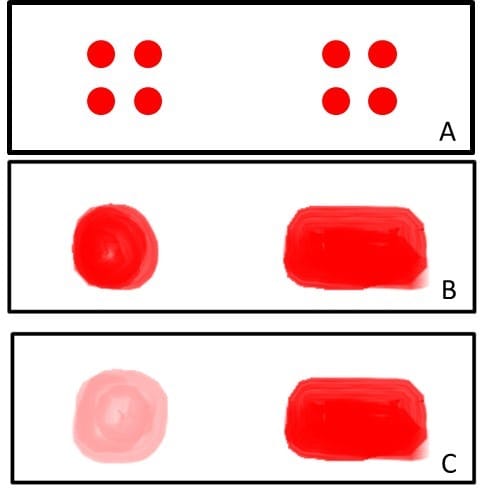
Esfregaço em gota espessa
Método simples, barato e que utiliza maior quantidade de sangue quando comparado com o esfregaço estriado, o que aumenta a probabilidade de visualizar o parasita. A técnica é feita com quatro gotas de sangue, que são colocadas sobre uma lâmina e homogeneizadas (podendo ser em formato de círculo ou retângulo). Em seguida, a lâmina é seca por, no mínimo, uma hora e mergulhada de forma vertical em água destilada morna para a desmoglobinização, a fim de se notar se houve o esbranquiamento na lâmina. Depois dessas etapas, está pronta para ser corada.
Essa técnica permite a identificação dos estágios de desenvolvimento dos parasitas e apresenta boa sensibilidade nos casos de baixa parasitemia. No entanto, requer experiência para análise das lâminas, pois o processo de desmoglobinização pode levar a alterações nos parasitas. Além disso, após a coleta a lâmina deve ser rapidamente processada, pois a hemoglobina pode ficar fixada à lâmina, atrapalhando a coloração.
Saiba mais
A gota espessa com a coloração de Walker ou Giemsa é o método oficial para o diagnóstico da malária no Brasil.
Colorações
Assim como nos exames de fezes, a coloração permite melhor visualização morfológica dos parasitas. Os corantes utilizados apresentam características neutras e coram os compostos nucleares e citoplasmáticos em tons vermelhos (quando ácidos) e azuis (quando básicos).
Existe uma série de corantes, conforme veremos a seguir.
É a mais utilizada nos esfregaços de sangue e ajuda a diferenciar morfologicamente plaquetas, eritrócitos, leucócitos e parasitas localizados dentro e fora das células. Quando empregada no esfregaço estirado, é necessária a fixação com álcool metílico (cinco a dez minutos). Já para o método de gota espessa, não há necessidade de fixação.
É aplicado o corante Giemsa (azur-eosina-metileno) por um período de cinco a dez minutos; em seguida, lavamos com água corrente e deixamos secar em temperatura ambiente. Depois, a lâmina é lida em objetiva de 40X. Nessa coloração, os núcleos aparecem em tons de púrpura, e o citoplasma, em tons de azul. Permite a diferenciação de espécies de T. cruzi e a identificação de Plasmodium spp. em todas as fases de desenvolvimento.
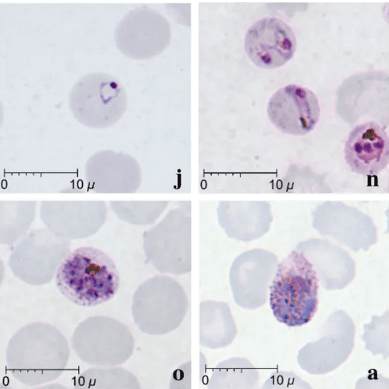
Método similar ao método de Giemsa, que foi desenvolvido para facilitar o diagnóstico de malária. Nessa técnica, são utilizadas duas soluções: a solução de Field A (azul de metileno) e B (eosina). Após a confecção dos esfregaços, a lâmina é incubada na solução A e, depois, na B. Os Plasmodium sp. são visualizados com uma coloração azulada, e as hemácias, com uma coloração avermelhada.
É usada para pesquisa de parasitas no sangue, como as outras técnicas de coloração. Não é necessária fixação durante o procedimento, desde que tenha álcool metílico na sua composição. A técnica é feita cobrindo-se o esfregaço sanguíneo estirado com o corante (eosina amarelada e produtos de oxidação do azul de metileno) pelo tempo de um a três minutos. Os parasitas apresentam tons avermelhados, e a leishmania sp. cora-se de uma cor vermelha forte.
Coloração feita para esfregaços de sangue com uma excelente qualidade para a coloração de leucócitos. É ultilizada para identificar algumas espécies de tripamossomas, formas amastigostas e promastigotas de Leishmania sp. e Plasmodium sp. A coloração é feita com um corante semelhante ao corante de Wright. O esfregaço não necessita de fixação prévia pelo álcool metílico, pois este já faz parte de sua formulação.
Em geral, as lâminas preparadas por esse método não são muito duráveis nem tão perfeitas quanto as preparadas pelo método de Giemsa, mas se trata de uma técnica muito utilizada devido à rapidez e facilidade de execução. A coloração dos parasitas é muito parecida com a da técnica de Giemsa, mostrando tons mais escuros, como roxo-azulado.
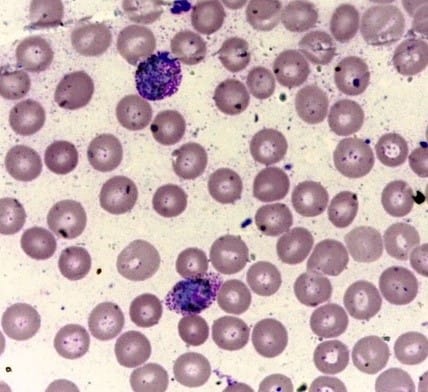
Essa coloração é feita com dois corantes diferentes, o corante de Giemsa (azur-eosina-metileno) e o May-Grunwald (eosina-metileno). Nessa coloração, em primeiro lugar, é feita a coloração e a fixação pelo corante May-Grunwald e, depois, com Giemsa, que possibilita um resultado melhor e mais detalhado.
No corante de May-Grunwald, o corante básico (azul de metileno) cora os elementos ácidos celulares (DNA e RNA) de tons azuis. Os elementos básicos celulares serão seletivamente corados pelo corante ácido (eosina) com a predominância de tons avermelhados. Essa coloração é amplamente utilizada para busca de parasitas Plasmodium sp. e Tripanosoma cruzi. Pode também ser utilizada em exames histopatológicos para a visualização de Leishmanias sp.
Coloração feita nos esfregaços de sangue e de fezes (frescas ou conservadas), favorecendo a visualização e o diagnóstico de oocistos das espécies Cryptosporidium parvum e Isospora belli. Para a coloração, as lâminas devem ser fixadas em álcool metílico e coradas com o cortante Kinyoun (Fucsina), lavadas com solução álcool-ácido e, depois, contracoradas com o corante de fundo, que, nesse caso, é o verde malaquita. Esses parasitas coram-se do rosa ao vermelho púrpura intenso sobre um fundo azul-esverdeado.
Neste vídeo, a Professora Mariana Ribeiro compara as colorações de leishmanias (Leishman e Giemsa), apresentando lâminas e discussão de lâminas.
Incubação no meio de cultura de Novy, McNeal e Nicolle (NNN)
A cultura é feita para o isolamento das espécies de Leishmania spp. e Trypanosoma cruzi, a partir de amostras de sangue e raspados ou aspirados de lesão (leishmanioses) para a detecção dos parasitas. Para isso, as amostras são inoculadas no meio NNN bifásico (parte sólida e líquida). Após cinco dias de incubação, a parte líquida é coletada e depositada em uma lâmina, fixada e corada pelo corante de Giemsa.
A cultura apresenta grande especificidade e sensibilidade e deve ser mantida por um período de sete a dez dias de incubação. Quando o resultado é negativo, é aconselhado repicar em outro meio e apenas liberar o diagnóstico negativo após 15 dias, sem a observação de nenhum parasita.
Você sabia
Microsporídios são conhecidos por infectar invertebrados e toda a classe de vertebrados, causando, em humanos, infecções sistêmicas e locais. Esses organismos são parasitas celulares obrigatórios, com dois estágios – o merogônico proliferativo e o esporogônico, que resulta na formação dos esporos. Existem várias linhagens celulares com diferentes meios e suplementação que são usadas para crescimento e isolamento dos microsporídios in vitro, em que são utilizadas diferentes amostras biológicas.
Microsporídios
São fungos parasitas chamados de parasitas, que são intracelulares obrigatórios e formadores de esporos! Causam microsporidiose, uma doença que acomete mais pacientes com AIDS.
MÉTODOS DE DIAGNÓSTICOS INDIRETOS
Como mencionado no módulo 2, os métodos indiretos consistem no reconhecimento antígeno-anticorpo e são uma ferramenta auxiliar no diagnóstico de parasitoses de difícil detecção pelos métodos diretos, como, por exemplo, a toxoplasmose, doença de Chagas (fase crônica), o abscesso amebiano, a leishmaniose visceral, esquistossomose (fase crônica), larva migrans visceral (toxocaríase), cisticercose e hidatidose.
Essas técnicas detectam anticorpos e, assim, permitem a verificação da resposta imunológica do hospedeiro. Além disso, possibilitam a detecção de antígenos em amostras de tecido durante os exames histopatológicos e líquidos corpóreos, como líquor (método direto). Os testes imunológicos possibilitam avaliar também a presença de hemoglobina nas fezes. O exame de sangue oculto pode ser realizado pela detecção de hemoglobina com a utilização de anticorpos, ou pelo contato com reagentes específicos. Esse exame é importante para avaliar possíveis lesões no TGI causadas por câncer, por exemplo.
Dica
Para saber mais sobre a pesquisa de sangue oculto nas fezes, visite o explore mais.
Atualmente, outras técnicas também auxiliam no diagnóstico parasitológico, como as técnicas de biologia molecular para a pesquisa de antígenos. Não podemos nos esquecer da importância dos exames de imagem para avaliação de algumas parasitoses, como no caso das causadas por helmintos!
A seguir, temos um resumo dessas técnicas. Vamos conhecê-las?
| Métodos | Técnicas | Amostras | Fundamento |
|---|---|---|---|
|
Pesquisa de antígenos (método direto) |
Imunofluorescência direta; enzimaimunoensaio (ELISA); histopatológico direto. |
Tecidos; líquidos corpóreos. |
Identificação de antígenos de vários parasitas pelo reconhecimento com anticorpos específicos. |
|
Pesquisa de anticorpos (método indireto) |
Hemaglutinação; imunofluorescência indireta, enzimaimunoensaio (ELISA); reação de fixação de complemento, contraimunoeletroforese; provas de imunodifusão. |
Tecidos; líquidos corpóreos (sangue). |
Detectam anticorpos. São usados principalmente nas infecções por T. gondii, T. cruzi e gênero Leishmania. A desvantagem desses métodos é que alguns helmintos apresentam conteúdo antigênico parecido; isso acontece quando são da mesma família, dificultando a diferenciação das espécies. Além disso, temos de esperar o organismo produzir anticorpos; assim, infecções recentes podem não ser detectadas. |
|
Pesquisa de fragmentos específicos de DNA parasitário (método direto) |
Teste de biologia molecular (PCR) |
Tecidos; líquidos corpóreos (sangue). |
Detectam a presença de parasitas mesmo em pequenas quantidades. São altamente sensíveis e reprodutivos e consistem em uma opção diagnóstica para várias infecções parasitárias por T. cruzi, gênero Leishmania e Cryptosporidium parvum. No entanto, ainda é uma metodologia cara, que requer material e mão de obra especializada, não podendo ser implementada em laboratórios de rotina. |
|
Intradermorreação (IDR) para pesquisa de reatividade mediada por células T (método indireto) |
Teste de hipersensibilidade cutânea. |
Não se aplica |
A técnica consiste na aplicação subcutânea de antígenos parasitários, com o desencadeamento de uma resposta inflamatória local e a medição do halo após o período de 48 a 72 horas de incubação. Essa reação revela apenas um contato prévio com o parasita, e não uma infecção atual. É utilizada com maior frequência para detectar leishmaniose tegumentar. |
|
Exames de imagem |
Exames de radiologia convencional, tomografia computadorizada, ressonância magnética, cintilografia e ultrassonografia. |
Não se aplica. |
Importantes em algumas infecções por helmintos, tais como larvas dos gêneros Taenia (cisticerco) e Echinococcus (cisto hidático) e em determinados casos de parasitismo em adultos, como a infecção por larvas de A. lumbricoides. Podem determinar o diagnóstico etiológico específico. |
DIAGNÓSTICO POR INOCULAÇÃO DE ANIMAIS DE LABORATÓRIO
A incubação de parasitas em camundongos ou cobaias de laboratório para diagnóstico de parasitoses, como a doença de Chagas, não é mais utilizada. No entanto, essa técnica ainda é empregada para o isolamento de espécies de parasitas e microrganismos em pesquisas científicas. Para isso, ocorre a inoculação das amostras nos animais de laboratórios e, depois, estas são identificadas.
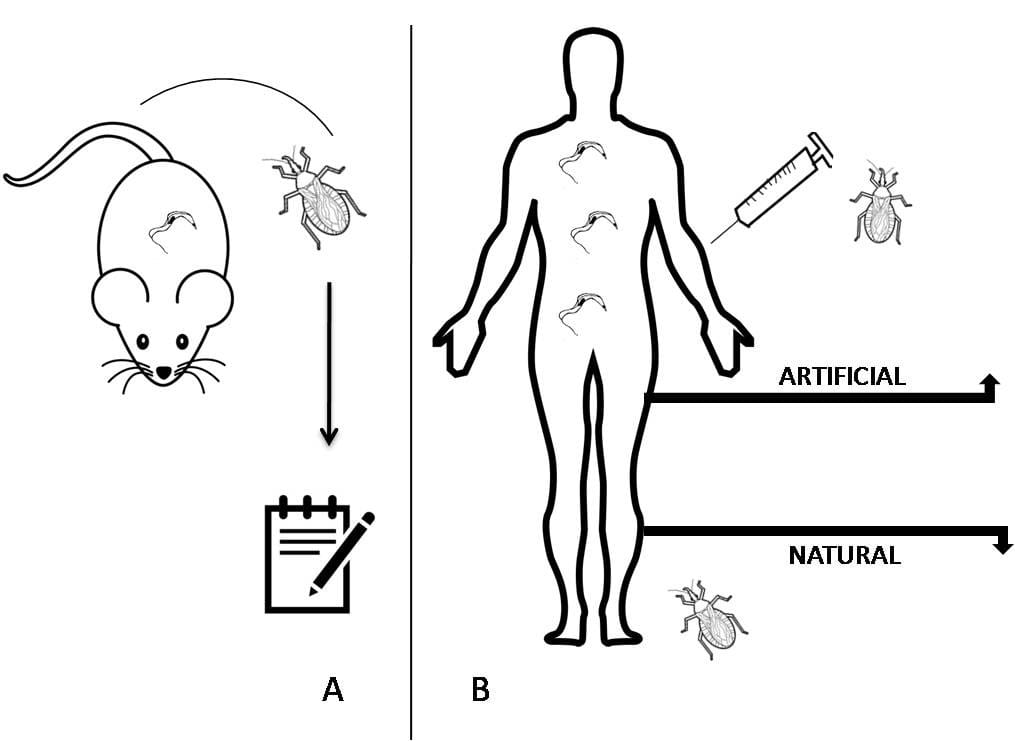
Xenodiagnóstico
Trata-se de uma técnica desenvolvida em 1914, que consiste na exposição de pacientes ou cobaias infectadas com insetos sadios cultivados em laboratório. Nessa técnica, os insetos sugam o sangue dos organismos infectados e, depois, são mantidos por até 90 dias (tempo necessário para a replicação do parasita) isolados em ambiente laboratorial controlado.
Após esse período, eles são analisados para verificar a presença do parasita (normalmente por dissecção intestinal). Esse tipo de exame é comumente empregado no diagnóstico da doença de Chagas, com parasitas da espécie Tripanosoma cruzi e com seus vetores, conhecidos popularmente como barbeiros. Essa técnica, conhecida como xenodiagnóstico natural (clássico), foi muito utilizada para a verificação da parasitemia em humanos com suspeita de doença de Chagas em áreas endêmicas do país.
A técnica clássica foi adaptada para ser realizada de forma artificial. A única diferença é que, na técnica artificial, não temos mais o contato do animal ou humano infectado com o vetor. Nessa metodologia, o sangue do paciente é retirado e oferecido (em bolsas de látex) aos insetos, para que eles se alimentem. Depois de um período de incubação, esses insetos são analisados.
Atualmente, outras técnicas são usadas para o diagnóstico da doença de Chagas, como métodos indiretos para detecção de anticorpos (IgM e IgG) e PCR.
Atenção
Os resultados dos exames parasitológicos devem ser relatados com o nome científico do parasita, incluindo gênero e a espécie, e, quando possível, deve-se informar o estágio de evolução do parasita, a consistência e a cor das fezes. Além disso, devem constar os métodos que foram utilizados.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Estudamos, ao longo deste tema, os principais exames parasitológicos que são realizados em diferentes amostras biológicas. Foi possível explorar a coleta dos diferentes materiais destinados a esse tipo de exame e as principais técnicas, focando na aplicabilidade, metodologia, nas vantagens e desvantagens. É de suma importância conhecer a aplicabilidade de cada teste e sua metodologia para garantir o processamento correto, a recuperação, a análise morfológica e a identificação correta dos parasitas, gerando, assim, uma conclusão diagnóstica.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu a coleta de amostras para as análises parasitológicas.
Reconheceu os métodos diretos empregados nos exames parasitológicos de fezes.
Identificou as técnicas parasitológicas do sangue e os métodos indiretos.