Descrição
Conceitos gerais de bacteriologia, testes de sensibilidade e métodos de coloração.
PROPÓSITO
Compreender as características gerais das bactérias, reconhecer os tipos de testes de sensibilidade e distinguir as principais técnicas de coloração bacteriana é importante, pois facilitará a execução de procedimentos na microbiologia clínica.
OBJETIVOS
Módulo 1
Descrever as características gerais das bactérias, as fases e os fatores que afetam o crescimento bacteriano
Módulo 2
Reconhecer os tipos de meios de cultura, bem como os testes de sensibilidade aos antimicrobianos
Módulo 3
Distinguir os métodos de visualização e coloração na prática laboratorial
Introdução
A Microbiologia é a ciência que estuda os organismos microscópicos, suas características e atividades, sendo as bactérias, os fungos, as algas e os protozoários os principais organismos estudados. Muitas bactérias são agentes infecciosos responsáveis por uma série de doenças nos seres humanos, podendo levar ao óbito dos indivíduos. Além disso, existe um grupo de bactérias multirresistentes aos antimicrobianos, não apresentando nenhum tipo de opção terapêutica.
A análise da morfologia, estrutura e metabolismo das bactérias é essencial para a compreensão e a identificação correta do tipo bacteriano, seja através do crescimento microbiano em meio de cultura adequado, ou através das técnicas de coloração, ou para investigar resistência a um ou mais antibióticos utilizados na clínica por meio dos testes de sensibilidade.
Você sabe por que algumas bactérias são classificadas como cocos gram-positivos e outras gram-negativas? Você sabe a diferença entre meios de culturas enriquecidos e seletivos? Como verifica-se a resistência aos antimicrobianos? Vamos juntos decifrar e explorar mais sobre a microbiologia clínica?
MÓDULO 1
Descrever as características gerais das bactérias, as fases e os fatores que afetam o crescimento bacteriano
Morfologia bacteriana
As bactérias podem apresentar diferentes morfologias, que caracterizam determinados gêneros ou grupos de bactérias. A análise da morfologia bacteriana auxilia na identificação e condução da escolha dos testes de identificação do tipo de bactéria, isolada a partir de espécimes clínicos.
As bactérias são classificadas morfologicamente de acordo com o tamanho, forma e arranjo e consistem nos menores seres vivos, da ordem de milésimos de milímetro e, portanto, visíveis apenas com a ajuda de um microscópio.
Enquanto células animais e vegetais podem ter até dezenas de micrômetros, a maioria das bactérias estudadas nos laboratórios de microbiologia medem em torno 1,0 µm de diâmetro.
µm
Micrômetro: Unidade de comprimento onde 1,0 µm equivale a 1000 mm, ou seja, igual a 1 x 10-6 m).
Você sabe quais são os formatos que as bactérias podem se apresentar?
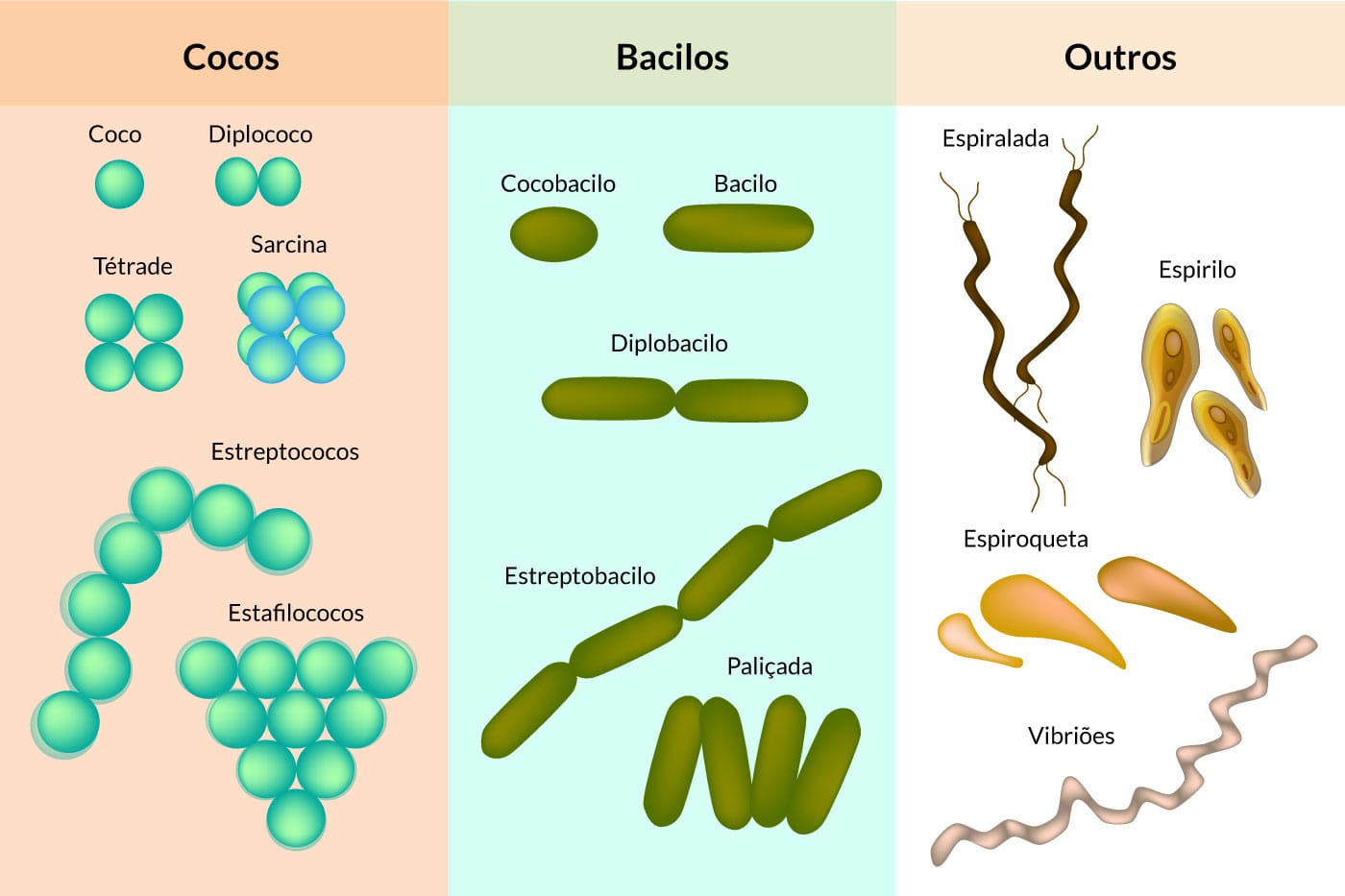
As bactérias podem se apresentar em três morfologias (Figura 1):
Cocos
Bactérias com formato esférico ou oval e que, de acordo com a sua divisão celular, são exemplos de cocos de importância médica, Staphylococcus aureus, Enterococcus spp, Streptococcus sp., Neisseria sp. Esses cocos podem se apresentar em diferentes arranjos:
Agrupamento de dois cocos. Os Streptococcus pneumoniae (pneumococo) são diplococos que podem causar pneumonia, meningite, sinusite e infecção do ouvido médio. Outro exemplo é a Neisseria gonorrhoeae agente etiológico da gonorreia.
Vários cocos agrupados em cadeia, lembrando um colar de pérolas. As infecções estreptocócicas, causadas por várias espécies de Streptococcus, podem desencadear diversos sintomas, como: pneumonia, faringite, febre escarlatina, impetigo e celulite.
Agrupamento de 4 cocos de forma semelhante a um quadrado.
Exemplo: Micrococcus spp., normalmente, não são patogênicos e integram a microbiota.
O aparecimento em uma cultura de sangue (hemocultura) desse tipo de bactéria é sugestivo de contaminação, que pode ter ocorrido no momento da coleta.
Agrupamento de 8 cocos unidos de forma semelhante a um cubo. Exemplo: Sarcina ventriculi, um importante patógeno em gatos, cachorros e bovinos. Em humanos, o potencial patogênico ainda não é muito bem elucidado, mas tem sido isolado em biopsias gástricas e relacionados com algumas doenças, como gastrite enfisematosa e perfuração gástrica.
Essa bactéria não é fácil de isolar e cultivar em laboratório de microbiologia. Assim, para o diagnóstico de gastrite provocada por essa bactéria recomenda-se o exame histopatológico com colorações de Hematoxilina e eosina.
Cocos agrupados de forma semelhante ao cacho de uvas. Como exemplo, temos as infecções por bactérias do gênero Staphylococcus aureus, que causam infecções cutâneas (foliculite, impetigo, abcessos, celulite), pneumonia, infecções na corrente sanguínea e osteomielite.
Bastonetes ou bacilos
São bactérias que apresentam um formato cilíndrico ou de bastão (bastonete), podendo ser curtas ou longas e apresentar extremidade reta ou de ponta arredondada. Normalmente, os bacilos não se agrupam em tantos arranjos como os cocos, apresentando-se, na maioria das vezes, de forma isolada. Entretanto, podem apresentar-se, eventualmente, como diplobacilos ou estreptobacilos.
Diplobacilos
Agrupamento de dois bacilos.
Em alguns casos, como o da Corynebacterium diphtheriae causadora da difteria, os bastonetes podem também apresentar arranjos diferenciados, como crescimento em paliçada ou letras chinesas.
Estreptobacilos
Agrupamento em cadeia.
Algumas doenças causadas por bactérias em formato de bastonete ou bacilos, são:
- Tétano - Clostridium tetani
- Tuberculose - Mycobacterium tuberculosis
- Difteria - Bacilo diftérico
- Hanseníase (lepra) - Mycobacterium leprae
É importante destacar que, durante a análise microscópica, alguns bacilos podem ser confundidos com cocos, isso ocorre pois são bacilos muito curtos. Esses bacilos curtos são chamados de cocobacilos.
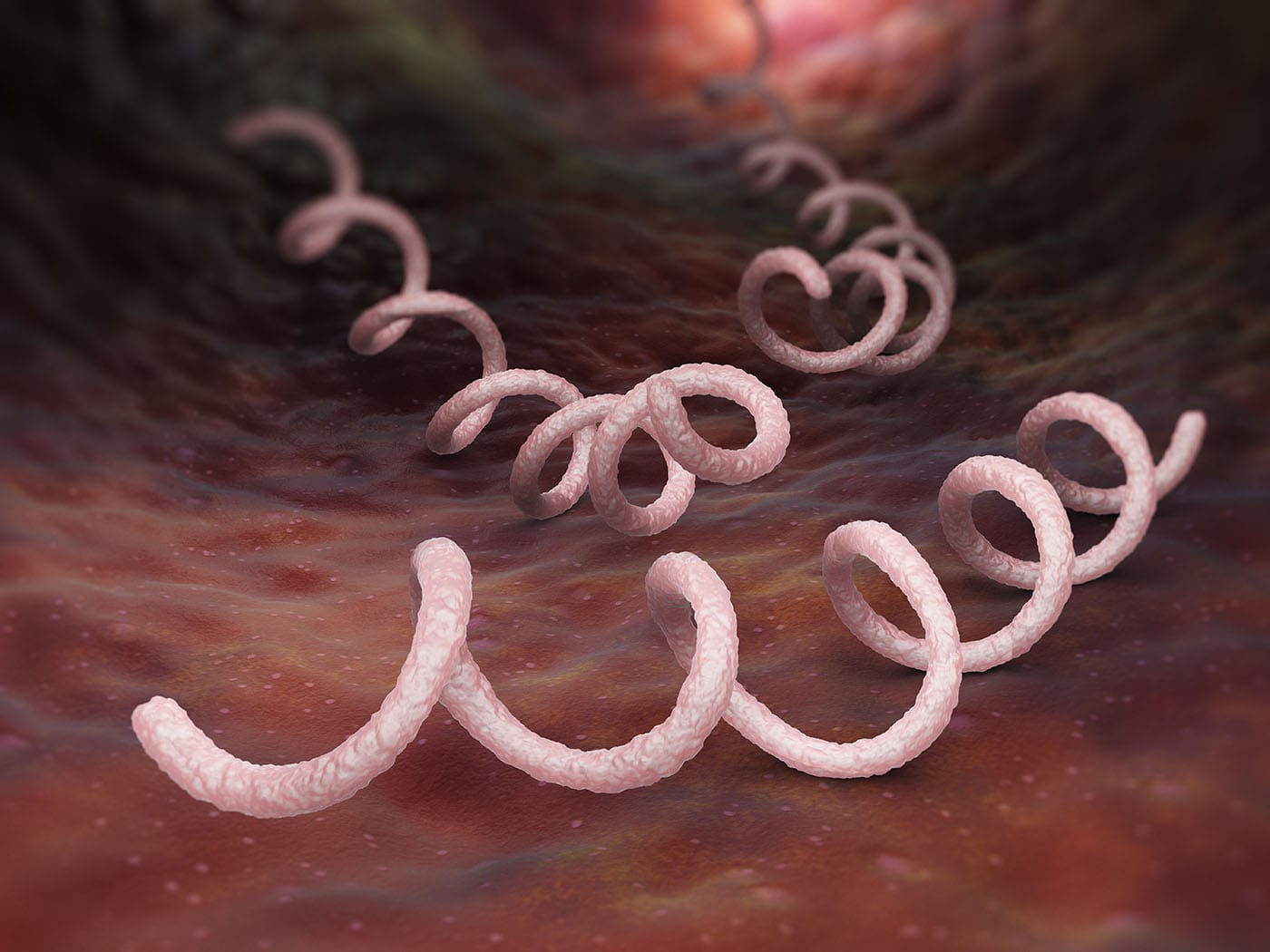
Espiraladas
Bactérias com formato espiralado ou helicoidal e que ocorrem, predominantemente, como células isoladas. Elas podem ser divididas em espirilos, espiroquetas e vibriões, conforme observado na Figura 2.
São móveis (locomovem-se com ajuda de flagelos), apresentam formato espiral e corpo rígido. Ex: Spirillum minus, que causa Febre da mordedura do rato em humanos e macacos.
São móveis, mas se locomovem por contrações citoplasmáticas, apresentam formato em espiral e são mais flexíveis; Ex: Treponema pallidum.
O T. pallium é o agente etiológico da sífilis, uma infecção bacteriana de transmissão sexual e vertical. Quando não tratada, pode evoluir para formas mais graves, comprometendo especialmente os sistemas nervoso e cardiovascular. Para o diagnóstico da sífilis, podemos utilizar:
- Métodos diretos a partir de materiais coletados das lesões primárias causadas por essa bactéria, que permite a visualização do treponema vivo e móvel.
- Pode ser feito com material fixado seguido de coloração (pelo método de Fontana de Tribondeau), mas é de difícil visualização.
- Pelos testes imunológicos para detecção de anticorpos-antitreponêmicos (mais empregado).
São móveis (locomovem-se com ajuda de flagelos) apresentam formato de vírgula. Ex: Vibrio cholerae, também conhecido como vibrião colérico, é o agente causador da cólera.
Citologia bacteriana
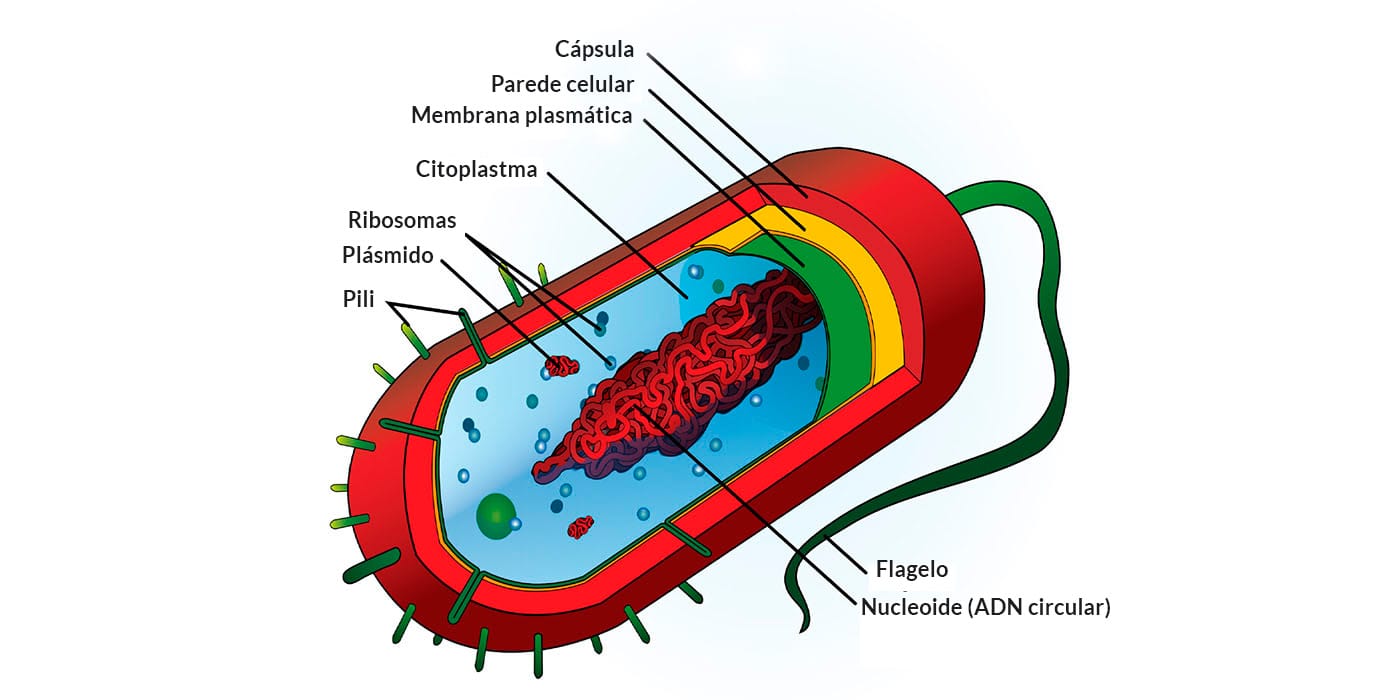
As bactérias pertencem ao grupo dos procariotos e, portanto, não possuem membrana nuclear (carioteca), bem como não possuem todo o conjunto de organelas das células eucarióticas. Entretanto, possuem elementos estruturais de grande importância, como a parede celular, que pode ser corada, permitindo o profissional da saúde identificar e diferenciar os principais grupos de bactérias.
Parede celular
Você sabe por que a parede celular é uma estrutura tão relevante para as bactérias?
Ela é importante na divisão celular, é responsável pela forma, rigidez da bactéria e confere proteção osmótica entre os meios externo e interno.
A parede celular possui uma espessura de, aproximadamente, 10 a 20 µm, é porosa, permitindo a passagem de metabólitos para a membrana plasmática, é formada por camadas rígidas de peptidoglicanos (mureína), e envolve a membrana citoplasmática da maioria dos procariotos.
As bactérias são classificadas em gram-positivas ou em gram-negativas, de acordo com a cor de sua parede celular após a realização da coloração de Gram.
A divisão desses dois grupos de bactérias é essencial em um laboratório de microbiologia clínica. A identificação microscópica de bactérias gram-positivas ou gram-negativas, além de direcionar os testes de identificação, também permitem que o médico inicie o tratamento empiricamente, antes mesmo de sair o resultado da cultura e do antibiograma, que demora, no mínimo, 48 horas.
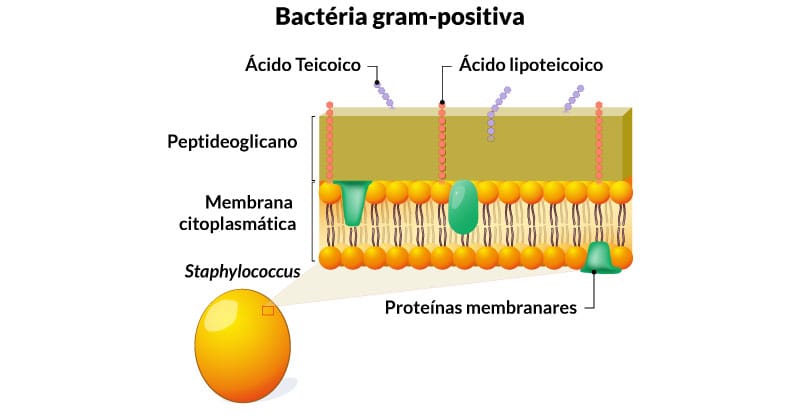
Bactéria gram-positiva
Possui uma parede celular mais espessa, com múltiplas camadas de peptideoglicanos (Figura 3), revestindo a membrana citoplasmática. Além disso, possui outros componentes, como os:
Ácidos teicoicos
Polímeros de fosfato de poliol, ligados covalentemente ao peptideoglicano, essenciais para a viabilidade da célula e considerados fatores importantes na virulência.
Ácidos lipoteicoicos
Possuem um ácido graxo e estão ancorados na membrana plasmática. São considerados antígenos de superfície, permitem a distinção dos sorotipos bacterianos e a aderência nas superfícies das células hospedeiras.
Virulência
A capacidade de um microrganismo de produzir danos que são fatais ou graves, podendo levar ao óbito (diferente de Patogenicidade que é a capacidade de uma bactéria de desenvolver uma doença (dano) em um determinado organismo). São exemplos de fatores de virulências: capacidade de multiplicar, produção de toxinas, produção de proteínas e enzimas que auxiliam a fuga dos mecanismos de defesa do organismo, dentre outros.
Dentre as bactérias gram-positivas, temos as que são partes da microbiota normal do organismo e que, geralmente, não causam doenças e temos aquelas que são patogênicas, causando difteria, carbúnculo, listeriose, septicemia, pneumonia, entre outros tipos de infecção.
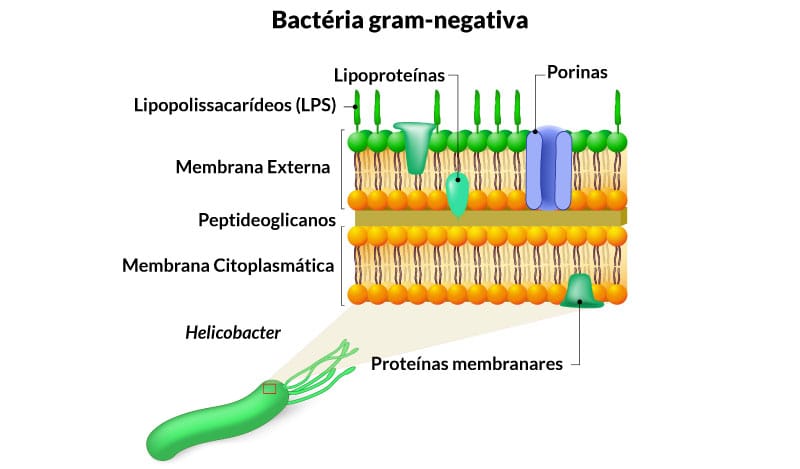
Bactéria gram-negativa
Apresenta a parede celular com uma estrutura mais complexa e, quimicamente, diferente quando comparada à parede celular de gram-positiva (ver Figura 4). Esta parede celular é composta de uma fina camada de peptideoglicanos (5-10% do peso da parede celular) e externamente a esta fina camada, encontramos uma membrana externa.
Atenção
1) O espaço entre membranas é conhecido como espaço periplasmático.
2) A membrana externa está presente apenas nas bactérias gram-negativas.
A membrana externa além de manter a estrutura bacteriana é uma barreira de permeabilidade, confere proteção contra condições ambientais adversas, como as do sistema digestivo do hospedeiro e resistência a alguns antimicrobianos como a penicilina. Essa membrana é formada por uma dupla camada lipídica, onde a camada interna é constituída basicamente de fosfolipídios e a camada externa possui uma molécula anfipática, o lipopolissacarídeo (LPS) ou endotoxina e proteínas.
O LPS é essencial para a viabilidade das bactérias, funciona como um potente indutor de respostas imunológicas, ativando linfócitos B e induzindo a produção de citocinas por macrófagos, células dendríticas e outras células. Por outro lado, provoca febre e pode causar choque endotoxêmico, sendo chamado também de endotoxina. As proteínas permitem a difusão de metabolitos pequenos, antibióticos hidrofílicos, têm função estrutural e atuam como receptoras para bacteriófagos e outros ligantes.
LPS
O LPS é composto de três secções estruturais: o Lipídeo A, o núcleo polissacarídeo e o antígeno O. O lipídeo A é responsável pelos efeitos tóxicos do LPS.
As bactérias gram-negativas podem causar uma série de infecções graves nos seres humanos, como peritonite, pneumonia, infecções urinárias, meningite, dentre outras. É importante ressaltar que essas bactérias estão cada vez mais resistentes aos antimicrobianos disponíveis para utilização terapêutica.
Atenção
Exceções bacterianas
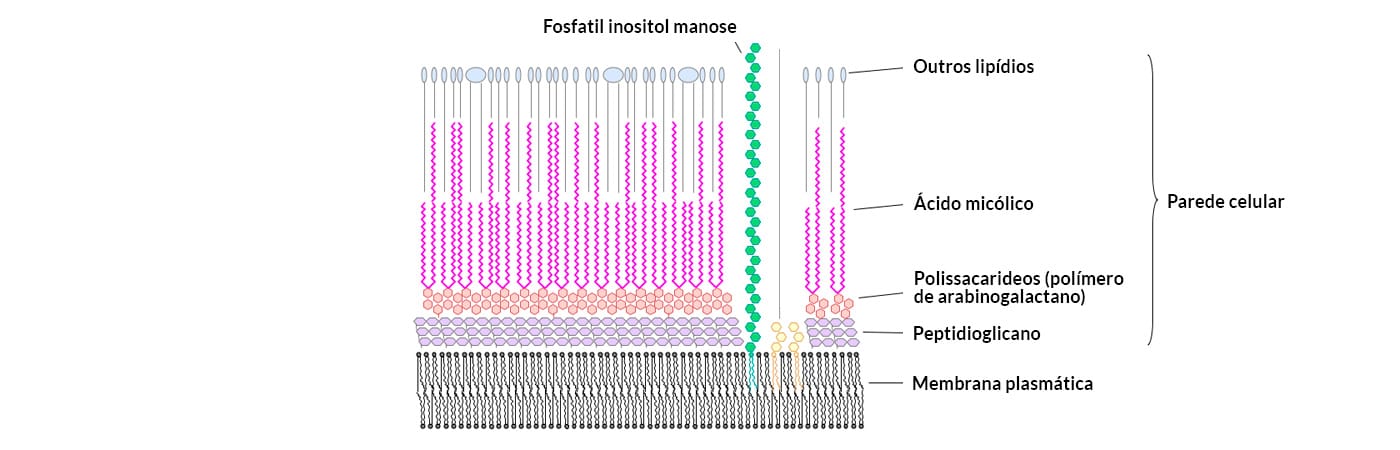
1) Micobactérias: Bacilos que apresentam a camada de peptideoglicanos da parede celular com estrutura um pouco diferente, pois é formada por polímeros de arabinogalactano e revestida por uma capa lipídica cerosa de ácidos micólicos. Devido ao caráter hidrofóbico da parede celular destas bactérias, a coloração pelo método de Gram não é a de escolha quando se deseja pesquisar esse tipo de bactéria. No entanto, elas poderão ser diferenciadas pela característica de álcool-ácido resistência (coloração de Ziehl Neelsen). Exemplo. Mycobacterium tuberculosis (bacilo da tuberculose). (Figura 5).
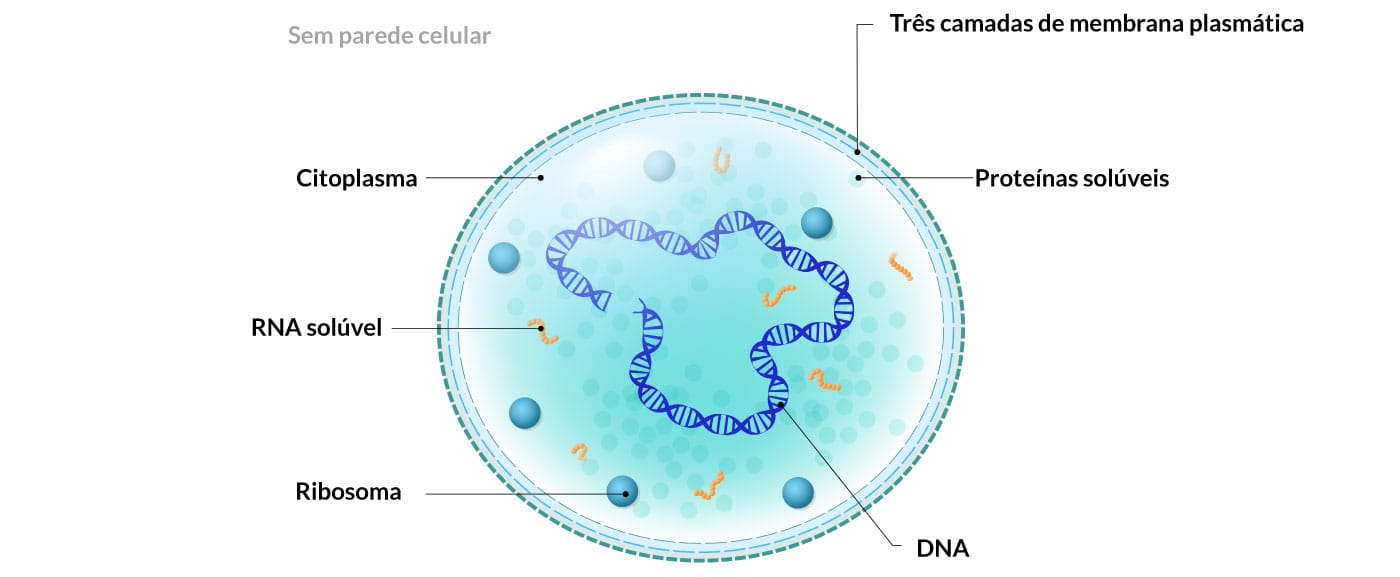
2) Micoplasmas: São as menores bactérias encontradas na natureza (cerca de 0,3 µm), não apresentam parede celular e incorporam esteróis do hospedeiro em sua membrana (Figura 6). O Mycoplasma pneumoniae é um agente causador comum de pneumonia.
Esteróis
Esteróis conferem a membrana celular fluidez e permeabilidade. Essas moléculas estão presentes na maioria das células eucariotas, na forma de colesterol.
Membrana celular ou membrana citoplasmática bacteriana
A membrana citoplasmática das bactérias é semipermeável, seletiva, contém várias enzimas, limita o citoplasma, é constituída de fosfolipídios e proteínas e, portanto, considerada semelhante à membrana plasmática dos organismos eucarióticos, exceto pelo fato de não possuírem esteróis.
Citoplasma: O citoplasma da célula bacteriana pode ser dividido em diferentes regiões:
- Citoplasmática: rica em RNA; partículas proteicas e ribossomos (responsáveis pela síntese proteica).
- Cromatínica: rica em DNA circular dupla fita.
- Porção fluída, com nutrientes dissolvidos.
Atenção
Algumas bactérias, como o Vibrio cholerae, podem possuir mais de um DNA; e outras, como a Borrelia burgdorferi, possuem um DNA linear).
Elementos acessórios
São estruturas que podem estar ou não presentes em determinadas bactérias. Vários desses elementos acessórios são importantes na virulência, patogenicidade e resistência bacteriana.
O glicocálice consiste em um revestimento de polissacarídeos. Quando o glicocálice apresenta estrutura uniforme e encontra-se firmemente aderido à parede celular é denominado de cápsula. Quando as camadas de polissacarídeos possuem pouca aderência e apresentam espessura não uniforme, são chamadas de camada viscosa. Essa estrutura, além de fornecer um envoltório protetor, evita a fagocitose pelas células de defesa do organismo, atua como reservatório de nutrientes e, principalmente, auxilia na aderência bacteriana a algumas superfícies. Exemplo: o Streptococcus mutans, que através da cápsula fixa e perfura o esmalte dentário.
A determinação dos constituintes da cápsula é fundamental na identificação de certas bactérias patogênicas, uma vez que algumas cápsulas são compostas de polipeptídios, ao invés de polissacarídeos, como ocorre com o Bacillus anthracis (agente do carbúnculo/ antrax).
Corresponde a um DNA circular extracromossomal, capaz de se replicar de forma autônoma, localizado no citoplasma da célula bacteriana e que não é responsável por características essenciais da bactéria. Podem se apresentar em várias cópias, além de possuir a capacidade de conferir vantagens adaptativas (por exemplo, resistência a antibióticos), podendo, inclusive, ser transferidos para outras bactérias.
São grânulos cuja função é de armazenamento, podendo ser de glicogênio, amido, fosfatos, enxofre etc. e podem ser visualizados através de colorações especiais, pois, geralmente, são refringentes.
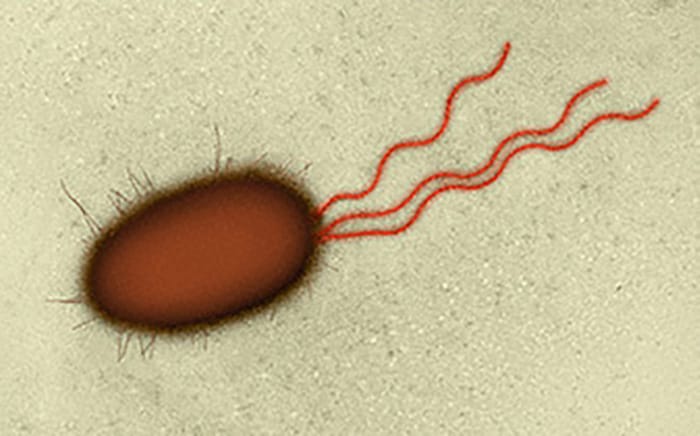
São estruturas de locomoção presentes em algumas bactérias, formadas por subunidades proteicas acopladas na forma helicoidal (flagelina) e que permitem às bactérias “irem” em busca de nutrientes ou fugir de substâncias tóxicas. O flagelo fica ancorado na membrana citoplasmática através do seu corpo basal (similar a um gancho), possui um comprimento geralmente muito maior que o da célula, e podem ser únicos ou múltiplos, polares (apenas nas extremidades) ou peritríquios (em todo corpo bacteriano). Embora os flagelos não possam ser visualizados, normalmente, no microscópio óptico, existem técnicas de coloração que os tornam visíveis no microscópio óptico e os microbiologistas usam como auxílio no diagnóstico.
Durante a identificação de uma bactéria, a avaliação da motilidade pode ser utilizada para diferenciar espécies de bactérias. Exemplo: Em uma cultura de fezes (coprocultura), a presença de bactérias gram-negativas imóveis é indicativa de Shigella sp. e móveis de Salmonella sp.
As fímbrias são estruturas filamentosas, que lembram fios de cabelo no lado de fora da bactéria, compostas por subunidades proteicas (pilina), que se projetam a partir da superfície de uma célula e, geralmente, estão em maior quantidade do que os flagelos. As fímbrias auxiliam na colonização das membranas de mucosas como ocorre no caso da Neisseria gonorrhoeae, agente causador da gonorreia e, no caso da E. coli, nas células do trato urinário. Os pili sexuais de uma bactéria se ligam a outras bactérias permitindo a transferência de material genético na conjugação bacteriana. Esse pili sexuais são codificados por um plasmídeo.
Produzidos por alguns gêneros de bactérias, como Bacillus e Clostridium, os esporos são uma estrutura resistente a agentes físicos e químicos, que é formada em resposta ao meio ambiente, quando este se torna inadequado para a sobrevivência da bactéria (ex.: escassez de água ou nutrientes). A resistência da forma esporulada possibilita que a bactéria sobreviva por longos anos em ambientes desfavoráveis, podendo reverter à forma vegetativa quando o local se tornar viável novamente para sua sobrevida. Cada célula forma um único esporo, que é liberado quando a bactéria morre.
Fatores de virulência e patogenicidade de bactérias
Fases de crescimento e fatores que afetam o crescimento bacteriano
As bactérias, quando inoculadas em meio de cultura adequado e em condições apropriadas, iniciam processo de duplicação bacteriana, no qual por divisão binária, ocorre aumento da população de forma logarítmica. O tempo de geração, ou seja, o tempo necessário para que uma bactéria se duplique varia de acordo com a espécie bacteriana, podendo ser extremamente curto (E. coli ± 15 minutos) ou bastante longo (M. tuberculosis ± 932 minutos).
Saiba mais
Para uma cultura de micobactéria ser considerada negativa, temos que esperar, no mínimo, 45 dias de incubação e não ser visualizado nenhum crescimento.
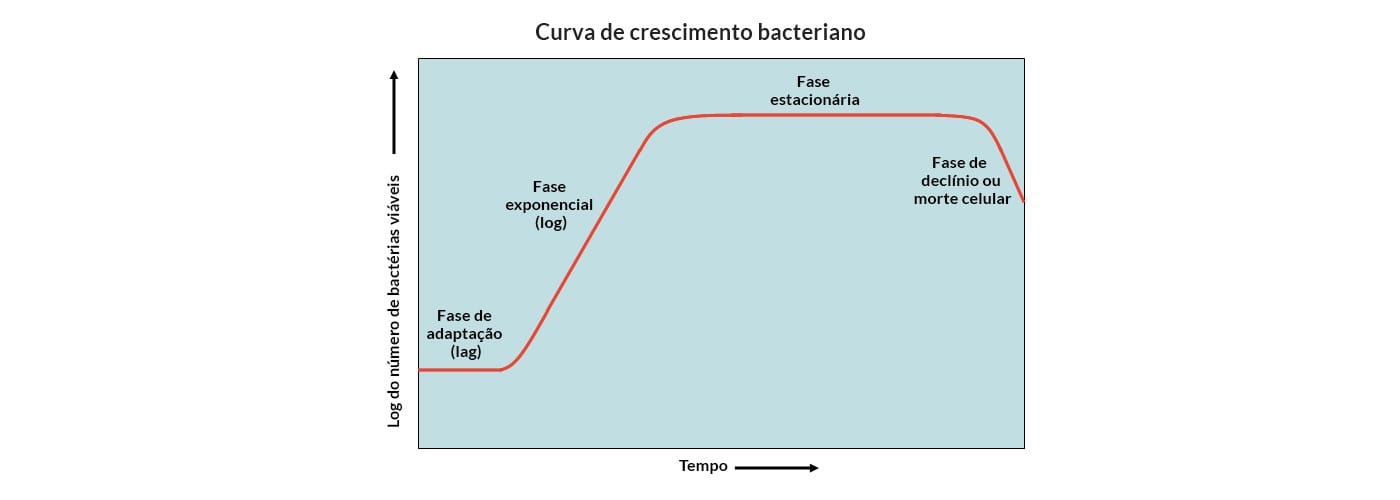
Compreender que o crescimento bacteriano em um meio de cultura apresenta 4 fases, cada uma com suas características peculiares, é de extrema importância para a escolha do meio de cultura ideal e das técnicas para isolar e identificar as bactérias em uma rotina laboratorial. Vamos conhecer essas fases?
Fase Lag
Quando bactérias são adicionadas a um meio de cultura (semeadas), elas necessitam de um tempo para se adaptar ao novo ambiente antes de começar a se dividir. Neste momento, não há reprodução e a população permanece temporariamente inalterada. É importante ressaltar que, nesta fase, as células não estão em latência, uma vez que aumentam no tamanho e fisiologicamente estão muito ativas.
Fase Logarítmica (fase Log ou exponencial)
Nesta fase, as células iniciam a divisão que ocorre de forma exponencial, regular e constante. A velocidade de crescimento é máxima nesta fase, e varia de acordo com a cepa e com as condições ambientais.
Fase estacionária ou fase Platô
Em determinando momento do crescimento bacteriano, haverá carência de nutrientes e produção de substâncias tóxicas no meio, dessa forma, o número absoluto de bactérias no meio de cultura permanecerá constante, resultado do equilíbrio entre bactérias que ainda estão se duplicando e bactérias que estão morrendo.
Fase de declínio ou morte
Etapa que ocorre morte bacteriana, pois há falta de nutrientes e de espaço, aliada à toxidez do ambiente que levam os microrganismos a morrerem mais rápido do que produzirem novas células (a morte bacteriana nesta fase se dará de forma exponencial ou logarítmica). Sendo assim, há uma progressiva morte celular até a cultura se tornar estéril.
Fatores ambientais que afetam o crescimento bacteriano
Além de nutrientes apropriados, é necessário conhecer as condições físicas ambientais ideais para o crescimento bacteriano em meio de cultura. Dentre estes, os principais fatores são:
Temperatura
A temperatura ótima de crescimento é aquela que possibilita o maior crescimento, durante o menor tempo e varia para cada gênero. As bactérias, no geral, são classificadas de acordo com sua temperatura ótima de crescimento em:
Crescem melhor de 12°C e 20°C.
Crescem melhor de 25°C a 40°C. Neste grupo, está a maioria dos patógenos bacterianos de importância clínica, já que nesta faixa encontra-se a temperatura do corpo humano.
Crescem melhor de 45°C a 60°C.
Saiba mais
A temperatura de crescimento também pode ser usada durante a identificação bacteriana. Exemplo: A N. gonorrhoeae e N. Meningitis não crescem na temperatura de 22°C, mas as outras espécies de Neisseria sp. são capazes de crescer.
Oxigênio
As bactérias podem ser divididas de acordo com a necessidade e a tolerância ao oxigênio:
Só crescem na presença de oxigênio. Ex.: Acinetobacter sp.
Crescem tanto na presença quanto na ausência de oxigênio. Ex.: E. coli.
Só crescem em ambiente contendo baixas concentrações de oxigênio (menores que as encontradas no ar atmosférico). Ex.: Campylobacter sp.
Só conseguem crescer na ausência de oxigênio. Em contato com O2, o crescimento dessas bactérias é inibido ou ocorre morte bacteriana. Ex.: Clostridium botulinum e Neisseria sp.
Saiba mais
Quanto às espécies de Neisseria, o ideal é semear imediatamente após a coleta em meio sólido, levar para a estufa 36 °C em jarra com vela ou com gerador de CO2 e umidade.
pH
Normalmente, a grande maioria das bactérias cresce bem em meios com pH neutro, em torno de 6,5 a 7,5, apesar de muitas espécies tolerarem variações de pH entre 4,0 e 9,0. Os meios de cultura geralmente são tamponados para impedir mudanças bruscas de pH, decorrentes do próprio metabolismo das bactérias.
Pressão osmótica
A pressão osmótica é a pressão que deve ser exercida sobre um sistema para evitar que a passagem de água por osmose, ou seja, para o meio mais concentrado ocorra. A parede celular, além da rigidez, impede a entrada excessiva de água. Dessa forma, a pressão osmótica dos meios de cultura pode afetar diretamente a viabilidade das bactérias. Meios de cultura com pressões osmóticas menores comparado ao interior da bactéria, normalmente, não afetam sua viabilidade. De forma diferente, meios de cultura com pressões osmóticas maiores causam perda de água intracelular, trazendo efeito bacteriostático ou bactericida.
Bacteriostático
Bacteriostáticos são substâncias que inibem o crescimento e a reprodução bacteriana sem provocar sua morte imediata, sendo reversível o efeito, uma vez retirada a droga.
Bactericida
Bactericidas são substâncias capazes de matar ou lesar irreversivelmente as bactérias.
Saiba mais
Halofismo - Certas bactérias isoladas de salmouras, pacotes de sal, alimentos e água do mar, chamadas bactérias halofílicas ou halófitas obrigatórias, crescem apenas quando o meio contém uma concentração inusitadamente elevada de sal (10% a 15%). Isto representa uma resposta especial do microrganismo à pressão osmótica.
Fala, mestre!
No vídeo apresentado por Mariele de Jesus sobre biomédica, o tema abordado é o mapa de risco e seu objetivo. O vídeo ensina como identificar diferentes tipos de risco no laboratório, tais como risco químico, risco físico, risco biológico, risco ergonômico e risco de acidentes, bem como a importância dos Equipamentos de Proteção Individual (EPIs) e Equipamentos de Proteção Coletiva (EPCs). Cada tipo de risco é associado a uma cor específica e exemplos práticos são fornecidos para ilustrar cada um. Também é destacada a importância do uso adequado dos EPIs para minimizar riscos de acidentes e questões ergonômicas no ambiente de trabalho. Por fim, os alunos são incentivados a identificar os riscos em seus próprios laboratórios e desenvolver um mapa de risco.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer os tipos de meios de cultura, bem como os testes de sensibilidade aos antimicrobianos
Meios de cultura: composição e classificação
Os meios de cultura são capazes de fornecer os nutrientes necessários para o crescimento e desenvolvimento de microrganismos fora do seu habitat natural. Os meios de cultura apresentam em sua composição diferentes macronutrientes (carbono, oxigênio, nitrogênio, enxofre, fósforo e hidrogênio) e micronutrientes (ferro, zinco, manganês, cálcio, potássio, sódio, cobre, cloro, cobalto, molibdênio, selênio, magnésio, entre tantos outros), necessários à síntese biológica de novos organismos. Nos laboratórios clínicos, os meios de cultivo podem ser comprados totalmente prontos ou então serem preparados.
Meio de cultura
É qualquer substância, sólida, semissólida ou líquida que possua um conjunto de fontes de nutrientes e que seja utilizada para o cultivo de microrganismos.
Após a coleta de uma amostra biológica, destinada para a cultura e/ou antibiograma, essa será semeada em meios de culturas capazes de suprir as bactérias com as exigências nutricionais mínimas, dentro das condições ambientais necessárias para o cultivo, possibilitando o crescimento microbiano e a formação e visualização de colônias.
Durante a semeadura de uma amostra biológica, por exemplo, o líquor, em casos de suspeita de meningite, deve-se conhecer os principais agente etiológicos dessa doença para escolher os meios apropriados (com nutrientes específicos e pH), as condições ideais de crescimento, como a presença e quantidade de oxigênio ou até mesmo a sua ausência. Todos esses aspectos são essenciais para auxiliar na identificação bacteriana e na conclusão diagnóstica.
Vamos juntos conhecer um pouco mais sobre a classificação dos meios de culturas.
Classificação dos meios de cultura
Os meios de cultura são classificados a partir do seu estado físico, da sua composição e do seu objetivo de utilização.
1) De acordo com o seu estado físico:
Você provavelmente já preparou gelatina na sua casa, correto? Lembra da sua consistência?
Para obtermos diferentes consistências nos meios de cultura, adicionamos ágar-ágar, um polissacarídeo complexo obtido de alga marinha vermelha e que atua como agente solidificante, muito semelhante à maneira como a gelatina é utilizada na sua cozinha.
É válido lembrar que, para obtenção de um meio de cultura ideal contendo ágar, deve-se, após sua adição, aquecer a solução para dissolver o ágar em água fervente até a solução ficar homogênea. Entretanto, não devemos ferver ou aquecer a solução diversas vezes, pois podemos provocar alteração no valor nutritivo, no percentual de água e outros parâmetros que interferiam no crescimento.
Meios sólidos
Obtidos a partir da adição de 1,0 g a 3,0 g % de ágar. A maioria dos microrganismos crescem formando colônias. Ex: Ágar nutritivo.

Meios semissólidos
Obtidos, na maioria das vezes, após adição de 0,1 g a 0,7 g %”, separando o 0,7 de g. Dentre as finalidades, temos a visualização da motilidade bacteriana ou, muitas vezes, servir como base de meio de transporte. Ex: Meio SIM (meio de detecção da produção de enxofre, motilidade e produção de indol) e Cary & Blair.

Meios líquidos
Não apresentam ágar, são conhecidos como “caldos” e utilizados para ativação das culturas, repiques de microrganismos, provas bioquímicas, dentre outros. Ex: caldo tetrationato e selenito-cistina para cultivo de salmonelas, caldo tioglicolato para Clostridium perfringens.
2) De acordo com a composição química
Meios quimicamente definidos
A composição química de todos os seus constituintes é conhecida (definidos). Ex: Meio AR-103.
Meios Complexos
A exata constituição do meio de cultura não é conhecida. Esses meios apresentam em sua composição soro, sangue, extratos moídos ou digeridos de órgãos animais (corações, fígados, cérebros), peixes, leveduras, e vegetais ou outro componente que não se tem total conhecimento da composição química. Ex: Ágar sangue.
3) De acordo com o objetivo da utilização
Meios enriquecidos ou ricos
São os meios que contêm um grande suprimento de nutrientes pela adição de diversas substâncias como sangue, soro, extratos de tecidos animais ou vegetais ao caldo ou até mesmo ágar nutritivos, para permitir o crescimento de bactérias fastidiosas (nutricionalmente exigentes), como Haemophilus spp., Neisseria spp., Branhamella catarrhalis e Moraxella spp.
Exemplo
O ágar-sangue (ágar nutriente com 5% de eritrócitos de carneiro) e o ágar-chocolate (ágar nutriente com hemoglobina em pó) são exemplos de meios enriquecidos utilizados de forma rotineira nos laboratórios de bacteriologia clínica.
Meios Seletivos
São meios que apresentam em sua composição substâncias químicas específicas (inibidores) adicionadas ao caldo ou ao ágar nutritivo que previnem o crescimento de um determinado grupo de bactérias. É importante ressaltar que os inibidores atuam em um grupo específico de bactéria, favorecendo apenas o crescimento da bactéria de interesse.
Exemplo
O ágar MacConkey é um meio seletivo pois tem em sua composição sais biliares e cristais violeta que inibe o crescimento da maioria das bactérias gram-positivas, permitindo o crescimento apenas das bactérias gram-negativas.
Meios diferenciais ou indicadores
Contêm certos reagentes ou substâncias no meio que permitem a distinção de diferentes tipos de bactérias.
Exemplo
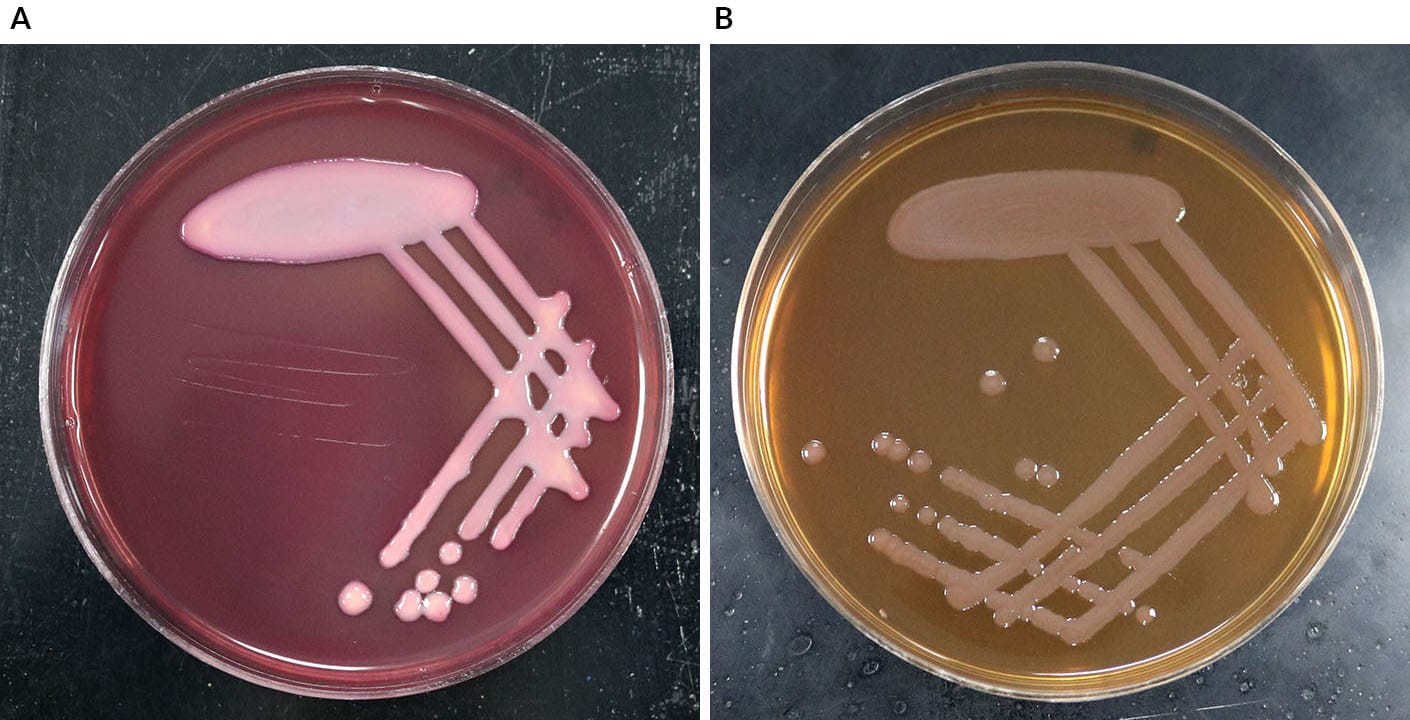
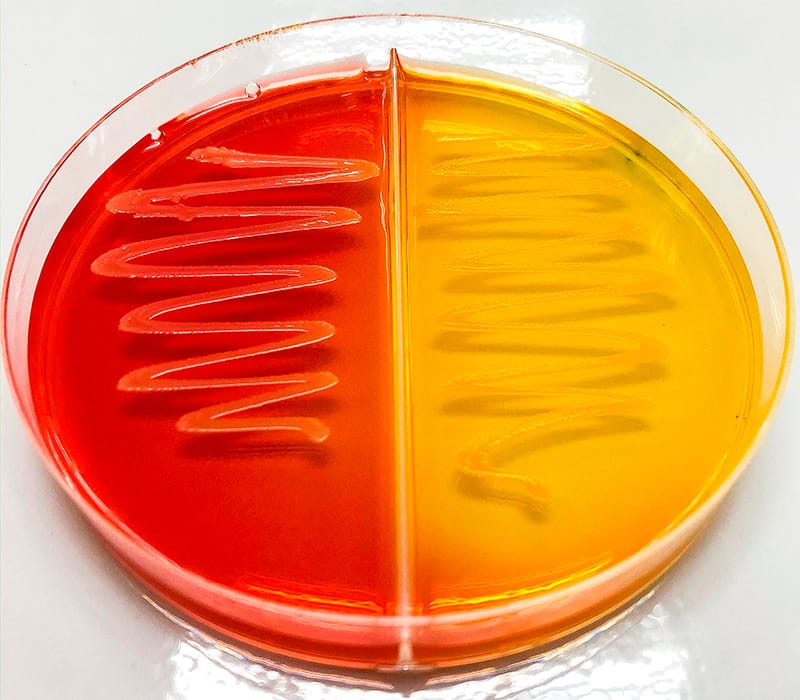
O Ágar MacConkey, além de um meio de cultura seletivo, é, frequentemente, utilizado para diferenciar bacilos gram-negativos isolados de amostras fecais. As bactérias gram-negativas que fermentam a lactose (um ingrediente do ágar MacConkey) produzem colônias rosas (Figura 7A), como E. coli, enquanto aquelas incapazes de fermentar a lactose produzem colônias incolores e amarelas (Figura 7B), como Acinetobacter baumanii.
Colônias rosas
Bactérias gram-negativas que fermentam a lactose crescem produzindo colônias rosas.
Agora que você conheceu esse meio de cultura, imagina por que temos essa diferença?
Como mencionado anteriormente, a lactose é um nutriente presente no Ágar MacConkey e, além desse nutriente, o meio apresenta um indicador de pH (que permite a alteração da coloração do meio de acordo com o pH). Bactérias que são capazes de metabolizar a lactose produzem ácidos mistos que alteram o pH do meio que fica com uma cor rosa/ avermelhado. De forma diferente, as bactérias que não fermentam a lactose, utilizam como fonte de energia a peptona. A peptona, ao ser metabolizada, produz amônia, que eleva o pH do meio e torna as colônias e o meio amarelados/ sem cor.
Exemplo
Outro exemplo de meio seletivo é o ágar manitol salgado. Esse meio de cultivo é composto de manitol e alta concentração de sal (7,5% de NaCL). Na rotina laboratorial ele é utilizado para o isolamento de Staphylococcus aureus a partir de diferentes amostras biológicas. Todas as espécies de Staphylococcus são capazes de crescer nesse meio, mas o S. aureus é capaz de fermentar o manitol presente no meio, produzindo ácido, que torna o meio e as colônias amareladas. As outras espécies de estafilococos, como os Staphylococcus epidermidis e o Bacillus subtillis não metabolizam o manitol, apresentando assim colônias brancas.
Meios de transporte
Geralmente, são semissólidos e possuem o mínimo de nutrientes para a manutenção das bactérias, durante o tempo de transporte, sem que estas se reproduzam ou acidifiquem o meio. Atualmente, para auxiliar na coleta de algumas amostras biológicas destinadas à cultura e à antibiograma, como secreções vaginais, é utilizado um Swab. Após a coleta, eles são armazenados em um tubo que contém o meio de transporte (ex: meio Stuart – permite uma boa conservação de bactérias patogênicas como Salmonella spp. e Shigella spp.)
Swab
Teste de sensibilidade aos antimicrobianos (TSA)
Uma tarefa importante do laboratório de microbiologia clínica é a realização de testes de sensibilidade aos antimicrobianos a partir de isolados bacterianos. Os objetivos dos testes são detectar uma possível resistência aos antibióticos em patógenos comuns, nortear a escolha do antibiótico mais adequado a fim de predizer o sucesso do esquema terapêutico para infecções específicas.
Os testes usados incluem macrodiluição em tubos, microdiluição em caldo e o método de disco difusão. O método de disco difusão fornece flexibilidade e apresenta baixo custo. Cada método tem pontos fortes e fracos, incluindo organismos que podem ser testados com precisão pelo método. Alguns métodos fornecem resultados quantitativos (por exemplo, concentração inibitória mínima) e todos fornecem avaliações qualitativas usando as categorias de suscetível, intermediário ou resistente.
Em geral esses métodos são recomendados para ajudar a direcionar o tratamento do paciente. É importante ressaltar que a detecção precisa dos mecanismos de resistências das bactérias são utilizados para fins epidemiológicos e medidas de contenção destas bactérias resistentes.
Segundo a Agência Nacional de Vigilância Sanitária (2008): o TSA é sempre realizado na avaliação das seguintes bactérias:
- Enterobactérias
- Pseudomonas spp.
- Acinetobacter spp.
- Staphylococcus spp.
- Enterococcus spp.
- Streptococcus pneumoniae
- Streptococcus do grupo viridans e beta-hemolítico
- Haemophilus influenzae
- Complexo Burkholderia cepacia
- Stenotrophomonas maltophilia
- Neisseria gonorrhoeae e Neisseria meningitidis
Atenção
A padronização das etapas relacionadas à realização dos TSA (da escolha dos antibióticos até a interpretação dos resultados) é feita por organizações especializadas, que elaboram documentos, os quais apresentam com riqueza de detalhes como realizar e interpretar os testes de sensibilidade. Tais organizações são:
- Clinical and Laboratory Standards Institute (CLSI, EUA)
- European Committee on Antimicrobial Susceptibility Testing (EUCAST, Europa)
- Brazilian Committee on Antimicrobial Susceptibility testing (BrCAST, Brasil)
- British Society for Antimicrobial Chemotherapy (BSAC, Reino Unido)
- Comité de L’Antibiogramme de la Société Française de Microbiologie (CA-SFM, França)
A seguir, verificaremos as diferentes técnicas empregadas na realização dos TSA, trazendo algumas de suas vantagens e desvantagens.
Independentemente da técnica escolhida pelo laboratório de microbiologia, todas as etapas devem ser rigorosamente controladas. O bom emprego do controle de qualidade é a melhor forma de garantir a confiabilidade e reprodutibilidade dos resultados. Além disso, deve ser feito seguindo as normas de biossegurança.
Macrodiluição em tubos
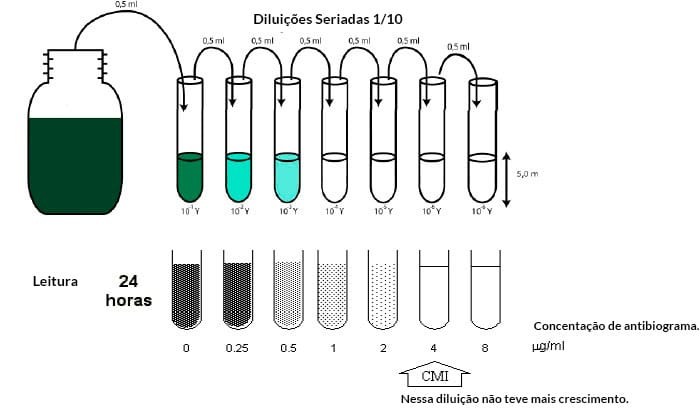
Um dos primeiros testes de susceptibilidade antimicrobiana desenvolvido foi a macrodiluição em tubos. Este procedimento envolve:
- Preparar diluições seriadas de antimicrobianos (por exemplo, 1, 2, 4, 8 e 16 microgramas/mL) em meio de cultura líquido.
- Inocular os tubos contendo antimicrobianos com uma suspensão bacteriana padronizada em torno de 5 X 105 UFC/mL.
- Incubar por de 18 a 24 horas, a 35°C.
- Examinar a presença de turbidez, que evidencia o crescimento microbiano. O primeiro tubo da série que apresentar aparência límpida (sem turbidez) representa a concentração inibitória mínima (CIM ou MIC).
CIM ou MIC
A sensibilidade dos microrganismos aos antimicrobianos é representada pela concentração inibitória mínima (CIM ou MIC) de cada microrganismo para cada antimicrobiano, que corresponde à menor concentração do antimicrobiano capaz de inibir o desenvolvimento visível do microrganismo.
A vantagem da macrodiluição em tubo é a geração de um resultado quantitativo (CIM ou MIC). As desvantagens correspondem ao trabalho manual que leva a possibilidade de erros durante o preparo de soluções de antibióticos para cada antibiótico testado, a quantidade relativamente grande de reagentes e o espaço necessário para cada teste.
Microdiluição em caldo
A técnica de microdiluição em caldo é a técnica de macrodiluição, realizada em placas estéreis de 96 poços. Essa adaptação tornou esse teste mais prático e popular. A seguir, o passo a passo desta técnica:
Passo 1
Preparar diluições seriadas de antimicrobianos (até 8 diluições logarítmicas) de até 12 antimicrobianos.
Passo 2
Inocular as bactérias a serem testadas obtendo-se uma concentração bacteriana final de aproximadamente 5 x 104 - 105 UFC/mL por poço.
Passo 3
Incubar as placas (também chamadas de painéis) de microdiluição a 35 ± 2ºC por 18 a 24 horas (dependendo do gênero bacteriano e do antimicrobiano testado).
Passo 4
Realizar a leitura da placa visualmente e, de preferência, com luminosidade ambiente, para facilitar a leitura, observando a turbidez.
Saiba mais
Poucos laboratórios de microbiologia clínica preparam suas próprias placas. Normalmente, os laboratórios compram painéis, com os antibióticos já liofilizados ou congelados nas diluições necessárias, de fornecedores comerciais. Além disso, alguns laboratórios clínicos utilizam a metodologia automatizada, que realiza essa análise através do MIC.
Vantagens do procedimento de microdiluição incluem a geração de um resultado quantitativo (CIM ou MIC), a reprodutibilidade dos resultados, a conveniência de poder utilizar painéis pré-preparados, e a economia de reagentes e espaço que ocorre devido à miniaturização do teste. A geração de relatórios computadorizados também é possível se um leitor de painel for utilizado. A principal desvantagem do método de microdiluição é a inflexibilidade das seleções de drogas disponíveis em painéis comerciais padrão, além do custo de cada placa de microdiluição.
Prova de sensibilidade com discos de papel em meio sólido
O teste de disco-difusão em ágar, também chamado de técnica de Kirby-Bauer em homenagem aos microbiologistas que descreveram este teste em 1966, é um dos métodos de sensibilidade mais simples, prático, confiável e mais utilizado nos laboratórios de microbiologia, fornecendo resultados qualitativos. A seguir, o passo a passo desta técnica.
Técnica
Toda a etapa deve ser realizada de forma estéril, seguindo as normas de biossegurança do laboratório.
Fonte do protocolo da técnica: (adaptado do NCCLS ‘M2-A8—Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved Standard—Eighth Edition (ISBN 1-56238-485-6). Cópias da atual edição podem ser obtidas no seguinte endereço: NCCLS, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898, USA):
Vamos ao passo a passo:
Método do crescimento
Após crescimento em placa de ágar (24 horas), selecionar de três a cinco colônias, bem isoladas, do mesmo tipo morfológico. A superfície de cada colônia é tocada com uma alça, e os microrganismos são transferidos para um tubo contendo 4-5 mL de NaCL 0,9% (salina) estéril.
Incuba-se a cultura na salina até alcançar a turbidez de uma solução padrão de McFarland 0,5.
Definição de escala de MacFarland:
Escala de nefelométrica de turvação. Essa é uma escala que possibilita verificar a concentração bacteriana pela intensidade de turvação do meio. Quanto maior a turvação do meio, maior a concentração bacteriana, maior opacidade e mais difícil é a passagem de luz.
Essa escala é composta de 11 tubos numerados de 0,5 a 10, onde o tubo 0,5 (indica uma concentração bacteriana de 1,0 a 2,0 x 108 colônias/mL. e o tubo 10 -30 x 108 colônias/mL). Ao preparar uma suspensão de bactérias para realização do antibiograma é feito a comparação visual com os tubos padrão da escala. A leitura é feita a olho nu utilizando um cartão de fundo branco com linhas pretas no fundo, ou então através de um espectrofotômetro.
Inoculação das placas de teste
Após a preparação da suspensão bacteriana, mergulha-se um swab de algodão estéril na suspensão. Essa etapa deve ser realizada em até 15 minutos após ajustar a turbidez da suspensão. O swab deve ser girado várias vezes e apertado firmemente contra a parede interna do tubo, acima do nível do líquido, o que ajuda a retirar qualquer excesso de inóculo no swab.
A superfície da placa de ágar Müeller-Hinton é inoculada esfregando o swab em toda a superfície estéril do ágar. Repete-se o procedimento esfregando outras duas vezes, girando a placa aproximadamente 60° cada vez, a fim de assegurar a distribuição uniforme do inóculo. Após a distribuição, passa-se um swab na margem de toda a placa de ágar, completando pelo menos uma volta completa.
A tampa pode ser deixada entreaberta de três a cinco minutos de maneira a permitir que qualquer excesso de umidade seja absorvido antes de se aplicar os discos impregnados de droga. No entanto, a placa não pode ultrapassar 15 minutos aberta.
Devemos evitar inóculos com alta concentração de bactérias. Nunca devemos usar culturas em caldo, não diluídas, do dia anterior, ou outros inóculos não padronizados para semear nessas placas.
Ágar Müeller-Hinton
Meio de cultura preconizado para os testes de sensibilidade da maioria das bactérias de interesse médico.
Aplicação de discos a placas de ágar inoculadas
O conjunto de antibióticos é previamente definido. Esses são discos de papeis de filtros impregnados com concentrações definidas de antibióticos. Os discos de antibióticos são colocados na superfície de placa de ágar anteriormente semeada, com auxílio de uma pinça ou com um dispensador. Ao ser colocado, cada disco deve ser pressionado de maneira a assegurar o contato completo do disco com a superfície de ágar. Os discos devem ser distribuídos mantendo a distância entre os centros de pelo menos 24 mm. Em geral, deve-se colocar 12 discos, no máximo, em uma placa de 150 mm, ou cinco discos em uma placa de 100 mm.
Algumas drogas difundem-se quase instantaneamente quando em contato com o meio. O disco não deve ser reaplicado após ter entrado em contato com a superfície de ágar. Em vez disso, coloque um novo disco em outra parte da placa.
As placas devem ser invertidas e colocadas em uma estufa, a 35° C, até 15 minutos após a aplicação dos discos. No entanto, no caso das cepas de Haemophilus spp., N. gonorrhoeae e dos estreptococos, as placas não devem ser incubadas em atmosfera enriquecida com CO2, porque os padrões de interpretação foram estabelecidos usando incubação em ar ambiente, e o CO2 irá alterar significativamente o tamanho dos halos de inibição de alguns antibióticos.
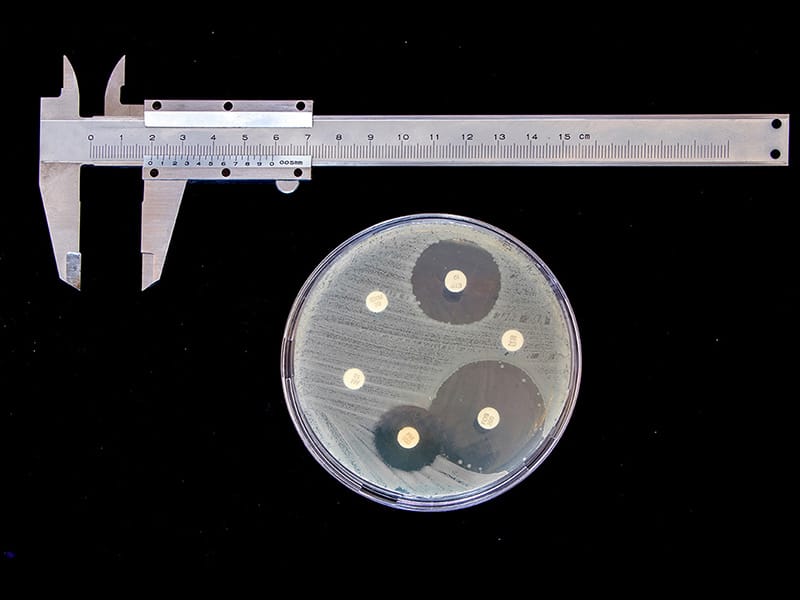
Leitura das placas e interpretação dos resultados
A leitura é realizada após 18 a 24 horas de incubação. Inicialmente, analisamos a superfície da placa para verificar se a semeadura foi satisfatória. Em seguida, os halos (diâmetros) devem ser medidos, em milímetros, com auxílio de paquímetro ou uma régua. Para isso, a placa deve ser invertida, e a régua ou o paquímetro apoiado na parte de trás da placa. As medidas devem ser feitas contra uma fonte luminosa.
Fonte luminosa
Normalmente, o teste de sensibilidade das espécies de estreptococos é feito adicionando sangue à base de ágar Müeller-Hinton . Nesse caso, os halos deverão ser medidos a partir da superfície superior do ágar iluminada com luz refletida, uma vez retirada a tampa. E não confundir o halo de hemólise, característico nessas bactérias com halo de inibição.
- Se a placa foi satisfatoriamente semeada, e o inóculo era correto, os halos de inibição resultantes serão uniformemente circulares e haverá um tapete confluente de crescimento. Se colônias individuais forem aparentes, o inóculo era demasiado leve e o teste deverá ser repetido.
- O halo de inibição é a área sem crescimento detectável a olho nu.
Cuidado:
- O crescimento de pequenas colônias, detectável apenas com lente de aumento, na margem do halo de inibição do crescimento deve ser ignorado.
- Crescimento discreto de colônias dentro de um halo de inibição, o teste deverá ser repetido com uma cultura ou subcultura pura de uma única colônia, isolada da placa de cultura primária. Se pequenas colônias continuarem a crescer no halo de inibição, o halo de inibição livre de colônias deve ser medido.
Com a medida de cada halo (diâmetro) a bactéria testada é classificada, como sensível, intermediário, ou resistente em relação aos agentes antimicrobianos testados, usando como comparação o tamanho dos halos preconizados pelas organizações internacionais (CLSI, BSAC e BrCAST).
Vantagens desse método: Simplicidade do teste; não requer nenhum equipamento especial; os resultados categóricos facilmente interpretados; flexibilidade na seleção de discos para teste; baixo custo e de fácil execução.
Desvantagens: Teste manual, sem automação; não pode ser utilizado para verificar a resistência a alguns microrganismos, pois falta padronização do método.
Exemplo: Para avaliar o perfil de sensibilidade do S. pneumoniae versus ceftriaxona, deve ser feito o teste do MIC (quantitativo). De acordo com o CLSI (2018), esse método não pode ser mais utilizado para verificar o perfil de sensibilidade da polimixina B nas bactérias gram negativas, pois a polimixina apresenta baixa difusão no Agar, sendo preconizado a microdiluição.
Qual é a acurácia aceitável de um teste de suscetibilidade?
Quando desejamos mediar a acurácia de um novo método de suscetibilidade, é importante testar um número representativo de cepas bacterianas resistentes a diferentes antibióticos e de cepas suscetíveis no novo método de suscetibilidade e no método padronizado. A partir desses resultados, conseguimos comparar e verificar se o método em estudo é capaz de detectar as bactérias que são verdadeiramente resistentes e sensíveis e determinar a taxa de erros que podem ser esperados em um ambiente de laboratório clínico.
O surgimento de novos mecanismos de resistências antimicrobianas, incluindo alguns que podem ser difíceis de detectar (por exemplo, susceptibilidade intermediária à vancomicina em S. aureus e produção de carbapenemase em alguns organismos gram-negativos) requer que o desempenho dos dispositivos de susceptibilidade seja constantemente reavaliado e atualizado quando necessário.
Acurácia
Refere-se ao grau em que o teste é capaz de determinar o verdadeiro valor do que está sendo medido.
Carbapenemase
Enzimas capazes de clivar os antibióticos da classe carbapenêmicos. Em infecções por bactérias gram-negativas resistentes à grande maioria dos antibióticos, os antibióticos carbapenêmicos (Imipinem e Meropenem) representam a única escolha para o tratamento eficaz. No entanto, nos últimos anos, algumas bactérias adquiriram resistência a esses antibióticos, diminuindo assim a possibilidade terapêutica e a necessidade de busca de novas drogas e métodos rápidos de confirmação da resistência bacteriana.
Teste de sensibilidade na prática
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Distinguir os métodos de visualização e coloração na prática laboratorial
Introdução
Vimos no módulo 1 que as características das células bacterianas, bem como sua morfologia, são essenciais para entendermos e aplicarmos as técnicas de coloração bacterianas. No entanto, uma vez que as bactérias são seres microscópios, não podemos enxergá-las a olho nu, e necessitamos do auxílio dos microscópios:
- Óptico – permitem aumentos de até 1000 vezes.
- Eletrônicos – permitem aumentos de 10.000 vezes (varredura) e 1.000.000 vezes (transmissão).
No dia a dia dos microbiologistas, a forma mais comum de se examinar os microrganismos é utilizando técnicas associadas ao microscópio óptico.
A resposta correta é “Não”!
De uma maneira geral, as bactérias vivas podem ser observadas quanto à forma e movimentos, a partir de material biológico em suspensão (uma gota) entre lâmina e lamínula (sem formar bolha). Esta preparação é conhecida como a fresco e exige um bom manuseio do microscópio por parte do microbiologista, uma vez que é necessário fazer ajustes de intensidade da luz, regular bem o condensador, se possível empregar filtros para uma melhora na qualidade da imagem a ser visualizada e, geralmente, utilizar um microscópio de campo escuro.
Correto!
De uma maneira geral, as bactérias vivas podem ser observadas quanto à forma e movimentos, a partir de material biológico em suspensão (uma gota) entre lâmina e lamínula (sem formar bolha). Esta preparação é conhecida como a fresco e exige um bom manuseio do microscópio por parte do microbiologista, uma vez que é necessário fazer ajustes de intensidade da luz, regular bem o condensador, se possível empregar filtros para uma melhora na qualidade da imagem a ser visualizada e, geralmente, utilizar um microscópio de campo escuro.
E quando preferimos este tipo de preparo?
Quando nossa intenção é visualizar a mobilidade e a morfologia de bactérias espiraladas, as quais sob fixação ficam distorcidas, ou até mesmo observar alterações na divisão celular e formação de esporos.
Como é de se esperar, na preparação a fresco, por não utilizar corantes, as bactérias são vistas sem cor (incolores), mesmos que estas sejam capazes de produzir cor quando cultivadas em meios de cultura específicos. Para uma melhor visualização da morfologia e citologia bacteriana, vários corantes passaram a ser utilizados e os microrganismos são corados após os microrganismos serem fixados na lâmina (mortos), na maioria das vezes, pelo calor, etapa chamada de fixação. A fixação permite que a bactéria fique aderida à lâmina e evita que as bactérias sejam lavadas e perdidas durante a coloração. No entanto, antes da etapa de fixação e coloração, devemos lembrar da importância da realização de um bom esfregaço, que deve ser:
- Pouco espesso
- Bem homogêneo
- Realizado em área de segurança biológica, a partir de um caldo ou material diluído em solução salina, espalhado com alça bacteriológica em lâmina limpa e seca
Atenção
Todas as manipulações devem ser feitas seguindo as normas de biossegurança e, de forma estéril, para não haver contaminação das amostras e resultados falso positivos. Ao final, todos os resíduos produzidos devem ser autoclavados antes de descartados.
As técnicas de coloração podem ser classificadas de acordo com o número de corantes utilizados em:
- Coloração simples: Quando utilizamos apenas um único corante para observar a morfologia bacteriana;
- Coloração diferencial: Quando utilizamos mais de um corante, além de mordentes e do diferenciador para identificar diferenças entre grupos de bactérias. Dentre os métodos (colorações) diferenciais, também chamados de seletivos, de maior importância dentro de laboratórios de Microbiologia Clínica, temos os de Gram, de Ziehl-Neelsen e de Albert-Laybourn. Além destes, destaca-se ainda o método de Fontana-Tribondeau, que, embora não seja diferencial, ainda é utilizado por alguns microbiologistas. Também existem métodos de coloração pouco utilizados, mas que podem ser úteis quando há necessidade de evidenciar algumas estruturas bacterianas, como a coloração de flagelos, esporos e cápsula.
Mordente
Substância utilizada durante a fixação que tem a função de manter a durabilidade da coloração.
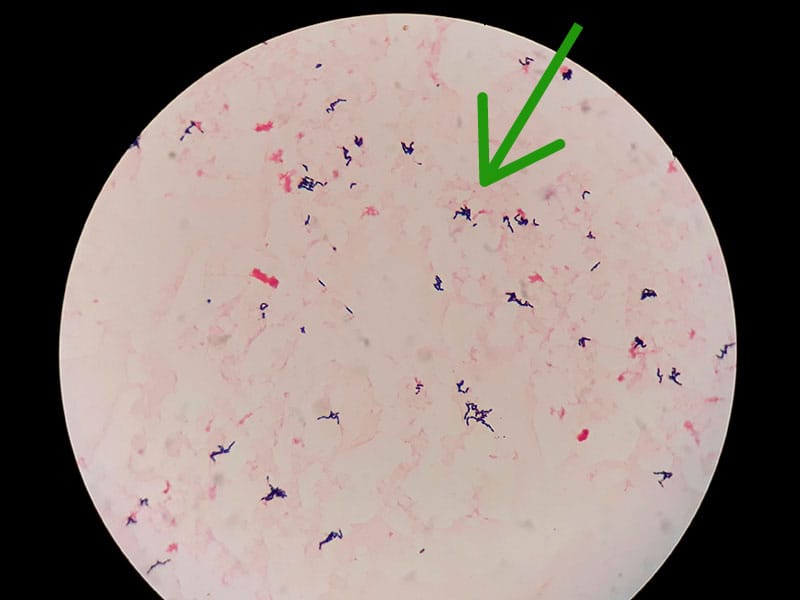
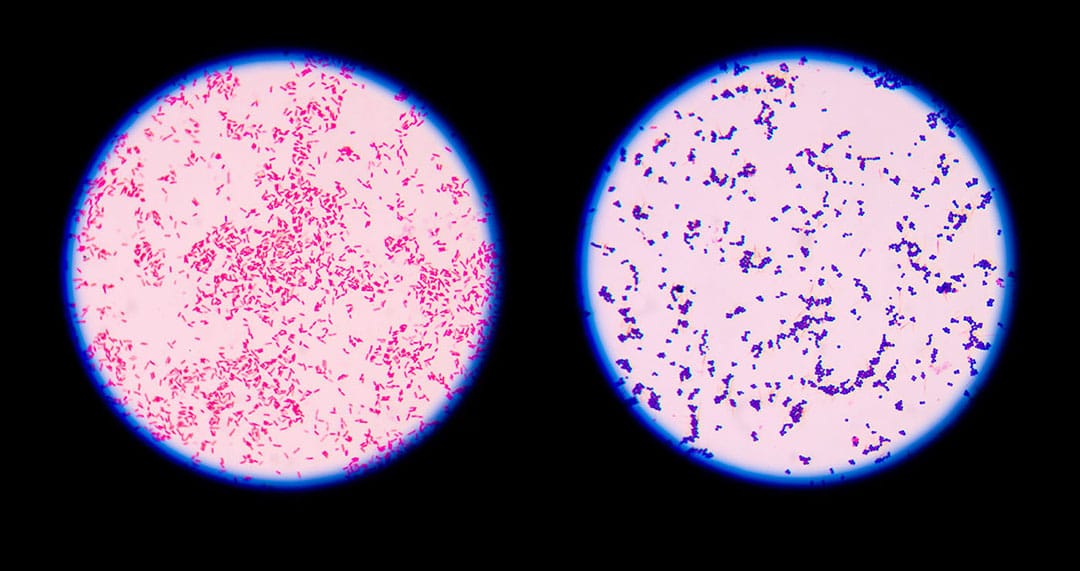
Coloração de Gram
Esta técnica foi desenvolvida em 1884, pelo médico dinamarquês Hans Christian Joachim Gram, e é a mais utilizada em bacteriologia por permitir distinguir bactérias gram-positivas de bactérias gram-negativas. Diferenças nas características químicas e estruturais das paredes celulares, bem como na permeabilidade aos reagentes químicos nestes dois grupos de bactérias levam a diferenças de coloração.
Como realizamos essa coloração? Vamos conhecer?
Na técnica de Gram, utilizamos:
|
Corante básico (violeta genciana, cristal-violeta, metilvioleta). |
|
Mordente (solução iodo-iodetada, conhecida como lugol) que aumenta a afinidade da célula pelo primeiro corante utilizado (corante básico). Ocorre assim a ligação do corante com o lugol e a formação de um composto roxo, insolúvel que cora o espaço protoplasmático e a parede celular de roxo. |
|
Agente descolorante (álcool a 95% ou álcool-acetona).
|
|
Segundo corante básico (safranina ou fucsina) que cora as bactérias gram-negativas, recentemente descoradas, de vermelhas. As gram-positivas permanecem roxas. |
Dessa forma, ao final da coloração de gram, as bactérias gram-positivas serão visualizadas no microscópio com cor roxa e as gram-negativas com cor vermelha. De uma forma geral, a literatura científica evidencia que, geralmente, os cocos de importância médica são gram-positivos (exceção do gênero Neisseria), e os bastonetes gram-negativos (exceção dos gêneros Corynebacterium, Listeria, Bacillus e Clostridium).
Atenção
É muito importante a utilização de culturas jovens para evitar resultados falsos.
A coloração de gram na prática
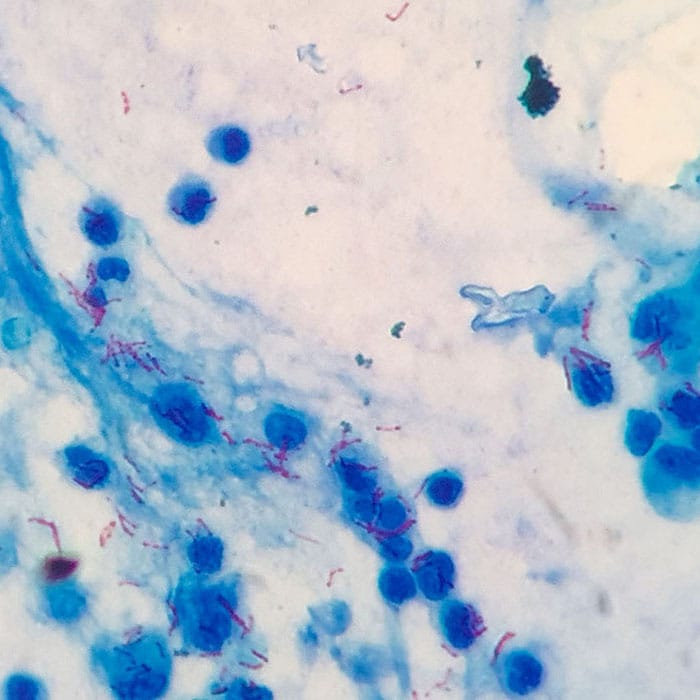
Coloração de Ziehl-Neelsen
No módulo 1, você aprendeu que existem bactérias cuja parede celular fogem da classificação como gram-positivas e gram-negativas, pois possuem acima da camada de peptideoglicanos, uma camada denominada Micolato Arabinogalactano, formada por polímeros de arabinogalactano (açúcares) e revestida por uma porção lipídica de ácidos micólicos. Esta constituição torna a parede celular hidrofóbica, dificultando a penetração de corantes aquosos, bem como a ação do lugol e, portanto, impedindo a identificação e a diferenciação desse tipo de bactéria através da coloração de Gram.
Entretanto, em 1882, um bacteriologista chamado Franz Ziehl e um patologista alemão Friedrich Carl Adolf Neelsen, evidenciaram que alguns gêneros bacterianos, como Micobacterium e Nocardia são capazes de resistir a descoloração com uma solução de álcool-ácido, após tratamento com fucsina fenicada aquecida, de forma que permanecem vermelhas, diferentemente de outras bactérias, que, por não possuírem esta propriedade, apresentam a cor do corante de fundo, normalmente, feita com azul de metileno.
Sendo assim, estes gêneros receberam a denominação de BAAR (Bacilos-Álcool-Ácido-Resistente), e esta capacidade de álcool-ácido-resistência está relacionada à hidrofobicidade da parede celular, assegurada pela presença de lipídeos como o ácido micólico. Quanto à coloração, esta ficou conhecida como coloração de Ziehl-Neelsen.
Como realizamos essa coloração? Vamos conhecer?
Na técnica de Ziehl-Neelsen, após a confecção do esfregaço, fixamos os esfregaços no calor. Após este passo, é depositado a solução de fucsina de Zieel e aquecemos o corante até a emissão de vapores (sem ferver), esse procedimento deve ser feito 3 vezes e deve durar até 5 minutos. Em seguida, lavamos a lâmina com água e realizamos a descoloração com solução de álcool-ácido clorídrico a 1%. Na sequência, o esfregaço deve ser coberto com azul de metileno, por meio minuto, a lâmina é lavada com água corrente e, após secar, está pronta para ser observada no microscópio óptico (objetiva 100 X). Os BAAR serão visualizados como bastonetes finos, vermelhos, sobre fundo corado em azul.
Saiba mais
A análise do escarro pela coloração de BAAR é um método simples, barato e muito importante para o diagnóstico da tuberculose, pois confere um resultado precoce (quando realizado de forma correta). Além disso, permite o acompanhamento a evolução do tratamento de pacientes com essa doença. Pacientes com sinais e sintomas (febre vespertina, tosse persistente por mais de 3 semanas, emagrecimento, com imagem no raio x) que apresentam bacilos gram-negativos no escarro em amostras coradas pela ZH indicam a presença do M. tuberculosis. No entanto, é importante destacar que outras micobactérias se coram por essa técnica e esse método. Para diferenciar as espécies, é necessário cultura.
Essa técnica pode ser realizada em outras amostras, como: urina, líquidos pleurais, lavado bronco alveolar, aspirado traqueal, biópsias e líquor.
Coloração de Albert-Laybourn
Algumas bactérias apresentam corpúsculos citoplasmáticos (corpúsculos metacromáticos ou corpúsculos de Babes Ernst) nas suas extremidades e que podem ser corados pelo Lugol forte (com cor marrom), em contraste com o corpo do bacilo, que se cora em esverdeado/azulado pela solução de Laybourn. Esta técnica é uma técnica simples que foi sugerida em 1920 por Henry Albert e, posteriormente, foi modificada por Ross Laybourn, em 1924.
Os corpúsculos citoplasmáticos são encontrados no gênero Corynebacterium diphtheriae, agente causador de sintomas clínicos característicos da difteria. Desta forma, a pesquisa por bacilos metacromáticos cuidadosamente coletados da oro e nasofaringe serve como um método auxiliar no diagnóstico da difteria.
Difteria
A difteria (ou crupe) é uma doença de origem bacterina, que acomete as amígdalas, laringe, faringe, nariz, conjuntiva e pele, causando amidalite com o aparecimento de placas bacterianas bem amareladas, dificuldades respiratórias e até mesmo parada respiratória com óbito. Essa doença é causada pela bactéria Corynebacterium diphtheriae e pode ser transmitida por meio das vias respiratórias ou então através de contato físico.
Como é feita essa coloração?
Após a obtenção do esfregaço, este é corado com a solução de Albert-Layborn durante 5 minutos. Após esse período, o corante deve ser retirado e a lâmina coberta com a solução de Lugol forte, por 2 minutos. Em seguida, com as lâminas secas, elas podem ser analisadas no microscópio. O resultado é considerado positivo quando há presença de grânulos metacromáticos no citoplasma de bacilos com morfologia em paliçada/letras chinesas. Tais achados sugerem bacilo diftérico e devem ser comunicados imediatamente ao médico.
Coloração De Fontana Tribondeau
O método foi desenvolvido em 1920, com objetivo de auxiliar a visualização de bactérias espiraladas (Leptospira interrogans e treponemas). Essas bactérias são muito delgadas e não coram completamente pela coloração de Gram. Esta coloração não é considerada verdadeira, pois consiste em uma técnica de impregnação pela prata. Atualmente, os laboratórios têm utilizado mais a microscopia de campo escuro a fresco para visualizá-las.
Como realizamos essa coloração? Vamos conhecer?
A partir de esfregaços finos, derramar sobre a lâmina algumas gotas da solução fixadora (renová-la 3 vezes, por 30 segundos). Em seguida, cobrir com solução mordente, aquecendo a lâmina até emitir vapores. Após 30 segundos, lavar em água corrente, acrescentar o nitrato de prata amoniacal, aquecendo rapidamente a lâmina até ocorrer novamente a emissão de vapores, deixando agir por 30 segundos (a preparação toma a cor marrom). Lavar bem em água corrente, secar com papel de filtro e examinar a lâmina ao microscópio com a objetiva de imersão (x100). As espiroquetas aparecem amarronzadas/negras, sobre um fundo amarelo-castanho ou marrom claro.
Coloração para flagelos
Como visto no módulo 1, os flagelos são estruturas bacterianas responsáveis pela locomoção e são constituídos por moléculas proteicas denominadas flagelinas. Entretanto, como são finos, delicados e se despolimerizam com facilidade, é necessário aplicar algumas técnicas para aumentar o diâmetro dos flagelos, de forma a torná-los visíveis pela microscopia. A demonstração do flagelo ocorre devido à ligação do corante ao ácido tânico, tornando-o mais espesso.
Como é feita a coloração? Vamos entender?
Segundo o protocolo descrito por Teva e colaboradores (2009):
|
Cultivar a bactéria em estudo, de acordo com suas preferências físicas, em uma placa de ágar infusão de cérebro-coração (BHI) ou em ágar tríptico de soja (com ou sem sangue). |
|
Coletar delicadamente uma alíquota do crescimento com uma alça de platina e transferi-la para um tubo, contendo cerca de 3 mL de água destilada. Inverter o tubo uma vez para homogeneizar a suspensão. Colocar uma gota desta suspensão sobre uma lâmina inclinada a 45o e deixar secar ao ar. |
|
Cobrir a lâmina com uma mistura de corantes, que inclui fucsina e ácido tânico (fórmula abaixo), e deixar por 5 minutos, até que um brilho metálico esverdeado cubra metade da área. Não deixar o corante secar sobre a lâmina. |
|
Retirar o corante, enxaguando com água. Secar e observar ao microscópio, com objetiva de imersão. |
Coloração para esporos com verde malaquita (Wirtz-Conklin)
Os esporos ou endósporos bacterianos consistem em uma parede espessa formada por vários envoltórios, no interior de algumas bactérias, altamente resistente ao calor, à dessecação e a outros agentes químicos e físicos, permitindo que a bactéria entre em um estado de latência por longos períodos. Este processo ocorre quando a bactéria está em condições adversas à sua sobrevivência.
A parede do esporo é impermeável, mas pode ser atravessada por corantes (como o verde de malaquita) quando submetidos ao aquecimento, o que confere aos esporos uma cor verde intensa. Associado a isso, essa estrutura não consegue ser descorada pela ação do álcool, mas as outras estruturas podem ser descoradas. Para melhorar a visualização e como contraste (contracorante), utiliza-se a safranina, que cora outras estruturas em vermelho, facilitando a diferenciação dos esporos.
Como é feita a coloração? Vamos entender?
Segundo o protocolo descrito por Teva e colaboradores (2009):
| Técnica para coloração de esporos |
|---|
|
Preparar esfregaço e fixar pelo calor. |
|
Cobrir o esfregaço com o corante verde malaquita. |
|
Aquecer água em um béquer, até a emissão de vapores. Colocar a lâmina sobre este béquer, mantendo o corante aquecido por 5 minutos. Alternativamente, cobrir a lâmina com verde malaquita e aproximar de uma chama até que desprenda vapor, sem deixar que o corante ferva. Afastar do fogo e, após 1 a 2 minutos, repetir a operação por 3 a 4 vezes. |
|
Lavar suavemente com água, evitando o choque térmico, que poderá quebrar a lâmina. |
|
Adicionar a solução de safranina por 30 segundos. |
|
Lavar e secar. |
|
Observar ao microscópio com objetiva de imersão. |
Coloração de cápsula
Como aprendemos, a cápsula envolve a parede celular, é produzida por algumas espécies bactérias e representa uma estrutura muito importante para a patogenicidade da bactéria. Isso porque, confere a ação antifagocitária, ou seja, funciona como um mecanismo de fuga da ação da fagocitose pelas células do sistema imunológico do indivíduo.
A cápsula é uma camada gelatinosa composta de açúcares ou polipeptídeos, com caráter hidrossolúvel, que pode ser facilmente removida durante as etapas de lavagem durante a coloração, o que dificulta a sua coloração. Além disso, a fixação dos esfregaços pelo calor, amplamente utilizado para as outras colorações, pode levar a contração da célula e a formação de um halo ao redor do microrganismo, que pode ser facilmente confundido com a cápsula. Entretanto, é possível visualizar bactérias produtoras de cápsula a partir da coloração pela tinta da china. Essa coloração é conhecida como coloração negativa, pois a cápsula rejeita as partículas do corante. Se as bactérias apresentarem cápsula, será possível verificar microrganismos descoradas envoltas por um halo (cápsula) sobre um fundo negro.
Vamos conhecer um pouco mais a coloração da tinta da China?
A seguir, o protocolo descrito por Teva e colaboradores (2009):
| Método da tinta da China (coloração negativa) |
|---|
|
As colônias suspeitas devem ser cultivadas em caldo rico (BHI). |
|
Colocar 1 ou 2 gotas de cultura em uma lâmina. |
|
Depositar na lâmina uma gota de tinta da China ao lado das gotas de cultura. |
|
Cobrir com uma lamínula, comprimindo-a entre folhas de papel de filtro, para se obter uma quantidade bem tênue de corante e material. |
|
Observar ao microscópio óptico (40X). |
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Ao longo desta jornada, compreendemos as características gerais das bactérias e relacionamos a sua morfologia e estruturas celulares com as diferentes técnicas de coloração, importantes e muito utilizadas nos laboratórios clínicos para identificação ou distinção de grupos bacterianos. Além disso, entendemos como os diferentes meios de cultura são úteis para identificação e crescimento bacteriano, bem como as vantagens e desvantagens de cada tipo de teste de sensibilidade a antimicrobianos, os quais permitem investigar resistência a um ou mais antibióticos utilizados na clínica.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu as características gerais das bactérias, as fases e os fatores que afetam o crescimento bacteriano
Reconheceu os tipos de meios de cultura, bem como os testes de sensibilidade aos antimicrobianos
Distinguiu os métodos de visualização e coloração na prática laboratorial