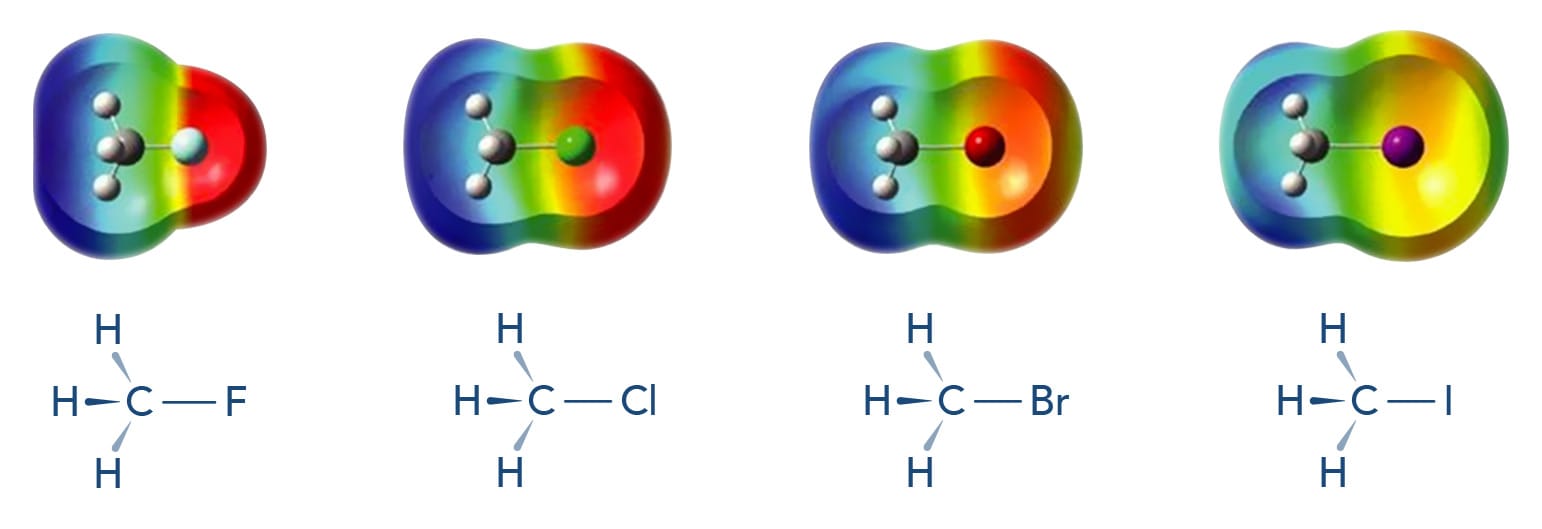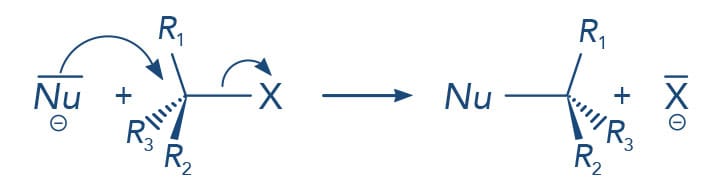Descrição
As características e as reações iônicas dos haletos de alquila.
PROPÓSITO
Conhecer os compostos orgânicos classificados como haletos de alquila, suas propriedades físico-químicas, nomenclatura e reatividade para a compreensão das reações de substituição nucleofílica e eliminação, que são importantes tanto em síntese orgânica quanto em processos bioquímicos.
Preparação
Antes de iniciar o conteúdo deste tema, tenha à mão a bibliografia recomendada e uma tabela periódica para entender termos específicos da área.
OBJETIVOS
Módulo 1
Identificar a estrutura, a nomenclatura, a classificação e as características dos haletos de alquila e seus mecanismos de reações iônicas
Módulo 2
Reconhecer a reatividade dos haletos de alquila e os tipos de reações de substituição nucleofílica
Módulo 3
Reconhecer os mecanismos que influenciam as reações SN1 e SN2
Módulo 4
Identificar características e fatores que influenciam a ocorrência das reações de eliminação
Introdução
A Química Orgânica estuda os compostos do carbono, um átomo que compõe milhares de substâncias importantes para a vida, como o DNA, as proteínas, os lipídeos e os carboidratos. O carbono também está nos produtos desenvolvidos em laboratório que facilitam o dia a dia das pessoas, como os diversos polímeros e medicamentos.
Mas como é feito o desenvolvimento desses medicamentos? A maioria dos medicamentos são compostos orgânicos sintéticos, mas o que são as reações orgânicas? Como ocorrem? Será que a inserção de uma metila em um composto é um processo simples? Que fatores influenciam essas reações?
O estudo da síntese orgânica é bastante vasto e complexo, precisamos começar pelo entendimento dos intermediários de reação e por reações altamente versáteis e funcionais como as substituições nucleofílicas e eliminações, sintetizando assim álcoois, éteres, ésteres, aminas, tioéter, nitrilas e alcenos nos processos de eliminação.
MÓDULO 1
Identificar a estrutura, a nomenclatura, a classificação e as características dos haletos de alquila e seus mecanismos de reações iônicas
Estrutura e nomenclatura dos haletos de alquila
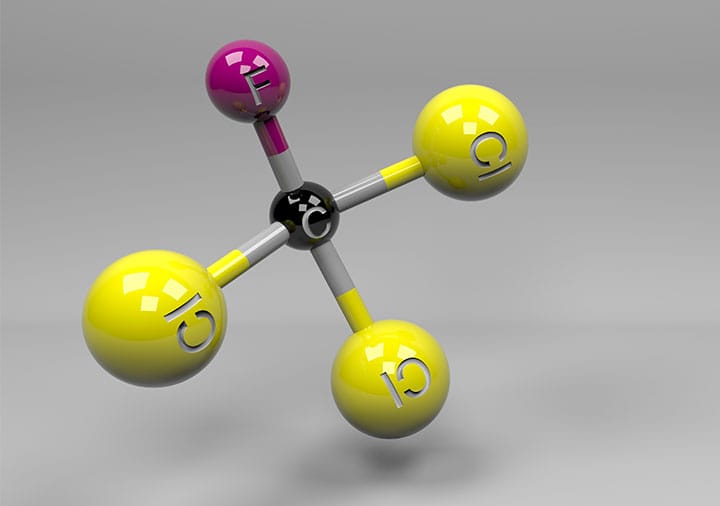
Haletos orgânicos, ou haletos de alquila, são compostos por um átomo ou grupo de átomos eletronegativos - um halogênio - ligado a um carbono com hibridização sp3. Esses compostos são importantes como intermediários de síntese orgânica e possuem diversas aplicações industriais e caseiras.
Dependendo do halogênio que está ligado à cadeia de hidrocarboneto, usamos designações específicas.
| Haletos de alquila: R-X (X = F, Cl, Br, I) | |||
|---|---|---|---|
|
R-F Fluoreto de alquila |
R-Cl Cloreto de alquila |
R-Br Brometo de alquila |
R-I Iodeto de alquila |
Veja alguns exemplos de haletos orgânicos:
Tetraclorometano, triclorometano e 1, 1, 1-tricloroetano. Eles são amplamente utilizados como solventes, na fabricação de plásticos, inseticidas e gás de refrigeração.
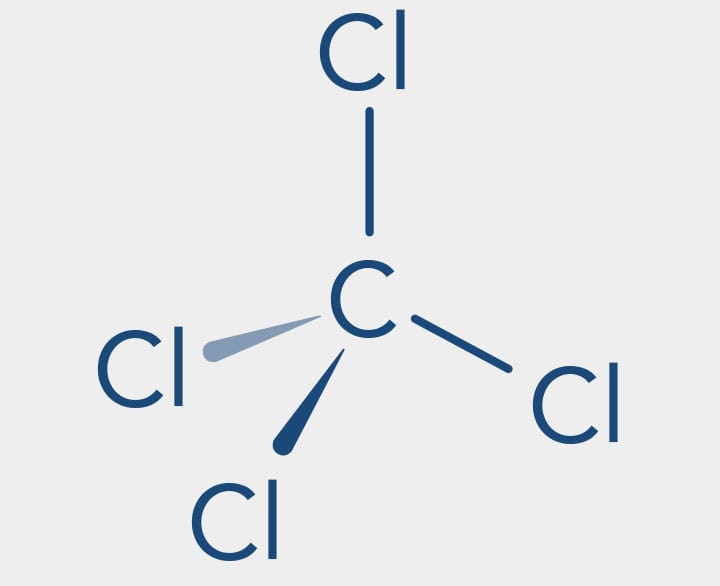
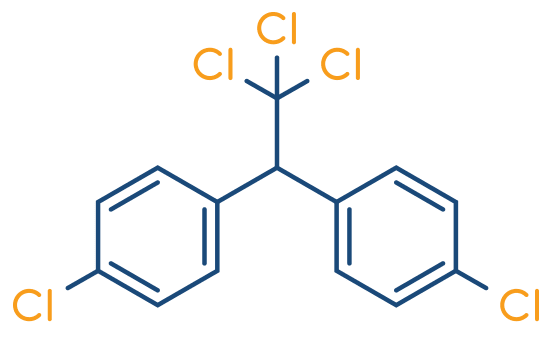
O DDT (diclorodifeniltricloroetano) é um inseticida que deixou de ser utilizado por ser altamente tóxico.
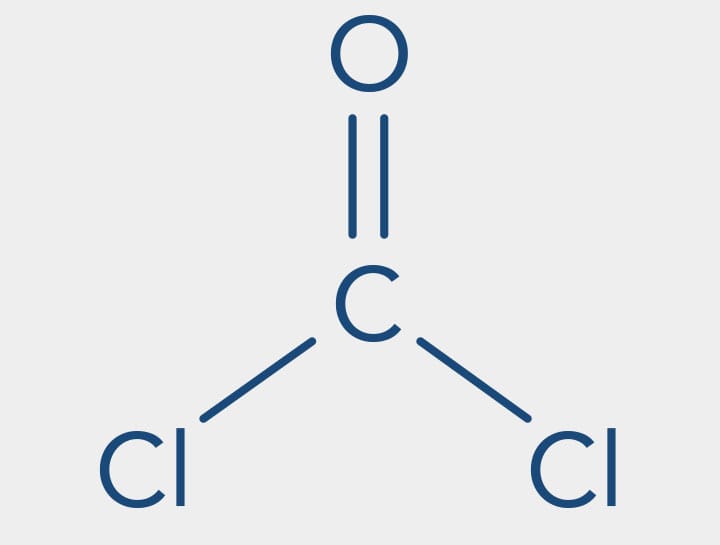
Durante a Primeira Guerra Mundial (1914-1918), os haletos orgânicos começaram a ser utilizados como armas químicas, um exemplo é o fosgênio - COCl2.
Os clorofluorcarbonetos - CFC ou Fréons® são formados por moléculas do tipo metano (CH4) e etano (H3C-CH3). Seus átomos de hidrogênio são substituídos por átomos de cloro e flúor. Os principais CFC são CCl3F (nome comercial CFC-11), CCl2F2 (CFC-12), CClF2CClF2 (CFC-114) e CClF2CF3 (CFC-115).
Os CFC já foram usados em compressores para refrigeração doméstica (por exemplo, em geladeiras), para expansão de polímeros e em produtos do tipo spray. Porém, eles estão sendo gradativamente substituídos por outros compostos, como os HFC - hidrofluorocarbonetos -, pois os CFC lançados na atmosfera são os principais responsáveis pela destruição da camada de ozônio.
Até agora, mencionamos os nomes de diferentes haletos de alquila. Mas como esses nomes são atribuídos a seus respectivos compostos?
A nomenclatura dos compostos halogenados pode seguir dois sistemas:
O nome do composto é formado citando-se o prefixo (fluoro, cloro, bromo e iodo) seguido do nome do composto principal. Caso o composto seja formado por mais de um halogênio, os mesmos devem ser citados em ordem alfabética e cada prefixo antecedido do número indicativo de sua posição.
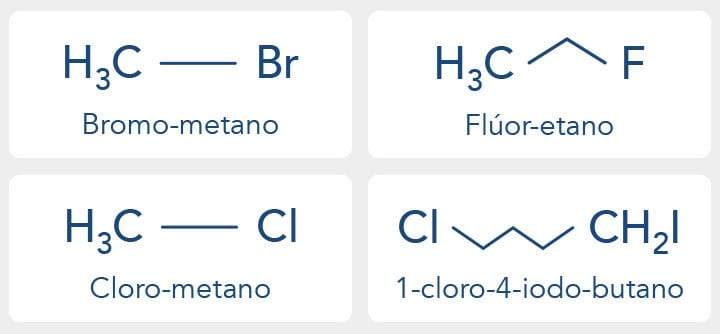
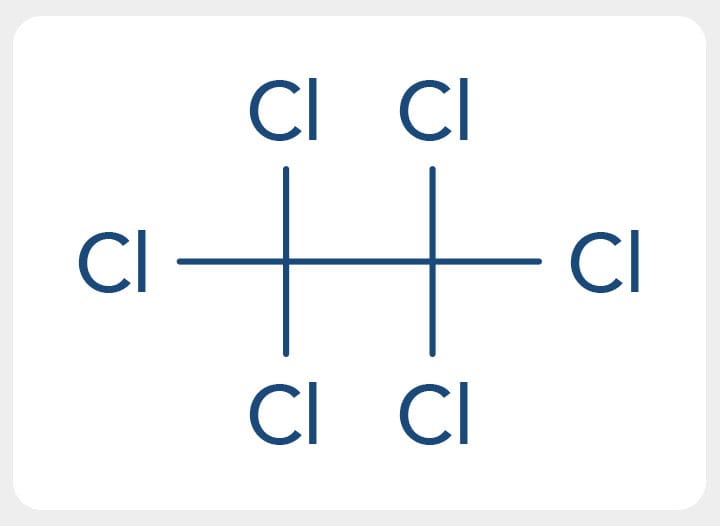
O prefixo "per" é utilizado para compostos que possuem todos os átomos de hidrogênio substituídos por halogênios, como exemplo o composto percloroetano (Cl3CCCl3).
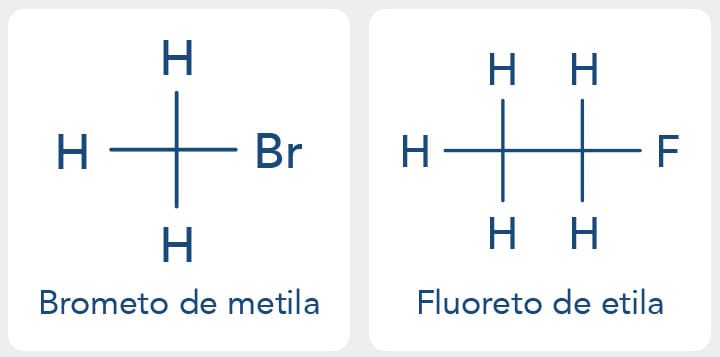
Os prefixos fluoreto, cloreto, brometo e iodeto são utilizados na nomenclatura radicofuncional, e estes prefixos são seguidos da preposição "de" e do nome do grupo alquila, exemplo: CH3Br - brometo de metila e CH3CH2F - fluoreto de etila.
Classificação dos haletos de alquila
Os haletos de alquila podem ser classificados em primários, secundários ou terciários de acordo com a classificação do carbono em que estão ligados.
Alguns exemplos favorecem o entendimento desta classificação:
1-clorobutano é um haleto primário, pois o átomo de cloro está ligado a um carbono primário quando o carbono é metílico, como no caso do cloreto de metila. Alguns autores classificam o haleto como metílico.
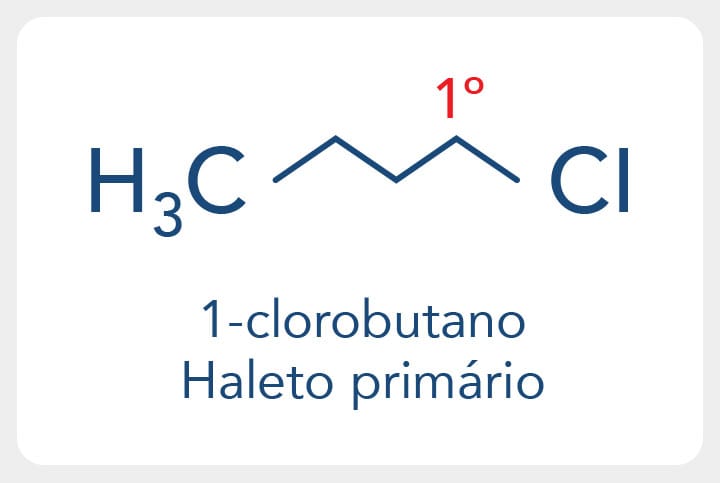
Haletos orgânicos secundários têm o halogênio ligado a um carbono secundário, como o 2-bromo-propano.
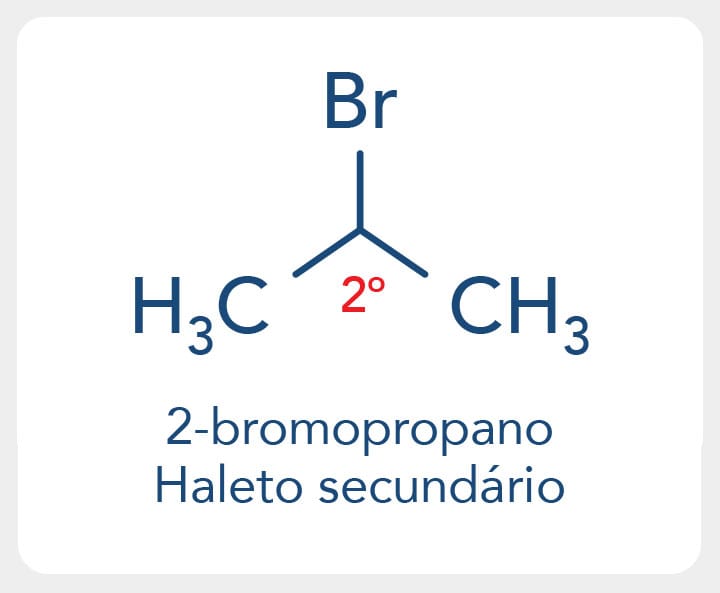
Os haletos terciários possuem o halogênio ligado a um carbono terciário, como o 2-iodo-2-metil-propano.
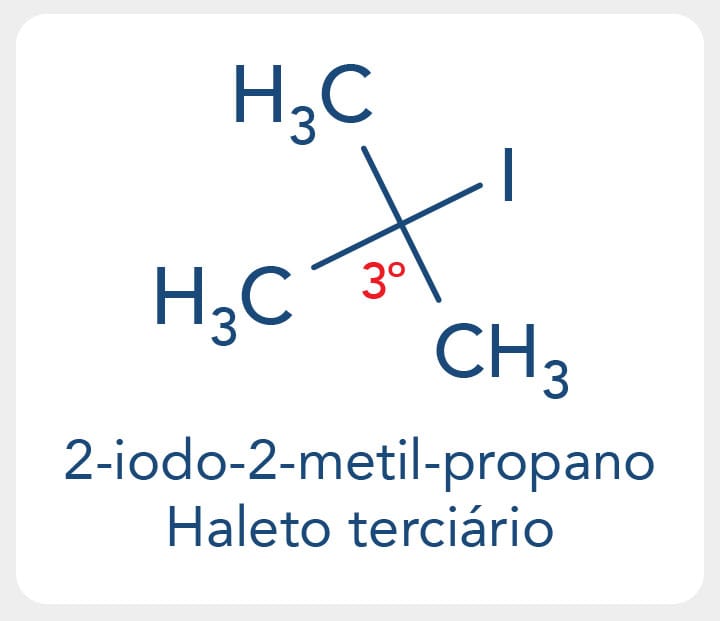
Podemos encontrar os termos haletos benzílicos e alílicos, quando o halogênio estiver ligado a um carbono vizinho a um grupo arila (aromático) ou a uma dupla ligação, respectivamente.

Características físico-químicas dos haletos de alquila
Sobre as propriedades físico-químicas dos haletos de alquila, podemos destacar a polarizabilidade, que é a capacidade de uma nuvem eletrônica se distorcer. Quanto maior o átomo, maior a polarizabilidade, pois mais fracamente este segura os elétrons na camada de valência. Quanto mais polarizável o átomo, mais forte são as interações de Van der Waals, o que influencia a solubilidade e os pontos de fusão e ebulição dos compostos. Desta forma, fluoretos de alquila apresentam menores ponto de ebulição do que os cloretos de alquila considerando a mesma cadeia alquílica.
Na figura e tabela a seguir, é possível verificar a força das ligações C-X e, a partir dos mapas eletrostáticos, visualizar que a polaridade (relacionada à diferença de eletronegatividade entre os átomos) é inversamente proporcional à polarizabilidade dos haletos de alquila.
Interações de Van der Waals
São interações intramoleculares do tipo dipolo-dipolo induzido.
| Ligação | Comprimento da ligação (Å) | Força da ligação | |
|---|---|---|---|
| kcal/mol | kJ/mol | ||
| C-F | 1,39 | 108 | 451 |
| C-Cl | 1,78 | 84 | 350 |
| C-Br | 1,93 | 70 | 294 |
| C-I | 2,14 | 57 | 239 |
Os compostos orgânicos halogenados apresentam baixa solubilidade em água e são bastantes solúveis em solventes pouco polares. Na síntese de fármacos, a adição de halogênios aumenta a lipossolubilidade dos novos análogos, aumentando a penetração dos novos compostos nas membranas biológicas. Porém, devido ao aumento do coeficiente de partição, há maior tendência de acúmulo destes fármacos no tecido adiposo.
A introdução de um halogênio ou um grupamento halogenado pode resultar na mudança de potência do composto, assim como sua posição na estrutura química.
Exemplo
A clonidina, com a sua substituição o,o-cloro (ED50 = 0,01 mg/kg) é mais potente que o análogo p,m-dicloro (ED50 = 3,00 mg/kg). Na clonidina, a imposição conformacional na estrutura feita pelos grupamentos volumosos o,o-cloro provavelmente é responsável pelo aumento de atividade observada.
Agora que já conhecemos a estrutura e as características dos haletos de alquila, vamos entender os princípios de reações iônicas nas quais os haletos de alquilas participam como um dos principais reagentes.
Introdução ao estudo dos mecanismos de reações iônicas
As reações orgânicas são transformações que ocorrem nos compostos orgânicos. Os principais tipos são as reações de adição, de substituição, de oxidação e de eliminação.
As reações ocorrem por meio da quebra de ligações dos compostos reagentes e a formação de outras novas ligações que darão origem aos produtos.
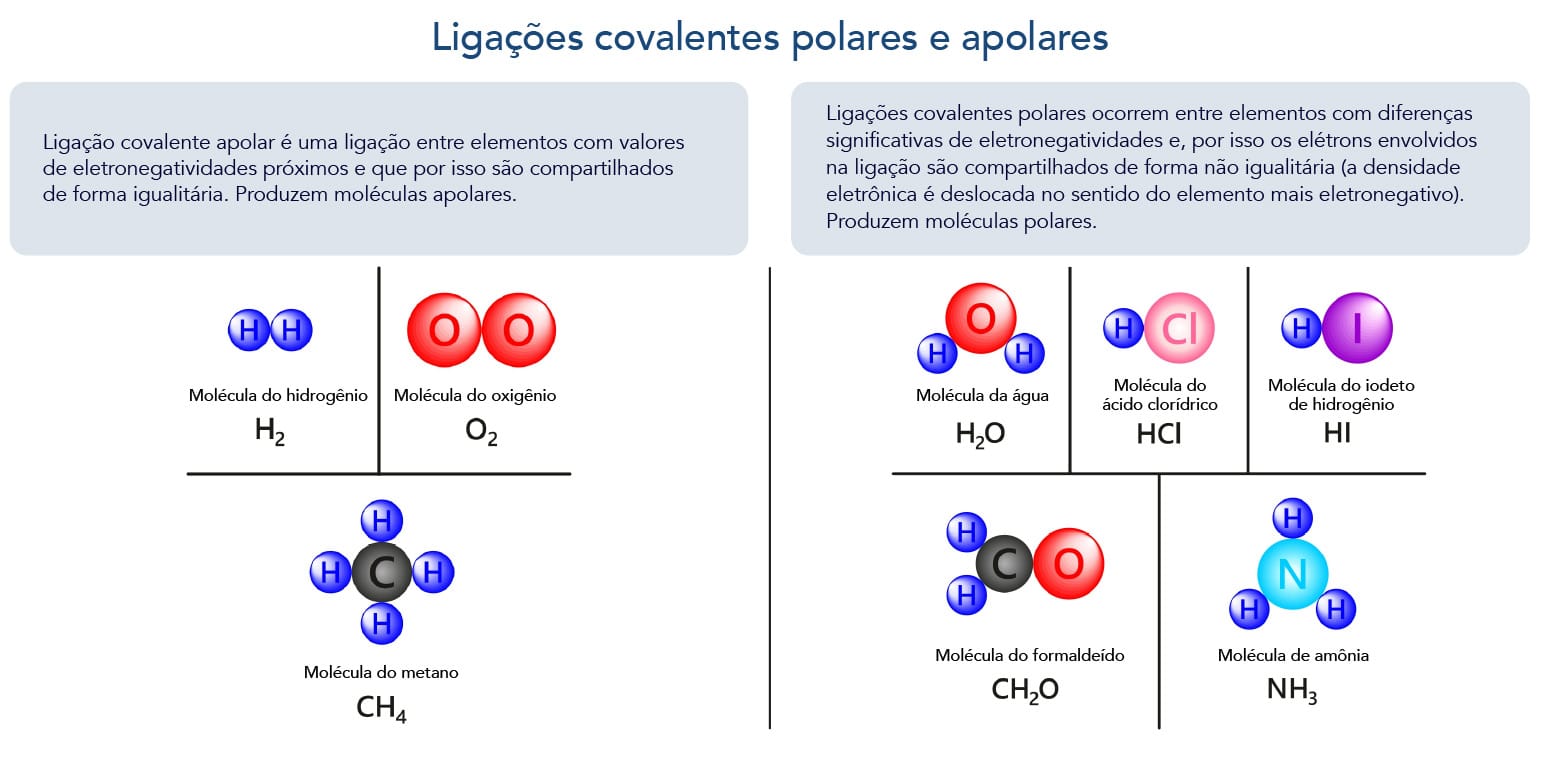
Em química orgânica, a maioria das ligações químicas são de natureza covalente. As ligações covalentes podem ser polares ou apolares. Quando um átomo atrai mais fortemente o par de elétrons em uma ligação do que outro, tem-se uma ligação covalente polar (ou dipolar: um polo positivo e um negativo). Moléculas em ligações polares existentes geram uma distribuição de densidades eletrônicas desiguais, são as denominadas moléculas polares.
Se não houver nenhum deslocamento líquido do par de elétrons, a ligação é covalente apolar. Compostos em que predominam as ligações covalentes apolares são classificados como compostos apolares.
Vejamos outros exemplos!
Alcanos, alcenos, alcinos e aromáticos que apenas possuem átomos de carbono e hidrogênio somente apresentam ligações apolares (a diferença de eletronegatividade entre o carbono e o hidrogênio é muito pequena, o que não gera um dipolo significativo); enquanto compostos orgânicos, como álcoois (R-OH), aminas (R-NH2), ácidos carboxílicos (R-COOH), possuem átomos de oxigênio e nitrogênio, que são mais eletronegativos que o carbono, gerando um dipolo e a polaridade da molécula. Mas existem compostos com estes elementos que não são significativamente polares, vejamos os éteres R-O-R1. Apesar de apresentarem o oxigênio, os dipolos tendem a se anular levando à apolaridade do composto.
Cisão homolítica e cisão heterolítica
Veja agora os tipos de quebra que as ligações químicas podem sofrer durante as reações químicas. As quebras de ligações químicas, também chamadas de cisões, podem ser:
A cisão homolítica ou homólise de uma ligação covalente é um processo que resulta na formação de radicais, espécies neutras e muito reativas que possuem um elétron desemparelhado.
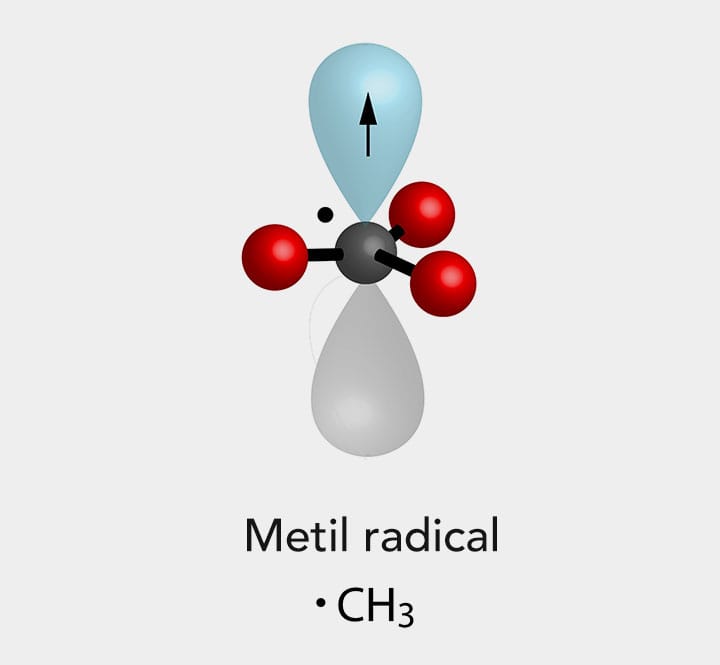
A equação a seguir representa uma homólise da ligação C-X:
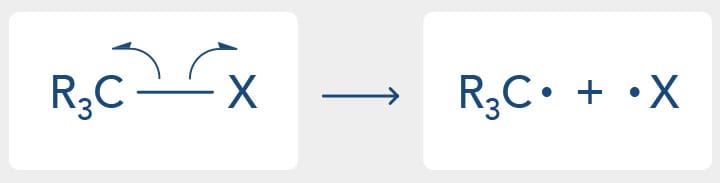
Como o nome já deixa entender, homo = igual. Ou seja, a ligação é quebrada em "partes iguais" e cada átomo fica com 1 (um) elétron.
Na cisão homolítica, temos a formação de radicais, também conhecidos como radicais livres, que são espécies instáveis e altamente reativas.
A homólise ocorre frequentemente em substâncias que apresentam ligações covalente apolares, onde não identificamos diferença de dipolos na ligação. É favorecida por altas temperaturas ou na presença de radiação eletromagnética, em especial radiações no UV (ultravioleta).
Os radicais livres são agentes oxidantes constantemente produzidos pelo nosso organismo e, em quantidades adequadas, são primordiais para o funcionamento adequado do sistema imunológico e de outros processos fisiológicos. Entretanto, quando se encontram em quantidades exacerbadas, eles reagem com estruturas de células saudáveis, danificando-as e, em alguns casos, levando à morte celular. São uma das responsáveis pelo envelhecimento precoce. A fim de regular a ação dos radicais livres, o organismo possui sistemas de defesa antioxidantes. A alimentação rica em substâncias antioxidantes (vitamina C (ácido ascórbico), flavonoides, vitamina A (retinol), vitamina E (tocoferóis), cobre, selênio e zinco.) é uma excelente medida para combater o envelhecimento precoce e outros males causados pelo excesso de radicais livres no organismo.
A cisão heterolítica (heterólise de uma ligação covalente) é um processo que resulta na formação de compostos orgânicos iônicos a partir de espécies com dois elétrons emparelhados (ânions, carbânions, nucleófilos), que são negativamente carregadas, e espécies positivas com o orbital vazio (cátions, carbocátions, eletrófilos).
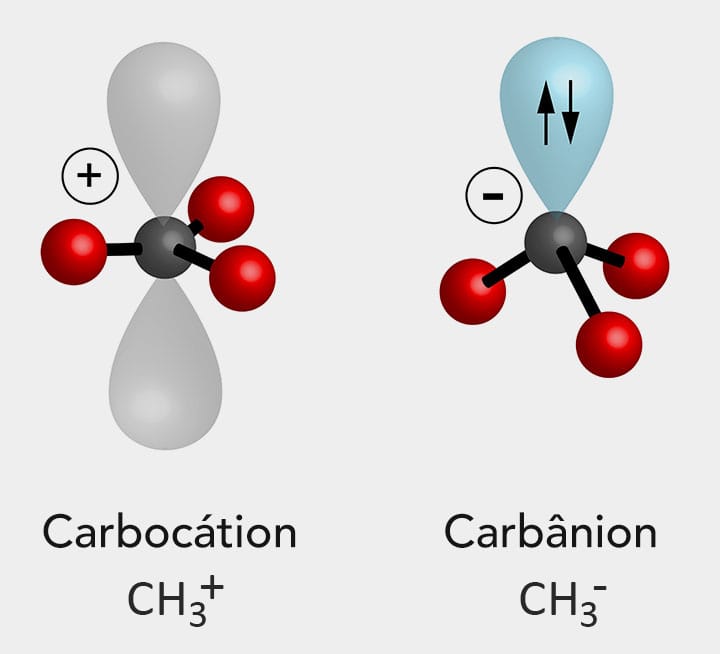
Em outras palavras, na cisão heterolítica, no caso de uma ligação se quebrar, um dos átomos recebe os dois elétrons da ligação, enquanto na reação homolítica após a quebra da ligação covalente cada átomo retém um elétron. O esquema da figura a seguir ilustra a ocorrência de uma cisão heterolítica.
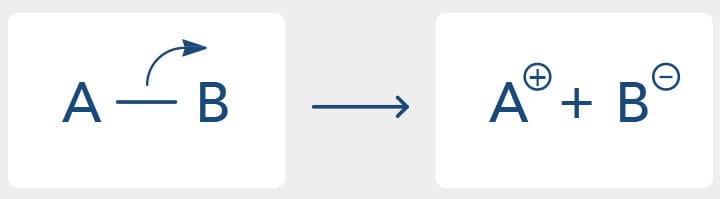
A cisão heterolítica ocorre principalmente em ligações polares. Comumente o átomo mais eletronegativo atrai os elétrons e recebe-os na quebra da ligação (conforme o exemplo da quebra da ligação H-F, como o flúor é mais eletronegativo que o hidrogênio, a quebra da ligação forma o ânion brometo e o cátion do hidrogênio - próton).
Observe na figura a seguir os símbolos que frequentemente utilizamos para representar o dipolo da ligação, demonstrando as cargas parciais positivas e negativas do hidrogênio e do flúor, respectivamente.

Substâncias antioxidantes
Tais como: vitamina C (ácido ascórbico), flavonóides, vitamina A (retinol), vitamina E (tocoferóis), cobre, selênio e zinco.
Para identificarmos os tipos de quebra de ligação, utilizamos setas para representar o movimento dos elétrons, a quebra e a formação de novas ligações. São setas curvas que podem ter a ponta da seta completa (seta com ponta dupla, representando o movimento de dois elétrons) ou a ponta da seta parcial (seta com apenas uma ponta, representando o movimento de um elétron).
Ponta da seta completa:

Ponta da seta parcial:

Nas reações iônicas, existem dois tipos de reagentes:
Espécie química que aceita um par de elétrons para formar uma nova ligação por ter uma carga positiva ou parcialmente positiva (δ+). Mesmo que neutros, possuem orbitais vazios capazes de receber elétrons (ácidos de Lewis). Exemplos: íon hidrônio (H3O+, dos ácidos de Brønsted-Lowry), trifluoreto de boro (BF3), cloreto de alumínio (AlCl3) e as moléculas de halogênio flúor (F2), cloro (Cl2), bromo (Br2) e iodo (I2).
Espécie química que doa um par de elétrons para formar uma nova ligação por ter uma carga negativa efetiva (ânion) ou parcialmente negativa (δ-). De forma geral, os nucleófilos são ânions ou espécies que possuem um átomo com pares de elétrons isolados. Exemplos: ânions halogênio (I-, Cl-, Br-), íon hidróxido (OH-), íon cianeto (CN-), amônia (NH3), aminas (R-NH2) e água (H2O).
ESTABILIDADE DOS INTERMEDIÁRIOS DE REAÇÃO
Assista ao vídeo a seguir para saber mais sobre a estabilidade dos intermediários de reação.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer a reatividade dos haletos de alquila e os tipos de reações de substituição nucleofílica
Reatividade de compostos orgânicos

Os compostos alifáticos podem conter apenas átomos de carbono e hidrogênio, sendo classificados como hidrocarbonetos não funcionais. Podem também apresentar pelo menos um outro elemento X, um heteroátomo, sendo classificados como compostos com grupos funcionais.
A reatividade dos compostos orgânicos envolve, portanto, a quebra de ligações C-H, mais raramente C-C, e da ligação C-X, que pode ser atacada com maior facilidade do que uma ligação C-H, devido à sua polarização e à alta estabilidade termodinâmica da ligação C-H. Desta forma, em compostos alifáticos R-X, a substituição do grupo X geralmente ocorre mais facilmente e de forma mais controlada do que a substituição C-H, que requer condições mais enérgicas.
Reatividade dos haletos de alquila
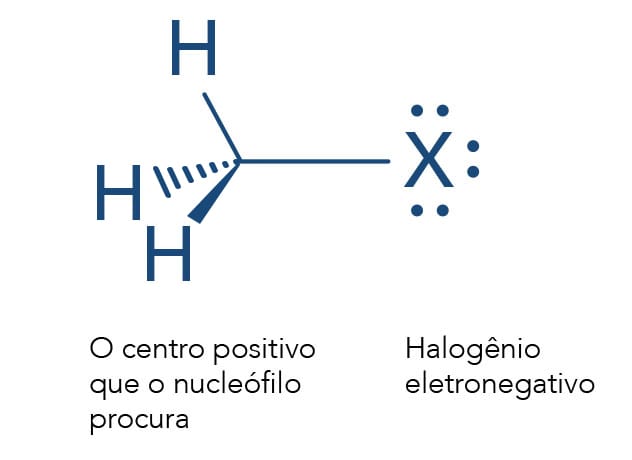
Para os compostos alifáticos funcionais R-X, onde X é um elemento do grupo 17, sabemos que a eletronegatividade do elemento X e do carbono no qual está ligado são diferentes. O halogênio X terá maior eletronegatividade que o carbono, o que levará à polarização dessa ligação, gerando uma carga parcial positiva no carbono (representado por +). A presença deste local deficiente de elétrons na molécula favorece o ataque de espécies negativas ou parcialmente negativas (δ-), os Nucleófilos (Nu- ou Nu:). Em reações de substituição nucleofílica, o Nu- substitui o X, também conhecido como grupo abandonador ou grupo de saída.
Tosila:
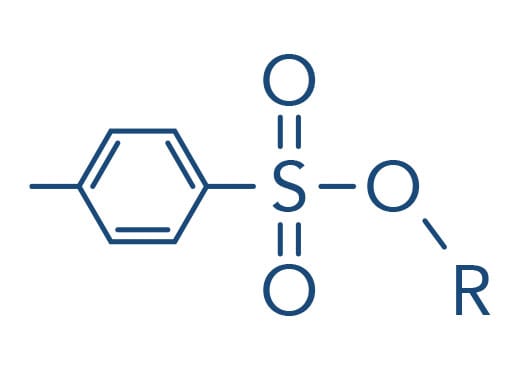
Mesila:
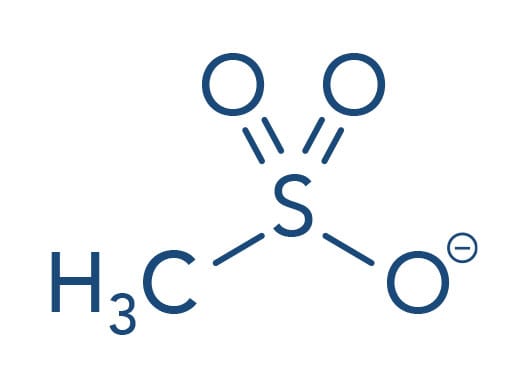
Para entendermos melhor a substituição nucleofilica (SN), já citamos que o carbono fica positivado devido ao grupo puxador de elétrons X ligado a ele. Assim, um reagente Nu- negativo ou parcialmente negativo é capaz de atacar os orbitais eletrônicos do carbono positivado, ou seja, um carbono com déficit de elétrons.
A letra N no símbolo SN para esta classe de reação é de "nucleofílica". Como já vimos anteriormente, a condição para ser um nucleófilo, em geral, é a disposição de pelo menos um par de elétrons não ligado que é utilizado para estabelecer a nova ligação ao carbono. Além disso, este par de elétrons deve alcançar o centro reativo C δ+ com certa facilidade, que é o caso em elétrons de orbitais exteriores de alta polarizabilidade. Uma dificuldade geral na execução da SN envolve a vizinhança do C funcionalizado (também chamada de posição ß). Por exemplo, se as cadeias ligadas diretamente ao centro eletrofílico próximas a ele forem muito volumosas, causam um impedimento espacial (ou impedimento estérico), o que dificulta o ataque do nucleófilo ao carbono C δ+.
A tabela a seguir apresenta vários exemplos de nucleófilos que podem participar deste tipo de reação nucleofílica. Como pode ser visto, a reação é útil para conversão de haletos de alquila em uma grande variedade de compostos orgânicos: álcoois, éteres, ésteres, nitrilas, aminas, alquinos, tióis, tio éteres e até hidrocarbonetos.
| Nucleófilo | Produto formado | Função orgânica |
|---|---|---|
| HO- | R-OH | Álcool |
| R'O- | R-OR' | Éter |
| R'COO- | R'COO-R | Éster |
| CN | R-CN | Nitrila |
| R'NH2 | RR'NH | Amina |
| R'C≡C- | R'C≡CR | Alquino |
| HS- | R-SH | Tioálcool ou Tiol |
| R'S- | R'S-R | Tioéter |
| R'-(R'Li) | R'-R | Hidrocarboneto |
Avançando um pouco mais na compreensão de como ocorrem as reações dos haletos de alquila, veremos que estes compostos podem sofrer três tipos de reações:
Substituição Nucleofílica
Eliminação
Oxidorredução
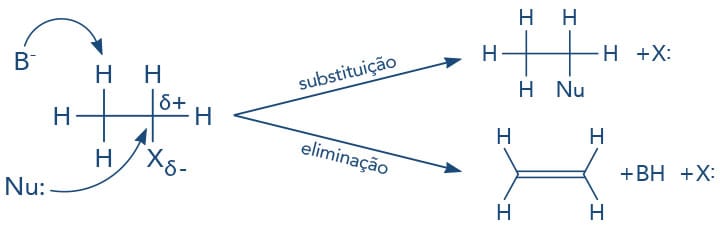
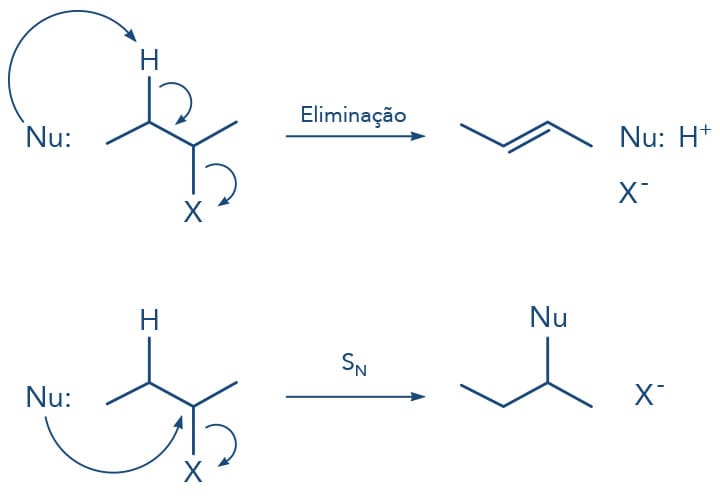
Abordaremos as reações de substituição e eliminação, assim como seus mecanismos e os fatores que influenciam as reações. Observe a seguir um esquema geral que apresenta os produtos das reações de substituição - reação do haleto de alquila com nucleófilo (Nu:) - e de eliminação - quando um próton do haleto de alquila é subtraído por uma base (B-).
Reações de substituição nucleofílica (SN)
Está claro que a presença do halogênio mais eletronegativo que o carbono polariza esta ligação deixando o carbono parcialmente positivo, sendo reativo para o ataque de reagentes nucleofílicos. O halogênio é o grupo de saída (S), também conhecido como grupo abandonador (GA) ou grupo de saída (GS), neste tipo de reação chamada de substituição nucleófilica (SN).
As reações de SN podem ser de dois tipos: SN2 - substituição nucleofílica bimolecular e SN1 - substituição nucleofílica unimolecular.
O mecanismo da substituição nucleofílica predominante dependerá de fatores como: a estrutura do haleto de alquila, a reatividade do nucleófilo, a concentração do nucleófilo e o solvente da reação. Iremos detalhar e analisar cada fator em nosso estudo.
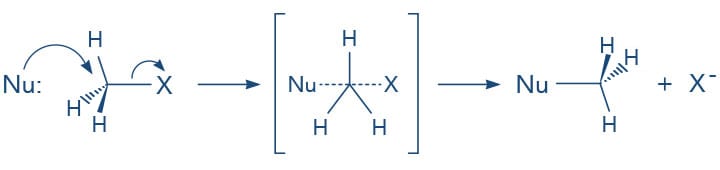
A reação do tipo SN2 - substituição nucleofílica bimolecular
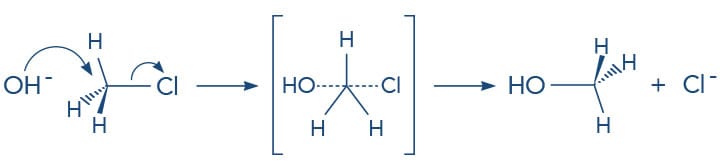
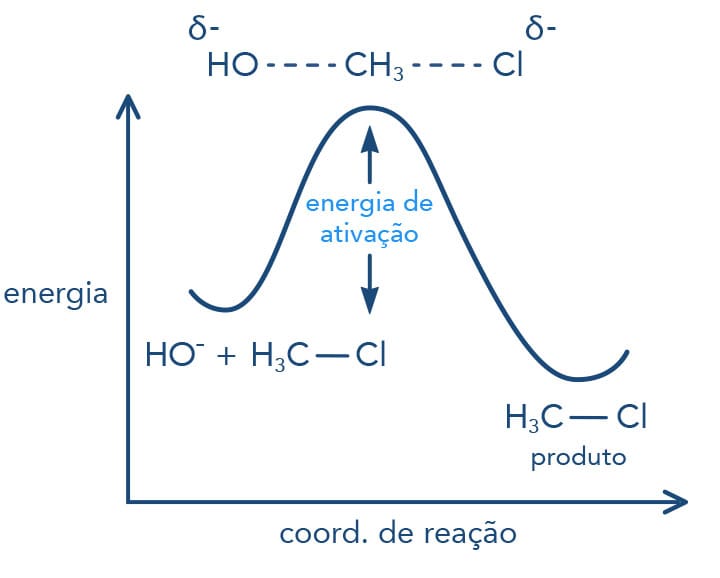
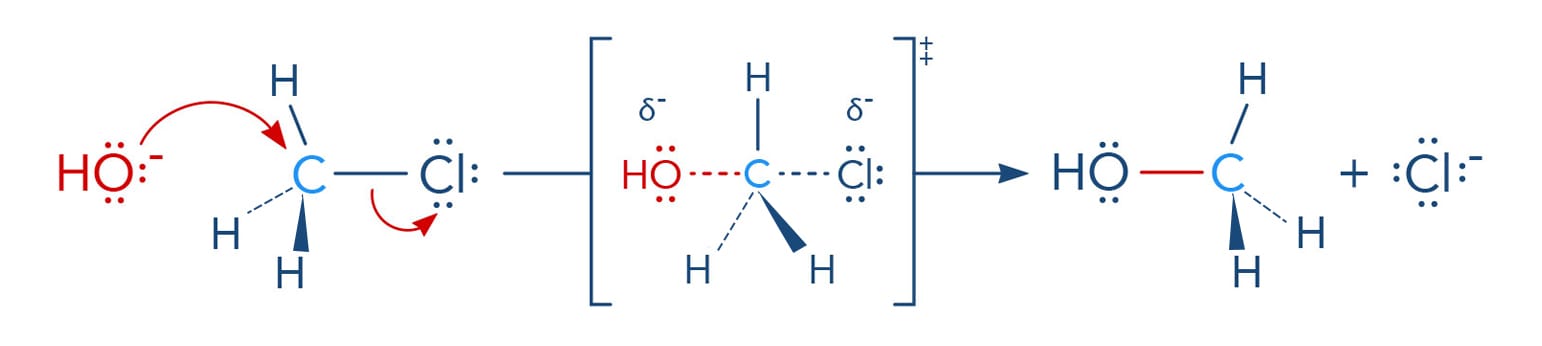
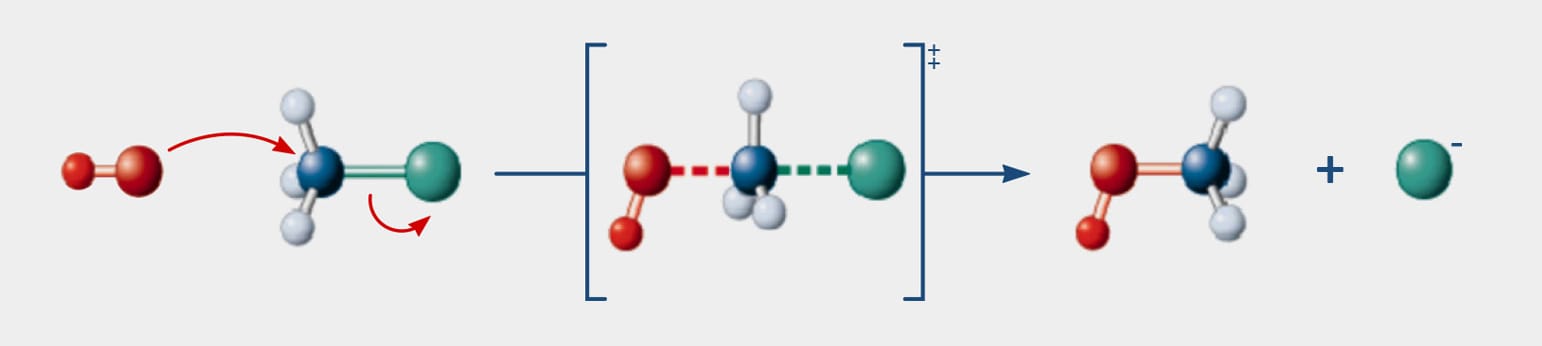
A reação do tipo SN2 ocorre por um mecanismo concertado, de forma que o nucleófilo é atraído pela carga parcial positiva do carbono ligado ao grupo de saída. Enquanto o nucleófilo se aproxima do carbono para formar uma nova ligação, a ligação carbono-halogênio se rompe de forma heterolítica, ou seja, uma nova ligação está se formando enquanto a ligação carbono-halogênio está se rompendo - tudo ao mesmo tempo, como podemos verificar pelas linhas pontilhadas no esquema a seguir.
Importante entender que a linha cheia significa ligação existente enquanto a linha pontilhada, ligação sendo quebrada ou formada em uma representação do estado de transição na reação.
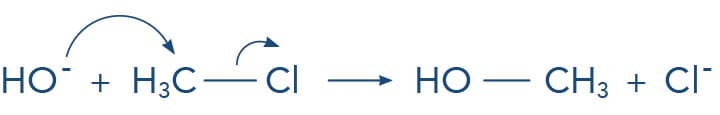
A reação a seguir evidencia o ataque do íon hidroxila (nucleófilo) ao cloreto de metila, levando à substituição do átomo de cloro (grupo de saída) pela hidroxila, formando o álcool - metanol. Acompanhe o esquema para entender todo o processo.
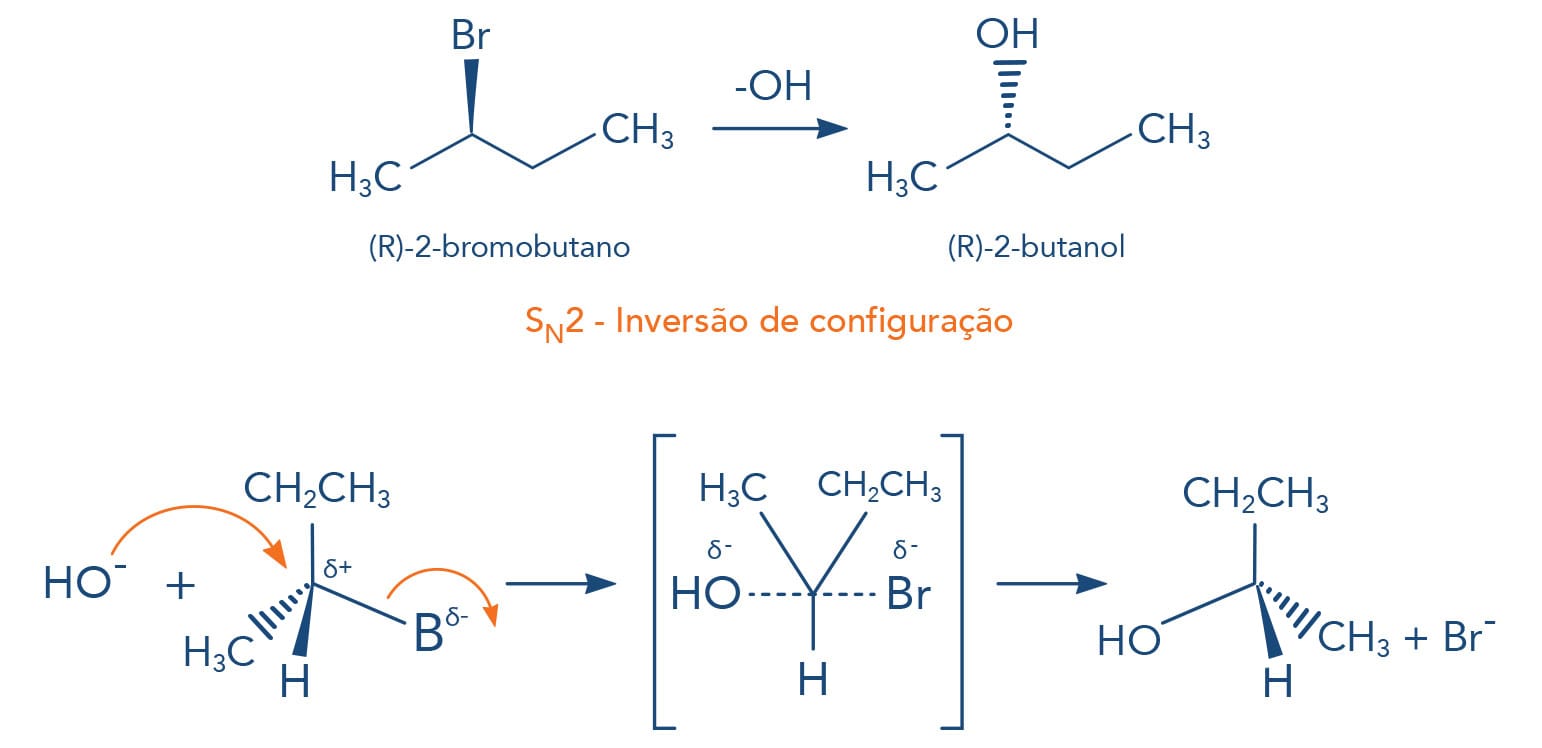
Vamos detalhar o mecanismo: devemos lembrar que no íon hidróxido que o átomo de oxigênio possui um elétron a mais na sua camada de valência, o que lhe confere carga negativa; a molécula do cloreto de metila possui o carbono parcialmente positivo, devido à ligação como o cloro, que atrai os elétrons do ânion hidroxila. Ao mesmo tempo, a hidroxila forma uma nova ligação com o carbono enquanto do lado oposto a ligação carbono-cloro se desfaz. Ao final da reação, verificamos que a hidroxila se ligou ao carbono, que teve sua configuração invertida, e o íon cloreto se formou. A observação do estado de transição deixa claro o termo: reação concertada.
A reação do tipo SN2 é uma reação de cinética de 2ª Ordem, em que a velocidade da reação é diretamente proporcional à quantidade do substrato e do reagente, ou seja, a velocidade da reação depende tanto da concentração do haleto de alquila quanto do nucleófilo/reagente.
Velocidade = k. [haleto de alquila]. [nucleófilo]
Onde k é a constante de velocidade da reação
Para a reação citada anteriormente, a Velocidade = k. [CH3Cl]. [-OH] e o estudo de sua velocidade estão citados na tabela a seguir.
| Reação | Concentração do substrato [CH3Cl] | Concentração do nucleófilo [OH] | Velocidade inicial (mol L-1s-1) |
|---|---|---|---|
| 1 | 1 x 10-3 | 1 | 4,9 x 10-7 |
| 2 | 2 x 10-3 | 1 | 9,8 x 10-7 |
| 3 | 1 x 10-3 | 2 | 9,8 x 10-7 |
| 4 | 2 x 10-3 | 2 | 419,6 x 10-7 |
A análise dos dados da tabela anterior esclarece a cinética de 2ª ordem. A velocidade da reação aumenta quando a concentração do substrato e/ou do nucleófilo aumenta. Isto é observado nas reações 2 e 3. Na reação 4, podemos ver que o dobro da concentração do substrato [CH3Cl] e do Nu aumenta a velocidade da reação em quatro vezes.
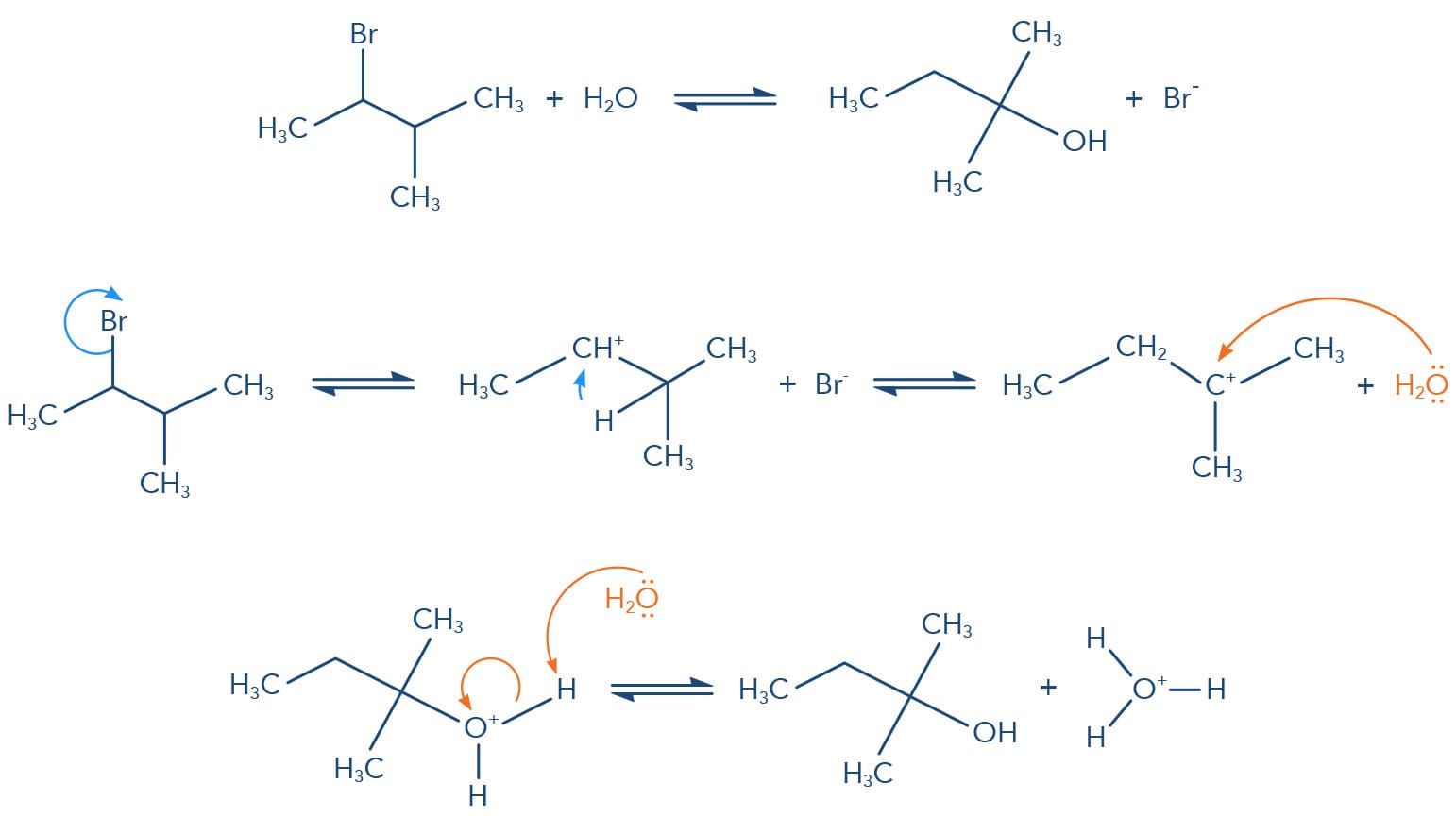
A reação do tipo SN1 - substituição nucleofílica unimolecular
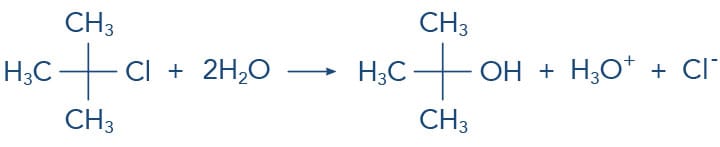
Considerando nossos estudos sobre a reação de substituição nucleófilica e o mecanismo SN2, se fôssemos questionados sobre a reação de um haleto terciário, como o cloreto de terc-butila, com um nucleófilo fraco como a água, rapidamente afirmaríamos que esta reação não ocorre. Para nossa surpresa, esta reação é extremamente rápida e favorecida, mas por outro mecanismo: o mecanismo SN1 - substituição nucleofílica unimolecular. Esse mecanismo apresenta cinética de 1ª Ordem, onde apenas uma espécie o haleto de alquila, está envolvida na etapa lenta (determinante) da reação.
Velocidade = k. [haleto de alquila]
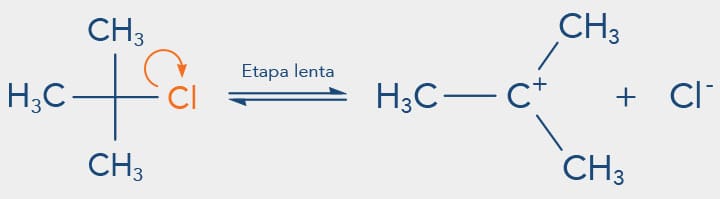
A etapa lenta das reações do tipo SN1 envolve a formação de um intermediário carbocátion a partir da cisão heterolítica da ligação entre o halogênio e um carbono no qual estava ligado.
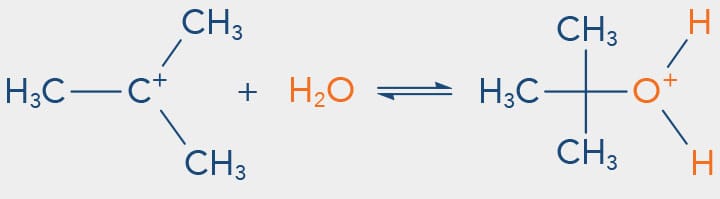
Vamos observar no esquema a seguir a reação de substituição nucleofílica do SN1 que ocorre com o cloreto de terc-butila em água:
No mecanismo SN1, a primeira etapa é a determinante da reação, ou seja, a velocidade da reação depende de a capacidade do grupo de saída quebrar a ligação com o carbono levando à formação de uma carbocátion. Quanto mais estabilizado o carbocátion mais favorecida será esta etapa. A presença de substituintes alquila neste carbono aumenta a sua estabilidade pelo efeito doador de elétrons fraco e pelo efeito de hiperconjugação dos grupos de alquila (forças de Van der Waals). Desta forma a reatividade dos haletos de alquila frente ao mecanismo SN1 é:
(mais reativo) Haleto de alquila terciário > haleto de alquila secundário > haleto de alquila primário > haleto de alquila metílico (menos reativo)
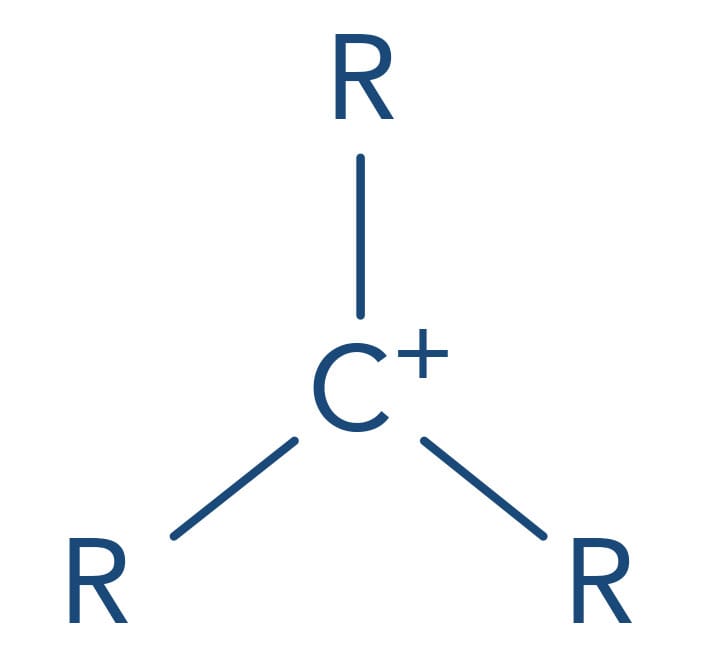
Terciário
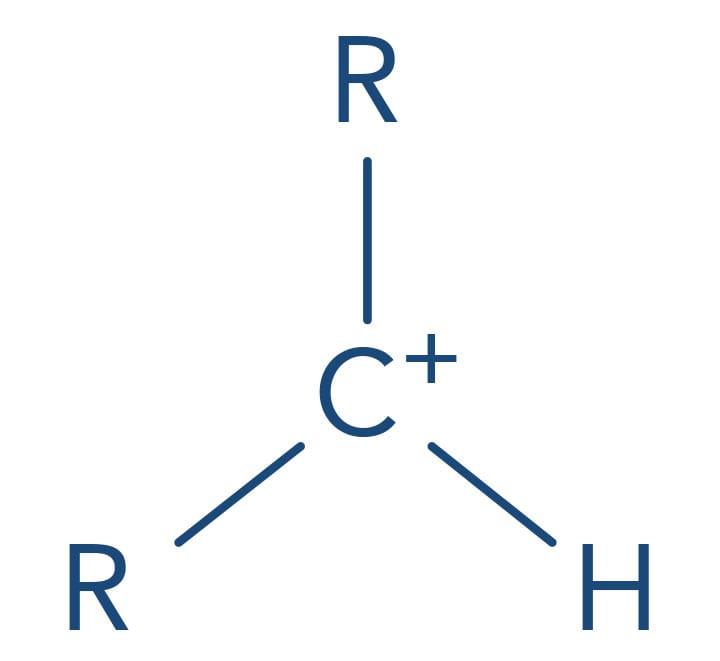
Secundário
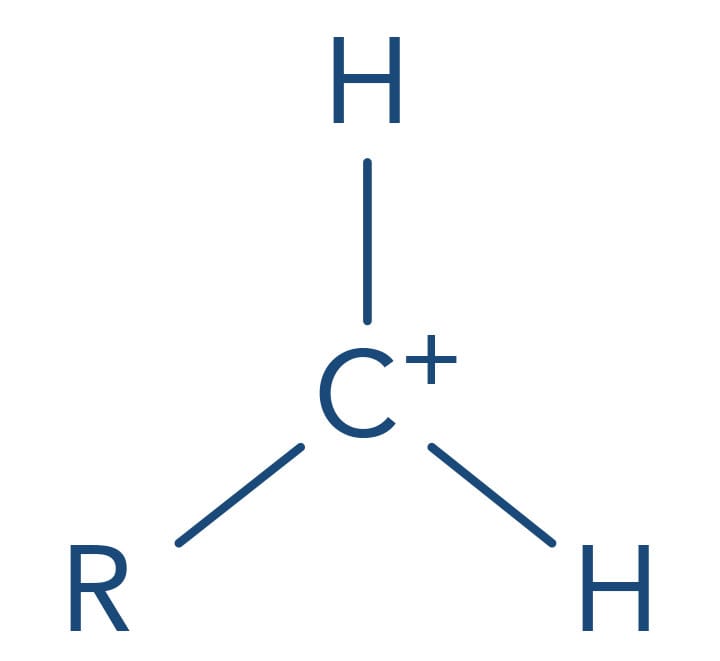
Primário
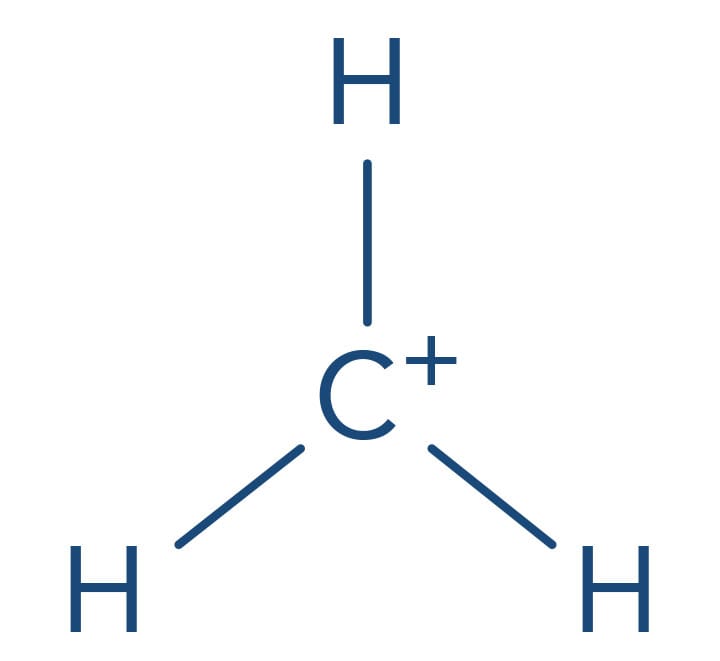
Metila
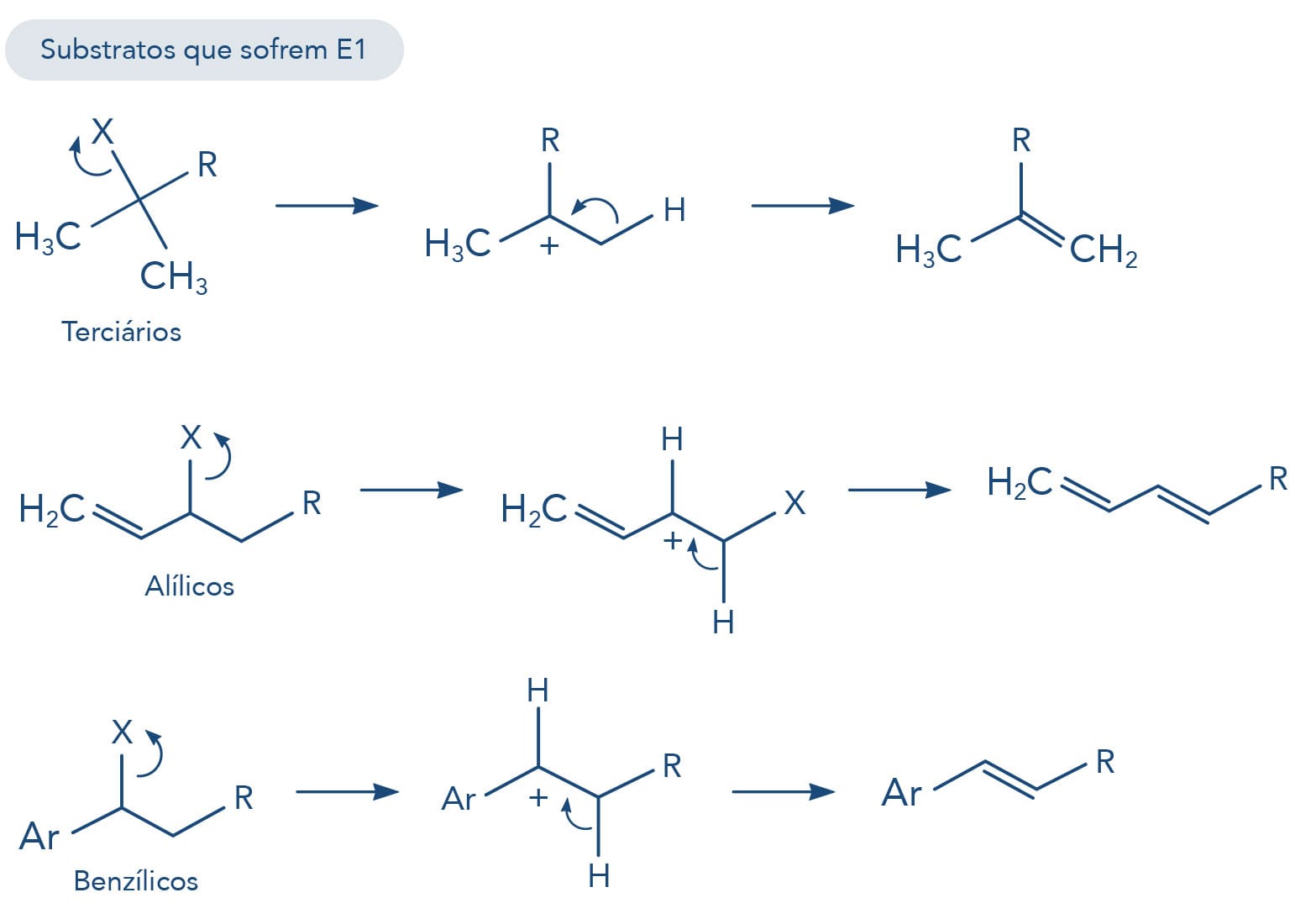
É importante destacar que, além do efeito doador dos grupos alquilas e o efeito de hiperconjugação, outros efeitos, como o de ressonância, são capazes de estabilizar carbocátions. É o caso dos carbocátions benzílicos e alílicos.
ASPECTOS CINÉTICOS E TERMODINÂMICOS DAS REAÇÕES DE SUBSTITUIÇÃO NUCLEOFÍLICA
Assista ao vídeo a seguir para saber mais sobre os aspectos cinéticos e termodinâmicos das reações de substituição nucleofílica.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer os mecanismos que influenciam as reações SN1 e SN2
Fatores que influenciam o mecanismo da reação SN2

Neste módulo, vamos discutir os fatores que influenciam a velocidades de reação para os mecanismos de substituição nucleofílica do tipo SN1 e SN2. Iniciaremos nossa abordagem pelas reações do tipo SN2.
A reação SN2 e a basicidade relativa dos íons haletos
Quando analisamos as características do substrato que influenciam as reações de substituição nucleofílica, precisamos avaliar a natureza do grupo de saída ou grupo abandonador e a estrutura desse substrato.
Um bom grupo abandonador deve ser uma base fraca e relativamente estável - deve receber facilmente os elétrons da ligação rompida. A base fraca facilita o rompimento da ligação C-GS, pois esta ligação tende a ser mais fraca.
Já vimos que os haletos se comportam como grupos de saída, mas possuem reatividades distintas devido à sua basicidade e polarizabilidade. A seguir, podemos observar a ordem de basicidade dos haletos e de que maneira estes funcionam como grupo de saída.
(Base mais fraca e mais estável) I- < Br- < Cl- < F- (Base mais forte e menos estável)
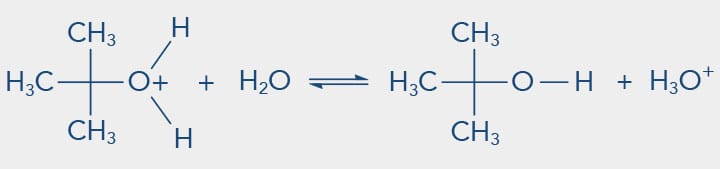
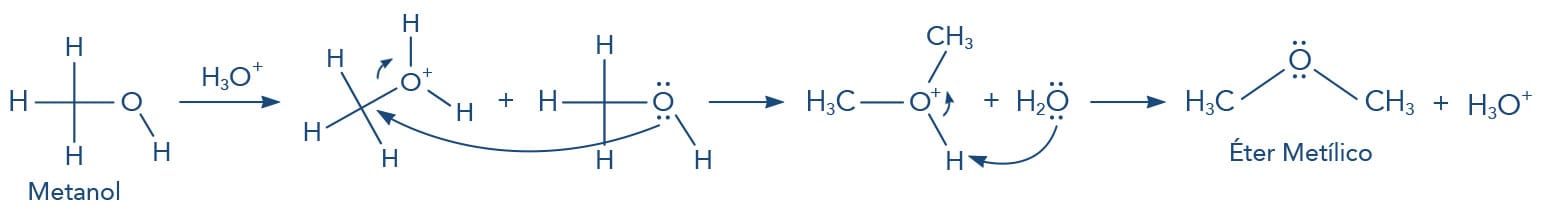
Assim, os iodetos de alquila são melhores grupos de saída que os fluoretos e, consequentemente, mais reativos para as reações de substituição nucleofílica. Mas existem outros grupos abandonadores e devem apresentar a mesma característica de bases fracas, alguns exemplos podem ser de moléculas neutras como H2O, NH3 etc. Observe o exemplo a seguir em que o metanol em um meio ácido-prótico pode gerar a formação do éter metílico:
Ainda sobre como os haletos de alquila reagem por substituição nucleofílica: a estrutura do haleto também influencia a velocidade das reações. Vamos lembrar que o mecanismo SN2 é concertado: o nucleófilo ataca o átomo de carbono pelo lado oposto à ligação do grupo de saída (halogênio). Este fato pode ser explicado pela presença do halogênio que estaria bloqueando um lado do carbono - impedimento estérico - e pela teoria dos orbitais moleculares em que, para formar uma ligação, o nucleófilo que contém o par de elétrons e seu orbital molecular HOMO (orbital molecular ocupado de maior energia) se sobrepõe ao orbital molecular LUMO (orbital molecular vazio de menor energia) do átomo de carbono.
À medida que o nucleófilo forma a nova ligação, o grupo de saída se afasta, ou seja, vai rompendo a ligação com o carbono, o que gera uma inversão da configuração do carbono sp3 - tetraédrico.
No mecanismo SN2, proposto em 1937 por Edward Hughes e Christopher Ingold, toda reação ocorre em uma única etapa - reação concertada e sem intermediários de reação - por meio da formação de um estado de transição que é um arranjo transitório entre os átomos.
A estereoquímica na reação SN2
Como podemos observar no mecanismo demonstrado na figura anterior, no estado de transição o nucleófilo ataca o carbono sp3 pelo lado oposto do grupo de saída - esse carbono em que a substituição ocorre tem sua configuração invertida durante a reação. Paul Walden verificou essa inversão de configuração do carbono nas reações SN2, desta forma sendo nomeada de Inversão de Walden. Carbonos quirais ao sofrerem reações SN2 terão sua estereoquímica invertida, por exemplo, a reação do (R)-2-bromo-butano com o íon hidroxila fornecerá o (S)-2-butanol.
Natureza do substrato
Outro fator que influencia a velocidade da reação SN2 é a natureza do substrato, como pode ser observado na tabela a seguir.
| Haleto de Alquila | Classificação do haleto | Velocidade relativa |
|---|---|---|
| CH3Br | Metílico | 1200 |
| CH3CH2Br | Primário | 40 |
| CH3CH2CH2Br | Primário | 16 |
| (CH3)2CHBr | Secundário | 1 |
| (CH3)3CBr | Terciário | Muito lenta |
Em outras palavras, as características estruturais do haleto de alquila, analisando a substituição do carbono sp3, são determinantes para sua reatividade e velocidade da reação.
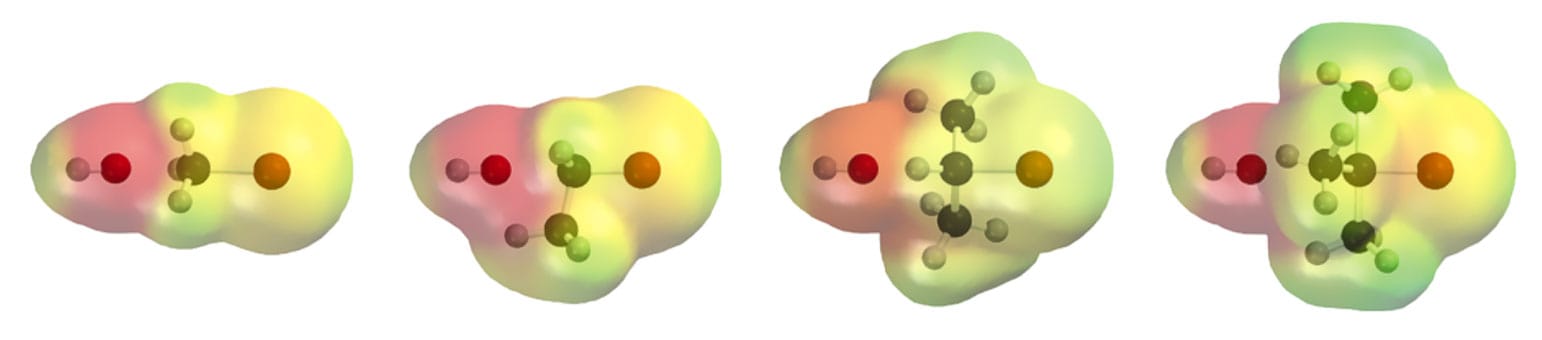
Os haletos metílicos e primários reagem muito mais facilmente que outros haletos. Como o ataque do nucleófilo ocorre pelo lado de trás do carbono, carbonos terciários e secundários apresentam reações muito lentas devido ao impedimento estérico de seus substituintes, o que dificulta a aproximação do nucleófilo.
Na figura a seguir, a visualização do ataque do íon hidroxila ao C sp3 do haleto de alquila em uma visão tridimensional e que demonstra o volume dos átomos. O impedimento estérico dos substituintes torna-se visível.
A força e a concentração do nucleófilo
Já vimos que a reação SN2 é bimolecular, de cinética de 2º Ordem, pois sua velocidade depende tanto da concentração do substrato quanto do reagente (nucleófilo). Quanto maior a concentração e a força do nucleófilo mais rápida a reação por este mecanismo.
Apesar de podermos avaliar a nucleofilicidade e a basicidade de um nucleófilo e, em muitos casos, ambas serem grandezas diretamente proporcionais, elas possuem definições diferentes. Vejamos:
Nucleofilicidade
É a capacidade de um nucleófilo em atacar um átomo deficiente de elétrons, formando com ele uma ligação covalente. No caso da reação SN2, o carbono sp3 ligado ao halogênio do haleto de alquila é o local deficiente de elétrons da molécula. A força de um nucleófilo é expressa por uma constante de velocidade de reação (k).
Basicidade
É a facilidade com que uma substância recebe (ou captura) H+ de uma espécie doadora de prótons. A força de uma base é medida pela constante ácida (Ka) de seu ácido conjugado - quanto menor o Ka do ácido conjugado mais forte é a base.
A constante ácida (Ka) de um ácido expressa sua capacidade transferir um próton para uma espécie aceptora (base).
De forma geral, bons nucleófilos são bases fortes e, quando carregados negativamente, sempre serão mais reativos que seus respectivos ácidos conjugados.
Exemplo
| Bom nucleófilo, base forte | Nucleófilo fraco, base fraca | |
|---|---|---|
| HO- | H2O | |
| CH3CH2O- | CH3CH2OH | |
| H2N- | NH3 | |
| CH3NH- | CH3NH2 | |
| H2N- | HO- | |
| HO- | F- |
A polarizabilidade da substância também influencia a nucleofilicidade da mesma, ou seja, o tamanho-volume do átomo determina se os elétrons da camada de valência estão disponíveis ou não para serem doados.
Átomos grandes possuem os elétrons mais afastados do núcleo e mais disponíveis para reagir. Assim, a nucleoficidade dos halogênios é:
I- > Br- > Cl- > F-
Efeito do solvente
As reações orgânicas ocorrem em meios líquidos e para isso o substrato e o reagente estão dispersos em um solvente. Os solventes podem ser classificados como:
Solvatam seus solutos por interações polares como ligações de hidrogênio e interações dipolo-dipolo.
Realizam basicamente interações de Van der Waals - interações hidrofóbicas.
Possuem um próton - átomo de hidrogênio ligado a um atómo bastante eletronegativo, em geral o oxigênio - e são capazes de realizar ligações de hidrogênio com os nucleófilos. Solventes como a água solvatam fortemente os nucleófilos por ligações de hidrogênio, diminuindo a reatividade do nucleófilo para as reações de substituição.
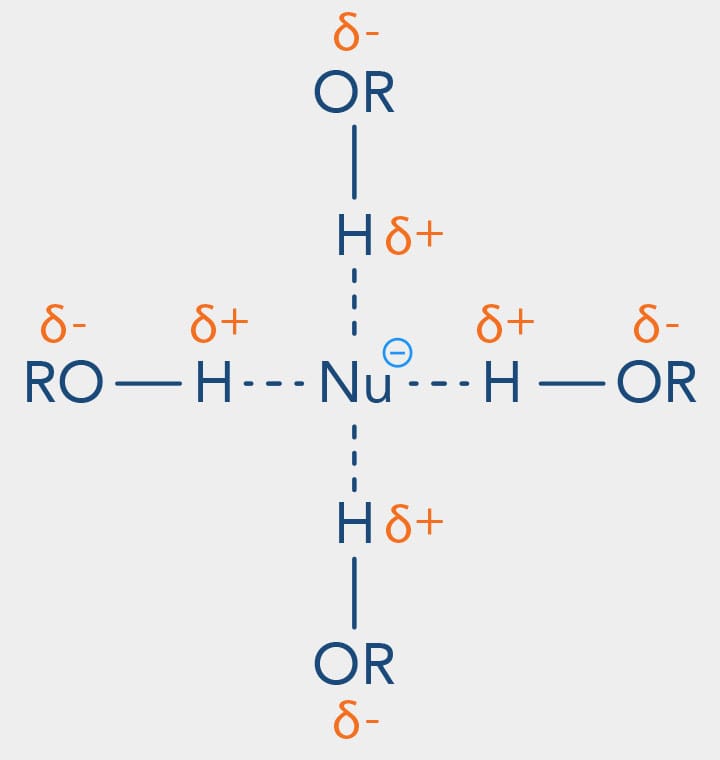
Em solventes polares próticos, a nucleofilicidade dos haletos é diretamente proporcional ao tamanho atômico:
I- > Br- > Cl- > F-
Isso se justifica pelo fato de íons com raios menores serem melhor solvatados neste tipo de solvente, como ilustra a figura a seguir:
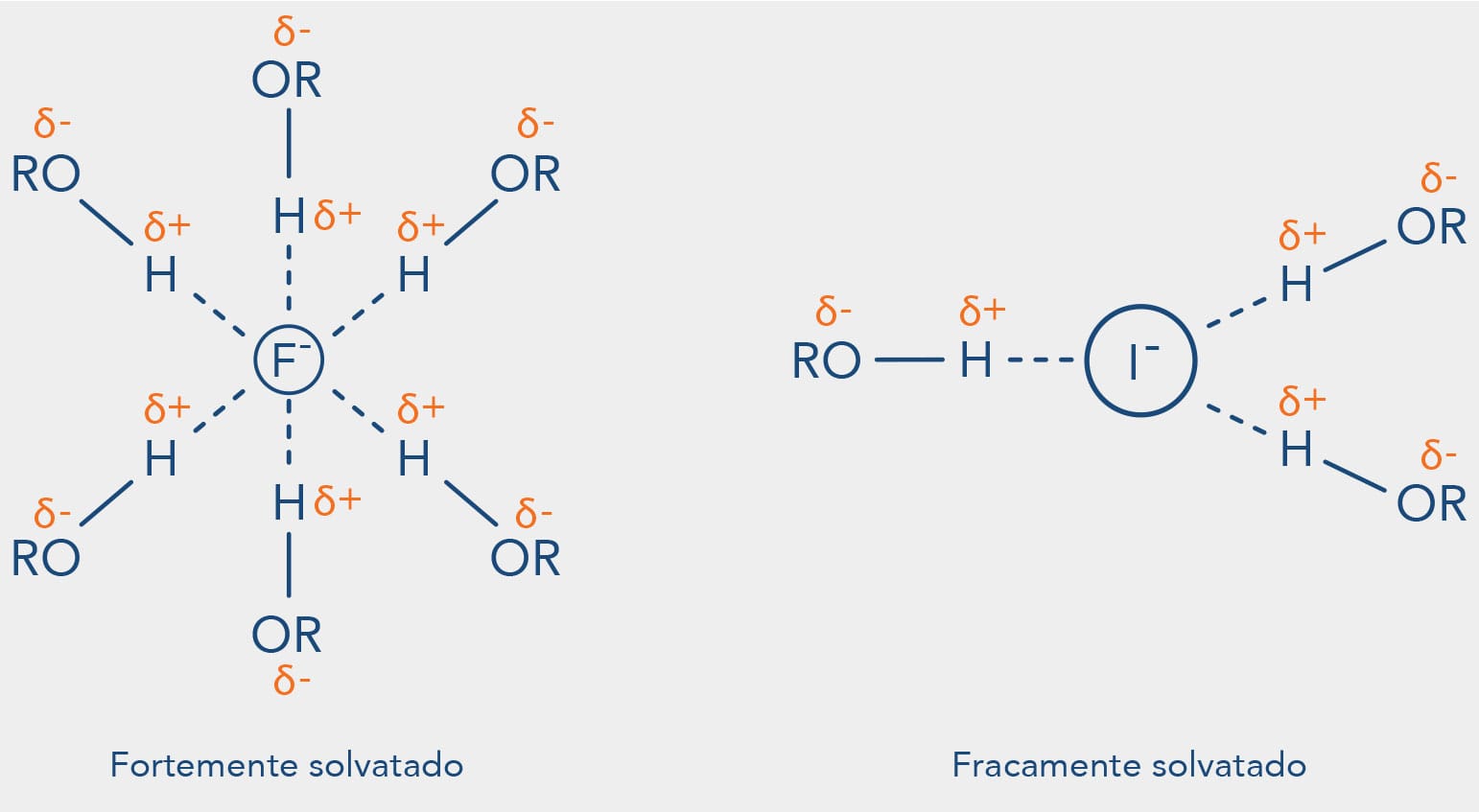
Quanto menor o volume do nucleófilo mais solvatado será pelo solvente, isto explica o ânion sulfeto - RS- ser mais nucleofílico que o RO- em solventes polares próticos, além da característica da polarizabilidade que já analisamos.
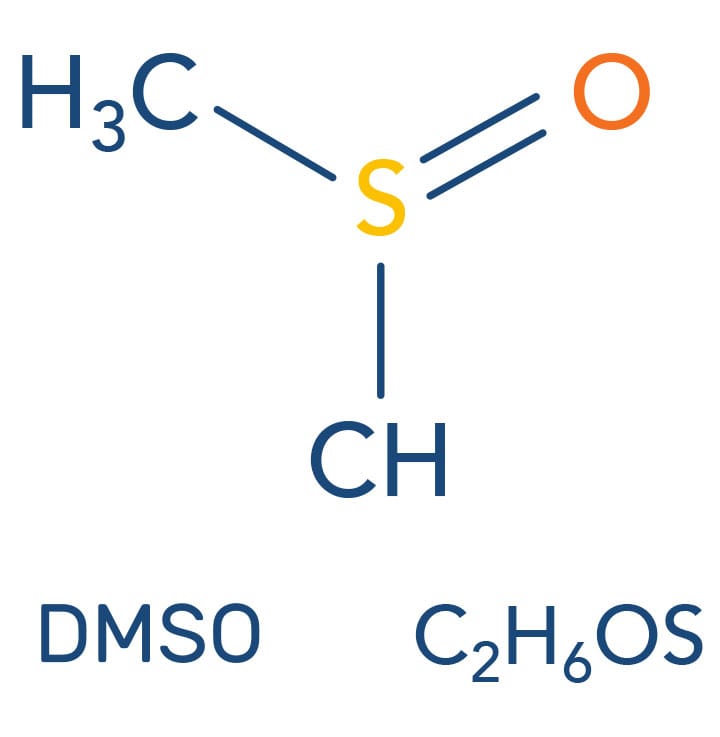
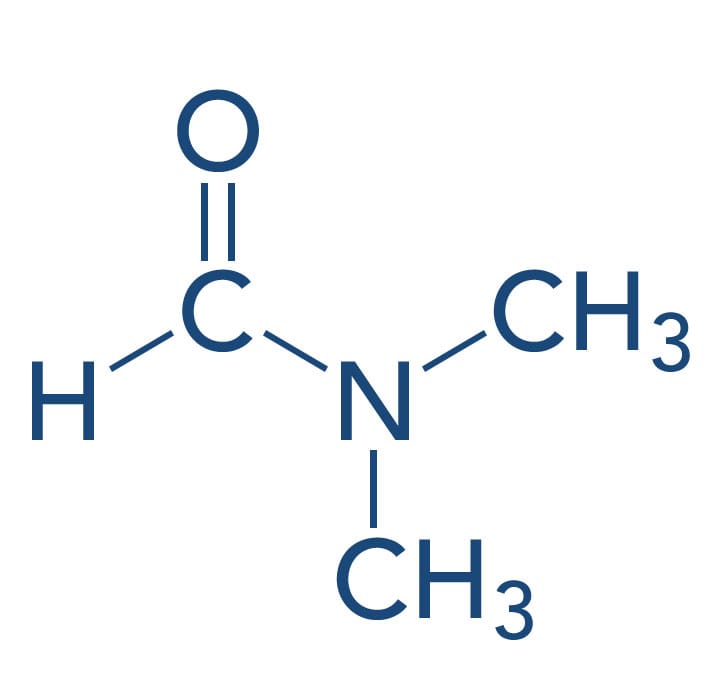
Não possuem o próton, desta forma não diminuem a reatividade dos nucleófilos. Os solventes polares apróticos como o DMSO (dimetilsulfóxido) e a DMF (N,N-dimetilformamida) dissolvem compostos iônicos e solvatam muito bem cátions, mas não solvatam ânions, ou seja, não impedem ou interferem a reação dos nucleófilos. Dessa forma, os solventes polares apróticos são muito utilizados nas reações SN2, aumentando sua velocidade de reação.
| DMSO (Dimetilsulfóxido) | DMF (N,N - Dimetilformamida) |
|---|---|
|
|
A ordem de nucleofilicidade e reatividade para SN2 dos íons halogênios é influenciada pelos solventes polares apróticos; é o inverso daquela observada para os solventes polares próticos:
F- > Cl- > Br- > I-
Observe que neste caso, a nucleofilicidade é diretamente proporcional à basicidade.
Teoria do estado de transição
Quando estudamos as reações químicas, temos dois tipos de reações: as exergônicas, que ocorrem com variação de energia livre negativa liberando energia para o ambiente, e as endergônicas, que ocorrem com variação de energia livre positiva absorvendo energia do ambiente.
Exemplo
CH3Cl + HO- → CH3OH + Cl-
Um exemplo de reação exergônica é a do cloreto de metila com o íon hidróxido em solução aquosa que libera energia - ∆G° = -100 kJ/mol a 60° C. Já vimos que esta reação é uma SN2 e altamente favorecida devido à sua alta constante de equilíbrio, ou seja, é uma reação que ocorre de forma completa, seu equilíbrio está voltado para a formação do produto.
Tal fato também pode ser explicado analisando a basicidade e a capacidade do grupo de saída de deixar a molécula. No exemplo citado, o Cl- é uma base mais fraca que o HO-, sendo melhor grupo de saída e favorecendo a reação para a formação do álcool.
Mas existem reações em que a diferença de basicidade entre o nucleófilo e o grupo de saída não é grande, desta forma a reação é reversível. Podemos citar como exemplo a reação do brometo de etila com o íon iodeto: a reação se torna reversível, pois a basicidade dos íons, medida pela força do seu ácido conjugado (pKa), são semelhantes (pKa do HI = -9 e pKa do HBr = -10).
Segundo o princípio de Le Châtelier, que estudou a termodinâmica das reações, se um equilíbrio for perturbado, o sistema se ajusta para compensar o distúrbio, ou seja, podemos orientar a direção das reações reversíveis pela remoção do produto assim que o mesmo é formado.
Grupo de saída
Assim como vimos no mecanismo SN2, a basicidade e a polarizabilidade dos halogênios influenciam a reatividade dos haletos de alquila. Os átomos de halogênios mais facilmente polarizáveis e que formam ânion, que são bases fracas, são melhores grupos de saída, favorecendo o mecanismo SN1 pela rápida quebra da ligação C-X para formação do carbocátion.
(Base mais fraca e haleto mais reativo) RI < RBr < RCl < RF (Base mais forte e haleto menos reativo)
A reação SN1 e suas características
No mecanismo SN1, também temos os fatores que afetam a velocidade da reação. São eles:
Nucleófilo
Natureza do substrato
Efeito do solvente
Característica do grupo de saída
Nucleófilo
Na cinética de reação de primeira ordem, mecanismo SN1, o nucleófilo não participa da etapa determinante da reação. Por isso sua concentração não influencia a velocidade na qual a substituição nucleofílica ocorre. Neste mecanismo, a força do nucleófilo não é determinante para esse tipo de reação, mesmo que em muitos casos os próprios solventes se comportem como o nucleófilo, sendo a reação conhecida como solvólise.
Natureza do substrato e rearranjo de carbocátions
No mecanismo SN1, o carbocátion é o intermediário de reação e quanto mais facilmente for formado e mais estável maior a velocidade da reação. Neste sentido, precisamos entender que as moléculas podem sofrer rearranjo de estrutura para buscarem carbocátions mais estáveis. Vamos analisar o caso da reação do composto 2-bromo-3-metilbutano na presença de água (solvólise). Com a quebra da ligação C-Br, inicialmente se forma um carbocátion secundário que é vizinho a um carbono terciário. Com o rearranjo 1,2 do hidreto, forma-se um carbocátion terciário que reage mais rapidamente com a água. Dessa forma a reação do 2-bromo-3-metilbutano em água leva à formação do 2-metil-2-butanol.
Efeito do solvente nas reações SN1
Solventes polares estabilizam as espécies carregadas (parcial ou totalmente) que são formadas durante as reações de substituição nucleofílica via SN1. Neste meio, a velocidade da reação é aumentada, uma vez que o estado de transição, o par iônico e os intermediários (produtos da etapa lenta) são estabilizados por meio da solvatação.
Condições de reação - SN1
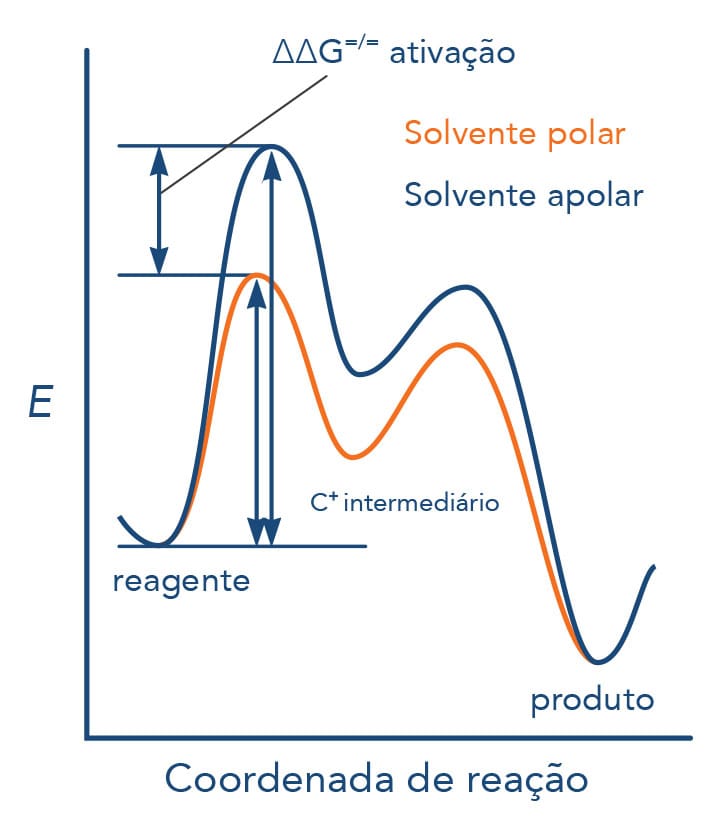
Condições de reação - SN2
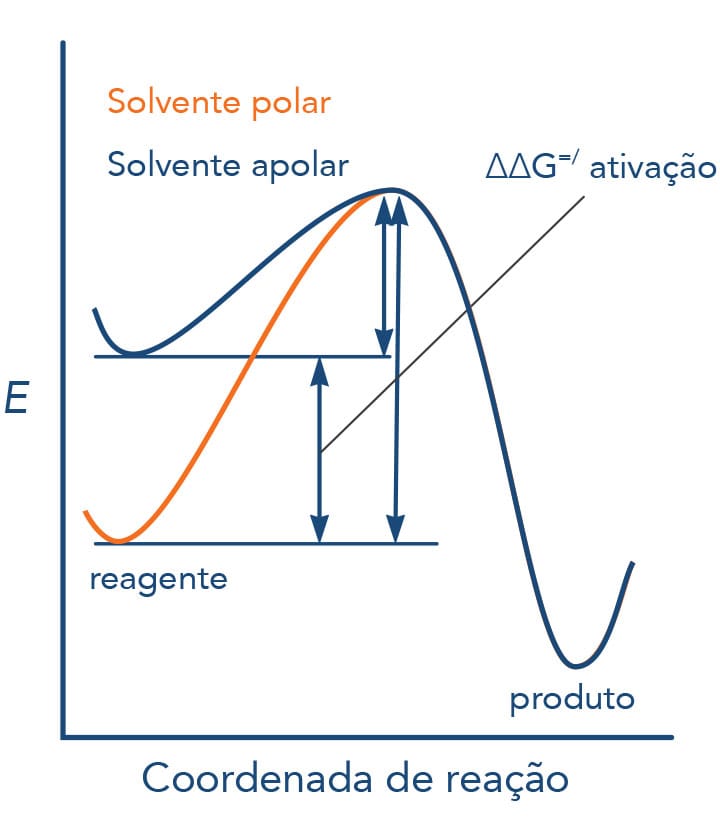
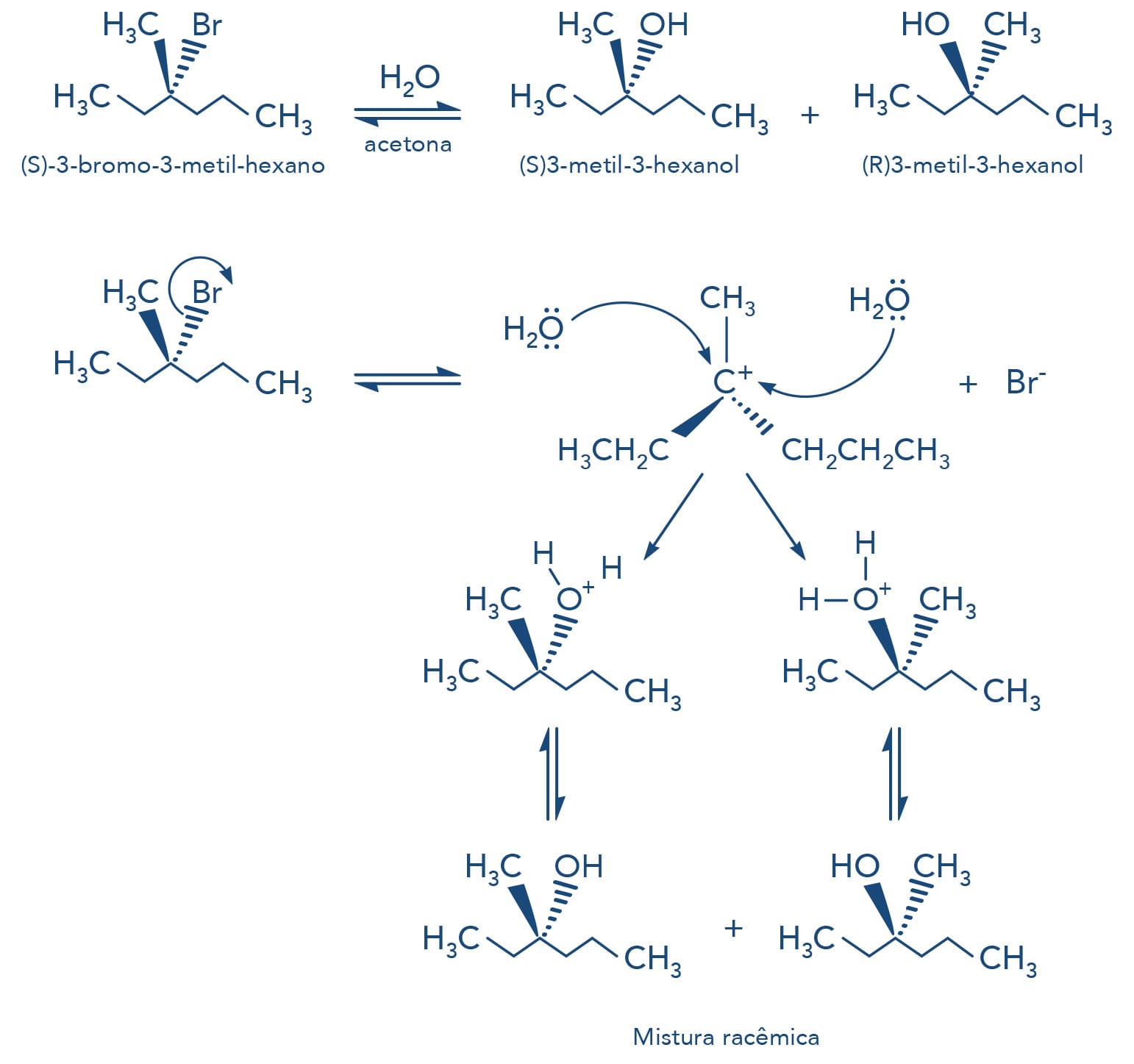
Estereoquímica das reações SN1
Retomando o mecanismo da reação SN1, identificamos que a primeira etapa da reação é a quebra da ligação carbono-grupo de saída com a consequente formação do carbocátion.
O carbocátion possui uma estrutura trigonal plana com um orbital p vazio do carbono sp2, assim o ataque do nucleófilo pode ocorrer pelos dois lados do carbono, levando a um processo de racemização, ou seja, formação de 2 estereosisômeros em quantidades iguais - mistura opticamente inativa.
Veja a seguir o exemplo da reação do (S)-3-bromo-3-metil-hexano que, na presença de água e acetona, levam à formação da mistura racêmica (mistura 1:1 dos enantiômeros R e S) do 3-metil-3-hexanol.
Resumo das reações SN2 e SN1
No quadro a seguir, disponibilizamos um resumo das reações de substituição nucleofílica que os haletos de alquila sofrem, bem como os fatores que influenciam a prevalência dos mecanismos SN2 e SN1, uma vez que os dois podem competir entre si.
| SN2 | SN1 | |
|---|---|---|
| Mecanismo | Acontece em uma etapa (mecanismo concertado) | Acontece em duas etapas (envolve a formação de um intermediário carbocátion) |
| Cinética | 2ª Ordem - bimolecular, depende da concentração do substrato e do nucleófilo | 1ª Ordem - unimolecular, depende da concentração do substrato |
| Substrato | Ordem reatividade: metil > 1º > 2º > 3º, não apresenta rearranjo |
Ordem reatividade: 3º > 2º > 1º > metil Rearranjo de carbocátion |
| Estereoquímica do produto | Inversão de configuração | Racemização |
| Concentração do Nucleófilo | Aumento do Nucleófilo, aumento da velocidade reação | Nucleófilo não interfere na velocidade da reação |
| Reatividade do Nucleófilo | Nucleófilo forte (basicidade e polarizabilidade), aumento da velocidade da reação | Nucleófilos fracos favorecem SN1 |
| Solvente | Favorecida por solventes polares apróticos (DMSO e DMF) | Favorecida por solventes polares próticos (água e álcoois) |
EFEITO DO SOLVENTE NAS REAÇÕES DO TIPO SN1 e SN2
Assista ao vídeo a seguir para saber mais sobre a influência do solvente na velocidade de reação e na ordem de basicidade e nucleofilicidade dos nuclófilos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Identificar características e fatores que influenciam a ocorrência das reações de eliminação
Reações de eliminação em haletos de alquilas
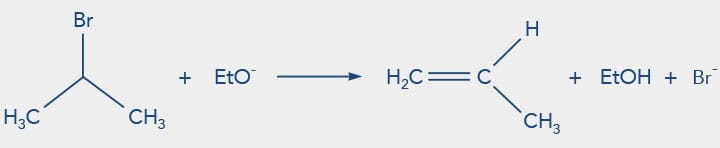
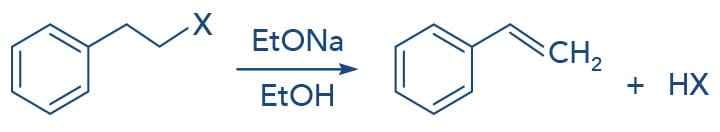
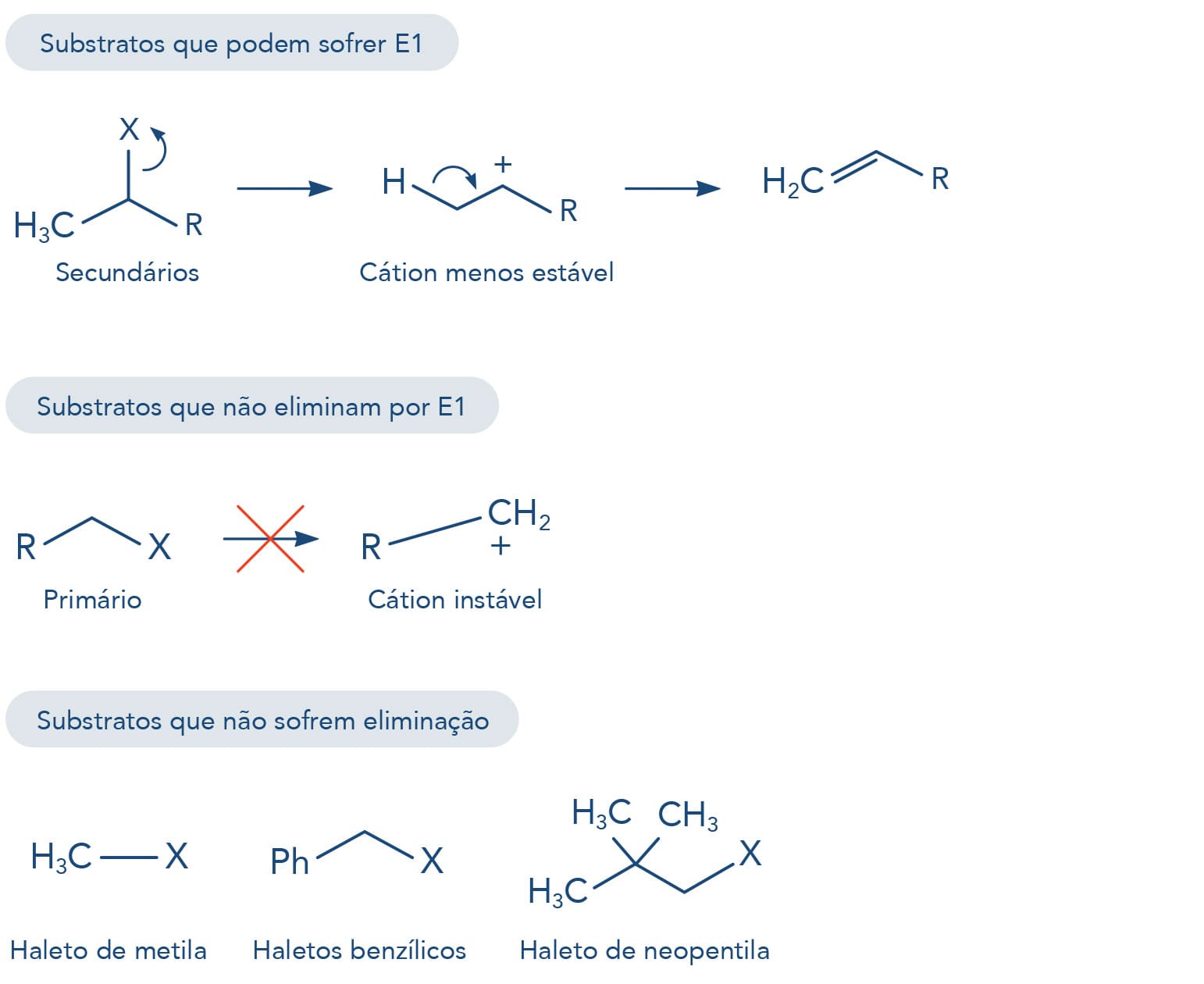
Além das reações de substituição nucleofílica, os haletos de alquila podem sofrer reações de eliminação de HX. Neste processo, o halogênio é removido de um carbono e o hidrogênio, do carbono adjacente, também chamada de eliminação β. Como consequência, uma ligação dupla é formada entre esses dois carbonos, originando um alceno.
A reação de eliminação também envolve dois mecanismos distintos chamados de:
O mecanismo da reação de eliminação unimolecular (E1) apresenta a formação de intermediário, pois o íon haleto inicialmente se dissocia da molécula levando à formação de um carbocátion. A base presente na reação retira o próton β ao carbono sp2 no carbocátion, de forma que os elétrons livres formam a nova ligação dupla carbono-carbono do alceno. Como a formação do carbocátion é a etapa determinante da reação (etapa lenta), a velocidade da reação é influenciada pela concentração do haleto de alquila.
Velocidade = k [haleto de alquila]
O mecanismo da reação de eliminação bimolecular (E2) é concertado, a reação ocorre em uma única etapa, sem formação de intermediários. Ou seja, a base se aproxima do hidrogênio β ao carbono ligado ao grupo de saída e, ao mesmo tempo que o próton se liga à base, o par de elétrons do carbono β se desloca para formar a dupla ligação enquanto a ligação carbono-grupo de saída se rompe.
A cinética da reação é de 2ª Ordem, onde a velocidade da reação depende da concentração da base (nucleófilo) e do substrato (haleto de alquila).
Velocidade = k [haleto de alquila][base]
As reações de eliminação também possuem mecanismos que competem entre si e são susceptíveis a fatores como: a natureza do substrato, a força e concentração da base, a ocorrência de rearranjos e, no primeiro caso, ainda levam à formação de compostos cíclicos.
Além de competirem entre si, a reação de eliminação compete com a reação de substituição, mas veremos isso um pouco mais adiante.
Natureza do substrato
Nas reações de eliminação 1,2 ou β, a base ataca o próton do carbono β ao carbono do halogênio (grupo de saída). Haletos que apresentam maior polarizabilidade e menor basicidade são reagentes mais reativos neste tipo de reação, assim segue a ordem de reatividade dos haletos de alquila para reações de eliminação, tanto E1 quanto E2:
(Base mais fraca e haleto mais reativo) RI < RBr < RCl < RF (Base mais forte e haleto menos reativo)
| VELOCIDADE RELATIVA DA REAÇÃO DE ELIMINAÇÃO | ||||
|---|---|---|---|---|
| X = | F | Cl | Br | I |
| K rel | 1 | 70 | 4000 | 30000 |
Reação de eliminação pelo mecanismo unimolecular (E1)
Com formação de carbocátion, a formação deste intermediário e consequentemente sua capacidade de estabilização são fatores que favorecem a reação. Desta forma, a reatividade dos haletos de alquila para E1 são:
Mais reativos haletos 3º > 2º > 1º menos reativos
Reação de eliminação pelo mecanismo bimolecular (E2)
Os haletos primários reagem mais rapidamente que os secundários e os terciários, isto porque no mecanismo em uma única etapa - concertado - a reação é susceptível ao efeito estérico dos grupos vizinhos, de forma que haletos mais substituídos e volumosos dificultam a aproximação da base para a retirada do próton.
Mais reativos haletos 1º > 2º > 3º menos reativos
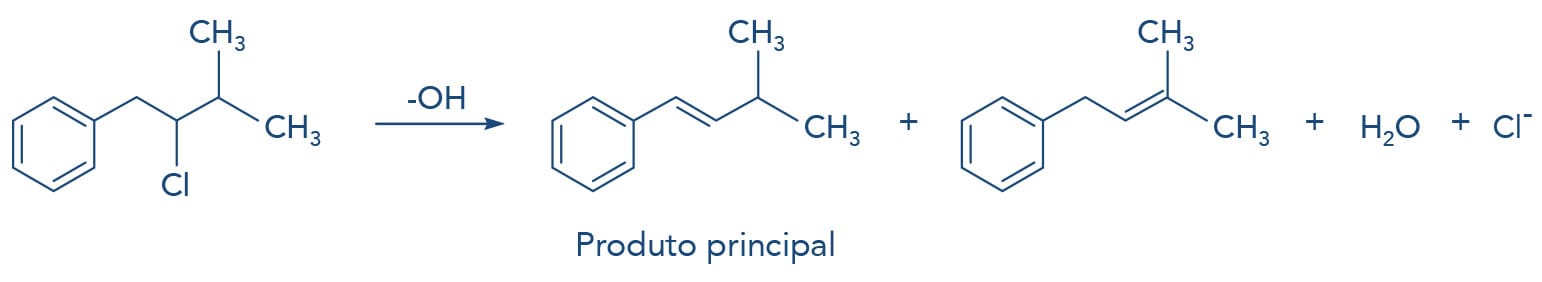
Os haletos alílicos e benzílicos geram carbocátions estáveis devido à estabilização da carga positiva por ressonância. Veja na figura a seguir.
Regiosseletividade das reações de eliminação
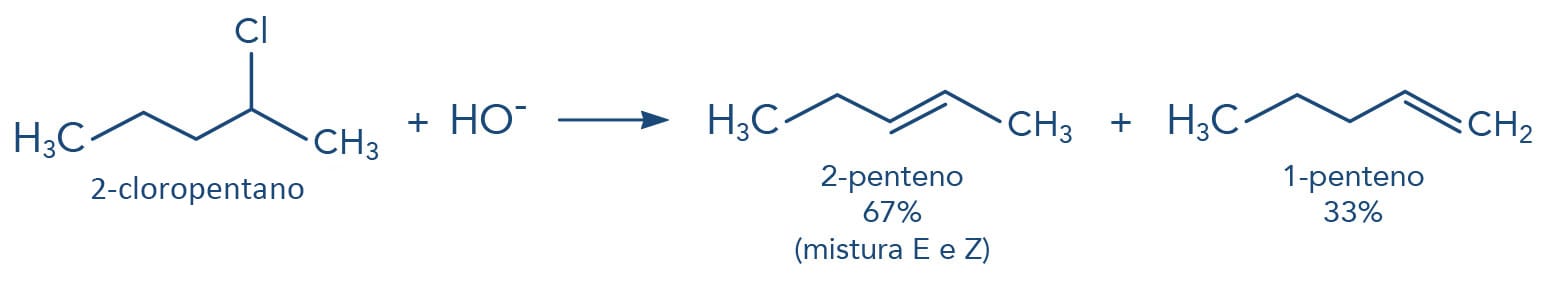
Ao analisarmos os produtos formados na reação de eliminação do 2-cloropentano na presença de uma base forte, verificamos que dois produtos são formados e em proporções diferentes: 67% do produto é a mistura E/Z do 2-penteno e 33% do 1- penteno, mas por que isto ocorre? O que influencia este tipo de eliminação?
Ao analisarmos os produtos - alcenos formados -, verificamos que o 2-penteno é mais estável, com menor energia que o 1-penteno. Isto porque a estabilidade do alceno é dependente do número de substituintes da dupla ligação, quanto mais substituído mais estável o alceno. Assim, nas reações de eliminação, o produto de menor energia é o principal produto formado - na maioria das vezes, é o alceno mais substituído. Este comportamento foi estudado por Alexander Zaitsev e hoje é conhecido como a Regra de Zaitsev.
Mas existem situações em que o alceno mais estável não é o mais substituído, uma vez que a conjugação das duplas ligações gera maior estabilidade do que duplas isoladas. Estes são casos que a Regra de Zaitsev não deve ser utilizada para a previsão do principal produto formado.
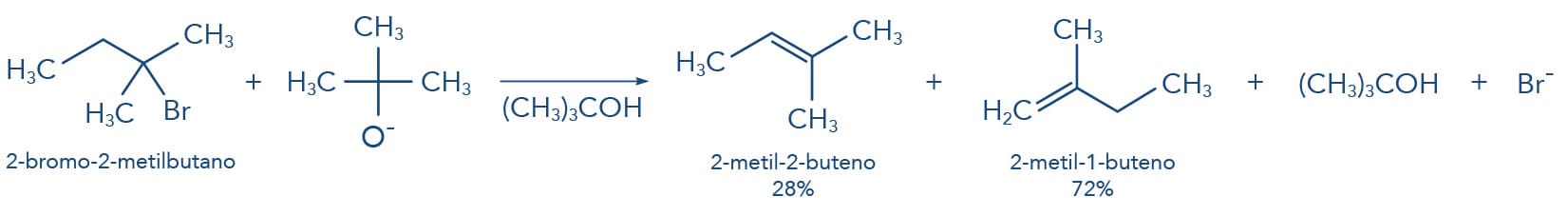
Outra situação ocorre na utilização de bases volumosas nas reações de eliminação. O volume da base dificulta a retirada de hidrogênios em regiões estericamente impedidas, e nestes casos o alceno menos substituído também é favorecidamente formado.
Nas reações de eliminação através do mecanismo E2, onde se utiliza uma base volumosa como o terc-butóxido de potássio (t-BuOK/t-BuOH), o volume da base não permite que ela se aproxime do hidrogênio ligado ao carbono mais substituído devido ao impedimento estérico. Sendo assim, a base volumosa retira o hidrogênio mais disponível, com menor impedimento estérico, levando à formação do alceno menos substituído, apesar de ser o menos estável, seguindo a Regra de Hoffmann.
Estereoquímica das reações de eliminação
Nas reações de eliminação, existem duas formas de as ligações C-H e C-X estarem dispostas no espaço, em conformação sin ou sinperiplanar (conformação onde estas ligações estão alinhadas paralelamente no espaço) ou em conformação anti ou antiperiplanar (conformação onde estas ligações estão em posições opostas no plano espacial). É importante entender que o confôrmero anti em oposição é mais estável do que o confôrmero sin que é eclipsado.
Essas características conformacionais influenciam a formação do estado de transição nas reações de eliminação do tipo E2, favorecendo o estado de transição em conformação anti, na qual a base retira o hidrogênio posicionado do lado oposto ao grupo de saída. Além da reação que acontece via mecanismo E2 formar, preferencialmente, um alceno mais substituído (regiosseletiva), é também estereosseletiva, uma vez que o produto majoritário da reação é o diastereoisômero E da dupla ligação. Outro fator que favorece a formação deste produto, em vez do seu diasteoisômero Z, é que o isômero E e o seu estado de transição correspondente, formado durante a reação, são mais estáveis pois possuem grupos volumosos em lados opostos da ligação dupla.
Quando retomamos o mecanismo E1, é de se esperar que ambos os estereoisômeros (isômeros E e Z) sejam formados. Porém, o produto majoritário será aquele mais estável, levando em consideração a regra de Zaitsev e a maior distância entre os grupos volumosos.
Competição entre as reações E2 e E1
Os fatores que influenciam as reações de SN1 e SN2, são praticamente os mesmos: haletos de alquila primários reagem pelo mecanismo E2, enquanto haletos secundários e terciários podem realizar reações E2 e E1. Observe a tabela a seguir e veja um resumo das características das reações de eliminação.
| E2 | E1 | |
|---|---|---|
| Mecanismo | Acontece em uma etapa (mecanismo concertado) | Acontece em duas etapas (envolve a formação de um intermediário carbocátion) |
| Cinética | 2ª Ordem - bimolecular, depende da concentração do substrato e da base | 1ª Ordem - unimolecular, depende da concentração do substrato |
| Substrato | Ordem reatividade: metil > 1ª > 2ª > 3ª não apresenta rearranjo | Ordem reatividade: 3º > 2º > 1º > metil Rearranjo de carbocátion |
| Estereoquímica do produto | Eliminação anti com formação do isômero E favorecidamente | Isômero E, alceno com grupos volumosos em lados opostos da dupla ligação |
| Concentração da base | Aumento [base] aumento velocidade reação | [Base] não interfere na velocidade da reação |
| Volume da base e força da base | Bases fortes, se pequena, o produto é Zaitsev; se volumosas, o produto é de Hofmann | Bases fracas favorecem E1 - solvólise |
Competitividade entre as reações de substituição nucleofílica e eliminação
Após o conhecimento da reatividade dos haletos de alquila, verificamos que os mesmos podem reagir com nucleófilos para as substituições nucleofílicas e com bases para as reações de eliminação. Mas os nucleófilos são bases em potencial, e todas as bases são nucleofílicos em potencial. Desta forma, existe uma competição entre as reações de substituição e eliminação.
As reações de SN2 e E2 são favorecidas por haletos primários e secundários e alta concentração de nucleófilos ou bases fortes. Para haletos primários na presença de bases fortes, como etóxido de sódio, a reação SN2 é preferencial a E2. Haletos secundários e terciários favorecem as reações E2 na presença de base forte devido ao impedimento estérico.
O aumento da temperatura favorece as reações de eliminação (E2 e E1), já que a temperatura intensifica o efeito da entropia.
O aumento do volume da base forte favorece a reação de eliminação do tipo 2, o volume dos substituintes impede a reação de substituição.
Para as reações SN1 e E1, a substituição nucleofílica é mais favorecida. Caso se deseje o alceno como produto majoritário, recomenda-se que as condições que favoreçam o mecanismo E2 sejam utilizadas.
REAÇÕES IÔNICAS DE HALETOS DE ALQUILA: LIMITAÇÕES E APLICAÇÕES
Assista ao vídeo a seguir para saber mais sobre as reações iônicas de haletos de alquila: limitações e aplicações.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste tema, estudamos as características, a classificação, a nomenclatura e a reatividade dos haletos de alquila. O halogênio ligado ao carbono gera um dipolo na ligação C-X devido à maior eletronegatividade deste em relação ao carbono. Como consequência, é gerada uma carga parcial negativa no halogênio e uma carga parcial positiva no carbono, o que possibilita a ocorrência de reações iônicas de substituição e/ou eliminação frente a reagentes nucleofílicos.
Vimos também que reações de substituições nucleofílica podem ocorrer por meio de dois tipos de mecanismos: substituição nucleofílica bimolecular (SN2) ou substituição nucleofílica unimolecular (SN1). As reações de eliminação também acontecem por dois tipos de mecanismos distintos: eliminação por mecanismo bimolecular (E2) e eliminação por mecanismo unimolecular (E1). Verificamos que, se tratando de reações iônicas cujo substrato é um haleto de alquila, alguns fatores são importantes para determinar o tipo de reação, bem como o tipo de mecanismo. São eles:
- A estrutura do haleto de alquila;
- As características do nucleófilo;
- A estabilidade do grupo de saída;
- As propriedades do solvente;
- A temperatura do meio reacional.
Além disso, podemos entender que as reações iônicas com haletos de alquila são muito versáteis e bastante utilizadas nos processos de síntese orgânica.
Podcast
Agora, o professor Luiz Américo Mota encerra o tema falando sobre os haletos de alquila: reações de substituição e eliminação.
CONQUISTAS
Você atingiu os seguintes objetivos:
Identificou a estrutura, a nomenclatura, a classificação e as características dos haletos de alquila e seus mecanismos de reações iônicas.
Reconheceu a reatividade dos haletos de alquila e os tipos de reações de substituição nucleofílica.
Reconheceu os mecanismos
Identificou características e fatores que influenciam a ocorrência das reações de eliminação.