
No âmbito da saúde
Por meio de exames que detectam doenças genéticas ou uma predisposição para o desenvolvimento de outras enfermidades, assim como o diagnóstico de doenças causadas por microrganismos parasitas.
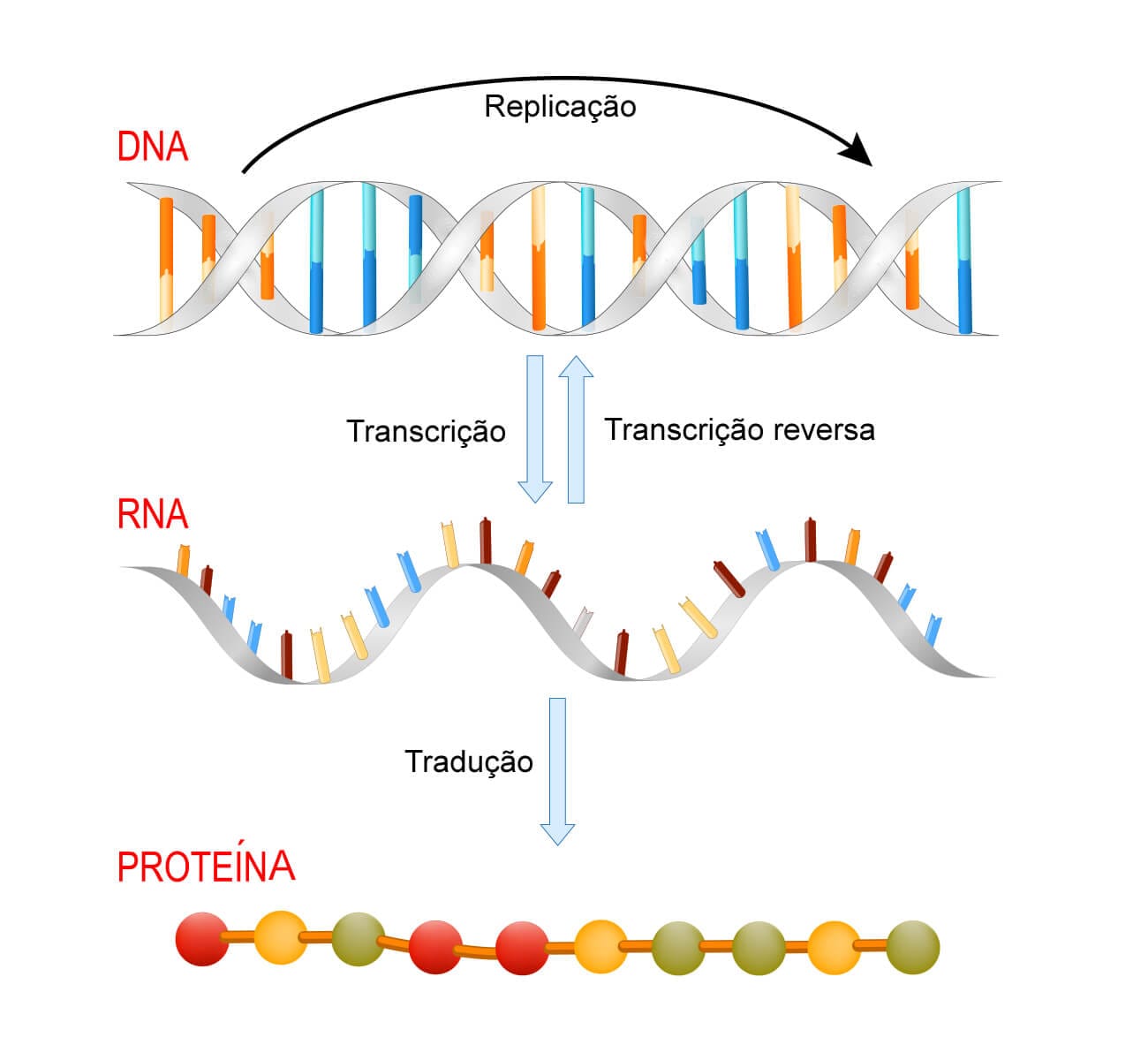
Estudo da genética molecular e o dogma central da biologia. Replicação, transcrição e tradução do DNA e o uso em novas tecnologias em clonagem, recombinação gênica e Projeto do Genoma Humano.
Conhecer a abrangência e as aplicações da genética molecular e o dogma da Biologia, para compreensão dos processos que envolvem replicação, transcrição e tradução do DNA e as novas tecnologias empregadas nas análises de DNA.
Identificar processos básicos de biologia molecular em genética
Reconhecer as tecnologias utilizadas em análise de DNA
Compreender o princípio de DNA recombinante e clonagem
Descrever a transformação genética e suas aplicações
Neste tema, estudaremos genética molecular, abordando o dogma central da biologia, através de diferentes conceitos sobre o DNA e processos celulares ligados a ele, para a manutenção da vida. Exemplificaremos também como e por quais motivos eles ocorrem.
Em seguida, aprenderemos sobre tecnologias usadas atualmente para a análise de DNA, dando ênfase ao Projeto Genoma Humano (PGH), apontando alguns princípios estudados, como, por exemplo, a tecnologia do DNA recombinante e clonagem.
Finalizaremos este tema falando sobre transformação gênica, citando como esta é empregada no ramo de biotecnologia, na transformação genética de plantas e animais.
Identificar processos básicos de biologia molecular em genética
O controle da vida se encontra no núcleo celular, pois lá estão localizados os ácidos nucleicos, que são constituídos por um conjunto de nucleotídeos, que possuem informações genéticas, através de códigos. Os ácidos nucleicos são classificados e denominados de acordo com sua estrutura química em desoxirribonucleicos e ribonucleicos. Com o conhecimento dessas estruturas e sabendo como ocorre a síntese de proteínas, foi possível entender o mecanismo de transmissão de informação genética da célula-mãe para as células-filhas.
Os ácidos nucleicos são compostos de:
A imagem a seguir ilustra a estrutura do nucleotídeo.
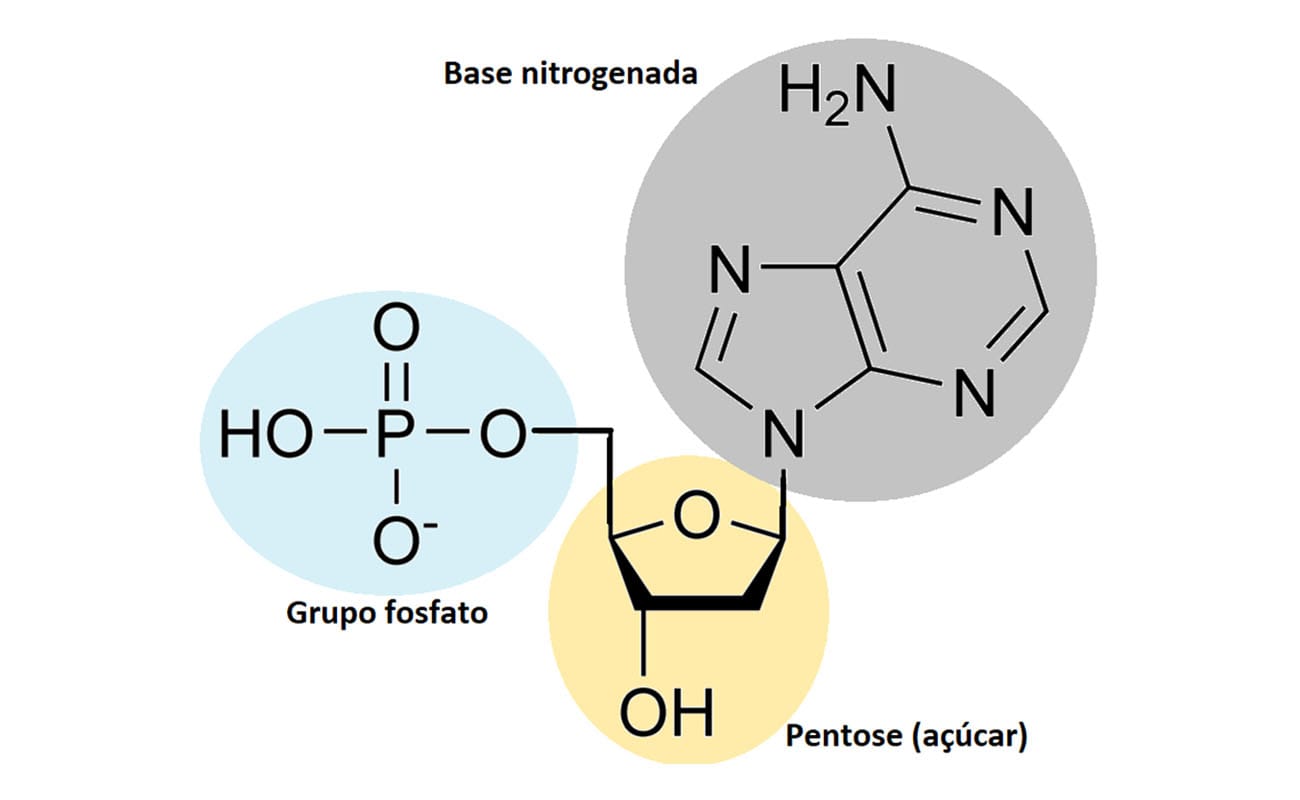
A desoxirribose é o açúcar que forma os nucleotídeos que compõem o DNA, e a ribose é o açúcar que compõe os nucleotídeos que formam o RNA. As bases nitrogenadas são divididas em duas classificações:
Constituídas por anéis de carbono e nitrogênio. São duas: a adenina (A) e a guanina (G).
São formadas de um único anel de carbono e nitrogênio. São três: citosina (C), timina (T) e uracila (U). A base nitrogenada timina só se apresenta em DNA, e a uracila, em RNA.
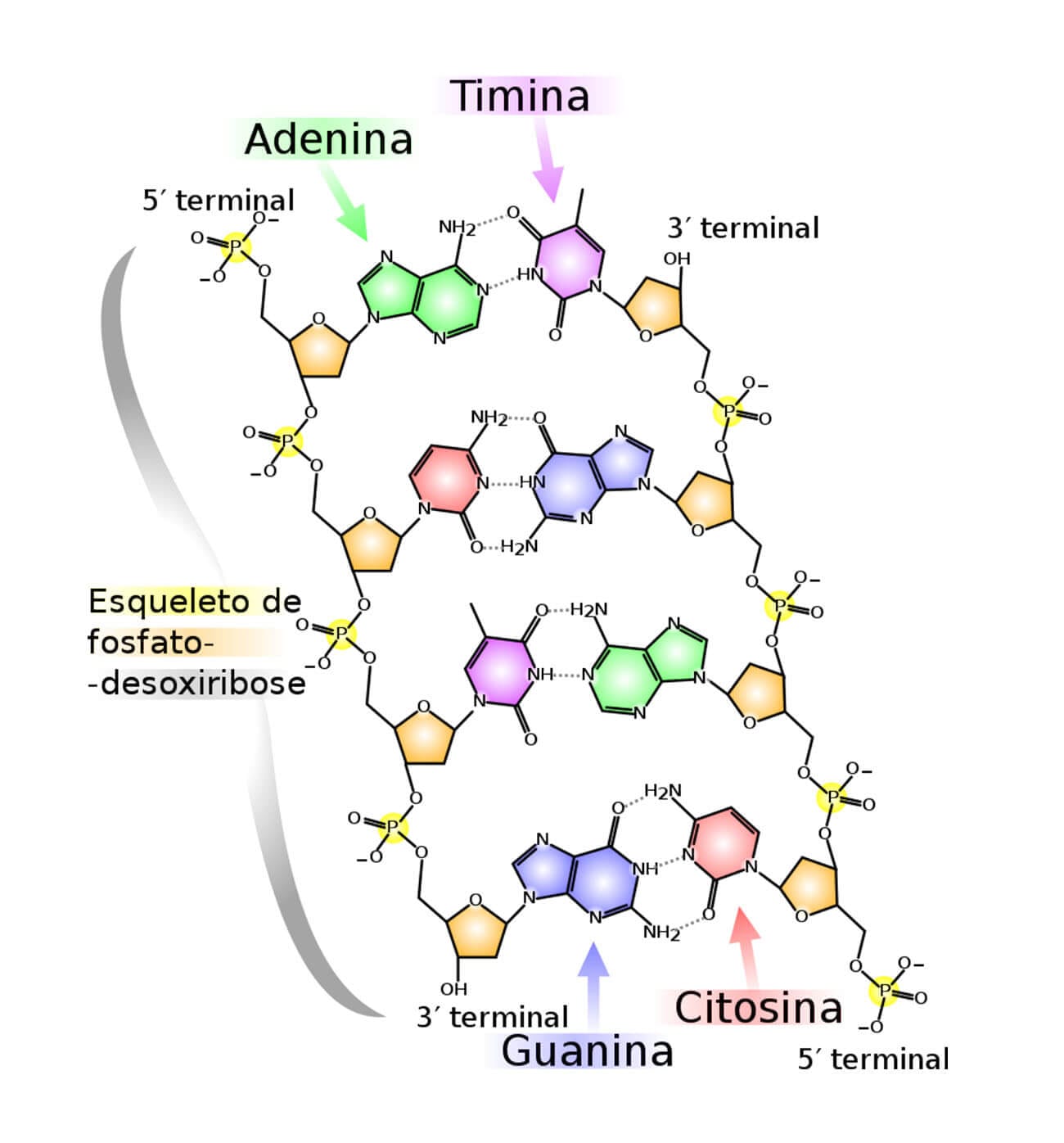
A imagem a seguir ilustra a estrutura dessas bases.
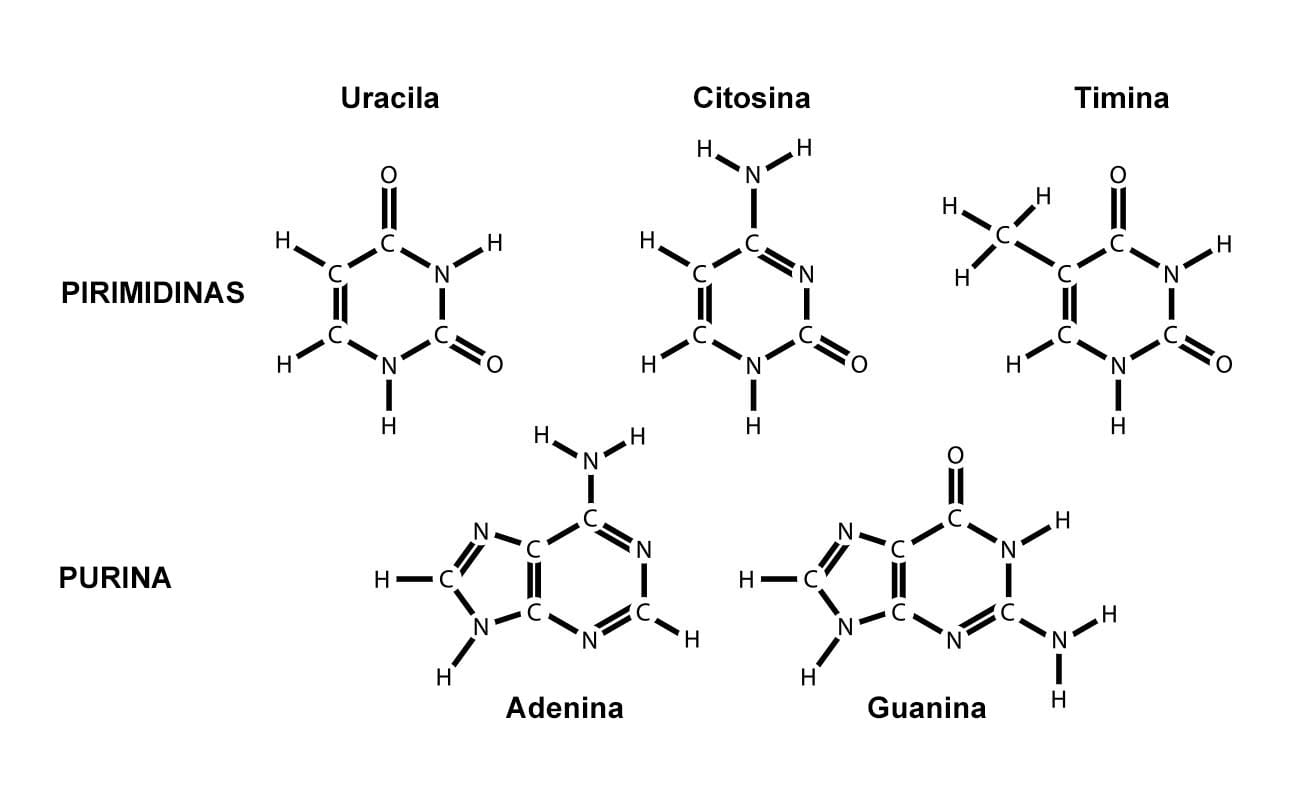
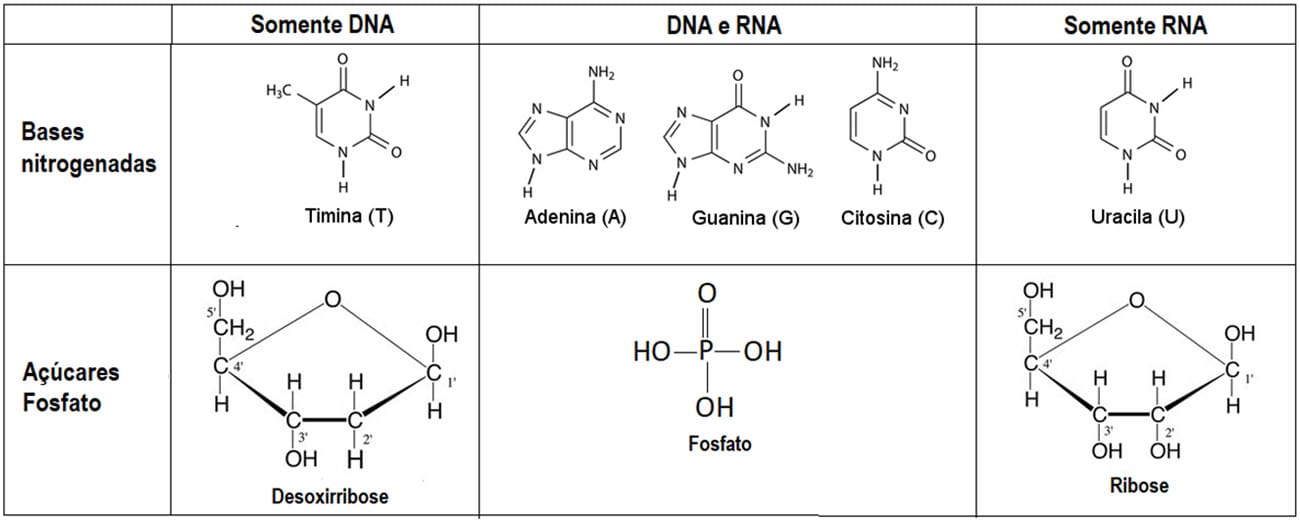
As bases nitrogenadas adenina, guanina e citosina são encontradas tanto nos nucleotídeos do DNA quanto do RNA; entretanto, a timina só é encontrada em DNA, e a uracila, apenas no RNA. Veja o quadro a seguir, que resume a composição dos nucleotídeos do DNA e do RNA:
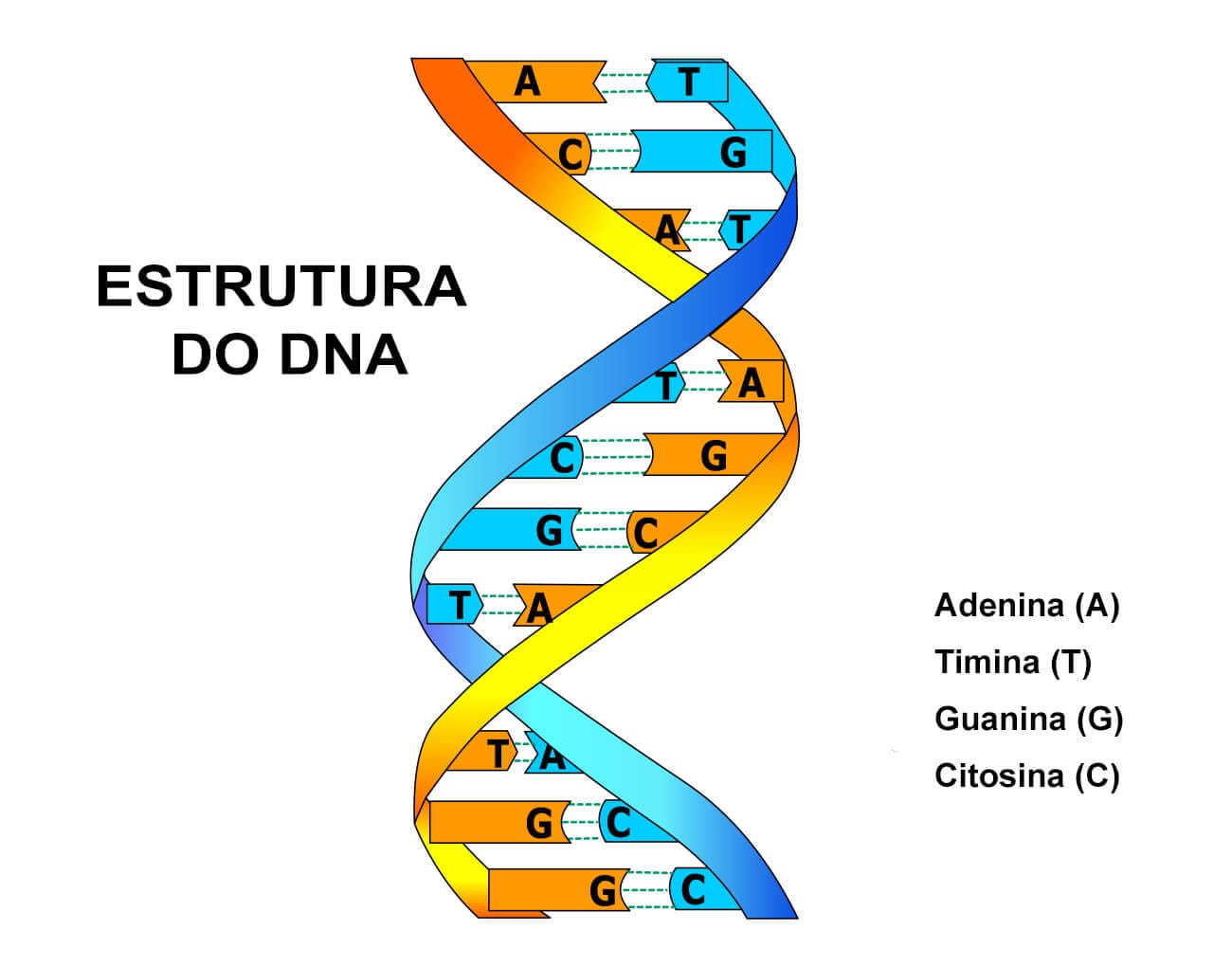
A molécula de DNA é formada por uma estrutura em dupla hélice, composta por duas cadeias nucleotídicas, que são organizadas em forma helicoidal e mantidas unidas por ligações de hidrogênio entre as bases nitrogenadas das duas cadeias.
Essas duas cadeias que compõem a dupla hélice são complementares, ou seja, quando se tem presente uma adenina, na mesma posição da outra cadeia terá uma timina, e vice-versa. Quando se tem presente uma guanina, terá na outra cadeia, na mesma posição, uma citosina, e vice-versa. É importante lembrar que não existe uracila no DNA, apenas no RNA. Dentre essas bases nitrogenadas, os pares são unidos por ligações de hidrogênio: a adenina e a timina formam duas ligações entre si, enquanto a guanina e a citosina formam três ligações.
Como vimos, para a formação da molécula de DNA, é necessária a união entre os nucleotídeos através de ligações covalentes, que ocorrem da seguinte maneira: o grupo hidroxila do carbono-3 da pentose, pertencente ao primeiro nucleotídeo, liga-se ao grupo fosfato, que se encontra ligado à hidroxila do carbono-5 da pentose do segundo nucleotídeo, através de ligações fosfodiéster.
Devido a esses fatores, a formação do DNA é direcionada sempre na direção de 5’=3’, já que, em um lado, temos disponível a hidroxila do carbono-5 da primeira pentose, e, na outra extremidade, temos livre a hidroxila do carbono-3 da última pentose.
Grupo funcional presente nos hidróxidos, formado por um átomo de hidrogênio e um oxigênio.
Carboidrato cuja molécula é formada por cinco carbonos.
Este processo se inicia através da enzima helicase, que é responsável pela separação das duas cadeias de DNA, ou seja, promove o rompimento da dupla hélice, formando duas fitas simples de DNA. Em seguida, a enzima DNA-polimerase usa as cadeias separadas como molde, pois, com os nucleotídeos dos filamentos expostos, são adicionados nucleotídeos complementares a cada umas dessas duas fitas, resultando em um novo filamento complementar. Com isso, ao final desse processo, temos dois novos exemplares, e cada dupla hélice filha possui um filamento intacto do seu genitor.
Como vimos anteriormente, a síntese de DNA sempre ocorre na direção 5’=3’, porque a enzima DNA-polimerase age apenas em hidroxila de extremidade 3’ livre, iniciando o processo de adicionar os nucleotídeos por essa extremidade. Portanto, a forma de complementar o segundo filamento ocorre de maneira diferente, de modo oposto e descontinuamente. Então, enquanto a fita principal é sintetizada de forma contínua e “para a frente”, a fita tardia é sintetizada a partir de fragmentos curtos e em sentido contrário à fita principal, existindo lacunas, que posteriormente são ligadas a fragmentos de Okazaki, e é catalisada pela enzima DNA ligase. Isso transforma a fita tardia em uma fita contínua.
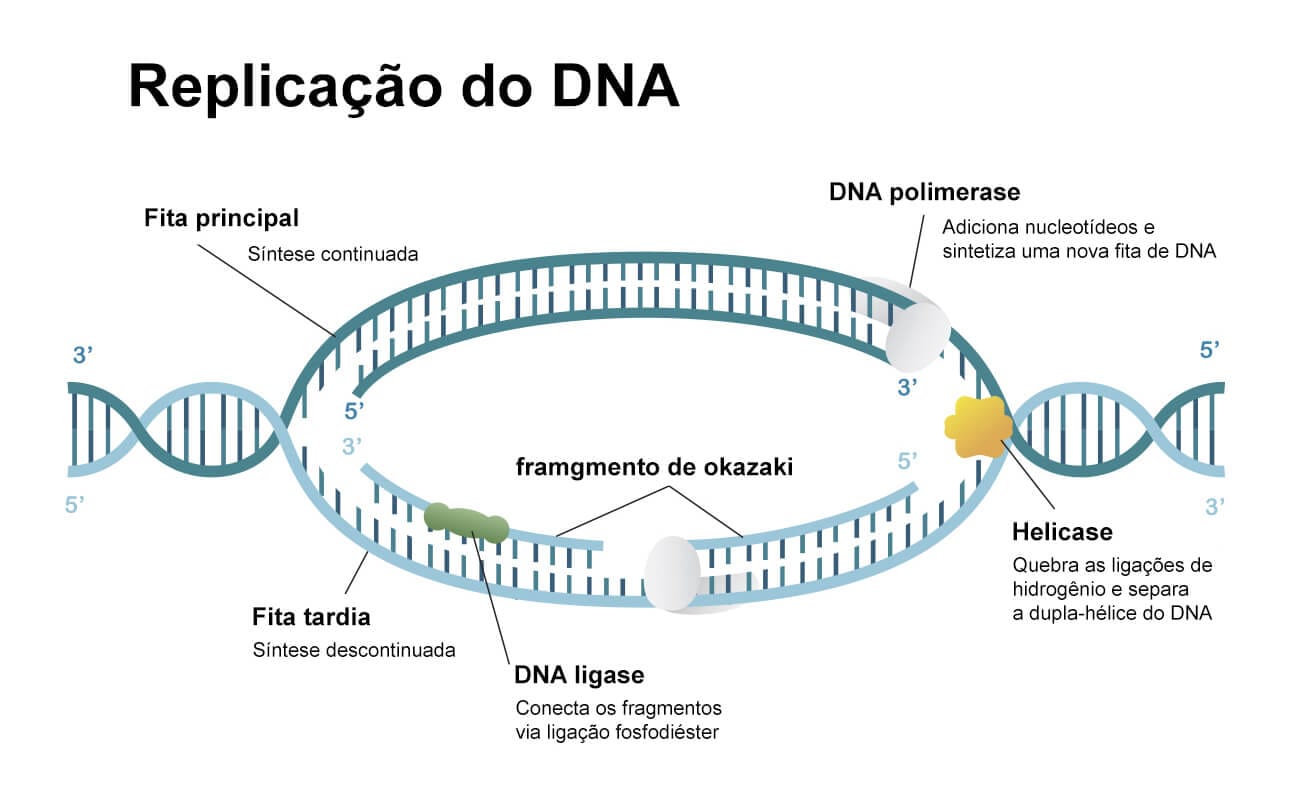
A replicação do DNA ocorre cada vez que uma célula dos organismos se divide. É um processo que deve ser muito preciso, para que não ocorram erros no momento da adição das bases nitrogenadas, o que pode originar câncer e mutações. Apesar disso, a existência de erros é comum, mas as células possuem mecanismos para eliminá-los: trata-se das verificações e dos reparos do DNA.
As polimerases, por exemplo, fazem um trabalho de revisão do pareamento das bases nitrogenadas. Se, após a formação da molécula de DNA, ainda houver alguma base mal pareada, ela será substituída através do reparo por mal pareamento. Porém, se o DNA fica danificado, outros mecanismos podem fazer o seu reparo: química reversa, reparo de excisão e reparo de quebras de fita dupla. Caso ele permaneça danificado, a célula entra em processo de morte programada (apoptose), para que o DNA danificado não seja transmitido a novas células que serão formadas.
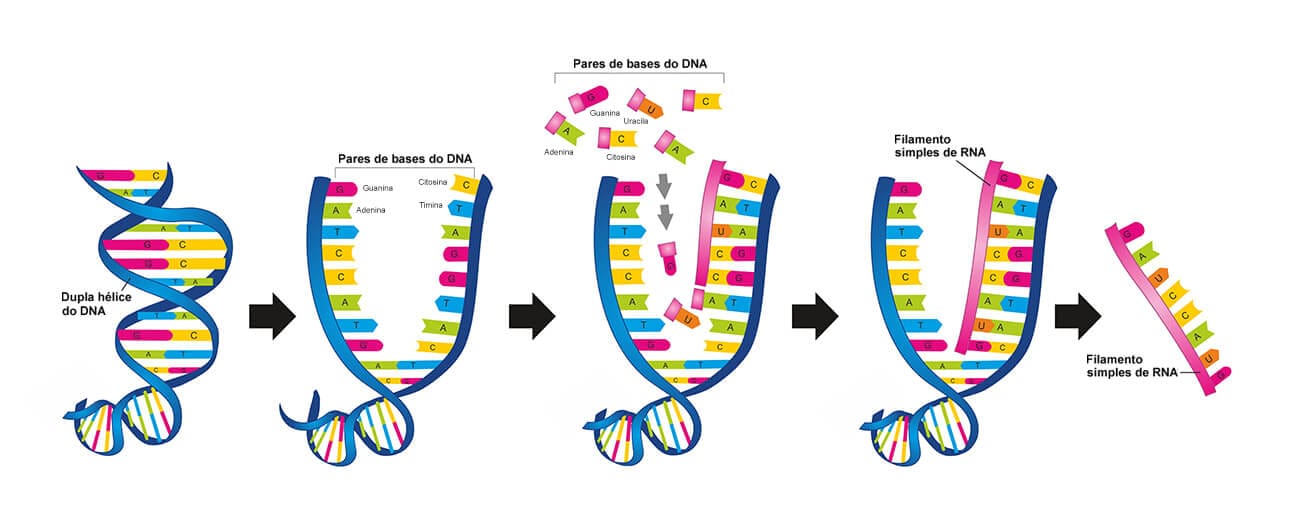
O processo denominado transcrição ocorre durante a fase intérfase do ciclo celular, e nele acontece a primeira etapa da expressão gênica para a síntese de proteínas.
A transcrição é o processo de cópia de um gene da sequência de DNA para fazer uma molécula de RNA, que levará à síntese de uma proteína.
O processo de síntese de proteínas ocorre através da ação de algumas moléculas:
Recebeu esse nome porque traz informações genéticas do DNA para os ribossomos.
A transcrição tem a participação da enzima RNA-polimerase, que se fixa na região promotora de uma das fitas de DNA (filamento molde), no trecho com o gene a ser transcrito, para dar início à produção do filamento de RNA, promovendo o pareamento de bases. Assim como o DNA, o filamento de RNA também é formado na direção 5’ = 3’; entretanto, no lugar da base timina, o RNA terá uracila, e o açúcar será a ribose. Quando a RNA-polimerase termina a transcrição, chegando ao fim do gene, recebe um “sinal” e se separa do DNA. Diferentemente do DNA, o RNA possui apenas um filamento, e seu tamanho varia de acordo com a proteína que este produzirá.
Esse filamento recém-montado recebe o nome de RNA transcrito primário do gene, que é processado e acaba deixando o núcleo, migrando para o citoplasma. Lá, participará da síntese de proteínas, como RNAm, em processo que chamamos de tradução.
A produção do RNAm é complexa, pois, quando o DNA é “lido” no processo de transcrição, todas as bases do segmento são verificadas. Porém, nesses segmentos, existem trechos “silenciosos” que chamamos íntrons.Estes serão excluídos da molécula de RNAm, no seu processo de maturação, e o que sobra após a maturação são os chamados éxons, que são traduzidos em molécula de proteína.
Com isso, podemos concluir que o processo de formação de RNAm é feito a partir da transcrição de trechos do DNA (cístrons) e que partes são transcritas e formarão moléculas de proteína (éxons) e partes não traduzidas (íntrons). Então, ao decorrer do processo de síntese de RNA, o RNA que é produzido a partir dos cístrons é classificado como transcrito primário, mas ainda dentro do núcleo. Após o processo de maturação, os íntrons são descartados por clivagem, sobrando os éxons, que, em seguida, serão unidos, formando o RNAm maduro.
Com esse processo descrito, temos um conceito que apresenta os mecanismos de transmissão e expressão da hereditariedade, o chamado dogma central da biologia.
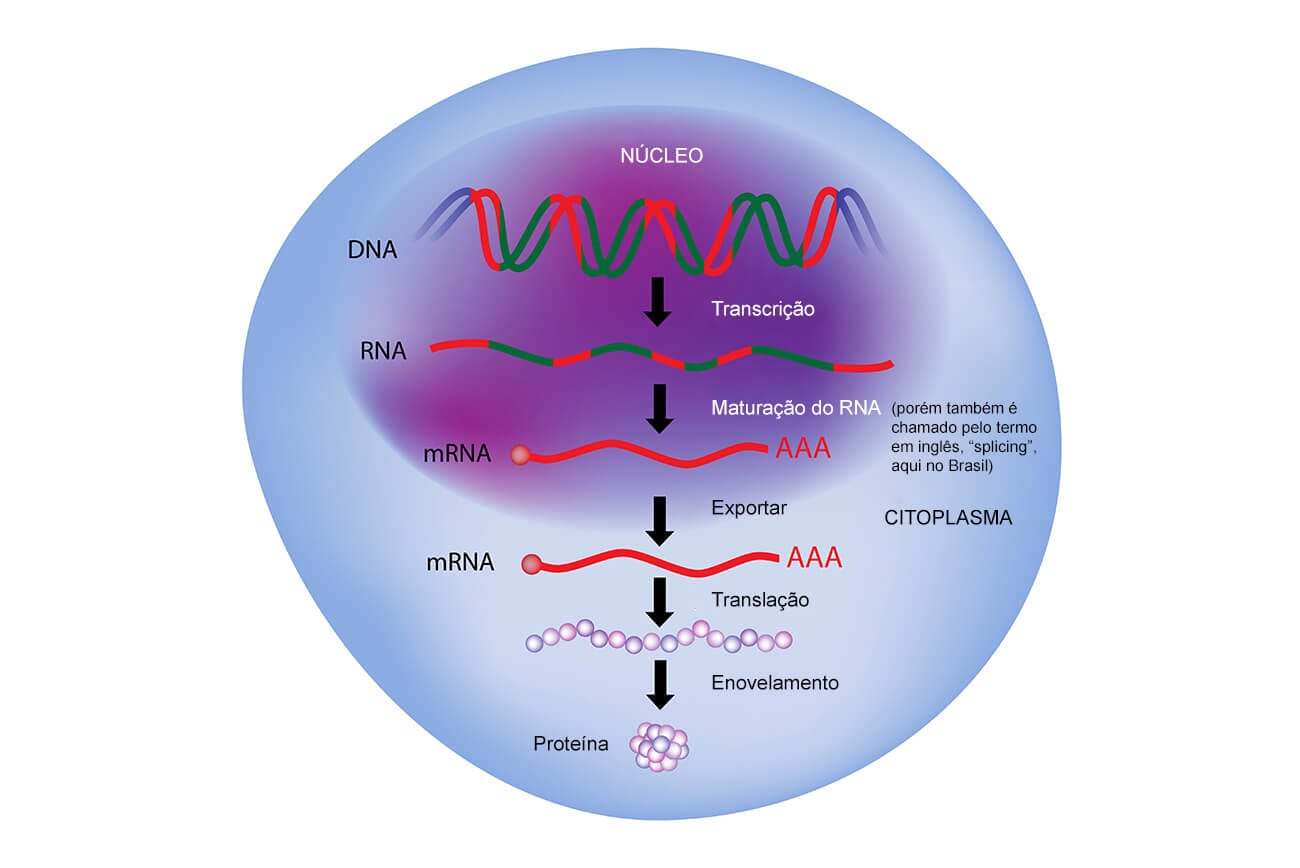
Em bactérias, não há a etapa de splicing. Ao chegar ao final da transcrição, o RNAm está pronto para ser traduzido.
A tradução é o processo no qual ocorre a síntese de proteínas, com a participação conjunta principal do RNAm, o RNAt e de estruturas celulares denominadas ribossomos.
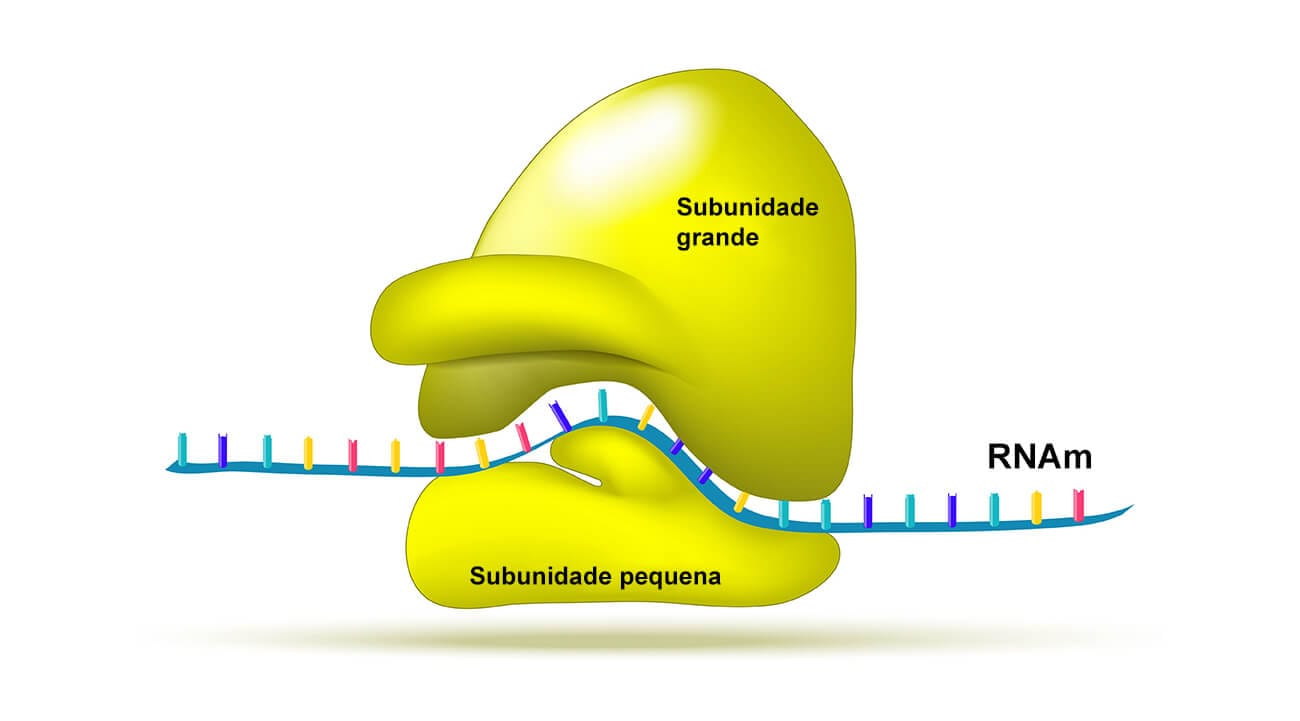
Já sabemos que a tradução em eucariotos ocorre após a maturação do RNAm, mas que em bactérias tem início logo que termina a transcrição, ou até antes.
É necessário, porém, lembrar que uma proteína é um polipeptídeo, constituído por diferentes aminoácidos. Para que seja executada a tradução, é importante lembrarmos também do código genético, pois a sequência de nucleotídeos no DNA é quem determina a sequência de aminoácidos nas proteínas. Portanto, podemos dizer que o DNA possui as informações para sintetizar moléculas de proteínas.
Cada sequência de três nucleotídeos no DNA determina o aminoácido que vai entrar na cadeia proteica.
A tradução tem início através do códon de iniciação AUG, referente ao aminoácido metionina (Met). É importante levar em consideração que a Met sempre será o aminoácido que dará início à tradução, mas não é sempre o primeiro aminoácido da cadeia proteica, já que muitas vezes a Met é retirada após a tradução.
Com o complexo de iniciação formado sobre o RNAm, acontece a ligação da subunidade grande ribossomal, com três locais onde a molécula de RNAt pode se ligar. Com isso, tem início a fase que é denominada de alongamento, e, nela, o RNAt, trazendo o aminoácido correspondente ao códon seguinte da cadeia, liga-se ao ribossomo, enquanto o RNAt de Met é liberado para o citoplasma. Na sequência, ligações peptídicas são realizadas e se repetem até que todos os códons presentes na molécula de RNAm sejam “lidos” pelos RNAt, com a adição dos novos aminoácidos. Ocorre, então, o crescimento da cadeia, por isso o nome fase de alongamento, e esta se estende até que chegue a um dos códigos de terminação, que podem ser UAA, UAC, UGA. Esses códons não codificam aminoácidos nem fazem ligação com nenhum RNAt; em vez disso, eles possuem estrutura para se ligarem a fatores de liberação de proteínas, fazendo com que a proteína recém-formada seja considerada completa e se separe do ribossomo.
Grupo de três bases nitrogenadas de RNAm que indicam o ponto de início da tradução.
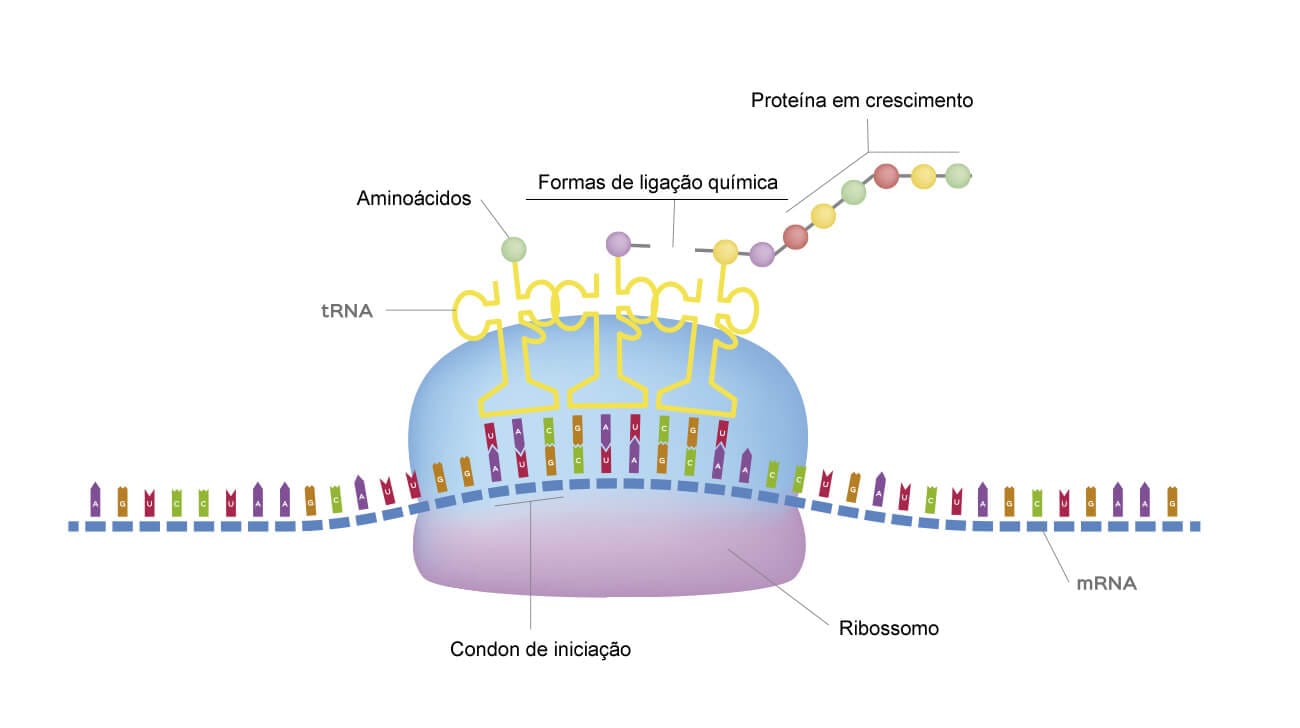
O código genético relaciona a sequência dos nucleotídeos que constituem o DNA, a sequência de códons do RNAm e os aminoácidos que constituem as proteínas sintetizadas, facilitando, dessa forma, o entendimento das funções biológicas ligadas a eles. Foi elaborado através de combinações dos 4 nucleotídeos do RNAm, em grupos triplos, obtendo-se 64 combinações, que codificam aminoácidos. Porém, atualmente, temos conhecimento de apenas 20 aminoácidos, o que nos leva a concluir que existe mais de um códon para o mesmo aminoácido. Em função disso, o código genético é intitulado como degenerado.
U |
C |
A |
G |
||||||
U |
UUU UUC |
Fenilalanina (Fen) |
UCU UCC UCA UCG |
Serina (Ser) |
UAU UAC |
Tirosina (Tir) |
UGU UGC |
Cisteína (Cis) |
U C A G |
UUA UUG |
Leucina (Leu) |
UAA UAG |
Códons de finalização |
UGA |
Códons de finalização |
||||
UGG |
Triptofano (Trp) |
||||||||
C |
CUU CUC CUA CUG |
Leucina (Leu) |
CUU CUC CUA CUG |
Prolina (Pro) |
CAU CAC |
Histidina (His) |
UGU UGC UGA UGG |
Argina (Arg) |
U C A G |
CAA CAG |
Glutamina (Gin) |
||||||||
A |
AUU AUC AUA |
Isoleucina (Ile) |
ACU ACC ACA ACG |
Treonina (Ter) |
AAU AAC |
Asparagina (Asn) |
UGU UGC |
Serina (Ser) |
U C A G |
AUG |
Metionina (Met) Códon de iniciação |
AAA AAG |
Listina (Lis) |
AGA AGG |
Argina (Arg) |
||||
G |
GUU GUC GUA GUG |
Valina (Val) |
GUU GUC GUA GUG |
Alanina (Ala) |
GAU GAC |
Ácido aspático (Asp) |
GGU GGC GGA GGG |
Glutamina (Gin) |
U C A G |
GAA GAG |
Ácido glutâmico (Glu) |
||||||||
A especialista Mildred Ferreira Medeiros fala sobre o dogma central da biologia e explica o processo de formação de proteínas.
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
Clique aqui e retorne para saber como desbloquear.
Reconhecer as tecnologias utilizadas em análise de DNA
O material genético possui características fundamentais para o entendimento sobre o funcionamento de diversos tipos de organismos, como de animais, plantas, fungos, bactérias etc. Por isso, é uma área bastante ampla, que originou instrumentos para muitos estudos genéticos no ramo da biologia molecular.
Devido ao intenso investimento na área de estudos do DNA, o conhecimento sobre o assunto se ampliou, fazendo com que deixasse de ser exclusivamente acadêmico, em teses, dissertações e artigos. O entendimento do funcionamento do DNA, suas características, possíveis formas de análises e como o organismo é comandado, além de doenças associadas diretamente ao DNA, motivaram diferentes áreas a pesquisarem e a ampliarem o conhecimento sobre o assunto.
O objetivo é tornar possível a mudança de cenários, visando a obtenção de cura para síndromes e outras doenças.
Após o domínio sobre os mecanismos de funcionamento do DNA, as tecnologias que utilizam material genético deixaram de ser aplicadas apenas nas pesquisas para a aplicação na prática.
Como exemplos de aplicação prática das análises de DNA, temos:
Profissionais da saúde usam o conhecimento acumulado sobre as características do DNA e realizam uma série de técnicas com finalidades diferentes, assim como também abrangem áreas que nem sempre estão relacionadas à saúde humana.
Muitas dessas técnicas foram desenvolvidas após o Projeto Genoma Humano, pois, nesse estudo, foram efetuadas padronizações sobre o sequenciamento de bases nitrogenadas, permitindo diversos achados. Logo, podemos dizer que esse projeto foi precursor para diversas técnicas cuja base é a utilização do material genético, resultando em uma mudança revolucionária na ciência. O projeto serviu como divisor de grande impacto para pesquisas na área biológica.
Apesar de todas as vantagens da utilização das técnicas de análise de DNA, ainda existem algumas limitações para que avancemos mais nas pesquisas científicas relacionadas à genética. Isso porque tais análises possuem um custo muito elevado, por requererem tecnologias de ponta, e estas se dão através de um maquinário com valor significativamente alto. Além disso, necessitam de um conhecimento avançado e específico a cada vez que avançamos nas pesquisas. E, quanto mais avançamos, mais complexos ficam os processos, exigindo muitos anos de estudos, testes e preparação dos profissionais, até que se comprove a sua eficácia.
Atualmente, com o conhecimento adquirido sobre as características do DNA, suas funcionalidades e regulações, empregamos essas descobertas através de diversas técnicas de análises moleculares, em diferentes áreas do conhecimento, como: saúde, justiça, agronomia, pecuária, farmácia, nutrição. A seguir, estudaremos exemplos de como essas análises são utilizadas na prática e de que forma contribuem para a solução de diferentes problemas.
Para um bom monitoramento da nossa saúde, é necessário que saibamos quais organismos nos cercam. Para conhecermos quais são os microrganismos que convivem com as pessoas de determinado local, são empregadas técnicas moleculares em amostras retiradas de objetos encontrados em:

Mobília, aparelhos eletrônicos, roupas etc.

Corrimão, torneiras, maçanetas etc.

Carros, ônibus etc.
Mãos de voluntários que residem na área do estudo.
A resposta é muito simples: com as tecnologias, podemos analisar as amostras coletadas em nível molecular, extraindo o DNA, e descobrindo quais microrganismos estão presentes para direcionar as estratégias prioritárias no seu combate. Com isso, são planejadas campanhas de vacinação para as doenças endêmicas; renovação ou ampliação do estoque de medicamentos dos postos de saúde; orientação para diagnósticos médicos; escolha de produtos para higienizar locais, principalmente hospitais.
Devido a essas informações, portanto, é possível fazer o monitoramento do microbioma da região, o que orientará as decisões no combate a possíveis doenças. Isso porque existirá um conhecimento prévio para ser levado em consideração, na hora de tomadas de decisões, de acordo com os microrganismos que foram detectados.
Através de análises genéticas, podemos saber se empresas do ramo alimentício realmente estão entregando o que prometem, ou seja, se os ingredientes descritos na embalagem de fato são utilizados em sua produção. Esse uso de análise genética tem o objetivo de impedir fraudes, principalmente no setor frigorífico, no qual já foram encontrados componentes distintos dos que estavam rotulados.
Já foi encontrado DNA de suíno em um produto que se apresentava como exclusivamente feito de carne bovina. Outro exemplo são produtos onde há mistura de carne de menor valor para baratear o preço final do produto e vender como se fosse exclusivamente feito da carne de custo mais elevado.
Pessoas que possuem casos de doenças genéticas na família são aconselhadas a fazer um exame para saber se também possuem o gene associado à doença em questão, indicando uma predisposição genética para o desenvolvimento da enfermidade futuramente. Sendo assim, esse é outro campo em que a engenharia genética, com seus avanços na área molecular, favoreceu-nos para desenvolver análises da presença ou ausência de determinados genes que indicam a predisposição para determinadas doenças.
Um exemplo são os casos de câncer de origem genética. Já foram descobertas mutações genéticas que aumentam a probabilidade do desenvolvimento da doença no individuo, como os genes BRCA1 e BRCA2, que são associados ao risco de desenvolvimento de câncer hereditário de mama e de ovários.
Quando existe uma suspeita de que um indivíduo possua uma doença genética, podemos confirmar ou descartar o diagnóstico através da análise do material genético da pessoa.
Se uma pessoa apresenta sintomas de fibrose cística, que é uma doença genética, um teste utilizando o DNA comprova se ela é ou não portadora do gene que determina a apresentação dessa condição.
Sendo assim, esse teste genético elucidará se de fato é fibrose cística ou não, com um diagnóstico preciso. Caso se confirme, o paciente receberá tratamento para amenizar os sintomas, pois doenças de origem genética não possuem cura. Caso o exame se confirme negativo, essa hipótese será descartada e outros exames devem ser realizados até que se feche um diagnóstico concreto.
Uma das formas mais avançadas do uso da tecnologia molecular para a detecção de doenças genéticas é para a prevenção da transmissão de doenças de pais para seus filhos. As técnicas de diagnóstico são empregadas até mesmo quando os pais não manifestam nenhuma doença genética, mas podem carregar genes recessivos no seu DNA. Esse tipo de prevenção tem sido empregado em fertilização in vitro. Nela, é necessário realizar um screening genético antes da implantação dos embriões, para que se tenha certeza de que estes sejam livres de genes que possam desenvolver desvantagens ocasionadas por alterações no código genético do indivíduo.
Quando a gravidez ocorre de forma natural, é possível identificar alguma alteração genética antes do nascimento?
Sim, porém essa identificação é realizada através de testes que são feitos durante o período da gestação, no pré-natal. Nesse caso, é retirada uma amostra do líquido amniótico, que é analisada para a detecção de possíveis alterações genéticas no feto em formação.
O aprimoramento da tecnologia permitiu que usássemos a genética também no ramo criminal, a fim de detectar indícios ou provas em materiais encontrados em cenas de crimes.
Essa área começou a se expandir através do trabalho de um geneticista chamado Alec Jeffreys, que publicou um artigo em 1985 na revista Nature, que possui grande alcance no meio médico/científico
No estudo, foi descrita uma técnica que utilizava como base a multiplicação simultânea de determinadas regiões do DNA, e estas foram denominadas como sondas multilocais. Funcionavam como “lanternas químicas”, pelo fato de serem capazes de reconhecer grande número de minissatélites simultaneamente, que são variáveis no DNA.
O resultado da multiplicação simultânea tinha como produto um padrão de bandas individuais, que se assemelhavam a um código de barras, e apresentavam características individuais. Então, Alec Jeffreys denominou esse sequenciamento de finger printing.
O termo “digitais do DNA” se deu por meio de uma analogia com impressões digitais, pois ambos possuem padrões exclusivos em cada indivíduo.
No meio criminal, essa técnica foi aplicada pela primeira vez na identificação de um assassino que violentou e matou duas jovens moças na Inglaterra, nos anos de 1983 e 1986. Através do emprego dessa técnica, foi possível a comparação do material genético dos suspeitos criminosos com o material genético encontrado nas evidências criminais, tendo assim um percentual altíssimo de precisão para determinar as sentenças.
Por meio da técnica de digitais do DNA, foi possível a associação de duas áreas distintas, originando a perícia forense, com base em análises biológicas de elementos encontrados em evidências em cenas de crimes.
Outro achado por meio do método da impressão do DNA foi a possibilidade de determinação com exatidão da paternidade, sendo também uma inovação de análise genética. Por meio da comparação do padrão genético do possível pai biológico com o padrão genético da criança, é possível determinar biologicamente o parentesco.
Como já temos conhecimento, o material genético de um indivíduo é formado pela junção de genes maternos e paternos, na proporção de 50% para ambos os pais. Então, assim como cada pessoa possui sua própria digital, o mesmo ocorre em relação à genética, em que cada indivíduo possui sua própria e exclusiva impressão genética.
Estudos que investigaram a padronização de genes e sua disposição no genoma apontaram que cada gene possui uma diversidade muito grande em alelos, e sabe-se que foram identificados mais de 11 mil pelo mundo. Consequentemente, é muito raro duas pessoas apresentarem o mesmo grupo de genes, com os mesmos alelos. Isso é encontrado no caso dos gêmeos univitelinos, isto é, aqueles originados da fecundação de um óvulo por um espermatozoide.
Portanto, podemos dizer que cada ser humano é único e apresenta sua impressão genética de acordo com a distribuição dos alelos nos genes e a ordem em que se encontram.
Durante a primeira fase do século XX, cientistas utilizavam o sistema ABO para analisar possíveis candidatos a pais biológicos, quando era necessário ser feito algum tipo de reconhecimento. No entanto, esse tipo de análise só pode ser utilizado para saber quais dos candidatos poderiam ser pais em potencial, devido às limitadas possibilidades de combinações dos tipos sanguíneos. Não é possível, através do sistema ABO, determinar qual dos indivíduos é o pai na situação em questão.
Com isso, técnicas para essa finalidade foram sendo aprimoradas e, nas décadas de 1980 e 1990, surgiu a possibilidade da análise e sequenciamento de DNA − para ser utilizado para fins de reconhecimento pessoal, podendo ser usado para determinar de fato qual candidato é realmente o pai biológico.
Esse tipo de exame se tornou referência no assunto de determinação de paternidade, pois, a partir dele, pudemos atingir níveis de alta precisão, dando- nos a certeza, devido ao aprimoramento do sequenciamento do genoma humano. .
A especialista Mildred Ferreira Medeiros explica como mecanismos existentes hoje no ramo da genética molecular e o avanço da tecnologia do sequenciamento do DNA humano colaboraram para solução de casos jurídicos que envolvam o questionamento sobre a paternidade biológica de crianças.
A molécula de DNA foi descoberta no ano de 1953 e, desde então, é uma das moléculas mais estudadas no mundo, pois exibe um papel de extrema importância e é indispensável para a manutenção dos seres vivos nos mais diversos ramos da Biologia. Portanto, estudos do sequenciamento do DNA são consideravelmente úteis para diferentes campos na ciência, como estudos evolutivos, cura e origem de doenças, reprodução, clonagem, dentre outros.
Sendo assim, a comunidade científica, tanto no meio médico como no da biotecnologia, acreditava que o sequenciamento do genoma humano traria descobertas que resultariam em melhorias imensuráveis. Então, entre os anos de 1999 e 2000, foi tomada a decisão de utilizar as tecnologias conhecidas e disponíveis naquele momento em prol do sequenciamento do genoma humano, dando início ao famoso Projeto Genoma Humano.

O PGH tinha como objetivo a tentativa de organizar a sequência dos 3,1 bilhões de bases nitrogenadas presentes no DNA humano e a ordem que os seus nucleotídeos se encontram dispostos, pois essas características são as que fazem com que as moléculas se diferenciem umas das outras. Conseguindo determinar tais fatos, teríamos conhecimento para analisar possíveis falhas ou anormalidades moleculares e usar esse conhecimento a favor da medicina e da biotecnologia.
A biologia molecular do século XXI teve grandes avanços em razão dos estudos genômicos de sucesso, incentivando outras áreas da ciência a se unirem nessa empreitada. Com embasamento do sequenciamento do DNA humano, tivemos investimentos na proteômica, que são estudos de proteínas e suas interações. Isso porque a comunidade científica chegou à conclusão de que, para melhor entendimento do DNA, obrigatoriamente, deveríamos também ter conhecimento sobre as proteínas, já que estas possuem funções celulares importantíssimas e essenciais em diversos processos relacionados ao material genético.
Veja a apresentação em 3D de um filamento de queratina, proteína que se encontra, por exemplo, em unhas e em cabelos humanos.
Em 2004, fomos apresentados à bioinformática, desenvolvida com o intuito de auxiliar os pesquisadores. Devido ao grande número de genes já descritos, as informações genéticas então obtidas foram reveladas na forma de números sequenciados e, em seguida, armazenadas em uma plataforma virtual norte-americana de bancos de dados denominada GenBank. Essa plataforma virtual utiliza os conhecimentos adquiridos através da bioinformática, como forma de auxílio para a organização de informações, facilitando, assim, a evolução das pesquisas.

Com o tempo, a plataforma se mostrou uma ferramenta eficaz, que vem sendo utilizada por décadas, armazenando fatos descobertos sobre o sequenciamento de DNA humano. Isso permite maior agilidade para os estudos e a existência de uma fonte de dados que possam ser usados como embasamento para solucionar futuras dúvidas.
Há quatro tipos de sequenciamento, a saber:
A demanda do material genético para a análise é elevada, o que pode inviabilizar análises em grande escala, como o gel de eletroforese.
É realizado através da polimerização de DNA com incorporação de dideoxinucleotídeos. Através dele, podemos realizar diversos projetos sobre o genoma humano, e uma das suas principais vantagens é gerar reads (leituras) grandes com boa precisão das bases.
Detecção através da luz, com liberação de pirofosfato na adição de um nucleotídeo. Tem como vantagens: ser um processo automatizado; realizar análise em curto espaço de tempo; apresentar resposta instantânea do sequenciamento; ter alto rendimento; e exigir um preparo rápido da amostra. Como desvantagens: apresenta custo consideravelmente elevado; exige absoluto domínio e conhecimento de bioinformática; e apresenta taxa de erro considerada elevada, na ordem de 0,0098.
São caracterizados por produzirem informações genéticas sobre milhões de bases em uma única corrida, como, por exemplo, em comparação com o processo em gel de eletroforese. Com um sequenciador, podemos processar cerca de 96 fragmentos; já com NGS, pode-se processar até bilhões, pois estes se diferenciam por se basearem em um procedimento paralelo e massivo de fragmentos de DNA, e seus sequenciadores leem bilhões de fragmentos ao mesmo tempo. Porém, em comparação ao Sanger, o custo para a realização desta técnica é considerado muito elevado, gerando uma desvantagem significativa.
Em outubro de 2020, ocorreu, no palácio do planalto, um pronunciamento do Governo Federal, quando foi lançado um Programa Nacional de Genômica e Saúde de Precisão, que recebeu o nome de Genomas Brasil. Este tem como principal objetivo a realização de um banco de dados com genomas completos de brasileiros, contando com cem mil genomas.
Sabemos que inicialmente os desafios tecnológicos enfrentados para que o Projeto Genoma pudesse dar continuidade foram grandes, devido à utilização de metodologias que necessitam de bastante tempo para sua finalização de forma eficiente. As dificuldades na época inicial do Projeto Genoma de compartilhamento de informações resultaram em análises superficiais naquele momento.
Durante o início, os estudos do sequenciamento dos genes eram baseados na análise dos fragmentos de DNA através do método de eletroforese com gel de poliacrilamida. Porém, houve um avanço que agilizou os estudos, adiantando os resultados antes do esperado, quando foi introduzido o Sequenciamento Sanger. Este permitiu um sequenciamento muito mais rápido e, assim, em 2003, tivemos o evento que ficou conhecido como o “final do início” ao anúncio da conclusão do sequenciamento.

Com esse grande avanço, muitas empresas de biotecnologia investiram em novo estudo nesse ramo, ocorrendo uma troca de informações interdisciplinares, que geraram pesquisas mais específicas e direcionadas. Esse evento, que tinha um objetivo maior, ficou conhecido como big sciense.
Surgiram processos mais específicos de biologia molecular, que recebem incentivos até os dias atuais, para resultados direcionados que permitam uma resposta individualizada, levando em consideração a árvore genealógica dos indivíduos e os padrões genéticos mais apresentados em determinados locais.
Atualmente, os cientistas estão trabalhando em estudos direcionados, buscando medicamentos, tratamentos, dentre outras coisas que atuem em combinação com o DNA do paciente.
Para que isso seja possível, é feita em conjunto a análise genética da população, para se ter ciência dos padrões apresentados, categorizando quais genes mais se repetem no local em que tal população reside. Todo esse processo tem o objetivo de gerar, futuramente, tratamentos personalizados de forma regional ou até individualizados, interagindo com o DNA de cada indivíduo. A pesquisa vem avançando para alcançar esse grau de sensibilidade nos tratamentos médicos, mas isso ainda requer anos de estudos e desenvolvimento de novas tecnologias.
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
Clique aqui e retorne para saber como desbloquear.
Compreender o princípio de DNA recombinante e clonagem
Com o avanço das pesquisas com os genes e o aparecimento da genética moderna, como nova forma de estudarmos fatores gênicos, surgiu o termo engenharia genética, que elucidou diversos processos na bioquímica, revolucionando a área em apenas algumas décadas. Na engenharia genética, a teoria que mais teve relevância para que acontecessem tamanhas mudanças significativas foi a técnica do DNA recombinante. A partir dela, outras estruturas moleculares foram elucidadas, sobretudo macromoléculas com importância para o metabolismo das células, permitindo também o entendimento de leis de catálise enzimática.
Utilizando como base a tecnologia do DNA recombinante, foi possível compreender processos bioquímicos cada vez mais complexos, permitindo o melhor entendimento sobre eventos como divisão celular, respostas do sistema imunológico, oncogênese, entre outros.
Você pode estar se perguntando no que, de fato, consiste esse princípio tão importante. Essa tecnologia consiste, resumidamente, em processos de transferência de DNA de um organismo para outro com o objetivo de gerar melhorias com a modificação e tem como técnica central a clonagem molecular. O termo DNA recombinante diz respeito a como nos referimos às moléculas de DNA que possuem tais alterações, ou seja, seu material genético é derivado de duas ou mais fontes, que muitas vezes são misturas de diferentes espécies.
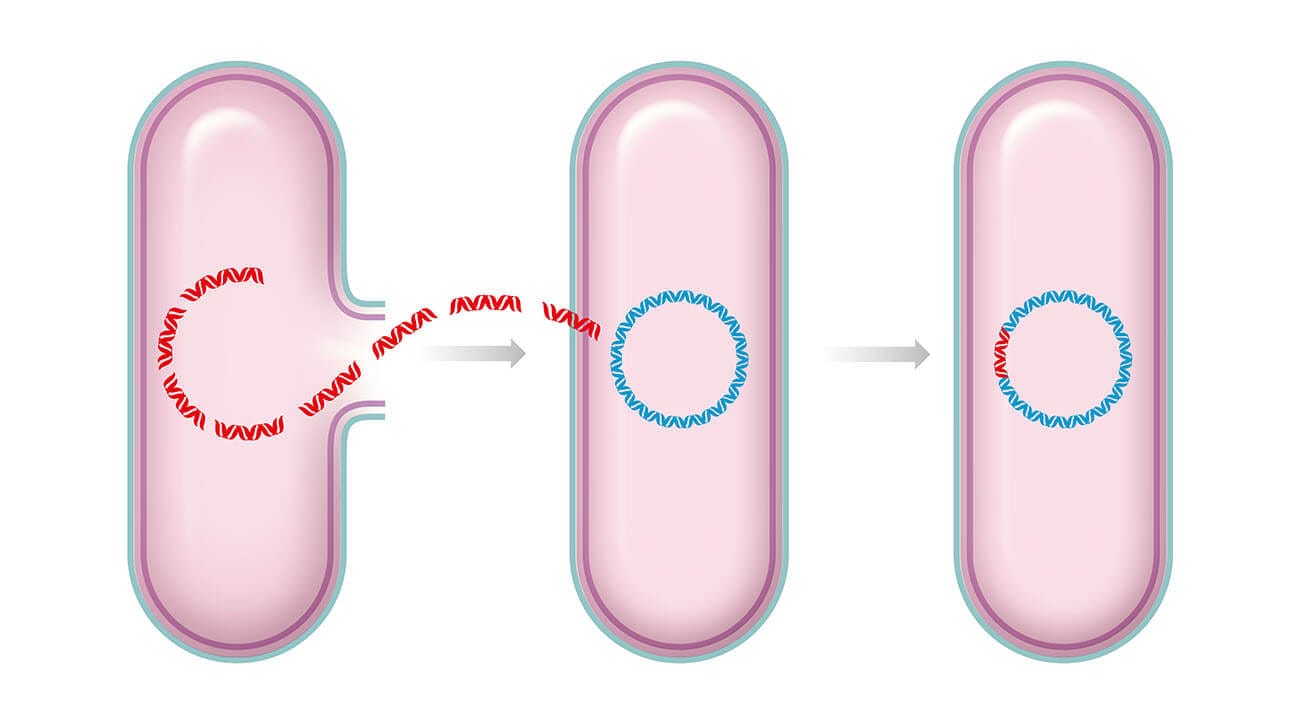
Para que isso possa ocorrer de fato, é necessário isolar in vitro as moléculas individualmente, para se entender um organismo inteiro e seus processos biológicos. Nessa etapa, os cientistas se depararam com um desafio, pois entender os mecanismos de armazenamento do material genético que é contido na molécula de DNA de forma bioquímica é extremante complexo. Isso porque existem diversos alelos "perdidos" nas grandes moléculas que formam os cromossomos, tornando muito difícil encontrar um gene específico, que está distribuído entre milhares de genes que encontramos no DNA de um mamífero, por exemplo.
A resposta para enfrentar essa barreira começou a surgir nos anos 1970, pois, naquela época, começaram a ser desenvolvidas tecnologias que permitiam localizar e isolar frações específicas de segmentos de DNA extraídos de cromossomos. Tais técnicas consistiam em extrair o fragmento de DNA de um cromossomo e fazer cópias desse fragmento, a fim de estudá-lo. Esse novo procedimento descrito foi denominado como clonagem e, na época em que foi apresentado, foi muito criticado, acusado de estar extrapolando o limite ético, na visão da sociedade. Ainda hoje, carrega alguns desses dilemas.
Atualmente, seu princípio de clonagem molecular − com o uso de enzimas, para a expressão de genes, fazendo a recombinação de DNA entre organismos distintos − tem suas técnicas bem desenvolvidas e dominadas, permitindo a sua aplicação em muitas áreas, como saúde e agropecuária, principalmente.

A técnica do DNA recombinante se desenvolve em quatro etapas, a saber:
Consiste no corte do DNA na localização precisa, procedimento que é possível devido ao uso de enzimas de restrição ou endonucleases, que funcionam como “tesouras” químicas a nível molecular, destacando o ponto desejado do DNA.
Ocorre a união dos dois segmentos de DNA que possuam a compatibilidade para se complementar, através dos segmentos dos filamentos complementares da fita de DNA.
É realizada a seleção e autorreplicarão de uma pequena molécula de DNA. Esse processo, também denominado de amplificação, é capaz de aumentar o DNA em número de cópias, através do processo denominado reação da cadeia da polimerase (PCR). Através dessa técnica, é possível obtermos uma quantidade mínima de cópias, com conteúdo suficiente para ser extraído, para dar seguimento aos experimentos.
É composta pela transferência do DNA. Ou seja, o DNA que se deseja acrescentar a uma célula é retirado de um tubo de ensaio para ser inserido na célula hospedeira, que dará condição para que ocorra a replicação desse DNA híbrido.
Esse conjunto de etapas descrito constitui o que chamamos de engenharia genética ou técnica do DNA recombinante.
Clonagem é o nome dado ao processo científico pelo qual é produzida uma cópia idêntica geneticamente a um molde. A clonagem pode ocorrer em nível molecular, celular ou mesmo de organismos. Em nível celular, uma célula geneticamente idêntica é criada a partir de uma célula molde, resultando em duas células idênticas, uma original e um clone. Em organismos, é realizada in vitro, onde é formado um indivíduo sem a fusão de gametas. Em nível molecular, a clonagem do DNA é o principal processo da tecnologia do DNA recombinante.
O termo “clone” significa seres geneticamente idênticos entre si.
De forma resumida, a clonagem do DNA envolve a seleção e a separação de um gene e até mesmo de um segmento de DNA específico. O material de escolha se liga a uma pequena molécula de DNA, que é replicado, originando milhões de cópias desse DNA recombinante.
Em primeiro lugar, é preciso definir o gene ou segmento do DNA que deverá ser clonado. O processo tem a participação de dois tipos de enzimas: as enzimas de restrição e a enzima DNA ligase. Utilizamos a primeira para realizar a separação do gene ou fragmento de DNA desejado, ou seja, essa enzima tem a capacidade de cortar a molécula de DNA em locais específicos, obtendo-se o gene ou o fragmento de interesse. Esse gene será posteriormente colocado em um vetor, que consiste em uma molécula de DNA que tenha a capacidade de transportar esse fragmento de DNA para dentro de uma célula.
Vetores de clonagem possuem três origens diferentes:
São moléculas de DNA circular de células bacterianas que se replicam facilmente e independentemente do cromossomo bacteriano nas células hospedeiras, transportando o fragmento desejado.
São fagos, vírus, que infectam bactérias e possuem estruturas muito simples, sendo constituídos basicamente por uma molécula de DNA. Quando este se liga à bactéria, ele se integra a ela e, quando essa bactéria se replicar, irá consequentemente também replicar o DNA inserido.
São plasmídeos recombinantes que possuem caraterísticas tanto de um plasmídeo como de bacteriófagos.
A imagem a seguir ilustra o processo de clonagem por meio de bacteriófagos.
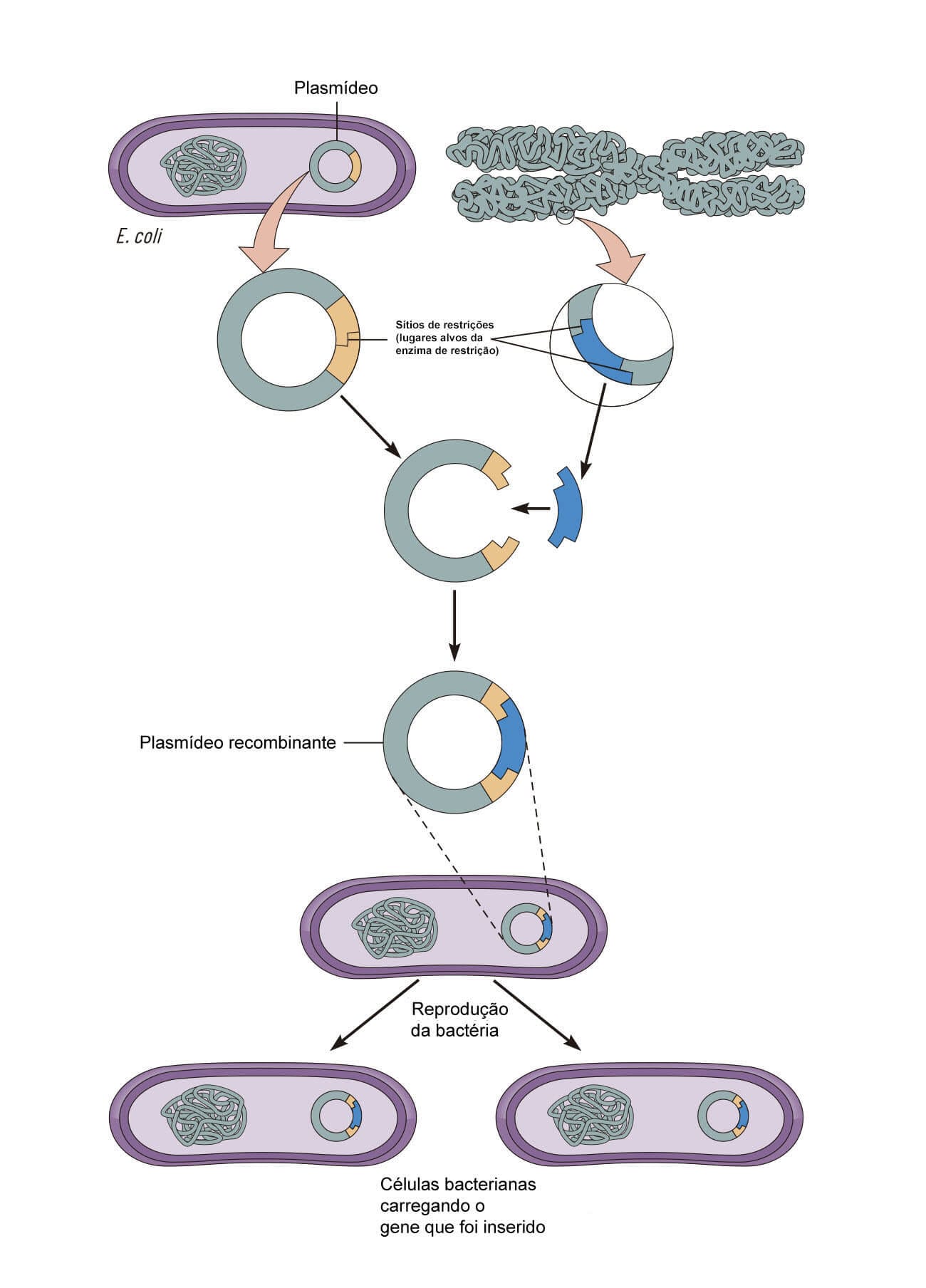
Para que este fragmento de DNA seja incorporado ao vetor, é necessária a atuação da mesma enzima de restrição que o separou de sua célula de origem. Após este processo, os dois segmentos de DNA podem ser incorporados através da enzima DNA ligase, formando finalmente a molécula de DNA recombinante.
Com a formação dessa nova molécula estável, o vetor pode ser introduzido em uma célula, geralmente célula bacteriana. Após sucessivas divisões das células, é feita a identificação e a separação delas, agora denominadas recombinantes, e passadas às células ou ao organismo-alvo; assim, a porção de DNA desejada é passada para este organismo, e este a incorpora. Após receber o fragmento de DNA, o organismo-alvo passa a possuir aquele gene de interesse, fazendo parte de seu material genético.
A partir da obtenção das células recombinantes, muitas aplicações são possíveis, como veremos mais adiante.
Os processos de clonagem foram, ao longo do tempo, tornando-se mais complexos, e atualmente já é possível a obtenção de exemplares de clones de diversas espécies, como:
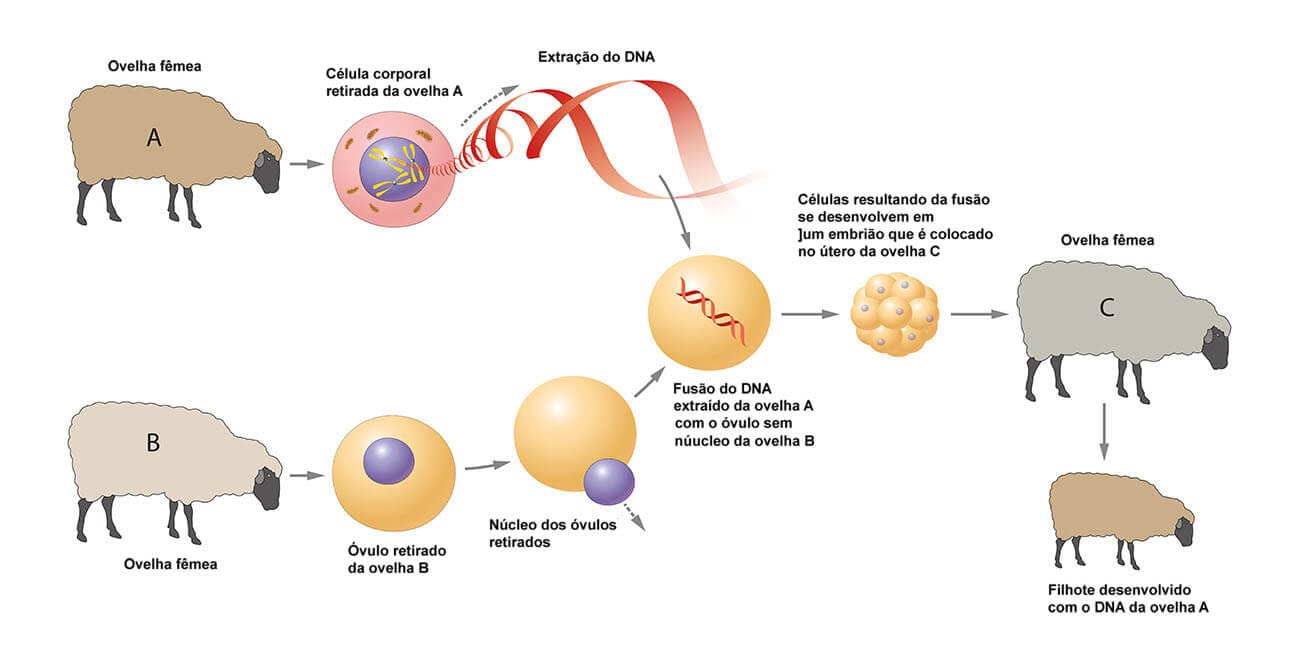
Porém, o caso mais famoso mundialmente é o da ovelha Dolly, o primeiro clone feito a partir de uma célula adulta de ovelha que teve sucesso, em 1997. Foi realizado por cientistas escoceses, através da união de uma célula somática mamária de uma ovelha de “cara branca” (Finn dorset) com um óvulo de uma ovelha de “cara preta”. Esse óvulo utilizado teve seu núcleo retirado, ou seja, teve suas informações genéticas removidas e, em seu lugar, foi implantado o núcleo da célula somática mamária contendo todo o genoma da ovelha de “cara branca”. A célula resultante desse processo foi implantada no útero de uma ovelha de “cara preta”, resultando no nascimento de Dolly, uma ovelha de “cara branca” originada a partir do material genético de uma célula de glândula mamária.

Por que a célula implantada foi o óvulo, e não a célula mamária, que já possuía o núcleo diploide? Por que o óvulo foi implantado na ovelha de “cara preta”?
Para se fazer pesquisa, alguns procedimentos são necessários a fim de que os resultados sejam confiáveis e reprodutíveis.
O uso do óvulo como núcleo da célula mamária foi empregado no experimento porque, em condições normais de fecundação, logo após a fusão dos núcleos, o óvulo começa a se dividir em um padrão específico para originar o zigoto. Implantando o óvulo com o núcleo diploide, seria como se o óvulo estivesse fertilizado e se dividiria, o que realmente aconteceu. A célula mamária, caso se dividisse, originaria novas células mamárias. A escolha da ovelha de "cara preta” para a implantação do óvulo no útero garantiria observar se a ovelha gerada teria as características esperadas da ovelha doadora da célula mamária (de “cara branca”) ou se houve alguma interferência da ovelha mãe (de “cara preta”).
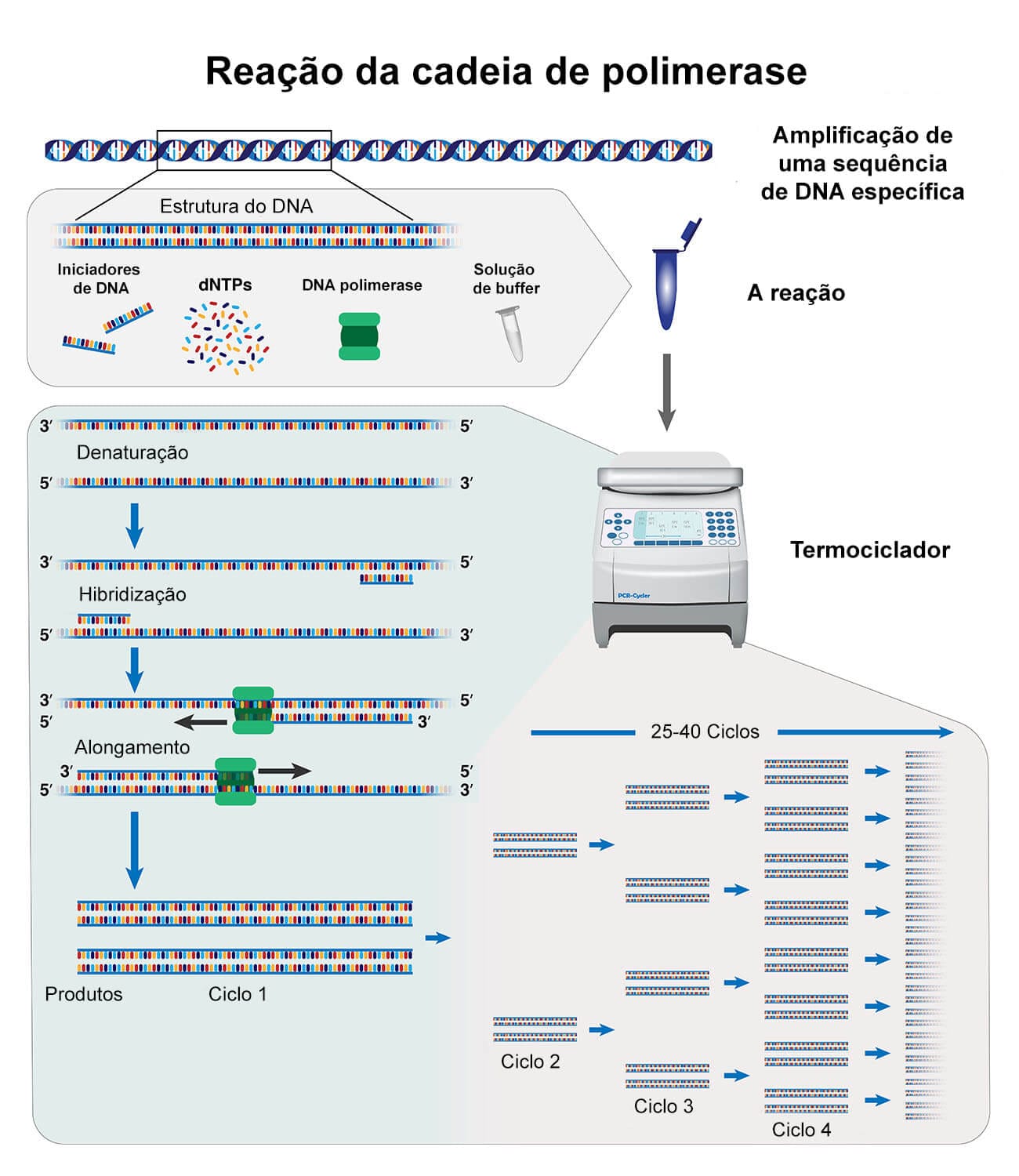
A utilidade do DNA recombinante é bastante reconhecida no meio científico para diferentes aplicações, independentemente de ser no ramo da pesquisa, no terapêutico ou no comercial. As áreas de abrangência também são diversas, mas figuram como as principais:
Muitas plantas utilizadas na alimentação de humanos e animais atualmente são geneticamente modificadas, com o intuito de gerar melhor retorno para os grandes produtores. Um exemplo de alimento muito consumido na forma transgênica é o milho.
A especialista Mildred Ferreira Medeiros fala sobre o uso de alimentos transgênico para a alimentação humana e possíveis efeitos colaterais na saúde.
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
Clique aqui e retorne para saber como desbloquear.
Descrever a transformação genética e suas aplicações
Dentro da Biologia, temos um ramo denominado biotecnologia, que consiste na união da biologia tradicional, clássica, que conhecemos, com os avanços tecnológicos que vivenciamos ao longo dos anos. Desde 1950, com o início do estudo do DNA, até os dias atuais, tivemos um avanço imensurável para relativamente pouco tempo. Historicamente falando, um dos avanços mais notáveis surgiu na década de 1970, com os estudos dos desdobramentos do código genético, não só dos seres humanos, mas de vários outros seres. Daí surgiu um conceito chamado engenharia genética, mencionada anteriormente, que ainda pode ser considerada relativamente nova.
O conceito de engenharia genética introduziu na área biológica novas perspectivas de abordagens para estudos científicos, com o entendimento de dinâmicas biológicas em níveis moleculares.
Fomos apresentados aos Organismos Geneticamente Modificados, também chamados de transgênicos, que atualmente já são uma realidade inserida no nosso dia a dia. No entanto, para o surgimento desses novos achados, houve investimento de distintos ramos industriais, incluindo as da área da agricultura, que obteve amplo sucesso.
A especialista Mildred Ferreira Medeiros fala sobre biotecnologia, sua origem e aplicabilidade.
Com os incentivos no estudo da genética agrícola patrocinada por grandes industriais do ramo, tivemos uma grande produção de dados sobre esses produtos, o que forçou a sociedade a se adequar a essas novas informações.
Mas o que são transgênicos? Qual o conceito que emprega tal denominação?
Os transgênicos, ou OGM, como o nome já diz, são aqueles organismos que sofreram alteração genética, ou seja, que receberam um gene de outro organismo, que atuou como doador. Esse gene recebido se integrou ao código genético do receptor, gerando uma mudança através de uma característica que o receptor não apresentava anteriormente.
Na natureza, tal evento reproduzido em laboratório ocorre de forma natural, através de mutações ou alterações que acontecem espontaneamente. Porém, no caso de OMG, a alteração é precisamente manipulada por cientistas em busca de alguma mudança benéfica e, após esse processo, são realizados estudos para averiguar se o novo organismo gerado é equivalente ou não ao produto de origem.
A engenharia genética permitiu que os cientistas modificassem o código genético de organismos, reproduzindo eventos que ocorrem espontaneamente na natureza de forma proposital em laboratório.
Mas qual o motivo de cientistas realizarem essas modificações no código genético de alguns organismos? Qual o intuito?
Podemos dizer que os cientistas enxergaram na engenharia genética a possibilidade para a solução de problemas da sociedade. Eles utilizaram conceitos já existentes na natureza, como dito anteriormente; logo, as técnicas não foram projetadas por seres humanos: são fruto da observação de outros seres, que possuem a habilidade de transferir características genéticas para outros organismos de outras espécies, de forma natural.
Levando em consideração tais informações, os OGMs são produtos da ideia de aprimorar alguns organismos, com o objetivo de amplificar habilidades, gerando vantagens evolutivas.
Criar sementes mais resistentes à alteração climática e que necessitem de menos nutrientes no solo para germinarem e crescerem, como solução para a fome, em certas regiões que possuem solos pobres em nutrientes. Evitar doenças geradas por agrotóxicos, através da criação de sementes que formem plantas resistentes a pragas, que não permitem que a plantação se desenvolva sem o uso dos pesticidas. Criação de plantas que não atraiam predadores, ou que liberem toxinas seletivas, evitaria doenças/intoxicação pelo uso de produtos químicos nas plantações e a fome, dentre outras várias alterações que podem se mostrar benéficas.
A produção de alimentos transgênicos, de acordo com a Lei Brasileira de Biossegurança (Lei nº 11.105/05) é permitida desde que atendidas às regulamentações para essas atividades. São aplicadas regras estritamente rigorosas, com determinações e requisitos a serem cumpridos obrigatoriamente, possuindo fiscalização e vigilância desde sua idealização, passando pelo setor de produção, teste nos diferentes níveis, até o produto final estar disponível para comercialização. São processos que geram um longo acompanhamento – em torno de dez anos.
Para ser garantida a segurança alimentar e ambiental do produto final, essas etapas são analisadas e aprovadas pela Comissão Técnica Nacional de Biossegurança, vinculada ao Ministério de Ciência e Tecnologia. A CTNBio reúne especialistas de várias áreas de conhecimento científico, que analisam mensalmente pesquisas em andamento e propostas de pesquisas envolvendo OGMs.
A CTNBio é responsável por diversas áreas, e não só pela agricultura, avaliando muitos produtos associados a possíveis impactos à saúde humana e animal, como também ao meio ambiente.
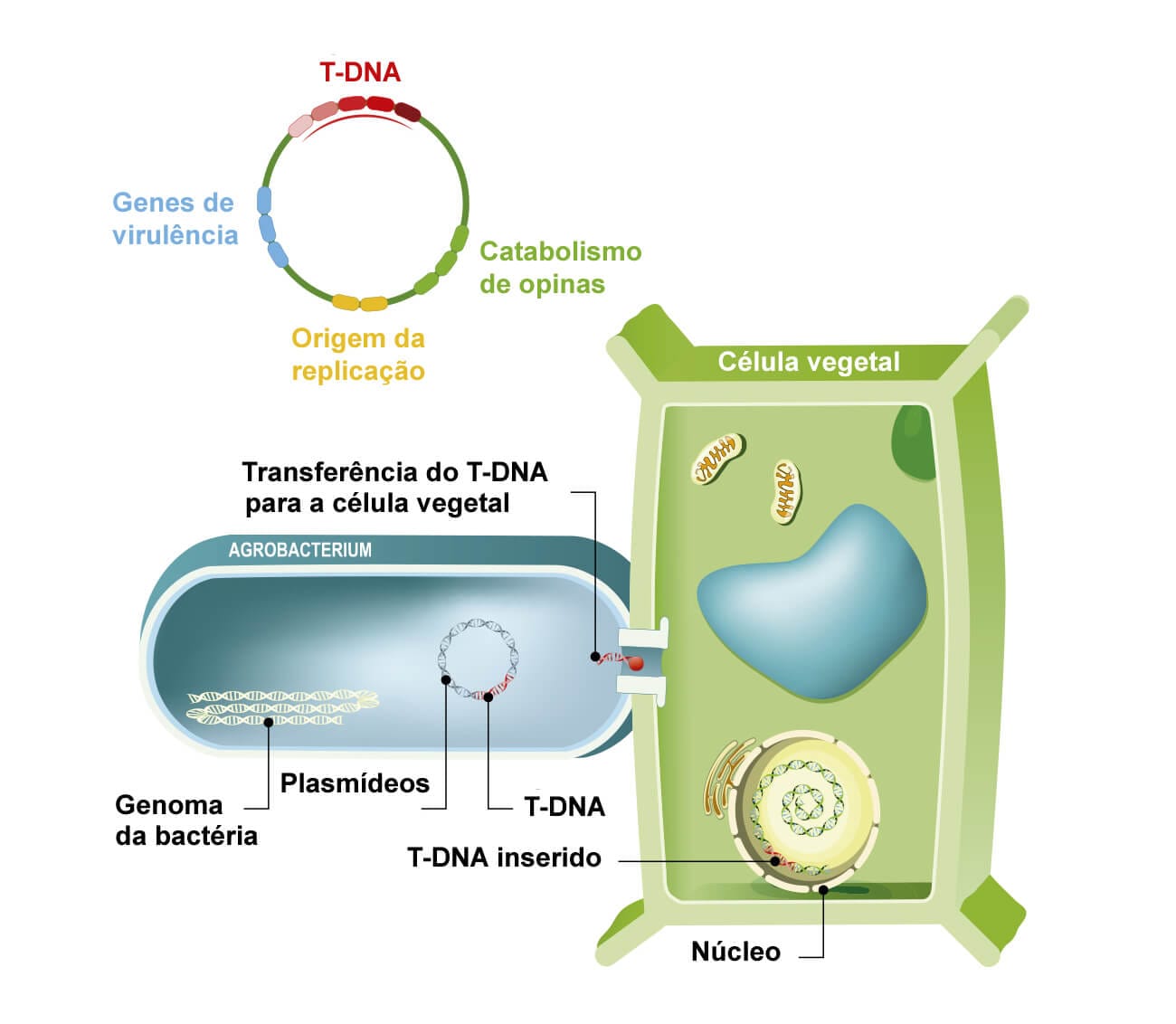
Agrobacterium tumefaciens é o agente causador da galha-da-coroa, que consiste em uma doença que afeta muitas plantas Eudicotiledôneas. A doença induz a formação de tumores na junção entre o caule e a raiz das plantas, região do colo ou coleto. Esses tumores são resultantes do desenvolvimento exacerbado das células, que ocorre devido à transferência de genes da Agrobacterium tumefaciens para o genoma da planta afetada.
Plantas do grupo das Angiospermas, que produzem flores, cuja semente é formada por dois cotilédones, estrutura que armazena nutrientes para o embrião. Quando partimos a semente do feijão ao meio, longitudinalmente, separamos os dois cotilédones dela.

Os genes da bactéria inseridos no genoma da planta infectada estão contidos em um plasmídeo, denominado Ti. Esses plasmídeos possuem genes com atividade altamente tumoral, que atuam através de duas regiões: a região T, que é a transmitida para a célula vegetal, e a região de virulência chamada de vir, com a parte do material genético de produção de proteínas, que a tornam capaz de transmitir seu material genético para a célula vegetal.
Quando a região T é transferida e se integra à célula vegetal, passa a ser chamada de T-DNA.
Os genes presentes no T-DNA são responsáveis pela codificação de enzimas que possuem função na síntese de produção de hormônios, associados ao crescimento das plantas (auxinas e citocinas), promovendo o crescimento exacerbado, formando tumores.
O T-DNA também possui regiões que codificam enzimas que determinam a síntese de opinas, catalisadas especificamente pela bactéria colonizadora, servindo como nutriente.
Se a Agrobacterium tumefaciens causa tumor na planta, por que ela é de interesse para a ciência?
Exatamente pela sua capacidade de transferência de gene. Essa característica da bactéria está sendo explorada em processos biotecnológicos, já que os genes que formam o T-DNA podem ser facilmente substituídos por outros genes de interesse, como os que expressam resistência a um antibiótico, por exemplo.
A transformação genética usando a Agrobacterium tumefaciens como vetor tem sido empregada em plantas, mas há pesquisas usando essa bactéria em outros organismos, como fungos, animais e até células humanas. Portanto, pode-se concluir que a transformação genética de plantas por meio da Agrobacterium tumefaciens é possível devido ao conhecimento prévio das bases moleculares responsáveis pelo processo de infecção da planta hospedeira, servindo como um vetor natural para a transformação genética em plantas e em outros organismos.
Biobalística é uma técnica de transformação genética que se dá por meio de um método de bombardeamento com micropartículas ou acelerador de micropartículas, que atua com o objetivo de introduzir moléculas de DNA ou RNA em outros organismos.
A biobalística é utilizada no processo de transformação de plantas, e ocorre através do uso de microprojéteis de ouro ou tungstênio envolto por DNA. Estes são acelerados a velocidades superiores a 1500km/h, através de equipamentos que utilizam sistemas de ondas de choques resultantes de uma explosão química, descargas elétricas ou pressão com uso de gás hélio.
Esse processo possibilita a penetração no genoma de maneira que não cause danos letais à célula no ato de romper a parede e a membrana celulares. Essas micropartículas que são inseridas, uma vez que penetram, alojam-se de forma aleatória nas organelas. Depois, pela ação do líquido presente no interior celular, têm o DNA dissociado, possibilitando a integração dessas novas moléculas inseridas no genoma do hospedeiro, ocorrendo, assim, a transformação celular.
Microprojéteis de ouro ou tungstênio?
Essa técnica possui desvantagens associadas tanto no uso de microprojéteis de ouro quanto nos de tungstênio. Vamos ver.

O uso do tungstênio, com o decorrer do tempo, causa deterioração, podendo se tornar tóxico para alguns tipos celulares, que também são sujeitos à oxidação, o que pode afetar a integração do DNA inserido, fazendo com que percam a adesão ou sejam degradados.

As partículas são mais compatíveis biologicamente, não causando danos, como ocorre com o uso do tungstênio. Porém, essas partículas tendem a se aglomerar no interior das células de forma irreversível, o que pode dificultar a integração do DNA inserido com o DNA da célula hospedeira, reduzindo a eficiência do método.
Com o uso de técnicas que surgiram graças aos investimentos nos setores de biotecnologia agrícola, atualmente, a transformação genética em plantas vem sendo utilizada com a finalidade de aprimorar características biológicas e/ou possibilitar a criação de novos vegetais.
A inserção de genes pode acontecer com uso de genes isolados de outras plantas, microrganismos ou animais, gerando trocas de material genético entre diferentes espécies, com a finalidade de determinar importantes características agronômicas, como resistência e condições climáticas adversas, tolerância a pragas etc.
Consiste no processo de introdução de um ou vários genes em um organismo.
Para que esse processo de transformação genética em plantas ocorra, é necessária a utilização de vetores. Para isso, é preciso ter conhecimento sobre três partes específicas do gene em questão:
Os vetores utilizados são geralmente plasmídeos.
Para o desenvolvimento desse evento na prática, existem diferentes métodos, que são agrupados em:
A transformação feita por método direto é baseada em ações físicas e químicas, nas quais a passagem do DNA para dentro da célula vegetal é desenvolvida utilizando a eletroporação, que permite a travessia desse material por meio de choques, em campo elétrico que apresente eletricidade controlada. Esse processo, como já discutido anteriormente, recebe o nome de biobalística e é realizado através da inserção em alta velocidade de microprojéteis cobertos de DNA na célula hospedeira.
Na transformação indireta, são utilizadas as bactérias Agrobacterium tumefaciens, já mencionadas, ou Agrobacterium rhizogenes, como vetores na intermediação da transformação do DNA. Esse método é mais utilizado em Eudicotiledôneas, pois possui pouca susceptibilidade em Monocotiledôneas.
Podemos definir que animais transgênicos são aqueles que tiveram seu material genético modificado, por meio de intervenção humana, por um processo chamado transgenia. Essa técnica consiste na inserção de DNA exógeno em um indivíduo, cujo genoma seja compatível para uma recombinação, alterando o genoma daquele indivíduo.
Desenvolvida na década de 1970 em camundongos (mamífero que até os dias atuais possui o genoma mais facilmente manipulável), atualmente, a transgenia é realizada através de duas técnicas:
É feita a transferência de um DNA exógeno para o genoma de um indivíduo.
A alteração de DNA já existente no animal é feita por combinações homólogas em células-tronco embrionárias.

Essa técnica é realizada, como o nome já diz, através de microinjeções contento uma solução com transgene de interesse em sua composição, no pronúcleo de um óvulo recém-fertilizado. Dessa forma, cópias dos genes injetados se integram ao DNA do indivíduo hospedeiro e se distribuem de forma mendeliana, em sítios aleatórios no genoma.
Por isso, o transgene deve conter todos os elementos de um gene natural, ou seja, a região promotora, a região codificante e o sítio de adição de poli-A, que são constituídos pela técnica de DNA recombinante, programados para responderem a estímulos biológicos.
Sendo assim, esse gene exógeno inserido, uma vez integrado ao DNA do indivíduo receptor, passa a se superexpressar nos tecidos de interesse, tornando possível o estudo da função daquele gene no organismo.
Essa técnica é amplamente utilizada como ferramenta de pesquisa, sobretudo em estudos de doenças genéticas dominantes, mas apresenta algumas limitações. Devido a sua inserção ocorrer em sítio aleatório no momento de integração do gene, este pode não estar no controle de todos os elementos cis, ou seja, no mesmo cromossomo, que controla a expressão do gene exógeno já presente previamente no núcleo do hospedeiro. Isso pode acarretar, como consequência, a presença de três alelos homólogos, dois correspondentes ao DNA original e um alelo do gene transmutado, o que pode gerar consequências críticas.
Essa metodologia foi criada a partir da combinação de duas técnicas:

Essa combinação gerou uma nova forma de criação de transgenia, mais precisa na manipulação do genoma, gerando um indivíduo geneticamente mais consistente.
Essa técnica consiste em algumas etapas, a saber:
As células-tronco possuem como característica principal o fato de não serem diferenciadas e serem pluripotentes. Ou seja, quando recolocadas em blastocistos, estas podem retomar o seu desenvolvimento normal, no tecido embrionário, incluindo a diferenciação de células germinativas.
Levando em consideração essa informação, cientistas descobriram que é possível modificar geneticamente células-tronco, através de culturas de células, utilizando a recombinação de genes homólogos, que geram um processo de substituição de um alelo normal de um gene específico por uma versão mutada do mesmo gene.
Dessa forma, é possível obter linhagens in vitro de células-tronco geneticamente modificadas.
Quando adicionadas em embriões, as linhagens de células-tronco geneticamente modificadas são agregadas à mórula e incorporadas ao embrião. O indivíduo resultante desse embrião é considerado um ser quimera, pois são originados parte por células do seu organismo natural, parte pelas células-tronco modificadas.
Se as células-tronco modificadas derem origem a células de linhagens germinativas, essa mutação será transmitida para suas próximas gerações e anulará o gene original. Quando isso acontece, dizemos que o gene foi nocauteado, e esse indivíduo recebe o codinome “nocaute”.
Essa técnica é bastante utilizada em camundongos, gerando os conhecidos camundongos nocauteados. Essa habilidade de modificar o genoma permite a seleção de genes específicos para passarem para a próxima geração, criando camundongos com genótipo desejado.
Utilizados em estudos, por exemplo, das várias funções de citocininas, de moléculas co-estimulatórias.
Blastocisto é um embrião que se desenvolveu até o quinto dia, por isso também pode ser denominado embrião D5 ou embrião de quinto dia.
É o primeiro estágio do desenvolvimento embrionário de alguns tipos de zigotos, processo que ocorre logo após a fertilização. É uma massa globular de células.
Esses animais possuem um papel fundamental na pesquisa científica, pois, com o estudo desses organismos, é possível ser feita a observação de reações fenotípicas, produtoras das alterações genéticas. Isso faz com que a técnica tenha um grande potencial para criarmos, futuramente, seres com genomas específicos in vivo de camundongos e de outros animais, para uma investigação gênica mais profunda.
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
Clique aqui e retorne para saber como desbloquear.
Neste tema, estudamos conceitos fundamentais da biologia molecular voltada para a genética e conceituamos o dogma central da biologia molecular, evidenciando as mudanças que seu descobrimento trouxe para a ciência.
Detalhamos como acontece a função de eventos básicos que ocorrem no material genético dos seres vivos, que são de extrema importância para a manutenção da vida e a variabilidade genética.
Aprendemos sobre fatos históricos na ciência, desde o descobrimento da molécula de DNA, passando pelo Projeto Genoma e chegando ao ramo da biotecnologia, no qual nos encontramos nos dias atuais. Abordamos o aprimoramento de técnicas com o uso de material genético de plantas e animais, com o intuito de resolver problemas sociais e trazer diversos outros benefícios para a vida humana e dos animais e para o meio ambiente.
Ouça o podcast sobre a relação dos transgênicos com o meio ambiente, sob a visão dos produtores de transgênicos e de ambientalistas.
Identificou processos básicos de biologia molecular em genética.
Reconheceu as tecnologias utilizadas em análise de DNA.
Compreendeu o princípio de DNA recombinante e clonagem.
Descreveu a transformação genética e suas aplicações.