Descrição
Neste tema, será apresentada a farmacologia envolvida na terapia das principais doenças do sistema nervoso central, por meio dos usos clínicos, mecanismos de ação, efeitos adversos e interação medicamentosa de cada grupo farmacológico.
PROPÓSITO
Obter conhecimento sobre as características farmacológicas dos antidepressivos, ansiolíticos, anticonvulsivantes, antipsicóticos e antiparkinsonianos, bem como sobre seus mecanismos de ação.
OBJETIVOS
Módulo 1
Descrever os mecanismos básicos que envolvem a depressão, a ansiedade e a farmacologia dos ansiolíticos e antidepressivos
Módulo 2
Reconhecer os fármacos que agem no controle das crises convulsivas, seus mecanismos de ação, efeitos adversos e suas interações medicamentosas
Módulo 3
Identificar fármacos antipsicóticos e antiparkinsonianos, enfatizando seus efeitos farmacológicos e suas utilizações terapêuticas de acordo com suas particularidades clínicas
Introdução
Drogas que atuam no sistema nervoso central (SNC) têm importante valor terapêutico, podendo aliviar a dor, reduzir a febre, suprimir movimentos desordenados, induzir sono ou excitação e reduzir o apetite. Esses fármacos, que agem seletivamente, podem ser usados para tratar ansiedade, depressão, mania ou esquizofrenia, mesmo com a preservação da consciência.
Medicamentos estimulantes socialmente aceitáveis e antiansiedade (ansiolíticos) contribuem para a estabilidade emocional, o alívio da ansiedade e o prazer. No entanto, o uso excessivo de tais drogas pode afetar a qualidade de vida quando não administradas de forma controlada.
A automedicação leva à dependência física e/ou a efeitos colaterais, como ocorre no uso de drogas recreativas que estimulam o SNC. Compreender a base celular e molecular das funções complexas e variadas do cérebro humano é apenas o começo para esclarecer como uma droga ativa no SNC pode atuar em vários sítios com efeitos opostos.
Os estudos científicos do SNC têm dois objetivos sobrepostos: usar drogas para elucidar os mecanismos que operam no SNC normal e desenvolver drogas para corrigir eventos fisiopatológicos no SNC anormal. Ao longo deste tema, você conhecerá as principais classes de fármacos que atuam nesse sistema, bem como seus respectivos mecanismos de ação, efeitos adversos e suas interações medicamentosas e alimentares.
MÓDULO 1
Descrever os mecanismos básicos que envolvem a depressão, a ansiedade e a farmacologia dos ansiolíticos e antidepressivos
Para começar, assista ao vídeo a seguir, que apresenta os aspectos clínicos e sintomas da depressão e da ansiedade.
Neuroquímica da depressão
Alterações nos estados de humor e nas formas de interação com o ambiente refletem as funções alteradas de regiões do encefalo através de suas comunicações sinápticas. O comportamento depressivo é ligado à modulação dos níveis dos neurotransmissores noradrenalina, dopamina e/ou serotonina liberados nas sinapses encefálicas, fazendo com que a depressão seja a consequência de um defeito em um ou mais desses sistemas de neurotransmissores.
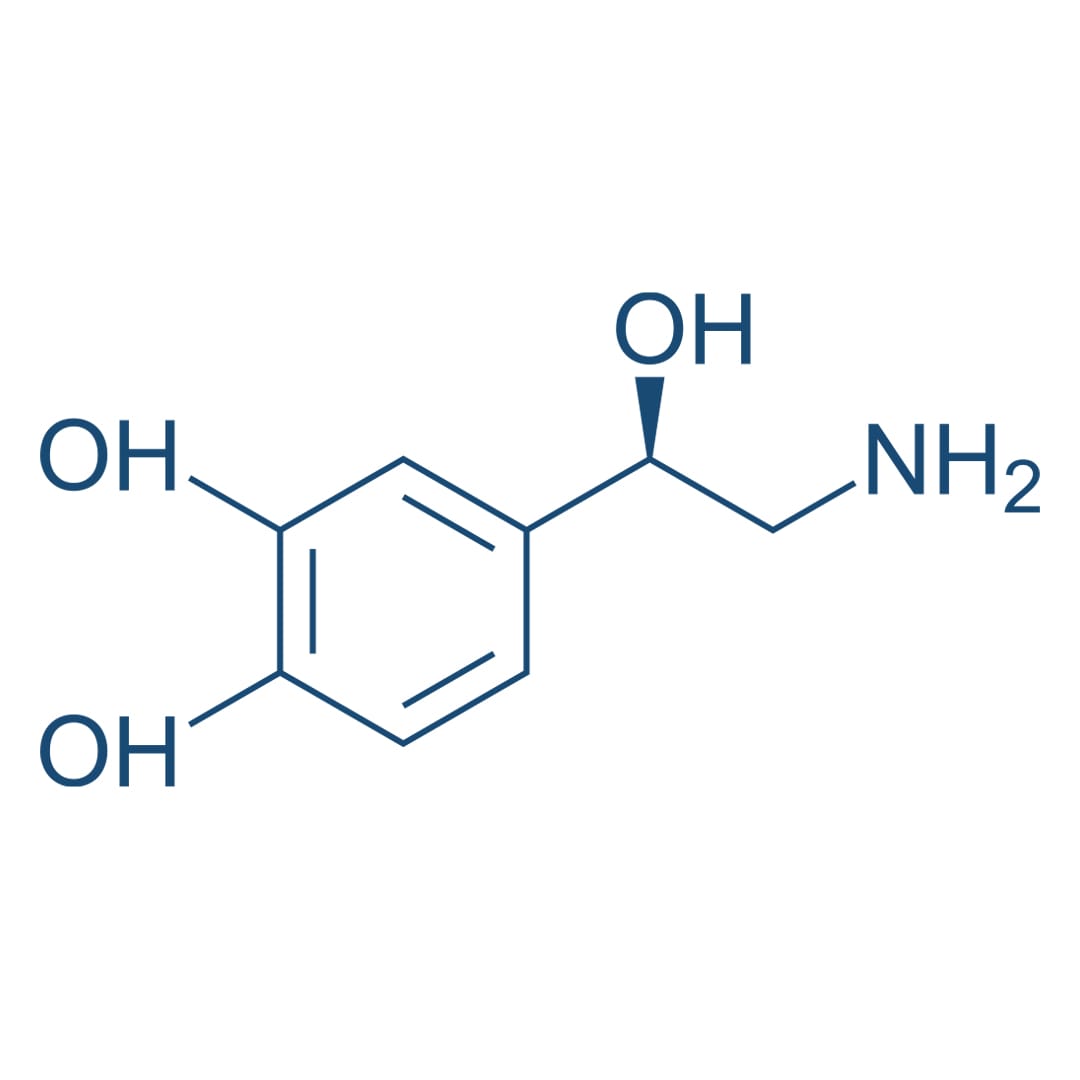
Noradrenalina
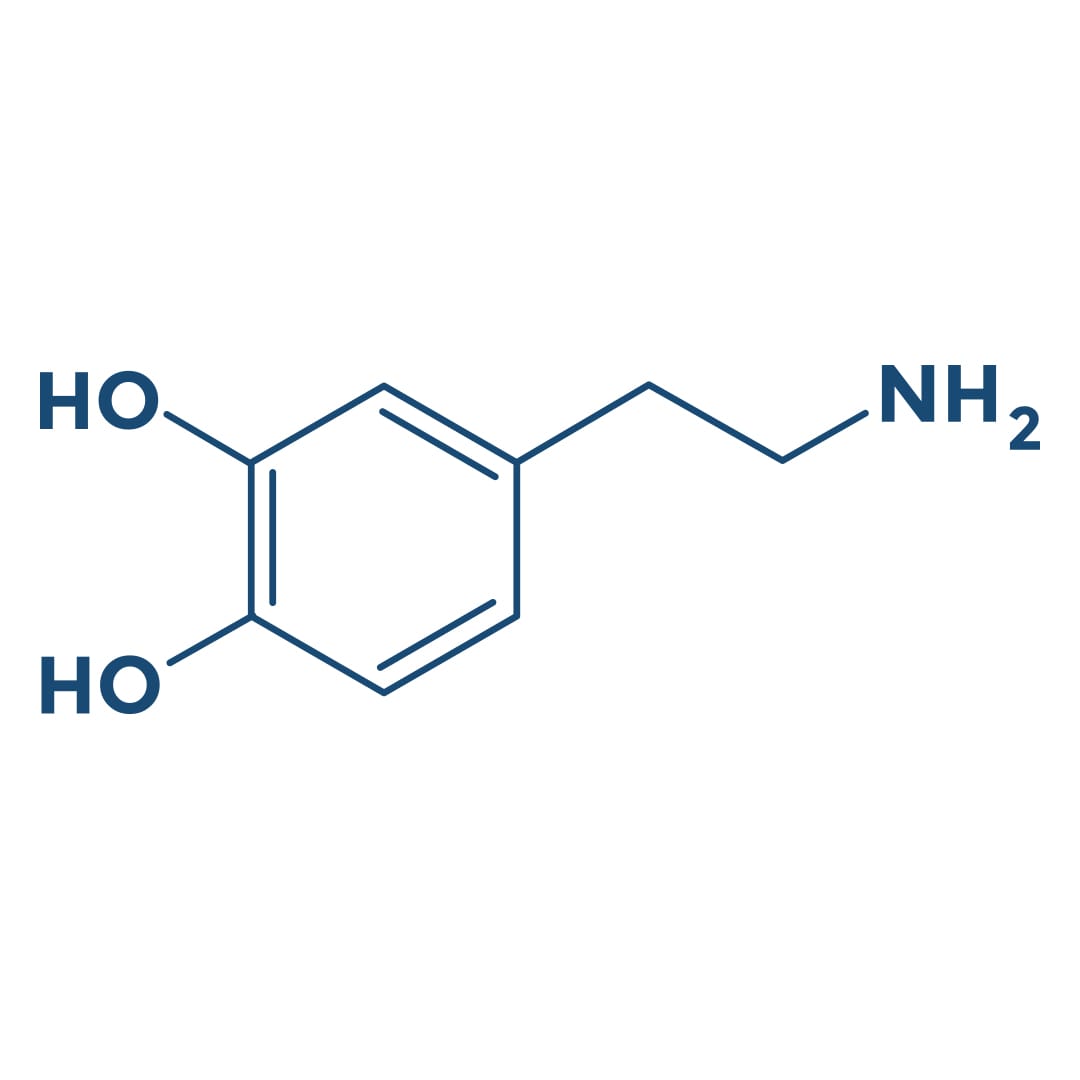
Dopamina
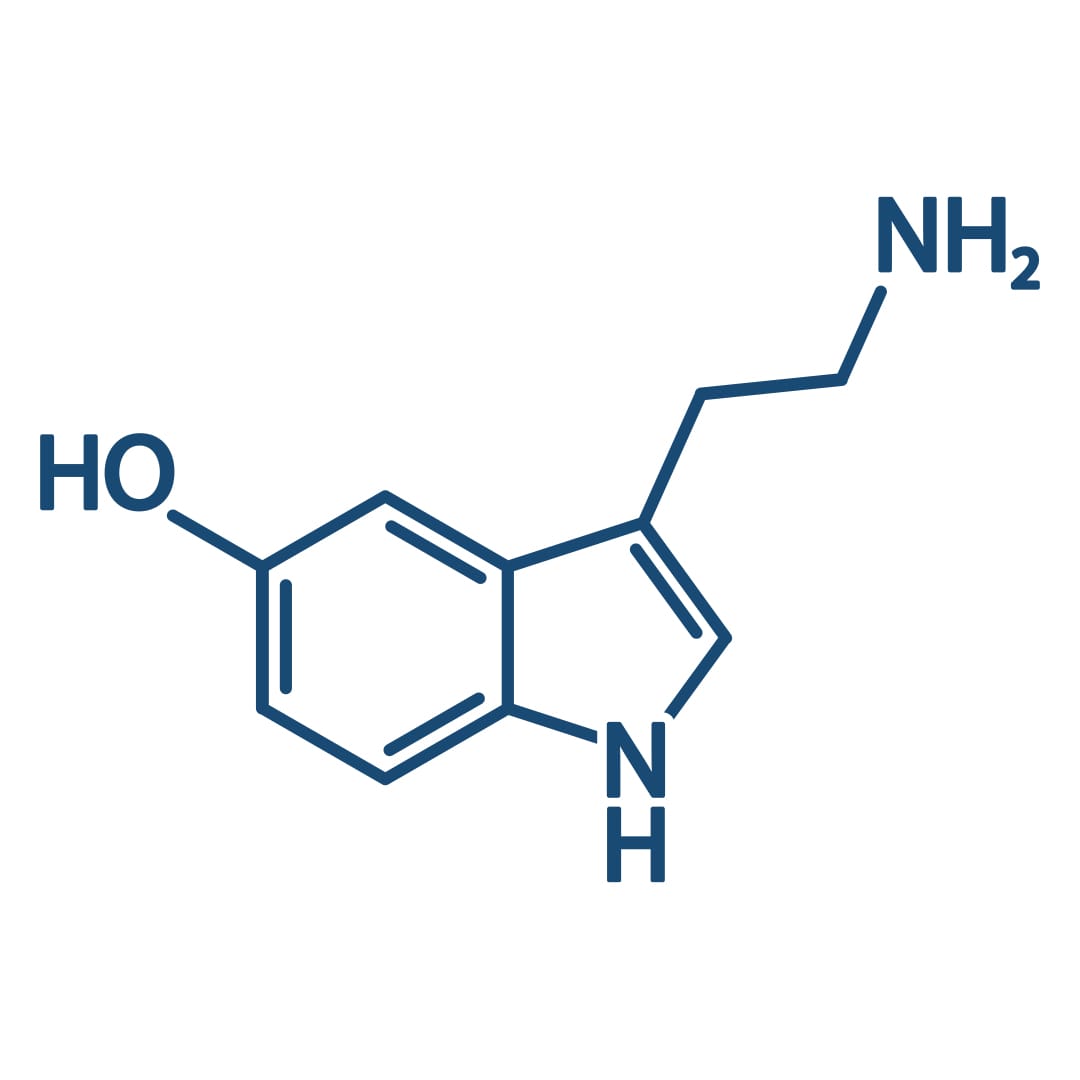
Serotonina
Na verdade, muitas drogas usadas atualmente para o tratamento da depressão têm em comum o aumento da atividade dessas sinapses no sistema nervoso central.

Fármacos antidepressivos
Após o início do tratamento com medicamentos antidepressivos, geralmente há um "atraso terapêutico" que dura de três a quatro semanas antes que uma resposta clínica seja evidente. Alguns pacientes podem responder ao tratamento antidepressivo antes desse período; outros podem exigir mais do que oito semanas para uma resposta adequada.
Saiba mais
Aproximadamente 60% dos pacientes deprimidos mostrarão uma redução de 50% nos sintomas depressivos com tratamento de oito semanas, e 30% vão experimentar uma remissão completa com o uso de um único antidepressivo.
Após o tratamento inicial bem-sucedido, uma fase de tratamento de manutenção de seis a doze meses é típica, passando por uma retirada gradual. Caso o paciente apresente dois episódios separados de depressão maior ou esteja cronicamente deprimido (ou seja, por um período maior que dois anos), o tratamento ao longo da vida com um antidepressivo é aconselhável.
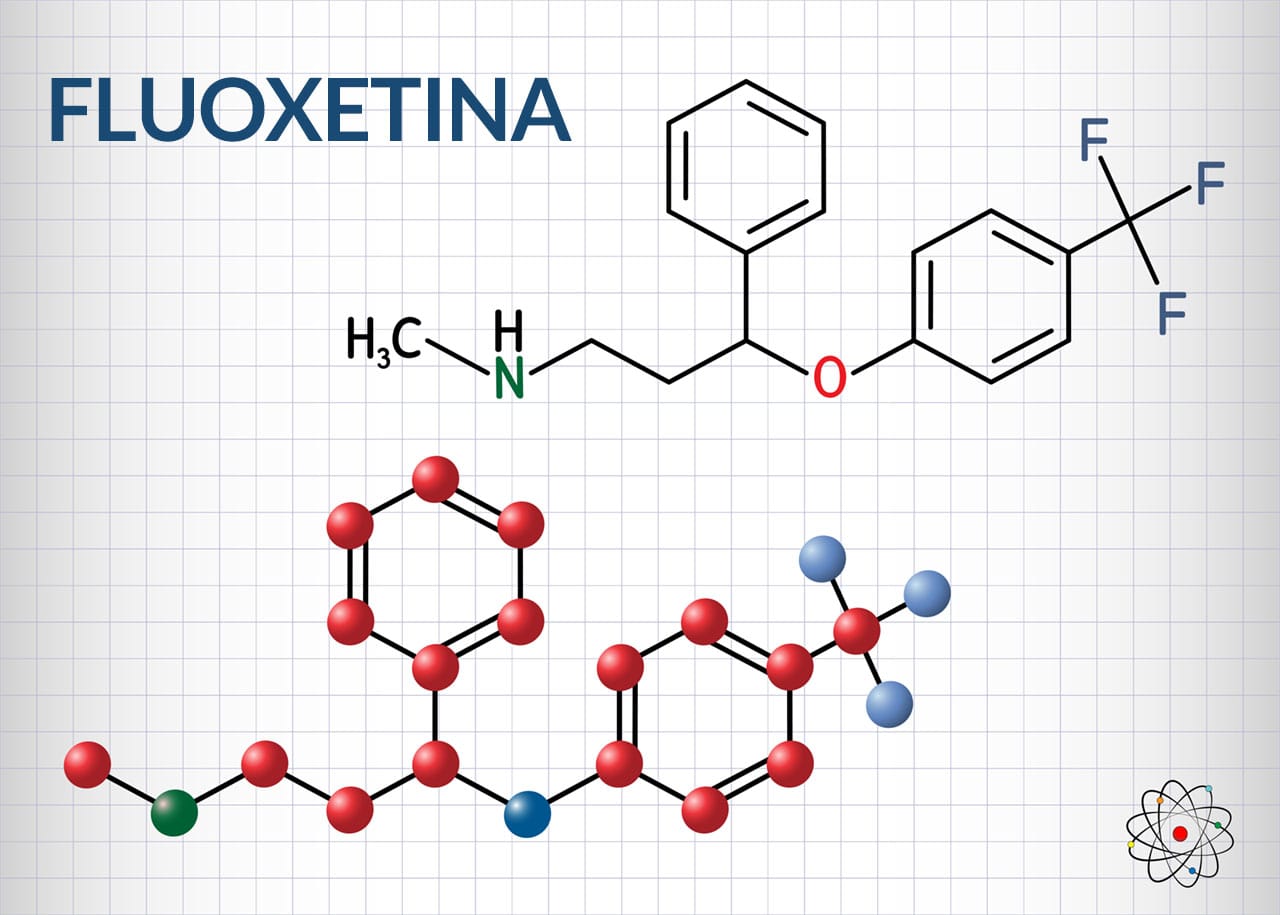
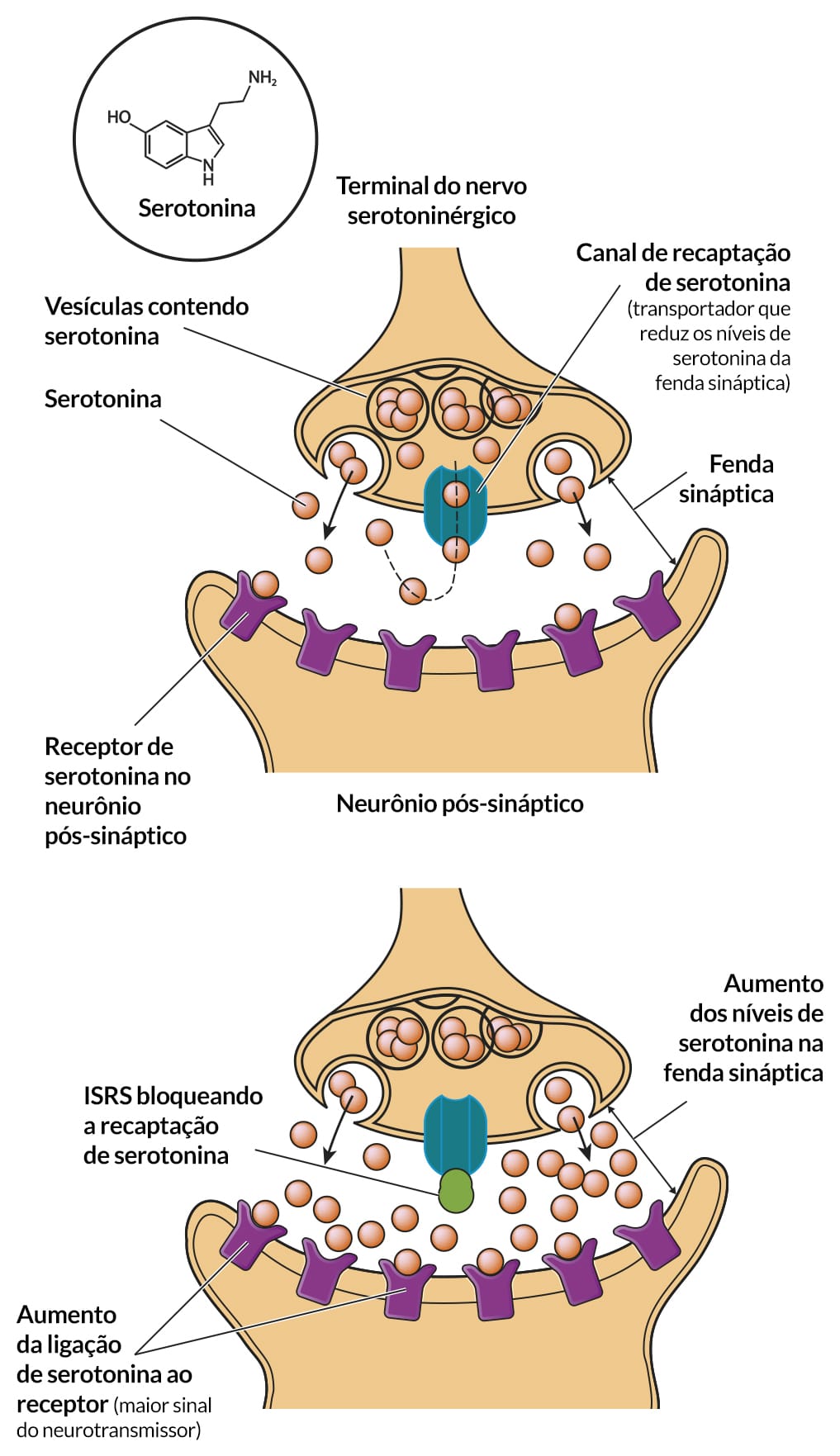
Inibidores seletivos de recaptação de serotonina (ISRS)
Vários inibidores seletivos de recaptação de serotonina (ISRS) foram introduzidos no tratamento da depressão de 1984 a 1997, incluindo fluoxetina, paroxetina, sertralina, citalopram, escitalopram e fluvoxamina. Todos os ISRS mostram uma melhoria clara na margem de segurança terapêutica em comparação com os antidepressivos tricíclicos (conheceremos mais adiante) e são muito mais seguros em caso de sobredosagem.
Os ISRS são eficazes no tratamento da depressão maior, mas também são ansiolíticos com eficácia comprovada no tratamento de ansiedade generalizada, pânico, ansiedade social e transtornos obsessivo-compulsivos. A sertralina e a paroxetina também são utilizadas no tratamento de transtorno de estresse pós-traumático, embora o tratamento dessa condição continue sendo um grande desafio clínico.
Mecanismo de ação
O tratamento com um ISRS bloqueia inicialmente a recaptação de serotonina e resulta em neurotransmissão serotoninérgica aumentada e prolongada. Os ISRS usados clinicamente são relativamente seletivos, apresentando maior disponibilidade sináptica de serotonina, estimulando muitos subtipos de receptor 5-HT pós-sinápticos e receptores de terminais pré-sinápticos, que regulam a atividade neuronal serotoninérgica e a liberação de serotonina.
Efeitos adversos
Os ISRS não causam grandes efeitos colaterais cardiovasculares, geralmente não apresentam efeitos colaterais antimuscarínicos (boca seca, retenção urinária, confusão), não bloqueiam a histamina ou os receptores α adrenérgicos e não são sedativos.
A estimulação excessiva dos receptores 5-HT2 no cérebro pode resultar em insônia, aumento da ansiedade, irritabilidade e diminuição da libido, piorando efetivamente os sintomas depressivos proeminentes. O excesso de atividade dos receptores 5-HT2 causa efeitos colaterais sexuais, incluindo disfunção erétil, anorgasmia e retardo ejaculatório.
A estimulação dos receptores 5-HT3 no SNC e na periferia contribui para os efeitos gastrointestinais, que são geralmente limitados a náuseas, mas podem incluir diarreia e vômitos. Alguns pacientes experimentam um aumento da ansiedade, especialmente com o dosagem inicial de ISRS. Com o tratamento continuado, também relatam dificuldade na realização de habilidades intelectuais e de concentração.
Ao contrário de outros ISRS, a paroxetina está associada a um risco aumentado de malformações cardíacas congênitas. A venlafaxina também está associada a um risco aumentado de complicações perinatais. Portanto, esses medicamentos não devem ser usados em mulheres grávidas.
Uma consideração cuidadosa deve ser feita em relação ao uso desses medicações em mulheres com desejo de iniciar uma gestação. Deve ser aconselhado evitar a gravidez enquanto estiverem tomando os medicamentos, ou a medicação deve ser substituída em caso de gestação.
Atenção
A retirada súbita de antidepressivos pode precipitar uma síndrome de abstinência. Para os ISRS, os sintomas de abstinência podem incluir tontura, dor de cabeça, nervosismo, náusea e insônia. Essa síndrome de abstinência parece mais intensa para a paroxetina e venlafaxina em comparação com outros antidepressivos, devido às suas meias-vidas relativamente curtas e, no caso da paroxetina, pela falta de metabólitos.
Interações medicamentosas
A maioria dos antidepressivos, incluindo os ISRS, exibem interações medicamentosas com base nas vias de metabolismo dos CYPs. A paroxetina e, em menor grau, a fluoxetina são inibidores potentes de CYP2D6. Essa inibição pode resultar em desproporcional aumento nas concentrações plasmáticas de medicamentos metabolizados pelo CYP2D6 quando as doses dessas drogas são aumentadas.
Uma interação proeminente e o aumento da exposição aos antidepressivos tricílicos podem ser observados durante uma coadministração desses fármacos. Inibidores da monoamino oxidase (IMAO) aumentam os efeitos de ISRS devido à inibição do metabolismo da serotonina. A administração simultânea dessas drogas pode produzir aumentos sinérgicos na serotonina extracelular do cérebro, levando à síndrome da serotonina.
Síndrome da serotonina
Sintomas da síndrome da serotonina incluem hipertermia, rigidez muscular, mioclonia, tremores, instabilidade autonômica, confusão e irritabilidade, o que pode progredir para coma e morte. Outras drogas que podem induzir a síndrome da serotonina incluem anfetaminas substituídas, como metilenodioximetanfetamina (ecstasy), que libera serotonina diretamente nos terminais nervosos.
Para quase todos os ISRS, exceto a fluoxetina, pelo menos 14 dias devem se passar, após o término de tratamento com um ISRS, antes de se iniciar o tratamento com um IMAO.
Inibidores de recaptação de serotonina-noradrenalina (SNRI)
Medicamentos com estrutura não tricíclica que inibem a recaptação de serotonina (SERT) e noradrenalina (NET) foram aprovados para o tratamento de depressão, transtornos de ansiedade e dor: venlafaxina e seu metabólito desmetilado, desvenlafaxina; duloxetina; e milnaciprano (aprovados apenas para dor de fibromialgia).
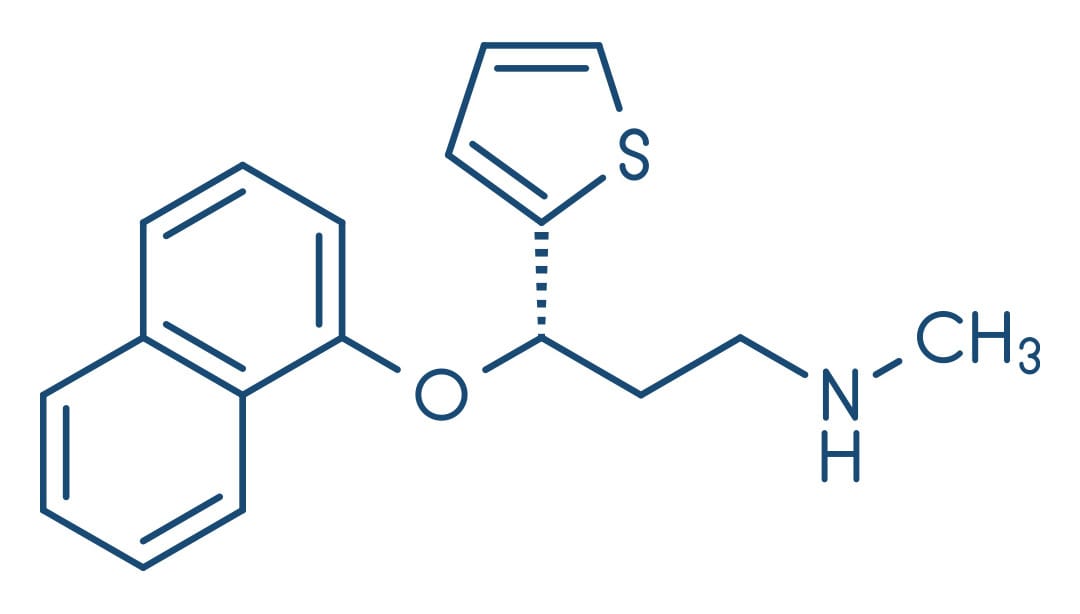
As indicações terapêuticas fora da aprovação central incluem: incontinência urinária (duloxetina), autismo, transtornos da compulsão alimentar periódica, episódios de calor, síndromes de dor, distúrbios disfóricos pré-menstruais e transtornos de estresse pós-traumático (venlafaxina). A duloxetina, além de ser aprovada para uso no tratamento de depressão e ansiedade, também é usada para o tratamento de fibromialgia e dor neuropática associada a neuropatia periférica.
Mecanismo de ação
Os SNRI inibem a SERT e a NET. Dependendo da droga, da dose e da potência em cada local, os SNRI causam neurotransmissão serotoninérgica e/ou noradrenérgica aumentada.
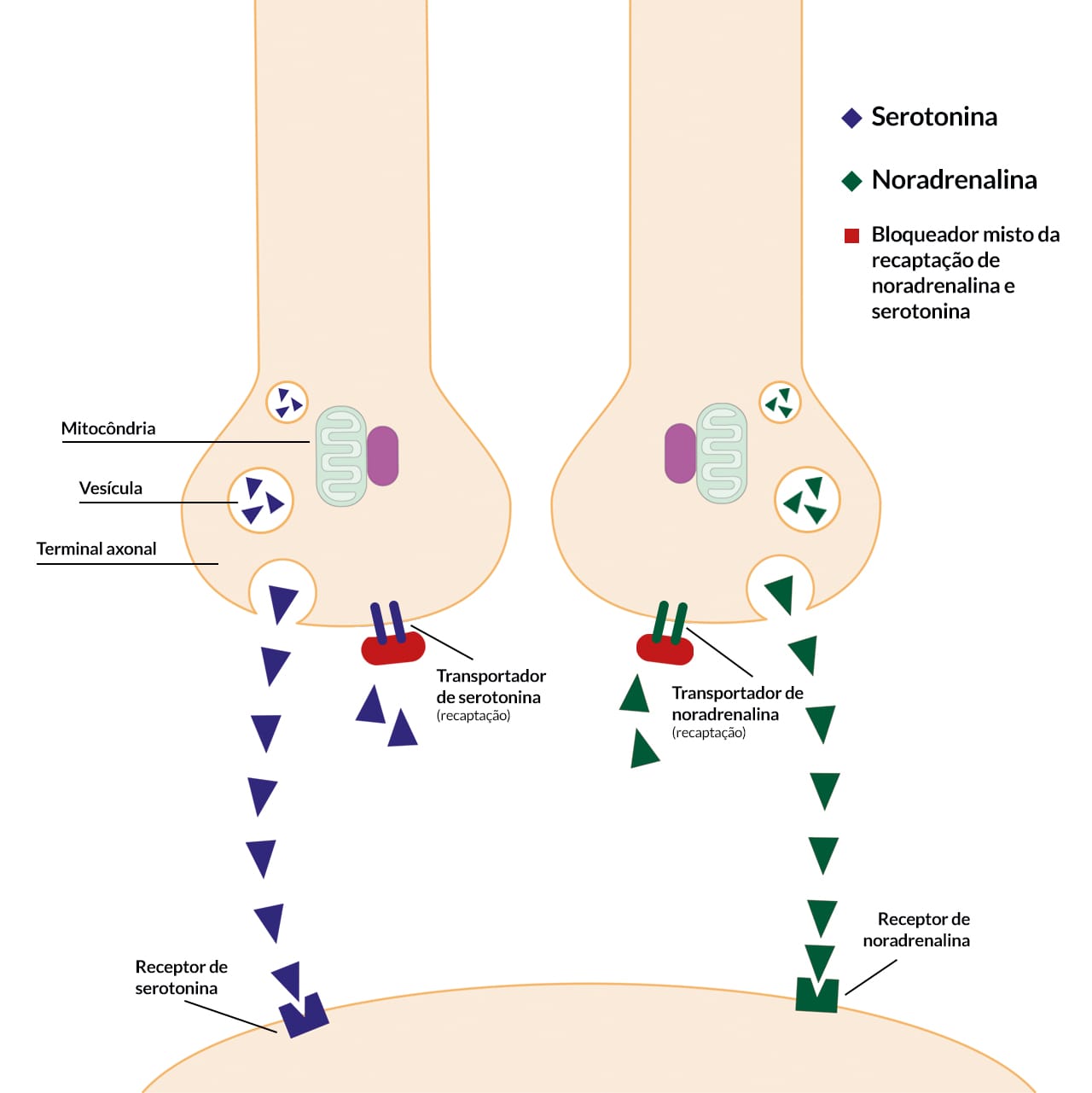
Efeitos adversos
Os SNRI apresentam vantagens de segurança desejáveis sobre os antidepressivos tricíclicos e têm um perfil de efeitos adversos semelhante ao dos ISRS, incluindo náuseas, constipação, insônia, dores de cabeça e disfunção sexual. A formulação de liberação imediata de venlafaxina pode induzir hipertensão diastólica. Esse efeito da venlafaxina pode não estar associado simplesmente à inibição da NET, uma vez que a duloxetina não compartilha desse efeito colateral.
Interações medicamentosas
Assim como os ISRS, os SNRI interagem com os IMAO da mesma forma. Sugere-se um intervalo de 14 dias entre o término da terapia com IMAO e o início do tratamento com venlafaxina. Um intervalo de apenas sete dias após a interrupção da venlafaxina é considerado seguro antes de iniciar um IMAO.
A duloxetina tem um intervalo semelhante ao início após a terapia com IMAO, mas requer apenas um período de espera de cinco dias para iniciar o tratamento com IMAO. A não observância desses períodos de espera exigidos pode resultar na síndrome da serotonina, conforme observado para os ISRS.
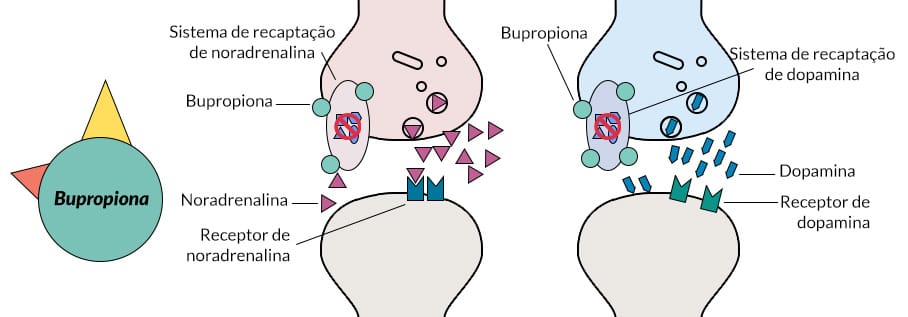
Bupropiona
A bupropiona é indicada para o tratamento da depressão, prevenção da sazonalidade do transtorno depressivo e como um tratamento para quem deseja parar de fumar. A bupropiona pode induzir distúrbios do sono e, em alguns pacientes, manter o estado de vigília. Por isso, essa substância tem efeitos no eletroencefalograma do sono, que são opostos àqueles da maioria dos medicamentos antidepressivos, podendo levar o paciente a apresentar insônia no início do tratamento.
A bupropiona pode melhorar os sintomas do transtorno de deficit de atenção e hiperatividade (TDAH) e tem sido usada para dor neuropática e perda de peso. Clinicamente, é amplamente utilizada em combinação com ISRS para obter maior resposta antidepressiva. No entanto, existem dados clínicos muito limitados que fornecem um forte suporte para essa prática.
Mecanismo de ação
A bupropiona é discutida separadamente porque parece agir por meio de vários mecanismos. Aumenta a neurotransmissão noradrenérgica e dopaminérgica por meio da inibição de suas recaptações; além disso, seu mecanismo de ação pode envolver a liberação pré-sináptica de noradrenalina e dopamina.
Efeitos adversos
Em doses maiores do que as recomendadas para depressão, o risco de convulsões aumenta significativamente. O uso de formulações de liberação prolongada, muitas vezes, reduz a concentração máxima observada após a dosagem e minimiza a chance de atingir níveis de drogas associados a um risco aumentado de convulsões.
Interações medicamentosas
A principal via de metabolismo da bupropiona é através do CYP2B6. Embora não pareça haver nenhuma evidência de metabolismo pelo CYP2D6, esse medicamento é frequentemente administrado com ISRS. O potencial para interações com drogas metabolizadas por CYP2D6 deve ser mantido em mente até que a segurança da associação entre esses fármacos esteja firmemente estabelecida.
Antidepressivos tricíclicos
Devido ao seu potencial de causar efeitos adversos graves, os antidepressivos tricíclicos (TCA) geralmente não são usados como medicamentos de primeira linha para o tratamento da depressão, porém ainda são indicados no tratamento da depressão maior. Os TCA são a primeira geração de antipsicóticos sinérgicos utilizados para o tratamento da depressão psicótica.
Os TCA de amina terciária (por exemplo, doxepina, amitriptilina) foram usados por muitos anos, em doses relativamente baixas, no tratamento de insônia. Além disso, devido ao papel da noradrenalina e da serotonina na transmissão da dor, esses medicamentos são comumente usados para tratar uma variedade de condições de dor.
Mecanismo de ação
O desenvolvimento dos ISRS e SNRI deriva da pronunciada ação dos TCA no antagonismo dos transportadores de serotonina e norepinefrina. Além de agir inibindo a NET seletivamente (desipramina, nortriptilina, protriptilina, amoxapina) ou SERT e NET (imipramina, amitriptilina), essas drogas também bloqueiam outros receptores (H1 , 5-HT2 , α1 , e muscarínico).
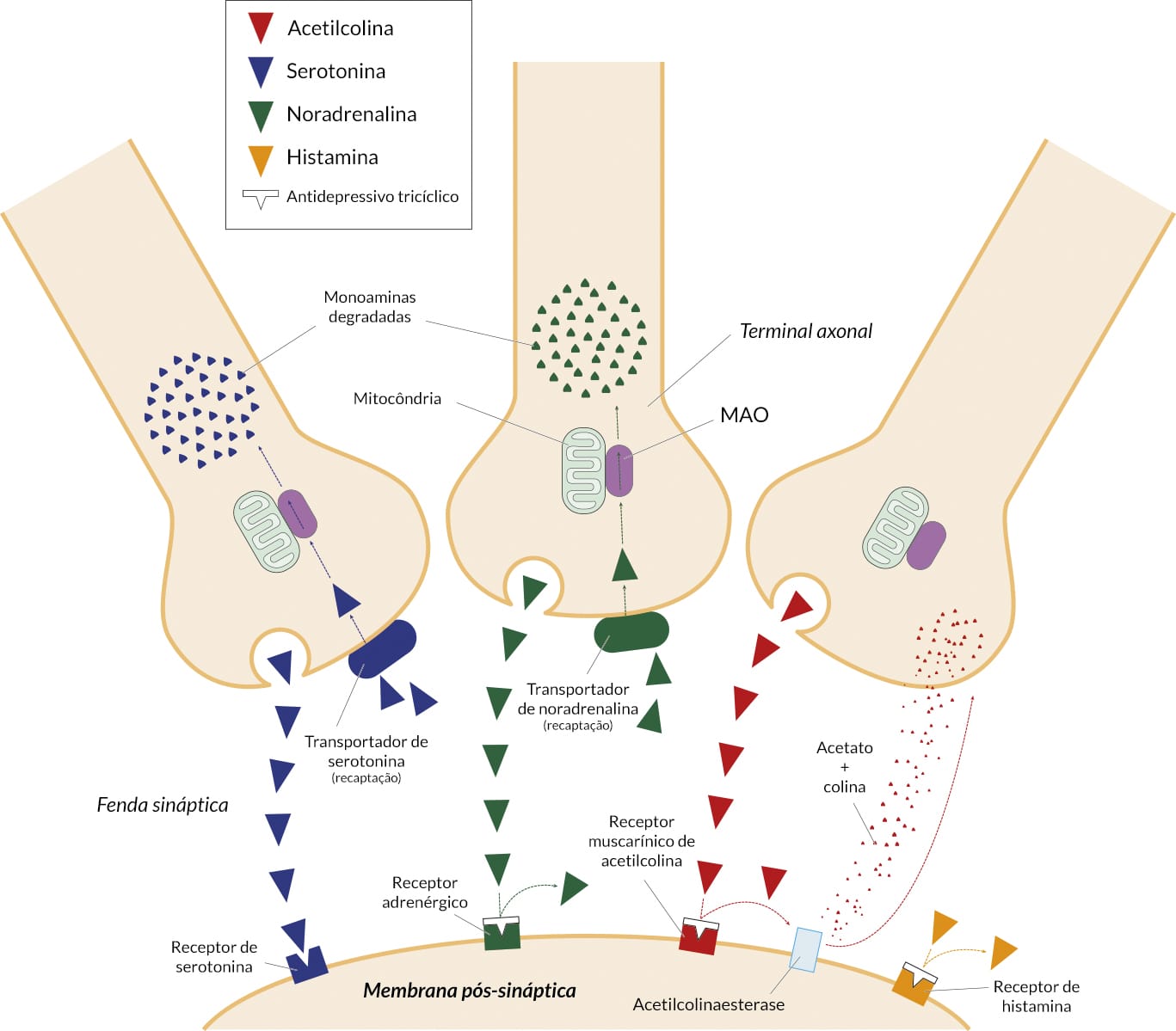
Efeitos adversos
Os TCA são antagonistas potentes dos receptores H1 de histamina. O antagonismo do receptor H1 contribui para os efeitos sedativos dos TCA. O antagonismo muscarínico dos receptores de acetilcolina contribui para o sinal cognitivo, bem como para uma gama de efeitos adversos mediados pelo sistema nervoso parassimpático (visão turva, boca seca, taquicardia, constipação, dificuldade de urinar).
O antagonismo dos receptores adrenérgicos α1 contribui para a hipotensão ortostática e sedação. O ganho de peso é outro efeito colateral dessa classe de antidepressivos. Como outras drogas antidepressivas, os TCA também reduzem o limiar de convulsão.
Interações medicamentosas
Drogas que inibem o CYP2D6, como os ISRS, podem aumentar a exposição plasmática de TCA. Outras drogas que podem agir de forma semelhante são os agentes antipsicóticos fenotiazínicos e outras substâncias com efeitos antimuscarínicos, anti-histamínicos e antagonistas α adrenérgicos. Os TCAs podem potencializar as ações das aminas simpaticomiméticas e não devem ser usados concomitantemente com os IMAO ou dentro de 14 dias após a interrupção do IMAO.
Inibidores da monoamina oxidase (IMAO)
Os IMAO têm eficácia equivalente à dos TCA, mas raramente são usados no tratamento da depressão por causa de sua toxicidade e das principais interações medicamentosas e alimentares. Os IMAO aprovados para o tratamento da depressão incluem tranilcipromina, fenelzina e isocarboxazida.
A selegilina está disponível como um adesivo transdérmico e é aprovada para uso no tratamento da depressão. A administração transdérmica pode reduzir o risco de reações hipertensivas associadas à dieta.
Mecanismo de ação
Os IMAO são inibidores seletivos e irreversíveis da MAO-A e MAO-B, que estão localizadas na mitocôndria e metabolizam as monoaminas, incluindo serotonina e noradrenalina. A selegilina inibe MAO-B em doses mais baixas, com efeitos na MAO-A em doses mais elevadas.
Efeitos adversos
As catecolaminas liberadas estimulam os receptores pós-sinápticos na periferia, aumentando a pressão arterial a níveis perigosos. Esses episódios podem ser revertidos por medicamentos anti-hipertensivos. Os inibidores da MAO-A são eficazes no tratamento da depressão. No entanto, os inibidores da MAO-B, como a selegilina, são eficazes no tratamento da depressão apenas quando administrados em doses que bloqueiam tanto MAO-A como MAO-B.
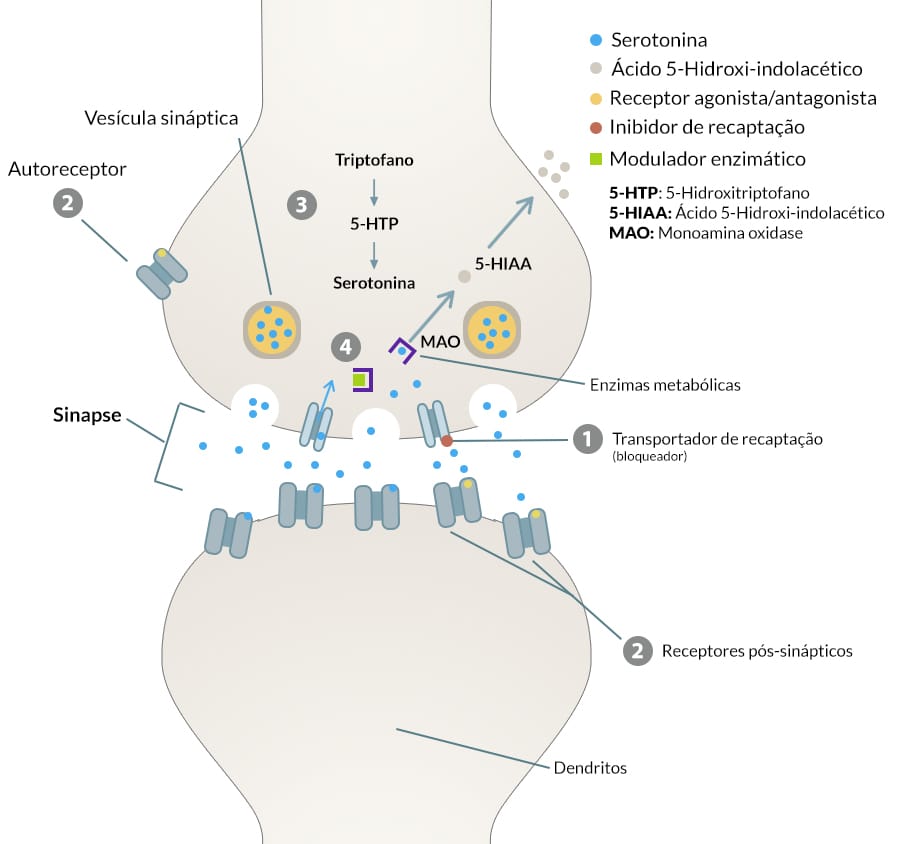
Assim, esses dados enfatizam a importância de aumentar a disponibilidade sináptica de serotonina e noradrenalina como eventos mediadores importantes para muitos medicamentos antidepressivos. Outro problema sério com a administração crônica de IMAO, que envolve risco de morte, é a hepatotoxicidade.
A crise hipertensiva decorrente de alimentos ou interações medicamentosas é uma das toxicidades potencialmente fatais associadas ao uso dos IMAO. Alimentos que contêm tiramina são um fator contribuinte. MAO-A dentro da parede intestinal e MAO-A e MAO-B no fígado normalmente degradam a tiramina da dieta. No entanto, quando a MAO-A é inibida, a ingestão de certos queijos, vinhos tintos, chucrute, favas e uma variedade de outros alimentos contendo tiramina leva ao acúmulo de tiramina em terminações nervosas adrenérgicas e vesículas de neurotransmissores e induz norepinefrina e liberação de epinefrina.
Interações medicamentosas
Muitas interações medicamentosas levam a contraindicações para o uso simultâneo com IMAO. Depressores do SNC, incluindo meperidina e outros narcóticos, álcool e os agentes anestésicos não devem ser usados com os IMAO. Meperidina e outros agonistas opioides em combinação com IMAO também induzem a síndrome da serotonina.
Os ISRS e SNRI são contraindicados em associação com os IMAO para evitar a síndrome da serotonina. Em geral, outros antidepressivos, como TCA e a bupropiona, também devem ser evitados em pacientes que tomam IMAO.
Fármacos ansiolíticos
Uma variedade de agentes e classes de drogas fornece efeitos ansiolíticos. Os tratamentos primários para transtornos relacionados à ansiedade incluem ISRS, SNRI, benzodiazepínicos, azipirona, buspirona e antagonistas beta-adrenérgicos. Historicamente, os TCA, particularmente clomipramina e IMAO, têm sido usados para o tratamento de alguns transtornos relacionados à ansiedade, mas seu uso foi substituído pelo de drogas com menor toxicidade.
Os ISRS e a venlafaxina são bem tolerados; além de sua atividade antidepressiva, eles também apresentam atividade ansiolítica no tratamento crônico da ansiedade. Os benzodiazepínicos são ansiolíticos eficazes no tratamento agudo e crônico da ansiedade. Há preocupação em relação ao seu uso devido a seu potencial de dependência e abuso, bem como aos efeitos negativos na cognição e na memória.
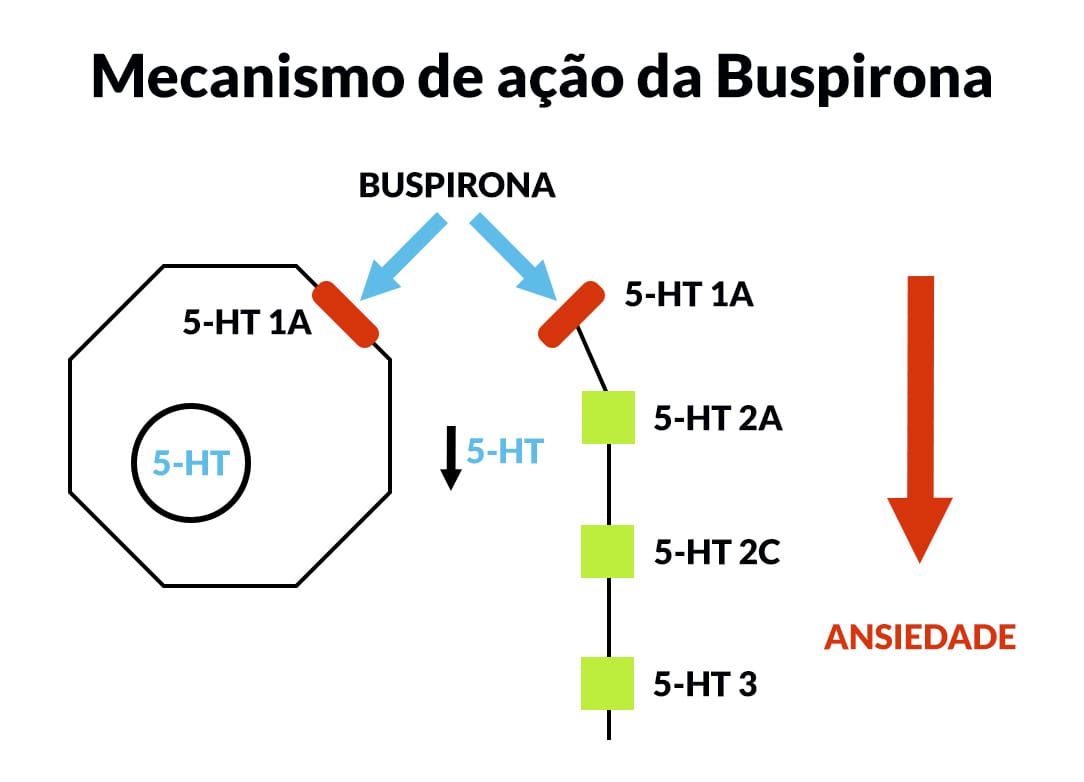
A buspirona é eficaz após o tratamento crônico com os ISRS. Ela atua por meio do sistema serotoninérgico, no qual é um agonista parcial dos receptores 5-HT1A. A buspirona também tem efeitos antagônicos nos receptores D2 da dopamina, mas a relação entre esse efeito e suas ações clínicas é incerta.
Os antagonistas β adrenérgicos, particularmente aqueles com maior lipofilicidade (por exemplo, propranolol e nadolol), são ocasionalmente usados para ansiedade de desempenho, como medo de falar em público; seu uso é limitado devido a efeitos colaterais significativos, como hipotensão. O anti-histamínico hidroxizina e vários agentes sedativos-hipnóticos têm sido usados como ansiolíticos, mas geralmente não são recomendados por causa de seus perfis de efeitos colaterais.
A hidroxizina, que produz sedação de curto prazo, tem sido usada em pacientes que não podem utilizar outros tipos de ansiolíticos (por exemplo, aqueles com histórico de uso de drogas ou abuso de álcool, casos em que os benzodiazepínicos devem ser evitados).
Aspectos clínicos das drogas ansiolíticas
A escolha do tratamento farmacológico para a ansiedade é ditada pelos distúrbios específicos de ansiedade e pela necessidade clínica de efeitos ansiolíticos agudos. Entre os ansiolíticos comumente usados, apenas os benzodiazepínicos e antagonistas β adrenérgicos são agudamente eficazes; o uso de antagonistas β adrenérgicos é geralmente limitado ao tratamento da ansiedade situacional. O tratamento crônico com ISRS, SNRI e buspirona é necessário para produzir e manter os efeitos ansiolíticos.
Os ISRS e o SNRI venlafaxina são tratamentos de primeira linha para a maioria dos tipos de transtornos de ansiedade; a fluvoxamina é aprovada apenas para o transtorno obsessivo-compulsivo. Outras drogas com ação na neurotransmissão serotonérgica, incluindo trazodona, nefazodona e mirtazapina, também são utilizadas no tratamento de transtornos de ansiedade.
Saiba mais
Tanto ISRS como SNRI são benéficos em condições específicas de ansiedade, como transtorno de ansiedade generalizada, fobias sociais, transtorno obsessivo-compulsivo e transtorno do pânico. Os fármacos barbitúricos tornaram-se, em grande parte, obsoletos, e seu uso passou a limitar-se à anestesia e ao tratamento de epilepsia (veremos mais adiante). Atuam por ligação em sítio específico no receptor de GABA-A, aumentando a afinidade desse neurotransmissor inibitório do SNC.
Buspirona
Como os ISRS, a buspirona requer tratamento crônico para eficácia terapêutica. Além disso, esse fármaco carece de muitos dos outros efeitos farmacológicos dos benzodiazepínicos: não é um anticonvulsivante, relaxante muscular ou sedativo e não prejudica desempenho psicomotor nem causa dependência.
A buspirona tem alta afinidade pelos receptores serotoninérgicos do subtipo 5-HT1A e não interage com receptores benzodiazepínicos ou GABAérgicos. É principalmente eficaz no tratamento do transtorno de ansiedade generalizada, mas não de outros transtornos de ansiedade.
Na verdade, os pacientes com transtorno do pânico frequentemente observam aumento agudo na ansiedade após o início do tratamento com buspirona. Isso pode ser resultado do fato de que a buspirona causa aumento nas taxas de disparo do locus coeruleus, sendo parte fundamental da fisiopatologia do transtorno do pânico.
Benzodiazepínicos
Quando um efeito ansiolítico imediato é desejado, os benzodiazepínicos são tipicamente indicados na primeira linha do tratamento. Benzodiazepínicos como alprazolam, clordiazepoxido, clonazepam, clorazepato, diazepam, lorazepam e oxazepam são eficazes no tratamento do transtorno de ansiedade generalizada, transtorno do pânico e ansiedade situacional.
Além de seus efeitos ansiolíticos, os benzodiazepínicos produzem efeitos sedativos, hipnóticos, anestésicos, anticonvulsivantes e relaxantes musculares. Esses fármacos prejudicam o desempenho cognitivo e a memória, afetam adversamente o controle motor e potencializam os efeitos de outros sedativos, incluindo o álcool.
Os efeitos ansiolíticos dessa classe de droga são mediados por interações alostéricas com o receptor GABA-A. O principal efeito ansiolítico dos benzodiazepínicos é o aumento dos efeitos inibitórios do neurotransmissor GABA.
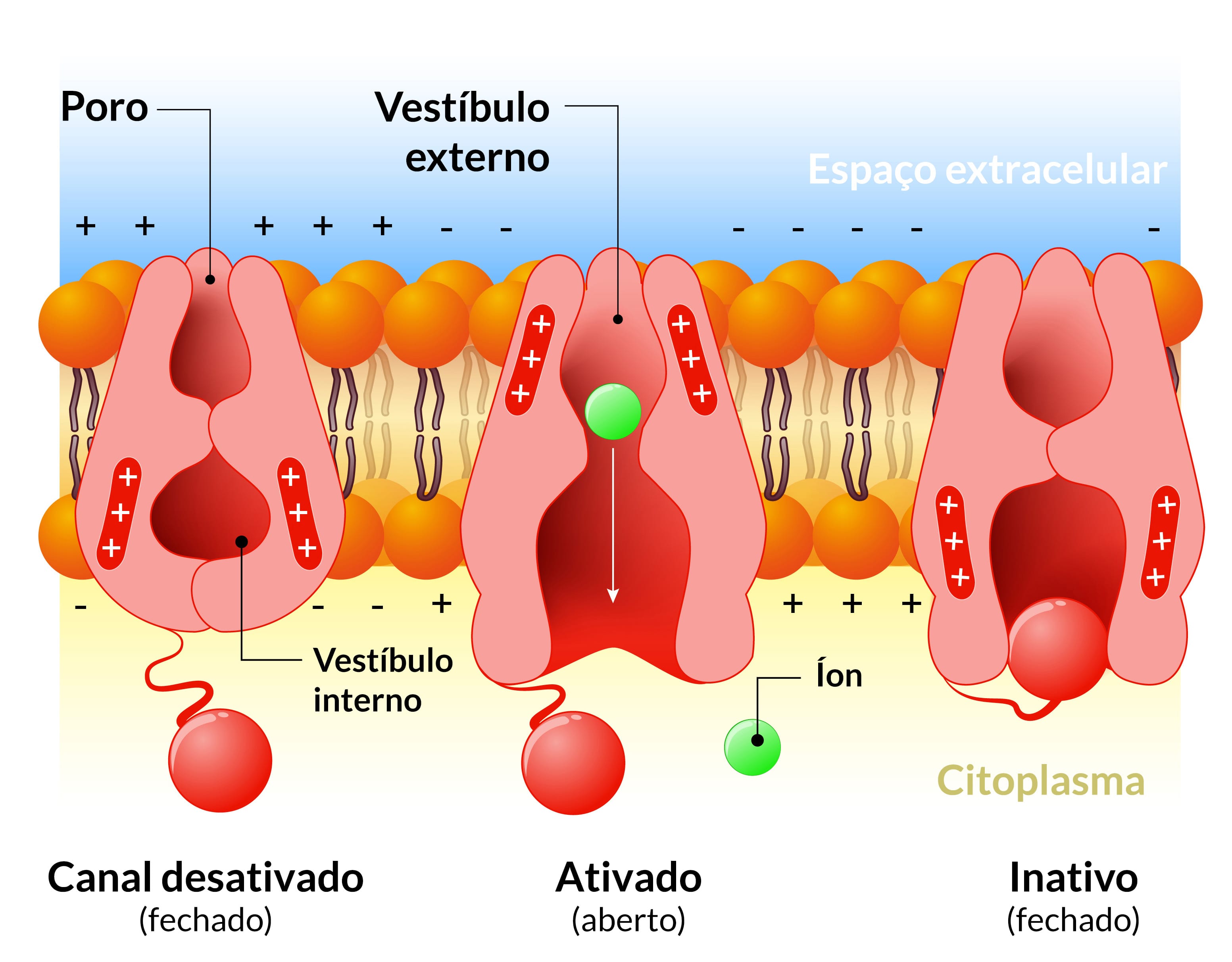
Receptor GABA-A
O receptor GABA-A tem um sítio de ligação para os benzodiazepínicos. Quando ativado, o receptor GABA-A promove a permeabilidade de íons cloreto e, consequentemente, reduz a excitabilidade da membrana pós-sináptica.
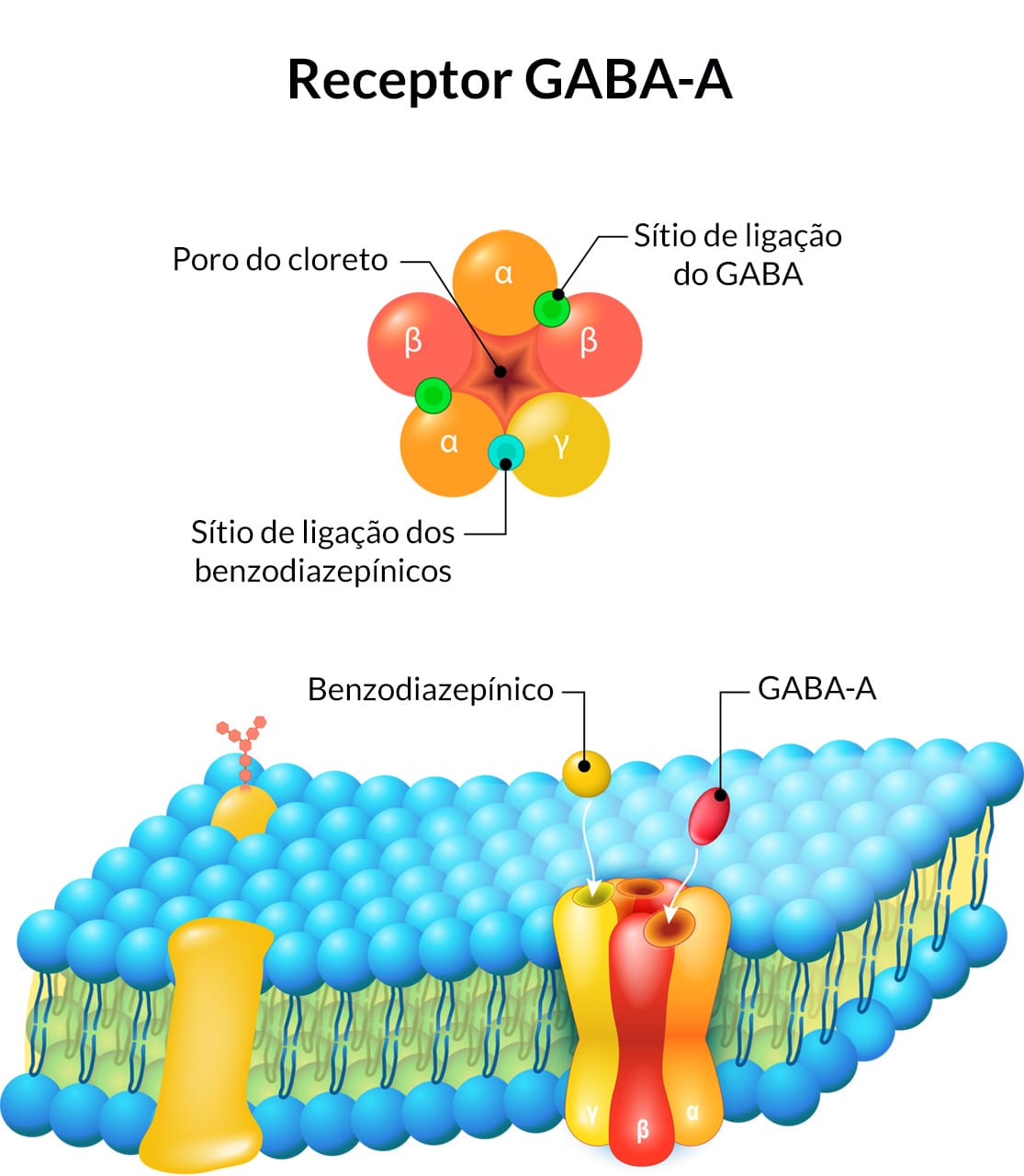
As preocupações em relação ao uso de benzodiazepínicos no tratamento da ansiedade são a habituação, a dependência e o abuso. Pacientes com certos transtornos de personalidade ou histórico de uso de drogas ou abuso de álcool são particularmente suscetíveis à dependência de benzodiazepínicos.
No entanto, o risco da dependência deve ser equilibrado com a necessidade do tratamento, uma vez que os benzodiazepínicos são eficazes no tratamento a curto e longo prazos em pacientes com crises de ansiedade sustentadas ou recorrentes. Além disso, a descontinuação prematura de benzodiazepínicos, na ausência de outros tratamentos farmacológicos, resulta em alta taxa de recidiva.
A retirada dos benzodiazepínicos após o tratamento crônico, particularmente aqueles de curto período, pode incluir aumento da ansiedade e crises convulsivas. Por esse motivo, é importante que a descontinuação seja realizada de maneira gradual.
Atenção
Os benzodiazepínicos causam muitos efeitos adversos, incluindo sedação, problemas leves de memória, diminuição do estado de alerta e lentidão no tempo de reação (que pode causar acidentes). Problemas de memória incluem deficits visoespaciais, mas se manifestam clinicamente de várias maneiras, incluindo dificuldade de encontrar palavras.
Ocasionalmente, podem ocorrer reações paradoxais com benzodiazepínicos, como aumento da ansiedade, às vezes atingindo proporções de ataque de pânico, irritabilidade, agressão ou desinibição comportamental e reações amnésicas. Em idosos, os benzodiazepínicos aumentam o risco de quedas e devem ser usados com cautela.
Esses medicamentos são mais seguros do que os sedativos hipnóticos clássicos em casos de superdosagem e, normalmente, são fatais apenas se combinados com outros depressores do SNC.
Os benzodiazepínicos têm potencial de serem usados como droga de abuso, embora sua capacidade seja consideravelmente inferior à de outros agentes sedativos-hipnóticos. Quando esses agentes são utilizados com esse fim, geralmente ocorre um padrão de abuso de múltiplas drogas. Na verdade, o principal motivo para o uso indevido desses agentes geralmente são as tentativas fracassadas de controlar a ansiedade.
Saiba mais
A tolerância aos efeitos ansiolíticos se desenvolve com a administração crônica, como resultado de quando alguns pacientes aumentam a dose de benzodiazepínicos com o tempo. Idealmente, os benzodiazepínicos devem ser usados em curtos períodos de tempo e em conjunto com outros medicamentos (por exemplo, ISRS) ou psicoterapias baseadas em evidências (por exemplo, terapia cognitivo-comportamental para transtornos de ansiedade).
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer os fármacos que agem no controle das crises convulsivas, seus mecanismos de ação, efeitos adversos e suas interações medicamentosas
As convulsões epilépticas costumam causar comprometimento temporário de consciência, levando o indivíduo ao risco de prejuízo no desempenho nos estudos e no trabalho. O tratamento é sintomático na medida em que os medicamentos disponíveis inibem convulsões, mas não há profilaxia eficaz nem cura para essa doença. A manutenção da medicação é um importante problema devido à necessidade de terapia de longo período, associada aos efeitos indesejáveis de muitas drogas.
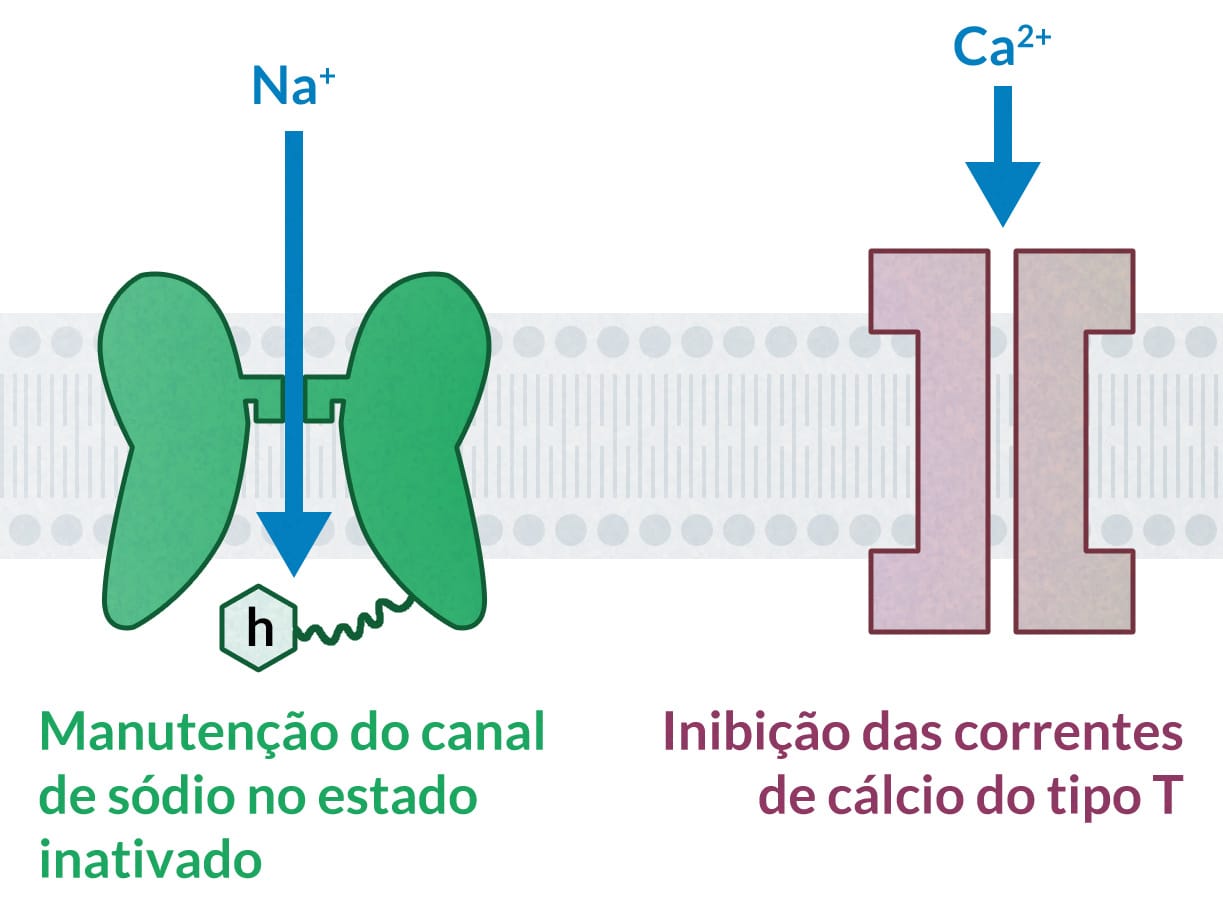
Os mecanismos de ação dos medicamentos anticonvulsivantes dividem-se em três categorias principais:
Limitar o disparo repetitivo e sustentado de neurônios por meio da manutenção dos canais de sódio ativados por voltagem em estado inativado.
Parece envolver inibição sináptica mediada por ácido γ-aminobutírico (GABA).
Drogas eficazes contra crises de ausência, uma forma menos comum de crise epiléptica, atuam com um terceiro mecanismo: inibição dos canais de cálcio ativados por voltagem, responsáveis pelas correntes de Ca2+ do tipo T.
Embora muitos tratamentos estejam disponíveis, esforços estão sendo dedicados a esclarecer as causas genéticas e os mecanismos celulares e moleculares pelos quais um cérebro normalmente se torna epiléptico.
Terminologia e classificação do padrão epiléptico
O termo convulsão se refere a uma alteração transitória de comportamento cerebral, devido ao disparo desordenado, sincrônico e rítmico de uma população de neurônios cerebrais. O termo epilepsia refere-se a um distúrbio da função cerebral caracterizado pela ocorrência periódica e imprevisível de convulsões.
Os agentes farmacológicos de uso clínico atual inibem convulsões e, portanto, são referidos como medicamentos anticonvulsivantes. Acredita-se que as convulsões surjam do córtex cérebral, e não de outras estruturas do sistema nervoso central (SNC), como tálamo, tronco cerebral ou cerebelo, mas esse assunto ainda causa controvérsias científicas.
As crises epilépticas foram classificadas em convulsões parciais, aquelas começando focalmente em um local cortical, e convulsões generalizadas, aquelas que envolvem amplamente ambos hemisférios desde o início da crise.
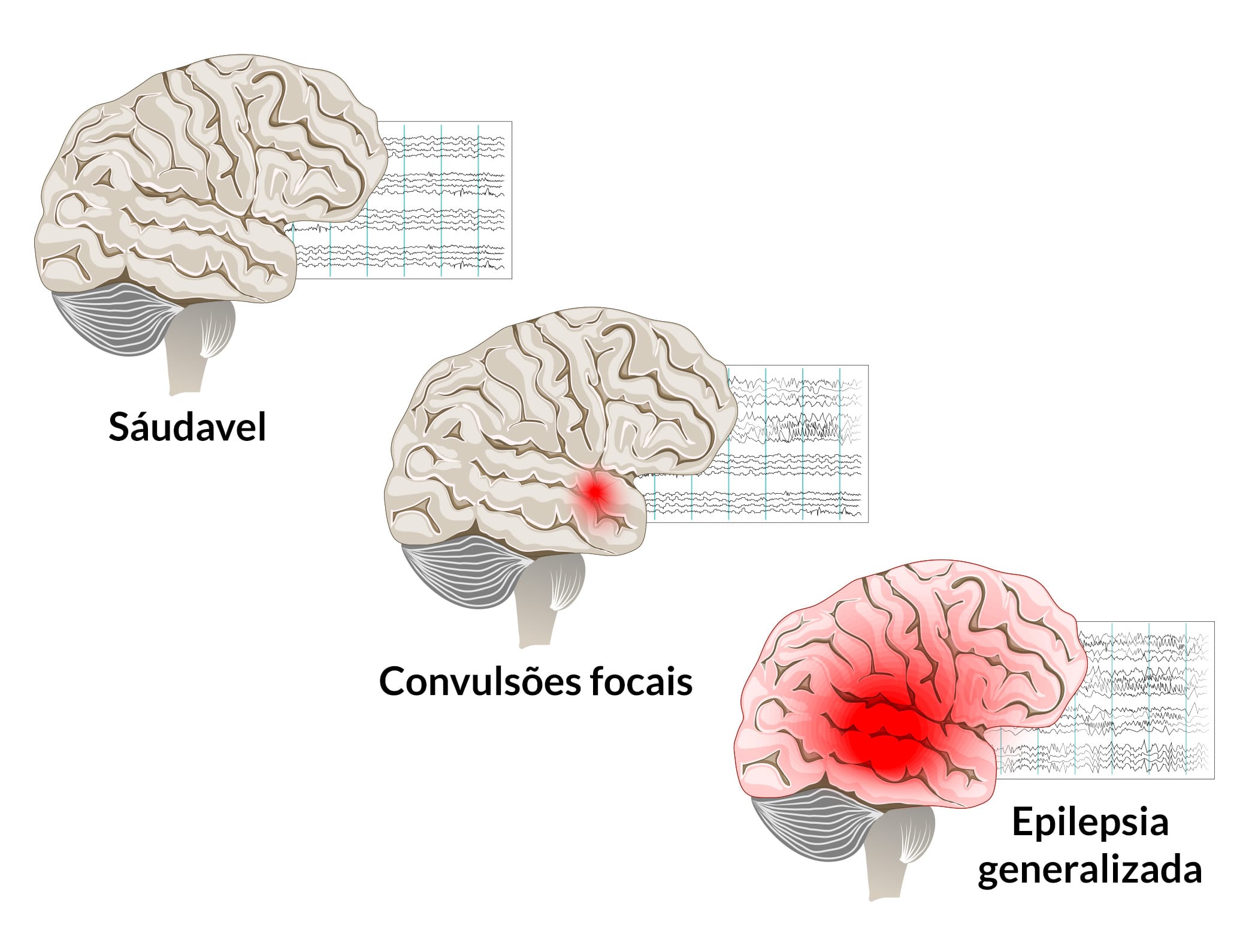
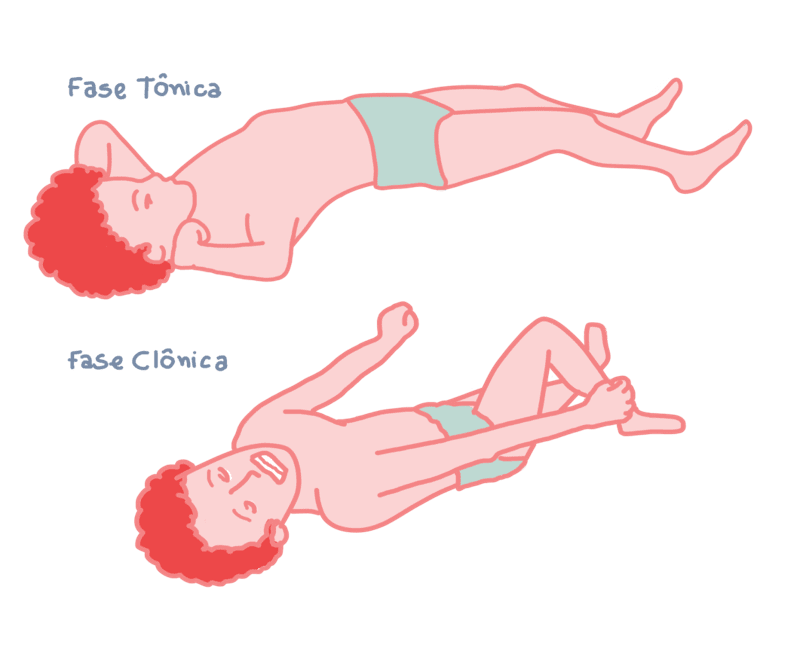
As manifestações comportamentais de uma convulsão são determinadas pelas funções normalmente desempenhadas pela região cortical em que a crise surge. Por exemplo, uma convulsão envolvendo o córtex motor está associada ao movimento clônico da parte do corpo controlada por essa região do córtex.
A maioria das convulsões parciais se originam do lobo temporal. Exemplos de convulsões generalizadas incluem ausência, convulsões mioclônicas e convulsões tônico-clônicas. O tipo de epilepsia é um determinante para a escolha da droga utilizada na terapia.
Medicamentos antiepilépticos
A droga anticonvulsivante ideal precisa suprimir todas as convulsões sem causar qualquer tipo de efeito indesejado. Infelizmente, as drogas usadas atualmente não apenas falham em controlar a atividade convulsiva em alguns pacientes, mas frequentemente causam efeitos indesejáveis, que variam desde um comprometimento mínimo do SNC até a morte por anemia aplástica ou insuficiência hepática.
O clínico que trata pacientes com epilepsia é confrontado com a tarefa de selecionar o medicamento apropriado ou a combinação de drogas que melhor controlem as convulsões com um nível aceitável de efeitos adversos. Como regra geral, o controle total das crises pode ser alcançado em até 50% dos pacientes, enquanto outros 25% podem ter melhoras significativas. O grau de sucesso varia em função do tipo de crise, causa e outros fatores.
Atenção
Para minimizar a toxicidade, o tratamento com um único medicamento é preferível. Se as convulsões não forem controladas com o agente inicial em concentrações plasmáticas adequadas, a substituição por um segundo medicamento é preferível. No entanto, a terapia com vários medicamentos pode ser necessária, especialmente quando dois ou mais tipos de crises ocorrem no mesmo paciente. O regime terapêutico final deve ser determinado por avaliação clínica de efeito e toxicidade.
Para compreender a escolha do anticonvulsivante, assista ao vídeo a seguir.
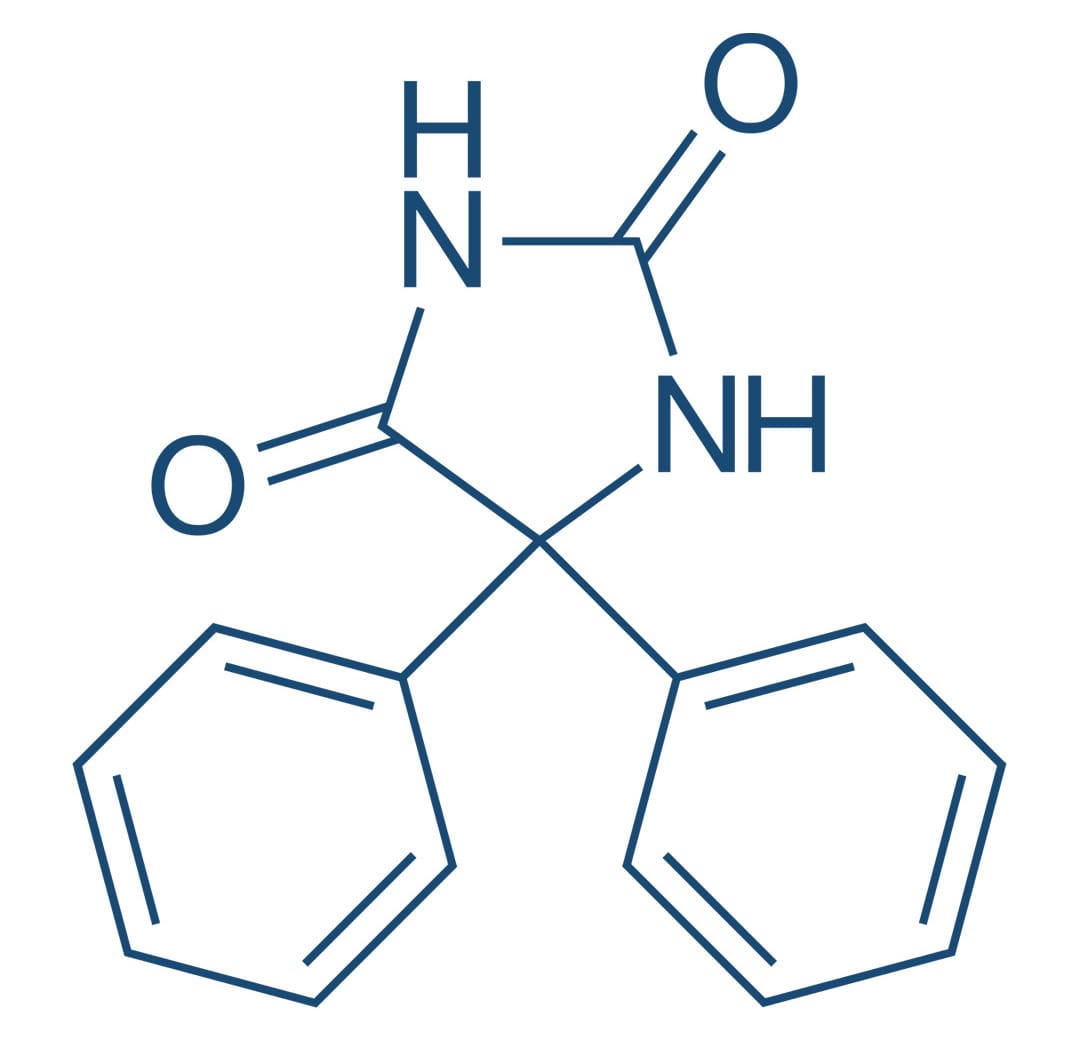
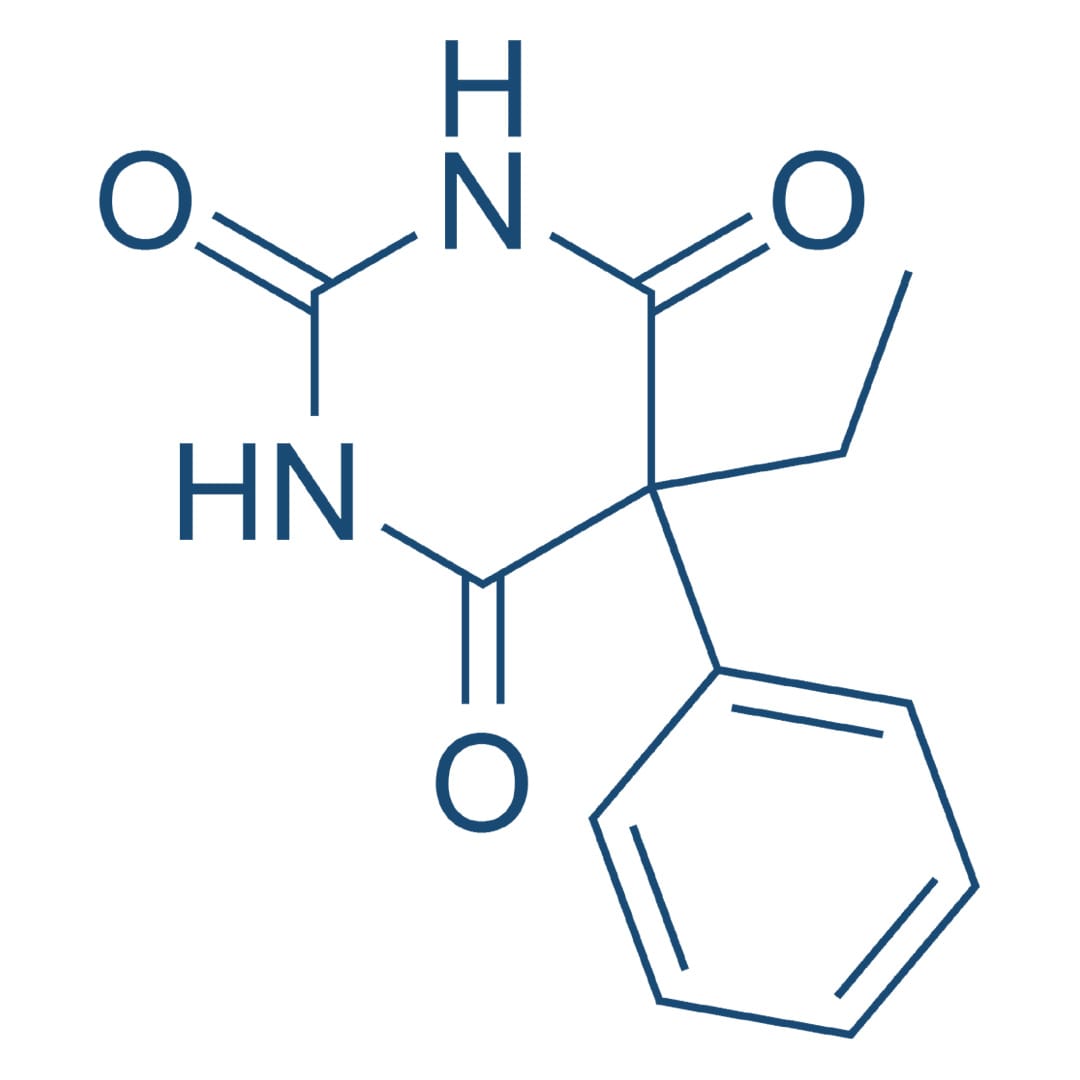
Fenitoína
A fenitoína é um dos agentes anticonvulsivantes mais amplamente usados, sendo eficaz contra crises parciais e convulsões tônico-clônicas, mas não para as crises de ausência. A fenitoína exerce um efeito anticonvulsivante sem causar depressão geral do SNC. Em doses tóxicas, pode produzir sinais excitatórios e, em níveis letais, levar a um tipo de rigidez descerebrada.
O efeito mais significativo da fenitoína se dá por meio de sua capacidade de modificar o padrão de disparo neuronal que medeia o efeito máximo das convulsões. A fase tônica característica pode ser abolida completamente, mas a crise clônica residual pode ser exagerada e prolongada.
Mecanismo de ação
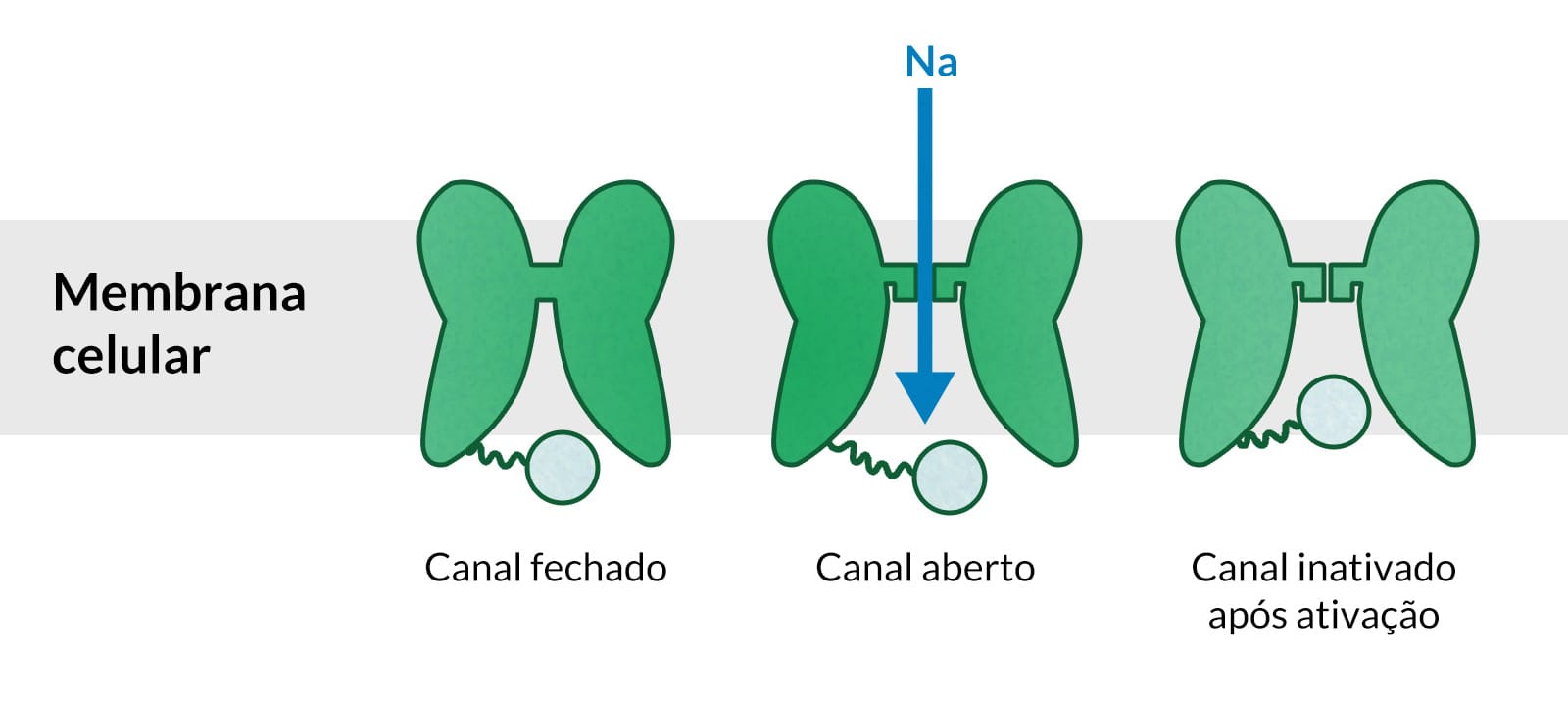
A fenitoína limita o disparo repetitivo de potenciais de ação evocados por uma despolarização sustentada. Esse efeito é mediado por uma desaceleração da taxa de recuperação de canais de sódio ativados por voltagem, mantidos na sua conformação inativada e bloqueando a condução do potencial de ação através do axônio.
Efeitos adversos
Os efeitos tóxicos da fenitoína dependem da via de administração, da duração da exposição e da dosagem. Quando a fosfenitoína, uma pró-droga solúvel em água, é administrada por via intravenosa no tratamento de emergência do estado de mal epiléptico, os sinais tóxicos mais notáveis são: arritmias cardíacas com ou sem hipotensão e/ou depressão do SNC.
Embora a toxicidade cardíaca ocorra com mais frequência em pacientes mais velhos e naqueles com doença cardíaca conhecida, também pode se desenvolver em pacientes jovens e saudáveis. A sobredosagem oral aguda resulta principalmente em sinais que se referem ao cerebelo e ao sistema vestibular; altas doses têm sido associadas à atrofia cerebelar marcada.
Os efeitos tóxicos associados ao tratamento crônico também são efeitos cerebelares vestibulares relacionados à dose, mas também incluem outros efeitos do SNC, como: alterações comportamentais, aumento da frequência de convulsões, sintomas gastrointestinais, hiperplasia gengival, osteomalácia e anemia megaloblástica.
A hiperplasia gengival ocorre em 20% de todos os pacientes durante a terapia crônica e é provavelmente a manifestação mais comum de toxicidade da fenitoína em crianças e adolescentes. As reações de hipersensibilidade incluem erupção cutânea morbiliforme em 2% a 5% dos pacientes e, ocasionalmente, reações cutâneas mais graves, incluindo síndrome de Stevens-Johnson e necrólise epidérmica tóxica.
Atenção
O crescimento excessivo do tecido gengival parece envolver colágeno alterado pelo metabolismo. A fenitoína também aumenta o metabolismo da vitamina K e reduz a concentração de proteínas dependentes dessa vitamina, que são importantes para o metabolismo normal do Ca2+ no osso. Isso pode explicar por que a osteomalácia nem sempre é melhorada pela administração de vitamina D.
Interações medicamentosas
A administração simultânea de qualquer medicamento metabolizado por CYP2C9 ou CYP2C10 pode aumentar a concentração plasmática de fenitoína, diminuindo sua taxa de metabolização. A carbamazepina pode aumentar o metabolismo da fenitoína, causando diminuição bem documentada na concentração de fenitoína sanguínea. Por outro lado, a fenitoína reduz a concentração plasmática de carbamazepina.
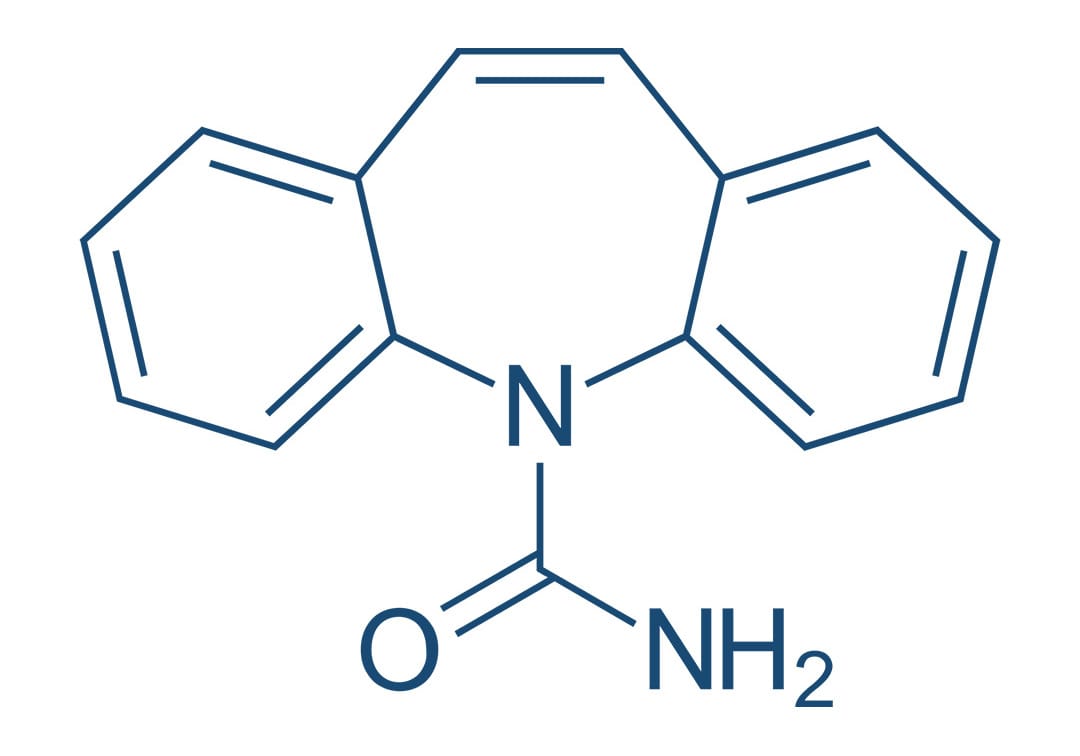
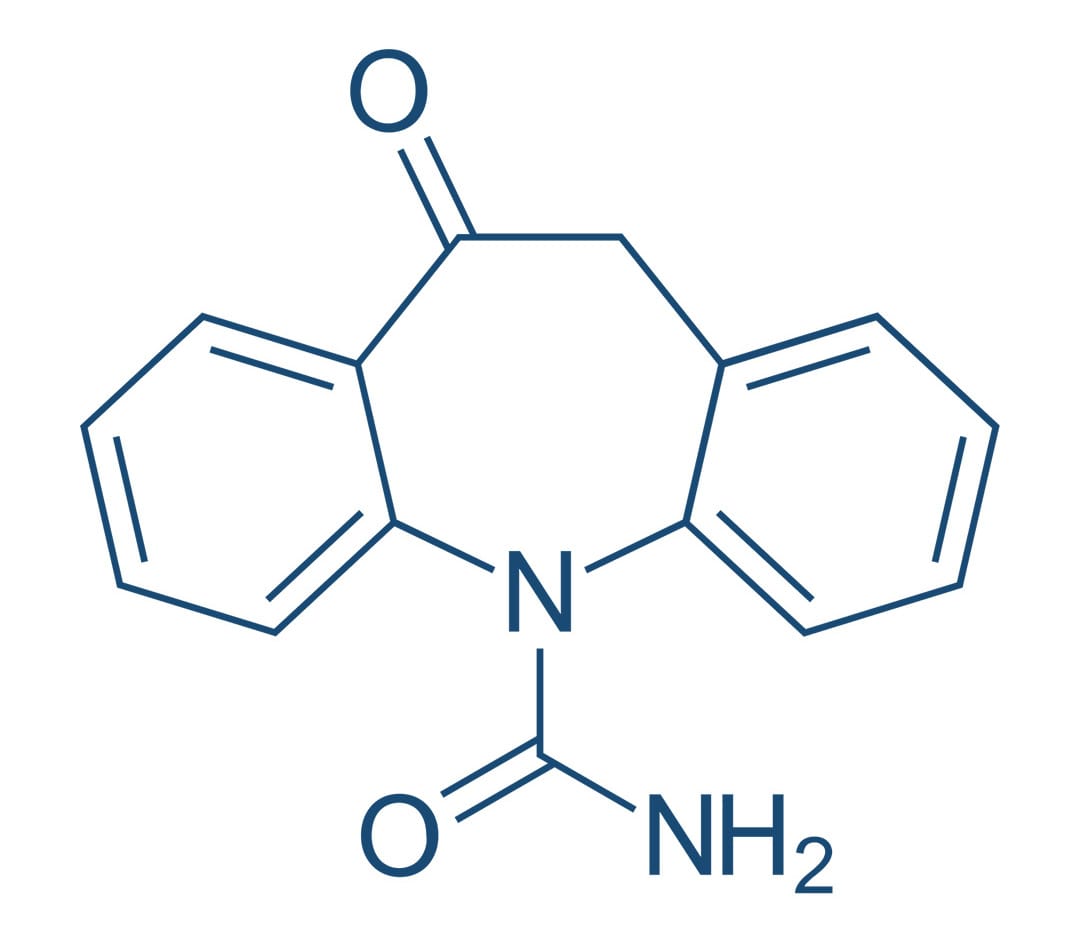
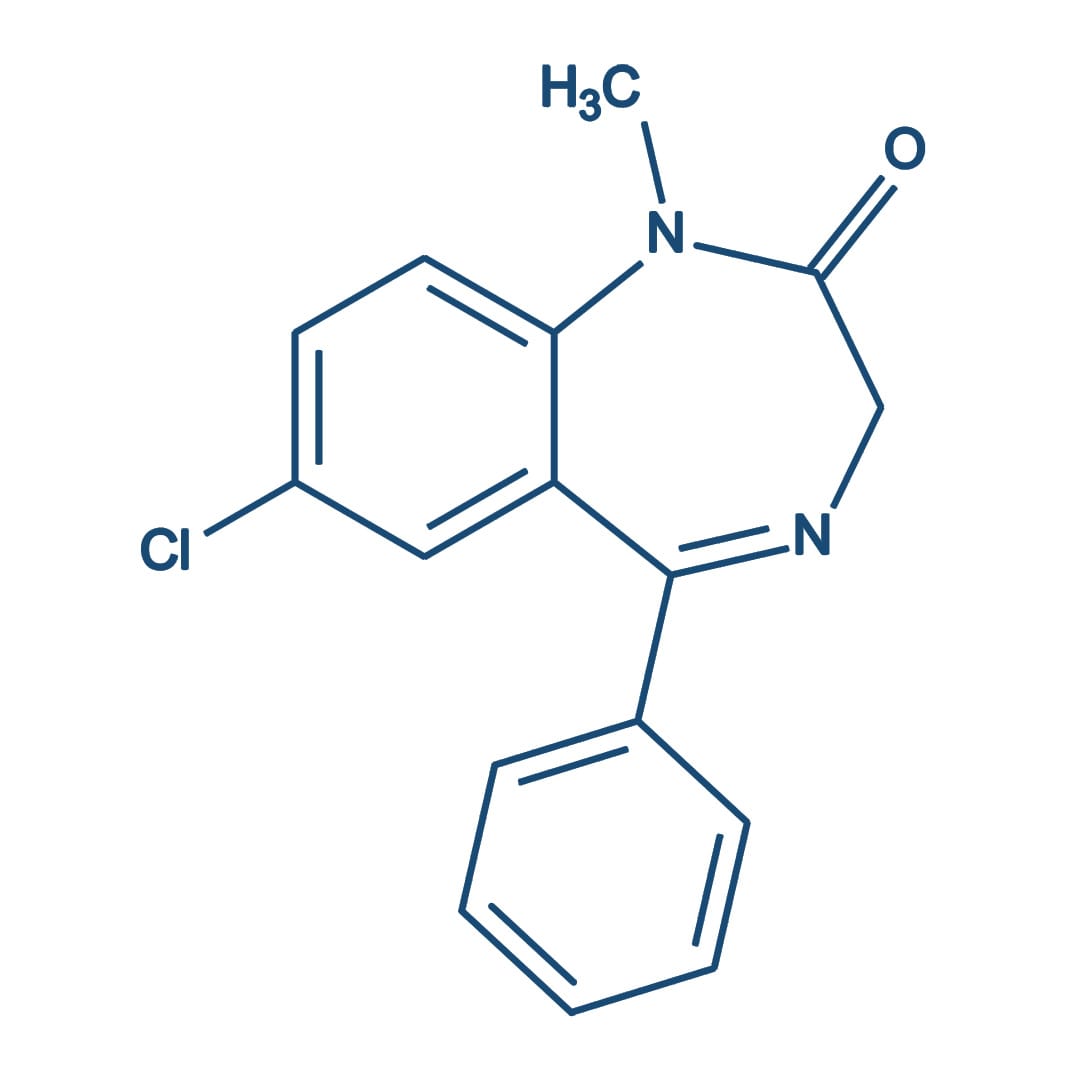
Carbamazepina
A carbamazepina foi inicialmente aprovada como agente anticonvulsivante em 1974. Tem sido empregada, no entanto, desde 1960 no tratamento da neuralgia do trigêmeo. Atualmente, é considerada um medicamento primário para o tratamento de convulsões tônico-clônicas e convulsões parciais simples e complexas.
Os efeitos da carbamazepina em humanos se assemelham aos da fenitoína de muitas maneiras. A carbamazepina tem sido utilizada para produzir respostas terapêuticas em pacientes maníaco-depressivos, incluindo alguns nos quais o carbonato de lítio não é eficaz. Utilizada em doses terapêuticas, a carbamazepina não apresenta efeitos sedativos.
Mecanismo de ação
Como a fenitoína, a carbamazepina limita os disparos repetitivos de potenciais de ação evocados por uma despolarização sustentada. Isso parece ser mediado por uma desaceleração da taxa de recuperação de canais de sódio ativados por voltagem, mantidos na sua conformação inativada e bloqueando a condução do potencial de ação através do axônio.
Efeitos adversos
A intoxicação aguda por carbamazepina pode resultar em estupor ou coma, hiperirritabilidade, convulsões e depressão respiratória. Durante a terapia de longo tempo, os efeitos adversos mais frequentes da droga incluem: sonolência, vertigem, ataxia, diplopia e visão turva. A frequência das convulsões pode aumentar, especialmente com sobredosagem.
Outros efeitos adversos incluem: náuseas, vômitos, toxicidade hematológica grave (anemia aplástica, agranulocitose) e reações de hipersensibilidade (reações cutâneas perigosas, eosinofilia, linfadenopatia, esplenomegalia). Uma complicação tardia da terapia com carbamazepina é a retenção de água, com diminuição da osmolalidade e concentração de sódio no plasma, especialmente em pacientes idosos com doença cardíaca.
Interações medicamentosas
Fenobarbital, fenitoína e valproato podem aumentar o metabolismo da carbamazepina por indução do CYP3A4; a carbamazepina pode aumentar a biotransformação da fenitoína. A administração simultânea de carbamazepina pode reduzir as concentrações de valproato, lamotrigina e topiramato. O metabolismo da carbamazepina pode ser inibido por propoxifeno, eritromicina, cimetidina, fluoxetina e isoniazida.
Oxcarbazepina
A oxcarbazepina (10,11-dihidro-10- oxocarbamazepina) é um ceto análogo da carbamazepina. A oxcarbazepina é uma pró-droga convertida em seu principal metabólito ativo, um 10-mono-hidroxi derivado, que é inativado pela conjugação do glicuronídeo e eliminado pela excreção renal.
Esse fármaco foi aprovado como monoterapia ou terapia adjuvante das convulsões parciais em adultos, como monoterapia para convulsões parciais em crianças de 4 a 16 anos e como terapia adjuvante em crianças de 2 anos de idade ou mais com epilepsia. Seu mecanismo de ação é semelhante ao da carbamazepina.
Você sabia
A oxcarbazepina é um indutor enzimático menos potente do que seu análogo. A substituição de oxcarbazepina por carbamazepina está associada a níveis aumentados de fenitoína e ácido valproico, provavelmente pela redução da indução de enzimas hepáticas. A oxcarbazepina não induz as enzimas hepáticas envolvidas em sua própria degradação. Embora não pareça reduzir o efeito anticoagulante da varfarina, induz o CYP3A e, portanto, diminui níveis plasmáticos de anticoncepcionais orais esteroides.
Fenobarbital
O fenobarbital foi o primeiro agente anticonvulsivante eficaz. Tem toxicidade relativamente baixa, é barato e ainda é um dos medicamentos mais eficazes e amplamente utilizados para esse fim. A maioria dos barbitúricos tem propriedades anticonvulsivantes; no entanto, apenas alguns desses agentes, como fenobarbital, exercem ação máxima no controle da convulsão em doses abaixo das necessárias para a hipnose, o que determina sua utilidade clínica como agente anticonvulsivante.
Você sabia
O fenobarbital é um agente eficaz para crises tônico-clônicas generalizadas e parciais. Sua eficácia, a baixa toxicidade e o baixo custo o tornam um importante agente para esses tipos de epilepsia. No entanto, tem efeitos sedativos, e sua tendência a alterar o estado de alerta em crianças reduziu seu uso como fármaco de primeira escolha no tratamento das epilepsias infantis.
Mecanismo de ação
O mecanismo pelo qual o fenobarbital inibe as convulsões envolve a potencialização da inibição sináptica por meio de uma ação no receptor GABA-A. Em níveis que excedem as concentrações terapêuticas, o fenobarbital também limita disparos repetitivos sustentados; isso pode estar associado a alguns dos efeitos anticonvulsivantes encontrados em concentrações mais altas de fenobarbital e alcançados durante a terapia do estado de mal epiléptico.
Atenção
Mecanismo de ação dos barbitúricos. São agonistas dos receptores GABA-A, promovendo sua abertura e a permeabilidade de cloreto para citosol e limitando disparos pós-sinápticos.
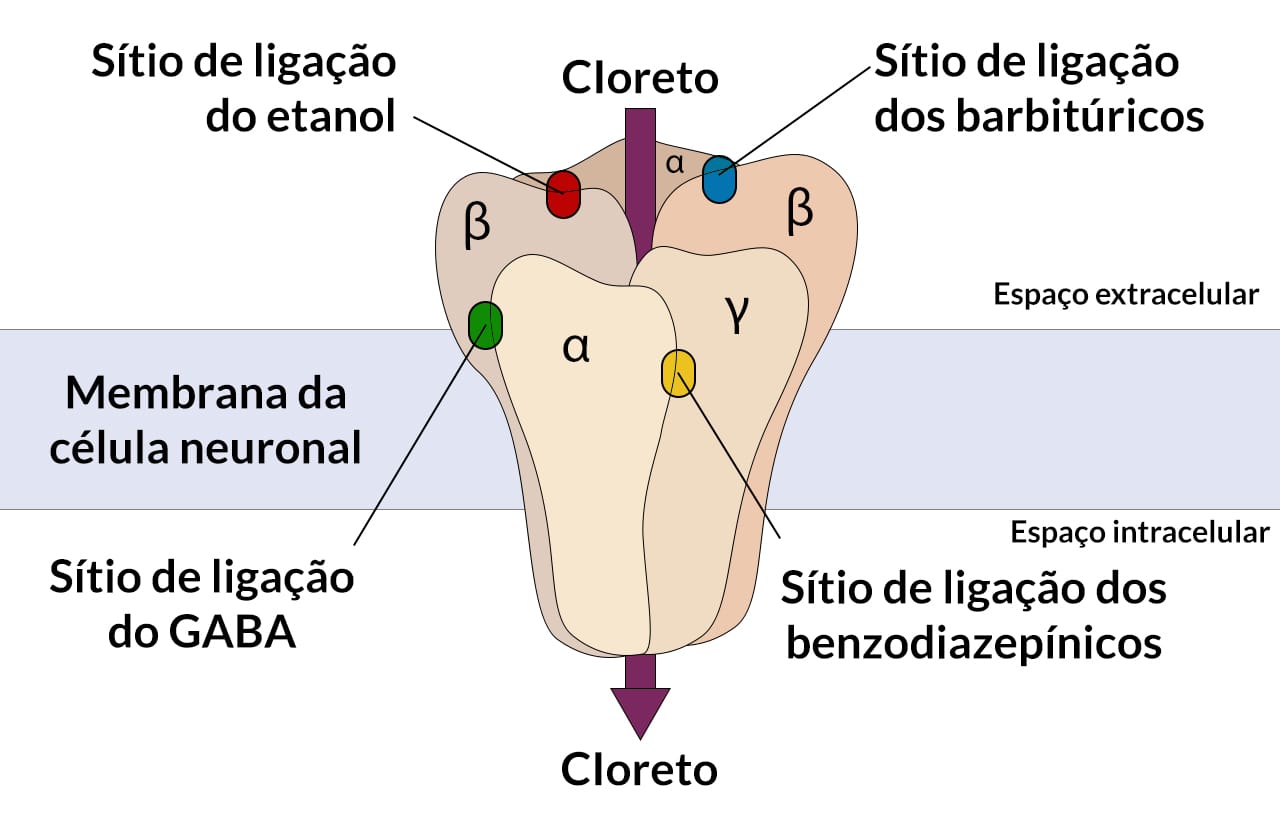
Efeitos adversos
A sedação é o efeito indesejado mais frequente do fenobarbital, normalmente presente na maioria dos pacientes no início da terapia, mas a tolerância se desenvolve durante o tratamento crônico. Nistagmo e ataxia ocorrem em dosagem excessiva. O fenobarbital pode produzir irritabilidade e hiperatividade em crianças e agitação e confusão em idosos.
Nistagmo
Oscilações repetidas e involuntárias em sentido horizontal de um ou dos dois olhos.
Ataxia
Perda de controle muscular ao executar movimentos voluntários.
Concentrações do fenobarbital no plasma
Durante a terapia de longo tempo em adultos, a concentração plasmática de fenobarbital é, em média, 10 μg/mL por dose diária de 1 mg/kg; em crianças, o valor é 5-7 μg/mL por 1 mg/kg. Embora não exista uma relação precisa entre os resultados terapêuticos e a concentração da droga no plasma, concentrações plasmáticas de 10 a 35 μg/mL são geralmente recomendadas para o controle das crises convulsivas.
A relação entre a concentração plasmática do fenobarbital e os efeitos adversos varia com o desenvolvimento da tolerância. Sedação, nistagmo e ataxia geralmente estão ausentes em concentrações abaixo de 30 μg/mL durante a terapia de longo período, mas os efeitos adversos podem ser aparentes por vários dias em concentrações mais baixas, quando a terapia é iniciada ou sempre que a dosagem é aumentada.
Concentrações maiores que 60 μg/mL podem estar associadas à intoxicação acentuada no indivíduo não tolerante. Uma vez que uma toxicidade comportamental significativa pode estar presente, apesar da ausência de sinais evidentes de toxicidade, a tendência de manter pacientes, principalmente crianças, que recebem doses excessivamente altas do fenobarbital deve ser evitada.
Atenção
A concentração plasmática do fenobarbital deve ser aumentada acima de 30-40 μg/mL apenas se o aumento for adequadamente tolerado e somente se contribuir significativamente para o controle das crises.
Interações medicamentosas
Interações entre o fenobarbital e outras drogas geralmente envolvem a indução do CYP pelo fenobarbital. A interação entre a fenitoína e o fenobarbital é variável. Concentrações do fenobarbital no plasma podem estar elevadas em até 40% durante a administração concomitante com ácido valproico.
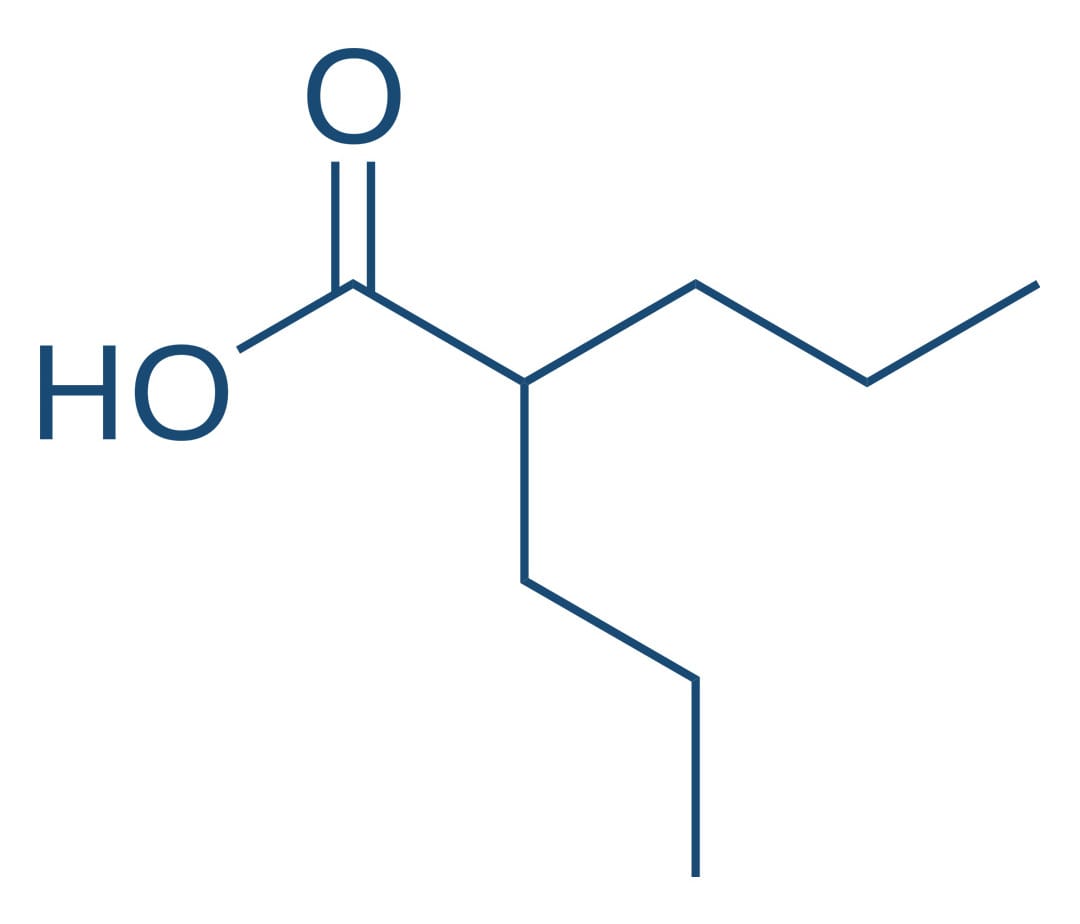
Ácido valproico
As propriedades anticonvulsivantes do ácido valproico foram descobertas acidentalmente quando o fármaco era empregado como um veículo para outros compostos que foram sendo investigados na terapia anticonvulsivante. Como a fenitoína e a carbamazepina, o valproato inibe a propagação do potencial de ação. O valproato é um medicamento anticonvulsivante de amplo espectro eficaz no tratamento de ausência, convulsões mioclônicas, parciais e tônico-clônicas.
Interações medicamentosas
O ácido valproico produz efeitos semelhantes aos da fenitoína e da carbamazepina. Seu efeito parece se dar por meio da desaceleração da taxa de recuperação de canais de sódio ativados por voltagem, mantidos na sua conformação inativada e bloqueando a condução do potencial de ação através do axônio. Pode limitar os disparos repetitivos e sustentados, reduzindo as correntes de cálcio do tipo T e contribuindo para a eficácia do ácido valproico no controle das crises parciais, tônico-clônicas e crises de ausência, respectivamente.
Correntes de cálcio do tipo T
São correntes implicadas no controle da liberação de neurotransmissores nas sinapses, como acetilcolina e serotonina, entre outros. As correntes do tipo T têm papel importante nas descargas rítmicas das crises epilépticas generalizadas de ausência.
Atenção
Mecanismo de ação do ácido valproico na indução da manutenção dos canais de sódio dependentes de voltagem em sua conformação inativa e na inibição das correntes de cálcio do tipo T.
Efeitos adversos
Os efeitos adversos mais comuns são sintomas transitórios gastrointestinais, incluindo anorexia, náusea e vômito. Os efeitos no SNC incluem sedação, ataxia e tremor; esses sintomas ocorrem com pouca frequência e geralmente respondem a uma diminuição abrupta na dosagem. Erupção cutânea, alopecia, estimulação do apetite e o ganho de peso foram observados no tratamento crônico com ácido valproico em alguns pacientes.
O ácido valproico tem vários efeitos na função hepática. A elevação das transaminases hepáticas no plasma é observada em até 40% dos pacientes e frequentemente ocorre de forma assintomática durante os primeiros meses de terapia.
Interações medicamentosas
O valproato inibe, principalmente, o metabolismo de medicamentos que são substratos do CYP2C9, incluindo fenitoína e fenobarbital. O valproato também inibe a UGT e, portanto, o metabolismo da lamotrigina e do lorazepam. Uma alta proporção de valproato está ligada à albumina, e as altas concentrações sanguíneas dessa droga resultam na redução da ligação da fenitoína e do valproato com a albumina.
A administração simultânea de valproato e clonazepam foi associada com o desenvolvimento do estado de ausência de epilepsia; no entanto, essa complicação parece ser rara.
Benzodiazepínicos
Os benzodiazepínicos são usados, principalmente, como sedativos e ansiolíticos, conforme abordamos no módulo anterior. Aqui, estudaremos seu uso na terapia das epilepsias. Um grande número de benzodiazepínicos têm propriedades anticonvulsivantes, mas apenas o clonazepam foi aprovado no tratamento crônico de certos tipos de convulsões.
O diazepam e o lorazepam são muito utilizados no controle do estado de mal epiléptico, ou seja, o diazepam é o fármaco de primeira escolha em pacientes com quadro de epilepsia ativa.

O clonazepam é útil na terapia da ausência, bem como em convulsões mioclônicas em crianças. No entanto, a tolerância aos seus efeitos anticonvulsivantes geralmente se desenvolve após o período de um a seis meses de administração, quando alguns pacientes não respondem mais ao clonazepam em qualquer dosagem. O clonazepam intranasal spray é designado como monoterapia para episódios agudos e recorrentes de crises convulsivas.
Embora o diazepam seja um agente eficaz para o tratamento do estado epiléptico, sua curta duração de ação é uma desvantagem, levando ao uso mais frequente de lorazepam.
Mecanismo de ação
As ações anticonvulsivantes dos benzodiazepínicos, bem como outros efeitos que ocorrem em doses não sedativas, resultam, em grande parte, da sua capacidade de potencializar a ação do GABA na inibição sináptica. Os benzodiazepínicos atuam em subconjuntos de receptores GABA-A e aumentam a frequência, mas não a duração, da abertura dos canais de Cl- ativados por GABA.
Efeitos adversos
Os principais efeitos adversos da terapia oral de longa duração com clonazepam são sonolência e letargia, que ocorrem em 50% dos pacientes. Porém, a tolerância frequentemente se desenvolve com a administração contínua. Incoordenação e ataxia são menos frequentes quando o clonazepam é administrado em curto ou longo períodos.
Gabapentina e pregabalina
A gabapentina e a pregabalina são drogas anticonvulsivantes que consistem em uma molécula de GABA covalentemente ligada a um anel de ciclohexano lipofílico ou isobutano, respectivamente. A gabapentina foi desenvolvida para ser um agonista de GABA centralmente ativo por apresentar alta lipossolubilidade e facilitar sua passagem através da barreira hematoencefálica.
Essas drogas são eficazes no tratamento das crises parciais, com e sem generalização secundária, mas, atualmente, a gabapentina vem sendo utilizada no controle da dor neuronal e da enxaqueca crônica.
Mecanismo de ação
Apesar de seu desenvolvimento inicial para agir como agonistas do receptor GABA-A, a gabapentina e a pregabalina não mimetizam o efeito do GABA. Esses compostos se ligam com alta afinidade a uma proteína de membranas, com uma sequência de aminoácidos idêntica à da subunidade α2δ-1 do canal de cálcio. Acredita-se que os efeitos anticonvulsivantes da gabapentina são mediados pela proteína α2δ-1.
Efeitos adversos
No geral, a gabapentina é bem tolerada terapeuticamente, apresentando os efeitos adversos mais comuns de sonolência, tontura, ataxia e fadiga. Esses efeitos geralmente são de gravidade leve a moderada, e são reduzidos dentro de duas semanas após o início do tratamento.
Lamotrigina
A lamotrigina é um derivado da feniltriazina inicialmente desenvolvido como um agente antifolato, baseado no princípio errôneo de que a redução do folato efetivamente reduziria as crises convulsivas.
A lamotrigina é utilizada na monoterapia e na terapia complementar de convulsões tônico-clônicas parciais e generalizadas em adultos, e síndrome de Lennox-Gastaut em crianças e adultos. A síndrome de Lennox-Gastaut é um distúrbio da infância caracterizado por vários tipos de convulsões, retardo mental e refratariedade à medicação anticonvulsiva.
A monoterapia com lamotrigina em convulsões tônico-clônicas generalizadas ou parciais recém-diagnosticadas é equivalente à realizada com carbamazepina ou fenitoína.
Mecanismo de ação
A lamotrigina age por mecanismos semelhantes aos da fenitoína e da carbamazepina. Por esse motivo, é utilizada terapeuticamente no controle das convulsões parciais e secundariamente generalizadas. No entanto, a lamotrigina é eficaz contra um espectro mais amplo de convulsões do que a fenitoína e a carbamazepina, sugerindo que a lamotrigina pode ter outras ações, além de regular a recuperação da inativação dos canais de sódio.
Efeitos adversos
Os efeitos adversos mais comuns são: tonturas, ataxia, visão turva ou dupla, náusea, vômito e erupção. Alguns casos de síndrome de Stevens Johnson e coagulação intravascular disseminada foram relatados com o uso da lamotrigina.
Stevens Johnson
A síndrome de Stevens Johnson é caraterizada por reações de hipersensibilidade cutânea grave.
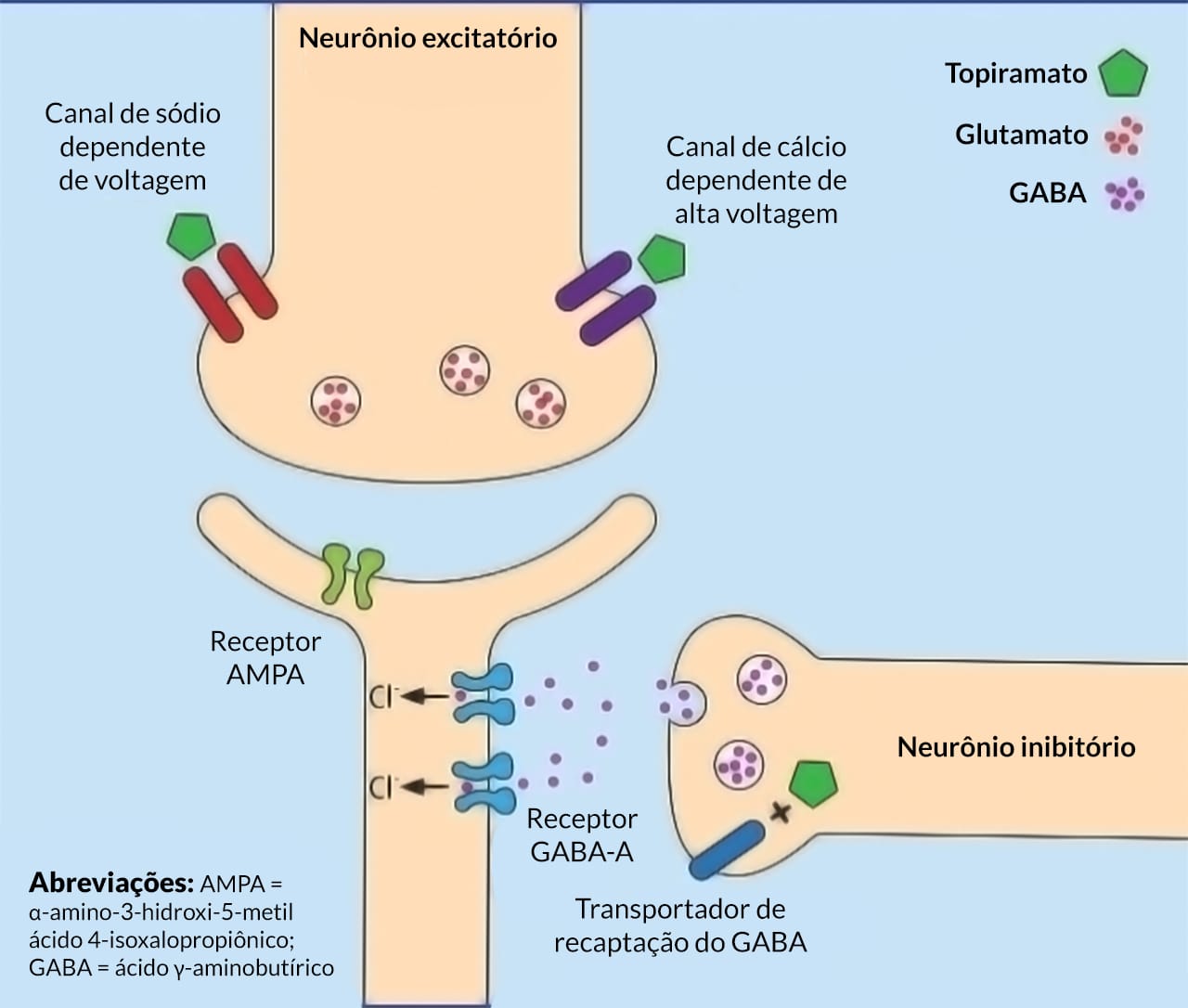
Topiramato
O topiramato é um fármaco anticonvulsivante utilizado como monoterapia inicial (em pacientes com pelo menos dez anos) e como terapia adjuvante (em pacientes a partir de dois anos de idade) em crises tonico-clônicas generalizadas, na síndrome de Lennox-Gastaut em pacientes com dois anos de idade ou mais e na profilaxia da enxaqueca em adultos.
Síndrome de Lennox-Gastaut
A síndrome de Lennox-Gastaut caracteriza-se por ser uma crise epiléptica pediátrica grave.
Mecanismos de ação
O topiramato reduz as correntes de sódio dependentes de voltagem, podendo atuar no estado inativado do canal de sódio de maneira semelhante à fenitoína. Além disso, o topiramato ativa uma corrente de potássio hiperpolarizante, aumenta as correntes pós-sinápticas do receptor GABA-A e limita a ativação do subtipo do receptor AMPA-cainato de glutamato.
Efeitos adversos
O topiramato é um fármaco bem tolerado. Seus efeitos adversos mais comuns são: sonolência, fadiga, perda de peso e nervosismo. Pode causar cálculos renais, o que é devido, mais provavelmente, à inibição de anidrase carbônica. O topiramato foi associado à deficiência cognitiva, sendo que os pacientes podem reclamar de uma mudança no sabor de bebidas gaseificadas.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Identificar fármacos antipsicóticos e antiparkinsonianos, enfatizando seus efeitos farmacológicos e suas utilizações terapêuticas de acordo com suas particularidades clínicas
Farmacologia das psicoses
A psicose é um sintoma de doenças mentais caracterizadas por um sentido distorcido ou inexistente da realidade.
Os transtornos psicóticos têm diferentes etiologias, e cada uma exige uma abordagem de tratamento única. Transtornos psicóticos comuns incluem: transtornos de humor (depressão ou mania) com características psicóticas, psicose induzida por substâncias, demência com características psicóticas, delírio com características psicóticas, transtorno psicótico breve, transtorno delirante, transtorno esquizoafetivo e esquizofrenia.
Atenção
Nem toda psicose é esquizofrenia, e a fisiopatologia relevante para o tratamento eficaz da esquizofrenia pode não se aplicar a outros transtornos psicóticos.
A eficácia dos antagonistas da dopamina D2 para os sintomas positivos da psicose observada na maioria dos transtornos psicóticos sugere uma etiologia comum para esses sintomas relacionados à neurotransmissão dopaminérgica excessiva em vias mesolímbicas da dopamina (DA).
Em transtornos psicóticos induzidos por substâncias, a substância pode aumentar diretamente a atividade pós-sináptica da DA por meio do aumento da liberação de neurotransmissores pré-sinápticos (anfetamina), da inibição da recaptação pré-sináptica de DA (metilfenidato, cocaína e anfetamina) ou da maior disponibilidade de DA (L-dopa).
Os antagonistas de NMDA (fenciclidina e cetamina) atuam indiretamente para estimular a disponibilidade de DA, diminuindo a inibição tônica mediada por glutamato na liberação de DA na via mesolímbica.
Todos os medicamentos antipsicóticos disponíveis comercialmente reduzem a neurotransmissão dopaminérgica. Essa descoberta implica o bloqueio do receptor D2 ou, no caso de aripiprazol, modulação da atividade DA como o principal mecanismo terapêutico. A clorpromazina e outros agentes antipsicóticos típicos de baixa potência também são profundamente sedativos, uma característica que costumava ser considerada relevante para a sua terapêutica.
O desenvolvimento do agente antipsicótico típico de alta potência haloperidol, um medicamento com afinidade por receptores de histamina H1 e muscarínicos M1, reduz significativamente os efeitos sedativos e a melhora da eficácia clínica de medicamentos antipsicóticos.
Uso clínico dos antipsicóticos
Delírio e demência
As variáveis da doença têm considerável influência na seleção de agentes antipsicóticos. Os sintomas psicóticos do delírio e da demência são geralmente tratados com baixas doses de medicamentos, embora possa ser necessário repetir as doses em intervalos frequentes para atingir o controle comportamental adequado.
Apesar do uso clínico generalizado, nenhum medicamento antipsicótico recebeu aprovação para psicose relacionada à demência. Além disso, todos os medicamentos antipsicóticos carregam avisos de que podem aumentar a mortalidade nesse cenário. Os medicamentos anticolinérgicos podem piorar o delírio e a demência.
Recomendação de medicamentos
Medicamentos antipsicóticos típicos de alta potência (por exemplo, haloperidol) ou agentes antipsicóticos atípicos com propriedades antimuscarínicas limitadas (por exemplo, risperidona) são frequentemente as drogas de escolha.
Mania
Quase todos os agentes antipsicóticos atípicos, com exceção da clozapina e da iloperidona, têm indicações para mania aguda, e as doses são ajustadas rapidamente para a dose máxima recomendada nas primeiras 24 a 72 horas de tratamento. Pacientes com mania aguda requerem doses diárias muito altas.
Drogas antipsicóticas típicas também são eficazes em casos de mania aguda, mas muitas vezes são evitadas devido ao risco de induzir o primeiro episódio psicótico. A resposta clínica (diminuição da agitação psicomotora e irritabilidade, aumento do sono e redução ou ausência de delírios e alucinações) geralmente ocorre em sete dias, mas pode ser aparente já no segundo dia.
Ao contrário dos pacientes com delírio, demência, psicose induzida por substâncias e transtorno psicótico breve, pacientes com mania podem ter a necessidade de continuar o tratamento com o antipsicótico por muitos meses após a resolução dos sintomas psicóticos e maníacos, normalmente em combinação com um estabilizador de humor, como lítio, ou preparações de ácido valproico.
Recomendação de medicamentos
O aripiprazol e a olanzapina têm indicações como monoterapia para o tratamento de manutenção do transtorno bipolar, mas o uso de olanzapina diminuiu dramaticamente devido a preocupações sobre os efeitos metabólicos adversos (ganho de peso, hiperlipidemia e hiperglicemia).
A risperidona injetável de longa duração também tem indicações para monoterapia de manutenção (e adjuvantemente com lítio ou valproato) em pacientes com transtorno bipolar. A combinação de um agente antipsicótico com um estabilizador de humor muitas vezes melhora o controle dos sintomas maníacos e reduz ainda mais o risco de recaída.
Agentes antipsicóticos com maiores riscos de ganho de peso (por exemplo, olanzapina e clozapina) devem ser evitados, a menos que os pacientes sejam refratários aos tratamentos preferenciais.
Esquizofrenia
Os objetivos imediatos do tratamento antipsicótico agudo são a redução do comportamento agitado, desorganizado ou hostil, diminuindo o impacto das alucinações, a melhora da organização dos processos de pensamento e a redução do isolamento social. As doses usadas são geralmente maiores do que as necessárias para o tratamento de manutenção de pacientes estáveis.
Apesar do debate considerável, antipsicóticos atípicos não são mais eficazes no tratamento de sintomas positivos do que os agentes típicos, mesmo que haja pequenas diferenças mensuráveis nos efeitos sobre os sintomas negativos e a cognição. Novos agentes antipsicóticos atípicos oferecem menos efeitos colaterais neurológicos do que as drogas antipsicóticas típicas.
As doses clinicamente eficazes de agentes atípicos mostram risco marcadamente reduzido na indução do primeiro ataque psicótico (ou quase ausente no caso da quetiapina e da clozapina), em comparação com os agentes antipsicóticos típicos.
O bloqueio excessivo dos receptores D2, como no caso do uso de agentes típicos de alta potência (por exemplo, haloperidol), não apenas aumenta o risco de efeitos neurológicos motores (por exemplo, rigidez muscular, bradicinesia, tremor e acatisia), como também retarda a bradifrenia e interfere com vias centrais de recompensa, resultando em queixas de anedonia por parte do paciente.
Recomendação de protocolos e práticas
Na psicose aguda, a sedação pode ser desejável, mas o o uso de um medicamento antipsicótico sedativo pode interferir com a função cognitiva e a reintegração social de um paciente. Os médicos geralmente preferem usar antipsicóticos não sedativos e adicionar baixas doses de benzodiazepínicos, conforme necessário.
Como resultado da melhora do perfil de risco neurológico e do risco agressivo, os antipsicóticos atípicos essencialmente substituíram antipsicóticos típicos na prática clínica, uma vez que a esquizofrenia requer tratamento por longo período.
Mecanismo de ação dos antipsicóticos
Dividimos os antipsicóticos em dois grandes grupos, sendo eles: típicos (primeira geração) – clorpromazina, haloperidol, tioridazina; atípicos (segunda geração) – clozapina, olanzapina, risperidona, quetiapina, ziprasidona.
Embora os dados emergentes indiquem que a estimulação de glutamato ou de receptores muscarínicos possam apresentar propriedades antipsicóticas, os antipsicóticos eficazes apresentam atividade de antagonistas dos receptores D2. Essa redução na neurotransmissão dopaminérgica é atualmente alcançada por meio de dois mecanismos: antagonismo D2 ou agonismo parcial D2, do qual o aripiprazol é o único exemplo atual.
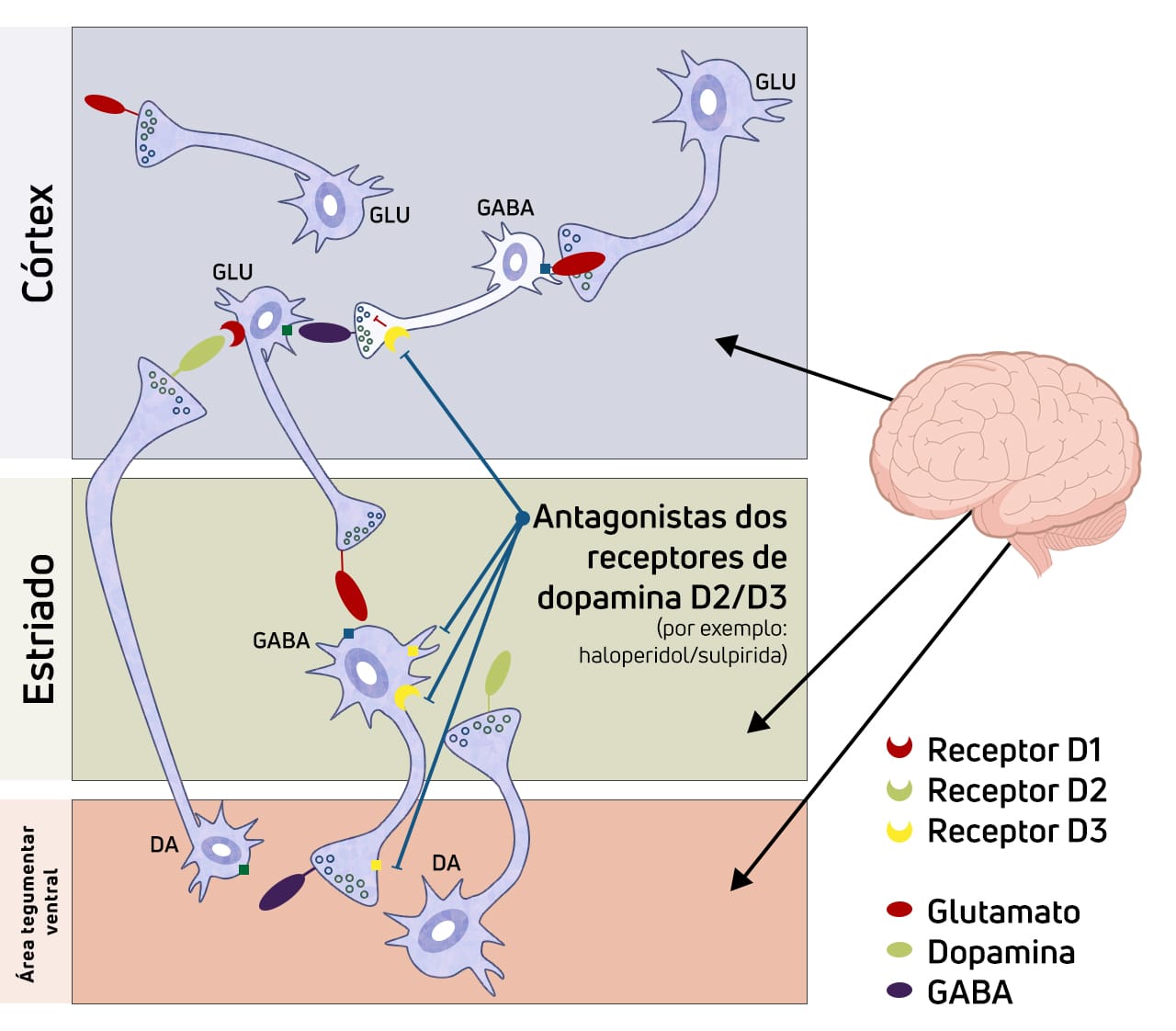
A neurofarmacologia e a farmacologia comportamental do antagonismo dos receptores 5-HT2 fornecem informações sobre propriedades vantajosas de medicamentos que têm efeitos sobre o sistema serotoninérgico. Agentes antipsicóticos com afinidade de 5-HT2 apresentam efeitos significativos nos receptores 5-HT2A e 5-HT2C, variando em suas potências relativas em cada subtipo.
Agentes antipsicóticos atípicos exibem potente antagonismo funcional em ambos os subtipos de receptores 5-HT2, mas há evidências de que esses efeitos resultam do agonismo inverso dos receptores acoplados à proteína G.
Efeitos adversos dos antipsicóticos
Com exceção do agonista parcial D2 aripiprazol, todos os outros agentes antipsicóticos apresentam propriedades antagonistas D2, podendo desencadear o primeiro episódio de surto esquizofrênico, acatisia, risco de discinesia tardia e hiperprolactinemia. As reações distônicas agudas ocorrem nas primeiras horas e nos primeiros dias de tratamento com maior risco entre os pacientes mais jovens, em resposta a diminuições abruptas da neurotransmissão D2 nigroestriatal.
Acatisia
Sensação de tremor muscular, agitação e incapacidade de ficar sentado e parado.
Discinesia
Causa movimentos involuntários repetitivos, como fazer caretas e piscar os olhos.
A distonia normalmente envolve os músculos da cabeça e do pescoço, a língua e, em sua forma mais grave, a crise oculogírica nos músculos extraoculares. Outro efeito adverso que os antipsicóticos podem causar é a hipotensão ortostática mediada pela inibição dos receptores alfa-1 adrenérgicos.
Parkinsonismo semelhante à sua forma idiopática ocorre quando a ocupação estriatal dos receptores D2 excede 78% e, frequentemente, responde à redução da dose ou à troca para um antipsicótico com antagonismo D2 mais fraco. Em situações em que isso não seja possível nem desejável, pode-se usar medicação antiparkinsoniana no controle desses sintomas.
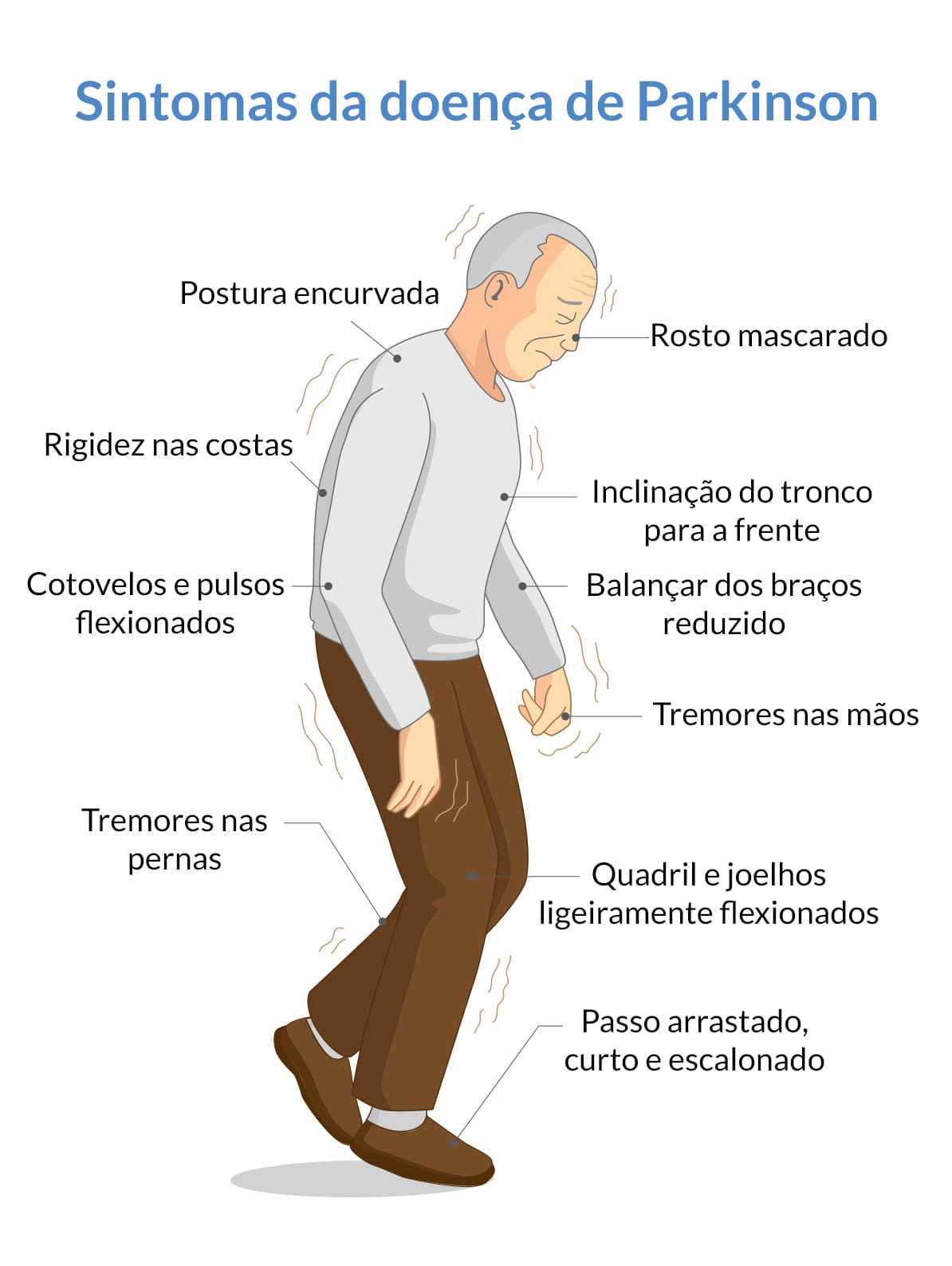
Clinicamente, há desaceleração generalizada e empobrecimento do movimento (bradicinesia) com expressão facial mascarada e movimentos de braço reduzidos durante a caminhada. A síndrome evolui gradualmente ao longo dos dias e das semanas à medida que o risco de distonia aguda diminui.
Os sinais mais perceptíveis são a lentidão dos movimentos e, às vezes, rigidez e tremor variável em repouso, especialmente envolvendo as extremidades superiores. Movimentos como “contar moedas” e outros tipos de tremor de repouso podem ser vistos, embora sejam menos proeminentes na indução de antipsicóticos do que no parkinsonismo idiopático.
A bradicinesia e a expressão facial mascarada podem ser confundidas com depressão clínica. Os pacientes idosos estão em maior risco.
A discinesia tardia é uma situação de aumento da atividade dopaminérgica nigroestriatal como resultado da supersensibilidade do receptor pós-sináptico e da regulação positiva de níveis cronicamente altos de bloqueio D2 pós-sináptico (e possíveis efeitos tóxicos diretos de alta potência dos antagonistas de DA).
A discinesia tardia ocorre com mais frequência em pacientes mais velhos, e o risco pode ser um pouco maior em pacientes com transtornos de humor do que naqueles com esquizofrenia. Sua prevalência é, em média, de 15% a 25% em adultos jovens tratados com agentes antipsicóticos típicos por mais de um ano. A incidência é de 3% a 5% com medicamentos antipsicóticos típicos, com uma taxa anual um pouco menor de remissão espontânea, mesmo com tratamento continuado.
Interações medicamentosas
Os agentes antipsicóticos não são inibidores significativos das enzimas CYP, com algumas exceções notáveis (clorpromazina, perfenazina e tioridazina inibem a CYP2D6). As meias-vidas plasmáticas de vários desses agentes são alteradas pela indução ou inibição das CYPs ou pelos polimorfismos genéticos que alteram as atividades da CYP.
Enquanto drogas antipsicóticas são altamente ligadas às proteínas plasmáticas, não há evidência de deslocamento significativo de outros medicamentos ligados a essas proteínas, portanto o ajuste da dosagem não é necessário para anticonvulsivantes, varfarina ou outros agentes com baixos índices terapêuticos.
Com relação às interações medicamentosas, é importante considerar os efeitos das exposições ambientais (fumo, nutracêuticos, sucos cítricos) e das mudanças nos padrões terapêuticos.
Agora, assista ao vídeo a seguir, que abordará a farmacologia do haloperidol e sua aplicação em psicopatias.
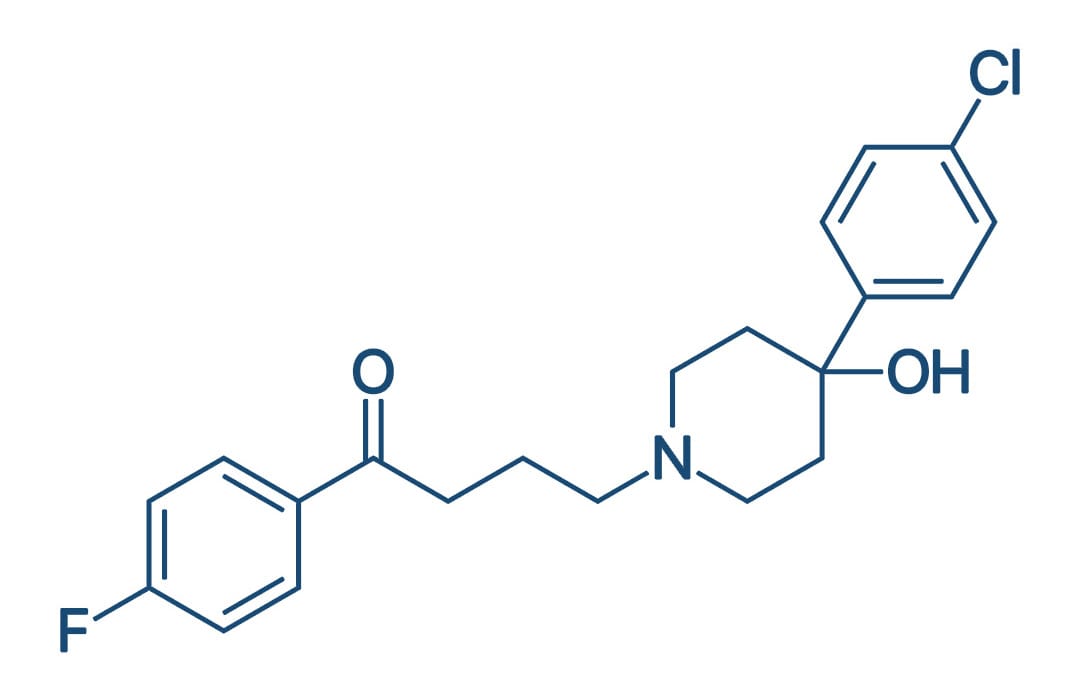
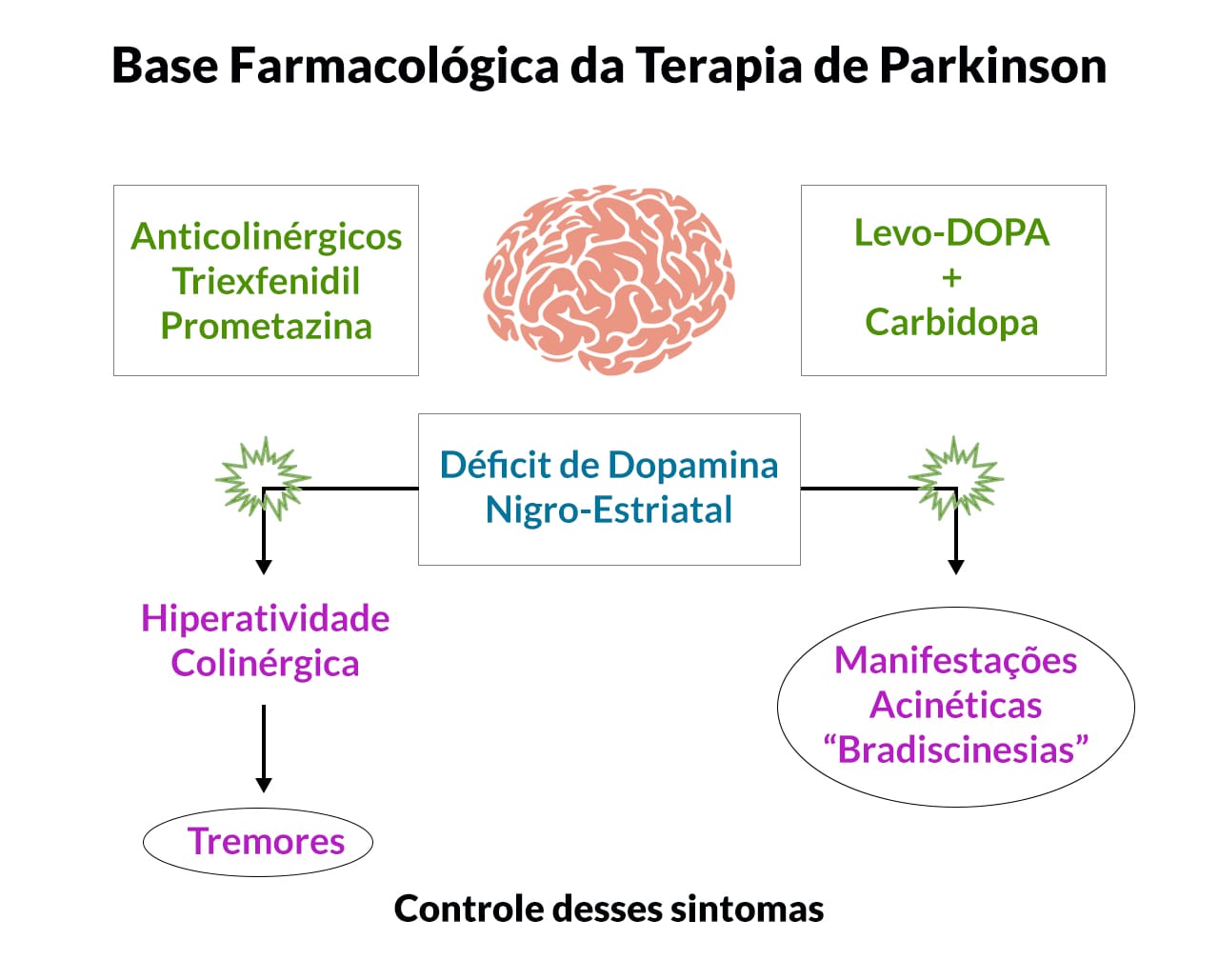
Fármacos antiparkinsonianos
O parkinsonismo é uma síndrome clínica que apresenta quatro características cardeais:
- Bradicinesia (lentidão e pobreza de movimento).
- Rigidez muscular.
- Tremor de repouso (que geralmente diminui durante o movimento voluntário).
- Comprometimento do equilíbrio postural, levando a distúrbios da marcha e quedas.
A forma mais comum de parkinsonismo é a Doença de Parkinson (DP) idiopática, descrita pela primeira vez por James Parkinson em 1817 como paralisia agitans, ou "paralisia agitante". A marca patológica da DP é a perda de neurônios dopaminérgicos da substantia nigra, com o aparecimento de inclusões intracelulares conhecidas como corpos de Lewy.
A perda progressiva de neurônios dopaminérgicos é uma característica do envelhecimento normal. No entanto, pacientes parkinsonianos perdem entre 70% e 80% de neurônios dopaminérgicos necessários para causar os sintomas motores da DP.
Sem tratamento, a DP progride ao longo de 5 a 10 anos a um estado acinético rígido em que os pacientes são incapazes de cuidar de si mesmos. A morte, frequentemente, resulta de complicações de imobilidade, incluindo pneumonia por aspiração ou embolia pulmonar.
A disponibilidade do tratamento farmacológico eficaz alterou radicalmente o prognóstico da DP. Na maioria dos casos, uma boa mobilidade funcional pode ser mantida por muitos anos. A expectativa de vida de pacientes tratados adequadamente aumentou substancialmente, mas a mortalidade permanece mais alta do que a da população em geral.
Saiba mais
Além disso, embora a perda de neurônios dopaminérgicos seja a característica mais proeminente da doença, o distúrbio afeta ampla gama de outras estruturas cerebrais, incluindo o tronco cerebral, o hipocampo e o córtex cerebral. As lesões nessas outras áreas são provavelmente as responsáveis pelas características "não motoras" da DP, que incluem distúrbios do sono, depressão e comprometimento da memória.
Como os tratamentos para as características motoras são eficazes, esses aspectos não motores tornaram-se fontes importantes de abordagem terapêutica para pacientes parkinsonianos.
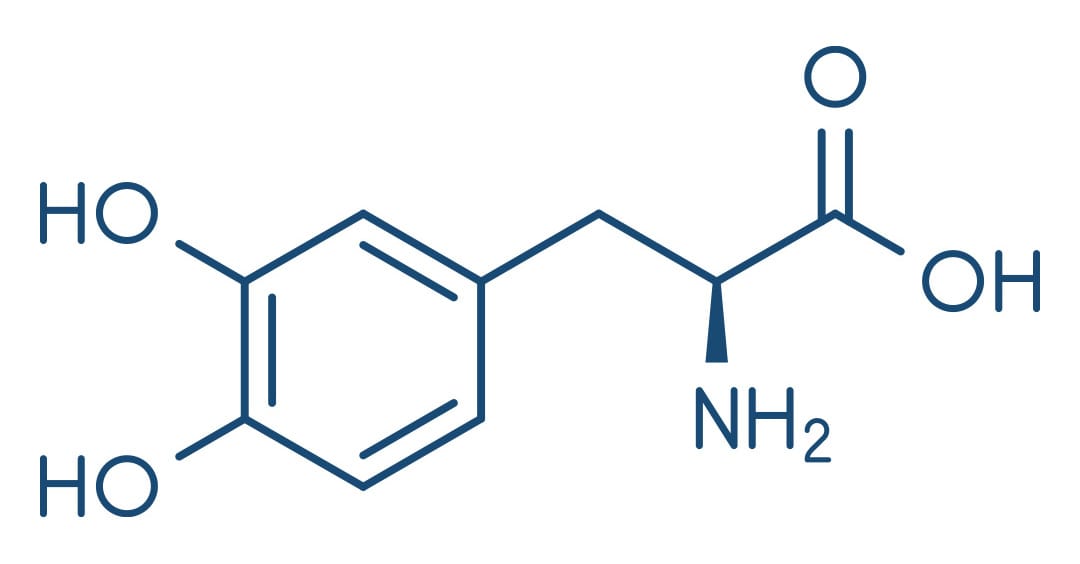
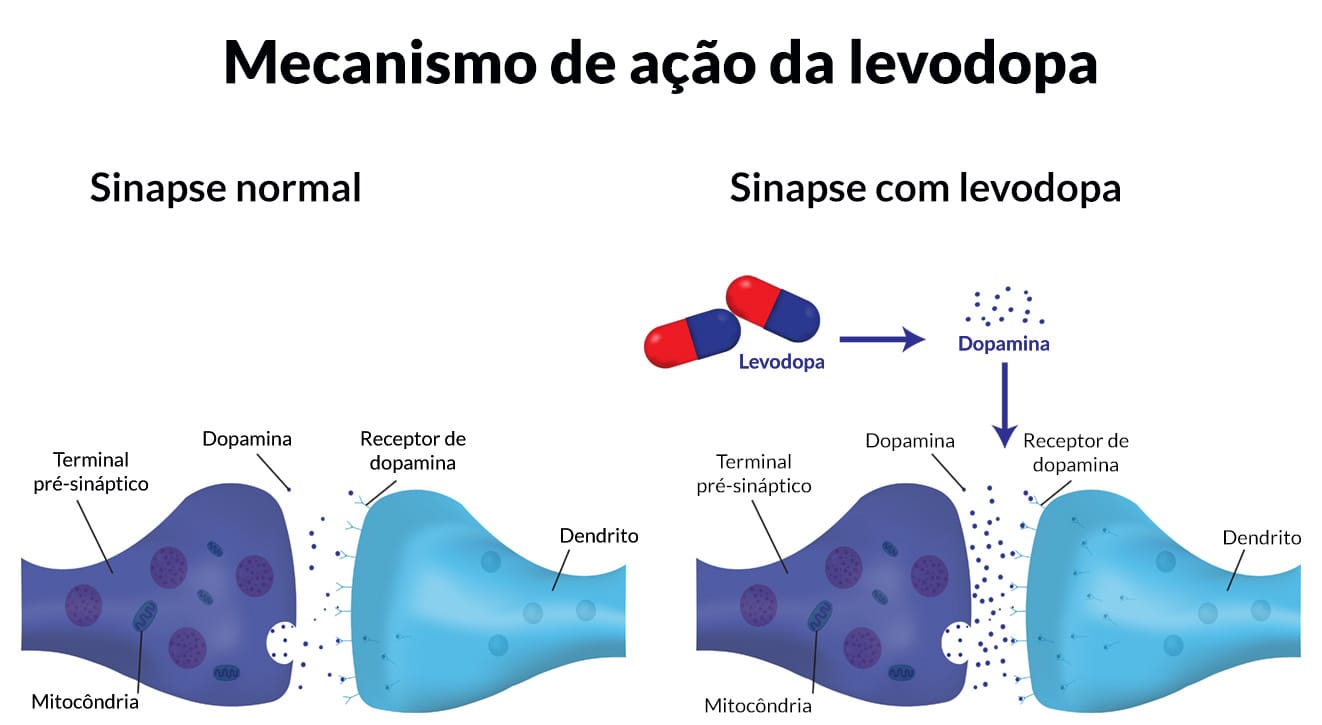
Levodopa
A levodopa (L-DOPA, larodopa, L-3,4-dihidroxifenilalanina), o precursor metabólico de dopamina (DA), é o agente mais eficaz no tratamento da DP. Quando administrada por via oral, a levodopa é absorvida rapidamente pelo intestino delgado.
As concentrações plasmáticas da droga geralmente atingem o pico entre meia e duas horas após uma dose oral, com meia-vida plasmática curta (uma a três horas). A taxa e a extensão da absorção da levodopa dependem da taxa de esvaziamento gástrico, do pH do suco gástrico e do período pelo qual que a droga é exposta às enzimas gástricas e intestinais. A competição por locais de absorção no intestino delgado com aminoácidos da dieta também pode ter um efeito marcante na absorção da levodopa.
A administração de levodopa com refeições ricas em proteínas retarda a absorção e reduz as concentrações plasmáticas máximas. A entrada da droga no SNC através da barreira hematoencefálica também é mediada por um transportador de membrana para aminoácidos aromáticos, sendo que a competição entre a proteína dietética e a levodopa pode também ocorrer nesse nível.
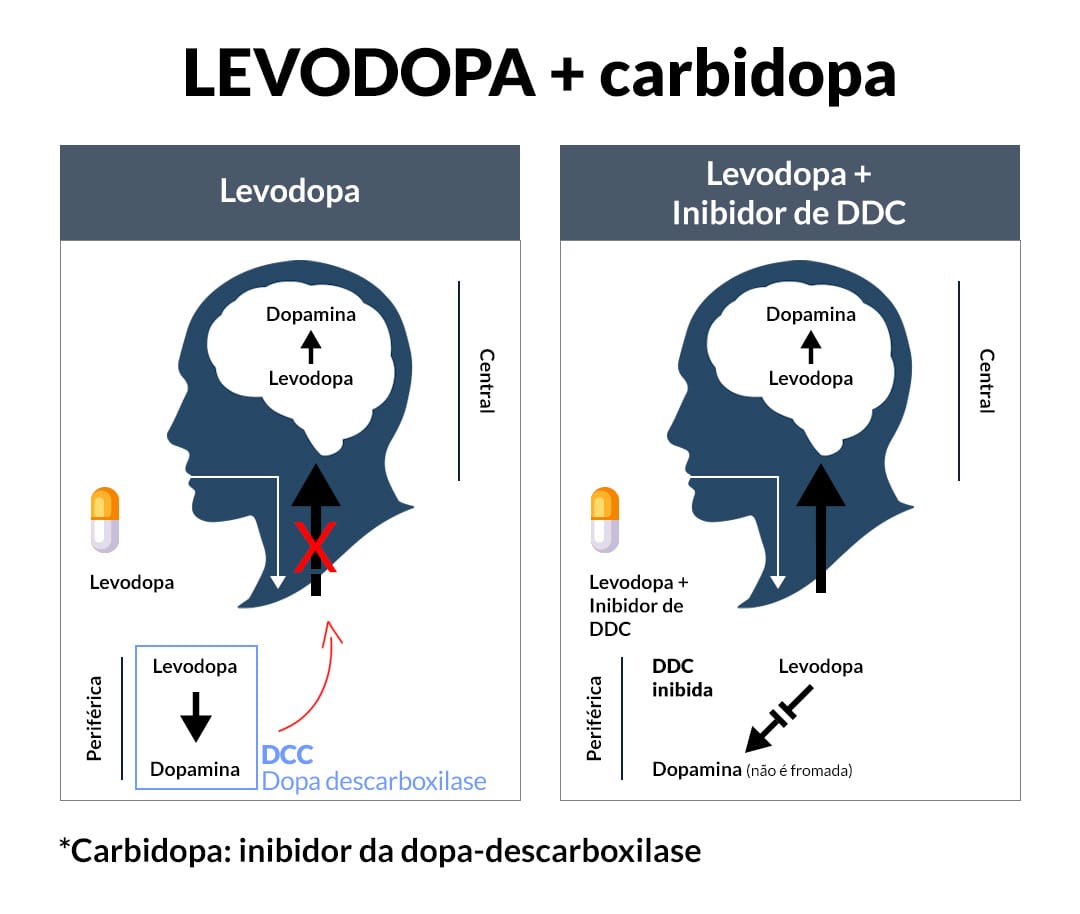
Na prática clínica, a levodopa é quase sempre administrada em combinação com um inibidor da L-aminoácido aromático descarboxilase de ação periférica, tal como carbidopa ou benserazida (conforme veremos mais à frente), drogas que não penetram bem no SNC.
Atenção
Se a levodopa é administrada sozinha, a droga é amplamente descarboxilada por enzimas na mucosa intestinal e em outros locais periféricos, de modo que relativamente pouco medicamento inalterado atinge a circulação cerebral e provavelmente menos de 1% penetra no SNC.
Além disso, a liberação de DA na circulação por conversão periférica de levodopa produz efeitos indesejáveis, particularmente náuseas. A inibição da descarboxilase periférica aumenta significativamente a fração de levodopa administrada que permanece não metabolizada e disponível para atravessar a barreira hematoencefálica.
Mecanismo de ação
No cérebro, a levodopa é convertida em DA por descarboxilação, principalmente nos terminais pré-sinápticos de neurônios dopaminérgicos do estriado. A DA produzida é responsável pela eficácia terapêutica do medicamento no tratamento da DP. Depois, é transportada de volta para os terminais dopaminérgicos pelo mecanismo de captação pré-sináptica ou metabolizada por ações da MAO e catecol-O-metiltransferase (COMT).
Efeitos adversos
A terapia com a levodopa pode ter um efeito dramático sobre todos os sinais e sintomas da DP. No início do curso da doença, a melhora do tremor, da rigidez e da bradicinesia é quase completa. No início da DP, a duração dos efeitos benéficos da levodopa pode exceder o tempo de vida plasmático da droga, sugerindo que o sistema nigroestriatal retém alguma capacidade para armazenar e liberar a DA.
A principal limitação do uso a longo prazo da terapia com a levodopa é que, com o tempo, essa aparente capacidade de "tamponamento" é perdida, e o estado motor do paciente pode flutuar drasticamente entre cada dose da levodopa, uma condição descrita como complicação motora da levodopa.
Um problema comum é o desenvolvimento do fenômeno de “desgaste”: cada dose de levodopa melhora efetivamente a mobilidade por um período de tempo, talvez de uma a duas horas, mas a rigidez e a acinesia retornam rapidamente no fim do intervalo de dosagem. O aumento da dose e a frequência de administração podem melhorar essa situação, mas isso geralmente é limitado pelo desenvolvimento de discinesias, movimentos involuntários excessivos e anormais.
Atenção
As discinesias são observadas mais frequentemente quando a concentração plasmática de levodopa é alta, embora, em alguns indivíduos, as discinesias ou distonias possam ser desencadeadas quando o nível está subindo ou descendo. Esses movimentos podem ser tão desconfortáveis e incapacitantes como a rigidez e acinesia da DP. Nas fases posteriores da DP, os pacientes podem flutuar rapidamente entre estar "desligado", não tendo nenhum benefício dos efeitos de seus medicamentos, e estar "ligado", mas com discinesias incapacitantes, uma situação chamada de fenômeno on/off.
Agonistas do receptor de dopamina
Os agonistas do receptor de DA em uso clínico têm duração de ação mais longa do que a da levodopa. Eles são frequentemente usados no gerenciamento das flutuações no estado motor relacionadas à dose, e podem ser úteis na prevenção de complicações motoras associadas ao desenvolvimento da doença.
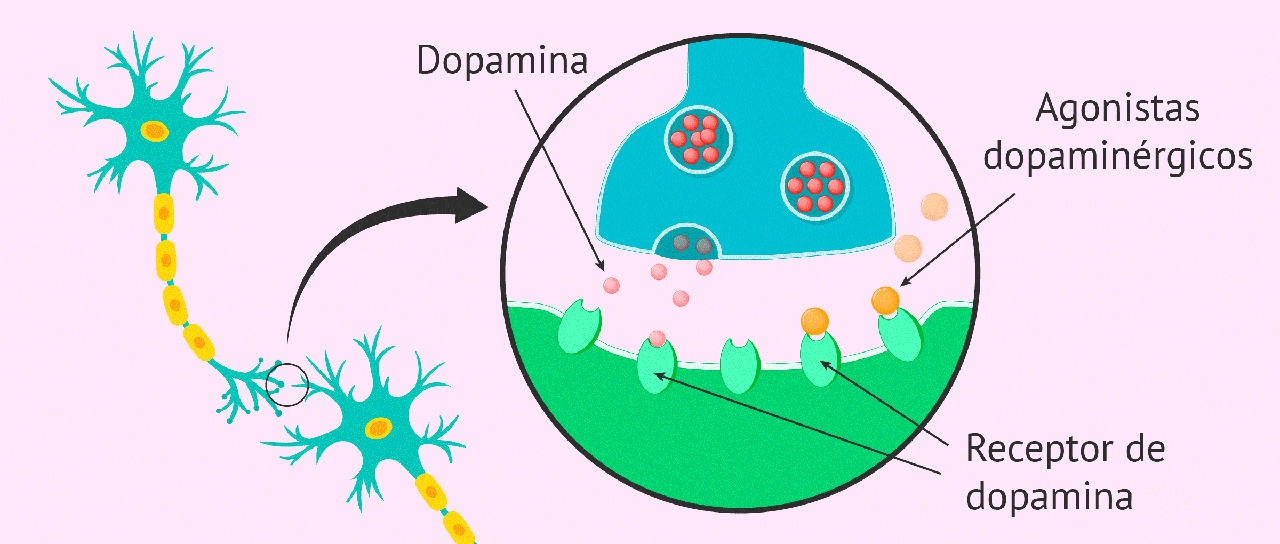
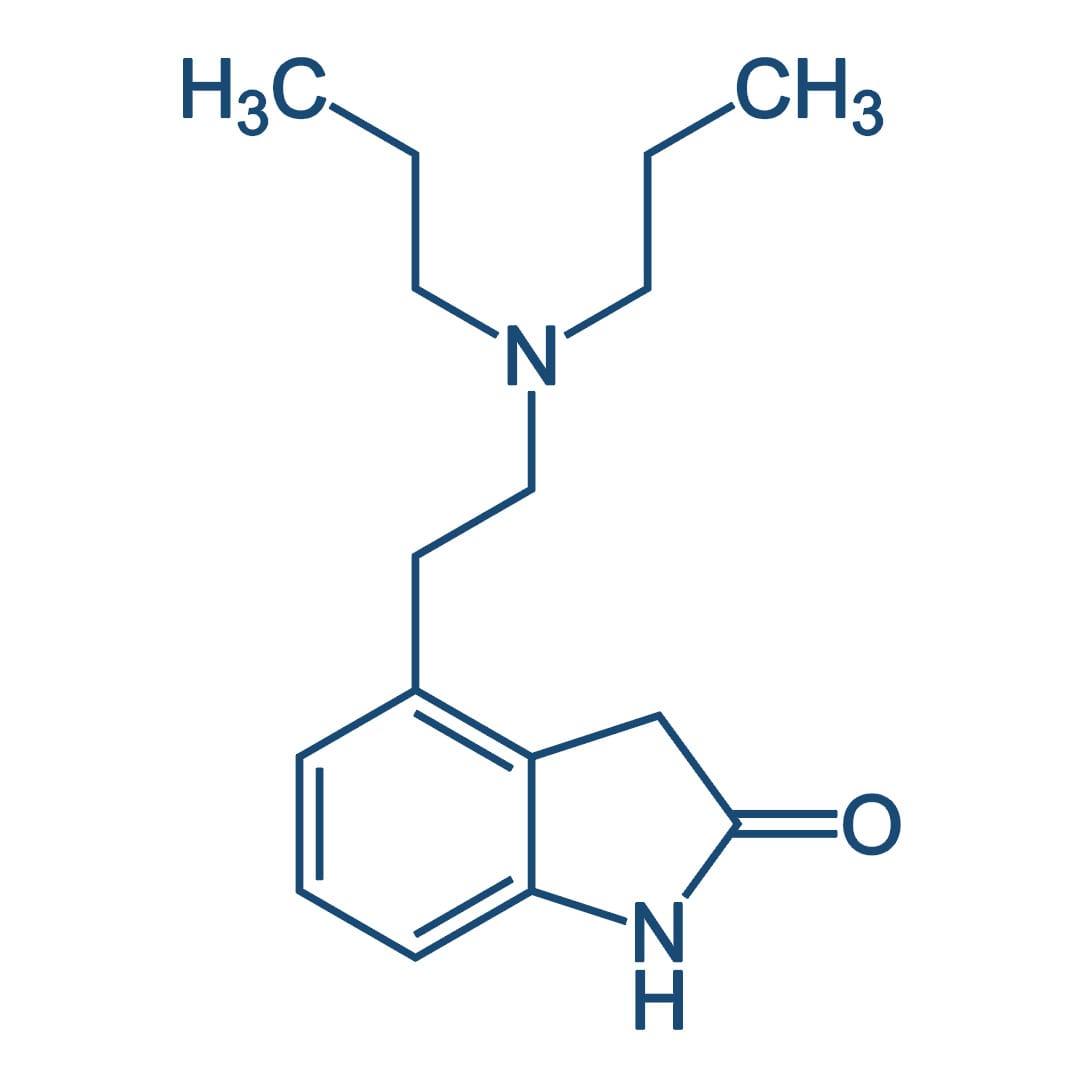
Os agonistas dos receptor de DA são capazes de modificar a progressão da DP, reduzindo a liberação endógena de DA, bem como a necessidade de levodopa exógena, diminuindo, assim, a formação de radicais livres. Os dois agonistas do receptor de DA administrados por via oral e comumente usados no tratamento da DP são: o ropinirol e o pramipexol.
Esses agentes são bem tolerados e substituíram os mais antigos (por exemplo, bromocriptina e pergolida), que devem ser descontinuados mais lentamente. A pergolida foi retirada do mercado americano por induzir fibrose na válvula cardíaca. O ropinirol e o pramipexol têm atividade seletiva nos receptores D2 e pouca ou nenhuma atividade nos receptores D1. Ambos são bem absorvidos por via oral e têm ações terapêuticas semelhantes. Como a levodopa, eles podem aliviar os sintomas clínicos da DP.
A duração da ação dos agonistas dos receptores de DA (8 a 24 horas) geralmente é mais longa do que a da levodopa (seis a oito horas), e esses agentes são particularmente eficazes no tratamento de pacientes que desenvolveram fenômenos on/off. O ropinirol também está disponível em uma formulação de liberação sustentada uma vez ao dia, o que é mais conveniente e pode reduzir os efeitos relacionados à dosagem intermitente.
O pramipexol e o ropinirol podem produzir alucinações ou confusão semelhantes às observadas com a levodopa e causar náuseas e hipotensão ortostática. Devem ser iniciados com uma dose baixa, sofrendo progressão de doses lentamente para minimizar esses efeitos.
Mecanismo de ação
Uma alternativa à levodopa é o uso de drogas que são agonistas diretos da DA no córtex estriado, uma abordagem que oferece várias vantagens potenciais. Uma vez que a conversão enzimática dessas drogas não é necessária para a atividade dos fármacos, eles não dependem das capacidades funcionais dos neurônios nigroestriatais.
Efeitos colaterais
Os agonistas dos receptores de DA, bem como a própria levodopa, são também associados à fadiga e sonolência. A sonolência, em alguns casos, pode ser bastante grave, com ataques repentinos de sonolência irresistível, levando a acidentes com veículos motorizados. Embora seja uma complicação incomum, é prudente aconselhar os pacientes sobre essa possibilidade e mudar para outro agente quando a sonolência for um problema.
Inibidores da catecol-o-metiltransferase (COMT)
Os medicamentos para o tratamento da DP incluem inibidores da enzima COMT, que, junto à MAO, metabolizam a levodopa e a DA. A COMT transfere um grupo metil do doador S-adenosil-L-metionina, produzindo os compostos farmacologicamente inativos 3-O-metil DOPA (de levodopa) e 3-metoxitiramina.
Quando a levodopa é administrada por via oral, quase 99% da droga são metabolizados e não atingem o cérebro. A maioria é convertida pela L-aminoácido aromático descarboxilase (AADC) para DA, o que causa náuseas e hipotensão. A adição de um inibidor da AADC, como a carbidopa, reduz a formação de DA, mas aumenta a fração de levodopa que é metilada pela COMT.
A principal ação terapêutica dos inibidores da COMT é bloquear essa conversão periférica de levodopa para 3-O-metil DOPA, aumentando tanto a meia-vida de levodopa como a fração de cada dose que atinge o SNC.
Inibidores seletivos da MAO-B (IMAO-B)
Os inibidores seletivos da MAO-B já foram discutidos no primeiro módulo, porém vamos abordar aqui sua utilização no tratamento da doença de Parkinson. Os IMAO-B são representados por inibidores de duas isoenzimas de MAO. Embora ambas as isoenzimas (MAO-A e MAO-B) estejam presentes na periferia e inativem monoaminas de origem intestinal, a isoenzima MAO-B é a forma predominante no córtex estriado e é responsável pela maior parte do metabolismo oxidativo da DA no cérebro.
Dois inibidores seletivos da MAO-B são usados para o tratamento da DP: selegilina e rasagilina. Quando usados nas doses recomendadas, esses agentes inativam seletivamente a MAO-B por meio da inibição irreversível dessa enzima. Ambos os agentes exercem efeitos modestos sobre os sintomas da DP. Presume-se que a base dessa eficácia seja a inibição da degradação de DA no estriado.
Ao contrário dos inibidores não específicos de MAO (como fenelzina, tranilcipromina e isocarboxazida), os inibidores seletivos da MAO-B não inibem substancialmente o metabolismo periférico das catecolaminas e podem ser associados com segurança à levodopa.
Antagonistas do receptor muscarínico
Antagonistas de receptores muscarínicos de acetilcolina foram amplamente utilizados para o tratamento da DP antes da descoberta da levodopa. A base biológica para as ações terapêuticas dos anticolinérgicos não é completamente compreendida. Eles podem agir em receptores localizados na região do cérebro específica do controle motor associado a vias colinérgicas, o córtex estriado.
Os receptores muscarínicos colinérgicos são metabotrópicos, sendo cinco subtipos de receptores muscarínicos (M1, M2, M3, M4 e M5). Todos eles estão provavelmente presentes no estriado, embora cada um tenha uma distinta distribuição. Os medicamentos anticolinérgicos atualmente usados no tratamento da DP incluem trihexifenidil, prometazina, benztropina e cloridrato de difenidramina.
A difenidramina também é um antagonista H1 da histamina. Todas essas drogas têm um efeito modesto na atividade antiparkinsoniana e são usadas apenas no tratamento da DP inicial ou como adjuvantes à terapia dopamimética. Os efeitos adversos resultam de suas propriedades anticolinérgicas. Os maiores efeitos adversos centrais são: sedação e confusão mental. Outros efeitos colaterais são: constipação, retenção urinária, visão turva e cicloplegia.
Amantadina
A amantadina é um agente antiviral usado para profilaxia e tratamento de influenza A que apresenta atividade antiparkinsoniana. A amantadina parece alterar a liberação de DA no estriado, tem propriedades anticolinérgicas e bloqueia os receptores NMDA de glutamato. No entanto, não se sabe quais dos efeitos farmacológicos da amantadina são responsáveis por suas ações antiparkinsonianas.
Em qualquer caso, os efeitos da amantadina na DP são modestos. É usada como terapia inicial de DP leve. Também pode ser útil como adjuvante em pacientes com flutuações motoras e discinesias relacionadas à dose de levodopa. As propriedades antidiscinéticas da amantadina foram atribuídas a ações nos receptores NMDA, embora a memantina (antagonista do receptor NMDA) não pareça ter esse efeito. Como efeito adverso, a amantadina pode induzir crises convulsivas.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear a conclusão, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
As combinações de drogas de ação central são frequentemente administradas buscando uma vantagem terapêutica (por exemplo, uma droga anticolinérgica e levodopa para doença de Parkinson). No entanto, outras combinações de drogas podem ser prejudiciais por causa de aditivo potencialmente perigoso ou efeitos mutuamente antagônicos.
Os efeitos de um medicamento no SNC podem ser aditivos com o estado fisiológico e os efeitos de outras drogas depressoras e estimulantes. Por exemplo, os ansiolíticos são menos eficazes em um sujeito hiperexcitável do que em um paciente normal; o inverso é verdadeiro para estimulantes.
Em geral, os efeitos depressores das drogas de diferentes categorias são aditivos (por exemplo, a combinação potencialmente fatal de barbitúricos ou benzodiazepínicos com etanol), assim como os efeitos de estimulantes proporcionados por essas drogas.
Neste tema, pudemos conhecer a ação dos principais grupos de fármacos que agem no sistema nervoso central, bem como compreender suas principais ações, suas interações medicamentosas, seus mecanismos de ação e, principalmente, suas utilizações clínicas no tratamento de diversas neuropatias.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu os mecanismos básicos que envolvem a depressão, a ansiedade e a farmacologia dos ansiolíticos e antidepressivos
Reconheceu os fármacos que agem no controle das crises convulsivas, seus mecanismos de ação, efeitos adversos e suas interações medicamentosas
Identificou fármacos antipsicóticos e antiparkinsonianos, enfatizando seus efeitos farmacológicos e suas utilizações terapêuticas de acordo com suas particularidades clínicas