Descrição
Aspectos históricos, estrutura, nomenclatura e propriedades do benzeno e aromaticidade. A regra de Hückel e energia de ressonância. O fenômeno da hiperconjugação. Reações de substituição eletrofílica aromática: sulfonação, halogenação, nitração e reação de Friedel-Crafts. Efeitos de orientação em SEAr e de múltiplos substituintes.
PROPÓSITO
Conhecer o benzeno e os compostos orgânicos aromáticos, suas propriedades físico-químicas, nomenclatura e reatividade para a compreensão das reações de substituição eletrofílica aromática, importantes processos em síntese orgânica, especialmente para síntese de fármacos e seus intermediários.
Preparação
Antes de iniciar o conteúdo deste tema, tenha em mãos uma tabela periódica para entender termos específicos da área.
OBJETIVOS
Módulo 1
Compreender o conceito de aromaticidade, bem como a estrutura, a estabilidade, as propriedades físicas e a nomenclatura de arenos, do benzeno e de seus derivados
Módulo 2
Reconhecer os princípios mecanísticos das principais reações de substituição eletrofílica em aromáticos (SEAr) do benzeno: nitração, sulfonação e halogenação
Módulo 3
Reconhecer os princípios mecanísticos da síntese de alquilbenzenos por acilação-redução e o efeito dos substituintes na reatividade de compostos aromáticos substituídos
Módulo 4
Descrever o efeito dos substituintes na regiosseletividade das sínteses de compostos aromáticos com múltiplos substituintes
Introdução
O estudo da química orgânica e da reatividade dos compostos orgânicos é essencial para o entendimento dos processos da vida. Os compostos orgânicos estão presentes no nosso dia a dia e vão desde os combustíveis que utilizamos, como a gasolina e o etanol, a todos os alimentos e derivados, o plástico, a celulose do papel, o nosso DNA – que traz toda a nossa essência genética –, e o fármacos. A maioria dos fármacos que atuam em alguma etapa dos processos de diagnóstico, tratamento ou cura das patologias são compostos orgânicos.
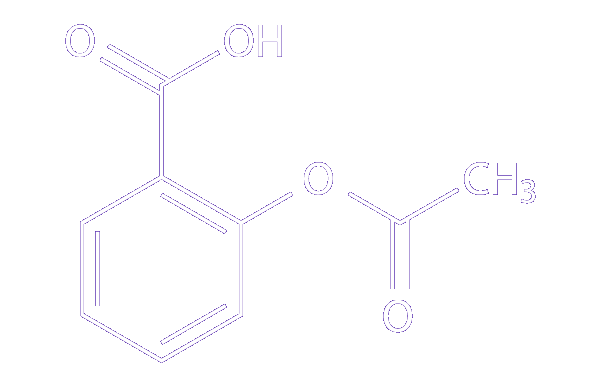
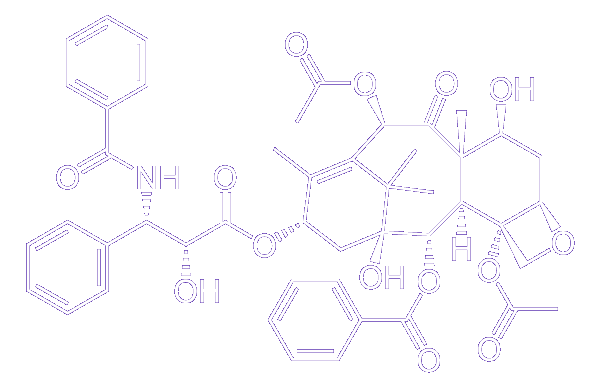
Os compostos aromáticos e suas reações são fundamentais na síntese de fármacos, e aqui destacamos desde moléculas simples, como o ácido acetilsalicílico (AAS), até estruturas mais complexas, como o taxol (paclitaxel), utilizado no tratamento contra o câncer. O estudo da síntese orgânica é bastante vasto e complexo, mas precisamos buscar o entendimento de reações altamente versáteis e funcionais, como as substituições eletrofílicas aromáticas, tão empregadas nos processos de obtenção de fármacos.
MÓDULO 1
Compreender o conceito de aromaticidade, bem como a estrutura, a estabilidade, as propriedades físicas e a nomenclatura de arenos, do benzeno e de seus derivados
O benzeno e a aromaticidade
Os compostos aromáticos participam de várias aplicações na área farmacêutica, alimentícia, química, entre outros, servindo como matéria-prima na fabricação de diversos produtos. Por exemplo, o tolueno é muito usado como solvente em vernizes, tintas, adesivos, borrachas e resinas.
É muito comum, quando falamos em aromáticos, já pensarmos no benzeno, mas para um composto ser um aromático ele precisa, necessariamente, ter estrutura semelhante à do benzeno?
De fato, o estudo dos aromáticos se iniciou com a identificação do benzeno, um resíduo oleoso encontrado nos tanques de gás comprimido da iluminação pública de Londres, descoberta realizada em 1825 por Michael Faraday.
(BARBOSA, 2006.)
A classificação “aromáticos” vem, de longa data, do cheiro de substâncias isoladas de resinas de plantas. Hoje, no entanto, refere-se a um grupo de compostos que vão além do benzeno, trazendo determinadas características que estudaremos a seguir.
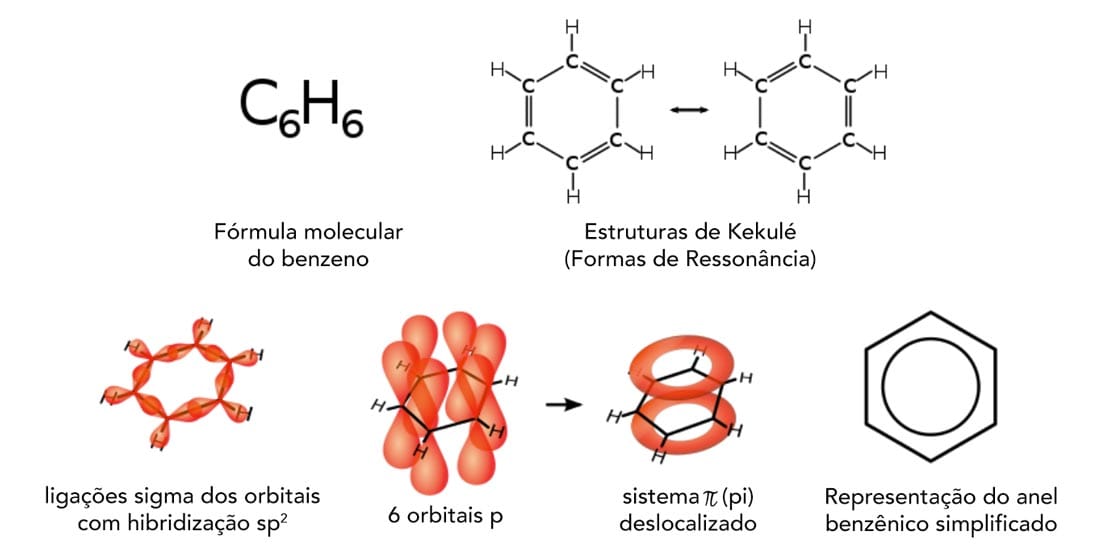
O benzeno é um dos aromáticos mais simples, formado apenas por C e H, com fórmula molecular C6H6. A fórmula estrutural do benzeno foi proposta por Friedrich August Kekulé, em 1865, de forma que os seis átomos de carbono estivessem ligados formando um anel com ligações duplas e simples alternadas. Completando a valência, cada carbono estaria ligado a um hidrogênio.
Kekulé, ao continuar os estudos sobre o benzeno, identificou que todas as ligações C–C tinham o mesmo comprimento (140 pm), comprimento intermediário entre uma ligação simples C–C (153 pm) e uma ligação dupla C=C (134 pm), além disso foi identificado que os elétrons no benzeno estavam deslocalizados, e não localizados na dupla ligação, como ocorre com os alcenos.
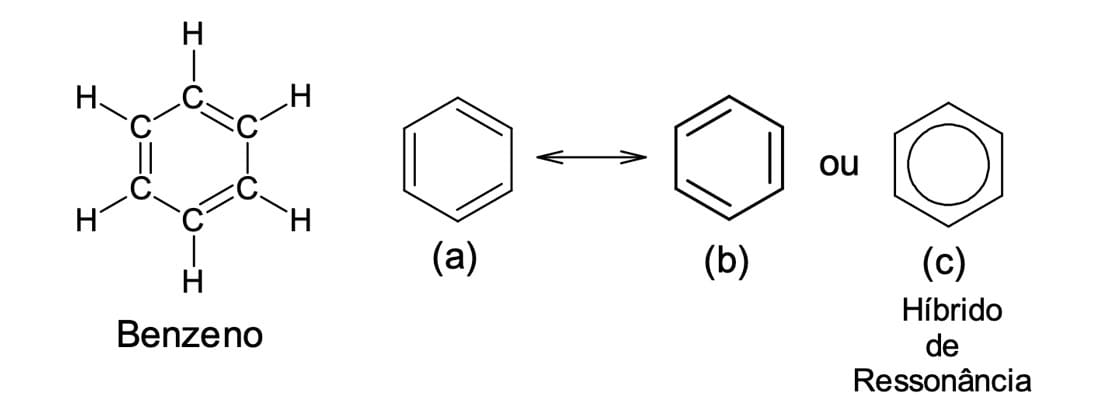
Dessa forma, a estrutura do benzeno (figura 1) pode ser representada com as duplas ligações entre diferentes posições (estruturas a e b) ou pela estrutura c, com o círculo representando os seis elétrons π deslocalizados.
A estrutura do benzeno é plana, isso porque os seis átomos de carbono apresentam hibridização sp2, o que gera ângulos de 120° – exatamente a angulação de um hexágono planar. Cada um dos carbonos do benzeno utiliza os orbitais sp2 para a ligação C–C e o orbital s para a ligação com o hidrogênio, e ainda possui um orbital p em ângulo reto ao orbital sp2.
Os seis orbitais p dos carbonos estão próximos e se sobrepõem, formando duas nuvens contínuas de elétrons, acima e abaixo do plano do anel, como pode ser observado na figura 2.
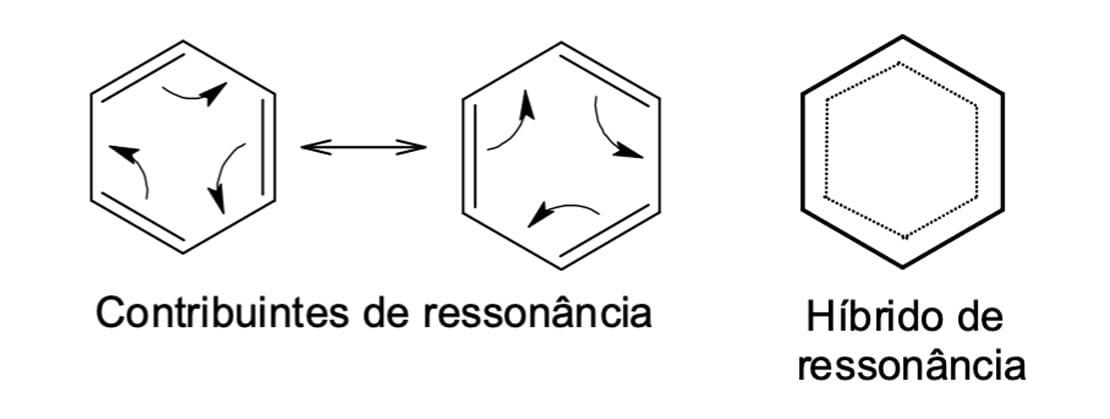
Note que a estrutura do benzeno pode ser representada por duas moléculas que se diferenciam apenas pela posição dos elétrons π. Porém, nenhuma delas é a representação exata do benzeno e por isso são chamadas de estruturas ou contribuintes de ressonância (figura 3). Nesses casos, a melhor representação estrutural da molécula é por meio de um híbrido de ressonância.
No estudo das estruturas de ressonância, utilizamos as setas que demonstram o movimento dos elétrons e facilitam o entendimento do híbrido de ressonância com a deslocalização eletrônica. Isso pode ser evidenciado não só para o benzeno, mas para muitos outros compostos que possuem elétrons deslocalizados.
Atenção
Além das setas que indicam a movimentação dos elétrons precisamos ficar atentos para não confundirmos as setas que indicam ressonância com as que indicam o equilíbrio de uma reação:

Normalmente utilizamos a representação dos contribuintes de ressonância nos estudos de mecanismos de reação para tornar mais fácil o entendimento das quebras e formações de ligação. No entanto, as estruturas de ressonância não contribuem sempre igualmente. Observe os exemplos da figura 4.
No caso do íon acetato as duas estruturas de ressonância são energeticamente equivalentes e contribuem igualmente para o híbrido de ressonância. Mas no caso do dieno, as estruturas de ressonância que geram cargas no carbono são energeticamente desfavoráveis. Isso porque nessas estruturas encontramos uma separação de cargas (um dos carbonos fica positivo e o outro, negativo), fazendo com que a estrutura central do dieno seja a mais favorecida (mais estável) e aquela que mais contribui para o híbrido de ressonância.
Em outras palavras, podemos afirmar que a maior parte do tempo esse composto se apresentará na forma do 1,3-butadieno, com as duas duplas ligações gerando uma espécie neutra.
Uma substância com elétrons deslocalizados é mais estável do que com os elétrons localizados.
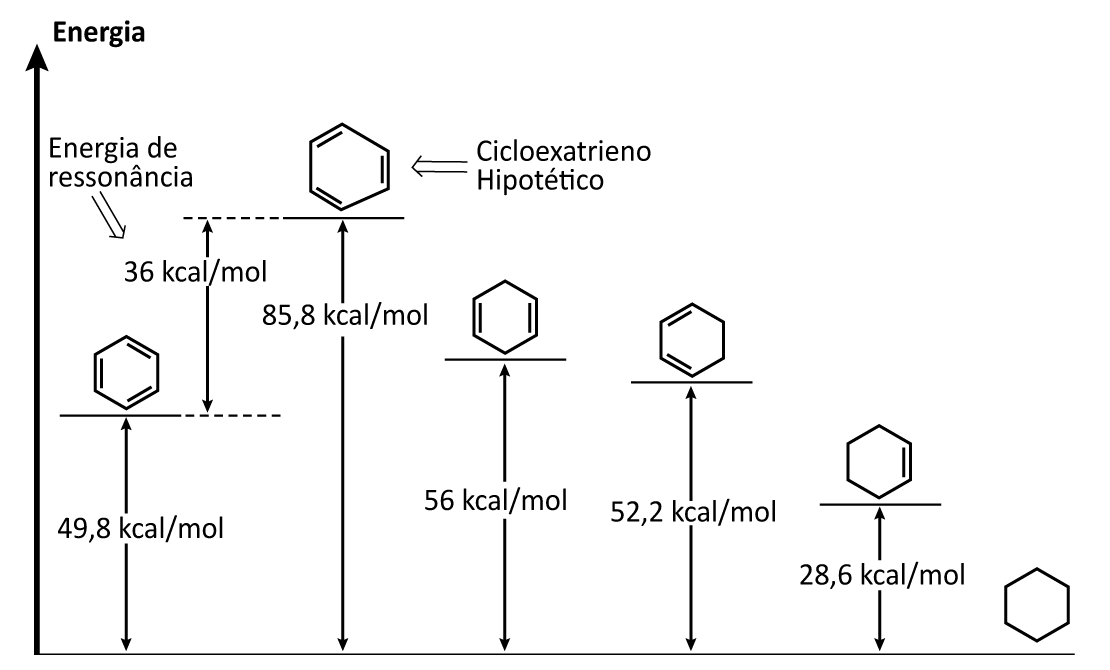
Para entendermos melhor a estabilidade e a reatividade do benzeno, precisamos, primeiramente, compreender que todos os carbonos são igualmente reativos. Vamos comparar o benzeno com o hipotético ciclohexatrieno, a diferença entre os dois compostos está exatamente no fato de que o primeiro apresenta todos os elétrons π deslocalizados, e o segundo, os elétrons teoricamente localizados.
Estudos da energia potencial desses compostos frente a uma reação de hidrogenação total para a formação do ciclohexano demonstraram que o ciclohexatrieno necessitaria de 85,8kcal/mol, enquanto o benzeno, de 49,8 kcal/mol, ou seja, o benzeno necessita de menos energia para realizar a reação (menos 36 kcal/mol do que o ciclohexatrieno). Isso nos mostra que o benzeno tem uma estrutura mais estável do que a do ciclohexatrieno.
Essa diferença entre a quantidade de energia realmente liberada e aquela que seria liberada com base na proposta estrutural de Kekulé é denominada energia de ressonância ou energia de deslocalização. A figura 5 mostra a energia de ressonância do benzeno.
Comentário
Podemos concluir que a energia de ressonância expressa a estabilidade extra que os compostos aromáticos apresentam. E o híbrido de ressonância – que expressa a deslocalização dos elétrons – é a estrutura que representa a forma mais estável do que qualquer uma das estruturas de ressonância isoladamente.
Em geral, quanto maior o número de estruturas de ressonância para um composto, mais estável ele será, porém devemos considerar a existência de estruturas de ressonância estáveis. Volte a observar a figura 4, que representa a ressonância do ânion acetato e do 1,3-butadieno. O ânion acetato tem duas estruturas de ressonância, mas igualmente estáveis. Já o 1,3-butadieno possui três estruturas de ressonância, mas duas delas pouco estáveis devido à polarização gerada nos carbonos.
Figura 4
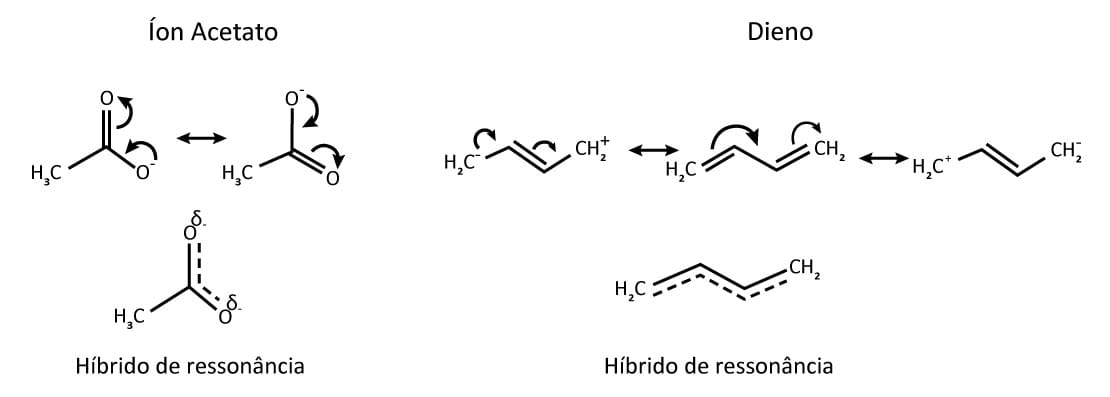
A energia de ressonância é tanto maior quanto mais equivalente forem as estruturas de ressonância. Assim, apesar de o acetato ter apenas duas estruturas de ressonância, estas são equivalentes, tornando-o mais estável do que o 1,3-butadieno, que possui três estruturas de ressonância, mas não equivalentes.
Compostos aromáticos e a regra de Hückel
Agora que entendemos que a estabilidade do benzeno vem da sua energia de ressonância, vamos estudar melhor as características dos compostos aromáticos.
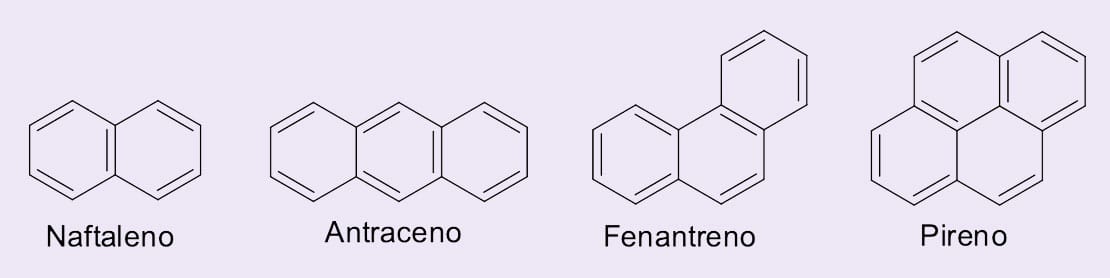
O benzeno foi o primeiro composto dessa classe a ser identificado e estudado. Por isso estruturas que contêm o anel benzênico são classificadas como aromáticos, como os benzenoides policíclicos representados na figura 6. Vale destacar que existem compostos aromáticos não benzênicos.
Aromáticos
Muitos derivados do benzeno foram obtidos a partir de bálsamos de origem vegetal. Por causa dos seus odores agradáveis, esses compostos foram denominados aromáticos. Mesmo com a descoberta de outras substâncias – inodoras –derivadas do benzeno, o termo “aromático” ainda é utilizado para descrever essa classe de compostos.
Compostos aromáticos, em geral, são cíclicos e possuem elétrons π deslocalizados, formando nuvens de elétrons ininterruptas (representadas na figura 2), o que lhes confere um grau maior de estabilidade, assim como já visto para o benzeno. Além dessas características, para ser considerado aromático, o composto deve seguir um padrão de número de elétrons π conjugados denominado regra de Hückel ou 4n + 2.
Segundo a regra de Hückel, um composto só pode ser considerado aromático se:
- o número de elétrons π conjugados no anel for par (2 ou 6 ou 10 etc.). Podemos também pensar esse padrão em termos de pares de elétrons π conjugados. Nesse caso, um composto cíclico com ligações π alternadas é considerado aromático se tiver número ímpar de par de elétrons;
- na série numérica de elétrons π conjugados, expressa por 4n + 2, n for um número inteiro;
-
ele for uma molécula planar, com nuvem ininterrupta de elétrons π deslocalizados. O benzeno, por exemplo,
apresenta três ligações π (três pares de elétrons π) e, consequentemente, contém seis elétrons π conjugados.
Se quisermos confirmar se o benzeno é realmente um composto aromático, podemos calcular
n: se n for um número inteiro, então o composto é aromático.
Para o benzeno
Substituindo π da equação pelo número de elétrons π do benzeno, temos:
Além disso, o benzeno é uma molécula planar com nuvem ininterrupta de elétrons π deslocalizados. Logo, podemos afirmar que o benzeno é um composto aromático.
Mas e os sistemas monocíclicos, com ligações duplas conjugadas que não seguem os requisitos da regra de Hückel? Como podem ser classificados?
Independentemente de serem aromáticos ou não, esses compostos são classificados como anulenos. Os anulenos que não apresentam aromaticidade podem ser denominados antiaromáticos ou não aromáticos. Entenda a diferença entre eles:
Anulenos
São hidrocarbonetos monocíclicos que apresentam ligações duplas conjugadas.
Não aromáticos
São anulenos que não apresentam a estabilidade extra conferida pela aromaticidade. Isso quer dizer que, quando comparados a seus congêneres, não mostram diferenças significativas em relação à estabilidade – têm propriedades de alcenos.
Antiaromáticos
São menos estáveis que os seus análogos estruturais e por isso são mais reativos.
OS ANULENOS E A REGRAS DE HÜCKEL PARA AROMATICIDADE
Assista ao vídeo em que a especialista explica o que são os anulenos, sua nomenclatura e os critérios para que um anuleno seja considerado um composto aromático.
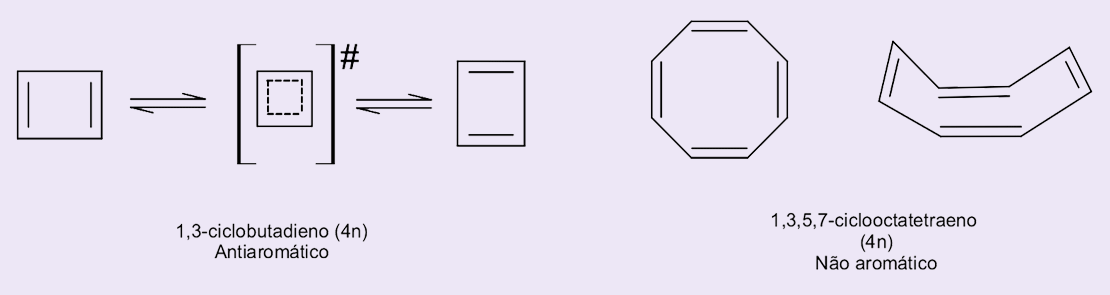
Vamos analisar os compostos 1,3-ciclobutadieno e 1,3,5,7-ciclooctatetraeno.
O 1,3-ciclobutadieno é um polieno simples, mas extremamente instável, sendo muito mais reativo do que os seus análogos ciclobuteno e 1,3-butadieno.
O 1,3-ciclobutadieno não é simétrico e é formado por duas ligações simples C-C e duas ligações duplas C=C.
Saiba mais
Dessa forma, o 1,3-ciclobutadieno não apresenta estruturas de ressonância, mas sim dois isômeros em estado de equilíbrio. Possui quatro elétrons π e, em vez de atender a regra de Hückel (4n + 2), o número de elétrons π é 4n, onde n é um número inteiro. Devido a sua instabilidade, é classificado como um composto antiaromático.
O 1,3,5,7-ciclooctatetraeno é um polieno cíclico que também é 4n, possui oito elétrons π, mas apresenta as características físico-químicas de um alceno, ângulos de ligação próximos a 120° e estrutura não planar. Além disso, as ligações duplas não se conjugam e estão em posição quase perpendicular umas às outras, o que lhe fornece a classificação de composto não aromático (figura 7).
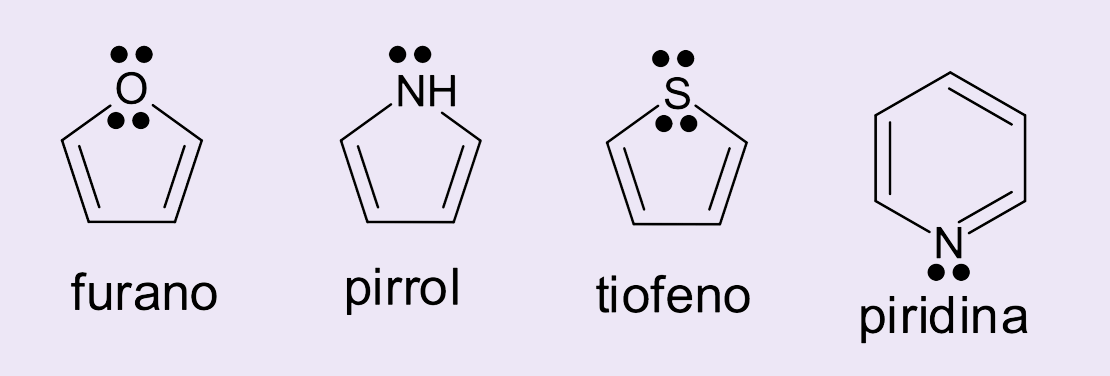
Apenas os polienos cíclicos conjugados que atendem a fórmula 4n + 2 serão aromáticos. Eles podem ser hidrocarbonetos (formados apenas por átomos carbono e hidrogênio) ou podem possuir heteroátomos (como, por exemplo, átomos de nitrogênio, oxigênio e enxofre) na cadeia cíclica.
Nos casos apresentados na figura 8, os pares de elétrons do heteroátomo podem completar os seis elétrons π em ressonância necessários para que esses compostos sejam considerados aromáticos. Além disso, mantêm as principais características estruturais dos aromáticos: energia de estabilização elevada pela ocorrência da ressonância, elétrons π deslocalizados e estrutura planar.
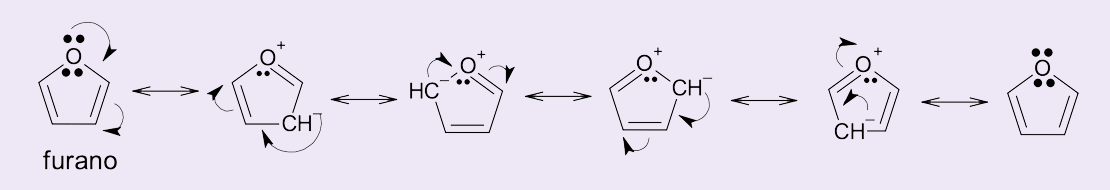
Nas moléculas do furano, pirrol e tiofeno o par de elétrons π do heteroátomo participa da ressonância da molécula, como exemplificado na figura 9.
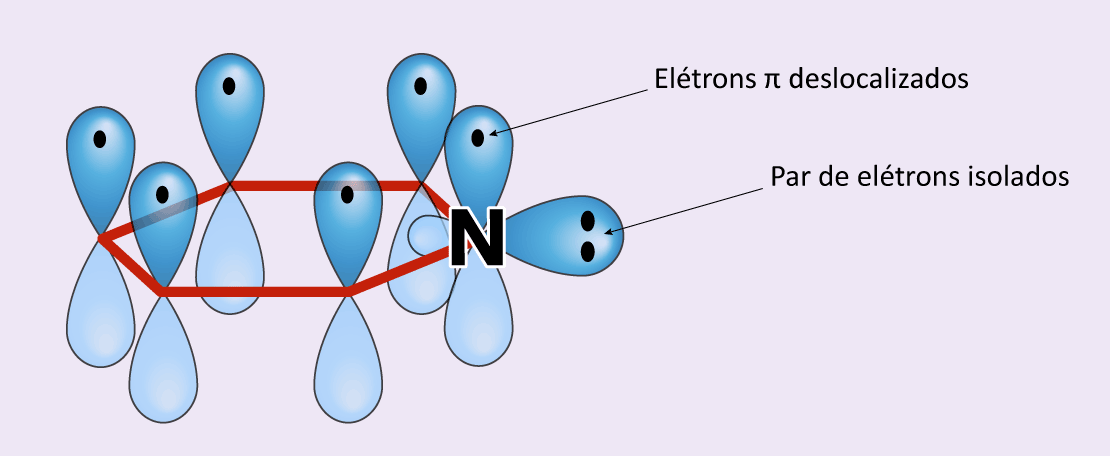
Porém, no caso da piridina, o par de elétrons isolados do nitrogênio está em um orbital fora do plano em que se encontram os elétrons π deslocalizados (figura 10). Por isso, eles não podem ser contabilizados no cálculo da regra de Hückel. Ainda assim, trata-se de um composto aromático, já que o anel possui seis elétrons π em ressonância.
Outros exemplos importantes de compostos aromáticos são:
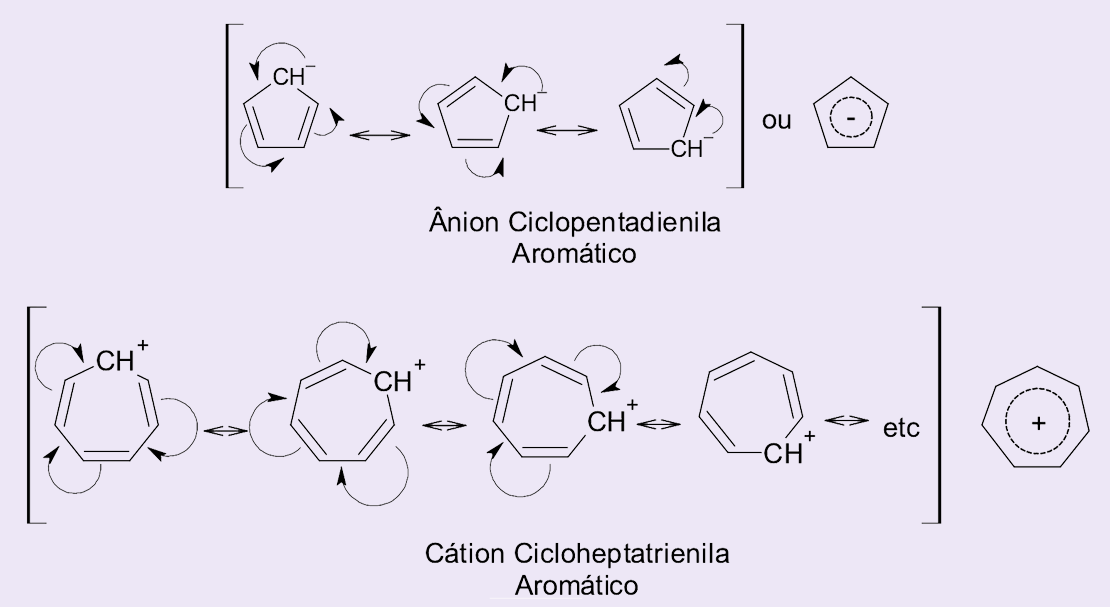
Moléculas com carga que seguem a regra de Hückel, como é o caso do ânion ciclopentadienila e do cátion cicloheptatrienila (íon tropílio).
Observe nas estruturas de ressonância apresentadas na figura 11 que o ânion ciclopentadienila possui seis elétrons π deslocalizados, em ressonância, sendo uma molécula planar, estável e por isso classificada como aromática. Já o cátion cicloheptatrienila, devido ao orbital vazio presente no carbocátion, permite que os seis elétrons π também estejam em ressonância, deslocalizados, gerando estabilidade adicional à molécula e caracterizando, assim, a aromaticidade do composto.
Atenção
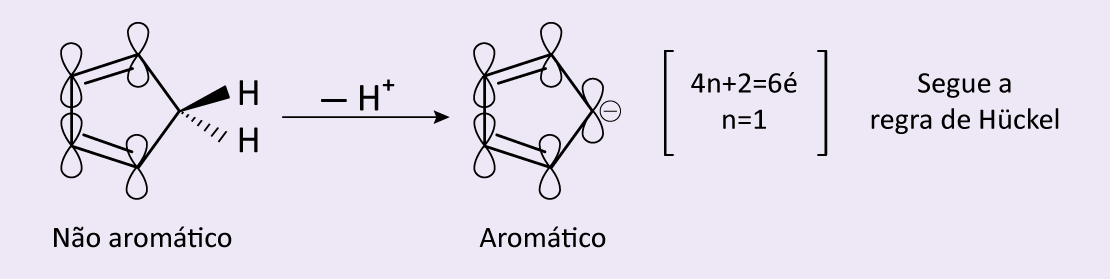
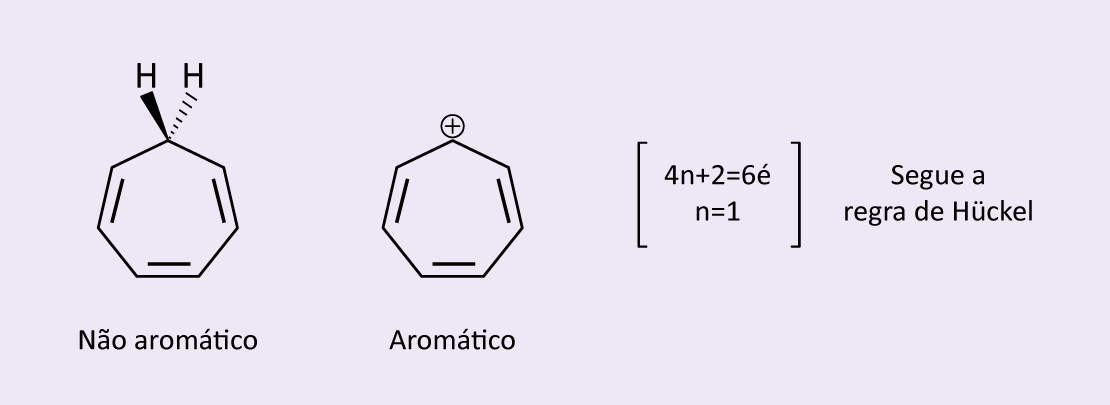
Ainda que os íons ciclopentadienila e cicloheptatrienila sejam aromáticos, seus análogos neutros, os compostos ciclopentadieno e cicloheptatrieno, não apresentam aromaticidade (figuras 12 e 13).
NOMENCLATURA DOS AROMÁTICOS DERIVADOS DE BENZENO
O nome benzeno vem de ácido benzoico, composto obtido de uma resina da árvore styrax benzoin, nativa de Java e Sumatra. O composto também já recebeu os nomes de benzina e benzol. O benzeno foi obtido pelos químicos Peligot (1833) e Mitscherlich (1834) a partir da reação do ácido benzoico com óxido de cálcio (BARBOSA, 2006).
Muitos dos compostos aromáticos são derivados do benzeno, sejam benzenos substituídos ou mesmo polibenzênicos. Para os compostos benzênicos a nomenclatura é obtida considerando a posição do substituinte e o prefixo do substituinte + benzeno.
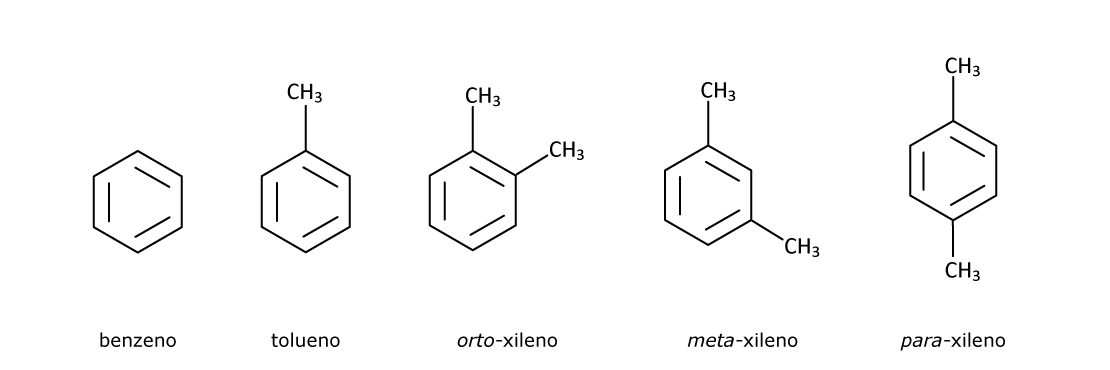
Veja alguns exemplos de benzenos monossubstituído:
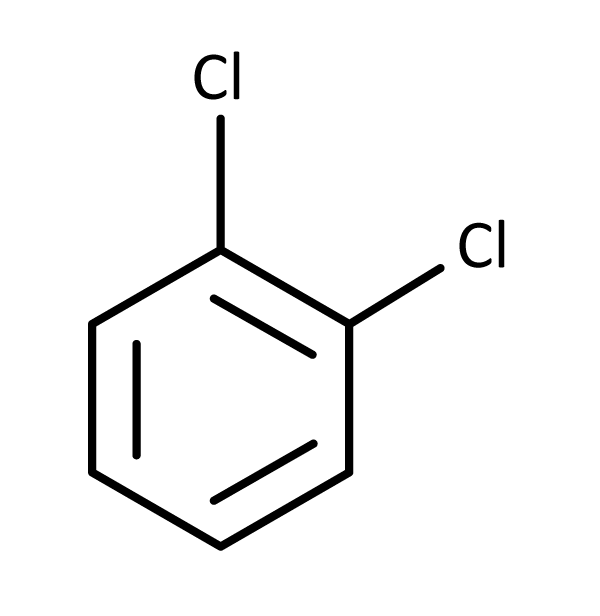
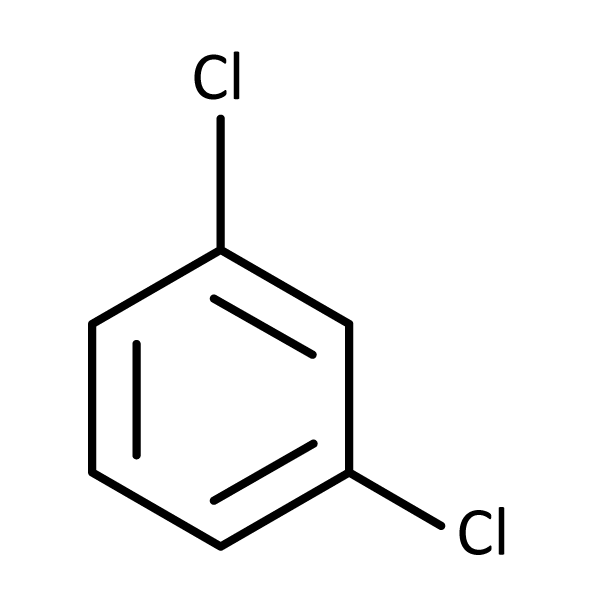
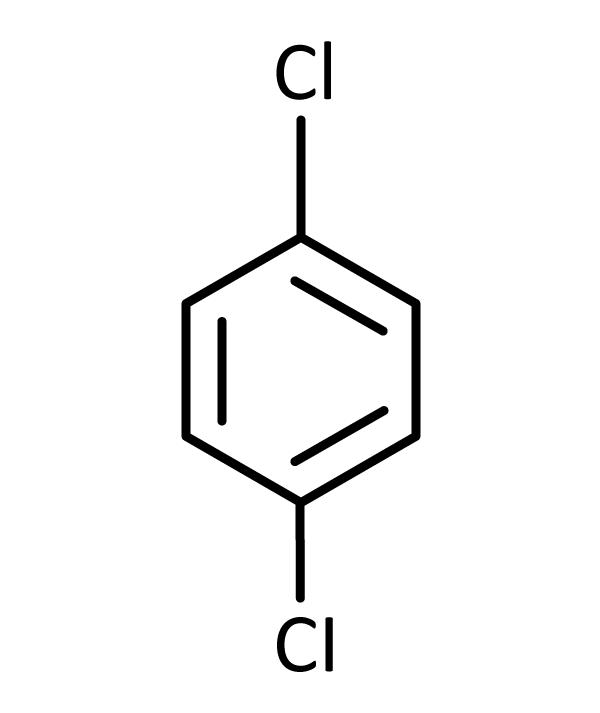
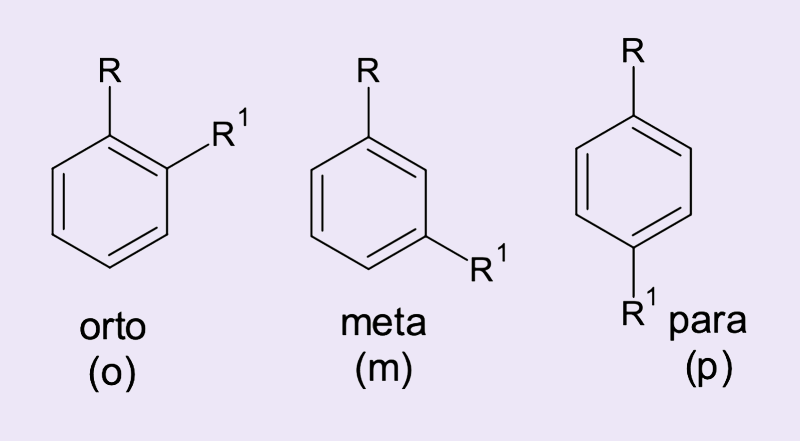
Quando analisamos os benzenos dissubstituídos identificamos três possibilidades: 1,2 quando os substituintes estão em carbono adjacentes – orto ou o-; 1,3 ou meta ou m-; e 1,4 ou para ou p-.
Os substituintes são informados na nomenclatura sempre em ordem alfabética. Assim, o 1,2-diclorobenzeno também é chamado de orto-diclorobenzeno ou, simplesmente, o-diclorobenzeno.
O 1,3-diclorobenzeno é também conhecido como meta-diclorobenzeno ou m-diclorobenzeno.
O 1,4-diclorobenzeno é o mesmo composto que o para-diclorobenzeno ou p-diclorobenzeno.
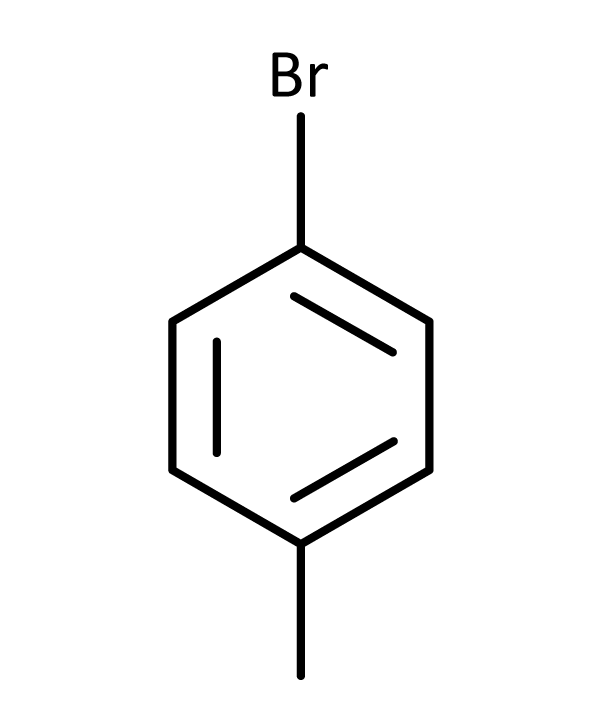
O 1-bromo-4-metilbenzeno é o mesmo composto que o para-bromometilbenzeno ou p-bromometilbenzeno – observem a disposição em ordem alfabética dos substituintes bromo e metil.
Muitos compostos derivados do benzeno, além da nomenclatura IUPAC, são identificados por uma terminologia usual ou vulgar, muito aplicada na prática, como destacamos a seguir:
Para benzenos com um número maior de substituintes, estes devem ser numerados, sempre de forma a obtermos as menores numerações e a nomenclatura descrita em ordem alfabética, é o caso do 1-cloro-2,3-dimetilbenzeno e 2,4-dimetil-nitrobenzeno.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer os princípios mecanísticos das principais reações de substituição eletrofílica em aromáticos (SEAr) do benzeno: nitração, sulfonação e halogenação
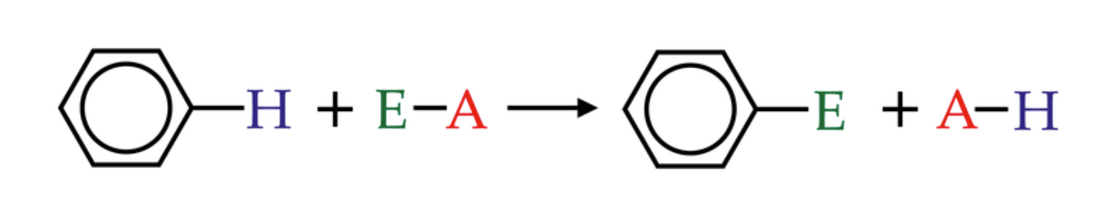
SUBSTITUIÇÃO ELETROFÍLICA EM AROMÁTICOS (SEAr)
O benzeno, assim como os demais aromáticos, é uma espécie rica em elétrons que pode reagir com eletrófilos. Estes podem ser espécies positivas (E+) ou mesmo espécies polares – mas com centro deficiente de elétrons (E-Nu) – que reagem substituindo um hidrogênio no composto aromático (figura 1), reação essa conhecida como substituição eletrofílica aromática (SEAr).
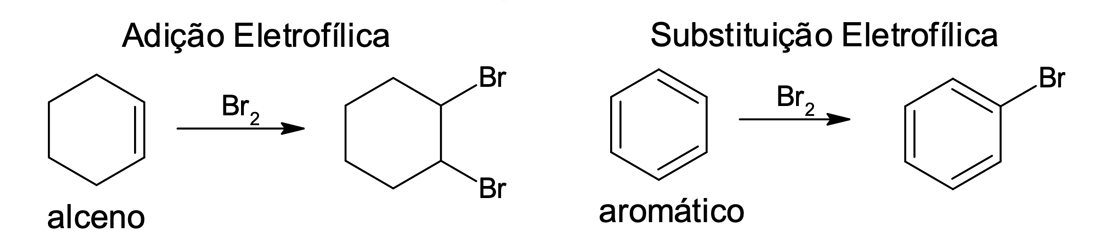
Os aromáticos mostram reatividade distinta quando comparados aos alcenos, os quais preferencialmente reagem com os eletrófilos por meio de reações de adição eletrofílica.
No estudo das reações, apresentado na figura 2, verificamos que o alceno reage com o eletrófilo por meio de reação de adição, na qual dupla ligação se desfaz para receber o eletrófilo e o produto final será um composto alifático saturado. Já o benzeno, quando reage com a mesma espécie, gera um composto substituído (um hidrogênio do anel benzênico é substituído pelo eletrófilo), que também é aromático.
Mecanismo geral da substituição eletrofílica aromática (SEAr)
Para descrever o mecanismo geral de reações do tipo SEAr, vamos usar como modelo a reação de substituição eletrofílica no benzeno. Nela, o benzeno atua como um nucleófilo. Veja as etapas a seguir:
Primeira etapa
Consiste no ataque nucleofílico que os elétrons π de uma das ligações duplas do benzeno fazem sobre eletrófilo e formam com ele uma ligação covalente (ligação C–E). Como consequência disso, os carbonos que anteriormente estavam envolvidos na ligação dupla (carbonos sp2 ) passam a ser carbonos com hibridização sp3 e um intermediário carbocátion é formado (quando o reagente aromático é o benzeno, esse intermediário carbocátion é denominado cátion arila). O intermediário carbocátion tem algumas estruturas de ressonância e, por isso, apresenta certa estabilidade. Porém, é muito menos estável do que o benzeno por não apresentar a nuvem contínua de elétrons π deslocalizadas, caraterística dos aromáticos primordial para a estabilidade desses compostos. Pelo fato de essa etapa ser termodinamicamente desfavorecida, acontece mais lentamente e é denomina etapa lenta ou etapa determinante da reação.
Segunda etapa
O intermediário carbocátion sofre a perda de um próton; a perda é promovida pela presença de uma espécie básica (aceptora de prótons – B:) no meio reacional. Observe que o hidrogênio a ser retirado é aquele ligado ao carbono sp3, que também está conectado ao eletrófilo. Quando isso acontece, esse carbono voltar a ter hibridização sp2 e os elétrons que estavam envolvidos na ligação C–H rompida passam a fazer parte da conjugação dos elétrons π no anel, restabelecendo a aromaticidade do produto.
Essa é uma etapa rápida, exotérmica e termodinamicamente favorecida (Figura 3).
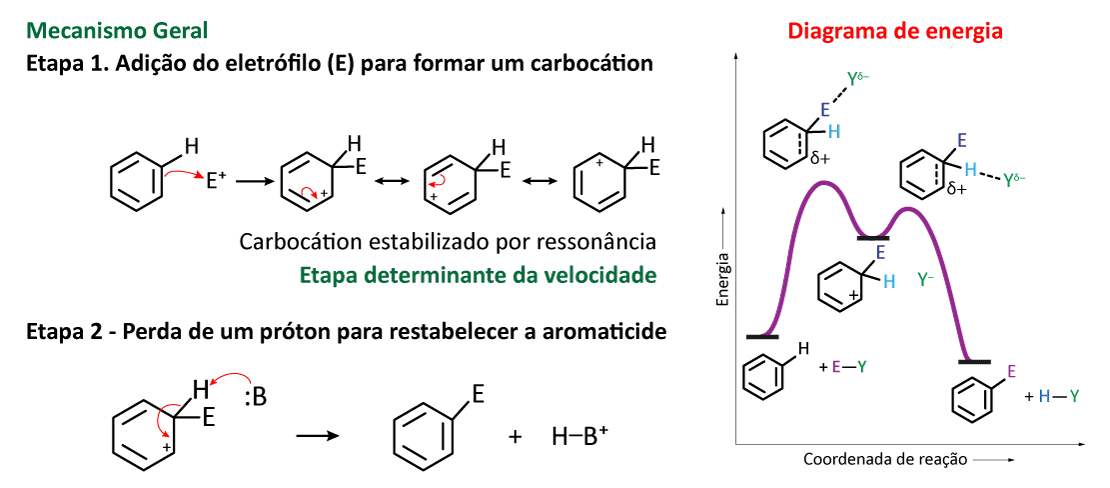
No diagrama de energia mostrado na figura 1, observamos que a energia do benzeno e do composto benzênico substituído são inferiores a energia do intermediário carbocátion formado. Esse é um motivo que pode explicar o porquê de a primeira etapa da reação ser mais difícil de acontecer (etapa lenta) e a segunda etapa acontecer rapidamente: uma etapa reacional é favorecida quando o produto formado por ela é mais estável (menos energético) do que a espécie que sofre a transformação química.
Comentário
Sendo assim, podemos concluir que a primeira etapa da SEAr não é favorecida, pois o carbocátion intermediário gerado é menos estável (mais energético) do que o composto aromático de partida. Por isso, para que essa reação inicie, são necessárias condições especiais que favoreçam cineticamente a formação de seus produtos. Em contrapartida, a formação do composto aromático substituído ao término da segunda etapa da reação é favorecida, uma vez que a estabilidade desse composto é maior do que a do carbocátion intermediário que lhe deu origem.
A substituição eletrofílica aromática envolve uma grande variedade de reações, entre as quais citamos a nitração, a sulfonação, a halogenação e as reações de Friedel-Crafts, além de outras como a nitrosação, o acoplamento azóico e a protonação. Em relação à síntese orgânica, podemos dizer que as substituições eletrofílicas aromáticas são extremamente importantes, pois constituem as etapas iniciais na síntese de aromáticos, possibilitando a inserção de substituintes reativos que podem ser substratos para outras reações de transformação ou deslocamento, gerando novos substituintes ou mesmo novos anéis aromáticos.
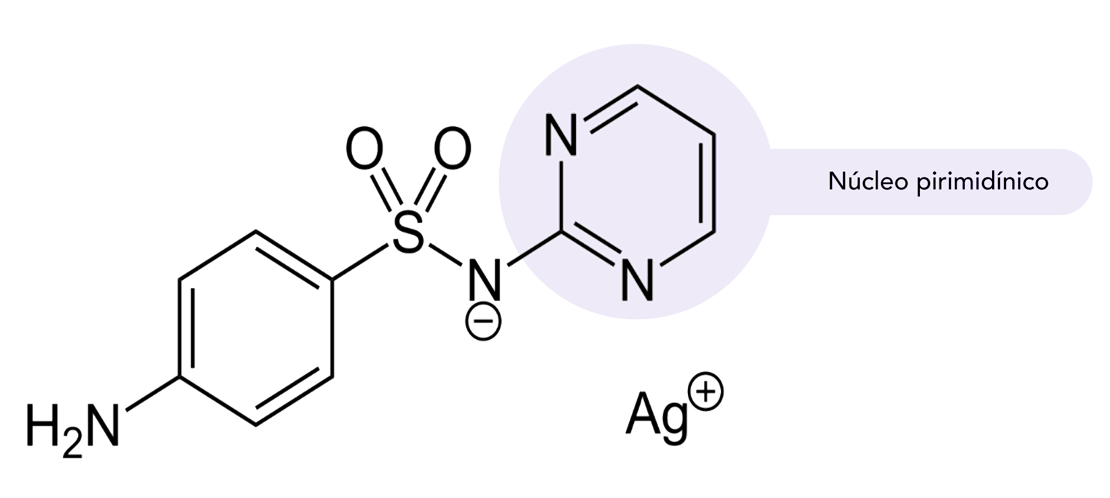
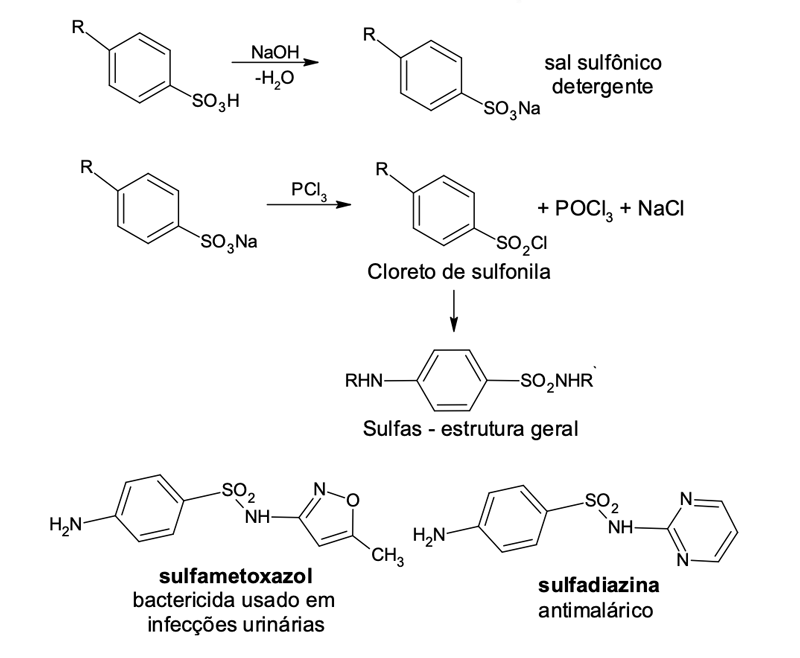
A substituição eletrofílica aromática é de grande interesse na obtenção de fármacos, uma vez que mais de 85% destes são compostos sintéticos e aromáticos. Vejamos o exemplo da sulfadiazina de prata (figura 4), uma sulfa com núcleo pirimidínico que surgiu na década de 1940.
As sulfas pirimidínicas foram utilizadas no combate a infecções causadas por coco e colibacilos. A sulfadiazina de prata, introduzida na prática médica em 1968, é hoje um medicamento tópico útil para o tratamento de queimaduras e úlceras varicosas, por proporcionar cicatrização rápida (BORGES, 2005).
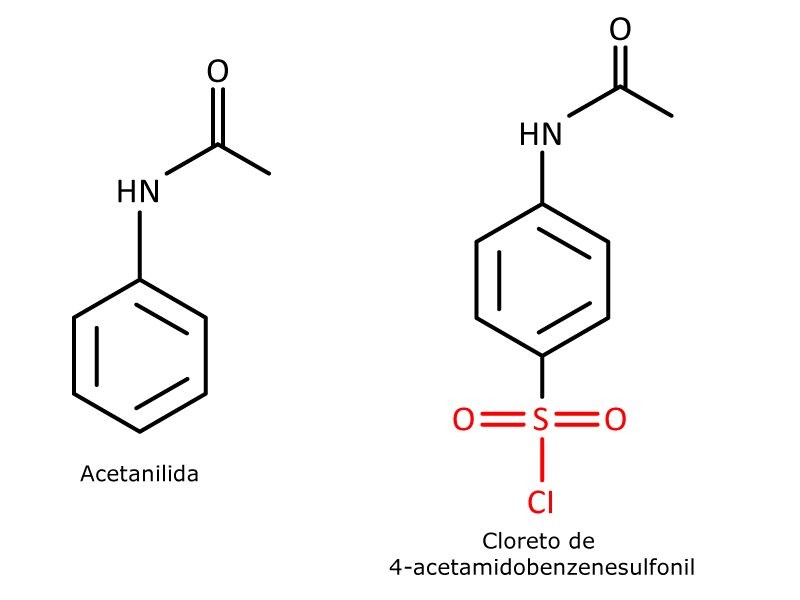
A síntese desse fármaco envolve algumas etapas, sendo uma delas a clorossulfonação da acetilanilina (figura 5), uma reação de substituição eletrofílica aromática.
Nos esquemas a seguir verificamos as principais reações eletrofílicas aromáticas (Ar = arila, qualquer grupo aromático):
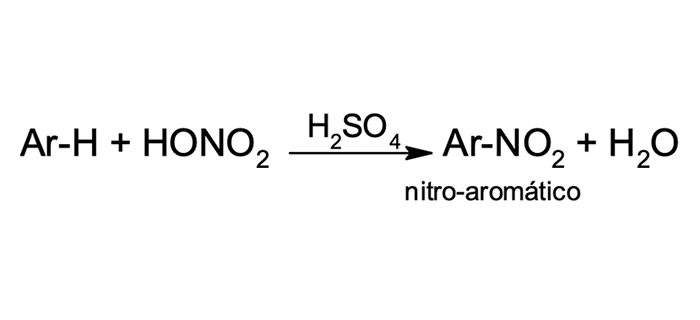
1
Nitração
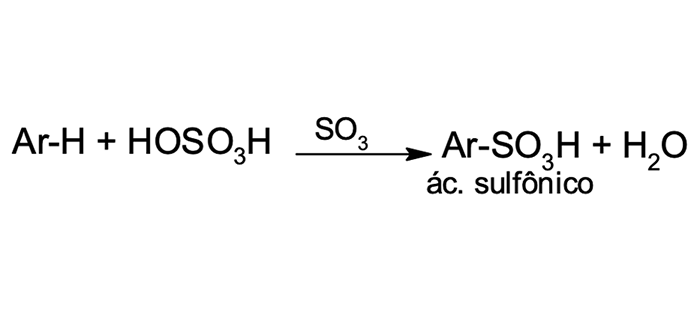
2
Sulfonação
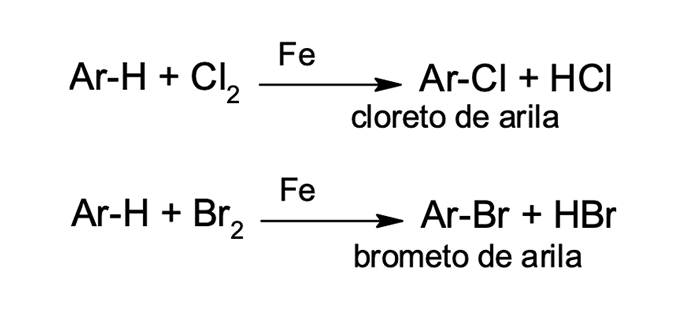
3
Halogenação
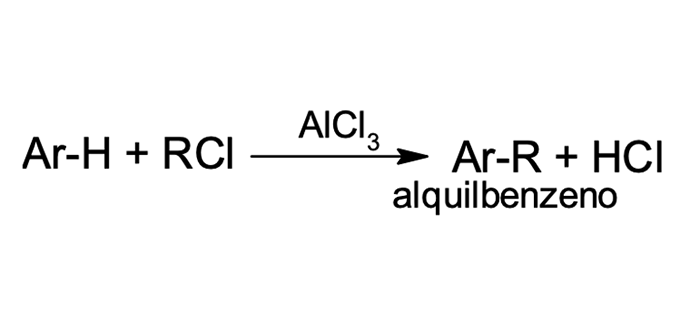
4
Alquilação de Friedel-Crafts
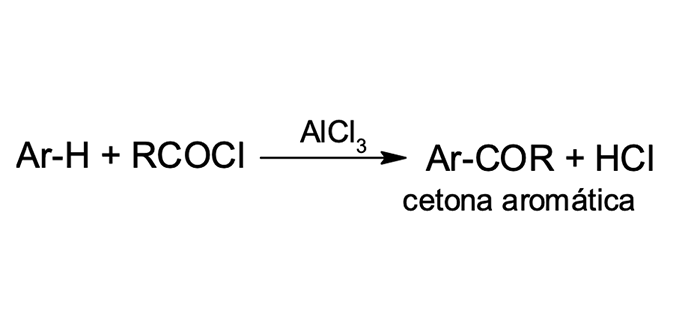
5
Acilação de Friedel-Crafts
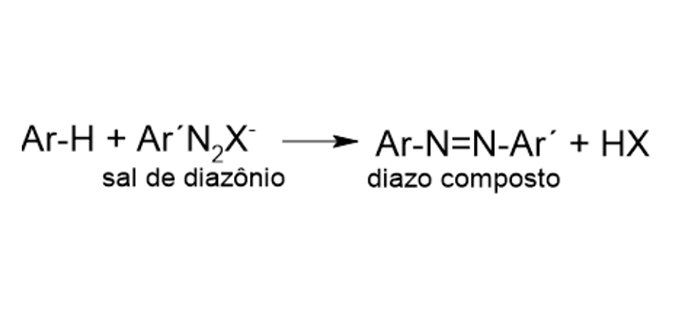
6
Acoplamento azoico
Vamos explorar, com detalhes, cada uma dessas reações.
Nitração do benzeno
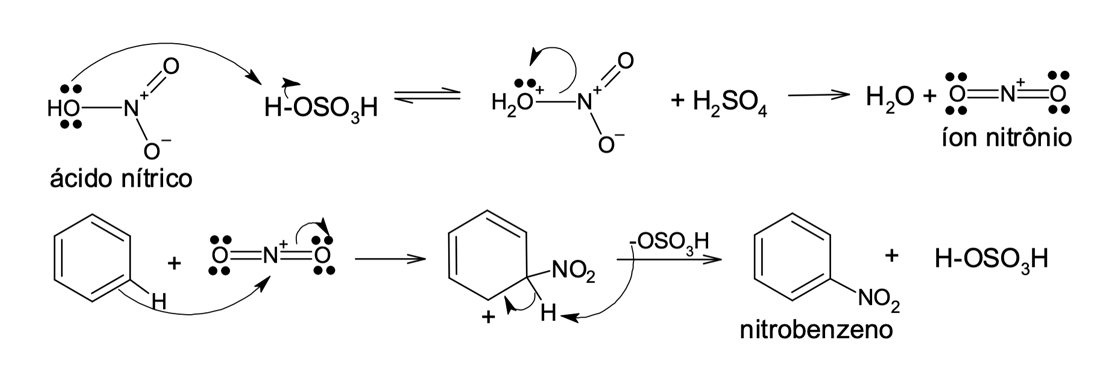
A nitração é uma importante substituição eletrofílica que ocorre em aromáticos. Para isso, é necessário obter um eletrófilo forte e reativo, como o íon nitrônio (NO2+). O íon nitrônio é formado pela reação do ácido nítrico na presença de um ácido forte, como o ácido sulfúrico concentrado. O ácido nítrico é ativado por receber o próton do ácido sulfúrico (nessa reação, o ácido de Bronsted-Lowry, mais forte). Essa espécie protonada perde uma molécula de água e o íon nitrônio é formado, conforme mostra a figura 6.
Atenção
É preciso ressaltar que sem a presença do ácido sulfúrico como catalisador a reação não deve ocorrer, já que o nitrogênio do ácido nítrico não é um eletrófilo suficientemente forte para reagir com o benzeno.
Na figura 6 identificamos a etapa lenta do ataque do anel aromático (nucleófilo) ao íon nitrônio (eletrófilo). O produto dessa etapa da reação é o carbocátion arila, que perde um próton e, após o restabelecimento da aromaticidade, o nitrobenzeno é formado.
A nitração é uma reação relevante em síntese orgânica, pois trata-se de uma forma de inserir substituintes nitrogenados nos aromáticos. O grupo nitro funciona como um intermediário para a obtenção de aminas por reações de redução e estas podem ser substrato de várias outras conversões de grupos funcionais. Além disso, o grupo nitro funciona como um orientador em reações posteriores de substituição.
Sulfonação do benzeno
Essa reação ocorre na presença de ácido sulfúrico fumegante, mas qual é a diferença entre ácido sulfúrico concentrado e ácido sulfúrico fumegante?
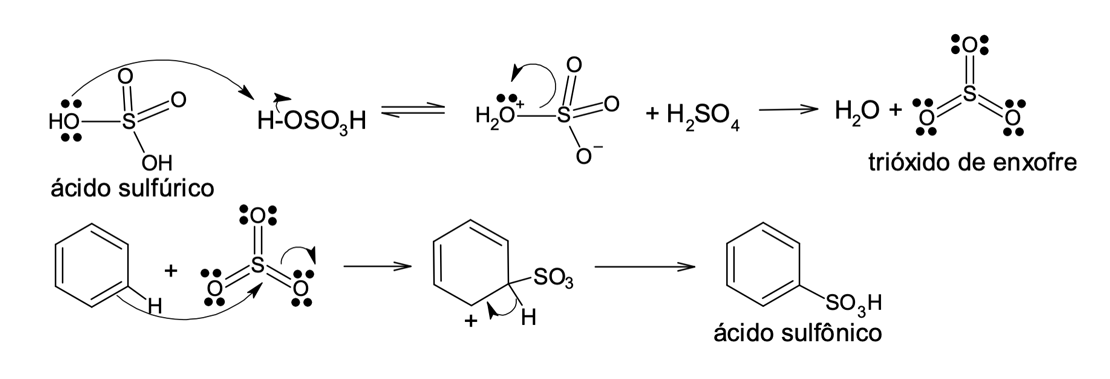
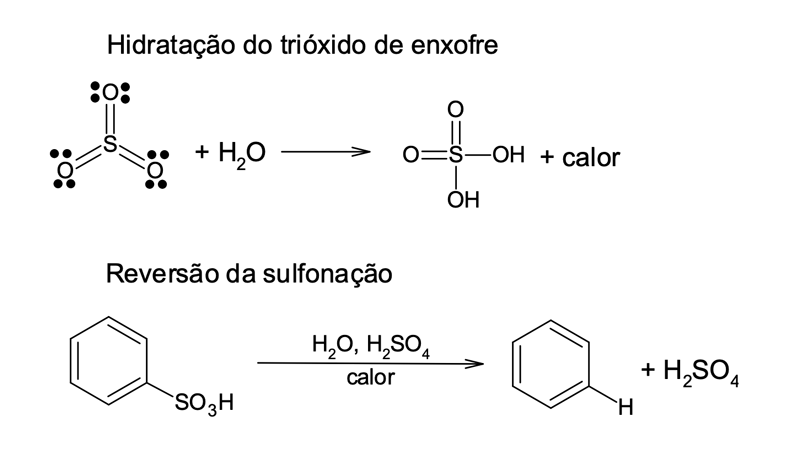
O ácido sulfúrico fumegante comercial é obtido pela adição de trióxido de enxofre (SO3) – cerca de 8% – ao ácido sulfúrico concentrado. O SO3 é um eletrófilo forte e reativo devido aos três átomos de oxigênio que atraem os elétrons do enxofre. A eletrofilicidade do enxofre é suficiente para promover a reação de substituição eletrofílica no benzeno.
Ele pode ser gerado pela reação de autoprotólise do ácido sulfúrico, conforme mostrado na figura 7.
Autoprotólise
Transferência de prótons entre duas espécies idênticas.
A sulfonação é uma reação reversível (figura 8), fácil de se desfazer na presença de água, uma vez que o trióxido de enxofre reage de forma exotérmica com o ácido sulfúrico, hidratando-se para gerar ácido sulfúrico e reconstituindo o benzeno.
Essa reversibilidade é de grande utilidade nos processos de síntese, uma vez que a sulfonila pode funcionar como um grupo bloqueador de determinadas posições no anel aromático, direcionando as reações subsequentes. Todas essas características são essenciais na estratégia de retrossíntese, ou seja, planejamento de etapas sintéticas para se obter um produto final, que pode ser um fármaco ou qualquer outro produto químico.
Além da importância nos processos de síntese, os ácidos sulfônicos são importantes intermediários para a formação de sais com propriedades saponificantes – detergentes (não biodegradáveis), corantes e cloretos de ácidos sulfônicos que são preparados pela reação do sal de sódio do ácido sulfônico com PCl3 ou SOCl2 (figura 9). Os cloretos de sulfonila são importantes intermediários sintéticos, principalmente na obtenção de grupos sulfonamidas presentes nas sulfas, antibióticos já citados neste texto.
Halogenação do benzeno
Assim como na halogenação e na sulfonação, os aromáticos podem reagir com halogênios (bromo e cloro), por meio do mecanismo SEAr.
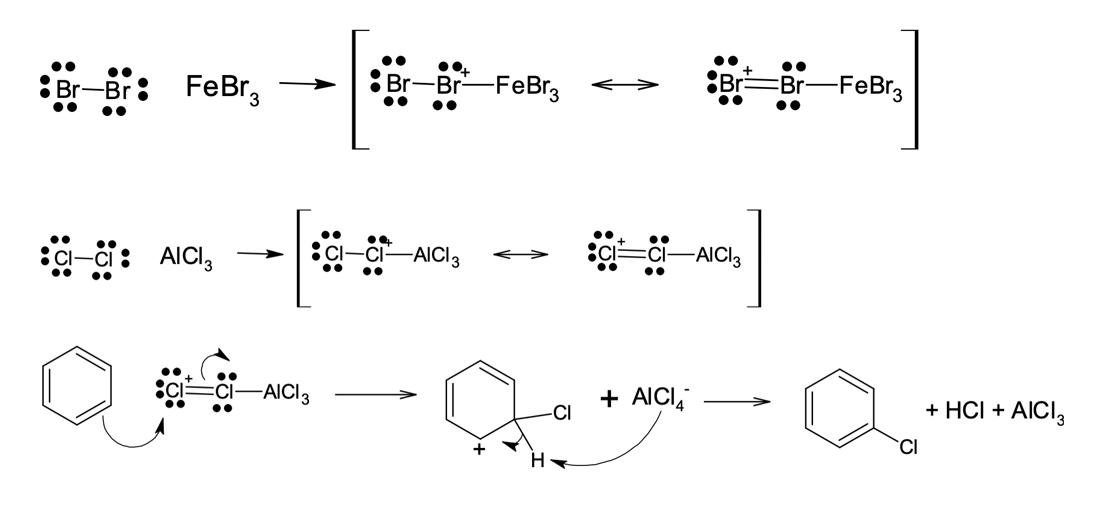
A halogenação de compostos aromáticos ocorre na presença de um ácido de Lewis (AlCl3 e FeBr3) que atua como catalisador, ativando os halogênios para a reação. A presença do ácido de Lewis junto ao halogênio aumenta o seu caráter eletrofílico, favorecendo sua reação com o anel benzênico. Isso acontece porque esses catalisadores são capazes de aceitar o par de elétrons de um dos átomos de halogênio, promovendo uma deficiência eletrônica nesse átomo.
Consequentemente, eles se tornam eletrófilos mais fortes e reativos, como demonstrado na figura 10.
Atenção
Devemos destacar que a reação de halogenação não é favorecida para os halogênios flúor e iodo. A reação do benzeno com flúor é tão exotérmica e reativa que se torna explosiva, sendo de difícil controle, já a iodação é endotérmica e pouco favorecida.
A explicação para a reatividade e o comportamento dos halogênios frente à reação de substituição eletrofílica aromática se deve à termodinâmica da quebra e da formação de novas ligações, ou seja, a energia de dissociação das ligações. No caso das ligações F–F e Ar–H, as energias são bem menores do que a energia desprendida pela formação das ligações Ar–F e H–F. Já no caso do iodo o comportamento é inverso e, por isso, a reação é muito endotérmica e pouco favorecida.
REAÇÕES DE SUBSTITUIÇÃO ELETROFÍLICA AROMÁTICA NA SÍNTESE DE FÁRMACOS
Assista ao vídeo em que a especialista explica a reação de substituição eletrofilica aromática, os principais exemplos de reação e um resumo de seu mecanismo.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer os princípios mecanísticos da síntese de alquilbenzenos por acilação-redução e o efeito dos substituintes na reatividade de compostos aromáticos substituídos
SÍNTESE DE ALQUILBENZENOS
Até o momento conhecemos algumas reações de substituição eletrofílica aromática.
No entanto, nenhuma delas foi capaz de formar ligações carbono-carbono, conversão química importante para o aumento das cadeias carbônicas. Como visto anteriormente, para que uma reação do tipo SEAr aconteça, o composto que irá reagir com o aromático precisa ter alta eletrofilicidade. Seguindo esse pensamento, se o nosso objetivo é fazer com que um dos carbonos do anel aromático se ligue a um átomo de carbono de um reagente, é necessário que o carbono a ser adicionado apresente propriedades eletrofílicas.
Em quais condições, então, um carbono pode estar deficiente de elétrons?
Mais uma vez a presença de catalisadores é essencial para a reação ocorrer e nesse caso, assim como nas reações de halogenação do benzeno, um ácido de Lewis pode funcionar como um catalisador pela capacidade de atrair elétrons gerando um centro positivamente carregado, suficientemente eletrofílico para a reação.
Vamos conhecer agora como isso ocorre por meio das reações de Friedel-Crafts
REAÇÕES DE FRIEDEL-CRAFTS
As reações de Friedel-Crafts são um dos principais mecanismos de inserção de cadeias carbônicas como substituintes em anéis aromáticos. Esse tipo de reação ocorre entre haletos de alquila ou haletos de acila na presença de catalisadores que são fundamentais para a formação da espécie eletrofílica no meio reacional.
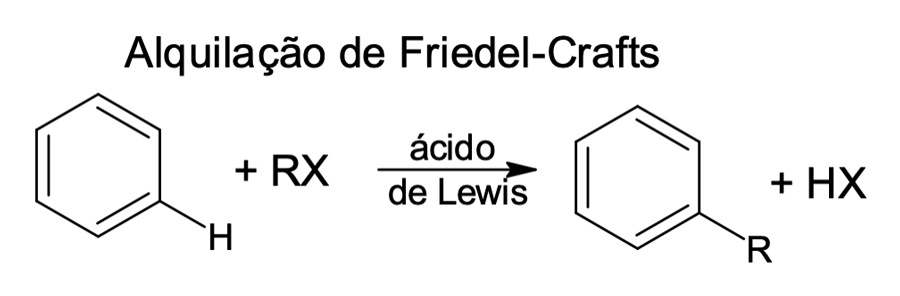
Alquilação de Friedel-Crafts
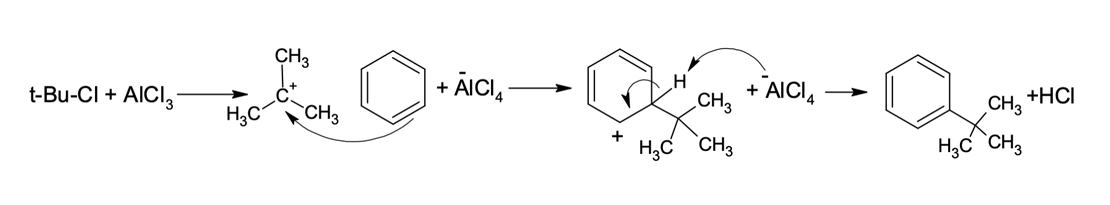
Em 1877 os químicos Charles Friedel (francês) e James Crafts (norte-americano) desenvolveram uma reação capaz de substituir um hidrogênio do aromático por grupos de alquila (R). Tal reação recebeu o nome de alquilação de Friedel-Crafts (figura 1).
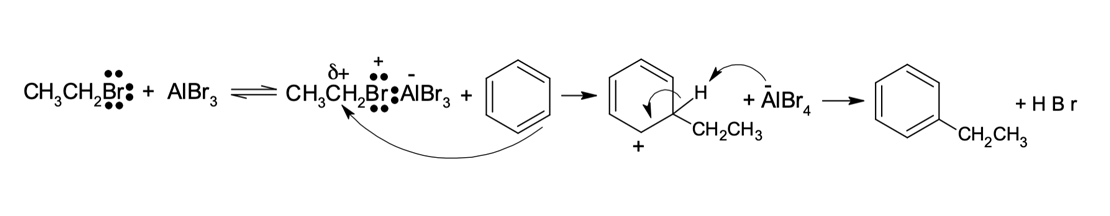
O mecanismo dessa reação se inicia com a formação do carbocátion eletrófilo do grupo de alquila. O ácido de Lewis é capaz de receber os elétrons de haletos de alquila secundários e terciários, favorecendo a quebra da ligação R–X para a formação de um carbocátion estável. No caso dos haletos de alquila primários, que não geram carbocátions estáveis, a aproximação do ácido de Lewis forma um complexo eletrofílico-estado de transição.
Para as reações de alquilação de Friedel-Crafts a reatividade dos haletos de alquila aumenta com a polaridade da ligação C–X assim o RF > RCl > RBr > RI. Para compreendermos melhor como ocorrem as alquilações de Friedel-Crafts nos diferentes tipos de haleto de alquila, vamos destacar, separadamente, cada um dos mecanismos.
Mecanismo para alquilação de Friedel-Crafts para haletos secundários e terciários (figura 2).
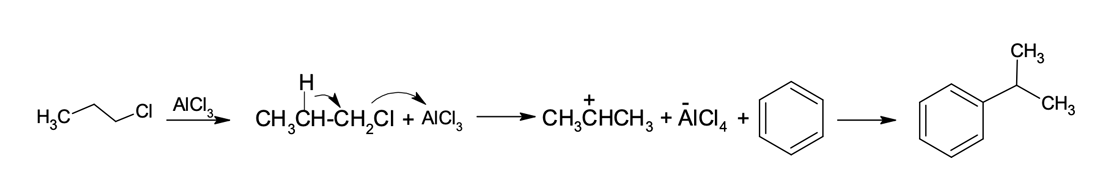
Mecanismo para alquilação de Friedel-Crafts para haletos primários
A alquilação de Friedel-Crafts para haletos primários é especialmente eficaz com cloreto de etila. Porém, com outros haletos primários o produto principal é um composto alquilbenzeno, cuja cadeia carbônica é ligada ao anel aromático por meio de um carbono secundário.
Vejamos o exemplo da halogenação do benzeno com o brometo de propila. O produto desejado seria o propilbenzeno, mas o produto formado é o isoprilbenzeno. Como explicar o que aconteceu?
Como já vimos, a primeira etapa da reação de alquilação com um haleto primário é a formação de um complexo do haleto com o ácido de Lewis, gerando um intermediário no qual o centro eletrofílico é um carbono primário. Mas esse pode se rearranjar pela migração do hidrogênio (rearranjo 1,2 de hidreto) para formar um carbocátion secundário ou terciário, que são espécies mais estáveis (figura 4). No caso do brometo de propila, o rearranjo de hidreto gera um carbocátion secundário que reage com o benzeno para a formação do isopropilbenzeno.
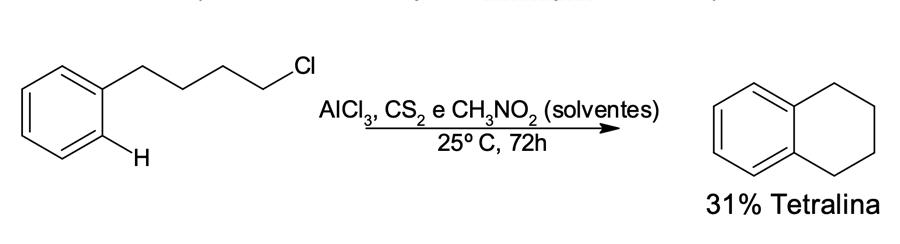
Essas alquilações podem ocorrer para formar um novo anel: são as alquilações intramoleculares de Friedel-Crafts. No exemplo da figura 5, podemos perceber que o aromático já possui uma cadeia lateral com um halogeno-alcano, na presença de um ácido de Lewis, para catalisar a reação, a ciclização da cadeia pode ocorrer.
As alquilações de Friedel-Crafts apresentam algumas limitações, seja pela ocorrência de rearranjo no carbocátion, como visto anteriormente, e formação de reações laterais, seja pela polialquilação. Em ambos os casos há uma redução do rendimento do produto principal desejado, levando à formação de misturas de compostos que são difíceis de ser separados. Isso se justifica pelo fato dos substituintes alquis serem grupos doadores de elétrons que aumentam a densidade eletrônica do anel e, consequentemente, fazem com que os compostos benzênicos alquilados sejam mais reativos do que o benzeno em reações do tipo SEAr.
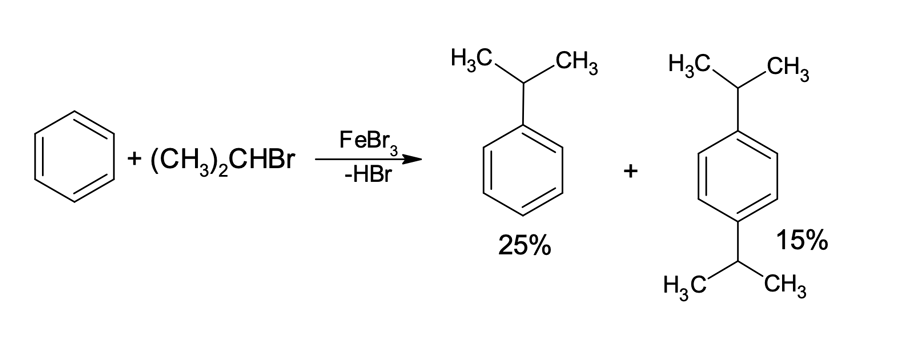
Na reação mostrada na figura 6, podemos constatar que o benzeno, ao reagir com o brometo de isopropila, leva à formação de uma mistura de 25% do isoprilbenzeno e 15% de 1,4-di-isopropilbenzeno.
Pelas limitações apresentadas, a alquilação de Friedel-Crafts não é uma reação de escolha nos processos de síntese. Uma alternativa para a inserção de grupos alquila nos aromáticos é a utilização da acilação de Friedel-Crafts, pois ao inserir um grupo acila, o anel fica desativado para as próximas reações, gerando maior controle nos processos de síntese. O substituinte acila, por uma etapa de redução, pode ser convertido em um grupo alquila. Esse processo é conhecido em química orgânica como interconversão de grupos funcionais (IGF).
Acilação de Friedel-Crafts
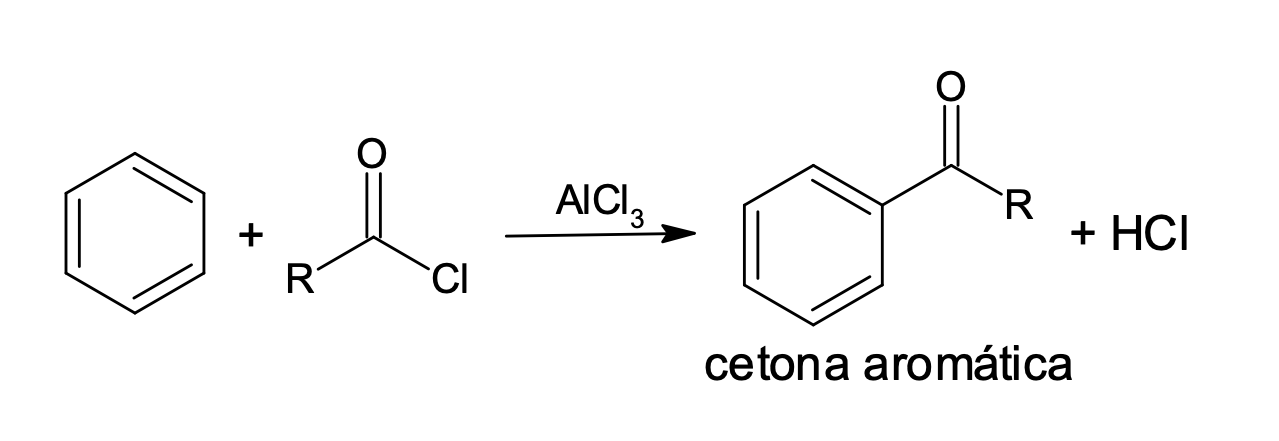
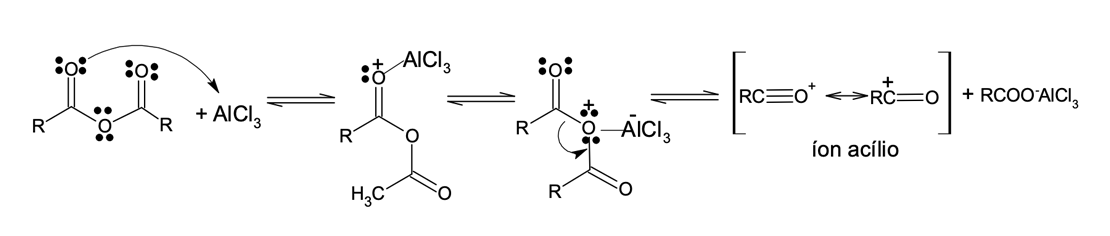
Como as demais reações de substituição eletrofílica aromática, a acilação de Friedel-Crafts (figura 7) promove a substituição de um próton do anel benzênico por um cátion acila (RC≡O+ ou ArC≡O+), sendo mais uma reação que promove a formação da ligação carbono-carbono nos compostos aromáticos. Os produtos das reações de acilação de Friedel-Crafts são cetonas aromáticas.
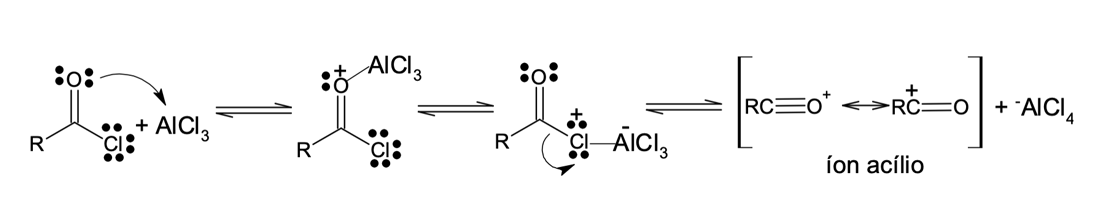
O mecanismo é muito semelhante ao das demais reações de SEAr. Existe a necessidade de um ácido de Lewis como catalisador para ativar a reatividade de halogenetos de alcanoíla, também chamados de halogenetos de acila. Nesse processo, há a formação do intermediário reativo e eletrofílico – cátion acila ou íon acílio (figura 8), que reage com o composto aromático.
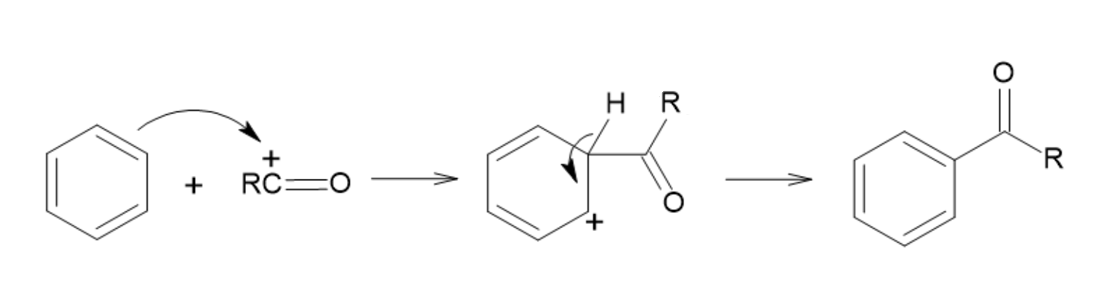
O íon acílio se liga ao anel aromático gerando o cátion benzílico e após a perda do próton a aromaticidade do anel benzênico é restabelecida (figura 9).
A acilação de Friedel-Crafts também pode ocorrer a partir da reação de derivados aromáticos com anidridos de ácidos carboxílicos, como mostra a figura 10.
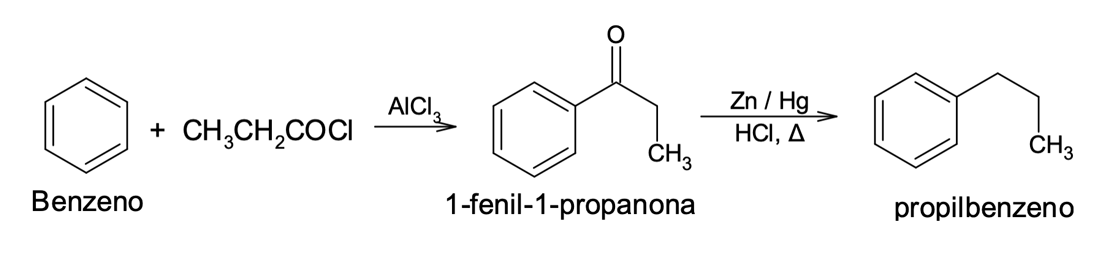
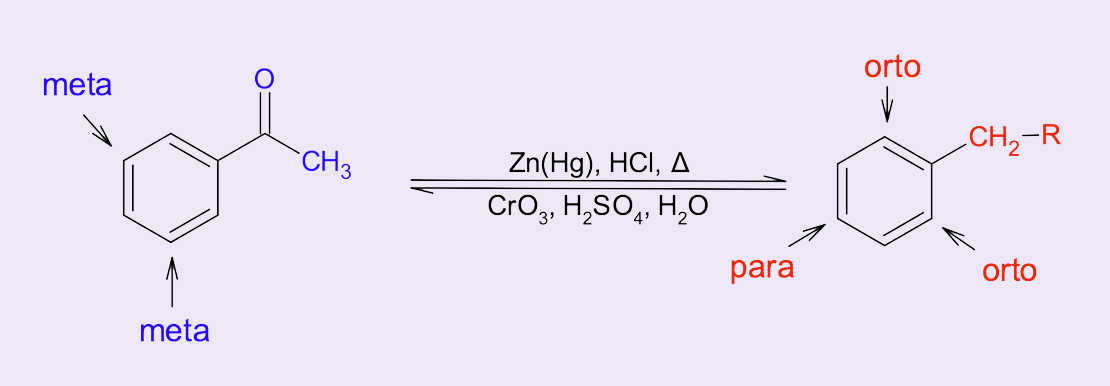
Ao contrário da reação de alquilação, a acilação de Friedel-Crafts possibilita a introdução de cadeias de carbono nos aromáticos de forma seletiva e controlada. Inicialmente o produto formado é uma cetona aromática, mas que pode ser convertida a um grupo alquil pela redução total da carbonila na presença de zinco e mercúrio (Zn/Hg) em meio ácido, conhecida como redução de Clemmensen (figura 11).
EFEITO DOS SUBSTITUINTES E REGIOSSELETIVIDADE DA SEAr
Até agora analisamos várias reações de SEAr, que têm como produtos derivados aromáticos monosubstituídos. Após a primeira substituição eletrofílica no benzeno podemos realizar outras reações e obter derivados di ou trisubstituídos. Vamos entender como isso ocorre.
Quando a SEAr ocorre em um benzeno que já possui um grupo qualquer, três regioisômeros podem ser formados: isômero orto (o), isômero meta (m) e isômero para (p), conforme mostra a figura 12.
Entretanto, esses isômeros não são obtidos em quantidades iguais. O grupo já presente no aromático influencia a reação SEAr de duas formas:
Reatividade do aromático
O substituinte afeta a reatividade do anel aromático podendo torná-lo mais reativo (grupos ativantes do anel aromático) ou menos reativo (grupos desativantes do anel aromático) que o composto aromático não substituído. É importante destacar que, nesse contexto, a reatividade está relacionada à velocidade com que a reação de substituição eletrofílica irá acontecer: quanto maior a reatividade, maior a velocidade da reação.
Orientação da posição da nova ligação
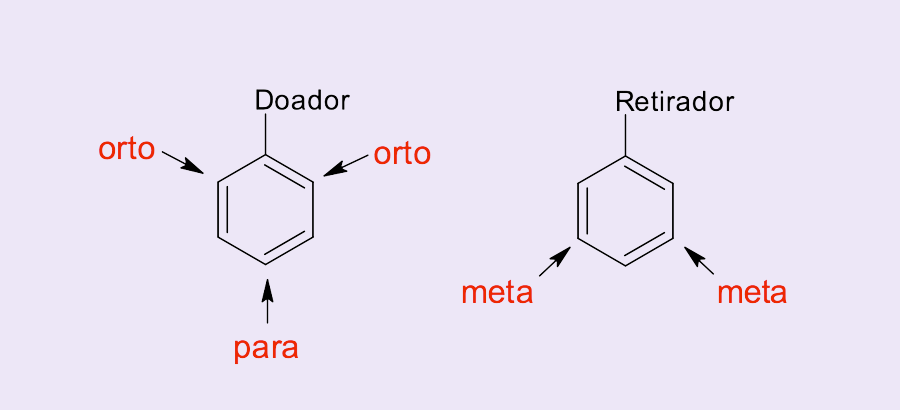
O substituinte influencia a posição preferencial para a ligação do segundo grupo no anel aromático (figura 13). Alguns substituintes favorecem as SEAr na posição meta e outros nas posições orto e para, sendo chamados de orientadores meta e orientadores orto/para, respectivamente.
ATIVAÇÃO OU DESATIVAÇÃO DO ANEL AROMÁTICO
Nas reações SEAr já entendemos que o anel aromático, muitas vezes exemplificado pelo benzeno, é uma espécie rica em elétrons que reage atacando uma espécie deficiente de elétrons, o eletrófilo. É de se esperar que quanto maior for a densidade eletrônica desse aromático, mais nucleofílico e mais reativo ele será frente a um eletrófilo. Os substituintes podem influenciar a densidade eletrônica do anel aromático por dois efeitos: ressonância e/ou efeito indutivo.
Veja a diferença entre eles:
A ressonância se propaga pelas ligações π conjugadas, pelas quais os elétrons se deslocam.
Já o efeito indutivo ocorre devido à diferença de eletronegatividade dos átomos, gerando polarização induzida das ligações σ, e enfraquece com o aumento da distância entre o grupo substituinte e o centro reacional.
Podemos classificar os grupos substituintes do benzeno em grupos doadores de elétrons, que, por aumentarem a densidade eletrônica do anel, o ativam e são chamados de ativadores do anel e grupos aceitadores ou retiradores de elétrons, que, por diminuírem a densidade eletrônica do anel, o desativam e são chamados de desativadores do anel.
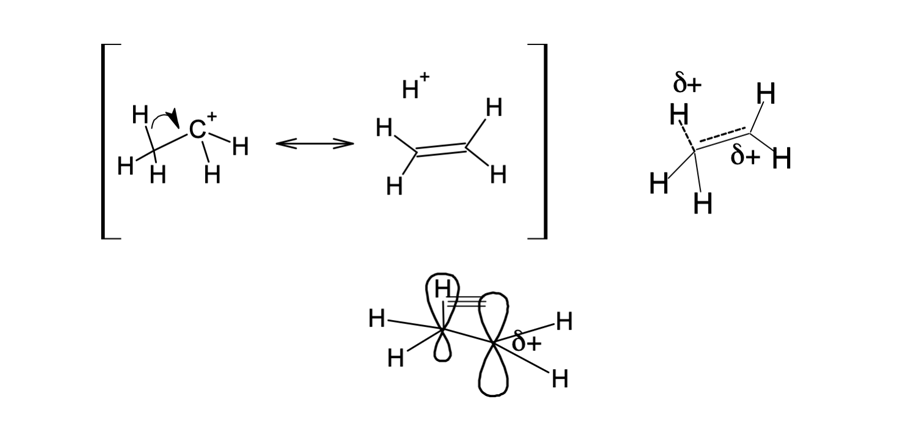
Os grupos alquilas, como, por exemplo, o grupo metila, são doadores de elétrons por efeito de hiperconjugação, que se caracteriza pela deslocalização dos elétrons por meio de ligações σ para orbitais vazios. Quando o carbono assume uma carga positiva ele adquire a hibridização sp2 e o orbital p fica vazio. Ligações σ vizinhas podem doar densidade eletrônica a esse orbital vazio, facilitando a deslocalização da carga, e diminuem a energia da espécie. Essa doação pode ocorrer por qualquer ligação σ próxima, mas acontece principalmente por ligações C–C ou C–H. Essa deslocalização faz com que o hidrogênio assuma parte da carga positiva do orbital p. Trata-se de um efeito muito menos intenso do que a ressonância.
A hiperconjugação (figura 14) é mais bem descrita por estruturas individuais, que contribuem para uma estrutura híbrida:
Ainda analisando o efeito indutivo, grupos mais eletronegativos que o carbono retira elétrons, como halogênios, nitrila (CN), nitro (NO2 ) e carbonila (CO), mas os três últimos também retiram elétrons por meio do efeito de ressonância, sendo capazes de estabilizar cargas negativas nas estruturas de ressonância.
Na tabela1, a seguir, podemos identificar a contribuição dos principais grupos substituintes para a reatividade do anel aromático, ativando-o ou desativando-o, e o efeito orientador orto/para e meta dos grupos.
| Orientadores orto/para | Orientadores meta | ||
|---|---|---|---|
| Ativantes forte |
-NH2 -OH -OR |
Desativantes forte |
-N+(CH3)3 -NO2 -CN -SO3H -COR |
| Ativantes fraco |
-NHCOCH3 -R, -Ar |
||
| Desativantes |
I, Br, Cl, F (os halogênios são exceções, pois trata-se de desativantes que orientam o/p) |
Desativantes fraco |
-COOH -COOR -CHO |
REAÇÕES DE FRIEDEL-CRAFTS
Assista ao vídeo em que serão apresentadas as reações de Friedel-Crafts – alquilação e acilação e sua importância na síntese de alquil e acilbenzenos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever o efeito dos substituintes na regiosseletividade das sínteses de compostos aromáticos com múltiplos substituintes
SÍNTESE ORGÂNICA A PARTIR DE REAÇÕES DE SEAr
Para compreendermos melhor as características da cinética, da regiosseletividade e o efeito dos substituintes em compostos aromáticos, vamos analisar algumas reações do tipo SEAr.
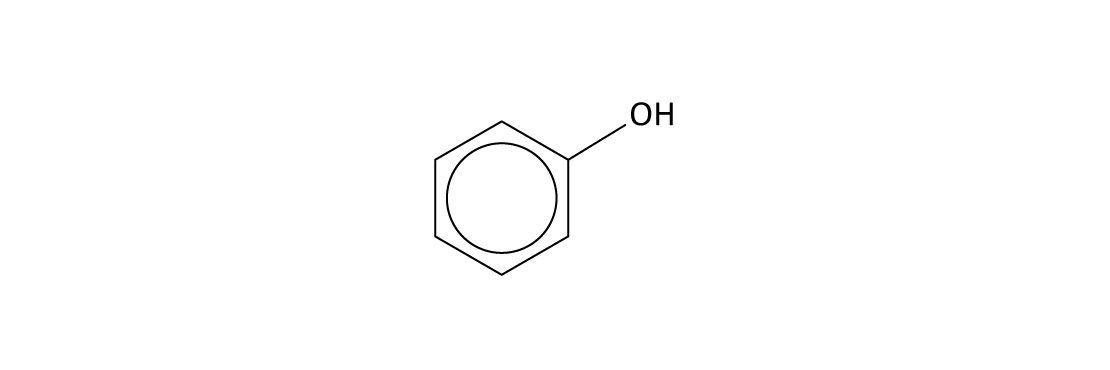
Iniciemos pelo fenol ou hidroxi-benzeno, uma substância obtida principalmente a partir da extração de óleos do alcatrão de hulha. Apesar de ter uma hidroxila ligada ao anel aromático, o fenol não é classificado como um álcool, uma vez que tem um próton ácido.
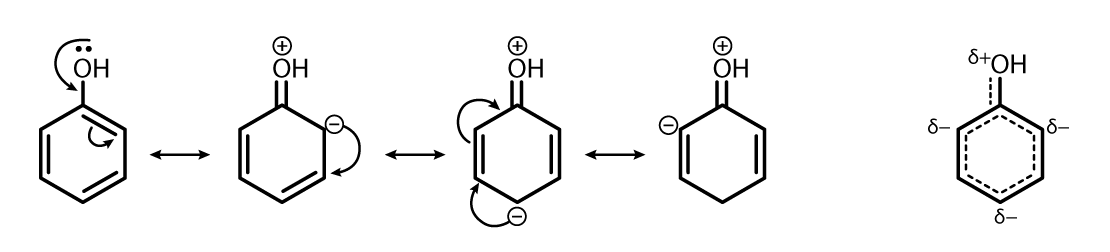
Ácido
O caráter ácido desse composto se deve à estabilidade de sua base conjugada conferida por ressonância.
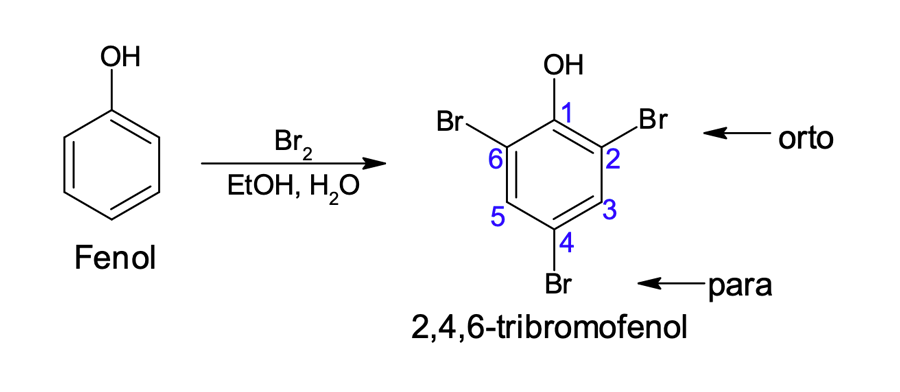
O fenol é mais reativo do que o benzeno. Uma evidência disso é que ele reage com Br2 sem a presença de um catalisador (figura 1). O produto majoritário dessa reação é o 2,4,6-tribromofenol.
Mas, por que o produto formado em maior quantidade é um composto fenólico trissubstituído?
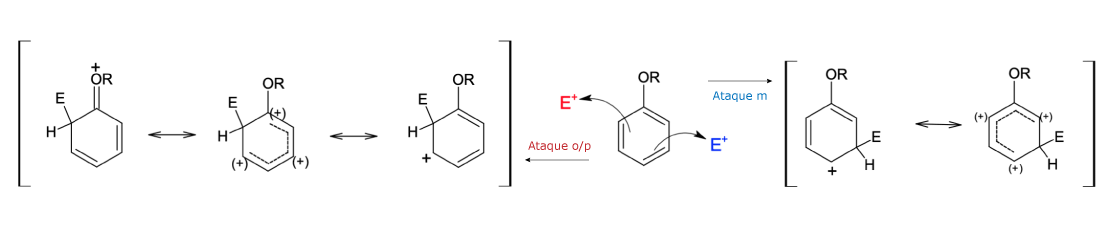
A alta reatividade do fenol faz com que a molécula sofra mais de uma reação de SEAr. Observe, ainda, que a hidroxila, além de um grupo doador de elétrons e ativador do anel, também orienta as substituições nas posições orto/para.
Existem duas justificativas para que substituintes capazes de doar elétrons ao anel aromático sejam orientadores orto/para:
Outros substituintes que doam elétrons também direcionam as reações de SEAr nas posições orto/para, principalmente aqueles que possuem oxigênio, nitrogênio (que tenha pares de elétrons isolados), e os halogênios (em especial F e Cl).
Vejamos alguns desses exemplos.
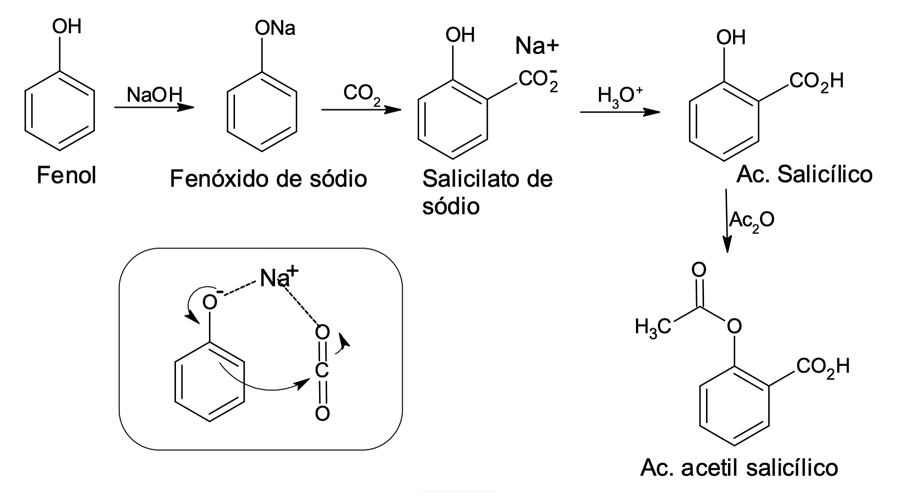
O íon fenóxido (base conjugada do fenol) é um composto aromático substituído muito reativo (mais até que o fenol). Ele é capaz de reagir com eletrófilos muito fracos, como o dióxido de carbono. O ácido salicílico, por exemplo, usado em peelings na cosmetologia e, industrialmente sendo precursor do ácido acetilsalicílico (AAS), pode ser obtido a partir da SEAr com fenóxido de sódio e CO2 (figura 4). Apesar de ser um dirigente orto/para, o grupo-O,- a reação de substituição com CO2 leva principalmente ao produto orto. Isso acontece devido à coordenação entre o íon sódio e os dois oxigênios, um do fenóxido e o outro do CO2.
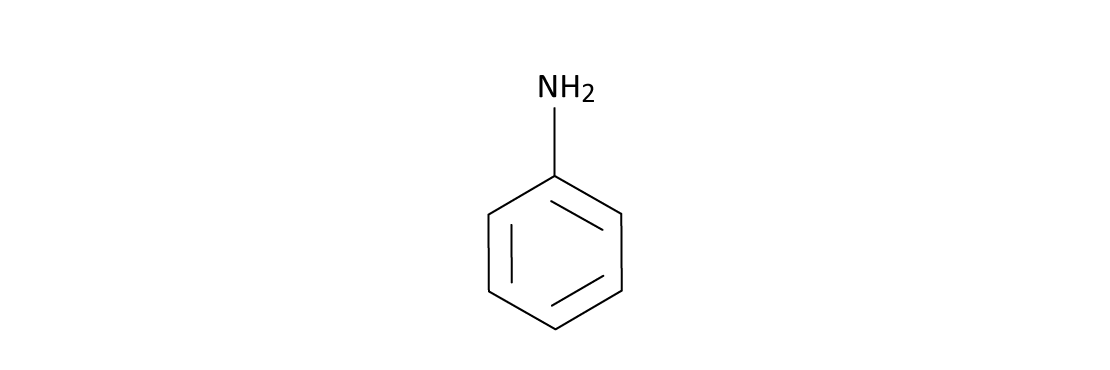
A anilina, fenilamina ou aminobenzeno é um líquido incolor (ligeiramente amarelo), de odor característico e sabor aromático cáustico. Não se evapora facilmente em temperatura ambiente, sendo facilmente inflamável (queima com uma chama fumacenta). A anilina é levemente solúvel em água e se dissolve facilmente na maioria dos solventes orgânicos e inorgânicos. É utilizada para fabricar uma variedade produtos, como, por exemplo, a espuma de poliuretano, produtos químicos agrícolas, pinturas sintéticas, antioxidantes, estabilizadores para a indústria do látex, herbicidas, vernizes, explosivos e também na fabricação de preservativos masculinos e femininos. Além disso é usada como matéria-prima para vários corantes e, por isso, de forma equivocada, seu nome é um sinônimo de corante.
O grupo amino na anilina é um doador de elétrons mais forte do que a hidroxila do fenol. Trata-se de um substituinte que ativa fortemente o anel benzênico e orienta as reações de SEAr nas posições orto/para. Assim como o fenol, na presença de bromo não necessita de um catalisador para que a bromação do anel benzênico ocorra de forma completa. Essa reação também gera um produto tribromado.
Tanto o grupo amino (NH2) quanto a hidroxila (OH) são bastante versáteis em síntese orgânica.
Esses grupos são muito importantes no planejamento de rotas sintéticas, uma vez que, ao inserirmos um substituinte doador ou retirador de elétrons no anel, estamos estabelecendo a regiosseletividade das próximas reações de SEAr, ou seja, definiremos se as substituições serão em orto/para ou em meta, respectivamente.
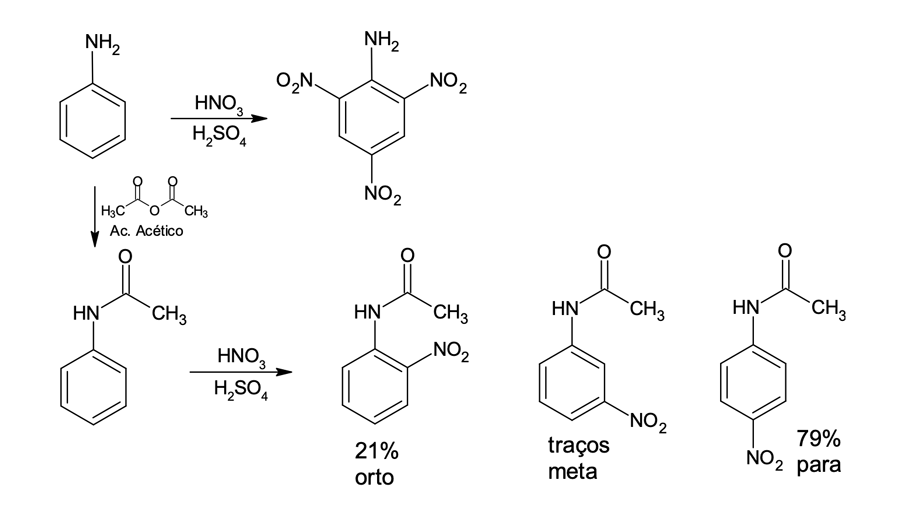
Por exemplo, ao realizarmos diretamente a nitração do fenol ou da anilina teremos a formação do derivado trinitrobenzeno com os substituintes nas posições orto/para. Mas se inicialmente acetilamos o grupo amina da anilina, geramos um substituinte amida que é doador moderado pela presença da carbonila (a carbonila ligada ao N da anilina puxa os elétrons isolados desse átomo tanto por ressonância, quanto por efeito indutivo, fazendo com que eles fiquem menos disponíveis para serem compartilhados na ressonância do anel benzênico e dos intermediários catiônicos formados durante a reação de SEAr). O substituinte N-acetil, por ser um ativador mais brando, possibilita maior controle da reação SEAr, formando principalmente o produto para (mais favorecido por ter menor impedimento estérico). Também é produzido em menor quantidade o produto com substituição em orto e, em quantidades ínfimas, o produto em meta (figura 5).
ESTRATÉGIAS DE SÍNTESE DE BENZENOS SUBSTITUÍDOS
Para realizarmos a síntese de derivados benzênicos substituídos é necessário o planejamento da reação para garantir que o padrão de substituição desejado seja obtido. Nesse planejamento, é importante analisar os seguintes fatores:
- Posição desejada dos substituintes;
- A ordem de entrada de cada substituinte, considerando se é ativador ou desativador do anel aromático;
- Se o substituinte orienta orto/para ou meta;
- Se existem outros produtos não desejados que podem ser formados, diminuindo o rendimento e a eficiência da reação;
- Se há possibilidade da ocorrência das interconversões dos grupos substituintes, a fim de controlar melhor as reações.
Para entendermos melhor como isso funciona, vamos analisar exemplos de algumas sínteses.
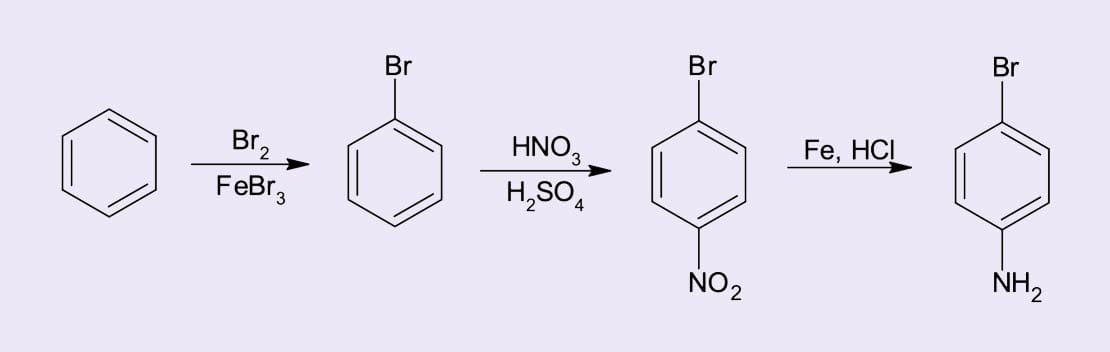
Síntese da p-bromo-anilina a partir do benzeno
O primeiro passo é identificar se vamos iniciar introduzindo o bromo ou a amina no benzeno. Na obtenção da p-bromo-anilina, tanto o bromo quanto a amina (NH2) são orientadores orto/para. Pensando na reatividade dos compostos benzênicos substituídos, qual grupo substituinte você adicionaria ao anel benzênico?
Amina
A amina é um ativador forte que favorece múltiplas SEAr. Por isso, se decidirmos partir da anilina para obtenção do p-bromo-anilina, antes da reação de bromação deveríamos converter o grupo amino em um grupo ativador moderado, como o N-acetil (acetilação da amina), para que a reação pudesse ser controlada mais facilmente e produtos polissubstituídos fossem evitados.
Bromo
O bromo é um substituinte desativante que orienta a reação nas posições orto e para. Isso quer dizer que o bromobenzeno é menos reativo frente a reações SEAr, o que possibilita menor formação de produtos polissubstituídos. Dessa forma, a rota mais eficaz para a obtenção do p-bromo-anilina seria: 1) bromação do benzeno para obtenção do bromobenzeno; 2) nitração do bromobenzeno para formação do para-bromo-nitro-benzeno; 3) redução do grupo nitro para a obtenção da para-bromoanilina (figura 6).
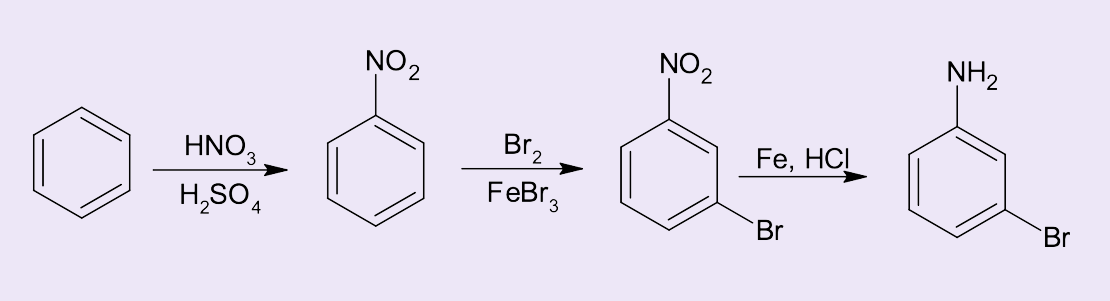
Síntese do m-bromoanilina
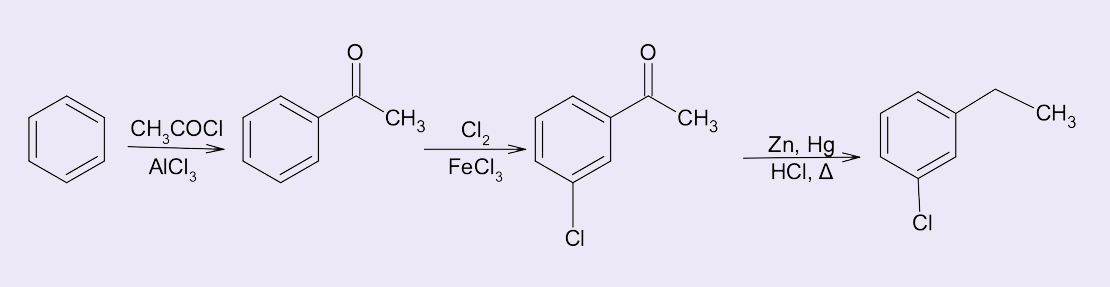
E o m-bromoanilina, como poderia ser obtido? Veja a figura 7. Uma vez que o grupo nitro é um desativante do anel benzênico e orienta reações do tipo SEAr em posição meta, para a síntese do m-bromo-anilina a rota sintética de escolha seria:
- Nitração do benzeno para a formação do nitrobenzeno.;
- Bromação para a obtenção do m-bromo-nitrobenzeno; e
- Pela redução do grupo nitro para formação da m-bromo-anilina.
Outro exemplo de alteração da orientação do substituinte no anel benzênico é escolher entre utilizar derivados alquil ou carbonil, já que o primeiro é doador de elétrons fraco e orientador orto/para, e os grupos carbonílicos são retiradores de elétrons e orientadores meta (figura 8).
Anteriormente, vimos que para a inserção de grupos alquil nos aromáticos a reação de escolha deve ser a acilação de Friedel-Crafts para evitarmos subprodutos de rearranjo ou polialquilações das alquilações de Friedel-Crafts, e que os derivados carbonílicos são convertidos a grupos alquila por meio da reação de redução de Clemmensen. Em contraposição, os derivados alquílicos podem ser oxidados nos seus respectivos derivados carbonílicos na presença de CrO3 e ácido sulfúrico.
Agora vamos planejar a síntese 1-cloro-3-etil-benzeno (figura 9). Mas por onde começar?
Pensando nas possibilidades mais triviais, que envolvem a inserção direta dos grupos substituintes, temos as seguintes situações:
Iniciar pela introdução do cloro – trata-se de um orientador orto/para; se o primeiro produto a ser obtido for o clorobenzeno, não será possível obter a segunda substituição na posição meta.
Iniciar pela ligação do grupo etila – os alquil também são orientadores orto/para.
Uma vez que os substituintes do produto desejado estão em posição meta, nenhuma dessas opções é viável. Então, vamos obter um padrão de substituição meta?
Uma rota possível é iniciarmos a síntese pela inserção de um grupo acila, que é um desativante (o que torna a reação mais controlável) e orientador meta e, depois de adicionado o cloro, interconvertê-lo em um grupo alquil. Assim, a síntese teria as seguintes etapas:
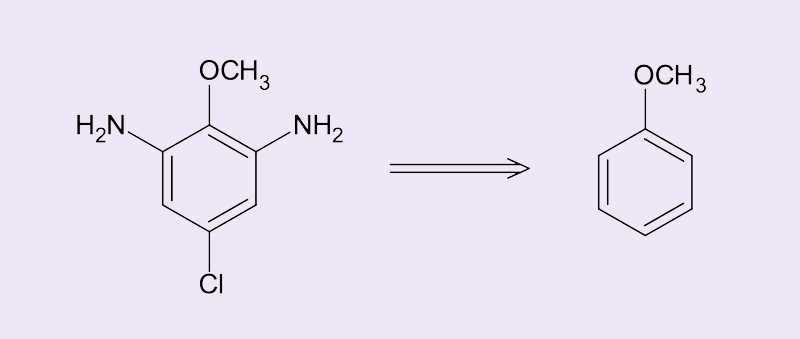
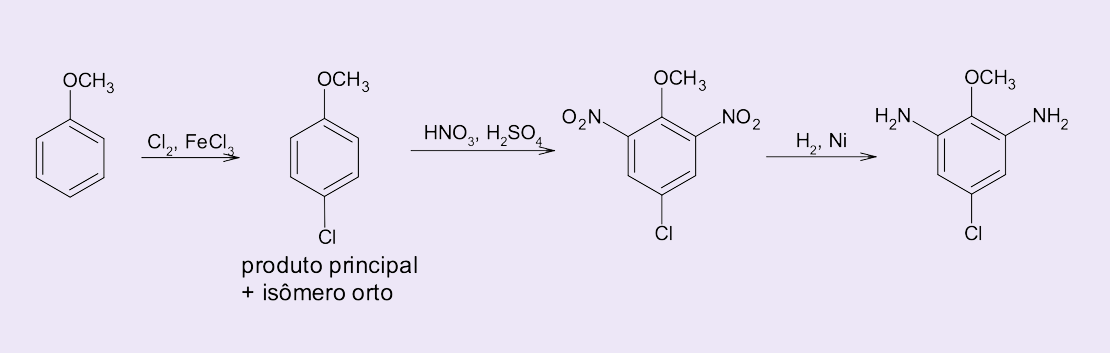
Por fim, como sintetizar de forma seletiva o 5-cloro-2-metoxi-1,3-benzenodiamina a partir do metoxibenzeno?
Para a obtenção desse produto, vamos pensar na síntese “de trás pra frente”, estudo chamado de retrossíntese (figura 10). Observe que a seta dupla demonstra esse processo, o que nos possibilita verificar as etapas necessárias para obter o produto a partir do substrato.
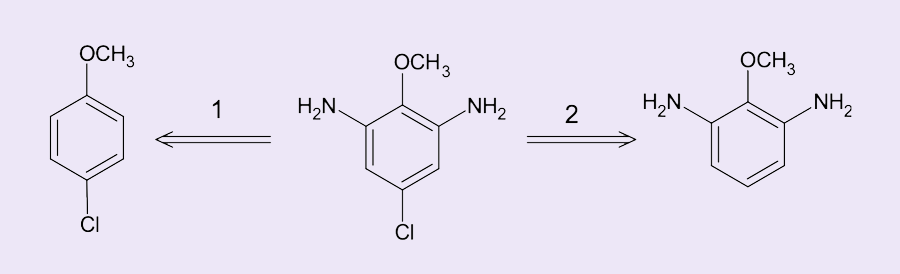
Temos duas opções (figura 11):
1) iniciar pela inserção do átomo de cloro; ou
2) iniciar pela inserção dos grupos aminas – que são obtidos a partir de grupos nitro.
Vamos analisar qual seria o substrato ideal para iniciarmos a reação:
Sentido 2 da seta:
O grupo metoxi (-OCH3) é um ativador do anel benzênico para SEAr e um orientador orto/para volumoso. Nesses casos, introduzir substituintes na posição orto sem inserção na posição para é um processo complexo, apenas favorecido em situações muito específicas pela formação de assistência através de interações intramoleculares, como pontes de hidrogênio. Assim, a etapa 2 é menos viável, pois o primeiro substituinte a ser inserido no metoxi-benzeno formará uma mistura de produtos orto/para.
Sentido 1 da seta:
Ao submetermos o metoxi-benzeno à reação de cloração, o principal isômero formado será o p-cloro-metoxibenzeno devido ao impedimento estérico do grupo metóxi, que desfavorece a substituição em orto. Assim, depois dessa etapa seria possível realizar a reação de nitração e redução dos grupos nitro para obtenção das aminas.
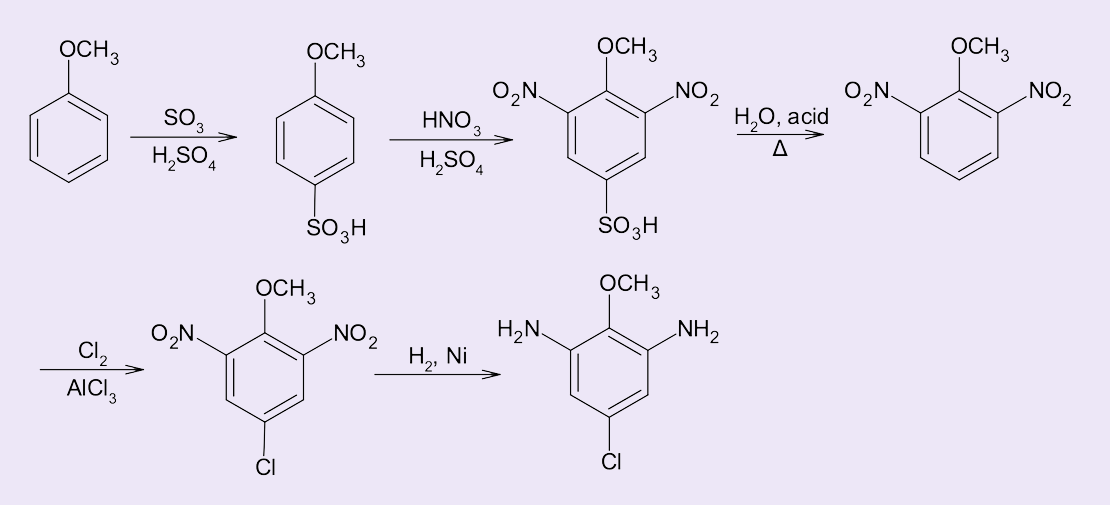
Mas se desejarmos uma síntese com maior regiosseletividade podemos utilizar o recurso da sulfonação reversível. A introdução do grupo ácido sulfônico protege a posição para inicialmente – como o SO3H é mais volumoso do que o cloro, o produto orto praticamente não é formado. A rota sintética a seguir (figura 13) demonstra a síntese regiosseletiva do 5-cloro-2-metoxi-1,3-benzenodiamina.
O EFEITO DOS SUBSTITUINTES NA REATIVIDADE E REGIOSSELETIVIDADE DOS DERIVADOS DO BENZENO
Assista ao vídeo em que a especialista explica de forma resumida o efeito dos substituintes na reatividade e regiosseletividade dos derivados do benzeno.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Como vimos neste tema, os aromáticos e derivados de benzeno são compostos orgânicos de grande relevância, não apenas para a síntese orgânica geral, mas de muito interesse para farmacêuticos e químicos que atuam na obtenção de substâncias biologicamente ativas. A maioria dos fármacos são derivados aromáticos e entender bem essa classe de compostos, sua reatividade e características é fundamental. A principal reação é a substituição eletrofílica aromática (SEAr) utilizada para a introdução de vários grupos funcionais no anel aromático e estes ainda podem ser transformados quimicamente para gerar uma infinidade de moléculas. Vimos também que, para sintetizarmos um composto benzênico polissubstituído é preciso levar em consideração diversos fatores, tais como: natureza ativante ou desativante do substituinte e como este interfere em substituições eletrofílicas subsequentes.
Podcast
Agora, a especialista Gabriela Barbosa encerra o tema relembrando alguns pontos importantes sobre compostos aromáticos: características e reações.
CONQUISTAS
Você atingiu os seguintes objetivos:
Compreendeu o conceito de aromaticidade, bem como a estrutura, a estabilidade, as propriedades físicas e a nomenclatura de arenos, do benzeno e de seus derivados.
Reconheceu os princípios mecanísticos das principais reações de substituição eletrofílica em aromáticos (SEAr) do benzeno: nitração, sulfonação e halogenação.
Reconheceu os princípios mecanísticos da síntese de alquilbenzenos por acilação-redução e o efeito dos substituintes na reatividade de compostos aromáticos substituídos.
Descreveu o efeito dos substituintes na regiosseletividade das sínteses de compostos aromáticos com múltiplos substituintes.