Definição
Princípios das Análises Volumétricas. Titulação ácido-base. Titulação de complexação. Titulação por oxidação e redução.
Titulação por precipitação. Análises Gravimétricas.
PROPÓSITO
Compreender que os fundamentos conceituais, cálculos e as aplicações das análises volumétricas e gravimétricas são de grande importância no ramo da química analítica, uma vez que essas técnicas são amplamente aplicadas na determinação quantitativa de analitos em diferentes tipos de amostras, dentre elas: alimentos, medicamentos e cosméticos.
Preparação
Antes de iniciar o conteúdo deste tema, tenha em mãos uma calculadora científica ou a própria calculadora de seu smartphone/computador. Além disso, utilize a tabela potencial padrão de redução (Eo), facilmente encontrada na internet.
OBJETIVOS
Módulo 1
Identificar os fundamentos gerais das análises químicas aplicados à análise volumétrica ácido-base
Módulo 2
Reconhecer os conceitos das análises volumétricas por complexação e oxidação -redução
Módulo 3
Definir os conceitos e aplicações da análise volumétrica por precipitação e gravimétricas
Introdução
Os métodos clássicos são aqueles em que as análises químicas são feitas utilizando vidrarias de precisão e soluções padrão, sem que haja necessidade de equipamentos de alto custo. A titulação, juntamente com a gravimetria, são importantes técnicas utilizadas na química analítica quantitativa. São métodos baratos, de fácil realização e que, na maioria dos casos, apresentam exatidão e precisão elevadas. É por esses motivos que, em muitos casos na rotina laboratorial, eles não perderam lugar para métodos mais sofisticados e complexos.
Neste tema, você terá a oportunidade de conhecer os princípios gerais das análises volumétricas. Esses princípios serão aplicados nos diferentes tipos de titulação que veremos ao longo do conteúdo (neutralização, complexação, oxirredução e precipitação). Abordaremos também os princípios das análises gravimétricas e suas aplicações.
MÓDULO 1
Identificar os fundamentos gerais das análises químicas aplicados
à análise volumétrica ácido-base
Princípios e definições gerais das análises volumétricas
A análise volumétrica, análise titrimétrica ou ainda, titulação corresponde à análise química quantitativa cujo sinal analítico é o volume de uma solução com concentração conhecida e bem definida necessário para consumir todo o analito presente na solução amostra que está sendo titulada. É importante destacar que, para que a quantidade do analito seja determinada, a reação entre titulante e analito, bem como sua estequiometria, deve ser conhecida.
Solução padrão
Uma solução padrão ou solução padronizada corresponde a um reagente com concentração conhecida. A concentração dessa solução, geralmente, é expressa em quantidade de matéria (mol) por volume. Em muitos casos, a solução padrão é preparada em uma concentração um pouco maior a fim de, posteriormente, promover a diluição até atingir a concentração desejada.
Podemos calcular a diluição aplicando a equação abaixo:
A solução padrão pode ser obtida por um padrão primário ou por um padrão secundário.
Vamos conhecer a diferença entre estes padrões.
É um composto de alta pureza e estabilidade que permite o preparo de uma solução por pesagem direta e diluição até volume determinado. São requisitos necessários para um padrão primário:
- Elevada pureza (impureza entre 0,01 a 0,02%), facilidade em purificar e secar entre 110 e 120 ⁰C;
- Em contato com a atmosfera, deve permanecer inalterada, ou seja, não deve oxidar ou absorver água (higroscópica);
- Deve possuir elevada massa molecular, pois isso minimiza os erros de pesagem;
- Deve ser solúvel no sistema reacional;
- De baixo custo;
- A reação do padrão primário com o reagente que está sendo titulado deve ser estequiométrica e instantânea.
Exemplos de padrões primários, o carbonato de cálcio, biftalato de potássio, ácido benzoico, tetraborato de sódio, ácido sulfâmico, hidrogenoiodato de potássio, oxalato de sódio, dicromato de potássio, nitrato de chumbo e óxido de arsênio (III).
É um composto que pode ser aplicado na titulação mediante estabelecimento prévio de sua concentração. Os mais utilizados são os hidróxidos de metais alcalino, a maior parte dos ácidos, permanganato de potássio, tiossulfato de sódio e tiocianato de potássio.
Cálculos volumétricos
Os cálculos aplicados nas análises volumétricas são baseados na quantidade de matéria (mol e mmol) ou concentração molar dos dois compostos que participam da reação. Vamos utilizar as seguintes equações para calcular a quantidade de matéria de um composto X.
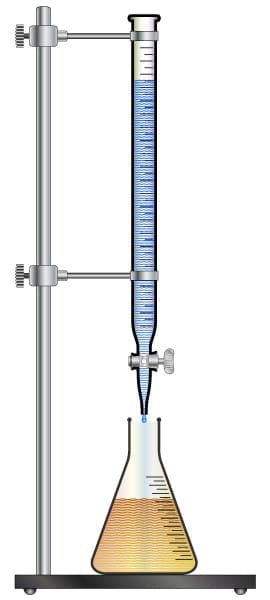
A solução de concentração conhecida na análise titulométrica é denominada titulante e a substância que contém o analito é chamada de titulado.
|
A solução titulante é adicionada ao titulado com a ajuda de uma bureta. |
|
A titulação inicia-se com a adição do titulante lentamente ao titulado. |
|
O final do processo, é detectado por alteração da cor ou formação do precipitado (turbidez). |
|
O ponto em que essas mudanças são observadas é chamado de ponto final da titulação. |
|
Em uma titulação ideal, o ponto final coincide com o ponto final estequiométrico ou ponto final teórico ou ponto de equivalência. |
|
O ponto estequiométrico ocorre quando a reação química se completa. |
Veja um arranjo experimental para a análise de titulação.
Titulação ácido-base
O caráter ácido ou básico das substâncias, assim como seus equilíbrios químicos em meio aquoso, ocupa um papel especial nas áreas das ciências biológicas e da saúde que abrangem processos químicos. Nas ciências farmacêuticas, por exemplo, essas substâncias merecem destaque, uma vez que grande parte dos medicamentos apresenta caráter ácido ou básico.
A titulação ácido-base busca determinar a quantidade do constituinte presente na amostra que possui propriedade ácida ou básica por meio da sua reação com um reagente padrão de característica oposta (analito ácido é titulado por solução padrão básica e analito básico é titulado por solução padrão ácida). O final da titulação é estabelecido por mudanças físico-químicas (geralmente, alteração de cor) promovidas por indicadores ou por meio de métodos instrumentais.
Indicadores ácido-base
Os indicadores são substâncias que mudam de cor conforme a concentração dos íons hidrônio (H3O+). A mudança de cor observada do meio ácido para o meio básico ocorre dentro de uma faixa de pH, denominado faixa de viragem do indicador. Se essa faixa de mudança de cor incluir o ponto de equivalência, o indicador poderá fornecer um meio rápido e fácil de observar o ponto final da titulação ácido-base.
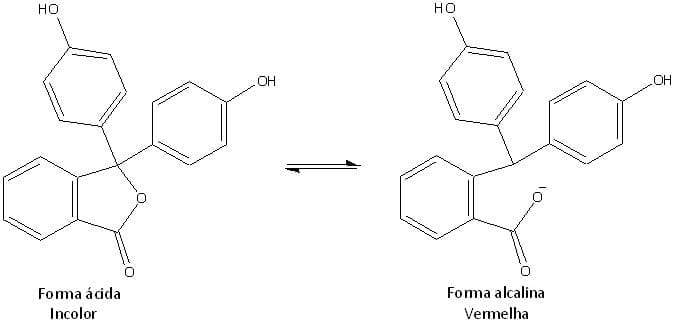
Um indicador ácido-base é em geral uma substância orgânica, sensível à variação de pH, que constitui um ácido fraco. A forma ácida do composto (HInd) tem uma cor, e a base conjugada (Ind-) outra cor.
Neste caso, as alterações estruturais internas acompanham a dissociação e causam a mudança de cor. Veja a mudança que ocorre na estrutura do indicador mais aplicado em titulações ácido-base, a fenolftaleína.
De acordo com o princípio de Le Chatelier, a alteração da cor será provocada pela adição dos íons hidrônio e hidroxila.
Atenção
Então, neste caso, é importante que se escolha um indicador com Kind conhecido. É importante que se escolha um indicador com pKind próximo ao pH do ponto de equivalência da titulação.
A fenolftaleína é incolor em meio ácido e vermelha em meio básico, sua mudança de cor ocorre na faixa de pH de 8,0 a 10,0. Na reação entre um ácido e uma base forte, o produto formado é um sal neutro e o pH resultante é 7,0. Então, por que podemos usar a fenolftaleína em uma titulação entre um ácido e uma base forte?
Sabemos que a expressão de Kind de um indicador é .
Logo, a . Em princípio, a cor do indicador é alterada quando a , pois, neste ponto, a . Logo, podemos pensar que será possível determinar exatamente a concentração de pela observação da cor.
Na prática, a nossa visão não é capaz de observar este ponto. Só percebemos a cor do HInd quando a razão [HInd]/[Ind-] ≥10 e a cor do Ind- quando a razão [HInd]/[Ind-]≤ 1/10, ou seja, só percebemos a cor sobre um intervalo de 100 unidades de [H3O+], o que corresponde a 2 unidades de pH. O que não é um problema, pois a variação do pH pode chegar a 7 unidades ao passar pelo ponto de equivalência.
Observe na Tabela 1 os principais indicadores usados nas titulações ácido-base.
Tabela 1. Exemplos de indicadores para titulações ácido-base.
|
Indicador |
Faixa de pH de viragem |
Mudança de cor |
|---|---|---|
|
Azul de timol |
1,2 – 2,8 |
Vermelho → Amarelo |
|
Timolftaleína |
9,4 – 10,6 |
Incolor → Azul |
|
Fenolftaleína |
8,0 – 9,6 |
Incolor → Vermelho |
|
Vermelho de metila |
4,4 – 6,2 |
Vermelho → Amarelo |
|
Alaranjado de metila |
3,1 – 4,4 |
Vermelho → Amarelo |
|
Amarelo de metila |
2,9 – 4,0 |
Vermelho → Amarelo |
|
Verde de bromo-cresol |
4,0 – 5,6 |
Amarelo → Azul |
|
Vermelho neutro |
6,8 – 8,0 |
Vermelho → Laranja |
|
Azul de bromo-fenol |
3,0 – 4,6 |
Amarelo → Azul violeta |
Como escolher o melhor indicador?
Se a concentração das soluções ≥ 0,1 M qualquer indicador na faixa de viragem entre 4,5 e 9,5 pode ser usado.
A faixa de pH de 8,0 a 10,5 cobre a maioria dos casos comumente encontrados.
Para bases com Kb > 10-5 a faixa de viragem é de 3,0 a 7,0 e, para bases mais fracas, entre 3,0 e 5,0.
Neste caso, não é possível o uso de um indicador simples, pois não existe aumento brusco na curva de neutralização. Uma alternativa é o uso de um indicado misto. Por exemplo, vermelho neutro com azul de metileno que é usado na titulação de amônia com ácido acético.
Construção de curvas de titulação ácido e base
Titulação de ácido forte com base forte
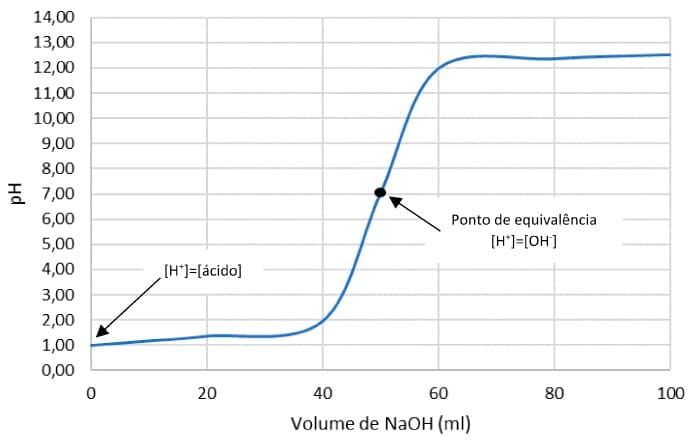
Na titulação do ácido clorídrico (HCl), um ácido forte, utilizando o hidróxido de sódio (NaOH), uma base forte, a resposta medida (pH) versus o volume do titulante adicionado ao longo do processo é chamado de curva de titulação ácido-base ou curva de neutralização.
A partir do exemplo a seguir, vamos construir a curva de titulação para um ácido forte e uma base forte.
Exemplo 1: Vamos construir a curva titulando o 50 mL de HCl a 0,1000 M com hidróxido de sódio a 0,1000 M.
O hidróxido de sódio deve estar previamente padronizado com biftalato de potássio 0,1000 M.
Calcular o pH do HCl antes da adição da base.
A reação de dissociação do ácido clorídrico: HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Logo, a [H3O+] = [HCl] = 0,1000 M
pH = -log [H3O+] = -log(0,1000) = 1,00
Calcular o pH do HCl depois da adição de 10, 20 e 40 mL de NaOH a 0,1000 M.
Para efetuarmos o cálculo após a adição de 10mL, usaremos a equação abaixo:
e o pH= -log(6,67 x 10-2) = 1,18.
Calcule você mesmo usando os volumes de 20 mL e 40 mL e compare com os resultados abaixo:
Com adição de 20 mL: [H3O+] = 4,29 x 10-2 M e pH = 1,37
Com adição de 40 mL: [H3O+] = 1,11 x 10-2 M e pH = 1,95
Calcular o pH no ponto de equivalência, adição de 50 mL de hidróxido de sódio. Neste ponto, ocorre a reação completa entre o ácido forte e a base forte. O pH é 7,00.
Calcular o pH após a adição de 60, 80 e 100mL de NaOH a 0,1000 M.
Para efetuarmos o cálculo com excesso de base usaremos a equação abaixo:
pOH = -log(9,09x10-3) = 2,04
pH = 14,00 – 2,04 = 11,96
Vamos praticar?
Com adição de 80 mL: [HO-] = 2,31x10-2 M; pOH = 1,64 e pH = 12,36.
Com adição de 100 mL: [HO-] = 2,50 x10-2 M; pOH = 1,60 e pH = 12,40.
O ponto de equivalência de uma titulação ácido-base localiza-se no ponto médio da parte vertical da curva de pH. Observe os resultados dos cálculos na curva de neutralização de um ácido forte e base forte.
Atenção
Em titulações entre ÁCIDO e BASE FORTES, o pH do ponto de equivalência SEMPRE será 7.
Observe que, nas curvas de titulação, existem três regiões importantes:
|
1) Antes do ponto de equivalência, onde predomina as características químicas do titulado |
|
2) Ponto de equivalência, onde todo analito foi consumido pelo titulante |
|
3) Depois do ponto de equivalência, onde predomina as características do titulante. |
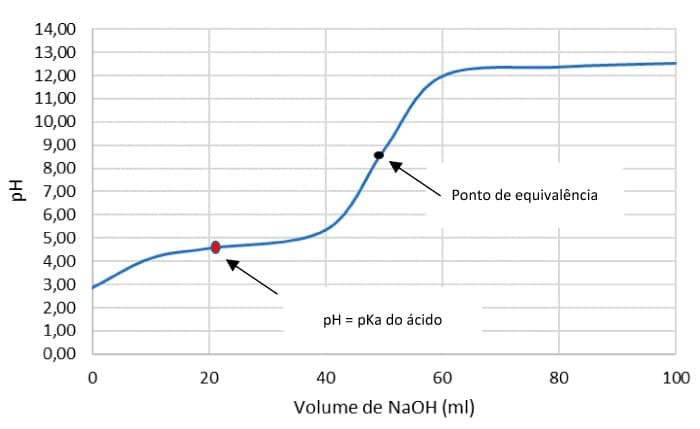
Titulação de ácido fraco com base forte
Exemplo 2: Vamos efetuar os cálculos para a titulação de um ácido fraco por uma base forte.
Observaremos um comportamento diferente da titulação daquele visto para um ácido e base fortes. Considere, por exemplo, a titulação de 50 mL de ácido acético (CH3COOH) a 0,1000 M com hidróxido de sódio a 0,1000 M. Ka = 1,80 x 10-5.
Calcular o pH do ácido antes da adição da base.
A reação de dissociação do ácido acético: CH3COOH(aq) + H2O(l) ⇌H3O+(aq) + CH3COO-(aq)
No equilíbrio:
pH = -log[H3O-] = -log(1,34x10-3) = 2,87
Calcular o pH após a adição de 10, 20 e 40 mL de NaOH a 0,1000 M.
Nesta etapa, ocorrerá a formação de um tampão acetato de sódio/ácido acético.
pH = -log[H3O+] = -log(7,19x10-5) = 4,14
Agora é sua vez! Utilize os volumes de 20 mL e 40 mL e compare com os resultados a seguir:
Com adição de 20 mL: [H3O+] = 2,70x10-5 M e pH = 4,57
Com adição de 40 mL: [H3O+] = 4,5x10-6 M e pH = 5,35
No ponto de equivalência, todo o ácido acético foi convertido em acetato de sódio. Portanto, a solução é similar àquela formada pela dissolução do sal em água.
A reação de dissolução do acetato de sódio: CH3COONa(aq) + H2O(l) ⇌ CH3COOH(aq) + OH-(aq)
pOH = -log[HO-] = -log(5,27x10-6) = 5,28
pH = 14,00 - 5,28 = 8,72
Calcular o pH após adição de 60, 80 e 100mL de NaOH a 0,1000 M.
pOH = -log(9,09x10-3) = 2,04
pH = 14,00 – 2,04 = 11,96
Agora pratique com os volumes 80 mL e 100 mL e compare com os resultados abaixo:
Com adição de 80 mL: [HO-] = 2,31x10-2 M; pOH = 1,64 e pH = 12,36.
Com adição de 100 mL: [HO-] = 3,33x10-2 M; pOH = 1,48 e pH = 12,52.
O ponto de equivalência de uma titulação ácido-base se localiza no ponto médio da parte vertical da curva de pH. Observe os resultados dos cálculos na curva de neutralização de um ácido fraco e base forte.
Perceba que o perfil da curva de titulação da Figura 4 é diferente do perfil da curva de titulação entre ácido e base fortes. Além do ponto de inflexão referente ao ponto de equivalência (neste caso, o pH é diferente de 7), a curva de neutralização ácido fraco x base forte apresenta um outro ponto de inflexão que é observado quando o pH do meio titulado se iguala ao valor do pKa do ácido.
Nas proximidades desta região, observamos que a adição do titulante provoca pouca variação de pH. Por que isso acontece?
Neste momento da titulação, um sistema tampão com capacidade máxima é formado do meio - lembre-se de que um sistema tampão atinge sua capacidade máxima quando as concentrações do ácido e sua base conjugada são iguais e, consequentemente, o pH = pKa.
Assim, as adições do titulante são “neutralizadas” pelos constituintes do sistema tampão formado e impede variações bruscas de pH.
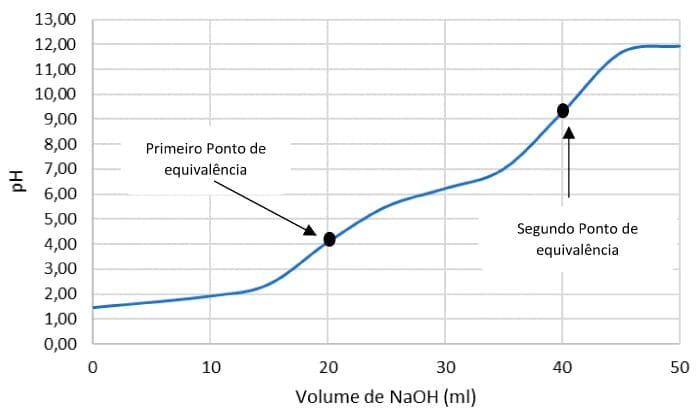
Titulação de ácido poliprótico
Um ácido poliprótico reage com uma base de acordo com a quantidade de hidrogênios ionizáveis. A curva de titulação dependerá das constantes de dissociação. Vamos, por exemplo, analisar a titulação de 10 mL de uma solução de ácido maleico a 0,1000 mol/L com hidróxido de sódio a 0,0500 mol/L.
Dissociação do ácido maleico:
HOOC-CH=CH-COOH ⇌ HOOC-CH=CH-COO- + H+ Ka1 = 1,20 x 10-2
HOOC-CH=CH-COO- ⇌ -OOC-CH=CH-COO- + H+ Ka2 = 6,00 x 10-7
Calcular o pH do ácido antes da adição da base.
No equilíbrio:
pH = -log[H3O+] = -log(3,46x10-2) = 1,46
Calcular o pH após a adição de 10 mL de NaOH a 0,0500 M. Este ponto corresponde a 50% da titulação do primeiro ponto de equivalência. Então, pH será igual a pKa1. Aplicamos a equação de Henderson-Hasselbalch.
pH = pKa = -log(1,2x10-2) = 1,92
No primeiro ponto de equivalência, após a adição de 20 mL de NaOH, todo o ácido maleico terá sido convertido em sua base conjugada (HOOC-CH=CH-COO-) que irá sofrer mais reações com a adição de mais base. O primeiro ponto de equivalência será dado por:
Após adicionar 30 mL de NaOH, a metade do HOOC-CH=CH-COO- formado na primeira titulação foi convertido a
-OOC-CH=CH-COO-. Neste ponto, o pH será igual ao pKa2.
pH = pKa = -log(6,0x10-7) = 6,22
No segundo ponto de equivalência, após a adição de 40 mL de NaOH, todo HOOC-CH=CH-COO- formado na primeira titulação foi convertido a -OOC-CH=CH-COO-. O segundo ponto de equivalência será dado por:
pOH = -log(1,83x10-5) = 4,74
pH = 14,00 - 4,74 = 9,26
Ao adicionarmos 50 mL de NaOH, teremos um excesso do titulante, o pH será determinado pela concentração de NaOH em excesso.
pOH = -log(8,33x10-3) = 2,08
pH = 14,00 – 2,08 = 11,92
O ponto de equivalência de uma titulação ácido-base se localiza no ponto médio da parte vertical da curva de pH. Observe os resultados dos cálculos na curva de neutralização de um ácido poliprótico com uma base forte.
Erro de titulação
Teremos o erro indeterminado, que é originado pela habilidade limitada da nossa visão em distinguir de modo reprodutivo a cor intermediária do indicador. Essa incerteza pode ser minimizada pela comparação da solução que está sendo titulada com um padrão de referência.
O outro tipo de erro é denominado determinado e ocorre quando o pH no qual o indicador não corresponde ao pH do ponto de equivalência. Esse erro pode ser minimizado com a escolha certa do indicador ou pela correção com um branco.
O ponto final da titulação é a estimativa experimental do ponto de equivalência. A diferença entre a quantidade do titulante necessária para chegar à equivalência real e o ponto final é chamada de erro da titulação.
VPF = volume de titulante necessário para se alcançar o ponto final.
VPE = volume de titulante necessário para se alcançar o ponto de equivalência real.
Exemplo
Vamos calcular o erro para a titulação de 50 mL de HCl a 0,1000 mol/L com hidróxido de sódio a 0,1000 mol/L, visto na titulação de um ácido forte com uma base forte, utilizando a fenolftaleína como indicador. O pH desse indicador está acima do ponto de equivalência e, neste caso, teremos um excesso de base forte. O volume de base necessário para que o pH da solução seja 8,80 será:
[OH-] = 10-pOH = 10-(14,00-8,80) = 10-5,20 = 6,31 x 10-6M
Assista ao vídeo a seguir onde serão realizados cálculos e a construção de curvas de titulação utilizando o programa Excell ®.
Curvas de Titulação
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer os conceitos das análises volumétricas por complexação
e oxidação -redução
Reações de complexação
Os complexos são compostos formados pela reação entre um ácido e uma base de Lewis. No contexto das titulações complexométricas, de forma geral, o analito é um metal (o ácido de Lewis) e o titulante é um agente complexante ou quelante (a base de Lewis).
Vejamos como isso acontece tomando como modelo a titulação complexométrica, que tem como titulante o EDTA.
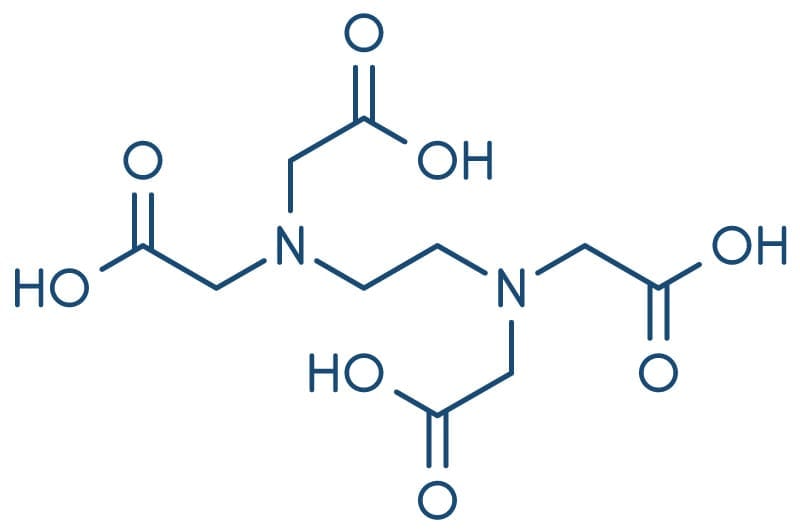
Titulação complexométrica com EDTA (ethylenediamine tetraacetic acid ou ácido etilenodiamino tetracético)
A fórmula estrutural do EDTA é:
É um ácido tetraprótico (H4Y) que possui seis sítios ativos para ligações com íons metálicos, quatro grupos carboxílicos e dois grupos amino, sendo classificado como um ligante hexadentado. O ácido é pouco solúvel em água, mas seu sal (Na2H2Y) é solúvel e o mais usado.
Este agente complexante reage com metais na relação molar de 1:1 conforme as reações genéricas abaixo:
M+ + H2Y2- ⇌ MY4- + 2 H+ K1 = 1,02 x 10-2
M2+ + H2Y2- ⇌ MY2- + 2 H+ K2 = 2,14 x 10-3
M3+ + H2Y2- ⇌ MY- + 2 H+ K3 = 6,92 x 10-7
M4+ + H2Y2- ⇌ MY + 2 H+ K3 = 5,50 x 10-11
O controle do pH é fundamental, pois dele depende o grau de ionização dos grupos ácidos do EDTA e o complexo a ser formado. A Tabela 2 apresenta a espécie de EDTA em função do pH e os metais que podem formar complexos.
Tabela 2. Espécie de EDTA em função do pH e os metais que podem formar complexos.
|
pH |
Espécie do ácido |
Metais selecionados |
|---|---|---|
|
1,0 – 3,0 |
H3Y- / H2Y2- |
Zn4+, Th4+, Bi3+, Fe3+ |
|
3,0 – 6,0 |
HY3- / H2Y2- |
Al3+, Cd2+, Sn2+, Pb2+, Cu2+, Zn2+, Co2+, Ni2+, Mn2+, Fe2+ |
|
6,0 – 10,0 |
HY3- / H2Y2- / Y4- |
Ca2+, Sr2+, Ba2+, Mg2+ |
Curvas de titulação com EDTA
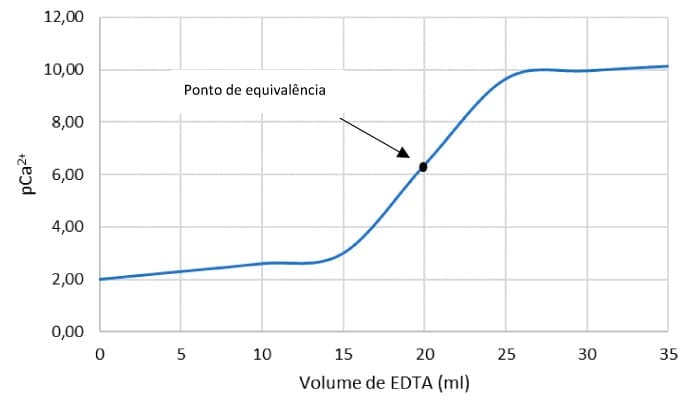
Vamos construir, analogamente, a titulação de ácido forte com base forte, a curva de titulação usando como agente titulante o EDTA a 0,0050 M e 10 mL de uma solução contendo íons Ca2+ a 0,0100 M em pH 10,0.
Reação da titulação: Ca2+ + EDTA ⇌ CaY2- Kf,ML = 1,75x1010
Concentração dos íons cálcio antes da adição do EDTA.
[Ca2+] = 0,0100 M
pCa2+ = -log[Ca2+] = -log(0,01) = 2,00
Concentração dos íons cálcio ao adicionar 5, 10 e 15 mL EDTA.
pCa2+ = -log[Ca2+] = -log(5,00x10-3) = 2,30
Agora é com você! Faça os cálculos para a adição dos volumes 10 mL e 15 mL e compare com os resultados abaixo:
Com adição de 10 mL: pCa2+ = 2,60.
Com adição de 15 mL: pCa2+ = 3,00.
No ponto de equivalência, após a adição de 20 mL de EDTA.
pCa2+ = -log[Ca2+] = -log(4,36x10-7) = 6,36
Ao adicionarmos 30 mL de EDTA.
pCa2+ = -log[Ca2+] = -log(1,14x10-10) = 9,94
O ponto de equivalência se localiza no ponto médio da parte vertical da curva de pCa2+. Veja os resultados dos cálculos na curva de titulação do Ca2+ com EDTA.
Mascaramento e desmascaramento
É um processo no qual uma substância é transformada impedindo a sua participação na titulação sem que seja separada fisicamente da solução do analito. Essa transformação se dá através de um agente complexante com a função de reagir seletivamente com a espécie química que desejamos impedir a participação da reação de titulação.
Exemplo
Emprego do fluoreto como agente complexante para evitar que o Fe3+ reaja com o EDTA durante a determinação do Ca2+ na análise de dureza da água.
Assim como podemos mascarar uma substância, também podemos desmascarar caso seja de interesse a análise da substância.
Se desejamos analisar Ca2+ e Zn2+ utilizando o EDTA. Podemos utilizar o cianeto para formar complexo com Zn2+ e analisar o Ca2+. Após a análise do cálcio, o zinco poderá ser liberado do complexo com cianeto utilizando formaldeído (CH2O). O formaldeído tem a função de reagir com o cianeto liberando o zinco para análise.
Indicadores complexométricos
O método mais usual para detectar o ponto final da titulação complexométrica é utilizando indicadores denominados de metalocrômicos. Esses indicadores devem ser sensíveis aos íons metálicos, específicos ou, pelo menos, seletivos. A mudança de cor no ponto final deve ser de fácil observação. A reação abaixo apresenta o ponto final de uma titulação aplicando um indicador metalocrômico.
M-Ind + EDTA ⇌ M-EDTA + Ind
(Cor A) (Cor B)
O indicador metalocrômico mais importante é o Negro de Eriocromo T, conhecido como NET ou Erio T, que forma um complexo vermelho-vinho com os íons cálcio e magnésio e no ponto de equivalência apresenta a cor azul, forma livre do indicador. Outros indicadores aplicados na volumetria de complexação são: a murexida, calmagite e pirocatecol violeta.
Titulação por oxidação-redução
Para iniciarmos o estudo sobre a análise volumétrica, redox ou análise volumétrica de oxidação-redução, vamos relembrar alguns conceitos sobre a reação de oxidação e redução (oxirredução). Em uma reação de oxirredução, ocorre simultaneamente a oxidação de uma espécie química e a redução da outra espécie, ou seja, ocorre a perda e ganho de elétrons.
Esta reação ocorre em muitos processos do nosso cotidiano, tal como: combustão, respiração, corrosão, fotossíntese entre outros.
Na química analítica quantitativa, aplicamos a reação redox nos métodos clássicos e nos métodos instrumentais. Uma análise que pode ser realizada, tanto pelo método clássico, como pelo instrumental é a demanda química de oxigênio, DQO. Nesta análise, a amostra contendo o excesso de dicromato não reduzido pela oxidação da matéria orgânica, é titulado com sulfato ferroso amoniacal. A reação abaixo apresenta a etapa da titulação desta análise.
┎━━━━━━━━━━━┒
Cr2O72- + 6 Fe2+ + 14 H+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
┖━━━━━━━━━━━┚
Nesta reação, podemos observar que o Cr6+ do dicromato (Cr2O72-) ganha elétrons e é reduzido a Cr3+ e o Fe2+ perde um elétron e é oxidado a Fe3+. Logo, a titulação redox é um método de volumetria que usa a reação de oxidação e redução. Os processos mais importantes dentro da titulação redox são:
Permanganimetria
Dicromatometria
Iodometria
Construção da curva de titulação redox
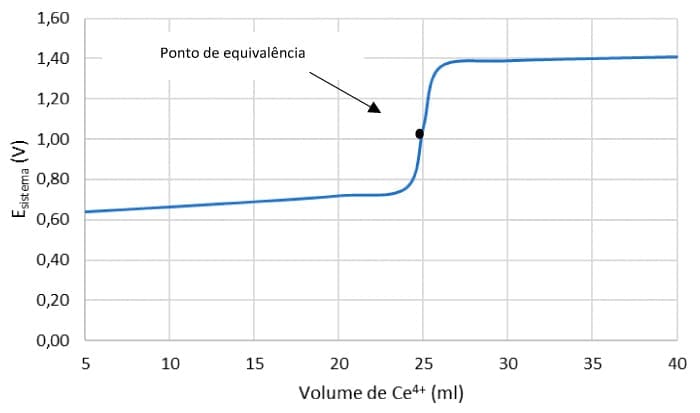
Para construirmos a curva de titulação redox, vamos considerar a titulação de 50 mL de uma solução de Fe2+ a 0,0500 mol/L por uma solução de Ce4+ com concentração de 0,1000 mol/L. A curva de titulação corresponde ao potencial do eletrodo (V) versus o volume de titulante, no nosso caso, o volume da solução de Ce4+.
Potencial antes da adição de Ce4+. Neste ponto, existe uma pequena concentração de Fe3+ inicial devido a oxidação do ferro em contato com o oxigênio da atmosfera. Mas, não temos essa informação e, por isso, não temos como calcular um potencial inicial.
Potencial após adicionar 5, 10 e 20 mL da solução de Ce4+. Quando adicionamos Ce4+ ocorre a oxidação do Fe2+. As reações são apresentadas abaixo:
Fe2+ ⇌ Fe3+ + e- E0 = -0,68V (0,5 M H2SO4)
Ce4+ ⇌ Ce3+ + e- E0 = +1,44V (0,5 M H2SO4)
No equilíbrio, a [Ce4+] é minúscula, então podemos fazer a aproximação.
Você pode praticar fazendo os cálculos para adição de 10 mL e 20 mL e comparando com os resultados abaixo:
Com adição de 10 mL: Esistema = + 0,67 V
Com adição de 20 mL: Esistema = + 0,72 V
No ponto de equivalência, após a adição de 25 mL de Ce4+.
Potencial após a adição 30 mL de Ce4+.
O ponto de equivalência localiza-se no ponto médio da parte vertical da curva. Veja o resultado dos cálculos no gráfico de E (V) versus volume de Ce4+.
Detecção do ponto final
Indicadores internos de oxidação e redução
Como vimos nos outros processos de titulação, o indicador de oxidação-redução também identificará a mudança brusca, neste caso, correspondente ao potencial, que ocorre nas vizinhanças do ponto de equivalência. A mudança do indicador deverá ser nítida e de fácil detecção. O indicador terá cor diferente na sua forma oxidada e na forma reduzida, conforme reação abaixo.
Ind + ne- ⇌ Indred
(Cor A) (Cor B)
Alguns indicadores que podem ser aplicados na titulação oxidação-redução: nitro-ferroína ou sulfato de 5-nitro-1,10-fenantrolina-ferro (II), ferroína ou sulfato de 1,10-fenantrolina-ferro (II), ácido N-fenil-antranílico, difenilamina, azul de metileno e amido-I3-/KI.
Reagentes autoindicadores
Um reagente autoindicador muda sua cor no ponto de equivalência e não há necessidade da adição de um indicador interno na titulação. Um exemplo de autoindicador é o permanganato de potássio, que imprime uma coloração rosa com apenas uma gota em várias centenas de mililitros de solução.
Padronização de soluções oxidantes e redutoras
Existe uma variedade de reagentes que podem ser aplicados em uma titulação redox e muitos métodos de preparo. No exemplo a seguir, você verá o preparo e padronização de uma solução de permanganato de potássio a 0,0200 M.
Vamos preparar e padronizar 500 mL de uma solução de permanganato de potássio a 0,0200 M. A solução será padronizada com 0,3 g de oxalato de sódio previamente seco a 105⁰C. O volume gasto de permanganato de potássio na titulação é de 45 mL.
O preparo da solução de permanganato requer processo de aquecimento e filtração. Primeiramente, vamos efetuar os cálculos necessários.
Calcular a massa de permanganato que devemos pesar em balança analítica.
Suponha que tenhamos pesado a massa de 1,5724 g em um vidro de relógio e transferido para um béquer de 1 litro. Adicionamos 500 mL de água, cobrimos com um vidro de relógio e aquecemos durante 30 minutos mantendo uma ebulição suave.
Deixamos esfriar até temperatura ambiente e filtramos a solução em cadinho filtrante de vidro sinterizado.
Armazenamos a solução em frasco âmbar em local livre da presença de luz.
Para a padronização, pesamos 0,3000g de oxalato de potássio e transferimos para Erlenmeyer de 500 mL. Adicionamos 240 mL de água destilada e 12,5 mL de ácido sulfúrico concentrado. O volume gasto de KMnO4 foi de 45 mL.
Reação: 2 MnO4- + 5 H2C2O4 + 6 H+ ⇌ 2 Mn2+ + 10 CO2 + 8 H2O.
Aplicações da titulação por complexação
e por oxidação-redução.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Definir os conceitos e aplicações da análise volumétrica
por precipitação e gravimétricas
Titulação argentimétrica
Esta técnica é empregada na determinação dos íons cloreto, brometo, iodeto, cianeto, cianato, mercaptanas, ácidos graxos e ânions bivalentes e trivalentes. Os métodos argentimétricos (ou argentimetria) recebem este nome porque tem como titulante solução padrão de nitrato de prata AgNO3. Eles podem ser são classificados como:
Construção da curva de titulação argentimétrica
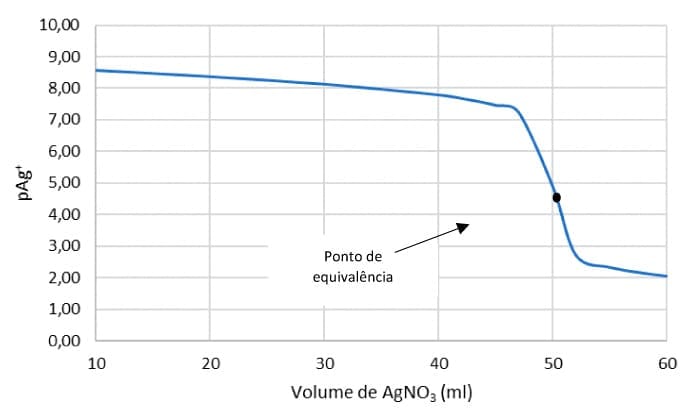
Vamos analisar a titulação de 50 mL de cloreto de sódio a 0,1000 M com nitrato de prata a 0,1000 M e construir uma curva correspondente a pAg versus o volume de nitrato de prata.
Reação da titulação: Ag+(aq) + Cl-(aq) ⇌ AgCl(s)
KpsAgCl = 1,77x10-10
Concentração dos íons prata antes da adição do nitrato de prata.
NaCl ⇌ Na+ + Cl-
Início: 0,1 mol/L 0,1 mol/L 0,1 mol/L
pCl- = -log[Cl-]= -log(0,1) = 1,0
pAg+ = 0,0
Concentração dos íons prata ao adicionar 10, 20, 30 e 40 mL de nitrato de prata.
Kps = [Ag+][Cl-]
1,77x10-10 = [Ag+] × 6,67x10-2
[Ag+] = 2,65x10-9M
pAg+ = -log[Ag+] = -log(2,65x10-9) = 8,58
Agora, repita os cálculos acima com os volumes de 20 mL, 30 mL e 40 mL e compare com os resultados abaixo:
Com adição de 20 mL: pAg+ = 8,38.
Com adição de 30 mL: pAg+ = 8,15.
Com adição de 40 mL: pAg+ = 7,80.
No ponto de equivalência, após a adição de 50 mL de nitrato de prata.
[Ag+] = [Cl-]
Kps = [Ag+]2
pAg+ = -log[Ag+] = -log(1,33x10-5) = 4,88
Ao adicionarmos 60 mL de AgNO3, teremos um excesso do titulante, o pAg+ será determinado pela concentração de AgNO3 em excesso.
pAg+ = -log[Ag+] = -log(9,09x10-3) = 2,04
O ponto de equivalência localiza-se no ponto médio da parte vertical da curva de pAg+. Veja o resultado dos cálculos no gráfico de pAg versus volume de nitrato de prata.
Detecção do ponto final da titulação argentimétrica
Apesar de existirem outras técnicas para a determinação do ponto final em titulações, o emprego de indicadores químicos é aquele que apresenta o menor custo e é a mais utilizada.
Em métodos argentimétricos em que um indicador químico é usado, o ponto final é produzido pelo aparecimento (ou desaparecimento) de coloração ou turbidez que deve acontecer de acordo com os seguintes critérios:
|
a) Em um intervalo limitado da concentração do reagente ou do analito (em termos da função p); |
|
b) Dentro da variação brusca de pAg ou pX nas proximidades do ponto de equivalência. |
Indicadores diferentes dão origem a métodos diferentes, que veremos a seguir.
É um método aplicado para a determinação dos íons cloreto e brometo usando cromato de potássio (K2CrO4) como indicador. A reação do indicador com os íons de prata forma um precipitado vermelho-tijolo de cromato de prata (Ag2CrO4) no ponto de equivalência. Na titulação ocorre, portanto, um processo de precipitação fracionada em que dois sais insolúveis são formados.
Reação com analito: Ag+ + Cl- ⇌ AgCl(s)
Reação com indicador: 2 Ag+ + CrO42- ⇌ Ag2CrO4(s)
O cloreto de prata é menos solúvel do que o cromato de prata. Logo, haverá a precipitação de todo o cloreto de prata e, em seguida, começará a precipitar o cromato de prata. A titulação deve ser realizada em meio neutro ou fracamente básico, ou seja, em pH entre 6,5 e 9,0. Se o pH for menor que 6,5 a concentração de íons cromato (CrO42-) será muito baixa devido a reação 2 CrO42- + 2H+ ⇌ Cr2O72- + H2O. Em pH maior que 9,0 ocorrerá a formação do precipitado de hidróxido de prata (AgOH).
É baseado na formação de um composto colorido para sinalização do ponto final. Consiste na determinação indireta de haletos em meio ácido. Envolve a titulação de íons prata com tiocianato (SCN-) para fornecer precipitado AgSCN. O indicador desta titulação é o nitrato de ferro (III) (Fe3+).
Reações durante o processo:
Ag+ + Cl- ⇌ AgCl(s)
(branco)
Ag+(excesso) + SCN- ⇌ AgSCN(s)
(branco)
SCN- + Fe3+ ⇌ [FeSCN]2+
(marrom-avermelhado)
O cloreto de prata é mais solúvel do que o tiocianato de prata e um problema que poderá ocorrer na titulação será a reação AgCl(s) + SCN- ⇌ AgSCN(s) + Cl- liberando os íons cloreto em solução.
Para evitar a liberação dos íons cloreto, podemos efetuar a filtração do cloreto de prata antes da titulação do excesso de prata; após a adição de nitrato de prata, podemos adicionar nitrato de potássio, que é um agente coagulante ou adicionar nitrobenzeno para cobrir as partículas do AgCl evitando a internação com tiocianato.
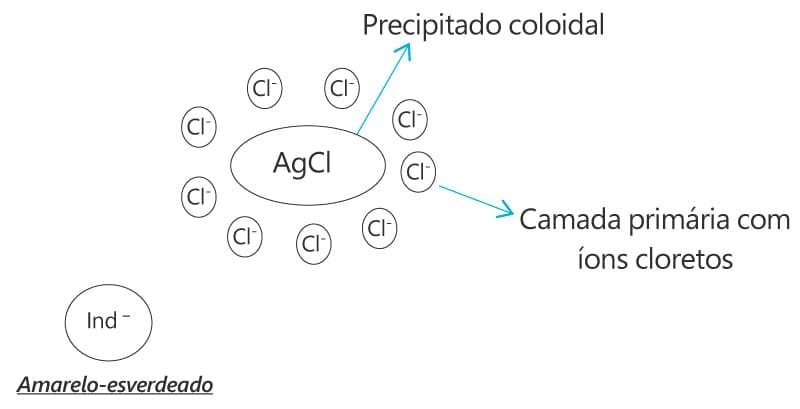
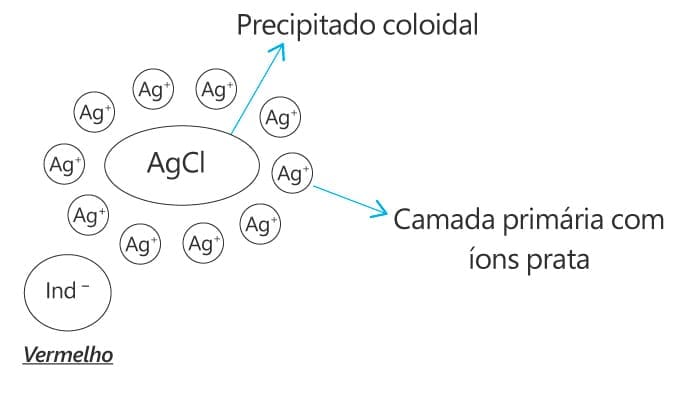
Este método baseia-se na detecção do ponto final por um corante carregado negativamente. No ponto de equivalência, o indicador é adsorvido pelo precipitado e o processo de adsorção promoverá mudanças no indicador e, consequentemente, mudança de cor.
Durante o processo de titulação, o precipitado terá uma carga líquida negativa até o ponto de equivalência em virtude do excesso de íons cloreto. Após o ponto de equivalência, as partículas de AgCl adsorvem fortemente o excesso de Ag+ adquirindo carga positiva. O indicador (fluoresceína, diclorofluoresceína ou tetrabromofluoresceína) é atraído pela camada de contra íons, o que altera a cor do precipitado de branco para rosa.
Análises Gravimétricas
Também denominada de gravimetria, é uma análise que se baseia nas relações estequiométricas da reação química para determinar a quantidade de um analito na amostra através da medição da massa.
São métodos para a realização da análise gravimétrica:
Gravimetria por precipitação
Gravimetria por volatilização
Eletrogravimetria
Todas têm como princípio a medição da massa. A gravimetria é aplicada na determinação de inúmeros cátions e ânions, por exemplo, o alumínio, níquel, sulfato e cloreto.
Gravimetria por precipitação
Este método é baseado na conversão do analito a um precipitado com baixa solubilidade que permita ser filtrado, lavado e convertido através da secagem a um produto de composição conhecida. As técnicas de filtração, lavagem do precipitado e secagem foram vistas na unidade de amostragem. Então, vamos estudar neste módulo sobre a natureza física dos precipitados os tipos de precipitados e influência na formação do precipitado.
Para ser aplicado na análise gravimétrica, o precipitado dever ser:
Suficientemente insolúvel, de fácil filtração e lavagem para remoção de impurezas.
Estável em contato com atmosfera e de composição conhecida.
Existem alguns fatores que são determinantes na formação do precipitado, tais como, o tamanho da partícula e o processo de filtração.
O tamanho das partículas no precipitado é influenciado pela solubilidade do sólido formado pela temperatura, pela concentração dos reagentes e pela velocidade na qual a formação se processa, ou seja, a velocidade com que o reagente de precipitação é adicionado. O efeito das variáveis pode ser estimado matematicamente pela equação abaixo.
Q = concentração do soluto em qualquer instante.
S = solubilidade no equilíbrio.
Se a supersaturação for grande, temos a tendência de formar precipitado coloidal e, se a supersaturação for pequena, provavelmente, ocorrerá a formação de um precipitado cristalino.
Precipitado coloidal
Possui partículas invisíveis a olho nu, que não decantam e não são facilmente filtradas.
Precipitado cristalino
É caracterizado pela formação de cristais bem desenvolvidos, densos e que se sedimentam rapidamente. Esse tipo de precipitado é filtrado facilmente e tem baixa probabilidade de adsorver impurezas.
Os precipitados são formados pelo processo de nucleação e crescimento da partícula. A nucleação é a etapa que envolve um número mínimo de átomos, íons ou moléculas que se unem para formar um sólido estável. Após a formação do núcleo, ocorre uma competição entre a nucleação adicional e o crescimento do núcleo já existente (partícula). Se a nucleação predominar, teremos a formação de muitas partículas muito pequenas e, se o crescimento predominar, teremos menos partículas de tamanho maior.
Experimentalmente, podemos aplicar algumas técnicas para promover o desenvolvimento de partículas cristalinas. Podemos:
|
Aumentar a temperatura para aumentar a solubilidade do precipitado e diminuir a supersaturação relativa; |
|
Adicionar o agente precipitante lentamente sob agitação eficiente, pois minimiza a concentração (Q) do soluto; |
|
Manter o volume da solução grande ou manter as soluções diluídas, de forma que a concentração fique baixa. |
Os precipitados coloidais, por exemplo, óxidos de ferro (III), alumínio e cromo (III) e muitos sulfetos devem passar pelo processo de coagulação para gerar uma massa amorfa filtrável. O processo pode ser obtido pelo aquecimento, agitação e pela adição de um eletrólito na solução.
Atenção
Devemos ter cuidado no processo de lavagem de um precipitado coloidal coagulado, pois ele pode sofrer o processo de peptização que consiste no retorno ao seu estado disperso.
Um processo que auxilia na formação do precipitado é o processo de digestão ou envelhecimento do precipitado.
Digestão ou envelhecimento do precipitado
Este processo favorece, tanto a coagulação do precipitado coloidal, como a formação dos precipitados cristalinos.
Os coloides são melhor formados quando aquecidos e agitados por uma hora ou mais na solução-mãe (solução de formação do precipitado) e posterior descanso nesta solução. Nos precipitados cristalinos, a digestão é feita sem agitação e por um longo tempo (acima de 24 horas) após a sua formação na solução-mãe. A digestão gera um produto mais puro e de fácil filtração.
Os precipitados podem arrastar compostos normalmente solúveis da solução. Este fenômeno chamamos de coprecipitação. Existem quatro tipos de coprecipitação:
Para ser aplicado na análise gravimétrica, o precipitado dever ser:
Adsorção superficial
Formação de cristal misto
Oclusão
Aprisionamento mecânico.
A adsorção e a formação de cristal misto são processos baseados no equilíbrio químico e os outros dois têm origem na velocidade de formação do precipitado. Esses compostos que o acompanham constituem a maior fonte de erro na análise gravimétrica.
No caso dos coloides, a pureza é melhorada pela digestão, pois, durante o processo, a água é expelida do sólido para gerar uma massa mais densa com área superficial menor para a adsorção. A formação de cristal misto pode ser evitada utilizando íons de tamanhos diferentes (mais de 5%) e classes cristalinas diferentes. A oclusão e aprisionamento mecânico corresponde ao aprisionamento de um composto durante o rápido crescimento de um cristal.
Pode ser minimizada diminuindo a velocidade de formação do precipitado, ou seja, em baixa supersaturação.
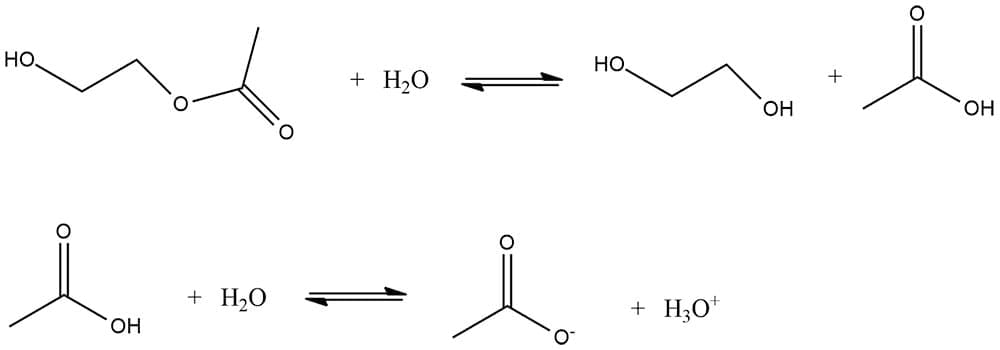
O precipitado pode ser formado através de uma reação química lenta a partir de uma solução homogênea. Neste processo, o agente precipitante é formado no meio reacional através de uma reação química cineticamente lenta e uniforme. Este tipo de precipitação é interessante quando queremos produzir íons H+ e OH- a fim de aumentar ou diminuir o pH da solução. Por exemplo, podemos fazer uso da reação lenta da água com o composto neutro 2-hidroxietil acetato para formar ácido acético. O ácido acético sofre dissociação, produzindo íons hidrônio que diminuem o pH da solução, conforme reação abaixo.
Outros reagentes podem produzir agentes precipitantes em reação química.
Exemplo
Ureia, trietil fosfato, dimetil oxalato, ácido sulfâmico e tiacetamida.
Cálculos dos resultados a partir de dados gravimétricos
As análises gravimétricas baseiam-se em dados obtidos experimentalmente e relacionam a massa da amostra e a massa de um elemento ou substância de composição conhecida.
Atenção
É muito importante conhecer os fenômenos físico-químicos e as reações envolvidas nos processos, pois, na maioria dos casos, os resultados são calculados a partir de relações estequiométricas entre o analito e a espécie química conhecida medida.
Exemplo
Uma amostra de 200 mL contendo níquel foi analisada por gravimetria. A precipitação foi realizada pela adição de uma solução a 1% de dimetilglioxima. O precipitado formado foi filtrado em cadinho de vidro sinterizado, lavado e seco em forno micro-ondas durante 15 minutos em potência média e 35 minutos em alta potência. O cadinho vazio pesava 25,3750 g e após a o processo de secagem a massa pesada foi de 25,5882 g.
Vamos calcular a concentração de Níquel na amostra em g/L e % p/p. Dados: M.M. (Ni) = 58,69 g/mol; M.M. (Ni(C4H7O2N2)2) = 288,77 g/mol.
Calcular a massa de Ni(C4H7O2N2)2 na amostra.
25,5882 – 25,3750 = 0,2132 g.
Calcular o número de mols de Ni na amostra. O número de mols de Ni é igual ao número de mols de Ni(C4H7O2N2)2. Logo, podemos escrever as relações abaixo.
Fator gravimétrico (f)
O fator gravimétrico é a razão entre a massa molar da substância desejada pela massa molar da substância pesada.
Para compreender melhor a temática, assista ao vídeo a seguir com a resolução de exercícios contextualizados de análise volumétrica por precipitação e gravimétricas.
Aplicações das análises volumétricas
por precipitação e gravimétricas
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste tema, discutimos os princípios e os diferentes tipos de análises volumétricas. Por fim, abordamos os principais conceitos e cálculos utilizados nas análises gravimétricas. Ao concluir o estudo deste tema, você deve ter percebido que as aplicações dessas técnicas são bastante diversificadas e estão presentes na rotina de praticamente todos os laboratórios que realizam análises químicas. Isso ocorre devido à praticidade, baixo custo e precisão que elas proporcionam.
Podcast
CONQUISTAS
Você atingiu os seguintes objetivos:
Identificou os fundamentos gerais das análises químicas aplicados à análise volumétrica ácido-base.
Reconheceu os conceitos das análises volumétricas por complexação e oxidação - redução.
Definiu os conceitos e aplicações da análise volumétrica por precipitação e gravimétricas.