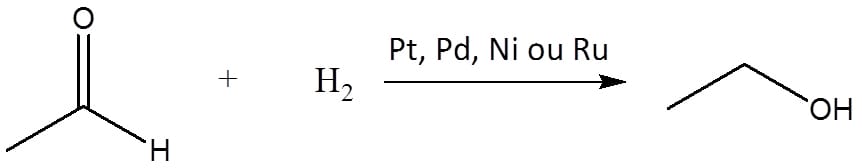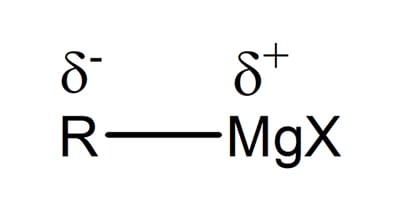Descrição
Apresentação dos princípios básicos da química de aldeídos, cetonas e suas principais reações, incluindo os mecanismos de oxidação, formação de enolatos e de substituição alfa à carbonila, de condensação aldólica e de adição conjugada a compostos carbonílicos α, β – insaturados.
PROPÓSITO
Compreender as propriedades químicas e as reações que envolvem aldeídos e cetonas é de extrema importância para sua formação acadêmica e profissional, pois facilita o entendimento dos mecanismos envolvidos no processo de produção de diversos fármacos e produtos químicos que se utilizam de compostos dessa classe.
OBJETIVOS
Módulo 1
Identificar aldeídos e cetonas, suas características físicas, químicas e os mecanismos de reação de adição nucleofílica mais importantes
Módulo 2
Identificar reações de oxidação e redução de aldeídos e cetonas e seus produtos
Módulo 3
Reconhecer o mecanismo de formação de enóis e enolatos e suas reações
Módulo 4
Identificar produtos de reações de condensação aldólica e os princípios da adição conjugada a compostos carbonílicos
Introdução
Aldeídos e cetonas são compostos abundantes na natureza e, mesmo sem saber, você já experimentou os efeitos de sua existência. O cheiro e sabor característicos da canela fornecidos pelo cinamaldeído, o odor da baunilha presente da vanilina e o aroma mentolado da hortelã, que é resultado da presença da (R)-carvona, são alguns exemplos agradáveis. Outros menos agradáveis ao olfato incluem o formaldeído, usado para conservar cadáveres, e a acetona, utilizada para remoção de esmaltes. Essas funções químicas também podem ser encontradas em hormônios produzidos pelo corpo humano, como o cortisol, além de estarem presentes no acetaldeído, o principal responsável pela ressaca causada depois da ingestão de grande quantidade de bebidas alcoólicas.
Aqui, vamos ver o que são esses compostos, quais características os definem, que tipo de reações sofrem, sua importância na química orgânica e, consequentemente, na vida.
MÓDULO 1
Identificar aldeídos e cetonas, suas características físicas, químicas e os mecanismos de reação de adição nucleofílica mais importantes
INTRODUÇÃO
O que são aldeídos e cetonas e o que eles têm em comum?
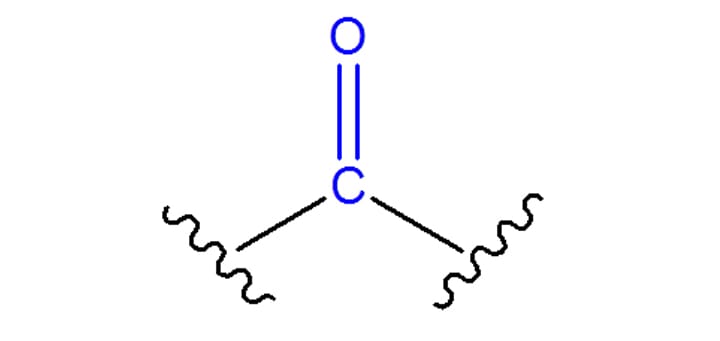
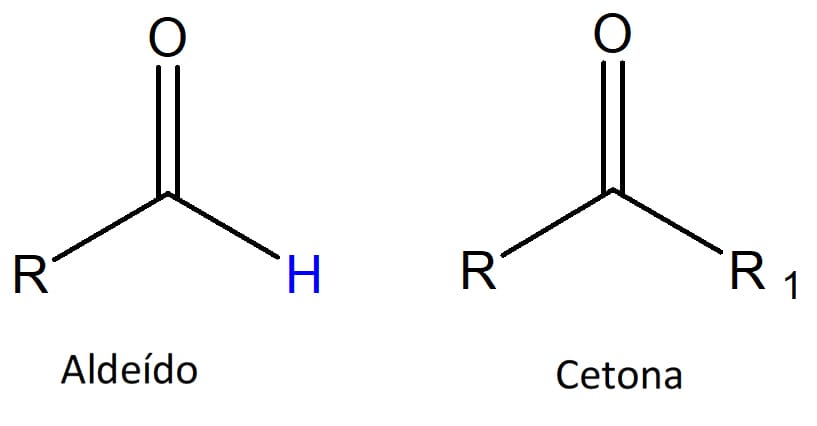
As duas classes de compostos se caracterizam por apresentar em sua estrutura um grupo conhecido como carbonila. Esse grupo consiste em um átomo de carbono ligado a um átomo de oxigênio através de uma ligação dupla, como pode ser visto na figura 1.
Você pode estar se perguntando:
“Se aldeídos e cetonas possuem o grupo carbonila na sua estrutura, como podemos diferenciar uma classe da outra?”
A diferença está na posição da carbonila. Aldeídos apresentam este grupo sempre na ponta da cadeia carbônica principal, ou seja, em um carbono primário, enquanto as cetonas apresentam a carbonila no meio da cadeia carbônica principal, em um carbono secundário (figura 2).
Nomenclatura dos Aldeídos
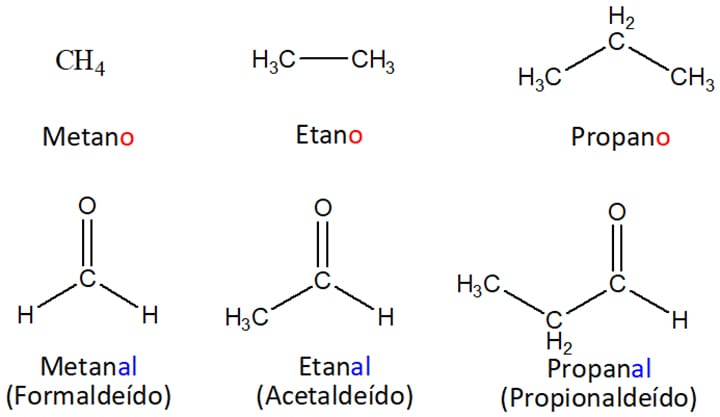
Seguindo a nomenclatura da IUPAC (União Internacional de Química Pura e Aplicada), podemos dizer que o nome do aldeído será o nome do hidrocarboneto correspondente com a substituição do sufixo –o (em vermelho) pelo –al (em azul). Veja os exemplos na figura 3.
Atenção
A cadeia principal será sempre aquela que contiver o grupo carbonila, ainda que não seja a mais longa. Não é necessário especificar a posição do grupo carbonila no nome da molécula, pois ele estará sempre na ponta da cadeia e o seu carbono será o carbono 1.
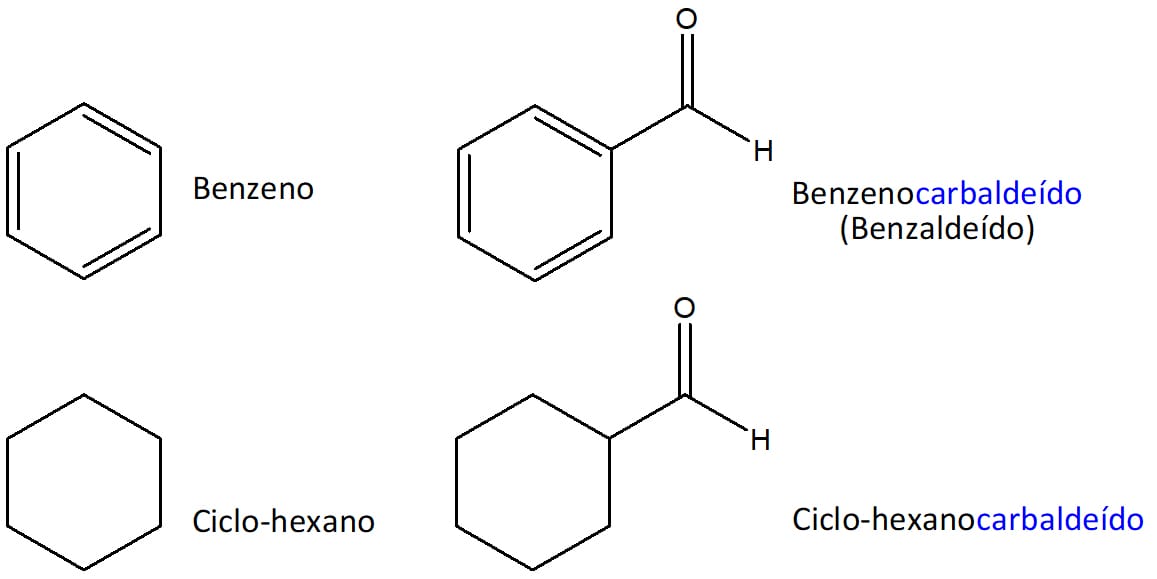
Caso o grupo –CHO esteja ligado a um anel (aromático ou não), o sufixo -carbaldeído é utilizado. Veja os exemplos na figura 4.
Nomenclatura das Cetonas
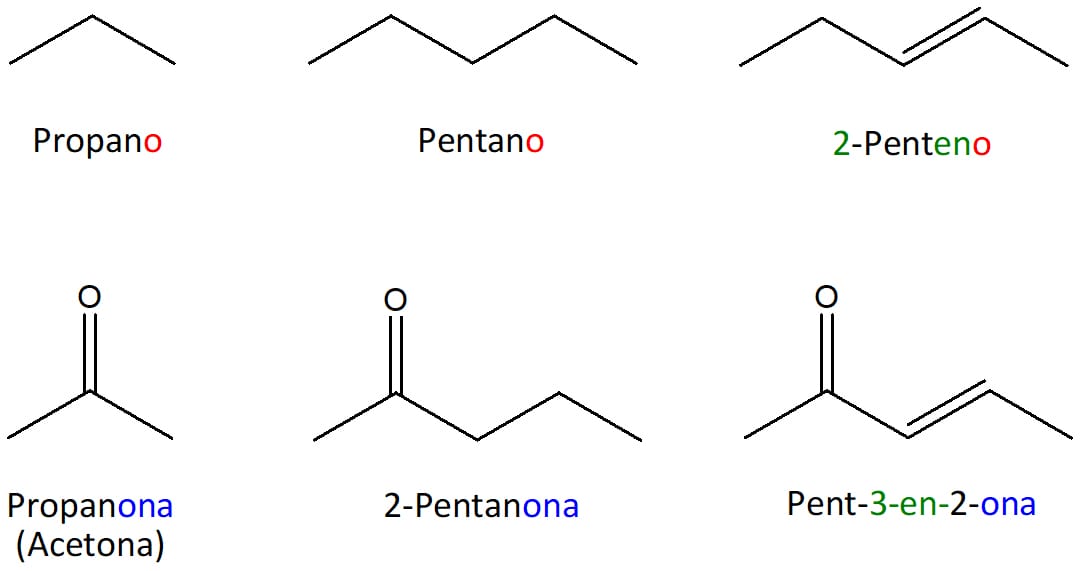
Assim como os aldeídos, podemos nomear as cetonas com base nos hidrocarbonetos correspondentes. Para isso, basta retirar o sufixo -o do hidrocarboneto e substituí-lo pelo sufixo -ona. Os exemplos podem ser vistos na figura 5.
Dica
Note que, na nomenclatura de cetonas, diferentemente dos aldeídos, a posição do grupo carbonila deve ser indicada no nome da cetona, uma vez que ela pode variar dentro da cadeia carbônica. O carbono 1 será sempre o carbono terminal mais próximo à carbonila.
CARACTERÍSTICAS QUÍMICAS E FÍSICAS DOS ALDEÍDOS E CETONAS
As principais características químicas e físicas dos aldeídos e cetonas são resultado da presença do grupo carbonila em sua estrutura.
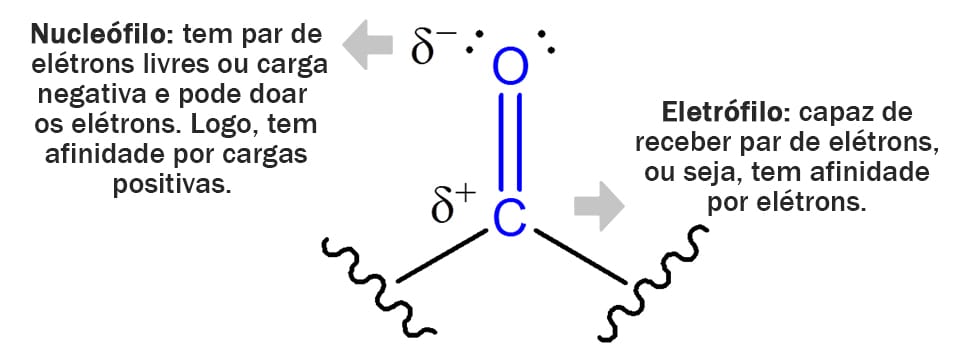
O primeiro ponto que precisamos entender em relação ao grupo carbonila é que existe uma diferença de eletronegatividade entre o carbono e o oxigênio ligado a ele. Isso quer dizer que os elétrons dessa ligação dupla estão mais próximos ao oxigênio, fazendo com que ele apresente uma carga parcial negativa – e, portanto, seja um nucleófilo –, enquanto o carbono apresenta uma carga parcial positiva, o que faz com que ele seja um eletrófilo (figura 6).
Essa diferença de eletronegatividade entre os dois átomos e a consequente polaridade formada na ligação faz com que aldeídos e cetonas estabeleçam forças intermoleculares do tipo dipolo-dipolo entre si.
As forças de dispersão de London feitas pelos hidrocarbonetos são mais fracas que as ligações de hidrogênio presentes entre moléculas de álcoois, por exemplo.
A diferença na magnitude das forças intermoleculares das classes químicas faz com que haja uma variação significativa em suas propriedades físicas, como o ponto de ebulição. Para exemplificar, observe no quadro 1 a seguir os pontos de ebulição de quatro compostos com massas moleculares próximas, porém diferentes tipos de força intermolecular.
| Butano | Propanal | Propanona | 1-Propanol | |
|---|---|---|---|---|
| Estrutura |

|
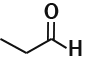
|

|

|
| Massa Molar (g/mol) | 58 | 58 | 58 | 60 |
| Ponto de Ebulição | -0,5°C | 49°C | 56,1°C | 97,2°C |
| Força intermolecular | Forças de dispersão de London | Dipolo-dipolo | Dipolo-dipolo | Ligação de hidrogênio |
Outra característica importante guiada pelas forças intermoleculares é a solubilidade. Aldeídos e cetonas conseguem fazer ligações de hidrogênio com a água e, por isso, aqueles de pequena cadeia carbônica e massa molecular são extremamente solúveis em água.
Seguindo a mesma comparação acima, podemos analisar as diferentes solubilidades em água dos compostos que fazem interações dipolo-dipolo (aldeídos e cetona) e ligação de hidrogênio (álcoois) com a água, e aqueles que não fazem, como os hidrocarbonetos.
| Butano | Propanal | Propanona | 1-Propanol | |
|---|---|---|---|---|
| Estrutura |

|

|

|

|
| MM | 58 | 58 | 58 | 60 |
| Solubilidade | 0,061 g/L | >100 g/L | >100 g/L | >100 g/L |
Atenção
É importante lembrar que o aumento no tamanho da cadeia é importante para o ponto de ebulição e para a solubilidade. As moléculas com cadeias mais longas vão ter essas propriedades físicas diferentes das vistas aqui.
REATIVIDADE DE ALDEÍDOS E CETONAS
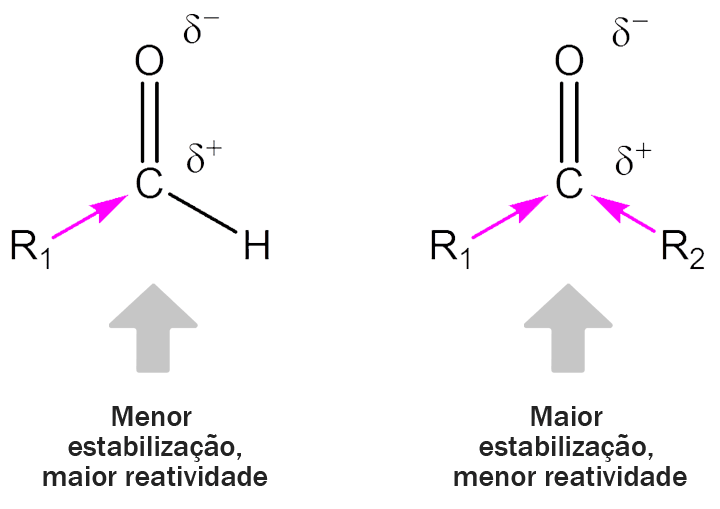
Em geral, aldeídos são mais reativos que cetonas. Dois fatores são responsáveis pela diferença de reatividade dessas classes de compostos: os eletrônicos e os estéricos, pois ambos favorecem os aldeídos.
Quando falamos da estrutura desses compostos, vimos que o aldeído tem um grupo alquila ligado ao carbono carbonílico, enquanto a cetona apresenta dois. Grupos alquila são doadores de elétrons, ou seja, ajudam a estabilizar a carga parcial positiva do carbono carbonílico e a torná-lo menos reativo. Por isso, as cetonas, com mais grupos alquila ligados à carbonila, são menos reativas que os aldeídos (figura 7).
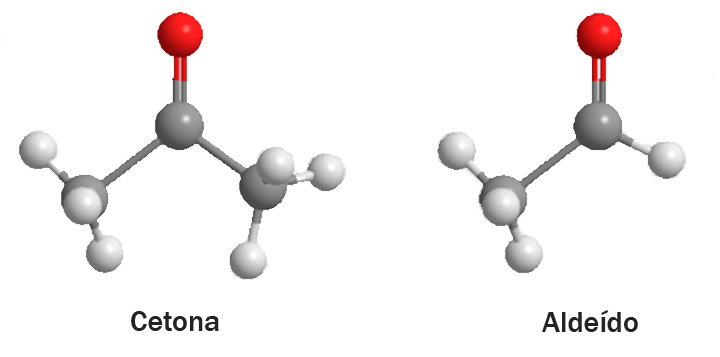
Estericamente, temos que levar em consideração o tamanho das cadeias ligadas à carbonila, que podem dificultar a aproximação dos reagentes. Aldeídos vão sempre ter, pelo menos, um hidrogênio ligado ao carbono carbonílico, enquanto cetonas terão sempre dois outros carbonos ligados a ele. Isso quer dizer que cetonas têm mais grupos volumosos ligados a elas e são, portanto, mais difíceis de acessar do ponto de vista do nucleófilo.
Veja a figura 8 para apreciar a diferença no volume dos grupos ligados às carbonilas de aldeídos e cetonas. As esferas cinzas representam carbonos, as vermelhas são oxigênios e as brancas, hidrogênios.
Reações de adição nucleofílica à carbonila
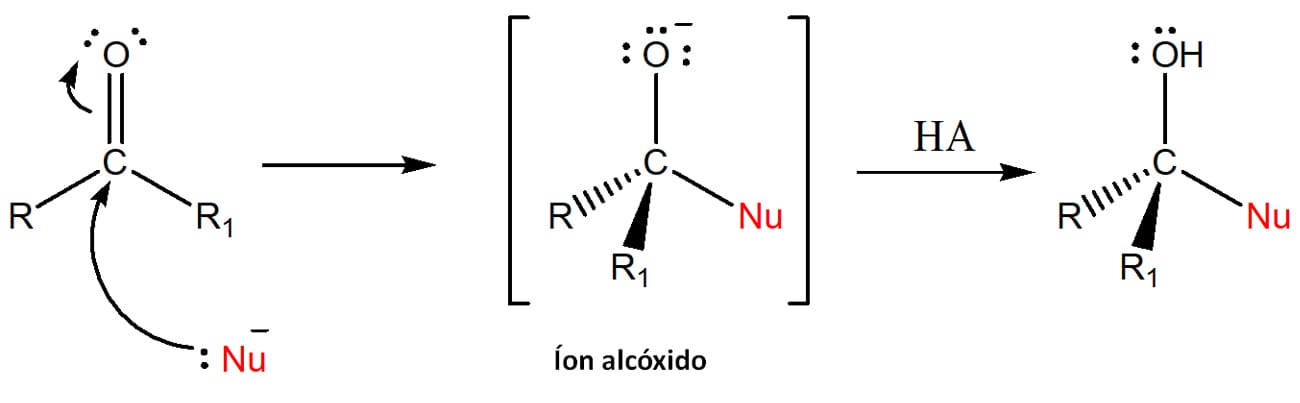
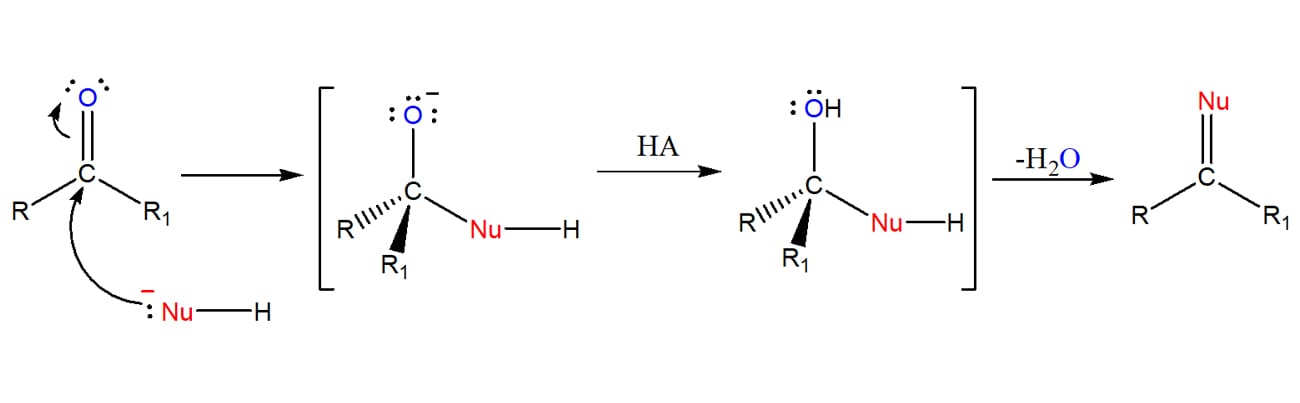
A mais geral das reações sofridas pelos aldeídos e cetonas é a de adição nucleofílica à carbonila. No que consiste essa reação?
Existem duas variações gerais deste tipo de reação. Entenda:
Atenção
É importante notar que, no primeiro caso, temos uma mudança na geometria da estrutura, que passa de trigonal plana para um produto tetraédrico, o que não acontece no segundo caso.
Vamos analisar os casos mais específicos e particulares deste tipo de reação:
- Reação de hidratação
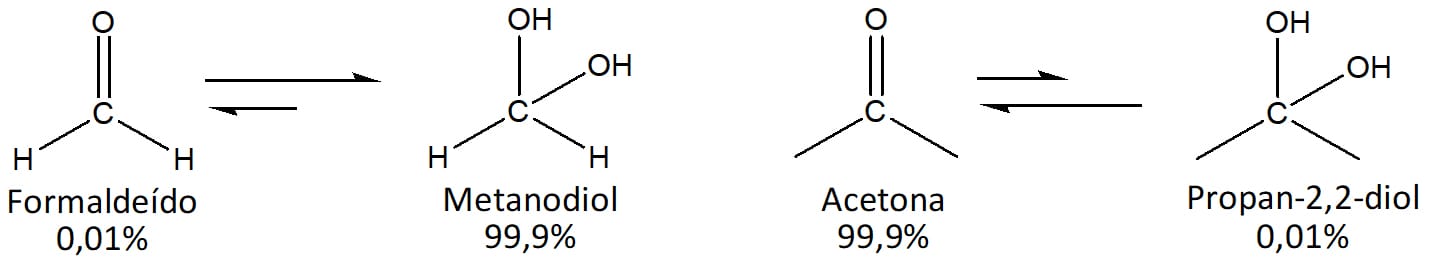
As reações de hidratação nada mais são que reações de adição nucleofílica à carbonila, onde o nucleófilo é a água.
As reações de hidratação de aldeídos e cetonas levam sempre à formação de 1,1-dióis, também conhecidos como dióis geminados (diol gem). Essas reações são reversíveis e, em geral, têm o equilíbrio deslocado no sentido da formação do composto carbonilado em razão do favorecimento estérico, embora aldeídos simples favoreçam a formação do diol gem. Esse é o caso do formaldeído, por exemplo. Enquanto em solução aquosa a propanona, ou acetona, encontra-se majoritariamente na forma carbonilada, o formaldeído encontra-se majoritariamente na forma de 1,1-diol, como pode ser visto na figura 9.
Embora não possamos mudar o sentido do deslocamento do equilíbrio, é possível aumentar a velocidade da formação de dióis a partir de cetonas ou aldeídos mais complexos através de catálise ácida ou básica. Vamos tratar as duas a seguir de maneira independente.
- Catálise ácida
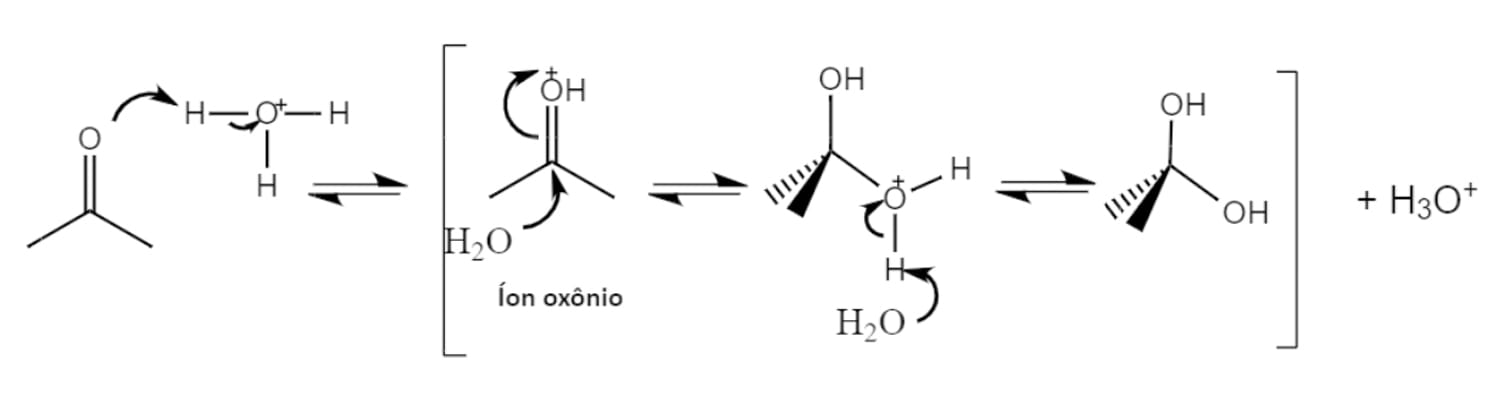
Neste modelo de catálise, um ácido é adicionado ao meio reacional com o objetivo de tornar o carbono mais eletrofílico. Vamos acompanhar o mecanismo dessa reação passo a passo (esquema 3):
O catalisador ácido protona o átomo de oxigênio da carbonila, gerando o íon oxônio e facilitando o ataque de um nucleófilo fraco como a água.
O par de elétrons livres do oxigênio da água ataca o carbono carbonílico levando à formação de um diol gem protonado.
Uma segunda molécula de água retira o próton do diol gem protonado, restaurando o catalisador ácido e levando à formação do produto neutro.
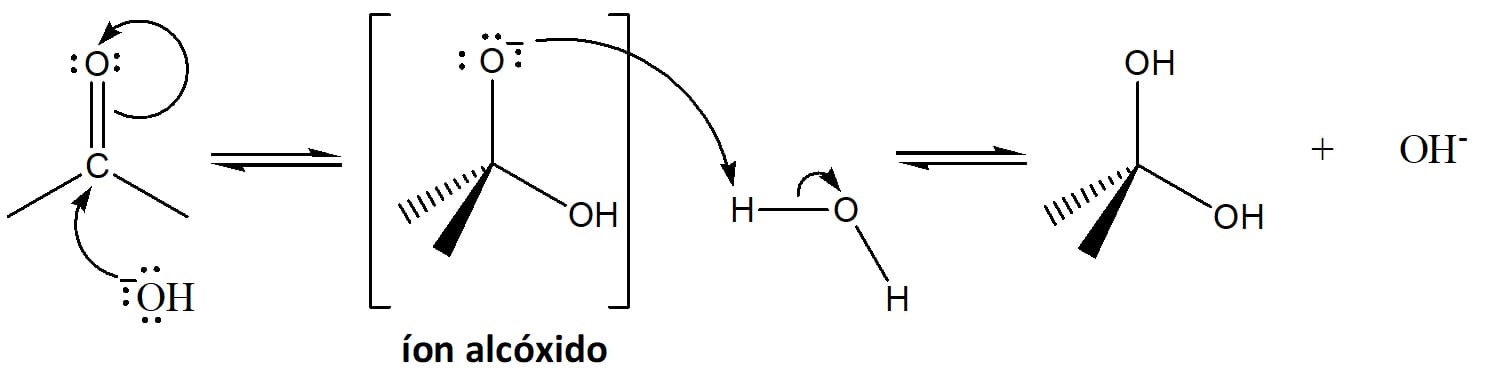
Enquanto na catálise ácida a velocidade da reação é favorecida por tornar o carbono da carbonila um eletrófilo melhor, na catálise básica, vamos usar um nucleófilo melhor, o íon hidroxila. Veja o que acontece nesse mecanismo (esquema 4):
Essa reação se inicia com o ataque da hidroxila ao carbono do grupo carbonila da cetona ou aldeído, com deslocamento do par de elétrons da ligação dupla para o oxigênio e a formação do íon alcóxido intermediário.
O íon alcóxido, por sua vez, desprotona a molécula de água levando à formação do produto diol gem neutro e regenerando o catalisador.
Atenção
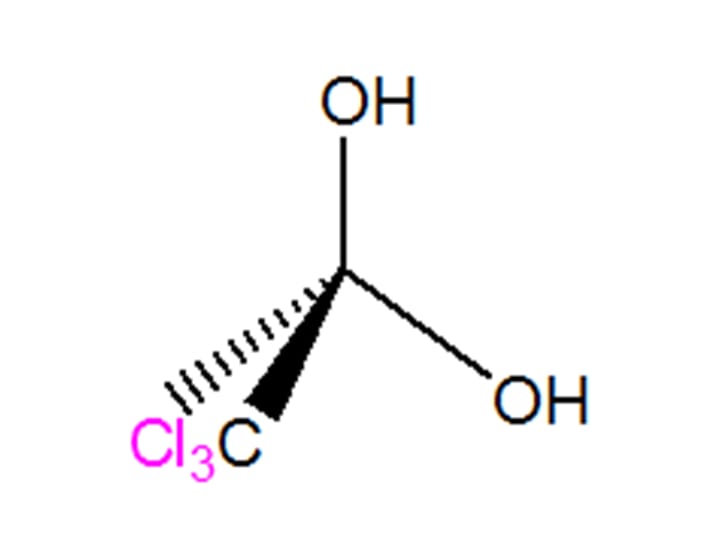
Na maioria dos casos, não é possível isolar o produto diol gem, uma vez que a simples remoção de água do meio desloca o equilíbrio no sentido da formação do composto carbonilado. A exceção à regra são os compostos que possuem grupos extremamente retiradores de elétrons vizinhos à carbonila do aldeído ou cetona, como é o caso do hidrato de cloral, um diol gem que possui três átomos de cloro em sua estrutura (figura 10).
Adição de ácido cianídrico e formação da cianoidrinas
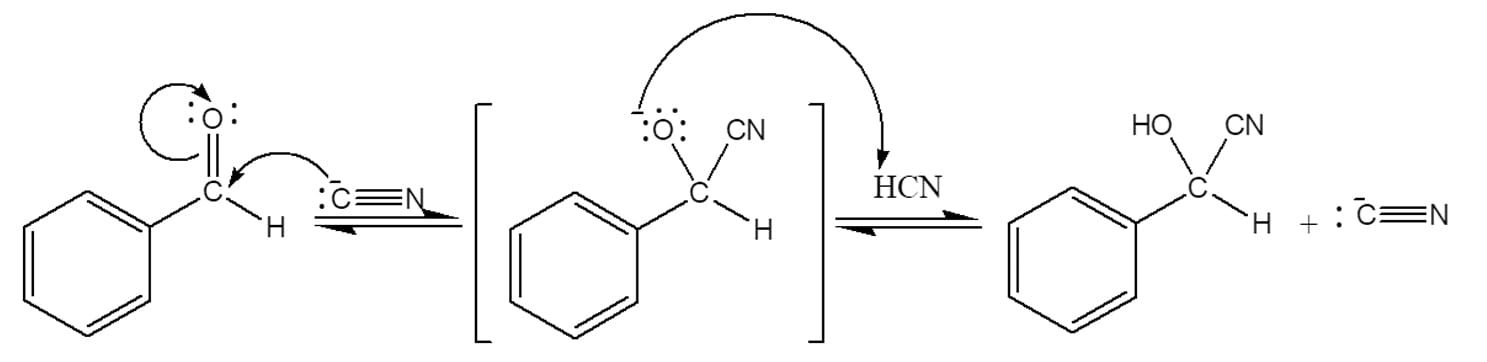
A reação entre o ácido cianídrico e aldeídos e cetonas leva à formação de uma classe de compostos conhecidos como cianoidrinas. As cianoidrinas são de extrema importância na Química Orgânica, principalmente por serem excelentes intermediários para formação de aminas ou ácidos carboxílicos, por exemplo.
O mecanismo da reação em si ocorre através de uma reação de adição nucleofílica típica, conforme as etapas a seguir:
O esquema a seguir mostra os passos que acabamos de descrever:
Devido à baixa acidez do ácido cianídrico, a velocidade da reação quando ele é adicionado isoladamente é muito lenta, levando à formação de apenas uma pequena quantidade do nucleófilo, o íon cianeto. Para aumentar a velocidade da reação, precisamos aumentar a concentração de íons cianeto disponíveis no meio reacional, o que pode ser feito através da adição de uma pequena quantidade de base ou mesmo de cianeto de potássio (KCN), um sal de cianeto.
- Reações de adição de álcoois: formação de hemiacetais e acetais
Vamos começar tratando dos hemiacetais.
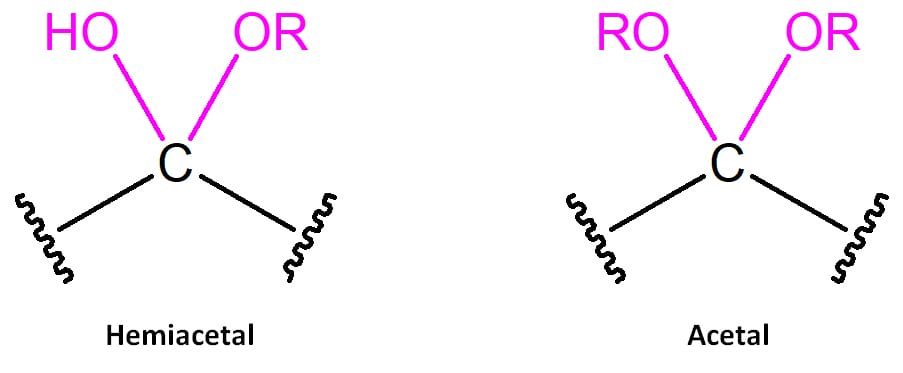
Hemiacetais são compostos que apresentam um grupo hidroxila e um grupo -OR ligados ao mesmo carbono e são o produto de reação de uma molécula de álcool e um aldeído ou cetona. Em geral, se houver excesso de álcool no meio, o hemiacetal não será passível de ser isolado, uma vez que a reação seguirá para a formação do acetal, uma molécula com dois grupos -OR ligados ao mesmo carbono (figura 11).
Saiba mais
Este tipo de reação acontece de maneira semelhante ao visto na catálise ácida das reações de hidratação, pois o princípio é o mesmo. Os álcoois são nucleófilos fracos e o grupo carbonila é um eletrófilo apenas moderado. Se a reação estiver em condições neutras, a velocidade com que ela procede é muito baixa, porém a adição de ácido ao meio possibilita a formação do íon oxônio, tornando o aldeído ou cetona muito mais reativo frente aos álcoois.
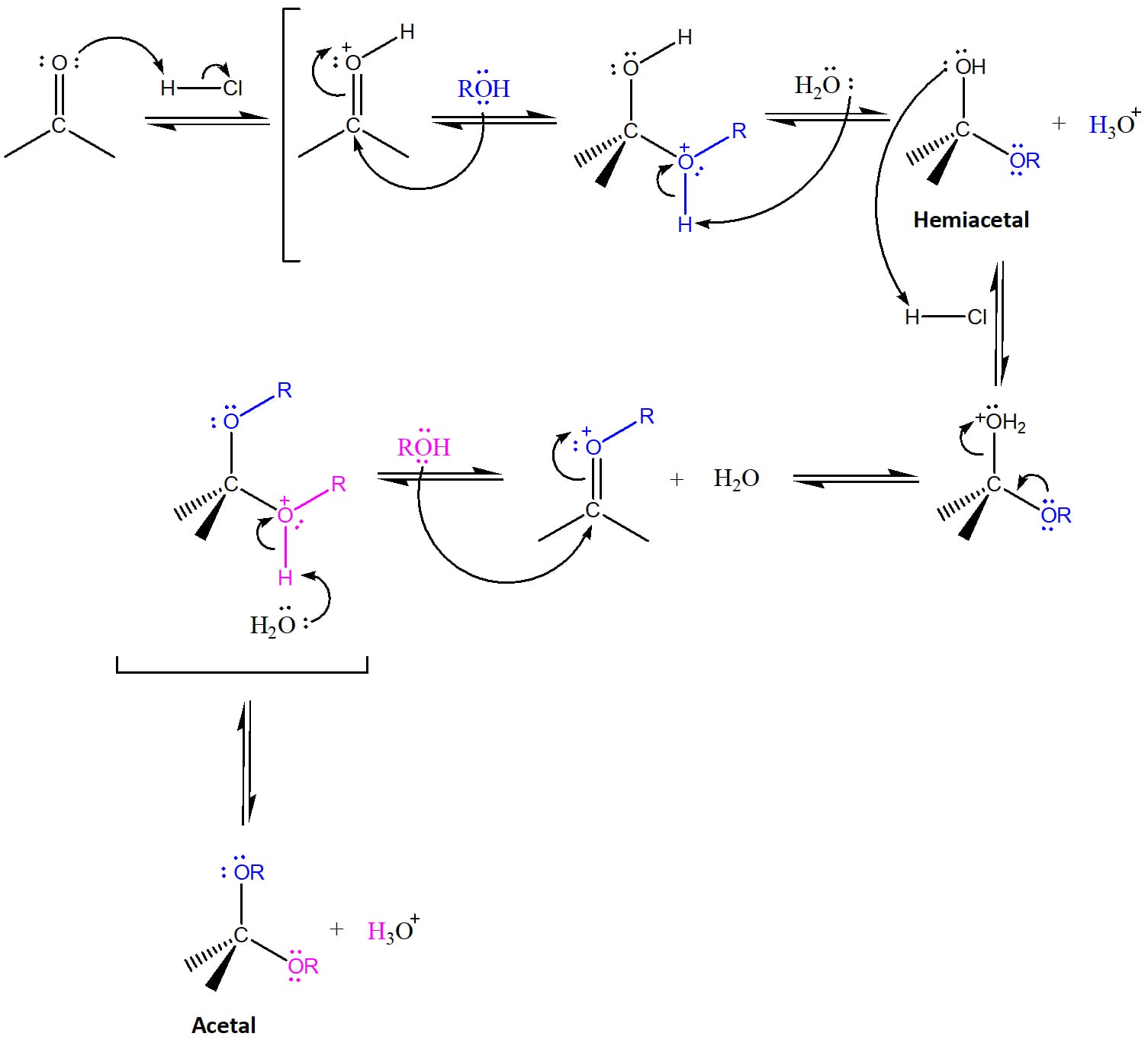
Vamos ver, individualmente, as etapas que compõem o mecanismo da formação de hemiacetais e acetais (esquema 6).
Etapa 1
Protonação da cetona ou aldeído com formação do íon oxônio.
Etapa 2
Ataque do par de elétrons do oxigênio do álcool (em azul) ao carbono carbonílico com formação do hemiacetal protonado.
Etapa 3
Desprotonação da molécula pela água com formação do hemiacetal neutro e regeneração do catalisador ácido.
Etapa 4
O ácido no meio protonará a hidroxila do hemiacetal tornando-a um excelente grupo de saída. O par de elétrons livres do oxigênio se deslocará eliminando água e tornando a formar um íon oxônio.
Etapa 5
O íon oxônio sofre o ataque de uma outra molécula de álcool (em rosa) levando à formação do acetal protonado.
Etapa 6
O acetal protonado leva à protonação da água e, em seguida, à formação do acetal.
Todas as etapas de formação do acetal são reversíveis. Por isso, a reação pode ser direcionada para a formação do produto desejado de acordo com as condições do meio. A formação do acetal é favorecida pela remoção de água, através de destilação, por exemplo, enquanto o sentido de formação do aldeído ou cetona é favorecido pelo excesso de ácido em meio aquoso.
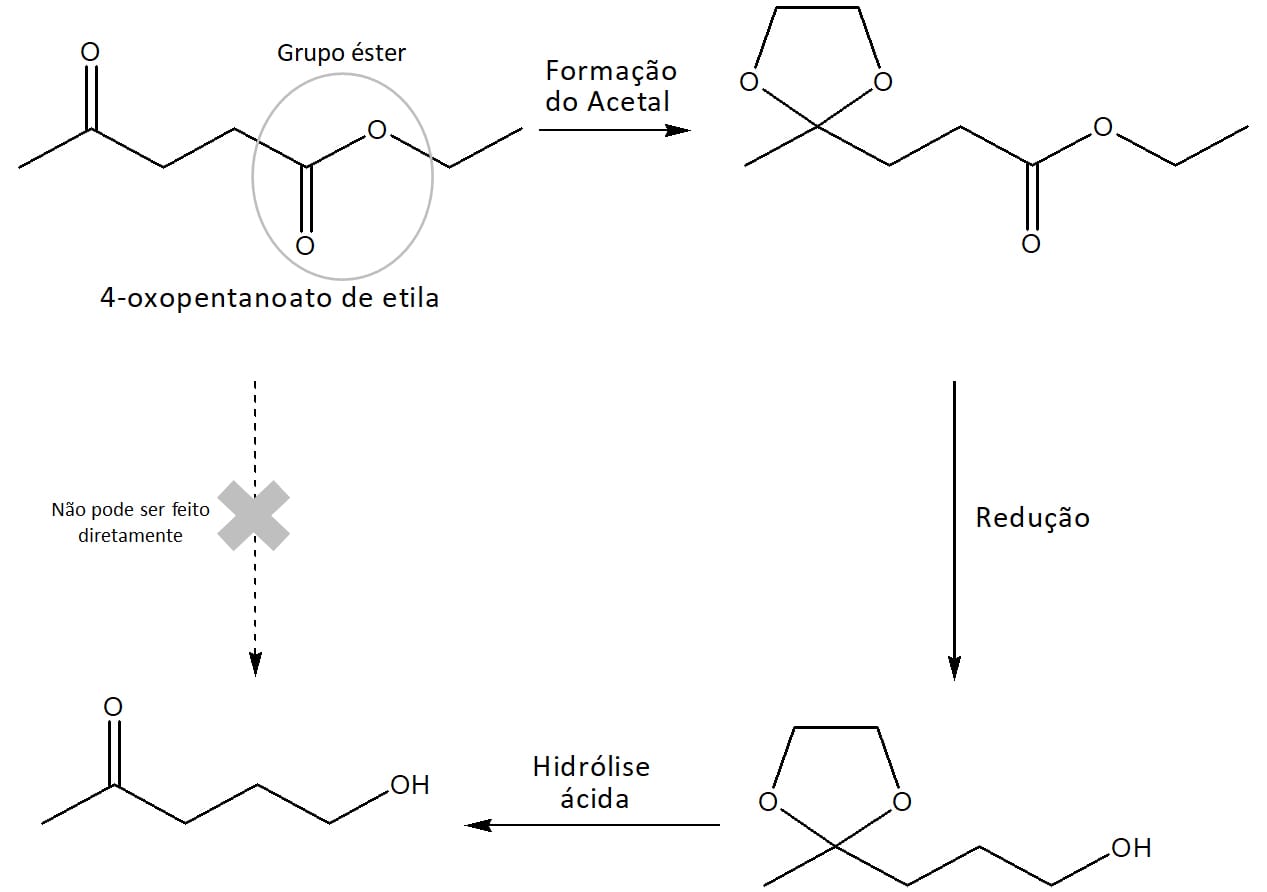
Qual é a importância desses compostos?
Os acetais são muito utilizados em síntese orgânica como grupo protetor. Vamos dizer que precisemos fazer a redução seletiva de um grupo éster em uma molécula que também apresenta uma cetona. Cetonas são reduzidas mais facilmente que ésteres e, por isso, qualquer reagente redutor que afete o éster afetará também a cetona.
Como resolver esse problema?
Simples! Antes de fazer a redução, reagimos o composto com um álcool de maneira a “protegermos” a cetona através da formação de um acetal. Em seguida, fazemos a redução – que afetará apenas o éster – e, através de uma hidrólise ácida, regeneramos o grupo cetona (figura 12).
Atenção
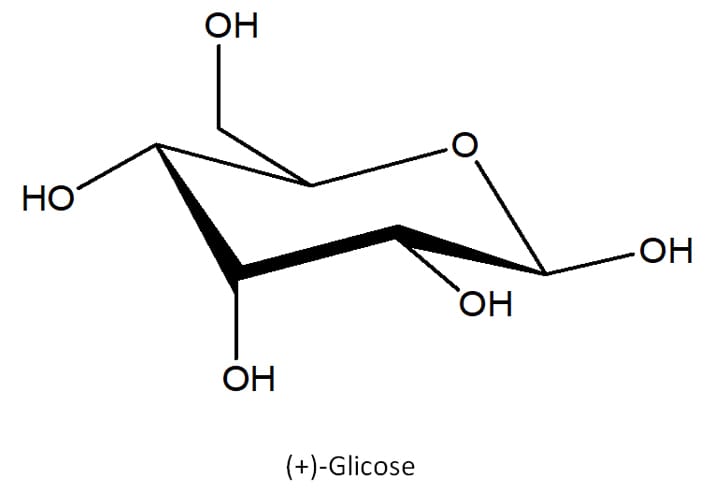
Além disso, é importante deixar claro que nem sempre a reação entre compostos carbonilados e álcoois precisa acontecer entre dois compostos diferentes. A reação pode se dar de maneira intramolecular, desde que o produto hemiacetal cíclico formado seja estável o bastante.
Um bom exemplo disso são os açúcares simples, como a glicose (figura 13).
- Reação de adição de aminas primárias e secundárias
Lembra quando falamos sobre os mecanismos gerais de adição nucleofílica à carbonila e vimos que havia duas possibilidades de produtos?
Até o momento, estudamos apenas exemplos do primeiro caso, em que era formado um produto substituído saturado. Agora, vamos estudar o segundo caso, em que vemos a formação de uma ligação C=Nu.
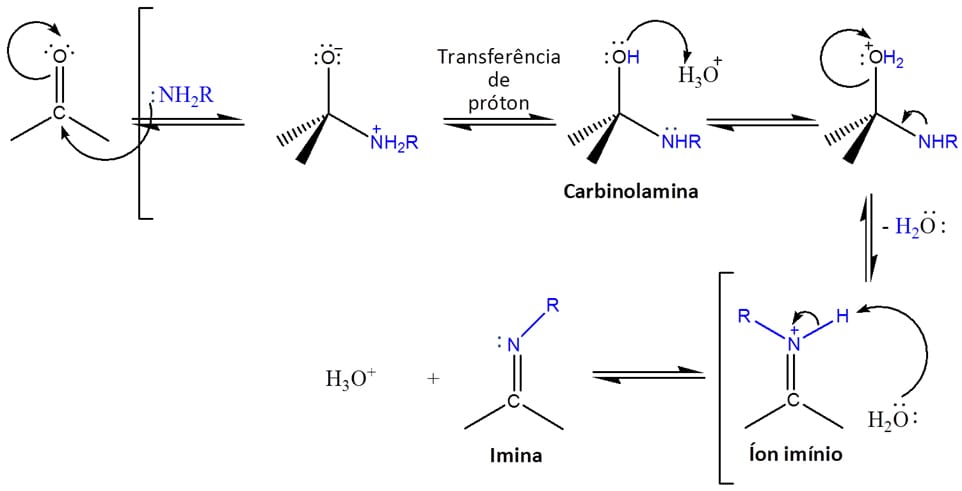
Aminas primárias reagem com aldeídos ou cetonas para formar compostos conhecidos como iminas através de processos reversíveis e com catálise ácida. Mais uma vez, vamos ver etapa a etapa o que acontece no mecanismo (esquema 7):
Etapa 1
O par de elétrons livres do nitrogênio da amina ataca o carbono do grupo carbonila, levando a um intermediário com carga negativa no oxigênio e positiva no nitrogênio.
Etapa 2
Um próton é transferido do nitrogênio para o oxigênio, dando origem a uma molécula neutra conhecida como carbinolamina.
Etapa 3
O catalisador ácido então protona o grupo hidroxila da carbinolamina, tornando-o um excelente grupo de saída, e o par de elétrons livres do nitrogênio se desloca expulsando água da estrutura e dando origem ao íon imínio.
Etapa 4
O íon imínio sofre o ataque de uma molécula de água, regenerando o catalisador ácido e dando origem a uma imina neutra.
Após estudar detalhadamente o mecanismo por trás da formação das iminas, podemos entender a importância do controle do pH nessa reação. Se o pH da reação estiver muito básico, não teremos ácido suficiente para protonar a carbinolamina e formar o íon imínio. Por outro lado, excesso de acidez pode levar à protonação de toda a amina e impedir o ataque nucleofílico original que inicia a reação. Interessante, não?
Cada reação de ataque nucleofílico para formação de iminas deve ser analisada individualmente para que se possa encontrar o pH ótimo que permitirá a maior velocidade de reação.
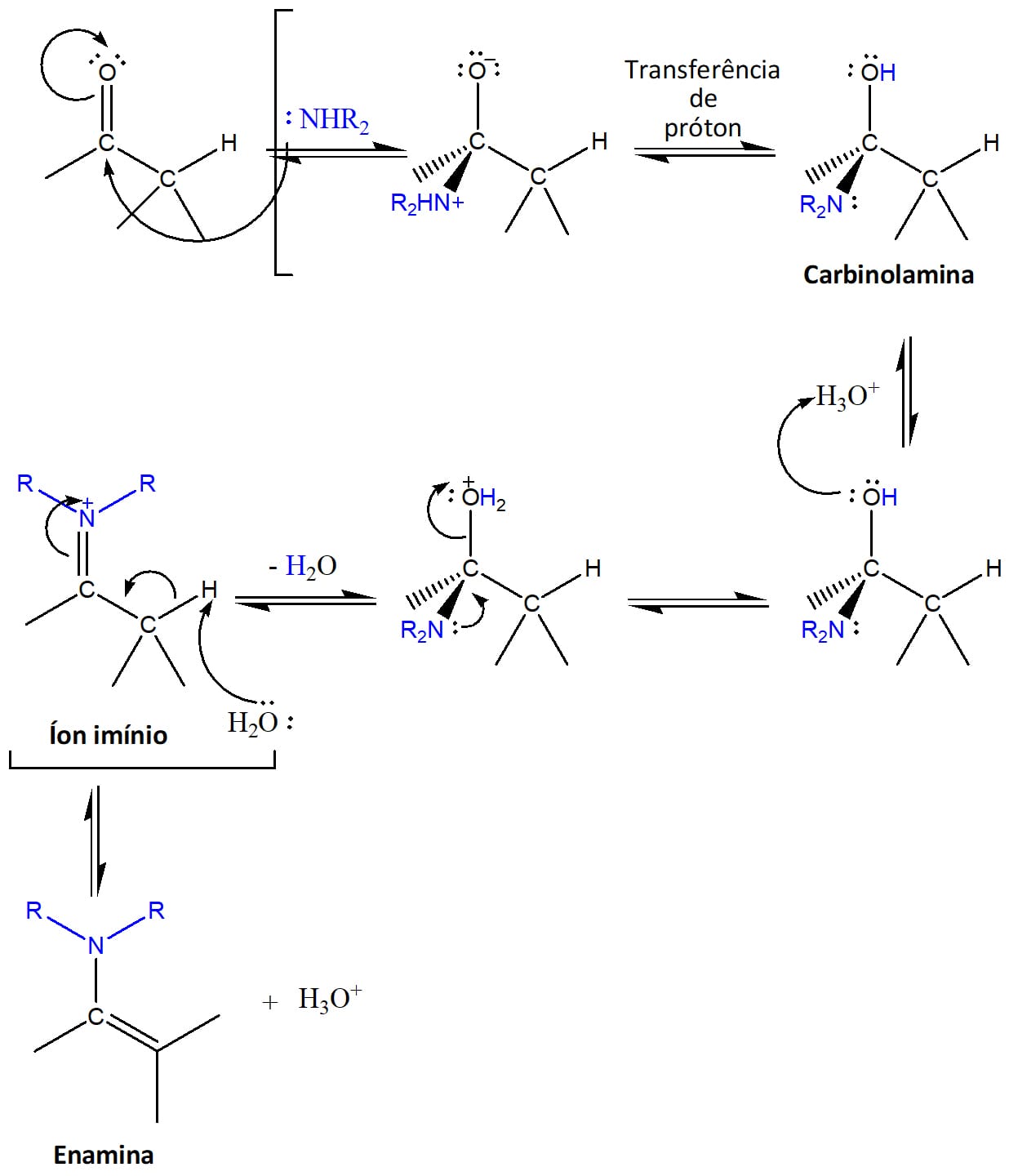
E se uma amina secundária reagir com um aldeído ou cetona?
Nesse caso, formaremos uma enamina, ou seja, uma amina insaturada. O mecanismo de reação da formação das enaminas é idêntico ao processo de formação das iminas até a formação do íon imínio. Neste ponto, porém, o nitrogênio proveniente da amina secundária não possui nenhum hidrogênio que possa ser perdido de maneira a tornar a molécula neutra e, por isso, essa perda ocorrerá no carbono ꭤ (vizinho) à carbonila, levando à formação de uma dupla ligação entre o carbono ꭤ e o carbono ligado ao nitrogênio.
O esquema 7 mostra as etapas do mecanismo de reação de adição nucleofílica de aminas secundárias a compostos carbonilados.
REAÇÕES COM ALDEÍDOS E CETONAS NA SÍNTESE DE FÁRMACOS
Assista ao vídeo em que vai ser apresentado um exemplo de síntese de fármacos que envolvem reações nucleofílicas com aldeídos e cetonas para explorar o mecanismo dessas reações.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar reações de oxidação e redução de aldeídos e cetonas e seus produtos
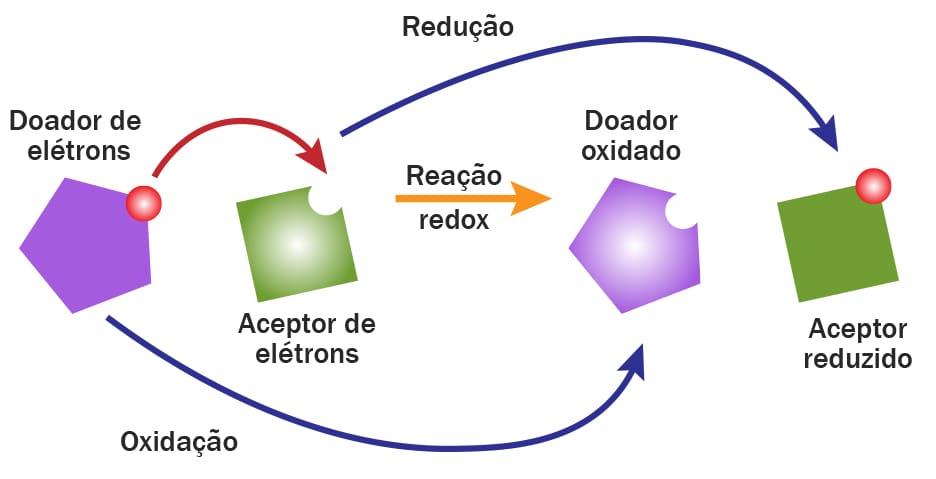
OXIDAÇÃO E REDUÇÃO: CONCEITOS GERAIS
Primeiramente, devemos entender o seguinte: o que é uma oxidação e o que é uma redução em química orgânica?
A oxidação será observada quando houver o aumento no número de átomos de oxigênio ou a diminuição na quantidade de átomos de hidrogênio. Vamos analisar o exemplo do esquema 8.
A reação contrária à oxidação é a redução. Logo, podemos concluir que a redução pode ser observada quando a molécula aumenta o número de hidrogênios presentes em sua estrutura ou diminui o número de oxigênios (esquema 9).
Atenção
Em todo este módulo, utilizaremos [H] para indicar uma redução em que não for necessário indicar o agente redutor. Para indicar uma oxidação sem indicar o agente oxidante, utilizaremos [O].
Analisando o esquema 9, podemos ver que o ácido carboxílico possui dois átomos de oxigênio em sua estrutura, enquanto o aldeído possui apenas um. Ou seja, o ácido carboxílico perdeu um oxigênio – foi reduzido – e um aldeído foi gerado neste processo. Digamos que temos um aldeído reagindo e formando um álcool. O número de átomos de oxigênio nesse caso permanece o mesmo.
Como então saber se o que ocorreu foi uma redução?
Pelo número de hidrogênios. Enquanto o aldeído apresenta apenas um átomo de hidrogênio ligado à carbonila, o álcool ganha dois e, com isso, passa a contar com três átomos de hidrogênio, comprovando que uma redução ocorreu.
Embora os conceitos mostrados acima sejam verdadeiros, existe uma concepção um pouco mais ampla de oxidação e redução: a de que o aumento na quantidade de átomos de qualquer elemento mais eletronegativo que o carbono é considerado oxidação e sua diminuição, redução (esquema 10).
REAÇÕES DE OXIDAÇÃO
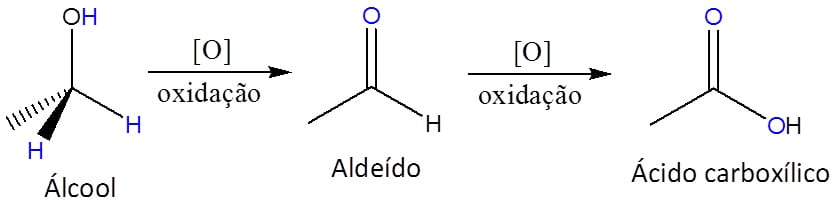
O primeiro ponto importante das reações de oxidação em aldeídos e cetonas é que aldeídos são significativamente mais susceptíveis a essas reações que as cetonas. Por quê?
Pela sua estrutura. Aldeídos têm um hidrogênio em sua estrutura que pode ser abstraído durante a oxidação – marcado em azul na figura 14, mas cetonas não.
Isso quer dizer que cetonas não sofrerão reações de oxidação em nenhuma hipótese?
Não. Quer dizer apenas que as condições para sua oxidação deverão ser mais drásticas do que as condições para oxidação de aldeídos.
Apesar de diferentes substâncias poderem ser utilizadas na oxidação de aldeídos a ácidos carboxílicos, o princípio mecanístico por trás da reação é sempre o mesmo:
Etapa 1
Reação de hidratação. A hidratação de um aldeído é uma reação espontânea, embora seja muito lenta sem a presença de um catalisador, e que leva à formação de um diol geminado.
Etapa 2
O par de elétrons livres do oxigênio do diol ataca então o agente oxidante com a saída de uma molécula de água.
Etapa 3
O intermediário formado passa por uma transferência intramolecular de próton que resulta na formação do ácido carboxílico neutro.
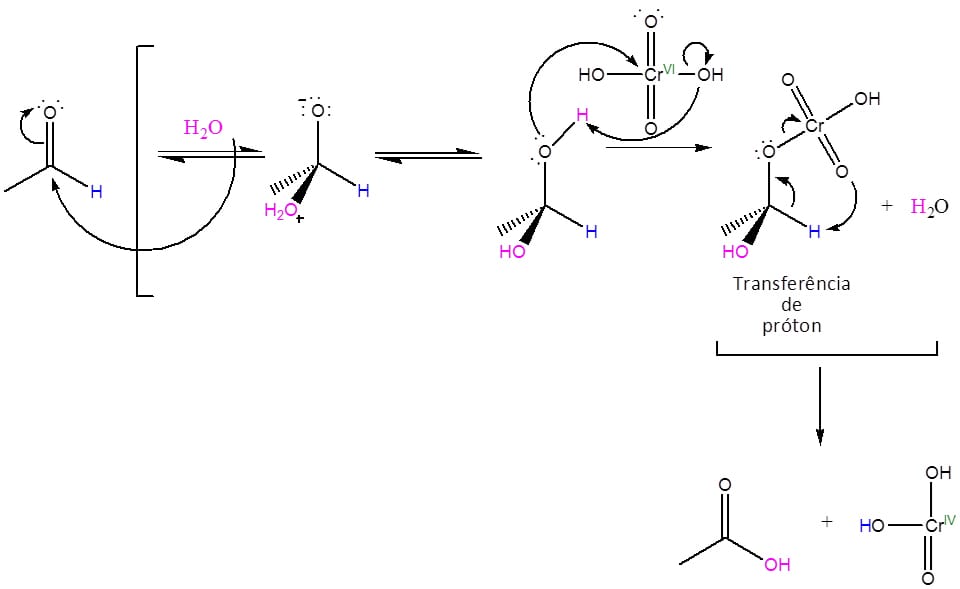
O esquema 11 é uma representação do mecanismo geral de oxidação e, para fins de exemplo, utilizaremos o reagente de Jones, ácido crômico formado in situ pela reação entre o trióxido de cromo (CrO3) e ácido sulfúrico (H2SO4) diluído, que é o mais utilizado pelo custo e facilidade de manuseio em laboratório.
Observe que o esquema anterior foi colorido para chamar a atenção para alguns fatores.
Primeiro, em verde, podemos observar a mudança de Nox sofrida pelo átomo de cromo que vai de VI para IV. Isso é importante porque, para toda reação de oxidação, uma reação de redução deverá ocorrer e aqui isso fica evidente.
Em segundo lugar, podemos visualizar a importância do hidrogênio do aldeído (em azul) na reação e porque a cetona tem tanta dificuldade em reagir.
Atenção
Note que, no ácido formado, o átomo de oxigênio da carbonila é o mesmo que o do aldeído inicial, porém o hidrogênio da hidroxila não é o mesmo, ele passa ao composto cromado para que a reação possa se completar e, por isso, é tão importante nas reações de oxidação.
Além disso, uma condição para que a oxidação do aldeído ocorra é a presença de água no meio reacional, como é evidenciado pela primeira etapa do mecanismo. Essa etapa depende da formação do diol gem, que só será formado na presença de água. Mesmo em meios reacionais sem catálise, a reação irá proceder com certa facilidade, pois o diol gem formado será logo oxidado e seu consumo deslocará o equilíbrio no sentido da sua formação.
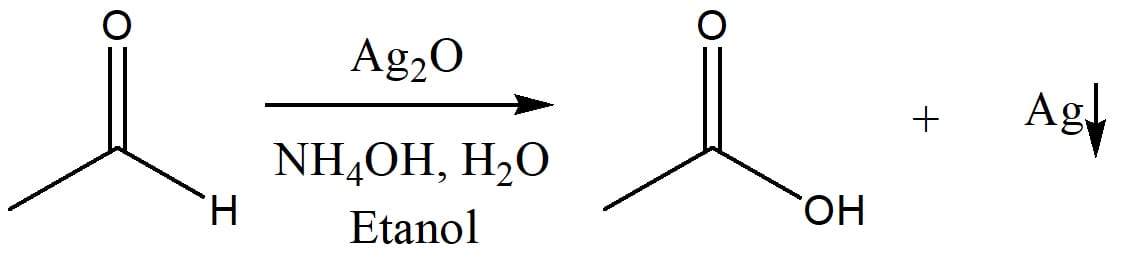
No caso da molécula ser sensível à presença do ácido, a alternativa é utilizar um reagente conhecido como reagente de Tollens, uma solução de óxido de prata (Ag2O) em amônia aquosa que leva à formação do íon diaminoprata(I) [Ag(NH3)2+], ou ainda uma solução de permanganato de potássio (KMnO4) em meio básico. O mecanismo se processa essencialmente da mesma forma, reduzindo a prata de +1 para 0, prata metálica; e o manganês de +7 para +4, na forma de MnO2, que precipita.
Veja a seguir o esquema geral da reação de oxidação utilizando o reagente de Tollens.
Oxidação de Baeyer-Villiger
Lembra quando falamos da dificuldade em oxidar cetonas?
Vamos estudar agora a reação mais utilizada para realizar essas oxidações.
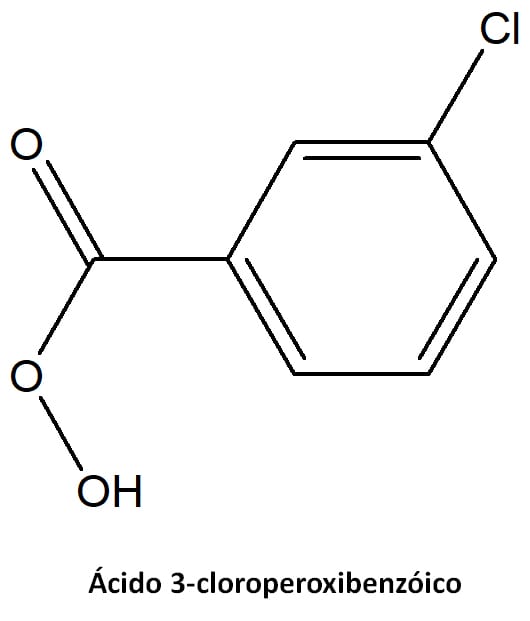
A oxidação de Baeyer-Villiger é uma clivagem oxidativa da ligação C-C adjacente à carbonila e converte cetonas de cadeia aberta e aldeídos a ésteres e cetonas cíclicas a lactonas. Essa reação pode ser feita utilizando um perácido, como o ácido 3-cloroperoxibenzóico (MCPBA – figura 15), ou uma combinação de peróxido de hidrogênio (água oxigenada) e um ácido de Lewis, como o BF3.
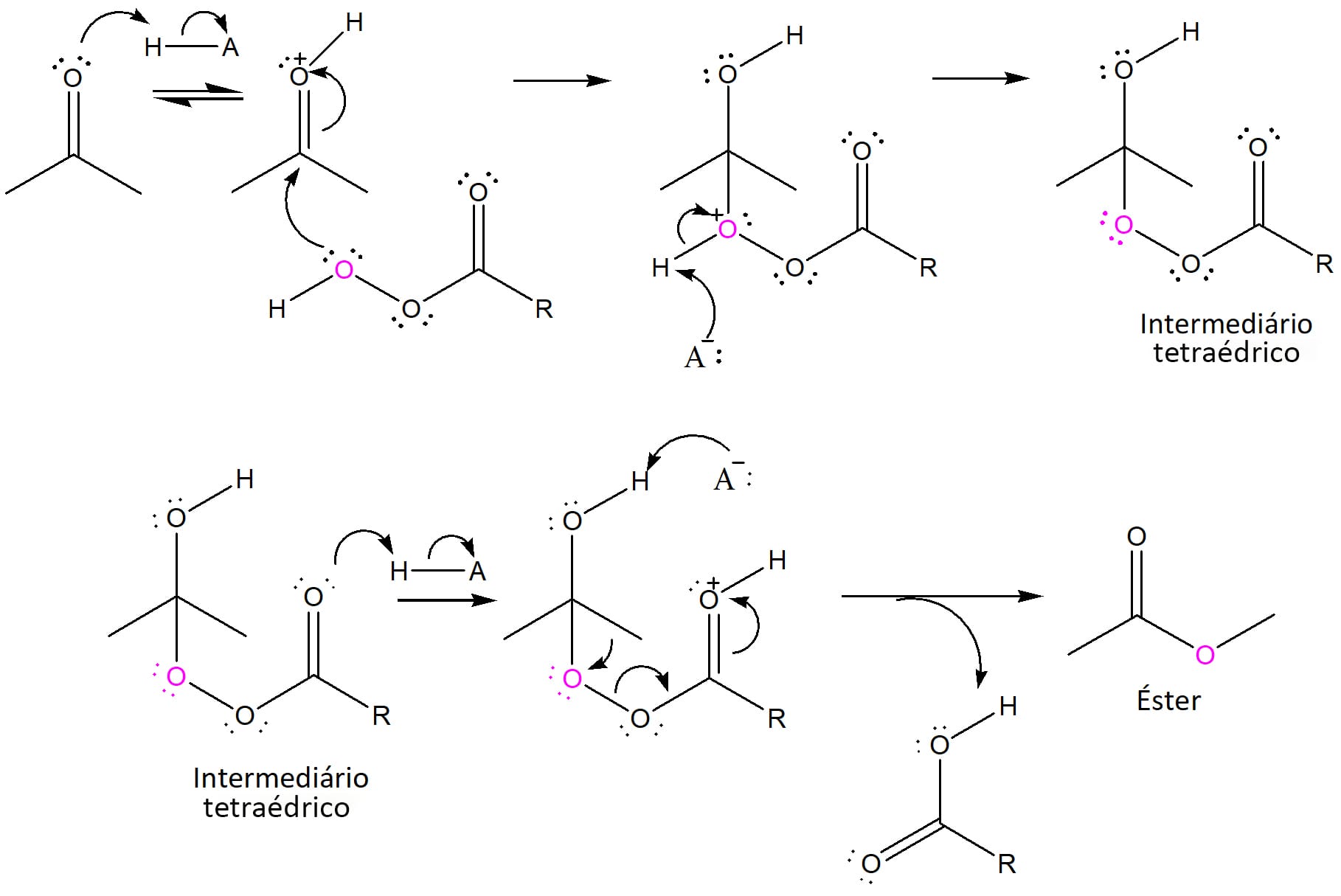
Veja esse mecanismo detalhadamente com o esquema a seguir, que ilustra todas as etapas:
Etapa 1
O ácido HA protona o oxigênio da carbonila, levando à formação do íon oxônio e facilitando o ataque pelo perácido.
Etapa 2
O par de elétrons livres do oxigênio do perácido ataca o carbono carbonílico e um par de elétrons da dupla ligação é deslocado em direção ao oxigênio carbonílico.
Etapa 3
A carga positiva formada no oxigênio do ácido após a adição é resolvida pela abstração do próton por A-, gerando um intermediário tetraédrico e regenerando o ácido HA.
Etapa 4
O oxigênio carbonílico proveniente do perácido é protonado.
Etapa 5
Ocorre um rearranjo onde uma das cadeias carbônicas da cetona original migra para o oxigênio proveniente do perácido (em rosa), levando à formação de um éster e à saída de um ácido carboxílico.
No exemplo aqui apresentado, as duas cadeias carbônicas da cetona são iguais e, por isso, não há diferença em qual das duas migrará para o oxigênio. No entanto, quando as cadeias carbônicas são diferentes, migrará aquela que tiver maior capacidade de estabilizar uma carga positiva, ou seja, a preferência de migração será:
H > fenila > alquila 3ária > alquila 2ária > alquila 1ária > metila.
Identificação de aldeídos e cetonas
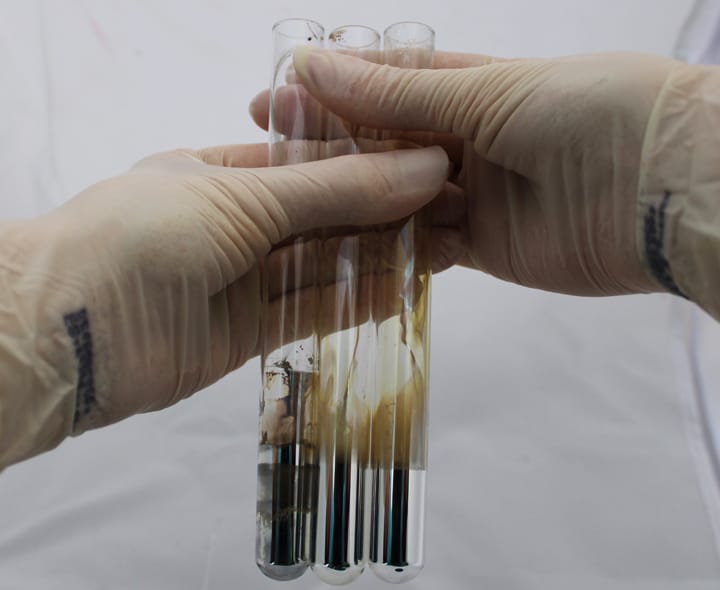
Existem duas maneiras principais de identificar aldeídos e cetonas. A primeira é com o reagente de Tollens que mencionamos anteriormente. A reação entre o aldeído e o reagente de Tollens leva à redução da prata, fazendo com que ela precipite e forme uma espécie de “espelho” de prata na parede do recipiente (este teste serve também para hidroxi cetonas, mas não para cetonas simples).
A segunda maneira é com a promoção da reação entre o aldeído ou cetona e derivados de amônia. A reação entre o aldeído ou cetona e a 2,4-difenilhidrazina, por exemplo, leva à formação de uma 2,4-dinitrofenilhidrazona, que é um precipitado de tom alaranjado.
Vamos para um exemplo prático!
Digamos que você está em um laboratório fazendo a oxidação de um aldeído. Como você poderia saber que todo o aldeído foi convertido a ácido?
Poderia ser feita uma reação de identificação de aldeídos e acompanhar seu desaparecimento do meio reacional. Se antes da adição do oxidante retirarmos uma alíquota do meio reacional e reagirmos com 2,4-dinitrofenilhidrazina, um precipitado alaranjado referente a uma 2,4-dinitrofenilhidrazona será formado.
Porém, após a adição do oxidante e o término da reação, apenas o ácido carboxílico estará presente no meio reacional e, por isso, se retirarmos uma nova alíquota para reagir com a 2,4-dinitrofenilhidrazina, não veremos formação de precipitado, evidenciando que todo aldeído foi consumido.
REAÇÕES DE REDUÇÃO

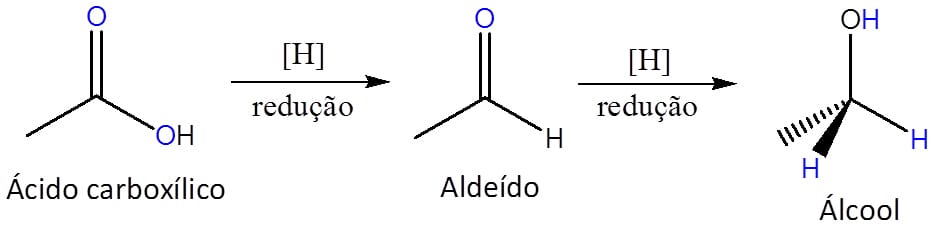
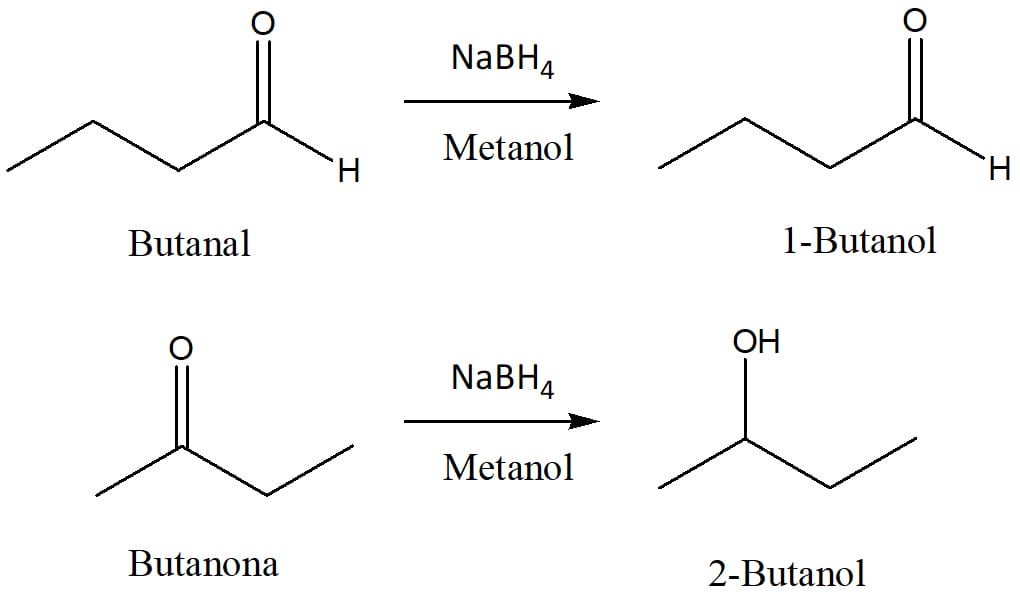
A redução de aldeídos e cetonas levará à formação de álcoois. Eles serão iguais? Não.
Aldeídos apresentam a carbonila em um carbono primário e, por isso, o álcool formado por sua redução será um álcool primário ou secundário. Da mesma forma, cetonas tem o grupo carbonila em um carbono secundário e levarão à formação de álcoois secundários ou terciários. Apesar disso, o mecanismo da redução dessas classes é o mesmo.
A maneira clássica de proceder uma redução é através da hidrogenação catalítica do composto, utilizando metais como paládio, níquel, platina ou rutênio (esquema 14).
No entanto, essas reações vêm sendo substituídas em laboratório pelas reações com hidretos.
Reações com hidreto
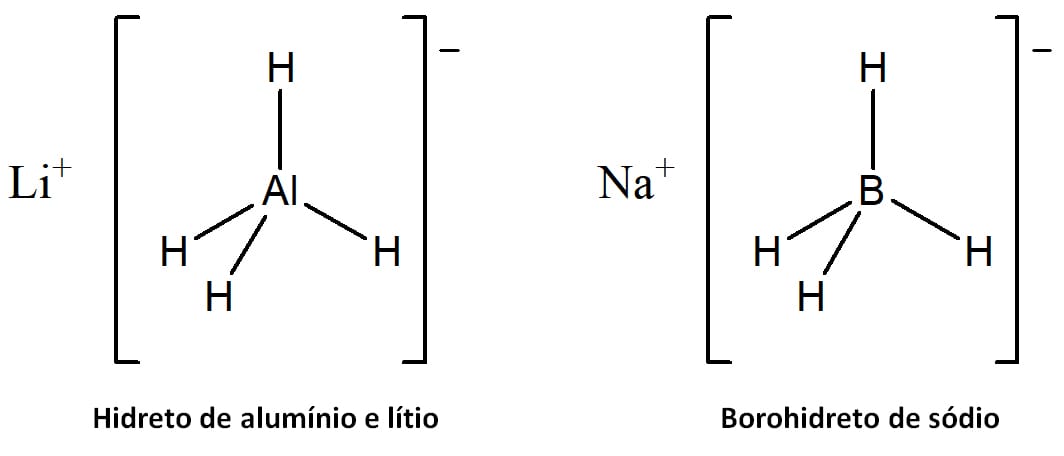
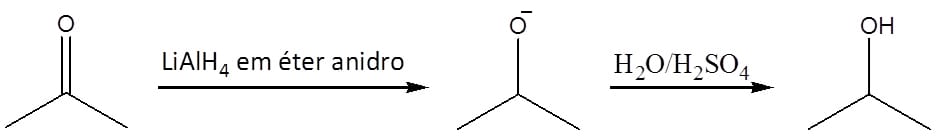
Os dois agentes redutores mais utilizados neste tipo de reação são o hidreto de alumínio e lítio (LiAlH4), também conhecido como LAH) e o borohidreto de sódio (NaBH4) (Figura 16). Nesses compostos, o hidrogênio está ligado a um elemento menos eletronegativo que ele e, por isso, apresenta carga negativa.
O hidreto de alumínio e lítio é um agente redutor bastante forte, capaz inclusive de reduzir ácidos carboxílicos e ésteres. Ele funciona muito bem com aldeídos e cetonas também. No entanto, reage violentamente na presença de doadores de prótons levando à liberação de gás hidrogênio e, em consequência, não pode ser usado na presença de água ou solventes polares próticos, como os álcoois.
Isso faz com que sua utilização em laboratório deva ser extremamente cuidadosa para que os solventes usados estejam devidamente anidros (sem água).
Água e ácido serão adicionados somente ao final, depois de todo LAH ter sido consumido na reação, de maneira a neutralizar qualquer LAH que, porventura, não tenha reagido e facilitar a extração do álcool formado (esquema 15).
O segundo reagente que vamos ver é o borohidreto de sódio. Este reagente é menos forte que o LAH. Logo, não é capaz de reduzir ácidos carboxílicos e ésteres, mas funciona perfeitamente bem para aldeídos e cetonas (esquema 16). Diferentemente do LAH, o borohidreto de sódio não reage violentamente com água ou solventes próticos, o que torna seu uso e manuseio em laboratório muito mais simples.
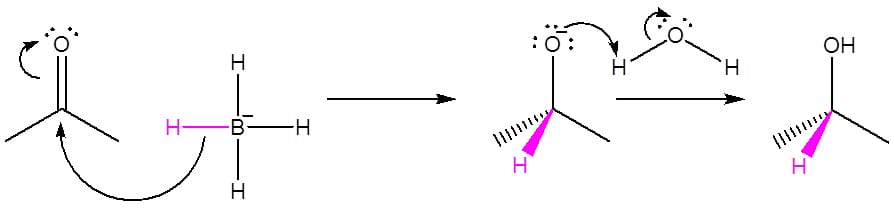
As reações de redução por hidreto se processam pela transferência do hidreto para o carbono carbonílico do aldeído ou cetona com a formação do íon alcóxido e a consequente protonação do mesmo pela água. O esquema 17 ilustra esse processo.
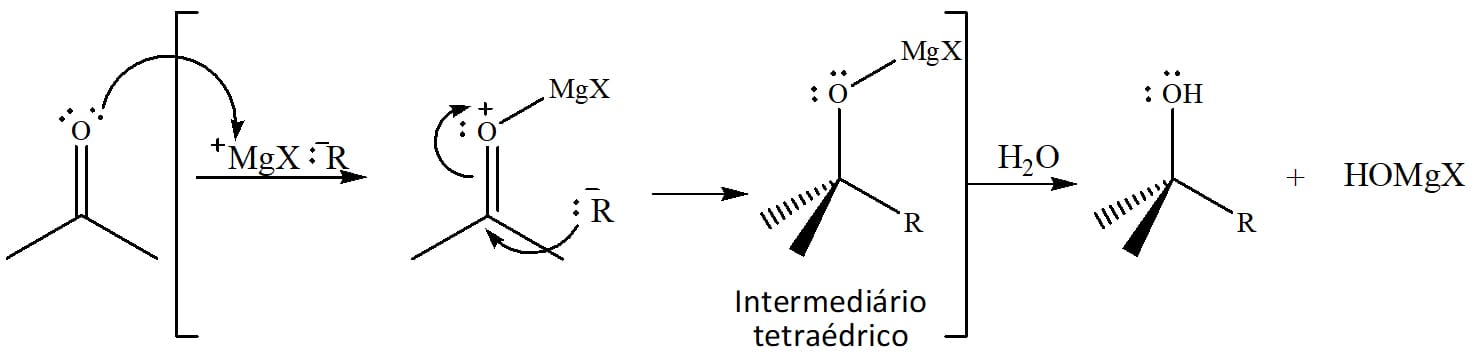
Redução por compostos de Grignard
Reagentes de Grignard são haletos de compostos de organomagnésio, ou seja, apresentam uma cadeia carbônica ligada a um átomo de magnésio ligado um átomo de halogênio (Cl, Br, I).
Esses compostos possuem uma ligação altamente polarizada (C-Mg, figura 17) e reagem com aldeídos e cetonas para formar álcoois, assim como os hidretos. A diferença entre as reações reside no nucleófilo que irá atacar o carbono da carbonila.
Enquanto antes tínhamos o íon hidreto fazendo o ataque ao carbono, aqui, o grupo R do composto de Grignard, na forma de carbânion, é quem será adicionado ao aldeído ou cetona em questão através de um ataque nucleofílico. Isso quer dizer que o formaldeído reagirá para formar um álcool primário, enquanto os demais aldeídos formarão álcoois secundários e as cetonas, álcoois terciários.
A ligação C-Mg, entre o magnésio e o grupo R, é tão polarizada que, para efeitos práticos, trataremos como R:-MgX.
A primeira etapa da reação é a formação de um complexo ácido-base de Lewis entre o oxigênio da carbonila e o íon Mg2+ a fim de tornar o carbono um eletrófilo melhor – da mesma forma que uma protonação faria. Em seguida, ocorre a adição nucleofílica de R ao carbono, gerando um intermediário tetraédrico. Quando a água for adicionada ao meio, o intermediário tetraédrico sofrerá uma hidrólise que levará à formação do álcool (esquema 18).
Quais são as limitações do uso dos reagentes de Grignard?
A primeira dificuldade é encontrar ou sintetizar o reagente de Grignard necessário à sua reação. Essa dificuldade existe, pois não é possível sintetizá-lo se houver grupos funcionais que reagirão com ele através de protonação (como hidroxila, ácido carboxílico e aminas), ou por adição a esses grupos (como nitro, amida e ciano).
A segunda dificuldade é que, assim como o LAH, reagentes de Grignard reagem com água e outros solventes polares próticos e, por isso, a reação deve ser realizada em meio polar aprótico e seco como o éter anidro.
Agora que vimos as reações de oxidação e redução de aldeídos e cetonas, que tal entender um pouquinho mais sobre sua importância fora dos laboratórios de química orgânica?
APLICAÇÃO DAS REAÇÕES DE OXIDAÇÃO E REDUÇÃO DE CETONAS E ALDEÍDOS
Assista ao vídeo que apresenta exemplos práticos das reações de oxidação e redução de cetonas e aldeídos, explorando os tipos de reações e suas aplicações no setor químico-farmacêutico.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer o mecanismo de formação de enóis e enolatos e suas reações
CONCEITOS INICIAIS

As reações de substituição alfa à carbonila envolvem a substituição de um átomo de hidrogênio por um eletrófilo através da formação de um enol ou do íon enolato. Essa reação é possível pela acidez, ainda que fraca, do átomo de hidrogênio alfa.
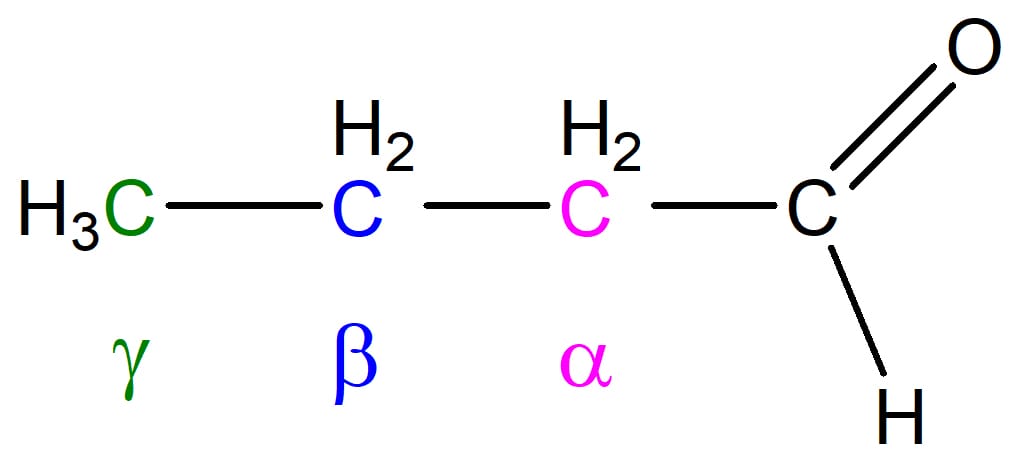
A primeira pergunta que devemos nos fazer é: quem são o carbono alfa e o hidrogênio alfa?
As letras gregas nos ajudam a designar os carbonos de um composto em relação ao carbono da carbonila. Vamos utilizar o butanal como exemplo na figura 18.
Podemos ver que o carbono alfa é o carbono imediatamente vizinho ao carbono da carbonila. Os hidrogênios seguem a mesma lógica, onde aqueles ligados ao carbono alfa, são os hidrogênios alfa, os ligados ao carbono beta são os hidrogênios beta, e assim sucessivamente.
Agora que entendemos quem são o carbono alfa e o hidrogênio alfa, a segunda pergunta importante é: quem são enol e enolato?
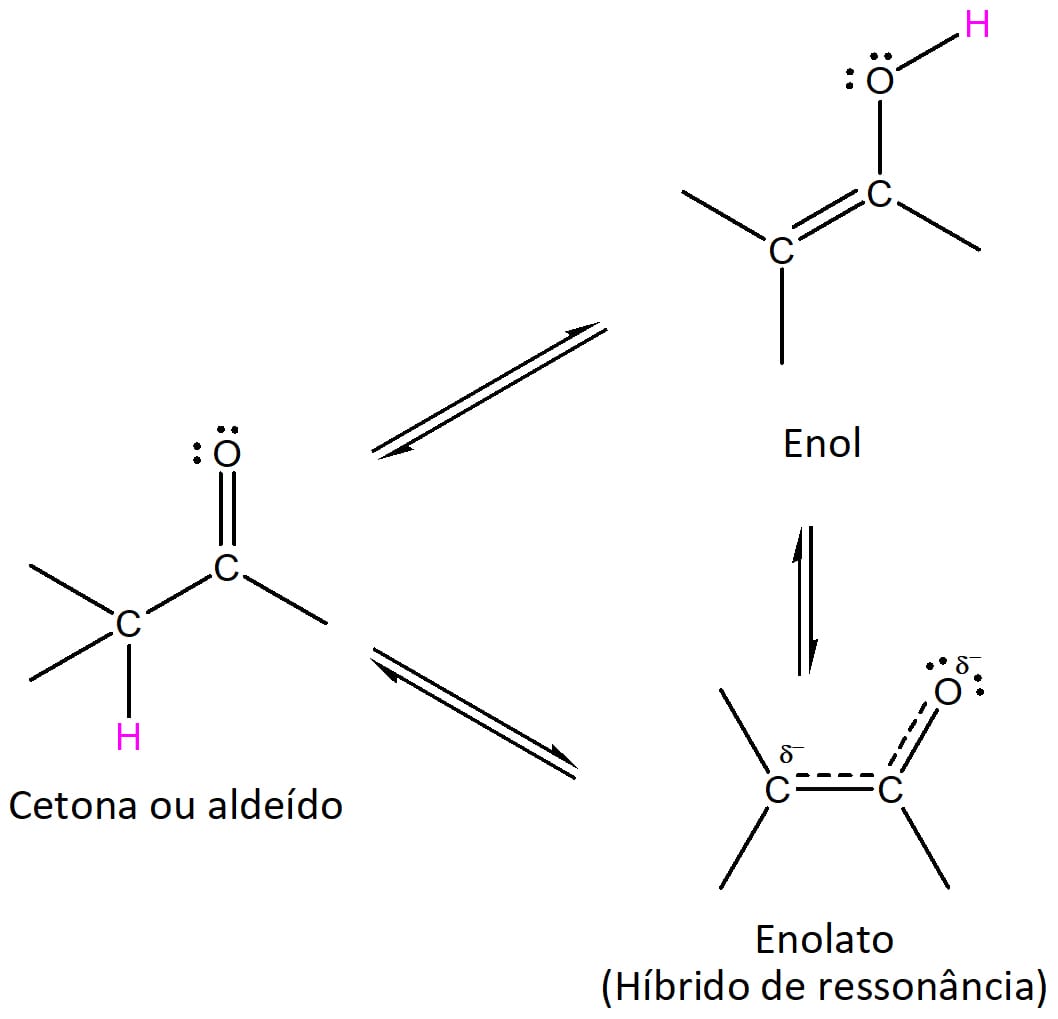
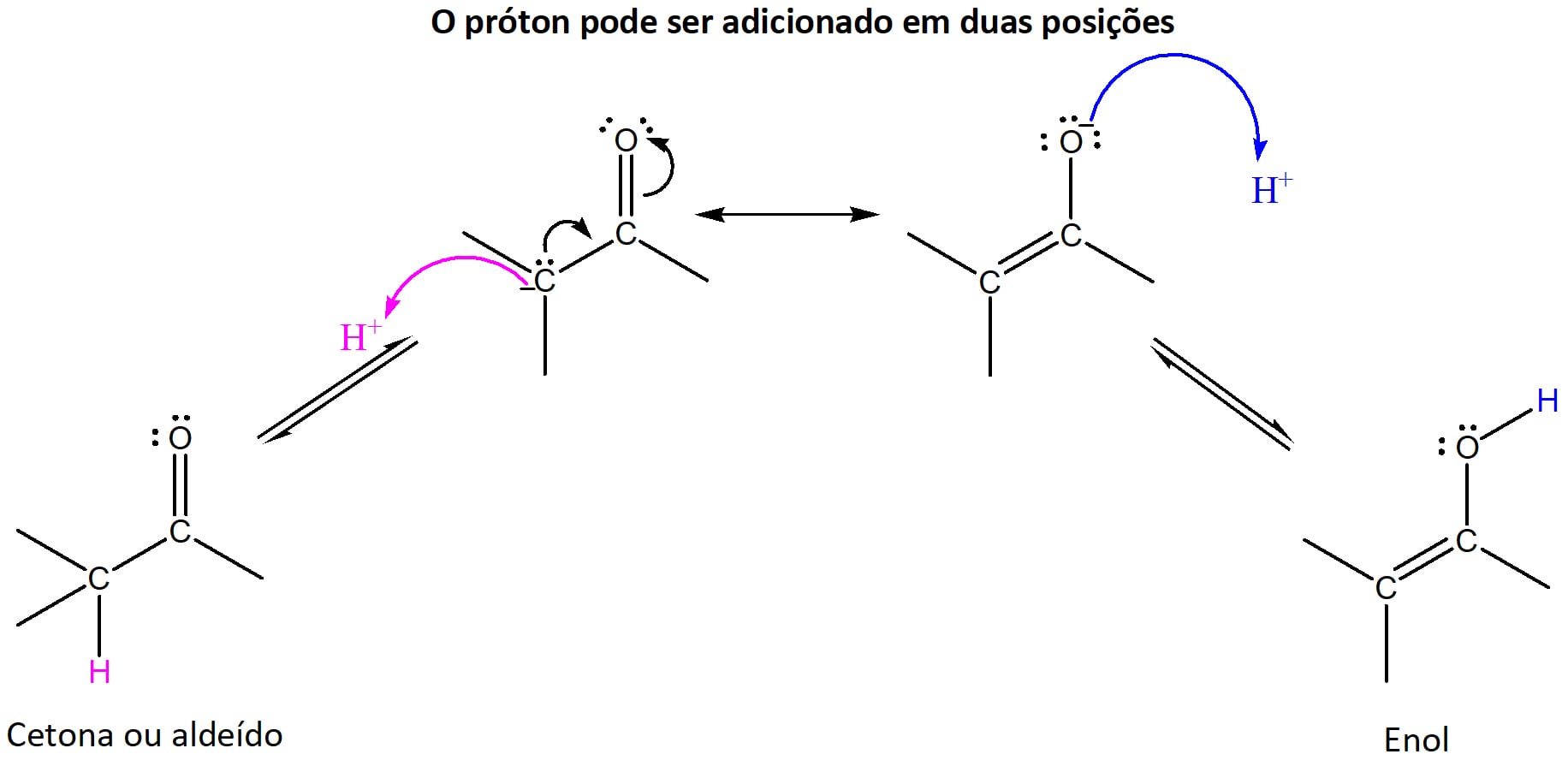
Enol (esquema 19) é um tautômero de aldeídos e cetonas, ou seja, eles são isômeros constitucionais (possuem a mesma fórmula molecular e estruturas distintas). Entretanto, diferentemente dos outros isômeros constitucionais, os tautômeros são capazes de se converter e coexistir em equilíbrio.
Atenção
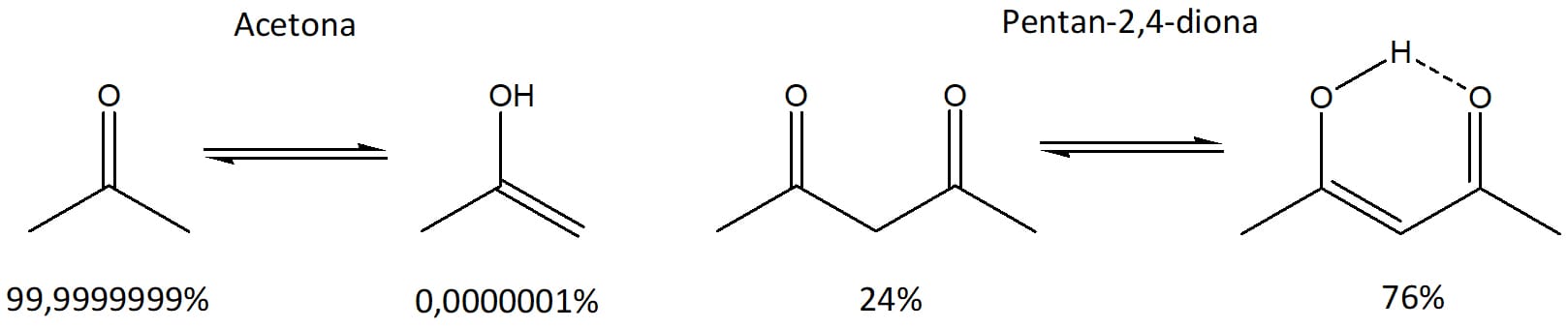
A maioria dos compostos carbonílicos se apresenta majoritariamente na forma ceto, fazendo com que os enóis puros sejam difíceis de isolar. A acetona, por exemplo, tem apenas 0,0000001% de enol à temperatura ambiente.
Por outro lado, compostos que apresentam dois grupos carbonilas separados por um átomo de carbono, conhecidos como compostos β-dicarbonilados, têm forma enólica mais presente no equilíbrio graças à formação de uma ligação de hidrogênio intramolecular que a estabiliza e à possibilidade de ressonância entre a ligação dupla C=C e a carbonila.
O esquema 20 mostra a comparação entre a acetona e a pentan-2,4-diona e seus respectivos enóis.
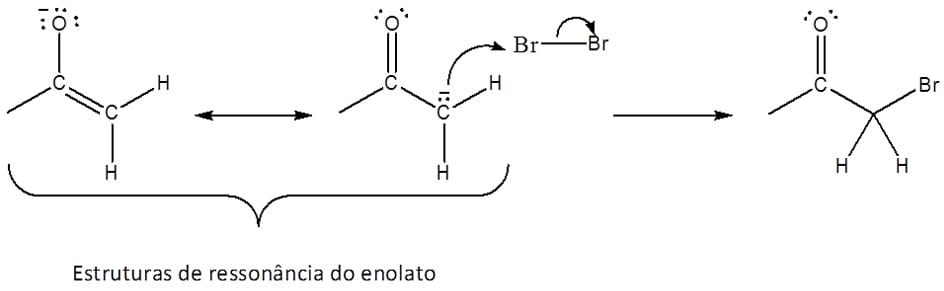
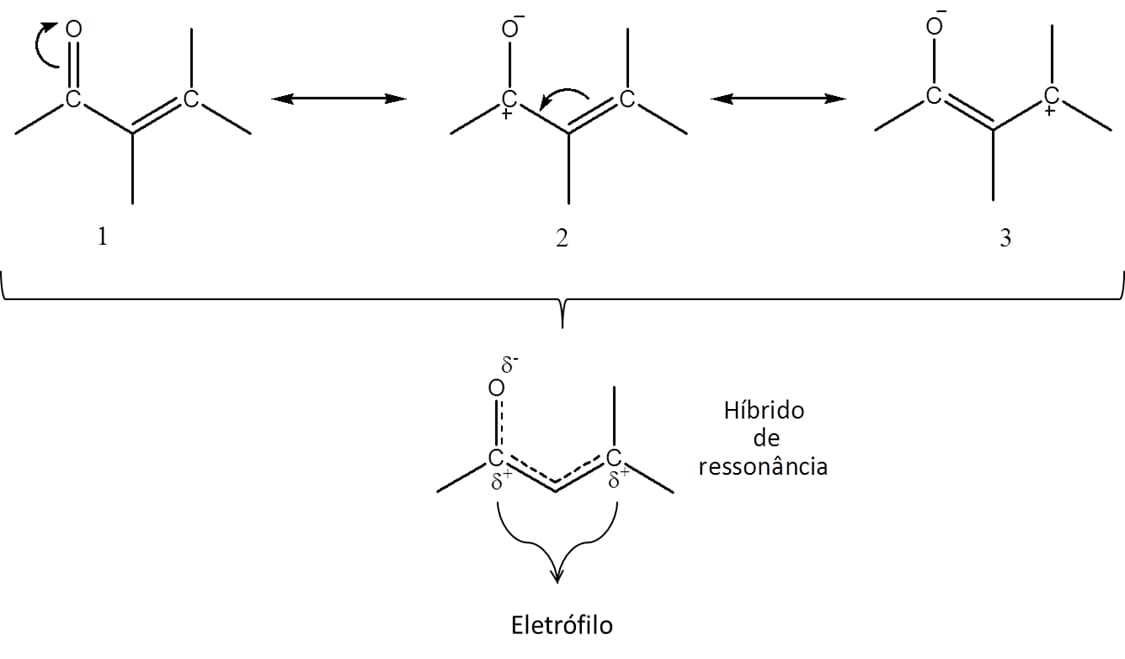
O íon enolato, por sua vez, é a base conjugada tanto da forma ceto quanto da forma enol dos aldeídos e cetonas (esquema 21) e é estabilizado por ressonância, conforme indicado pelo híbrido na figura 20.
Atenção
Um ponto importante da estrutura dos enolatos é que as duas formas de ressonância do composto não contribuem de maneira igual para o híbrido. Aquela que contém a carga negativa sobre o oxigênio contribui mais para a estrutura, pois esse elemento acomoda melhor a carga.
Quimicamente, esses compostos têm grande importância mesmo em baixas concentrações. Os enóis são nucleófilos melhores até do que alcenos, por exemplo, devido à ressonância que deixa o carbono alfa rico em elétrons. Quanto aos enolatos, apesar da menor contribuição da estrutura com a carga negativa sobre o carbono, é graças à possibilidade de sua existência que as reações que vamos estudar a seguir podem acontecer.
Acidez dos hidrogênios alfa
A maioria das reações que vamos estudar ocorre através da formação do íon enolato por perda de um hidrogênio alfa. Mas hidrogênios ligados a carbonos não são ácidos, são? A verdade é que a maioria não é, mas existem alguns cenários que tornam esses hidrogênios ácidos. A presença da carbonila é um deles.
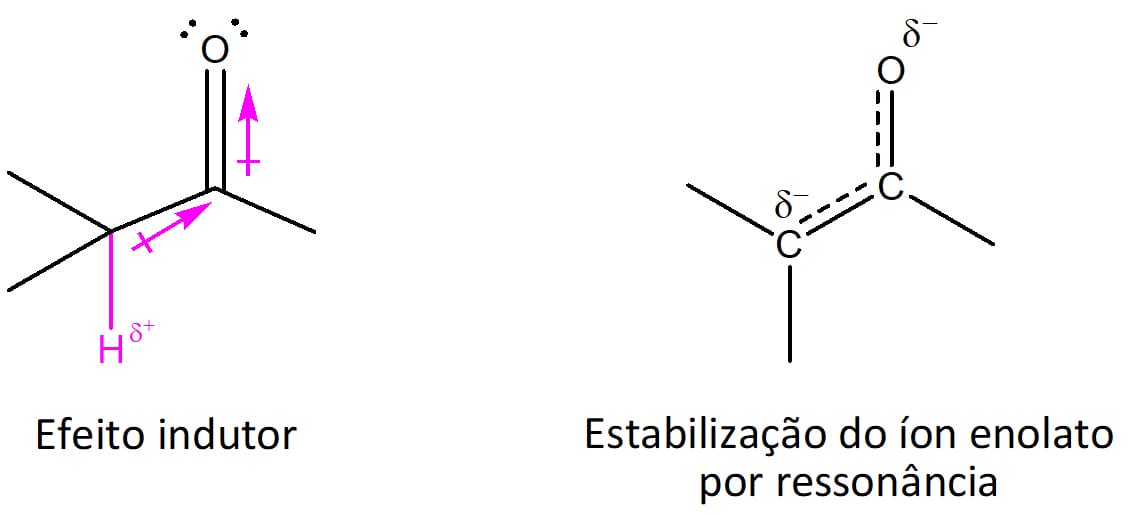
Existem dois fatores principais que influenciam a acidez do hidrogênio alfa, conforme pode ser visto na figura 19. O primeiro é o efeito indutor do grupo carbonila que atrai os elétrons na direção do oxigênio em função da sua maior eletronegatividade. O segundo fator é a estabilização por ressonância, que ocorre uma vez que o hidrogênio é perdido.
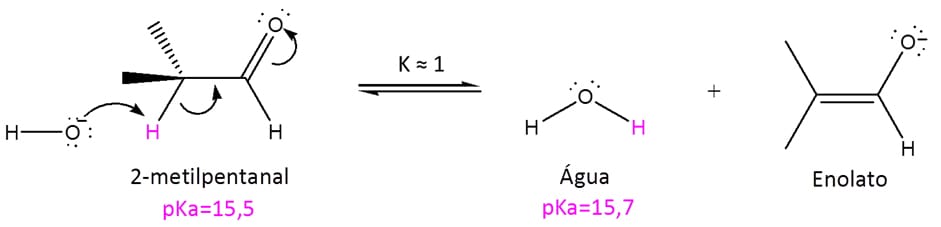
Nos aldeídos e cetonas mais simples, o pKa dos hidrogênios alfa fica em torno de 20. Isso quer dizer que eles são mais ácidos que os hidrogênios de alcinos (pKa=25), alcenos (pKa=44) e dos alcanos (pKa=60). Isso quer dizer também que bases comumente utilizadas como a hidroxila (-OH-) não são muito eficientes na desprotonação, uma vez que os pKas são muito próximos e a constante de equilíbrio é praticamente 1.
Vamos utilizar o 2-metilpropanal como exemplo no esquema 22:
Que bases podem ser utilizadas então?
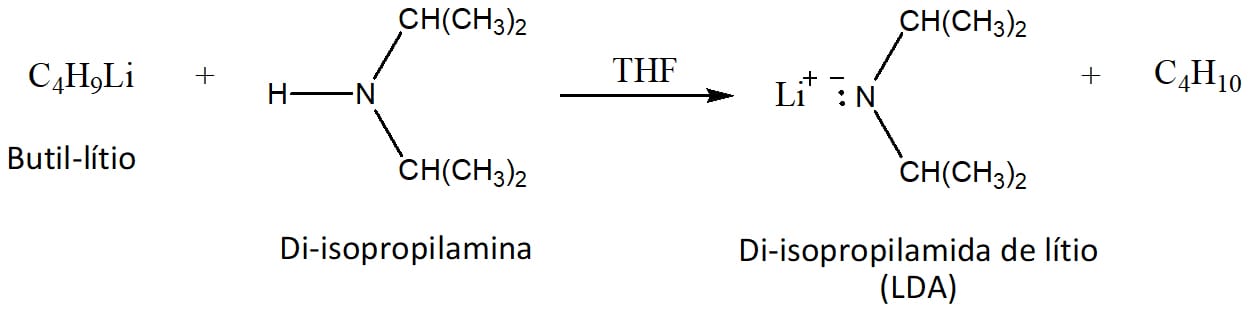
Uma base muito usada para este tipo de reação é a di-isopropilamina de lítio (LDA), capaz de converter completamente o aldeído ou cetona ao enolato. Essa base é preparada pela reação entre o butil-lítio e a di-isopropilamina, conforme o esquema 23.
As vantagens da utilização dessa base são sua força, solubilidade em solventes orgânicos, volume (não compete através de reações de adição nucleofílica) e eficiência a baixas temperaturas.
Para compostos β-carbonilados, como a pentan-2,4-diona mencionada anteriormente, o pKa do hidrogênio alfa cai para 9 uma vez que, nesses compostos, existem três estruturas de ressonância, ou seja, a carga fica ainda mais deslocalizada e, por isso, ainda mais estabilizada. O pKa mais baixo quer dizer que esses hidrogênios são mais ácidos do que os de aldeídos e cetonas simples, como a acetona, e podem ser desprotonados por bases mais fracas, como os etóxidos (esquema 24).
Agora que entendemos os princípios básicos da estrutura e reatividade desses compostos, vamos ver as diferentes reações sofridas por eles.
Halogenação no carbono alfa
A halogenação de aldeídos e cetonas pode ocorrer através de catálise ácida ou pode ser promovida por base. Vamos estudar cada uma individualmente para entender as diferenças nos mecanismos e as vantagens e desvantagens de cada método.
- Halogenação catalisada por ácido
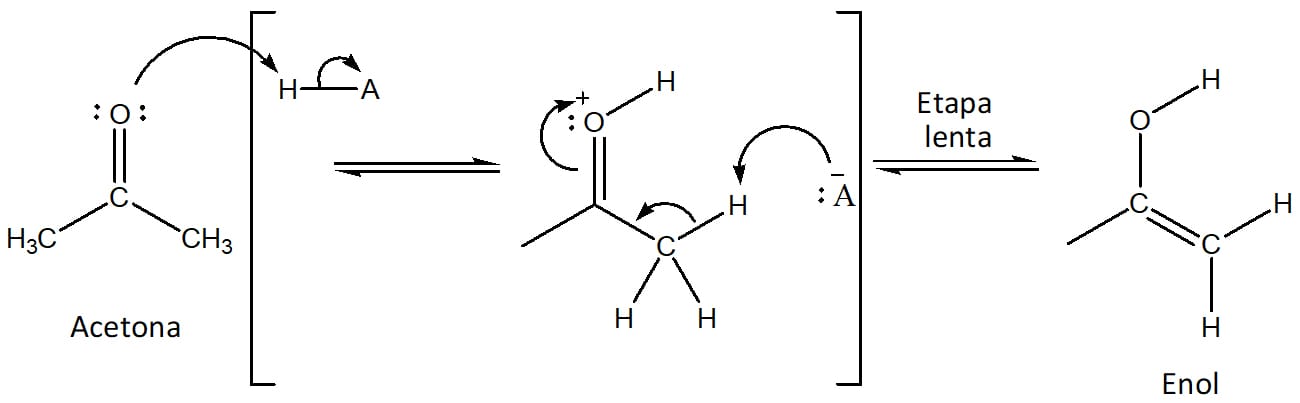
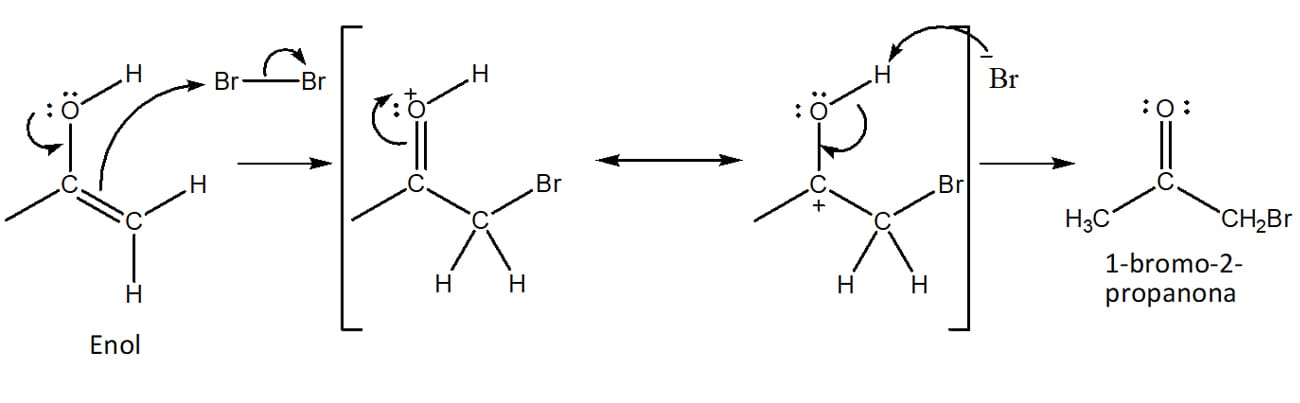
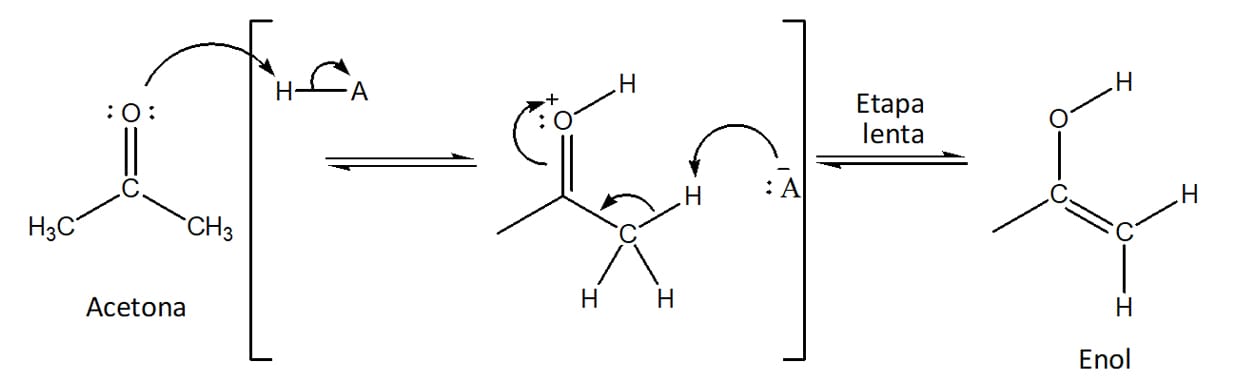
A reação entre aldeídos ou cetonas e halogênios em sua forma molecular (Cl2, Br2, I2) pode ocorrer através da formação de um intermediário enol – etapa lenta da reação – na presença de um ácido. O mecanismo da bromação da acetona será utilizado como exemplo para entendermos as etapas envolvidas na halogenação catalisada por ácido.
- Halogenação promovida por base
Como vimos anteriormente, quando um ácido é utilizado como catalisador, o intermediário da reação é o enol. Porém, quando a halogenação é promovida por base, o intermediário será o íon enolato. Apesar de termos discutido a acidez dos hidrogênios e visto que são necessárias bases muito fortes para a formação do enolato, neste caso, específico o uso de tais bases não é necessário.
Para a reação de halogenação, podemos utilizar uma base mais fraca como o hidróxido, pois mesmo uma pequena quantidade de enolato formado já é suficiente para prosseguir a reação, uma vez que ele reagirá rapidamente com o halogênio e seu consumo deslocará o equilíbrio da reação no sentido de sua formação.
Vamos analisar e discutir as etapas dessa reação passo a passo, utilizando hidróxido como base e acetona:
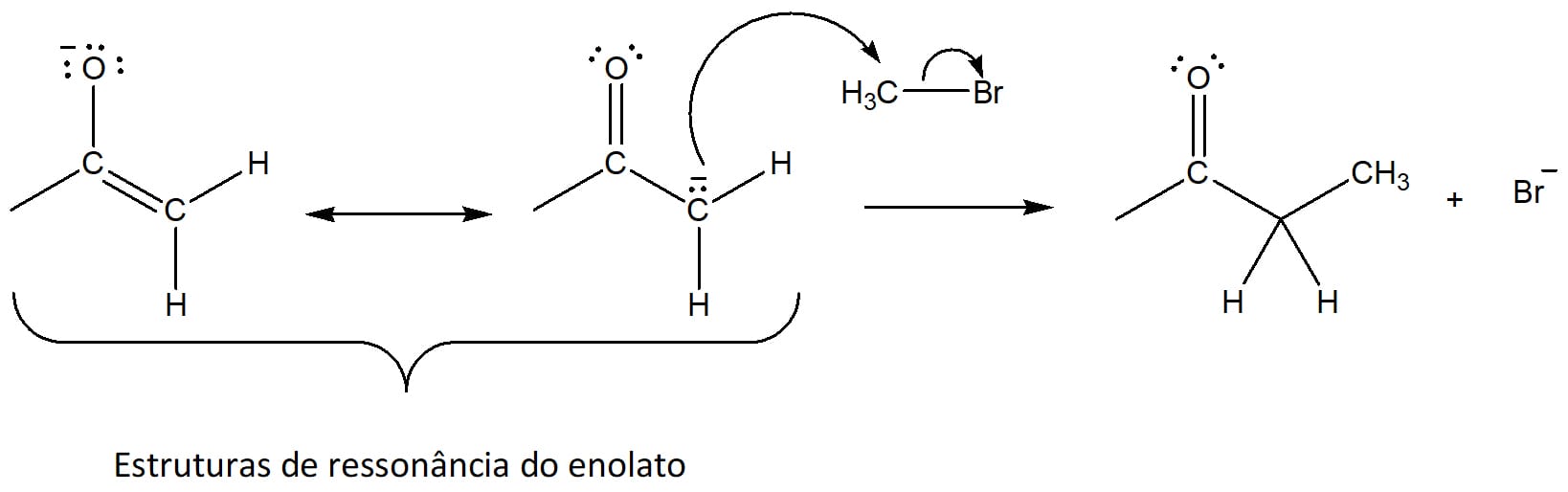
Etapa 1
Formação do enolato através da desprotonação do carbono alfa pela base. Essa é a etapa lenta da reação, a determinante da velocidade. Uma vez formado o íon enolato, ele fica em equilíbrio com a forma enólica (esquema 28).
Etapa 2
Ataque do enolato ao halogênio molecular, levando à formação do composto halogenado (esquema 29).
Aqui, devemos pontuar duas características importantes dessas reações.
A primeira é que você deve ter notado que, enquanto falamos de halogenação por catálise ácida, falamos aqui de halogenação promovida por base. Isso acontece porque enquanto o ácido é regenerado durante a reação, a base reage estequiometricamente com o aldeído ou cetona, não funcionando como um catalisador.
Um segundo ponto para o qual precisamos nos atentar é que o produto formado nesta reação tem hidrogênios ainda mais ácidos que os do composto original devido à presença do átomo de halogênio, que é bastante eletronegativo e tem um efeito indutor de retirada de elétrons bastante importante. Isso quer dizer que dificilmente essa reação fornece produtos mono-halogenados. O produto halogenado passará pelos passos 1 e 2 até que não haja mais hidrogênios ácidos.
- Reação de halofórmio
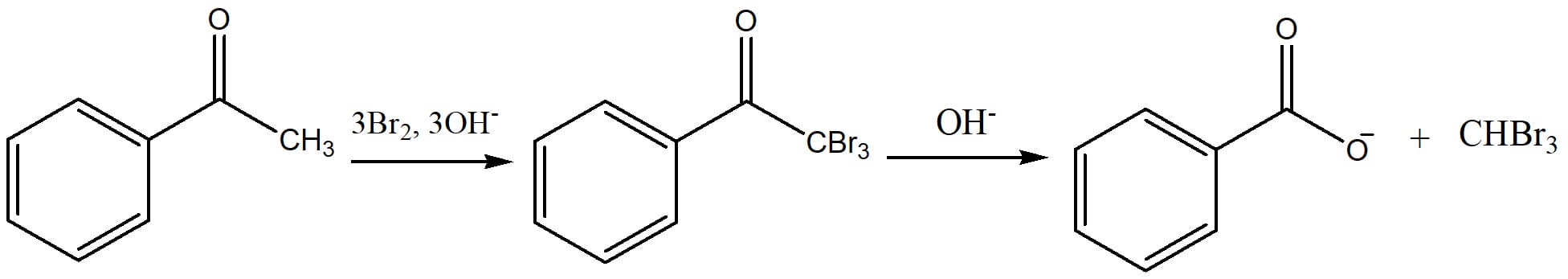
Uma metilcetona, cetona com grupo metila ligado a carbonila, que reage em meio com excesso de hidróxido e halogênio, sofre uma reação conhecida como reação de halofórmio. Nessa reação, o produto trissubstituído sofrerá uma reação de substituição e os produtos serão um halofórmio (CHCl3, CHBr3 ou CHI3) e um ácido carboxílico na forma de carboxilato (esquema 30).
Essa reação é útil, pois converte uma metilcetona em um ácido carboxílico.
Saiba mais
Normalmente utiliza-se cloro ou bromo como halogênios de escolha, pois o clorofórmio e o bromofórmio são líquidos imiscíveis em água, o que facilita sua retirada e separação do ácido de interesse. Reações com iodo formam o iodofórmio, um precipitado amarelo que pode ser útil na identificação de metilcetonas.
- Alquilação de enolatos
A alquilação direta de enolatos é uma reação de extrema importância porque possibilita a formação de uma ligação C-C, ou seja, conseguimos aumentar o tamanho da cadeia carbônica.
Essa reação se processa entre um íon enolato e um agente alquilante, normalmente um haleto ou tosilato de alquila. O mecanismo dessa reação é o mesmo de uma substituição do tipo SN2 e, por isso, segue os mesmos princípios e regras. Isso quer dizer que o substrato (agente alquilante) deve ser preferencialmente primário ou metílico (secundários não são muito reativos e terciários não reagem) e ter um bom grupo de saída, ou seja, um grupo que ao ser eliminado se torne um ânion estável.
A primeira etapa para que a reação se processe é a formação do íon enolato, que será o nucleófilo dessa reação e atacará o agente alquilante (eletrófilo). Esse mecanismo é exatamente igual ao que vimos na halogenação promovida por base. A segunda etapa do mecanismo é o ataque do enolato ao agente alquilante com a saída do grupo de saída (esquema 31).
Até este ponto, vimos diversas reações que envolvem a perda do hidrogênio alfa à carbonila. Utilizamos exemplos em que as cetonas eram simétricas, ou seja, não fazia diferença de que carbono alfa esse hidrogênio seria retirado.
Mas o que acontece quando trabalhamos com cetonas assimétricas?
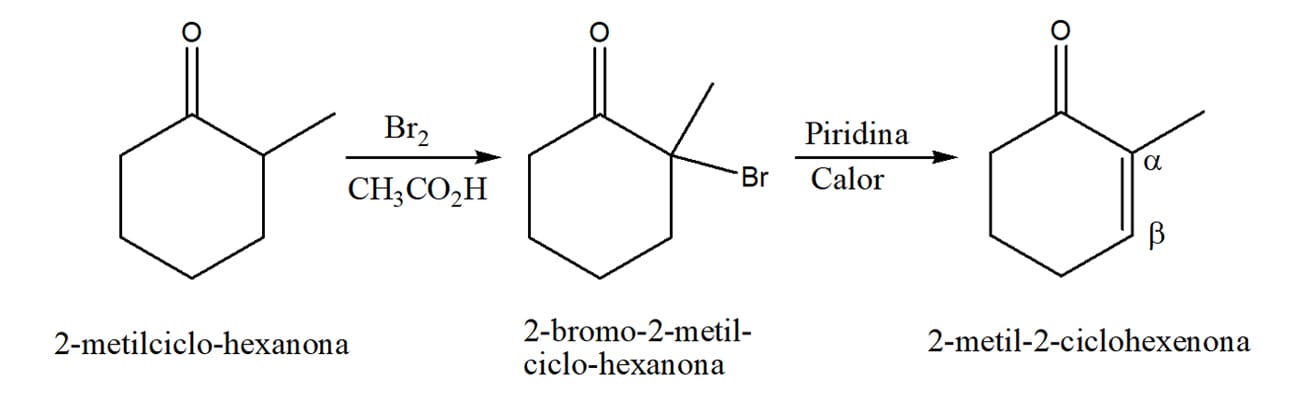
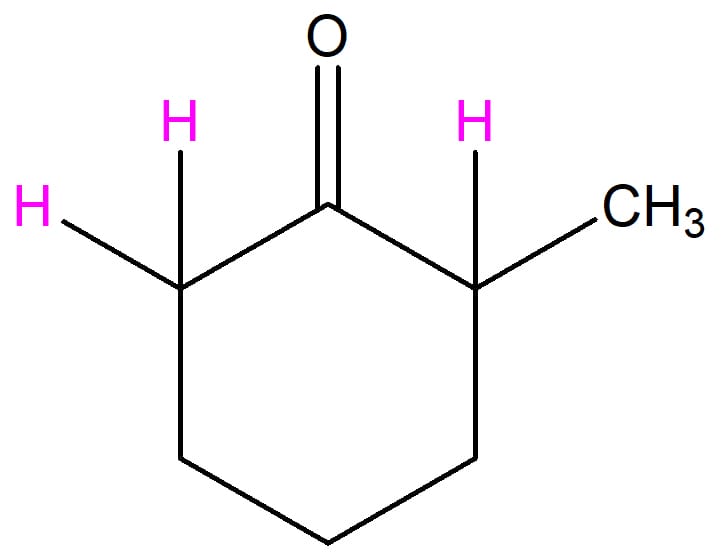
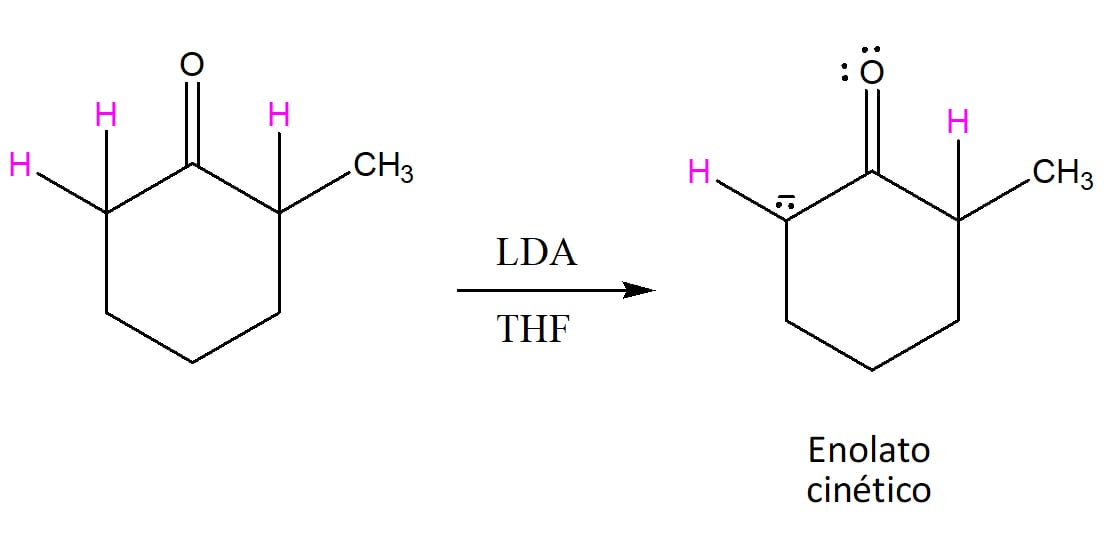
Vamos usar a 2-metilciclo-hexanona (figura 20) como exemplo:
Os hidrogênios marcados em rosa são hidrogênios alfa. Quem será retirado e onde ocorrerá a substituição?
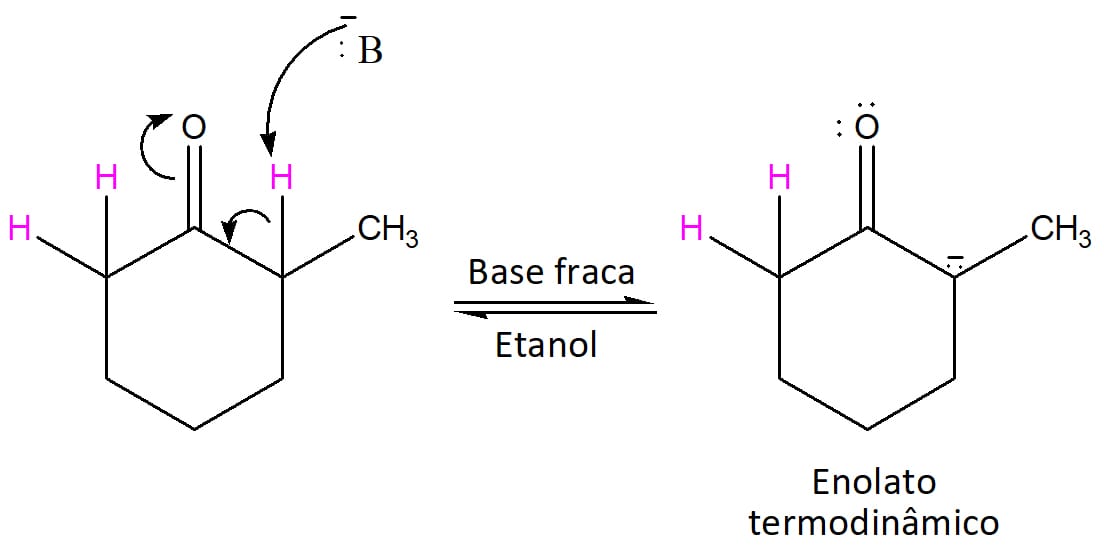
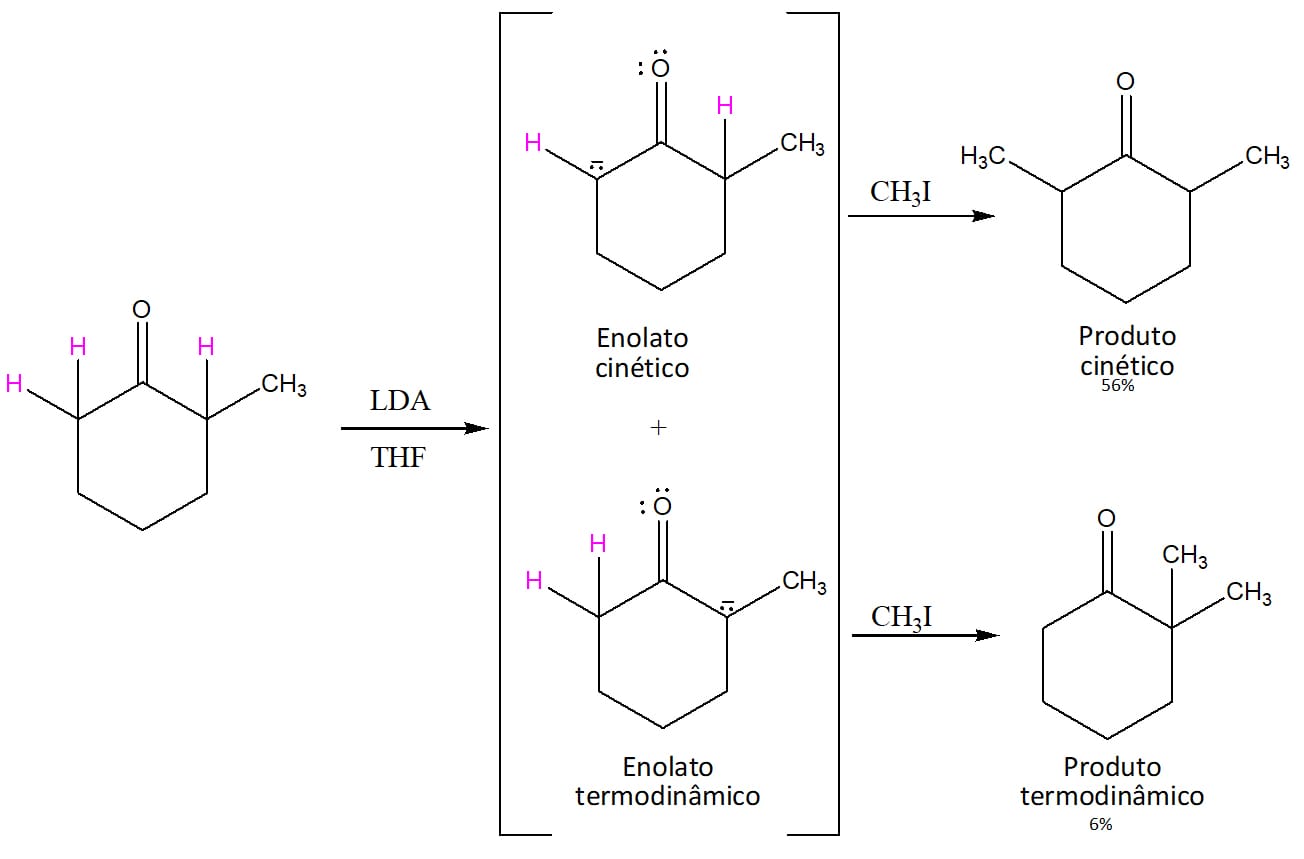
O resultado varia de acordo com as condições utilizadas na reação, pois é possível formar o enolato mais rápido (cinético) ou aquele mais estável, favorecido pelo equilíbrio (termodinâmico).
O enolato termodinâmico é favorecido pelas condições de reação que permitem o estabelecimento do equilíbrio. Neste sentido, temos o uso de bases mais fracas (etóxidos) e solventes que sejam capazes de se juntar em torno da molécula e estabilizar (solvatar) o enolato, como o etanol, por exemplo.
Nesses casos, a substituição ocorrerá no carbono alfa mais substituído, como no caso do esquema 32.
Caso a base utilizada seja uma base volumosa e forte, como o LDA que vimos anteriormente, ela irá retirar o hidrogênio de mais fácil acesso, ou seja, aquele que estiver no carbono menos substituído, como no esquema 33.
Atenção
É importante pontuar, no entanto, que embora o uso de LDA permita o favorecimento da formação do enolato cinético (menos estável), ainda haverá formação do enolato termodinâmico, mesmo que em pequena quantidade.
A reação final de alquilação ocorrerá conforme o esquema 34:
Podemos ver que o produto cinético é a 2,6-dimetilciclo-hexanona, que será majoritária, e o produto termodinâmico será a 2,2-dimetilciclo-hexanona, que será formada em quantidade bem menor.
QUAL É A IMPORTÂNCIA DESSES COMPOSTOS?
A importância química de enóis e enolatos vêm da sua capacidade de formar produtos que são intermediários valiosos e formar ligações C-C, permitindo o aumento de cadeias carbônicas.
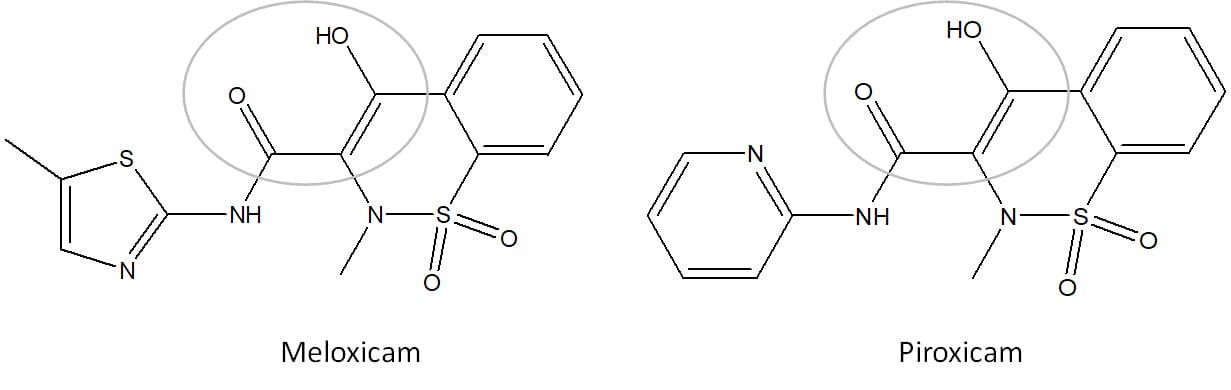
No dia a dia, você pode ter ouvido falar dos enóis sem saber. Existe uma classe de medicamentos bastante importante conhecida como antiinflamatórios não-esteróides (AINEs). Os AINEs podem ser subdivididos de acordo com a semelhança química entre os compostos, e uma dessas subclasses é a dos ácidos enólicos, também chamados de oxicans.
São essencialmente dois fármacos que compõem o grupo, o meloxicam e o piroxicam e, assim como todos os AINEs, eles apresentam ação antipirética, analgésica e antiinflamatória (figura 21) por inibição das enzimas cicloxigenases (COX).
Esses fármacos não são recomendados para tratamento de dores agudas, mas são muitos importantes em tratamentos de longo prazo de doenças como a artrite reumatoide e a osteoartrite.
CONHECENDO ENÓIS DE IMPORTÂNCIA FARMACOLÓGICA E SUAS REAÇÕES
Assista ao vídeo que apresenta os exemplos de substâncias que possuem o grupamento enol que apresentam importância farmacológica e exemplos de reações.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Identificar produtos de reações de condensação aldólica e os princípios da adição conjugada a compostos carbonílicos
REAÇÕES ALDÓLICAS
Até este momento, estudamos a adição nucleofílica que ocorre no carbono da carbonila e as reações com enolatos. Nesta seção, iremos estudar o que acontece quando duas moléculas de aldeídos ou cetonas reagem entre si em uma combinação de adição nucleofílica com reações de substituição alfa.
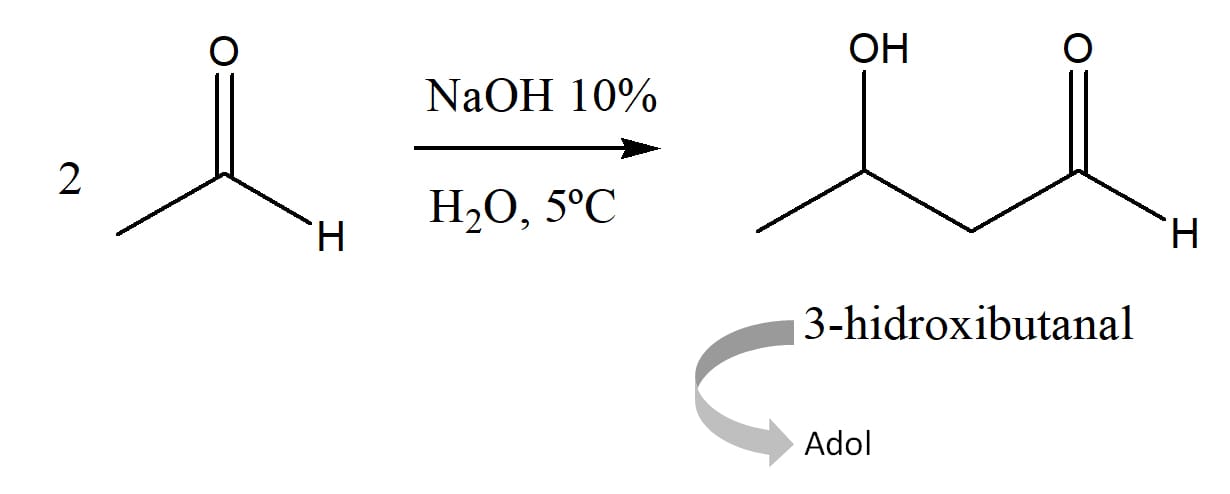
As reações são denominadas reações aldólica. O produto formado é conhecido como aldol (aldeído + álcool).
Exemplo
Duas moléculas de etanal reagem para gerar uma molécula de 3-hidroxibutanal.
Estas reações são importantes porque formam uma ligação C-C. A natureza se utiliza muito desse tipo de reação. Veremos alguns exemplos ao longo do nosso estudo.
Para que possamos entender as características e condições dessa reação, vamos entender o passo a passo de seu mecanismo.
Etapa 1
Para que a reação possa ocorrer, primeiramente deve ser formado o enolato, uma etapa dependente de catálise básica, conforme pode ser visto no esquema 36.
Etapa 2
O enolato ataca a cetona ou aldeído que não foi desprotonado e, por isso, tem o carbono da carbonila como um bom eletrófilo, levando à formação de um alcóxido (esquema 37).
Etapa 3
O alcóxido, uma base mais forte que a água, retira um próton dela, o que leva à formação do aldol, regenerando o catalisador básico (esquema 38).
Alguns pontos devem ser observados agora que vimos o mecanismo geral da reação. Entenda:
O primeiro deles é que essa reação só acontece caso o aldeído ou cetona tenha hidrogênios alfa para que haja formação do enolato. Além disso, devemos observar que a etapa 2 envolve o ataque de uma cetona ou aldeído à outra molécula igual, o que quer dizer que, quanto maior o grau de substituição das moléculas, mais difícil se torna a adição em função do impedimento estérico. Por isso, cetonas em geral e aldeídos substituídos no carbono alfa têm o equilíbrio deslocado na formação dos reagentes, enquanto aldeídos que não tenham substituintes no carbono alfa apresentam o equilíbrio deslocado no sentido dos produtos.
Para cetonas e aldeídos substituídos na posição alfa, é possível deslocar o equilíbrio no sentido dos produtos, no entanto, com a desidratação do aldol, como veremos mais à frente.
Todas as etapas da reação aldólica são reversíveis. Isso quer dizer que podemos gerar aldeídos ou cetonas a partir de aldóis. A reação retro-aldol é favorecida no equilíbrio para a formação de cetonas, o que pode não parecer importante ou que faça sentido.
Por que alguém iria querer fazer o contrário?
Essa é uma reação extremamente importante, por exemplo, para a glicólise, um processo bioquímico utilizado para obtenção de energia no organismo humano. Na glicólise, a enzima aldolase é responsável por quebrar a molécula de frutose 1,6-bifosfato para gerar duas moléculas com três carbonos cada, o gliceraldeído-3-fosfato e a diidroxiacetona fosfato, numa reação do tipo retro-aldol, com o objetivo de fornecer as trioses precursoras do piruvato.
Reação de condensação aldólica
A condensação aldólica é o conjunto das reações anteriores somada à reação de desidratação dos aldóis. O nome “condensação aldólica” deriva da formação da água e sua condensação no decorrer da reação.
Lembra quando falamos que a desidratação era capaz de deslocar o equilíbrio da reação aldólica de cetonas?
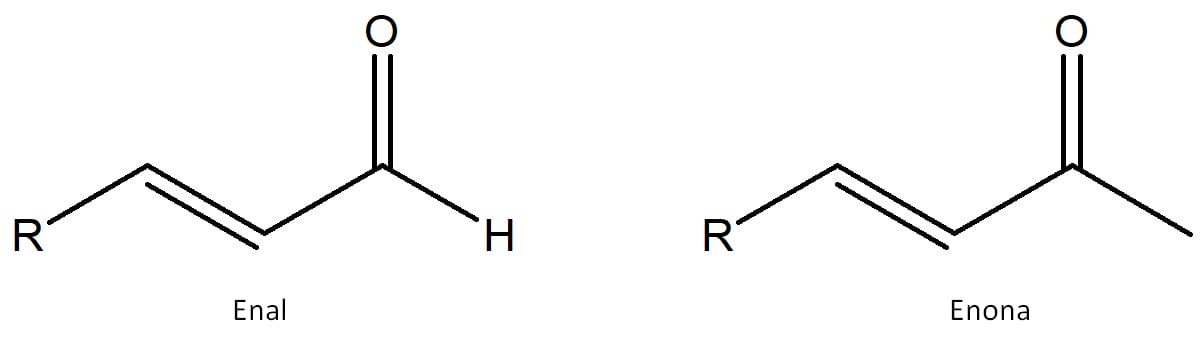
Isso é verdade, pois a desidratação do aldol é um processo irreversível, no qual ocorre a formação de um produto carbonílico α, β – insaturado denominado enal (aldeído) ou enona (cetona). Este produto, cuja estrutura geral pode ser vista na figura 22, é muito estável em função da conjugação da molécula.
Essa reação pode ser catalisada por base ou por ácido. A catálise básica passa por todas as etapas de adição que vimos, permitindo o isolamento do aldol. Na catálise ácida, o aldeído ou cetona reage diretamente para formar o enal ou enona. Esse mecanismo é particularmente importante na reação de cetonas, já que elas são mais impedidas estericamente e têm o equilíbrio deslocado no sentido da formação dos reagentes.
Catálise básica
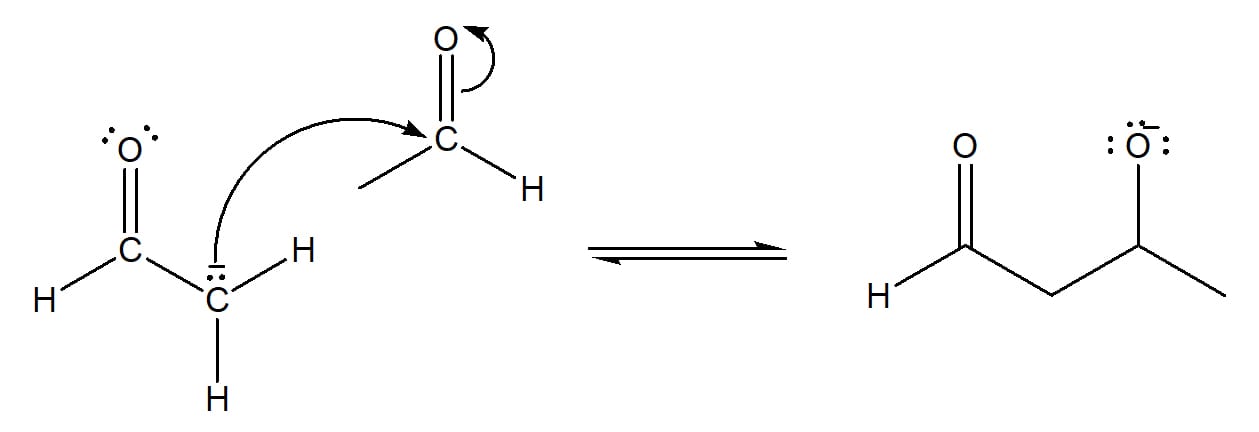
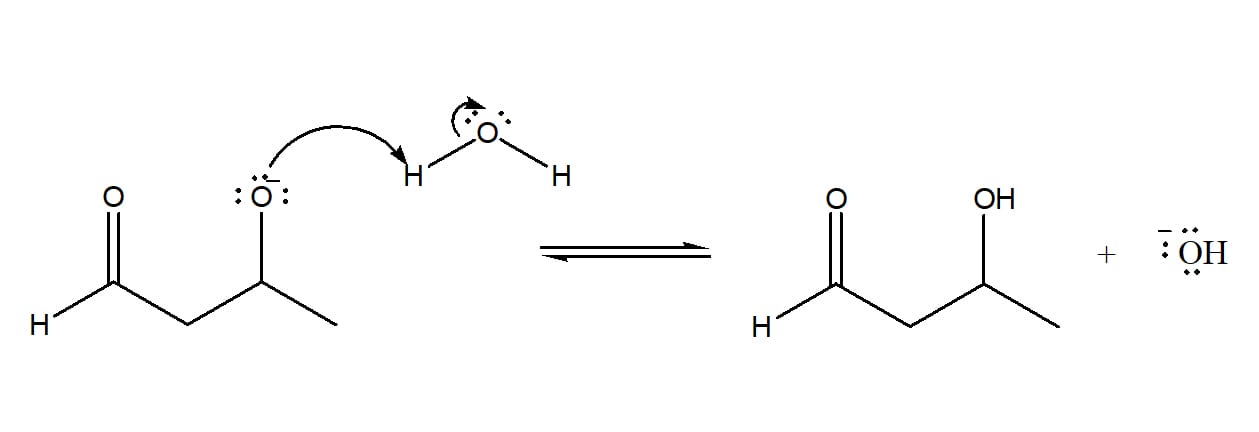
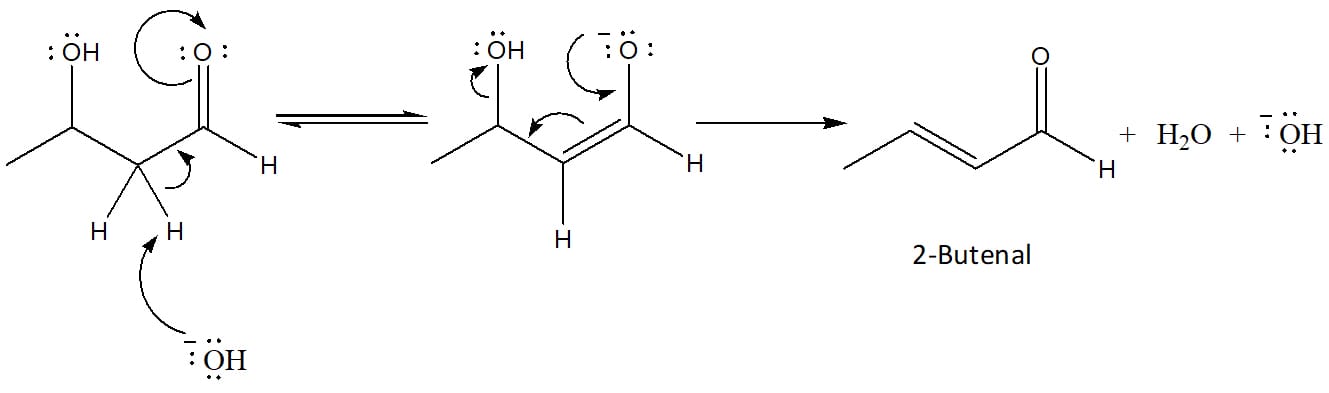
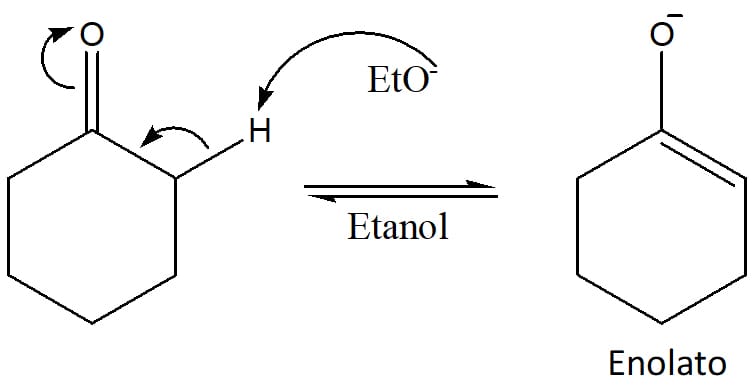
Na catálise básica, o hidrogênio alfa do aldol é retirado pelo hidróxido, levando à formação de uma molécula de água e gerando um íon alcóxido. Esse íon sofre um rearranjo que leva à expulsão de um íon hidroxila da molécula, regenerando o catalisador e dando origem ao produto α, β – insaturado mais estável, conforme pode ser visto no esquema 39.
Catálise ácida
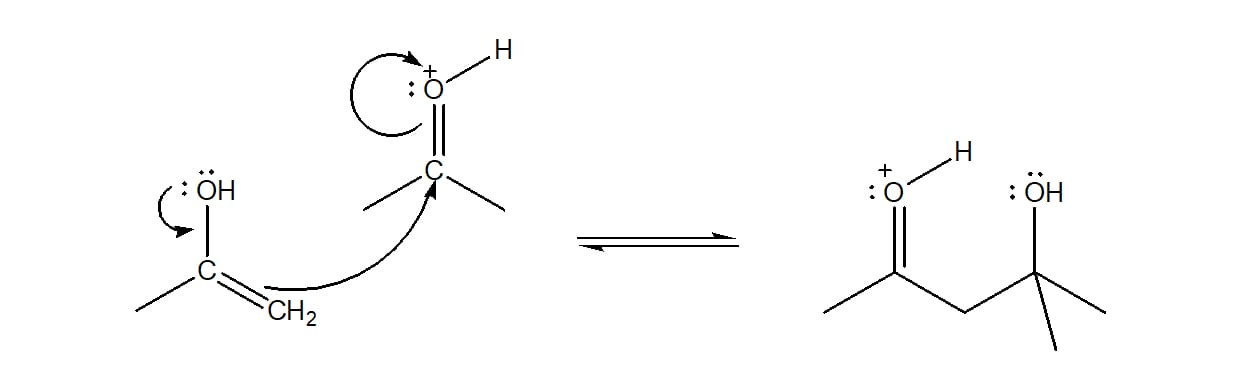
Na catálise ácida, o mecanismo é um pouco diferente e vamos ver um exemplo utilizando a acetona.
Etapa 1
Nesta etapa, o enol intermediário é formado através da protonação do oxigênio da carbonila e da retirada do hidrogênio alfa pela base conjugada do ácido (esquema 40).
Etapa 2
O enol, nucleófilo, ataca uma molécula de acetona protonada, levando à formação de um intermediário protonado (esquema 41).
Etapa 3
O próton é transferido do oxigênio carbonílico para o oxigênio do álcool, tornando-o um ótimo grupo de saída. A base conjugada do ácido utilizado como catalisador ataca o hidrogênio alfa, regenerando o catalisador ácido, formando uma molécula de água e o produto α, β – insaturado (esquema 42).
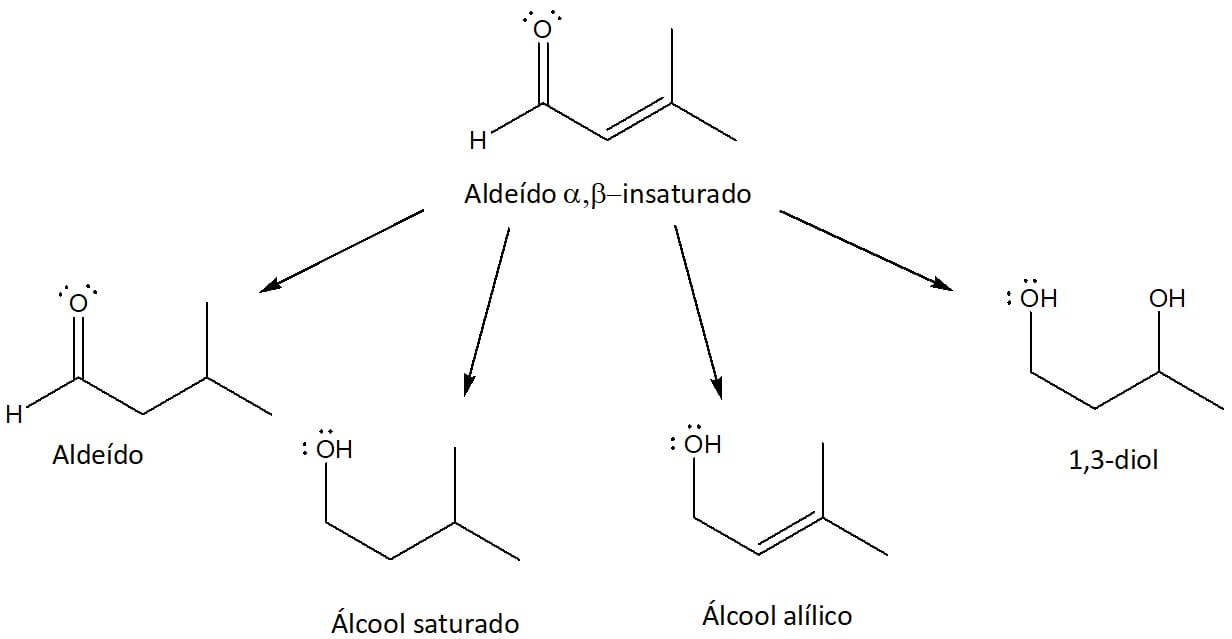
A formação de compostos α, β – insaturados é muito importante, pois eles podem sofrer reações de redução, por exemplo, e levar a diversos outros produtos. A figura 23 expõe os tipos de compostos que podem ser obtidos a partir de um aldeído α, β - insaturado, como aldeídos simples, álcoois saturados, 1,3-dióis e álcoois alílicos. Mais à frente, veremos também como esses produtos se comportam em reação de adição nucleofílica.
A variedade de produtos que podem ser obtidos a partir de aldeídos α, β – insaturados torna a reação de condensação aldólica uma grande ferramenta na síntese orgânica e, consequentemente, fazem seu entendimento ser tão importante.
Reações de aldol cruzadas
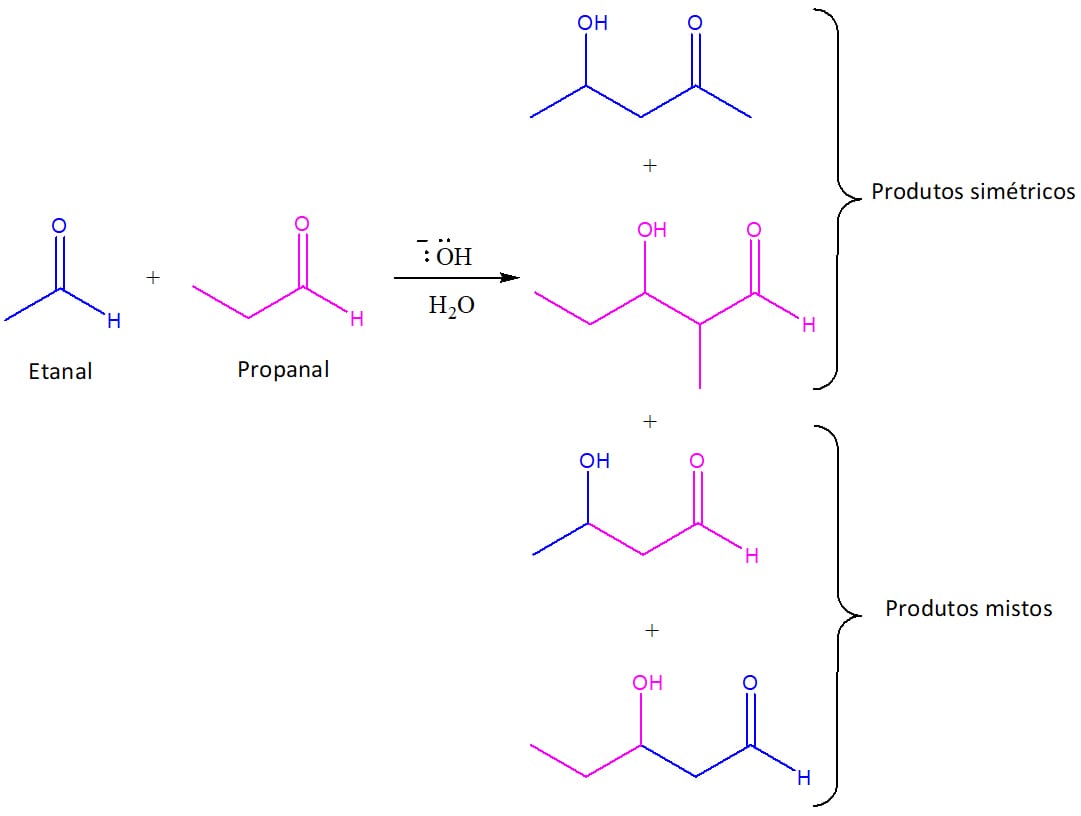
Até o momento, vimos o mecanismo e entendemos as reações aldólicas entre duas moléculas do mesmo composto, mas você deve imaginar que é possível reagir aldeídos e cetonas diferentes, e você está certo! Se colocarmos em um balão dois compostos diferentes nas condições apropriadas para que a reação aldólica se processe, no entanto, obteremos quatro produtos, e não apenas um (esquema 43).
Uma reação que fornece quatro produtos não é interessante em síntese orgânica porque significa maior dificuldade na purificação desses produtos e menores rendimentos. Existem, no entanto, maneiras de obter apenas um produto em reações aldólicas cruzadas, que dependem das condições do meio e dos reagentes utilizados.
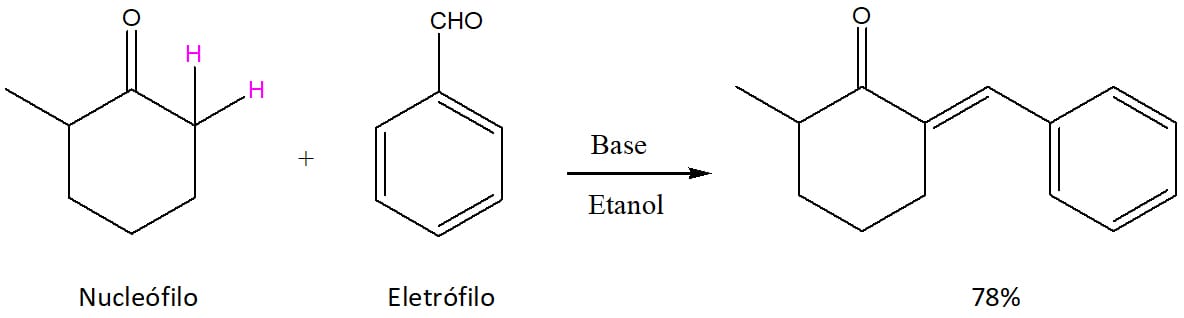
A primeira condição que possibilita a formação de um único produto cruzado é quando um dos compostos envolvidos na reação não tiver um hidrogênio alfa, como o benzaldeído, por exemplo. A falta do hidrogênio alfa quer dizer que o composto não forma o íon enolato e não pode ser o nucleófilo da reação. Note no esquema 44 que apenas um dos reagentes possui hidrogênios alfa (marcados em rosa) e o produto misto é formado com 78% de rendimento.
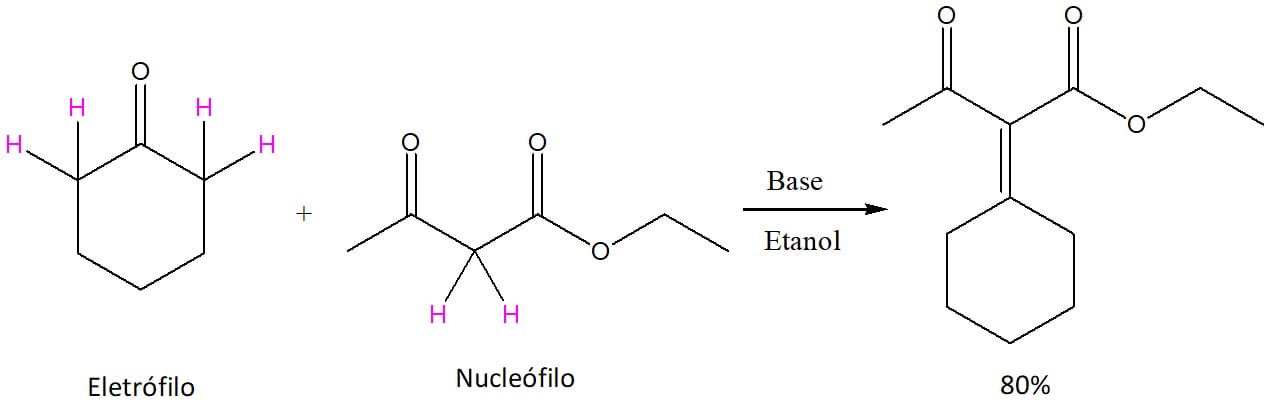
A outra condição que favorece a formação de produtos mistos é quando um dos reagentes possui um hidrogênio alfa consideravelmente mais ácido que o outro. É o caso que envolve compostos 1,3-dicarbonilados, por exemplo.
Neste caso, os hidrogênios alfa formam enolatos estabilizados por duas carbonilas ao invés de apenas uma, o que favorece sua estabilidade. Quando a ciclo-hexanona reage com o acetoacetato de etila, por exemplo, o produto preferencial é o produto misto, como podemos ver no esquema 45. Ou seja, com um bom nucleófilo ou um bom eletrófilo, é possível direcionar a formação do produto no sentido do produto misto.
REAÇÕES ALDÓLICAS INTRAMOLECULARES
Assista ao vídeo a seguir em que será explicado como ocorrem reações aldólicas intramoleculares.
Adições a aldeídos e cetonas α, β – insaturados
Um aldeído ou cetona α, β – insaturado é aquele que possui uma dupla ligação entre o carbono alfa e o carbono beta. Até o momento, nós estudamos reações que acontecem por adição do nucleófilo à carbonila ou devido à acidez do hidrogênio alfa à carbonila. Agora, vamos ver que a insaturação α,β também confere características de reação interessantes a esses compostos.
Primeiramente, vamos analisar a molécula em si (figura 24) e a importância da ressonância para as reações que veremos a seguir.
Atenção
Devemos observar que o composto possui três estruturas de ressonância, duas das quais apresentam carga positiva e negativa na mesma estrutura. Tanto a estrutura 2 quanto a 3 têm a carga negativa sobre o oxigênio. Isso quer dizer que elas contribuem significativamente para o híbrido de ressonância. Uma segunda característica importante evidenciada pelas estruturas de ressonância é que tanto o carbono carbonílico quanto o carbono beta presentam carga parcial positiva e são eletrofílicos.
O híbrido de ressonância deixa claras as cargas parciais de cada um dos átomos dessa estrutura e mostra que um nucleófilo pode entrar em qualquer um dos dois carbonos.
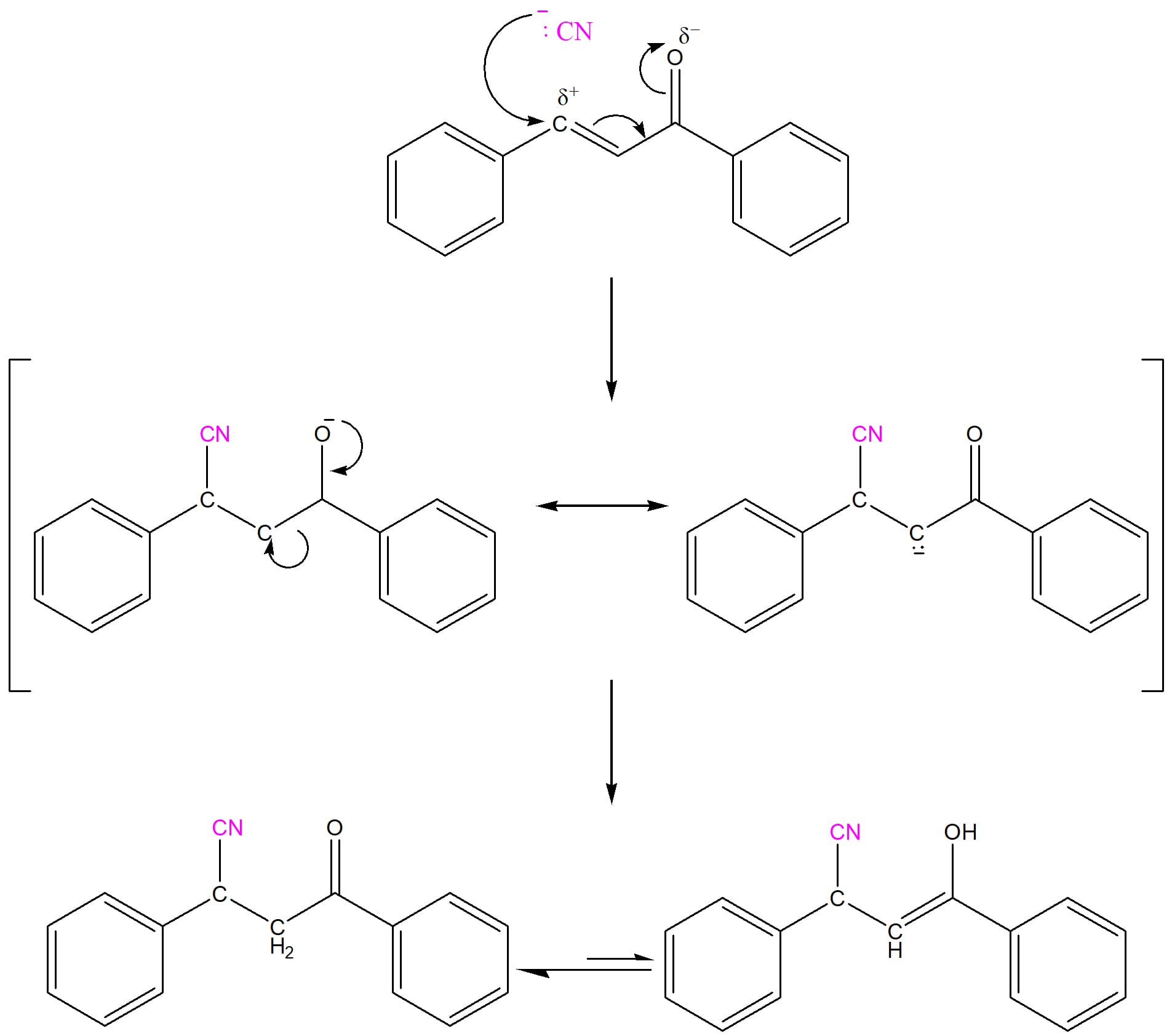
Os nucleófilos capazes de se adicionar ao carbono carbonílico de aldeídos e cetonas simples também são capazes de se adicionar aos carbonos beta, e os nucleófilos fracos têm nos carbonos beta o caminho de reação preferencial, como pode ser visto no esquema 46.
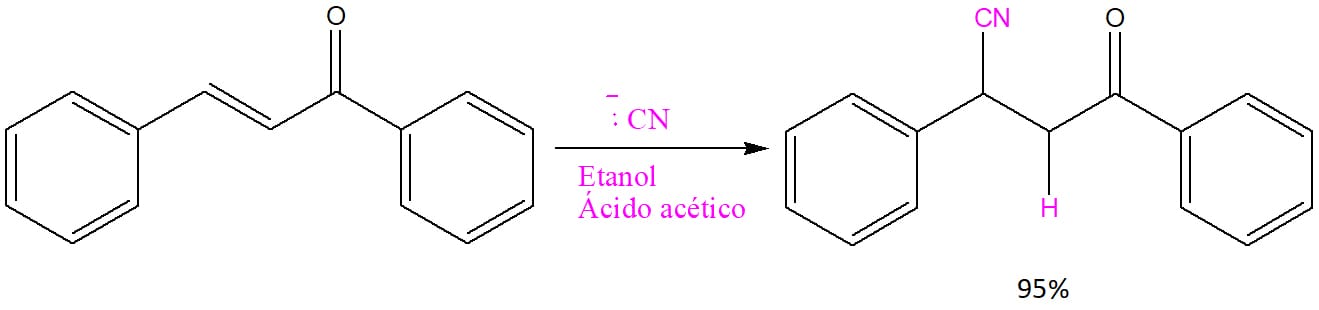
O mecanismo ocorre da forma exemplificada no esquema 47:
O cianeto ataca o carbono beta, que apresenta uma carga parcial positiva, e o íon enolato formado é, em seguida, protonado, dando origem ao produto substituído com o equilíbrio ceto-enólico deslocado no sentido da forma ceto.
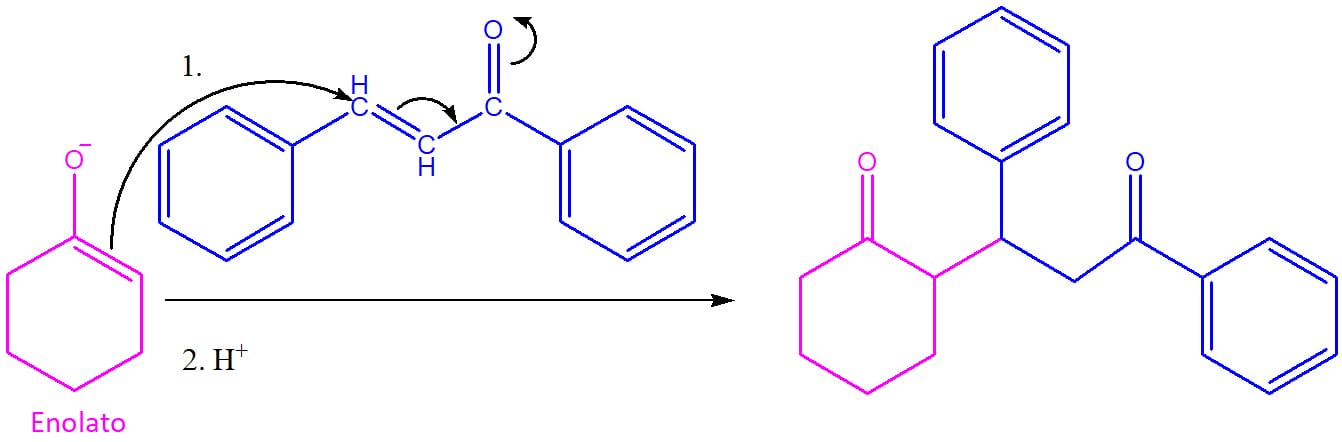
Reação de Michael
Quando o nucleófilo que ataca um composto α, β – insaturado é um enolato, chamamos o processo de reação de Michael em homenagem a seu descobridor. O mecanismo desse processo é similar à maioria das outras reações que já vimos. Na primeira etapa, uma base retira o hidrogênio alfa de um composto carbonilado, levando à formação de um enolato (esquema 48).
Michael
Arthur Michael (1853-1942) foi um químico orgânico americano. Apesar de ser autodidata, foi discípulo de grandes nomes da Química, dentre eles Robert Bunsen e Dimitri Mendeleev.
O par de elétrons da dupla ligação do enolato se adiciona ao carbono beta do composto α, β – insaturado, formando uma nova ligação C-C. O novo enolato formado é protonado e leva ao produto de adição neutro (esquema 49).
Essa reação pode ocorrer não só com aldeídos e cetonas, mas também com outros compostos, como as nitrilas α, β - insaturadas.
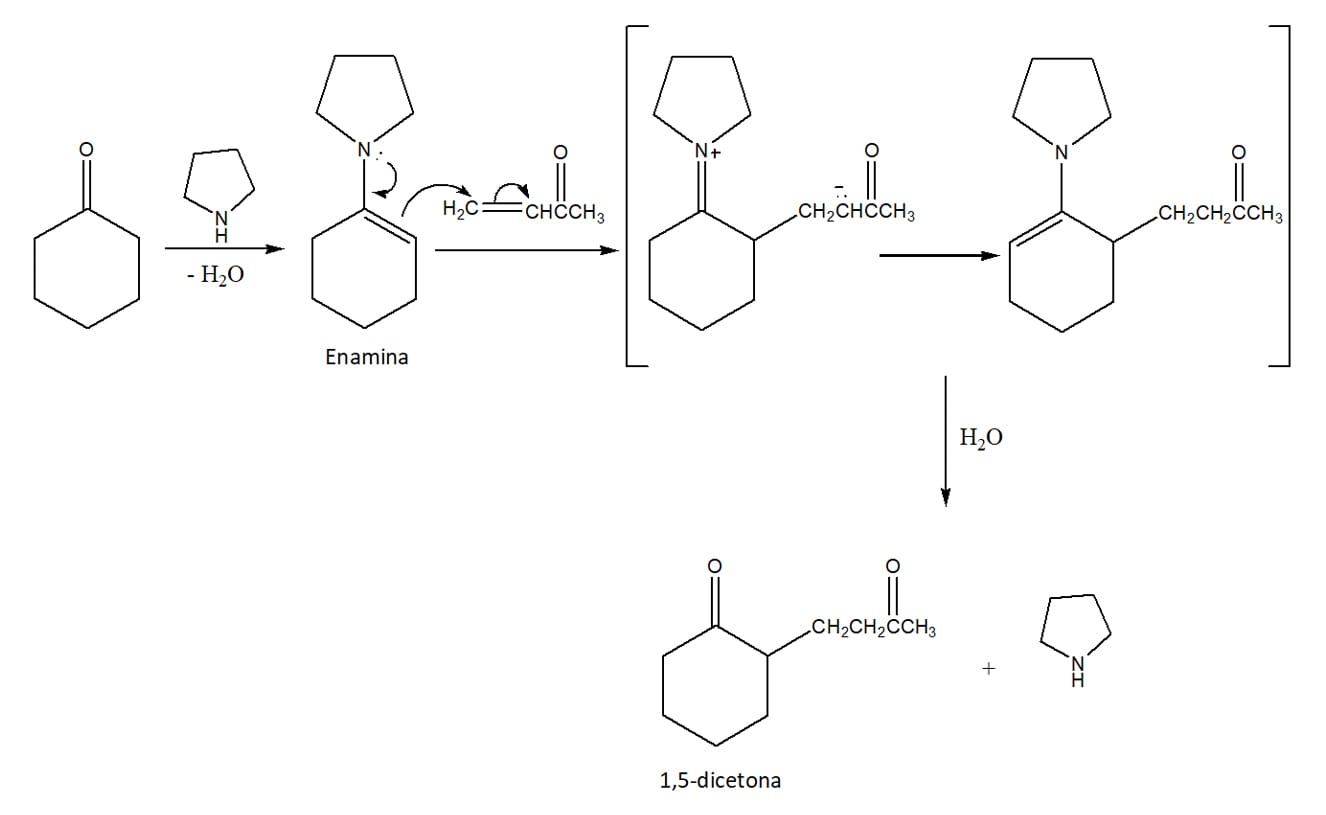
Reação de Enamina de Stork
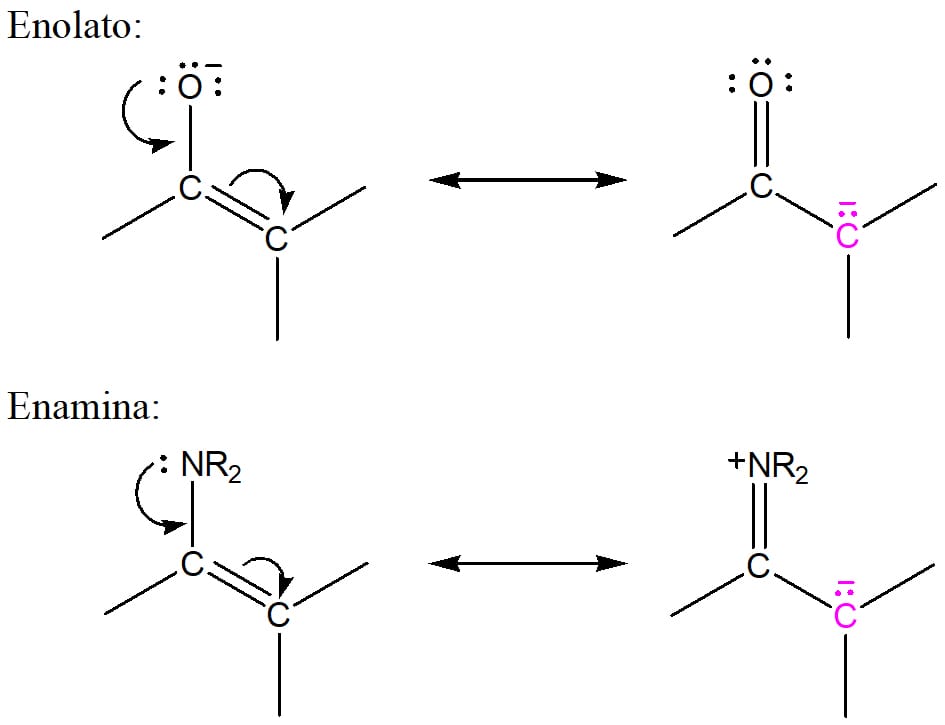
No primeiro módulo do nosso estudo sobre aldeídos e cetonas, vimos que a reação entre esses compostos e aminas secundárias formam compostos nitrogenados insaturados denominados enaminas. Enaminas e enolatos são parecidos eletronicamente e ambos possuem carbonos alfa nucleofílicos.
Vamos comparar as estruturas de ressonância dessas moléculas na figura 25?
Em ambos os casos, o carbono marcado em rosa apresenta carga negativa. Isso quer dizer que esse átomo de carbono é um nucleófilo e, por isso, capaz de atacar o carbono beta eletrofílico de compostos α, β – insaturados.
Na reação de Stork, o primeiro passo é a formação da enamina a partir de uma cetona. A enamina então ataca o composto α, β – insaturado e, por fim, sofre uma hidrólise ácida, levando à formação de uma nova cetona e da amina original que formou a enamina. Veja um exemplo desta reação no esquema 50.
Exemplo
Mais uma vez, temos uma reação que nos permite aumentar a cadeia carbônica e, no caso da reação de enamina de Stork, formar um produto dicarbonilado.
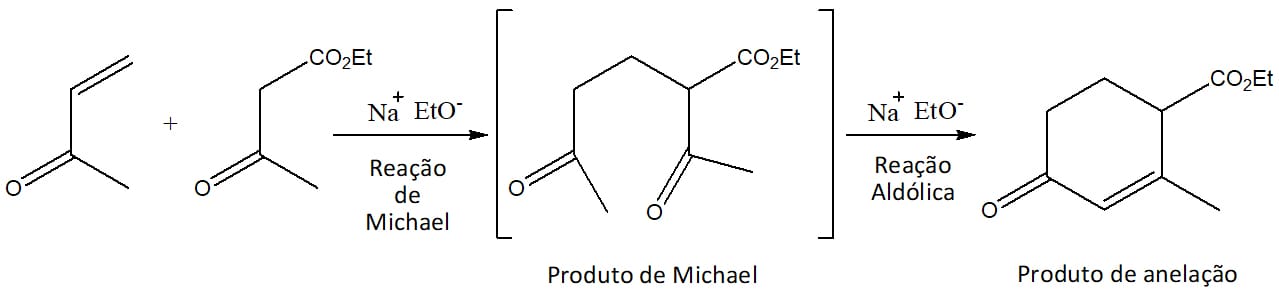
Anelação de Robinson
Esse processo é, na verdade, a junção de duas etapas, sendo a primeira uma reação de Michael e a segunda, uma reação aldólica.
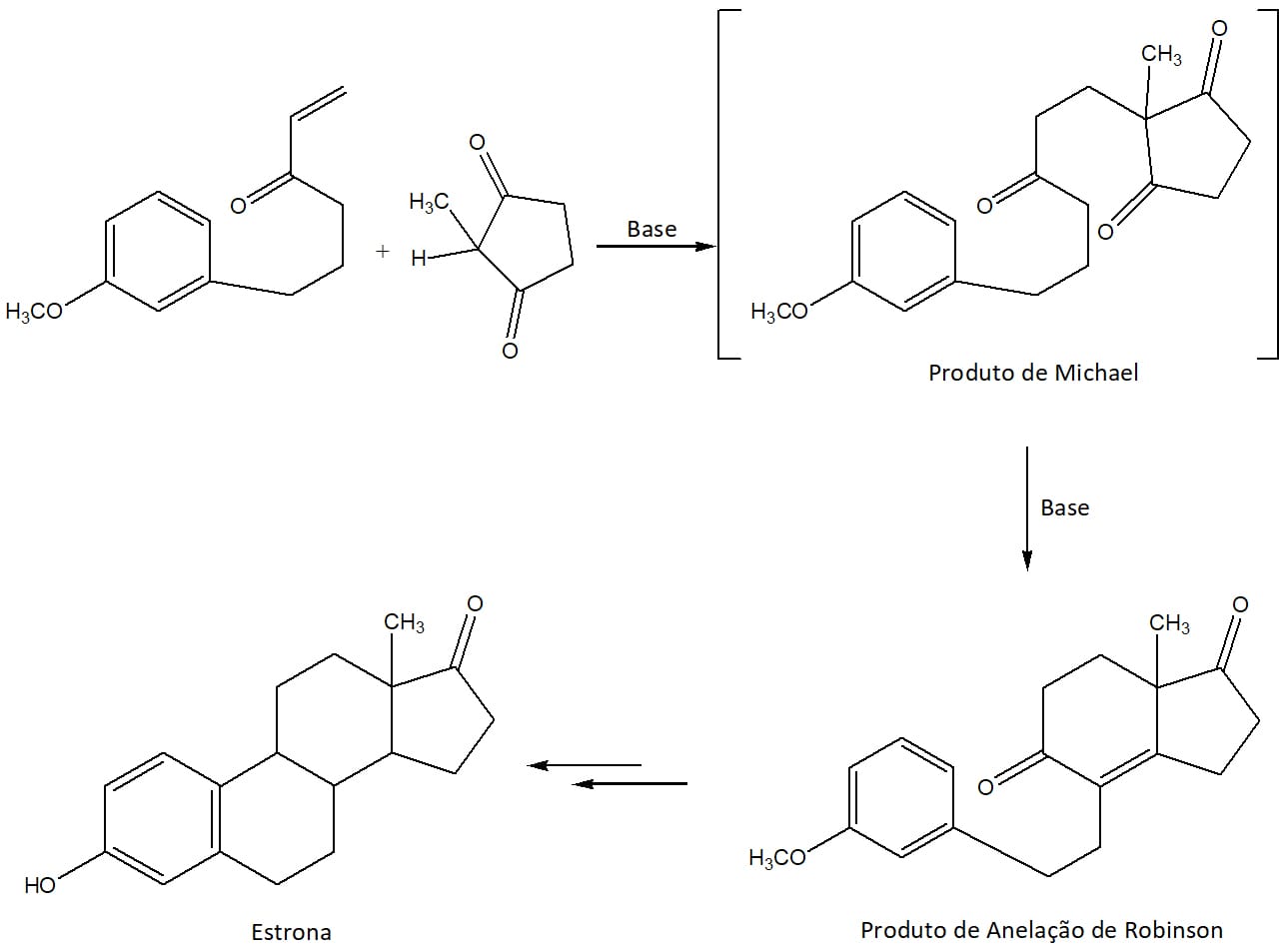
Essa é uma das reações mais importantes do arsenal da química orgânica, pois o uso de duas reações simples nos permite adicionar novos anéis a uma estrutura, o que é particularmente importante na síntese de moléculas complexas, como os esteróides.
A produção comercial do hormônio estrona conta com esse processo em sua rota sintética, como pode ser visto no esquema 52.
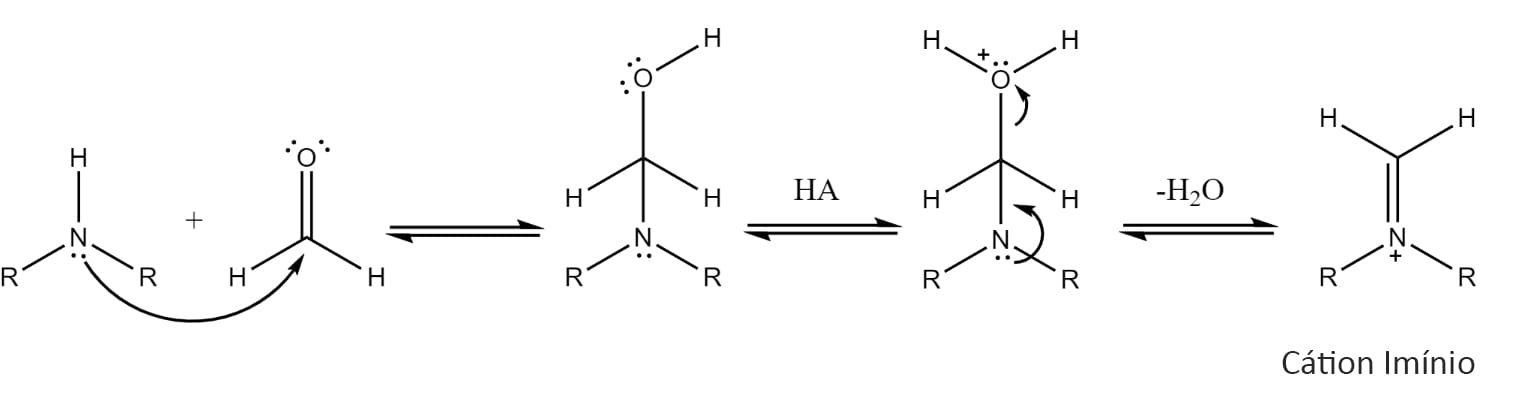
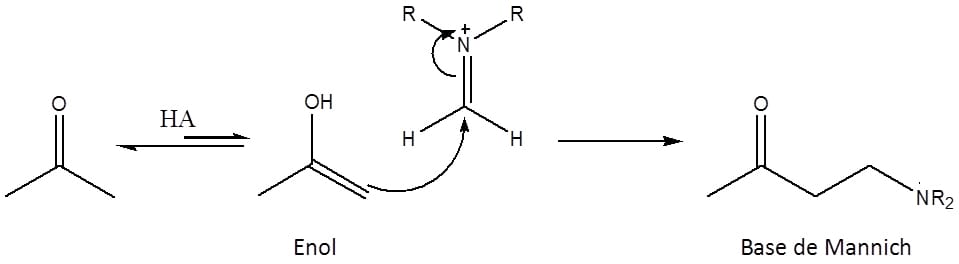
Reação de Mannich
Essa reação ocorre entre um íon imínio e um aldeído ou cetona enolizável para formar a chamada base de Mannich, que é um composto β-aminocarbonílico. O íon imínio é um composto nitrogenado que apresenta carga positiva no átomo de nitrogênio, o que torna o carbono ligado a esse nitrogênio um excelente eletrófilo e possibilita o ataque do enol.
O esquema 53 mostra a formação do íon imínio:
Depois de formado, o imínio reage com um enol levando à formação da base de Mannich.
Atenção
As bases de Mannich são muito importantes, especialmente para a indústria farmacêutica, pois compostos que apresentam esta estrutura já demonstraram importante atividade antimalarial, anti-inflamatória, analgésica e antimicrobiana, ou seja, as aplicações dessas reações são extensas e fundamentais para o desenvolvimento de fármacos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Ao longo desses quatro módulos, aprendemos a reconhecer aldeídos e cetonas, entender suas características químicas e físicas e as diversas reações que essas moléculas podem sofrer. Dentro do âmbito da síntese orgânica, aldeídos e cetonas têm extraordinária importância pela versatilidade de produtos que podem ser formados a partir de suas reações.
Entender essas reações nos permite não só aplicar seu potencial em laboratório, mas entender reações biológicas em nosso organismo e como elas ocorrem. Aprender o mecanismo pelo qual um processo acontece é o que nos permite utilizá-lo, modificá-lo e aprimorá-lo para que atenda às nossas necessidades.
Podcast
Agora, a especialista Gabriela Barbosa encerra o tema falando sobre aldeídos e cetonas: características e reações de adição nucleofílica.
CONQUISTAS
Você atingiu os seguintes objetivos:
Identificou aldeídos e cetonas, suas características físicas, químicas e os mecanismos de reação de adição nucleofílica mais importantes
Identificou reações de oxidação e redução de aldeídos e cetonas e seus produtos
Reconheceu o mecanismo de formação de enóis e enolatos e suas reações
Identificou produtos de reações de condensação aldólica e os princípios da adição conjugada a compostos carbonílicos