Descrição
Conceitos de termodinâmica em química orgânica; apresentação dos símbolos utilizados em mecanismos; tipos de quebra de ligação; estabilidade dos intermediários e reações de adição eletrofílica a alcenos, dienos e alcinos.
PROPÓSITO
Aprender os princípios que regem uma reação química e a leitura dos diagramas de energia e dos símbolos utilizados universalmente no desenho dos mecanismos das reações orgânicas permite o entendimento e estudo dessas reações não apenas na química orgânica, mas também na bioquímica e na farmacologia, por exemplo, facilitando a aprendizagem dessas disciplinas.
OBJETIVOS
Módulo 1
Identificar os aspectos termodinâmicos que afetam uma reação química e as informações presentes em um diagrama de energia
Módulo 2
Reconhecer nucleófilos e eletrófilos, além de símbolos utilizados em mecanismos, e a estabilidade de intermediários
Módulo 3
Descrever as principais reações de adição eletrofílica a alcenos, dienos e alcinos
Introdução
Neste conteúdo, entenderemos por que certas reações ocorrem espontaneamente e outras não; por que algumas são rápidas à temperatura ambiente, enquanto outras precisam de aquecimento. Aprenderemos a ler os diagramas de energia das reações químicas e obter deles informações importantes para a compreensão da reação, dos reagentes e dos produtos. Além disso, conheceremos os principais símbolos e espécies envolvidos nas reações químicas, e as maneiras universais de representá-los para que toda pessoa que conheça química entenda o mecanismo da reação. Por fim, iniciaremos os estudos das reações químicas orgânicas com as reações de adição eletrofílica a alcenos, dienos e alcinos, que permitem a formação de uma série de compostos muito importantes. Pronto para começar?
MÓDULO 1
Identificar os aspectos termodinâmicos que afetam uma reação química e as informações presentes em um diagrama de energia
EQUILÍBRIO QUÍMICO
Sabemos que compostos orgânicos são passíveis de sofrer reações químicas. Essas reações, em geral, apresentam condições específicas para que se processem da melhor forma possível. Algumas precisam ser aquecidas, outras resfriadas, algumas precisam de excesso de solvente e outras de quantidades precisas.
O primeiro item a ser observado é a direção da reação. Toda reação química pode ser favorecida no sentido da formação dos produtos – em geral é o desejável –, ou pode ter produtos pouco estáveis que retornam à forma de reagentes que, no equilíbrio, estarão em maior quantidade. O que é esse equilíbrio?
Resposta
O equilíbrio químico de uma reação pode ser quantificado e expresso na forma da constante de equilíbrio, Keq. Matematicamente, essa constante é dada pela razão entre as concentrações dos produtos e dos reagentes, com os coeficientes da reação servindo como exponente da equação.
Keq maior ou igual a 1
Quando Keq é maior ou igual a 1, a reação ocorre no sentido de formação dos produtos.
Keq menor que 1
Já quando Keq é menor que 1, a reação ocorre preferencialmente da direita para a esquerda, ou seja, no sentido dos reagentes.
Experimentalmente, então, podemos calcular o Keq a partir das concentrações de cada espécie quando o equilíbrio é atingido. Mas que fatores estão envolvidos nessa constante? O que faz com que a formação de produtos seja mais favorável do que a dos reagentes ou o contrário? A resposta para essas perguntas é essencialmente a mesma: energia. Existem dois tipos de energia importantes na química: a energia potencial e a energia cinética, que se traduz em calor nas reações químicas.
ENERGIA LIVRE DE GIBBS
A energia potencial de uma substância está intimamente relacionada com o quão estável a substância é, ou seja, quanto maior for a energia potencial, mais reativa será a substância. Analogamente, podemos pensar em uma pedra sobre uma colina. A pedra no alto da colina tem elevada energia potencial, podendo rolar montanha abaixo e liberar sua energia potencial na forma de energia cinética. No entanto, se ela estiver no vale, não há para onde rolar, sua energia potencial é muito menor e sua tendência é ficar parada, estável.


A energia das ligações químicas é uma forma de energia potencial. Quando dois átomos se ligam para formar uma ligação covalente, a energia da molécula é menor do que a energia dos átomos separados, e essa energia “excessiva” é liberada. A reação química como um todo tem sua energia expressa na forma da energia livre de Gibbs (G) e, mais especificamente, na forma de sua variação, ∆G°, onde a letra grega delta (∆) representa a variação, G representa a energia livre de Gibbs e o símbolo “°” sobrescrito significa que as condições são padrão.
Como ∆G é uma variação, o valor obtido poderá ser positivo ou negativo, e será a indicação da espontaneidade da reação:
Indica uma constante de equilíbrio favorável, e a reação ocorre de maneira espontânea. Essa reação é denominada exergônica.
Indica uma constante de equilíbrio desfavorável, ou seja, tendendo aos reagentes. É uma reação que não ocorre espontaneamente e é denominada endergônica.
Como vimos, o sinal do ∆G indica se a constante de equilíbrio é favorável ou desfavorável. Isso acontece porque as duas grandezas estão relacionadas matematicamente da seguinte forma:
Rearranjando os termos em função da constante de equilíbrio, podemos escrever que:
Onde R é a constante dos gases ideais que corresponde a 8,315 J (K. mol) -1; ln Keq é o logaritmo neperiano, ou natural, da constante de equilíbrio; e = 2,718; e T é a temperatura em Kelvin. Sabemos, então, que a constante de equilíbrio depende da temperatura, e uma variação na temperatura levará a uma alteração da constante. Estando de posse de qualquer uma das duas informações é possível calcular a outra. Além disso, o ∆G se correlaciona ainda com outros dois fatores importantes, a entalpia e a entropia, pela seguinte equação:
Entalpia
A entalpia, representada pela letra H, mas principalmente pela sua variação (∆H°), é a medida do calor liberado ou absorvido por determinada reação. Como dissemos, a ligação química é uma forma de energia potencial que pode ser transformada em calor durante uma reação e, por isso, a quebra de uma ligação química libera calor e sua formação a absorve. O ∆H° é a expressão de todas essas quebras e formações na transformação dos reagentes em produtos.
Como ∆H° é a variação de calor na reação, temos que:
Quando calor é liberado em função da reação, o sinal de ∆H° é negativo e a reação é dita exotérmica.
Quando a reação precisa absorver calor para ocorrer, o sinal de ∆H° é positivo e a reação é dita endotérmica.
Isso quer dizer também que, em uma reação exotérmica, a entalpia dos produtos é menor que a entalpia dos reagentes (∆H° = Hprodutos - Hreagentes), e na reação endotérmica o contrário é verdadeiro.
Entropia
Um segundo fator que tem papel importante na espontaneidade de uma reação química é a entropia (S) ou, mais comumente, por sua variação (∆S°). A entropia está relacionada ao nível de desordem ou ao grau de liberdade que o sistema apresenta. Podemos ver, pelo sinal negativo antes do termo na equação, que quanto maior a desordem do sistema, maior o ∆S° e, consequentemente, menor é o ∆G°, ou seja, mais a entropia contribui para o favorecimento da formação dos produtos. Se tivermos uma reação de decomposição de A em duas moléculas, por exemplo, estaremos aumentando o grau de desordem e favorecendo a formação dos produtos.
Por isso, resumimos dizendo que:
Quando ∆S° é positivo, a desordem no sistema aumenta e a formação dos produtos é favorecida.
Quando ∆S° é negativo, a desordem no sistema diminui e a formação dos reagentes é favorecida.
De maneira geral, a entalpia tem um papel mais relevante para a energia livre de Gibbs, porém, temperaturas mais elevadas fazem com que a entropia se torne significativa o suficiente para dominar a energia livre de Gibbs e ter um papel mais relevante na direção da reação.
Agora que entendemos os termos que afetam a magnitude da constante de equilíbrio e sabemos como verificar a direção na qual uma reação química ocorre, como podemos manipular as condições da reação de maneira que possamos favorecer a formação do produto de interesse, ou seja, deslocar o equilíbrio a favor do produto?
Deslocamento do equilíbrio
Precisamos lembrar que a constante de equilíbrio é, como seu próprio nome diz, constante. Isso quer dizer que, se a temperatura não for alterada, a constante deverá se manter mesmo que as concentrações das substâncias variem, ou seja, as concentrações restantes serão alteradas para a manutenção da constante de equilíbrio. Como vimos anteriormente, para a reação genérica , a expressão matemática da constante de equilíbrio é dada por:
Digamos que C seja o produto de interesse e D seja a água formada durante a reação. Se retirarmos a água à medida que ela estiver sendo formada – por destilação, por exemplo –, a concentração de C terá que aumentar para suprir a falta que a água fará, a fim de manter a constante de equilíbrio igual. A mesma coisa ocorrerá se aumentarmos um dos reagentes – A ou B –, de modo que o outro terá que ser consumido para compensar o súbito aumento na concentração. Da mesma forma, se uma reação libera calor (exotérmica), o aumento da temperatura irá favorecer o sentido da formação dos reagentes, enquanto a diminuição favorecerá o sentido dos produtos.
É importante observar que, ao longo de toda nossa discussão, estivemos falando da direção que a reação deverá tomar. Isso é importante, pois uma reação que apresenta ∆G negativo e constante de equilíbrio alta tem todos os pré-requisitos para ser extremamente favorável à formação dos produtos e, em certo momento, isso irá acontecer, mas pode levar alguns minutos ou vários anos. À temperatura ambiente, por exemplo, a reação de combustão da gasolina é extremamente lenta e, por isso, nos permite utilizá-la como combustível em carros, porém, se uma fonte de calor for fornecida, a reação acontece quase imediatamente. Vamos ver por que isso acontece.
DIAGRAMAS DE ENERGIA LIVRE
Sabemos que um ∆G negativo significa que os produtos apresentam menos energia que os reagentes e, por isso, têm sua formação favorecida. No entanto, a conversão entre um e outro exige, em geral, que ligações covalentes sejam rompidas nos reagentes e isso requer alguma energia para acontecer, ou seja, a energia precisará aumentar antes que possa cair.
Para facilitar a visualização desse processo, utilizamos um diagrama de energia de reação, no qual o eixo x é o progresso da reação e o eixo y é a energia. A figura a seguir traz um exemplo deste tipo de diagrama para uma reação em que o ∆G é negativo e a formação dos produtos é favorável. Em seguida, vamos entender melhor as informações que podemos extrair do diagrama de energia.
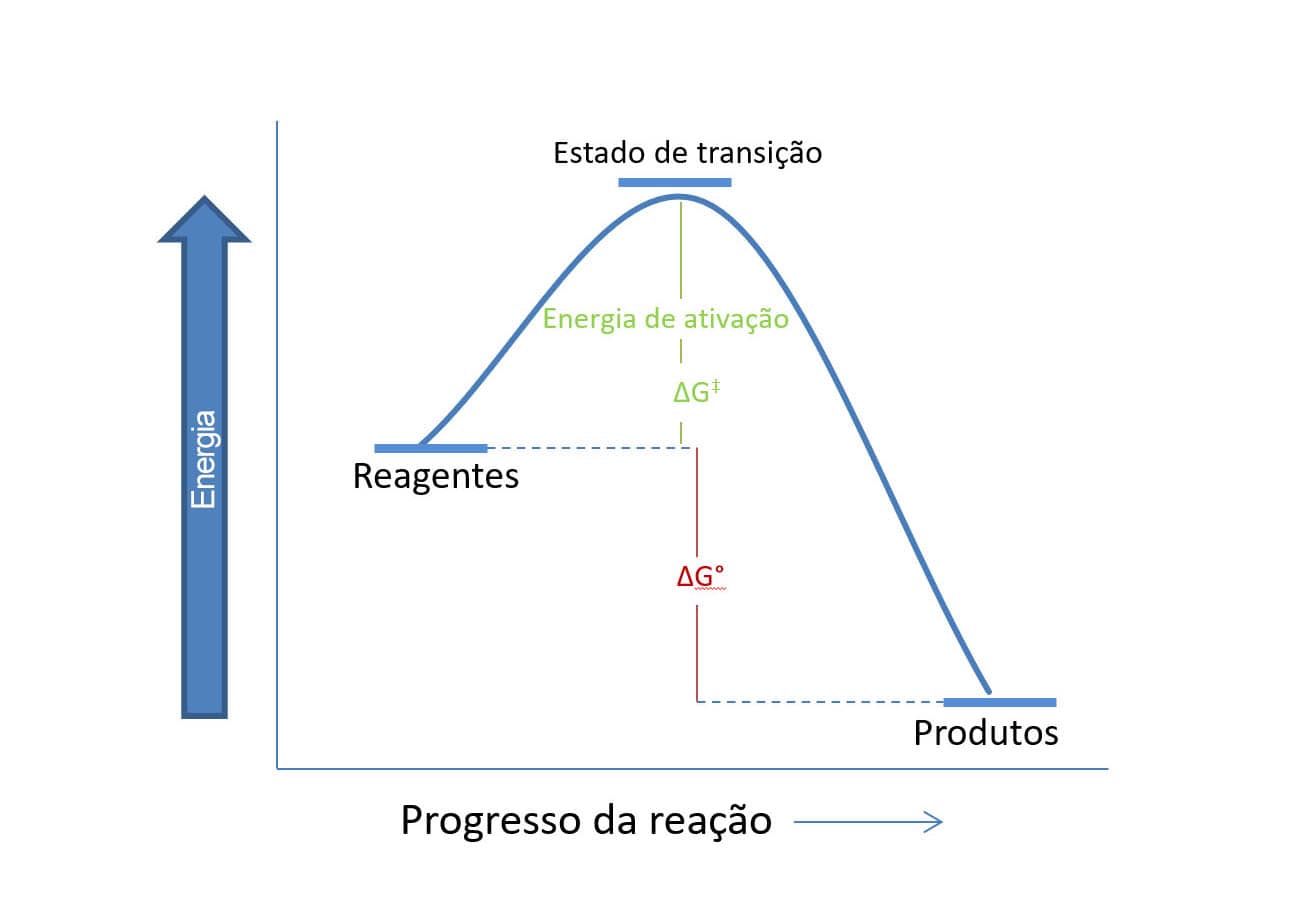
A primeira observação que podemos fazer ao olhar para o gráfico é que os produtos têm nível de energia mais baixo que os reagentes, e o ∆G°, que expressa essa característica, será negativo. A segunda observação é que existe uma energia de ativação (∆G‡), uma barreira energética que atrapalha a conversão dos reagentes em produtos. Quanto maior for a energia de ativação, mais lenta será a reação, pois poucas colisões entre as moléculas terão energia suficiente para formar o estado de transição. Por outro lado, quanto menor for a energia de ativação, mais rápida será a reação, pois grande parte das colisões levará ao estado de transição. E o que é o estado de transição?
Resposta
O estado de transição é a estrutura de maior energia que ocorre na reação, mas não pode ser chamada de molécula. Essa estrutura tem ligações parcialmente rompidas e outras parcialmente formadas, devido ao início da colisão entre os reagentes para formar o produto. Por ser o estado de maior energia, essa estrutura não pode ser isolada. Qualquer tentativa de isolá-la levaria a uma estrutura com menor energia e, por isso, simplesmente não seria possível. Uma vez que o estado de transição é formado, no entanto, a reação tende para as estruturas de menor energia, que, no caso apresentado, são os produtos.
E se o ∆G° for positivo? As informações que poderão ser extraídas do diagrama são as mesmas, porém, o perfil será outro, uma vez que, quando a energia livre de Gibbs é positiva, sabemos que os produtos têm energia maior que os reagentes. A figura a seguir mostra o perfil desse tipo de diagrama de energia.
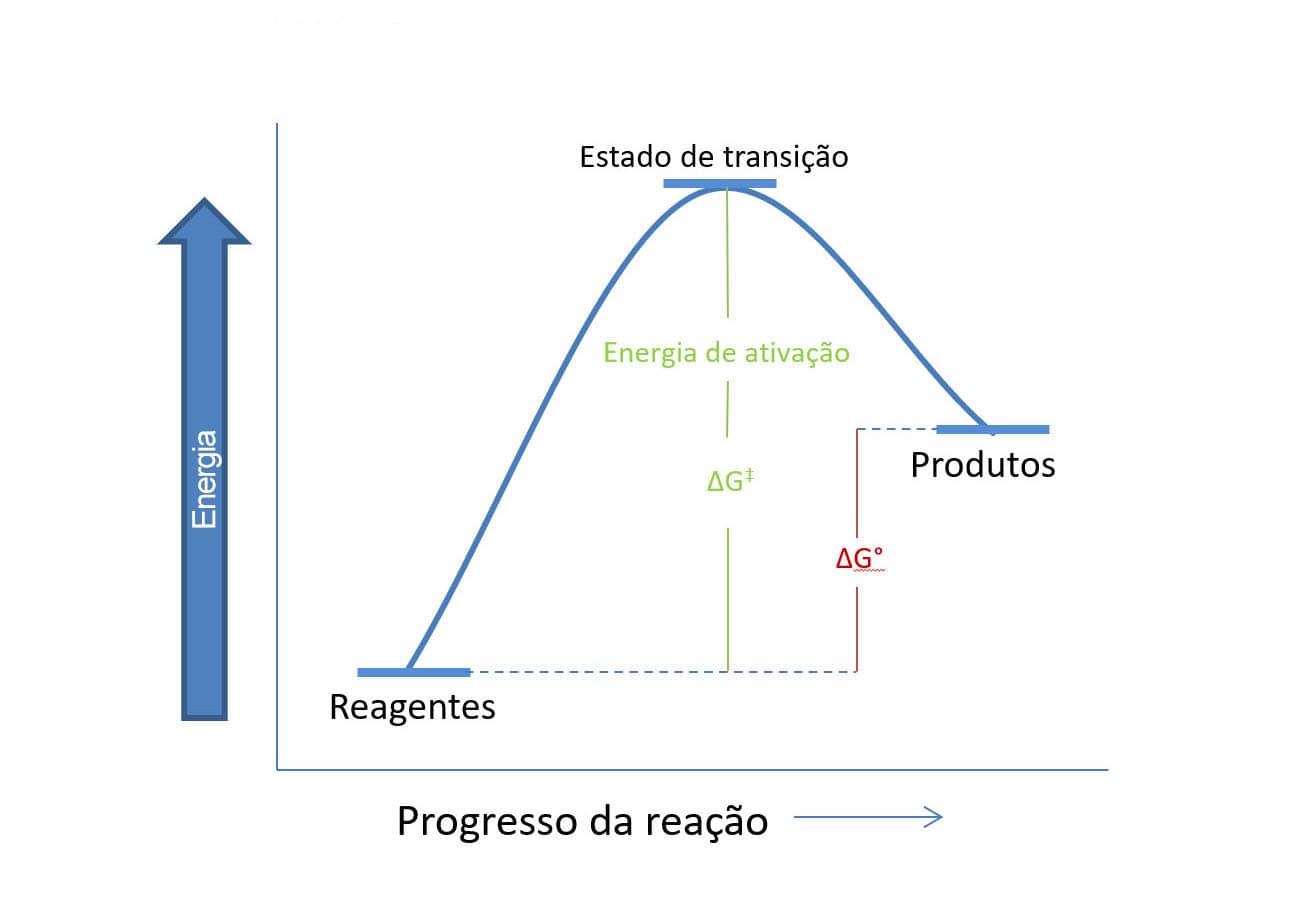
Note que, neste caso, a energia de ativação necessária para a conversão dos reagentes em produtos é muito maior do que a vista anteriormente. É importante observar que, nos exemplos de diagramas anteriores, mostramos casos clássicos em que a barreira dada pela energia de ativação é clara, assim como a diferença de energia entre os produtos e os reagentes. Porém, nem sempre a diferença precisa ser tão grande; ela pode ser mais discreta e, quanto menor for, mais rápida será a reação.
A energia de ativação pode ser pequena o bastante para que a reação ocorra em temperatura ambiente, mas, caso seja muito grande e a energia proveniente da temperatura ambiente não seja suficiente, pode ser necessário fornecer energia na forma de calor ou radiação, por exemplo.
Os diagramas de energia livre que vimos anteriormente correspondem a reações que ocorrem em uma única etapa e, por isso, apresentam apenas um estado de transição. Porém, se a reação apresentar várias etapas, veremos esse padrão repetido, de maneira que os vales serão intermediários e as cristas dos morros no gráfico serão os estados de transição. Os produtos e os reagentes estarão sempre ao início e ao fim do gráfico, conforme o exemplo a seguir.
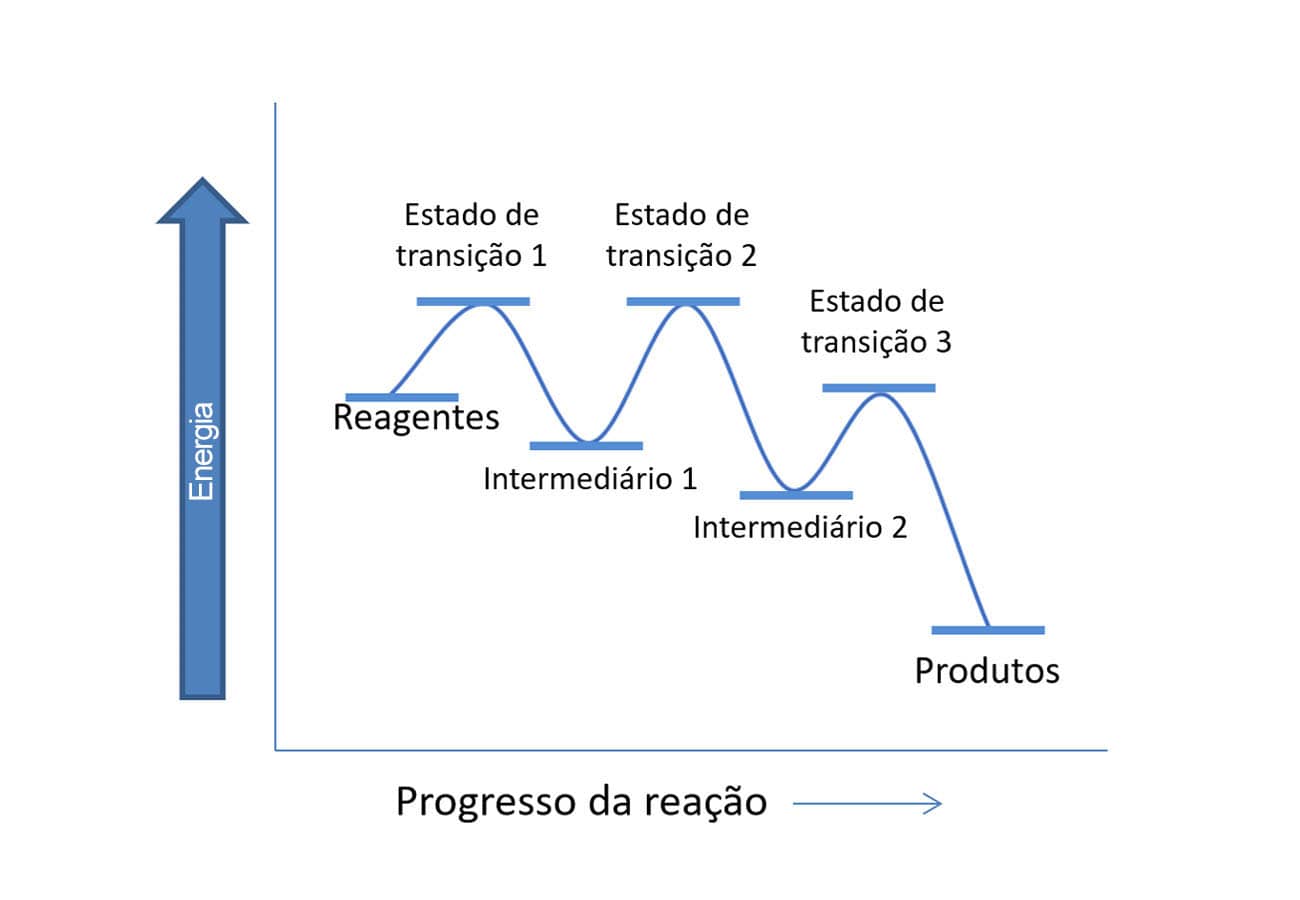
No vídeo a seguir, o especialista Luiz Mota fará uma revisão do conceito de energia livre de Gibbs e dos diagramas de energia de reações com mais de uma etapa.

ENERGIA LIVRE DE GIBBS E DIAGRAMAS DE ENERGIA
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer nucleófilos e eletrófilos, além de símbolos utilizados em mecanismos, e a estabilidade de intermediários
Vimos anteriormente as energias envolvidas no processo de reação química e como cada uma afeta a direção da reação e sua velocidade. Agora, vamos olhar para a reação em si, entender como ela acontece e como podemos representar graficamente os diferentes tipos de reação.
LIGAÇÕES POLARIZADAS
O conceito mais simples de entender é o de que cargas opostas se atraem. No entanto, na química orgânica, existem poucos ânions estáveis e os cátions estão em menor quantidade ainda. Por isso, tratamos principalmente de cargas parciais resultantes da polaridade nas ligações covalentes. Dois conceitos fundamentais para o entendimento de como se processa uma reação química polarizada são os de nucleófilo e eletrófilo.
É uma substância que apresenta afinidade por prótons (presentes no núcleo dos átomos), ou seja, é uma substância rica em elétrons, o que pode significar que é um ânion ou uma molécula que apresenta pares de elétrons livres. A água, a amônia e o íon hidróxido são alguns exemplos de nucleófilos.
É uma substância que apresenta afinidade por elétrons, ou seja, é uma substância com deficiência de elétrons, o que pode significar um cátion ou uma molécula neutra que apresenta um átomo com carga parcial positiva. Compostos carbonílicos, haletos de alquila e o íon hidrônio são alguns exemplos de eletrófilos.
Um terceiro conceito fundamental no entendimento das reações orgânicas e que vai ser muito importante na representação gráfica dos mecanismos é o de que, em uma reação orgânica, os elétrons serão os responsáveis pela reação entre duas substâncias. Isso quer dizer que representaremos sempre o fluxo de elétrons do nucleófilo para o eletrófilo. E como podemos fazer essa representação?
SÍMBOLOS UTILIZADOS NA REPRESENTAÇÃO DE MECANISMO DE REAÇÃO
Da mesma forma como foram criados símbolos uniformes para os elementos químicos, como as nomenclaturas têm regras sobre a forma de serem escritas, e como as unidades são estabelecidas internacionalmente, os mecanismos de reação também apresentam uma maneira padrão de serem escritos. Isso é importante, pois permite que químicos do mundo todo possam compartilhar essas informações de maneira a serem universalmente compreendidas. Um químico brasileiro, americano, indiano ou japonês representará os mecanismos das reações de forma padrão e o entendimento será possível a qualquer um dos outros.
Mecanismo de setas curvas
As setas curvas são a representação gráfica do movimento dos elétrons, na qual a seta se inicia nos elétrons que vão se “mover”, e a ponta da seta indica para onde vão os elétrons. A figura a seguir traz o exemplo da reação entre a água e o ácido clorídrico.
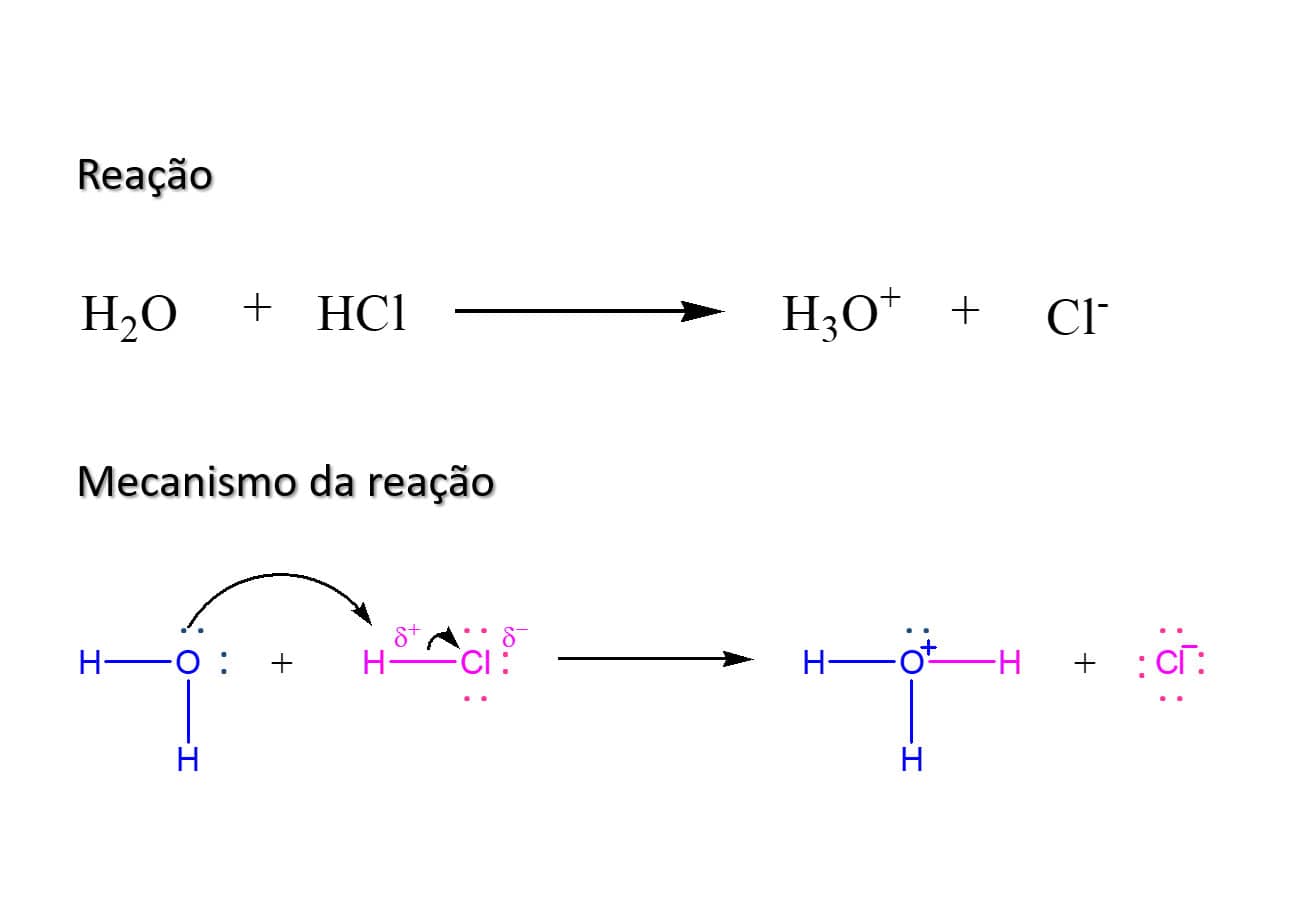
Note que, na reação anterior, as setas curvas mostram o fluxo de elétrons do par de elétrons do átomo de oxigênio presente na água (nucleófilo) para o átomo de hidrogênio do ácido clorídrico que apresenta carga parcial positiva. Esse fluxo de elétrons faz com que a ligação H-Cl seja rompida, e o par de elétrons que compõe a ligação simples se desloca em direção ao átomo de cloro, que é mais eletronegativo, levando à formação dos íons hidrônio e cloreto.
Ao utilizar as setas curvas deve-se ter o cuidado de:
Representar o fluxo de elétrons sempre do nucleófilo para o eletrófilo.
Nunca representar a movimentação de átomos. Os átomos seguirão o fluxo de elétrons, mas a representação é sempre em relação aos elétrons.
Não violar a regra do octeto para elementos do segundo período da tabela periódica.
Há ainda a possibilidade de cada átomo participante da ligação covalente receber um elétron na quebra da ligação, e esse mecanismo também é representado pelas setas curvas. No entanto, essas setas têm apenas meia ponta, sendo chamadas de setas anzol. As regras a serem seguidas para essa representação são as mesmas vistas anteriormente, e a diferença está apenas na ponta da seta. A figura a seguir mostra as setas curvas utilizadas em cada caso.

Atenção
Além das setas curvas, que são fundamentais para compreender os mecanismos das reações orgânicas, há outros dois símbolos que são importantes para a total compreensão do mecanismo representado graficamente.
Outros símbolos importantes
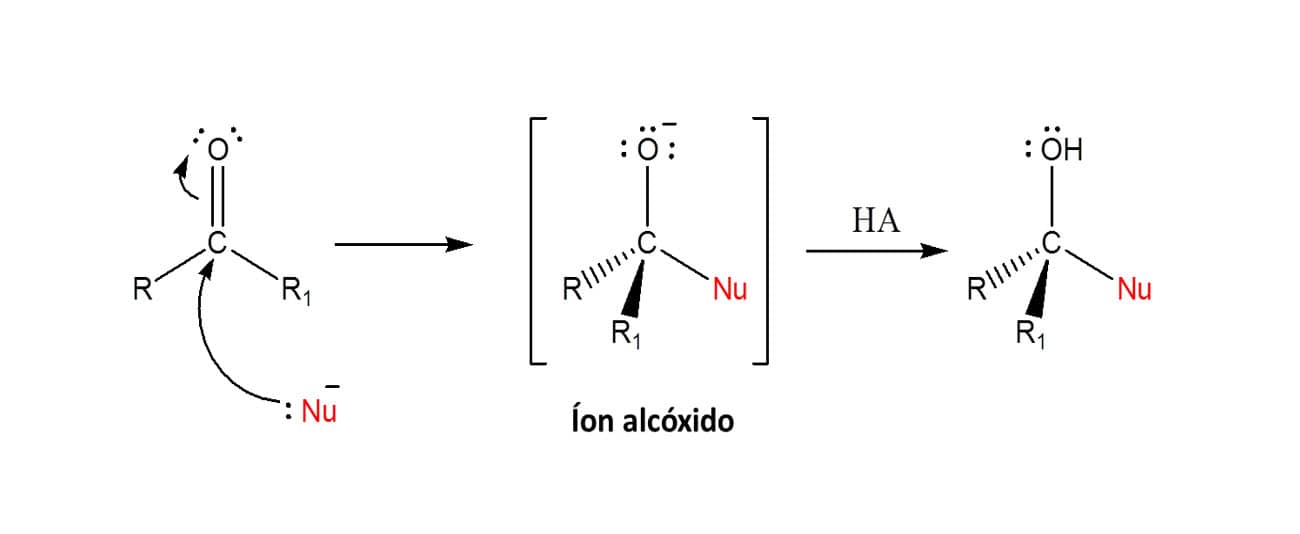
O primeiro desses símbolos são os colchetes, [ ]. Nos mecanismos de reações orgânicas, muitas vezes são formadas diversas substâncias antes do produto de interesse. Quando isso ocorre, representamos esses intermediários entre colchetes para sinalizar que aquele ainda não é o produto final, mas uma parte do mecanismo a fim de obter o produto que aparece na equação química. A figura a seguir traz o exemplo da redução de uma carbonila, na qual o íon alcóxido é formado como intermediário.
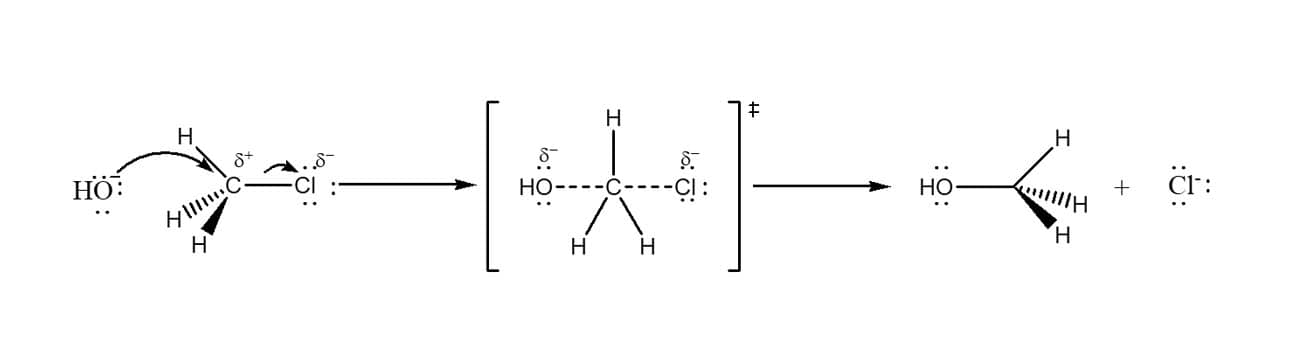
Por outro lado, quando o símbolo ‡ está presente sobrescrito após o colchete, isso significa que aquela estrutura representa o estado de transição entre reagentes e produtos. Como vimos no módulo 1, no estado de transição temos ligações sendo rompidas e outras sendo formadas simultaneamente. A figura a seguir traz um exemplo do estado de transição de uma reação de substituição nucleofílica aromática.
Devemos ter um cuidado especial com os conceitos de intermediário e estado de transição. Um intermediário apresenta ligações covalentes bem definidas e pode apresentar cargas formais, como no caso do alcóxido mostrado anteriormente, ou ser apenas um composto intermediário entre os reagentes e o produto desejado. Esse seria o caso de uma cetona na oxidação de um álcool a um ácido carboxílico. Um estado de transição é uma representação do que acontece quando há aproximação dos reagentes com a formação e quebra das ligações sendo mostradas simultaneamente sem que haja cargas formais, por exemplo.
TIPOS DE QUEBRAS DE LIGAÇÃO
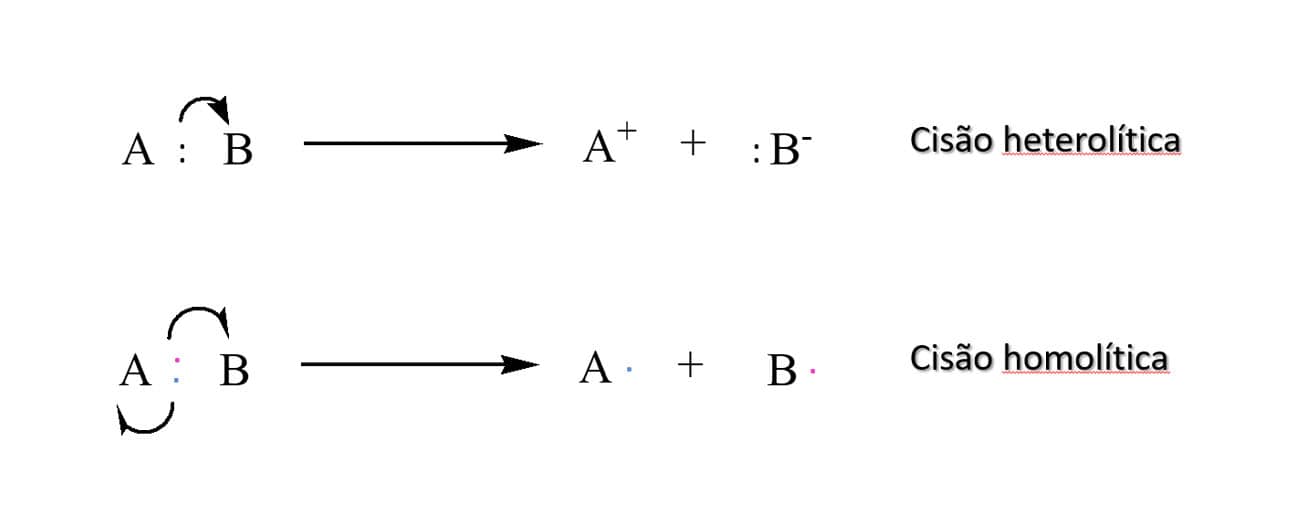
Como vimos anteriormente, uma ligação covalente pode ser rompida de modo que um elétron fique em cada átomo, ou de maneira que um par de elétrons seja transferido para um átomo ou outro.
Cisão heterolítica
A quebra de ligação é chamada de cisão heterolítica, quando ocorre de maneira que o par de elétrons compartilhado na ligação covalente permanece em um dos átomos, enquanto o outro perde ambos. Neste tipo de ruptura, dois elétrons participam do fluxo da reação.
Cisão homolítica
No entanto, quando a cisão ocorre de maneira que cada átomo que compõe a ligação covalente recebe um elétron, a ruptura é chamada de cisão homolítica. Isso ocorre em reações denominadas radicalares – um radical é uma espécie neutra que contém um elétron desemparelhado em sua estrutura e é altamente reativo.
Estabilidade dos intermediários
As quebras que vimos anteriormente vão originar compostos com características e estabilidades diferentes. A cisão heterolítica de um composto carbônico pode levar à formação de um carbocátion, composto no qual o carbono tem uma carga positiva, ou ainda de um carbânion, composto em que o carbono apresenta carga negativa. Os carbocátions são, em geral, mais comuns do que os carbânions, pois, para que esses últimos sejam formados, é necessário que o carbono esteja ligado a um elemento menos eletronegativo que ele. Em geral, carbânions são provenientes de compostos organolitiados e de compostos de Grignard, e têm papel importantíssimo na formação de ligações carbono-carbono.
Compostos de Grignard
São compostos organometálicos nos quais um metal, geralmente o magnésio, está ligado diretamente a um átomo de carbono e a um halogênio.
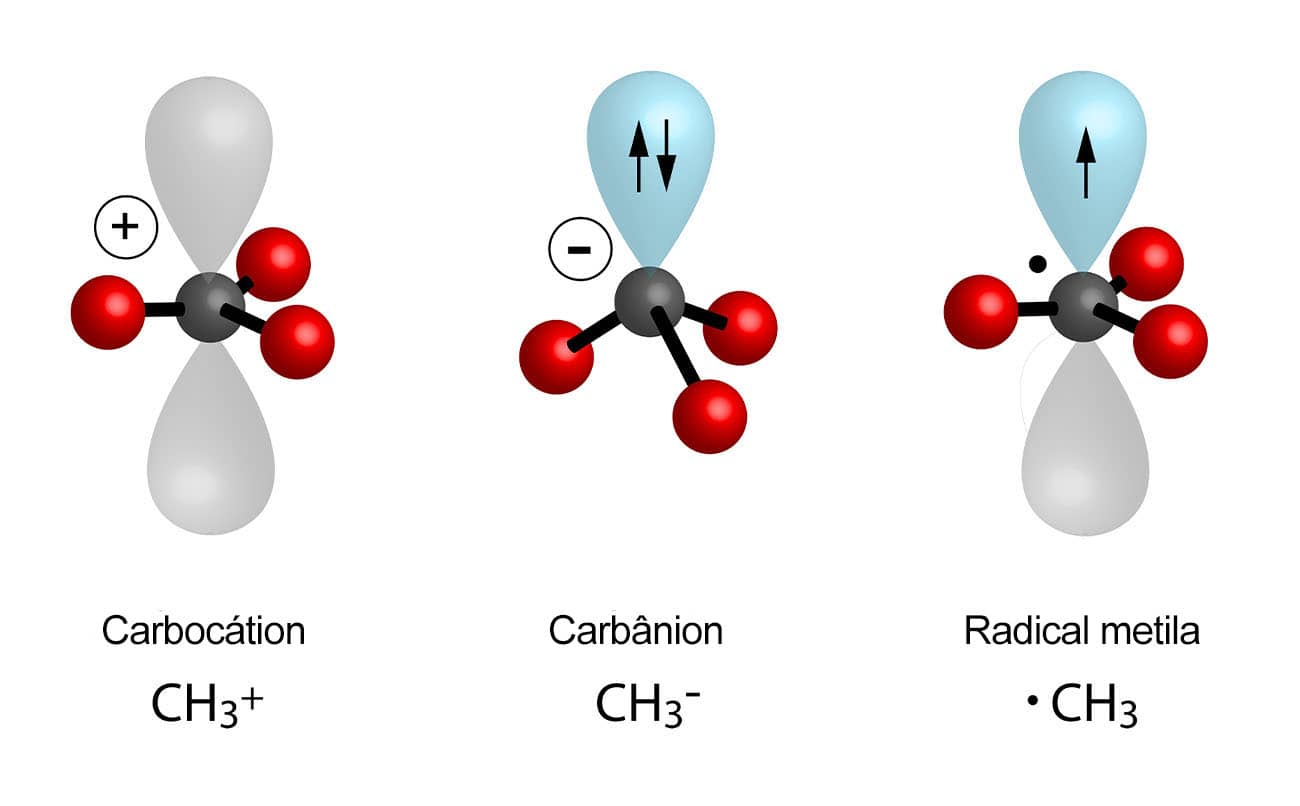
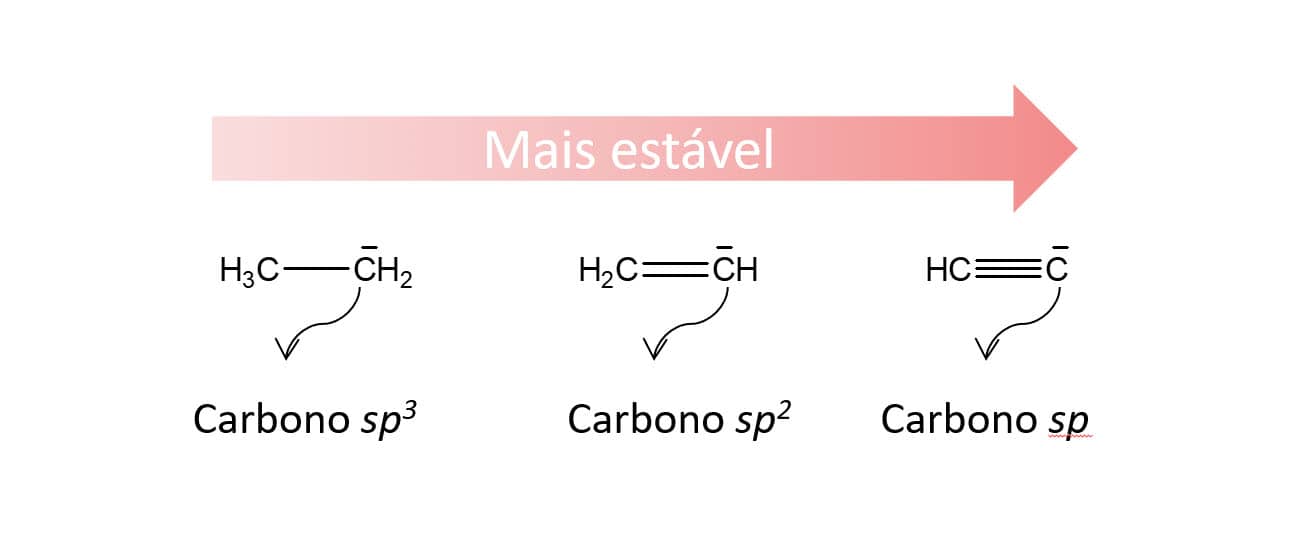
A estabilidade dos carbânions está relacionada à hibridização do carbono que apresenta a carga negativa. Cargas negativas são mais bem estabilizadas pela presença de cargas positivas que, no caso de átomos, estão presentes no núcleo na forma dos prótons. Isso quer dizer que, para carbânions, a estabilidade será maior quanto mais próximo ao núcleo estiverem os elétrons. Como podemos avaliar essa proximidade? Os carbonos hidridizados podem ser do tipo sp, sp2 ou sp3 e, quanto maior for o caráter s do orbital do carbono, maior será a estabilidade do carbânion formado, pois os elétrons estarão mais próximos ao núcleo e, consequentemente, à carga positiva. Sendo assim, temos que:
Carbocátions, por outro lado, apresentam carbono com hibridização sp2 e geometria trigonal plana. Sua estabilidade depende de dois fatores: o efeito indutivo e a hiperconjugação.
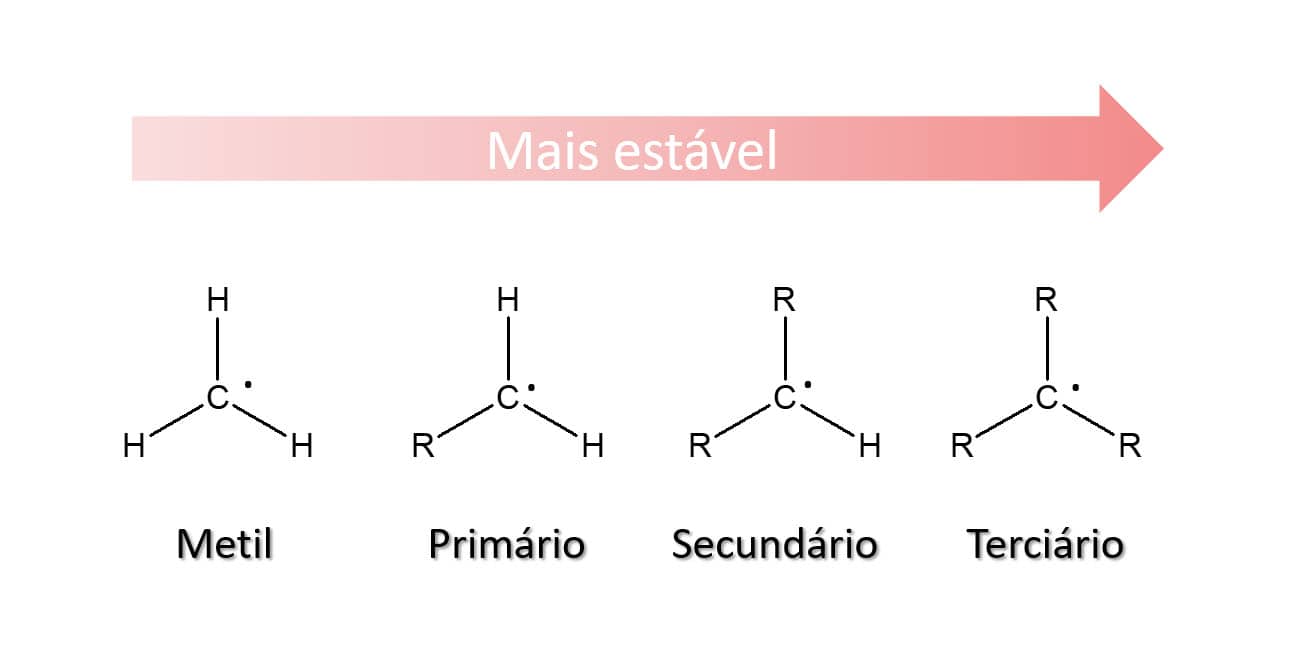
É, em geral, resultado do deslocamento da nuvem eletrônica de um átomo em função da eletronegatividade do átomo vizinho. Embora, em carbocátions, ambos os átomos presentes na ligação covalente sejam de carbono e, por isso, não haja diferença de eletronegatividade, a presença da carga positiva em um átomo de carbono atrai as nuvens eletrônicas dos carbonos vizinhos e, assim, aquela carga é mais bem estabilizada. Isso quer dizer que, quanto mais substituído for o carbono do carbocátion, mais estável ele será, uma vez que será estabilizado pelos elétrons dos carbonos vizinhos. Assim, temos que:
É o resultado da sobreposição de um orbital p vazio e de um orbital ocupado do átomo de carbono vizinho que faça uma ligação σ carbono-carbono ou carbono-hidrogênio, como pode ser visto na figura a seguir.
Isso quer dizer que metilas não são capazes de sofrer o efeito da hiperconjugação, pois não existe carbono vizinho com quem o orbital possa se sobrepor. Carbocátions primários têm uma chance de realizar hiperconjugação, secundários têm duas e, por fim, terciários têm três. Sendo assim, considerando o fenômeno de hiperconjugação, a estabilidade relativa dos carbocátions será a mesma apresentada anteriormente ao discutirmos o efeito indutivo, no qual a metila é a menos estável e os carbocátions terciários, os mais estáveis.
Agora que vimos as estabilidades dos carbânions e carbocátions formados pelas cisões heterolíticas, vamos ver a estabilidade dos intermediários formados pelas cisões homolíticas. Esses intermediários são denominados radicais e apresentam um elétron desemparelhado. Embora não apresentem carga positiva, os radicais são espécies deficientes em elétrons e, por isso, são estabilizados de maneira similar aos carbocátions. Na verdade, radicais são igualmente estabilizados por hiperconjugação e apresentam a mesma ordem de estabilidade relativa que os carbocátions vistos anteriormente.
Agora que aprendemos os símbolos utilizados para descrever uma reação e as quebras que podem ocorrer, vamos conhecer as reações químicas que podem ocorrer.
Para reconhecer reações orgânicas e os símbolos utilizados, descobrir os mecanismos que envolvam setas anzol e cheias, bem como revisar os tipos de quebra de ligação e a estabilidade dos intermediários, vamos assistir ao vídeo a seguir:

INTRODUÇÃO ÀS REAÇÕES ORGÂNICAS: SÍMBOLOS, MECANISMOS E INTERMEDIÁRIOS DE REAÇÕES
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever as principais reações de adição eletrofílica a alcenos, dienos e alcinos
No módulo anterior, falamos sobre a maneira de representar mecanismos de reações orgânicas, e vimos também algumas definições muito importantes: de nucleófilo e de eletrófilo.
A adição eletrofílica a alcenos é possível e favorável, pois os elétrons π dos alcenos estão mais disponíveis para reação do que aqueles presentes em ligações σ, por exemplo, e criam uma região de alta densidade de elétrons para onde os eletrófilos são atraídos, ou seja, a ligação π se comporta como um nucleófilo. Além disso, elétrons π têm maior energia que elétrons σ, e as ligações π são mais fracas que as ligações σ, o que significa que o rompimento de uma ligação π em favor da formação de uma ligação σ é um processo energeticamente favorável.
Aqui vamos ver as três principais reações de adição eletrofílica a alcenos: aquelas que envolvem ácidos binários halogenados (HX), água e halogênios moleculares.
Nucleófilo
Um nucleófilo é uma substância rica em elétrons que, em geral, apresenta pares de elétrons livres ou carga negativa.
Eletrófilo
Um eletrófilo é uma substância que apresenta deficiência em elétrons, seja na forma de cargas positivas ou orbitais vazios, por exemplo.
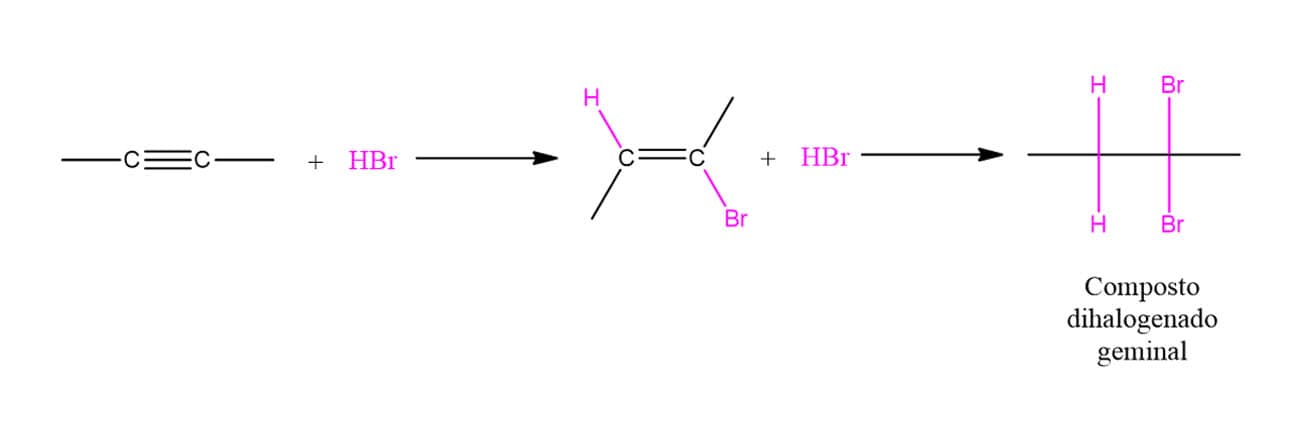
ADIÇÃO DE HX A ALCENOS
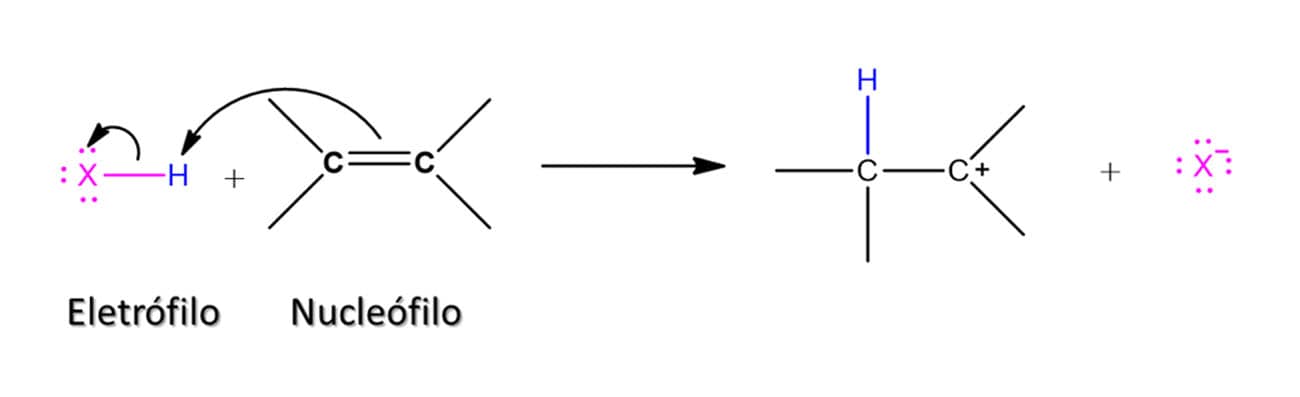
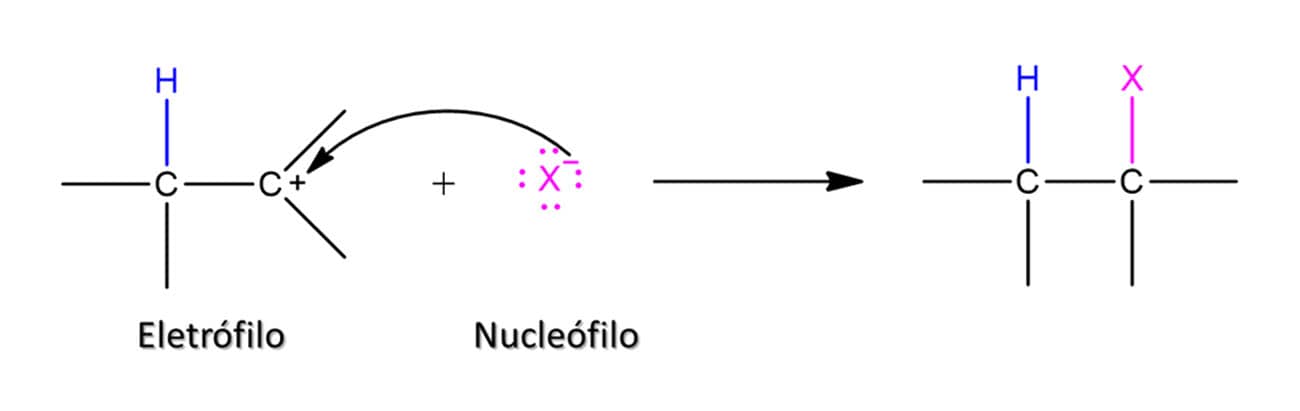
A reação entre os ácidos binários halogenados e os alcenos leva à formação de um haleto de alquila, uma vez que o átomo de hidrogênio entrará em um carbono e o halogênio no outro, conforme o esquema geral a seguir:
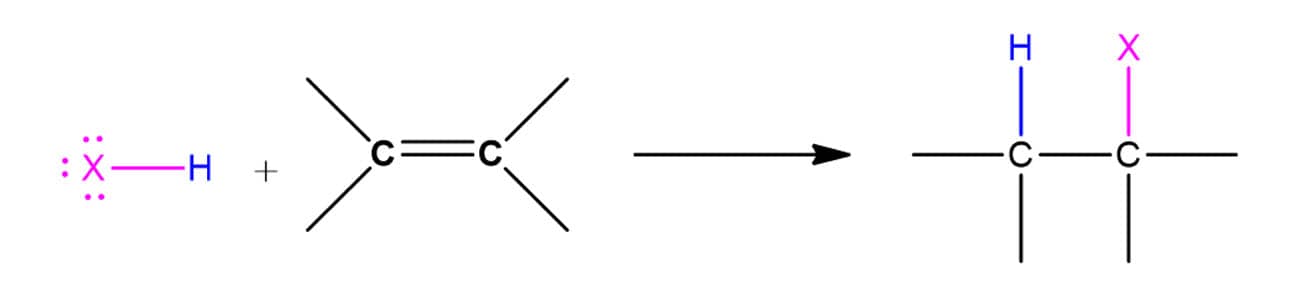
A reatividade dos ácidos segue o padrão da força deles, então, HI é o mais reativo e HF, o menos reativo. Nesse tipo de reação, o alceno terá uma molécula adicionada a ele em duas etapas. Vamos ver o mecanismo com um exemplo geral utilizando o ácido HX:
Agora que conhecemos o mecanismo da reação e vimos que ela ocorre em duas etapas, podemos analisar o seu diagrama de energia.
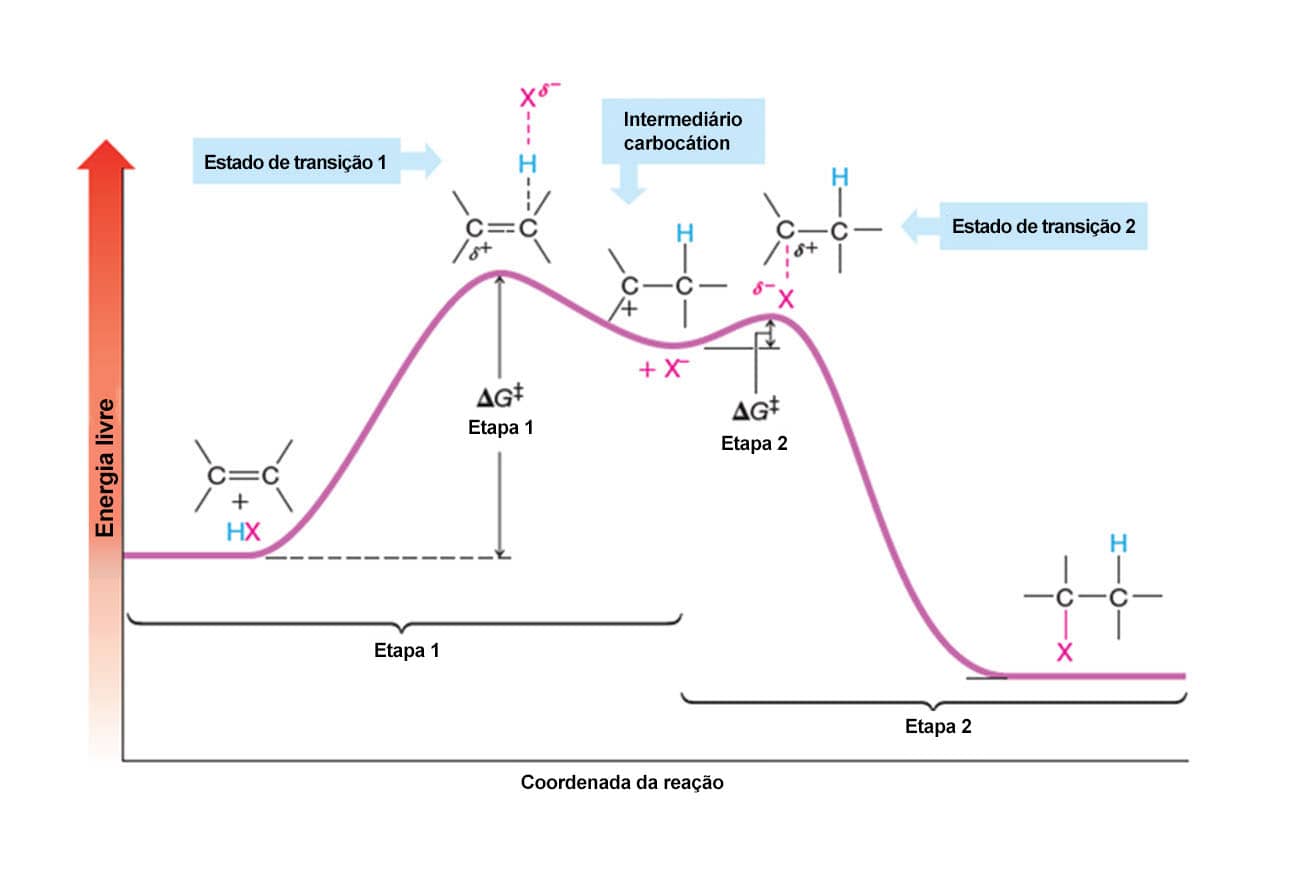
Como podemos ver ao analisar o diagrama, o haleto de alquila formado na reação tem menor nível de energia que os produtos, ou seja, o ΔG da reação é negativo e a reação é espontânea. Podemos ver também que a energia de ativação da etapa 1, que leva à formação do carbocátion intermediário, é maior do que a da etapa 2, ou seja, a primeira é a etapa limitante da reação. A etapa limitante de uma reação determina a velocidade em que a reação vai ocorrer, uma vez que é a mais lenta.
Quando os alcenos em que a reação estiver ocorrendo forem simétricos, como é o caso do eteno e do 2-buteno, por exemplo, não importa o carbono que ficará com o hidrogênio e com o halogênio, pois o produto formado será o mesmo. Porém, quando o alceno é assimétrico, existe a possibilidade de ocorrerem dois produtos. Vamos ver o caso do 2-metilpropeno:
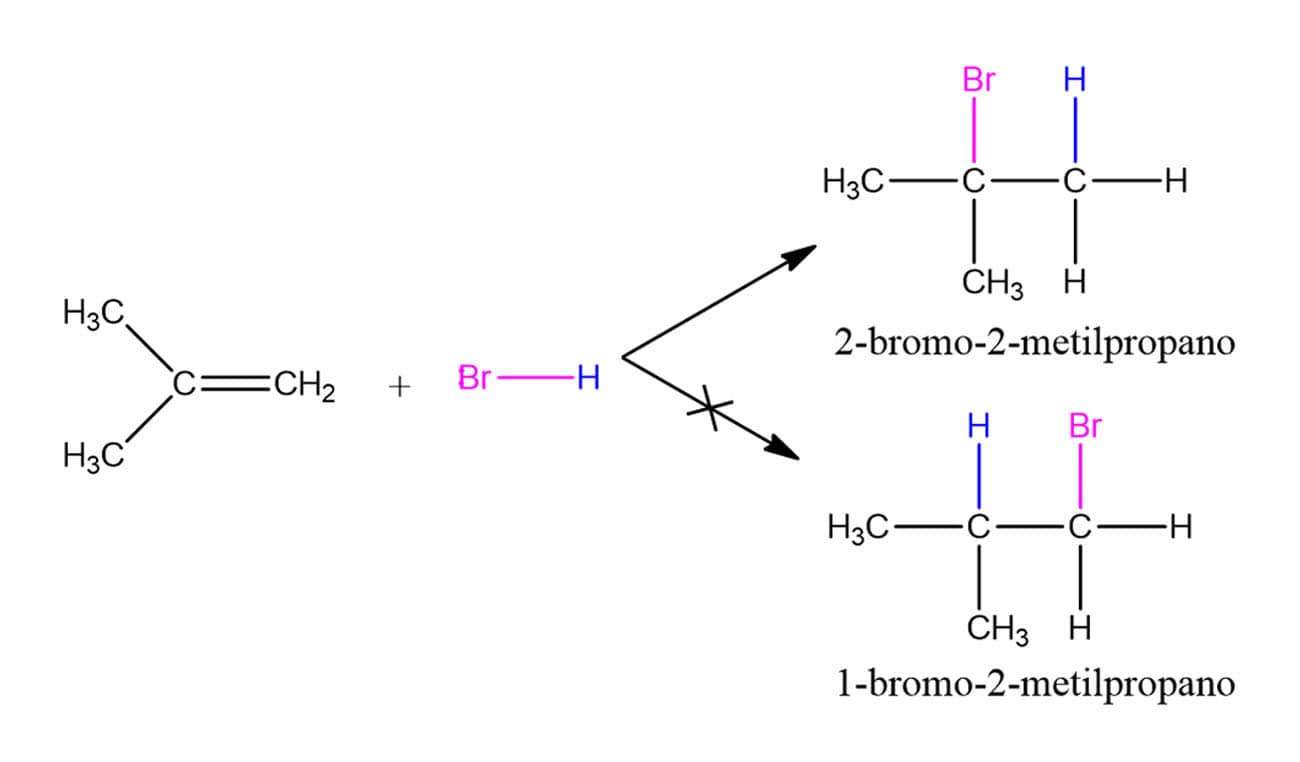
Na reação entre o 2-metilpropeno e o HBr existe a possibilidade de formar o 2-bromo-2-metilpropano ou o 1-bromo-2-metilpropano, porém, a reação se processa de forma que o produto majoritário é o 2-bromo-2-metilpropano, ou seja, ela é regioespecífica e o outro produto possível é formado em concentrações tão baixas que são desprezíveis. Como podemos saber, então, qual produto será formado em uma reação de adição eletrofílica em um alceno assimétrico? Foi por meio da observação de diversas reações desse tipo que o químico Vladimir Markovnikov criou uma regra usada até hoje.
Atenção
Na adição de HX a um alceno, o haleto se adicionará ao carbono com menor quantidade de átomos de hidrogênio. Ou seja, o produto formado é aquele no qual o átomo de hidrogênio se liga ao carbono menos substituído, e o halogênio, ao carbono com maior número de substituintes alquila. Você não precisa decorar essa regra, pois entendê-la é bastante simples agora que sabemos como é o mecanismo da reação e conhecemos a estabilidade relativa dos carbocátions.
Sabemos, ao estudar o mecanismo da reação, que um carbocátion é formado na primeira etapa. Vamos ver então os carbocátions que podem ser formados a partir do 2-metilpropeno na primeira etapa da reação?
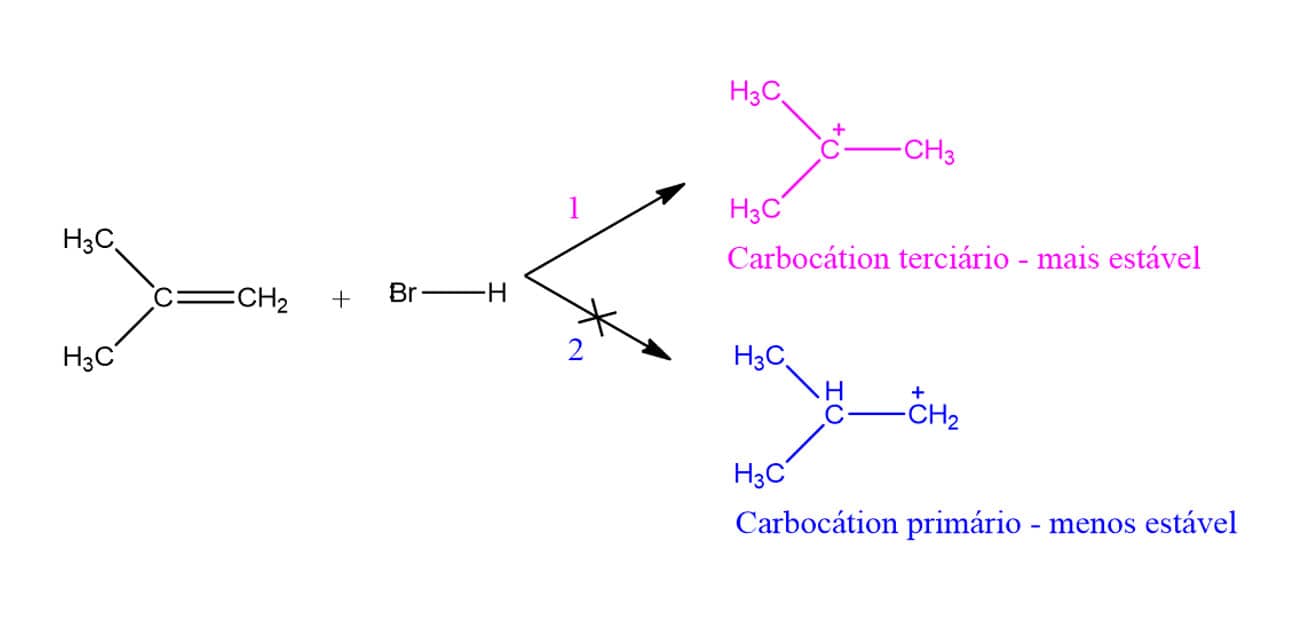
A maior estabilidade do carbocátion terciário significa que a energia de ativação necessária para que ele seja formado é menor do que a energia necessária para formar o carbocátion primário, ou seja, como a reação tende a ir pelo caminho de menor energia, apenas o carbocátion terciário é formado, e o halogênio só poderá entrar nessa posição.
A regra de Markovnikov pode ser expandida para outros tipos de reação eletrofílica a alcenos e não só para a adição de HX. Sempre será formado o carbocátion mais estável na primeira etapa e o ataque do nucleófilo, com posterior adição, ocorrerá neste carbono. O fato de a regra de Markovnikov se aplicar às reações de adição eletrofílica implica que reações desse tipo são regiosseletivas, ou seja, embora teoricamente pudessem existir dois ou mais isômeros constitucionais, apenas um é formado ou, pelo menos, é formado majoritariamente em detrimento dos demais.
Atenção
A adição de HBr a alcenos na presença de peróxidos apresenta um mecanismo diferente, pela formação de radicais, em que o produto preferencial não obedece à regra de Markovnikov. Esse mecanismo não é relevante para HF, HI e HCl e não será tratado em detalhes neste estudo, mas é importante saber que pode acontecer.
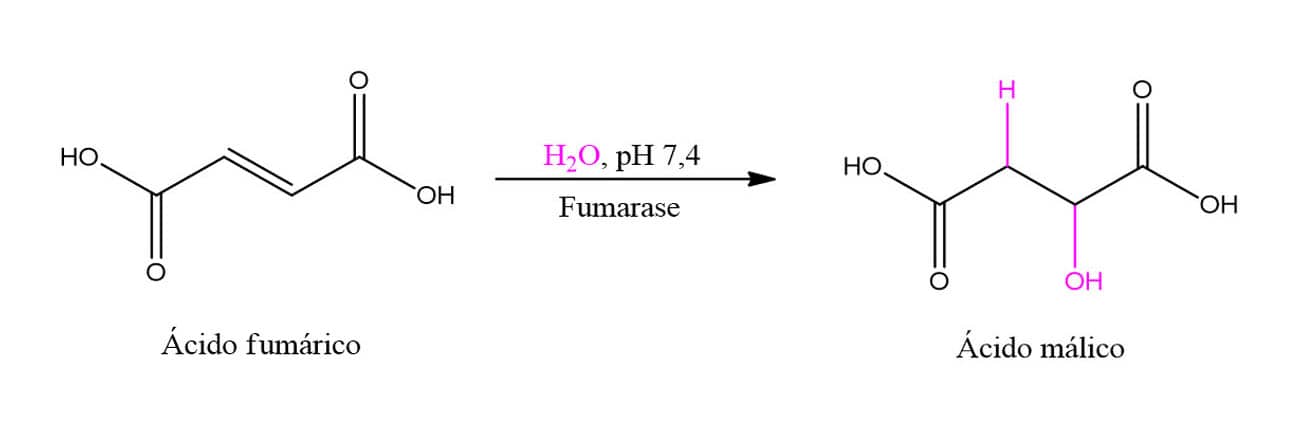
HIDRATAÇÃO DE ALCENOS
Reações de hidratação são aquelas nas quais uma molécula de água é adicionada a determinado composto. Aqui veremos a adição de uma molécula de água a um alceno, levando à formação de um álcool. Essa é uma reação muito utilizada na preparação em larga escala de álcoois de baixo peso molecular, sendo necessário utilizar ácido como catalisador.
A hidratação de alcenos segue a seguinte reação geral:
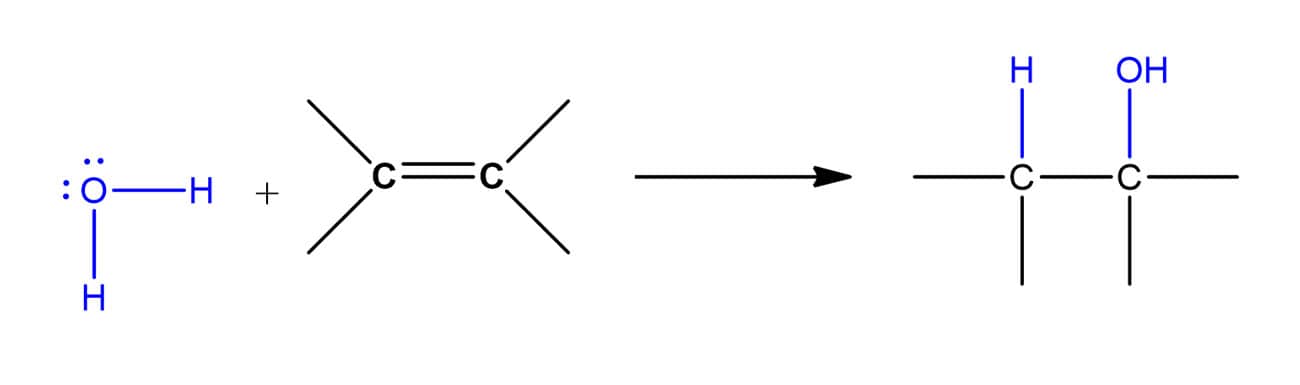
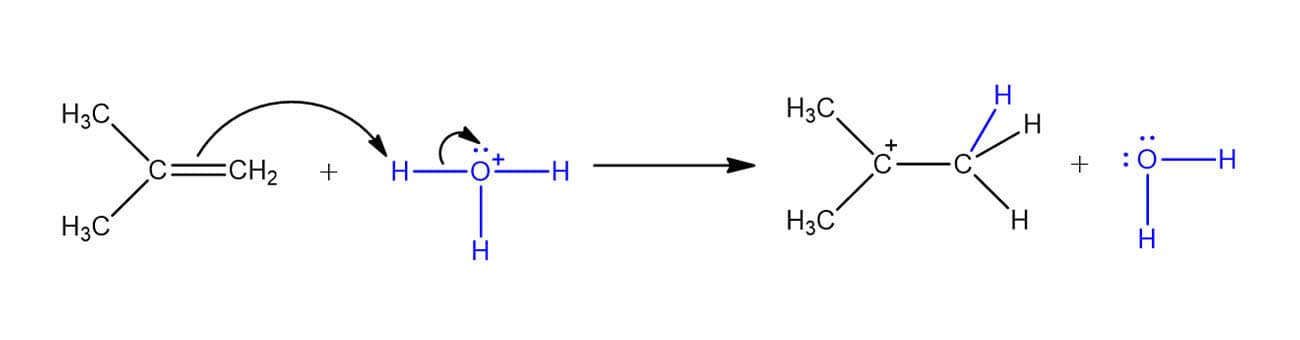
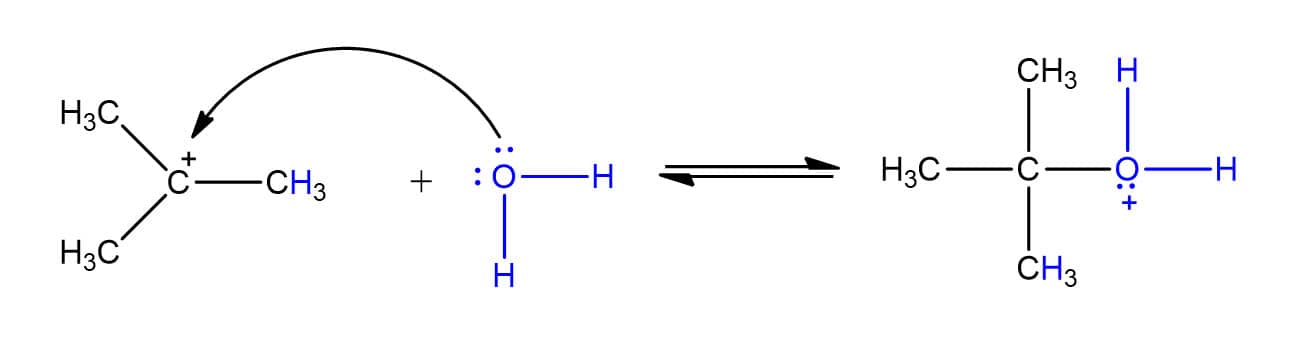
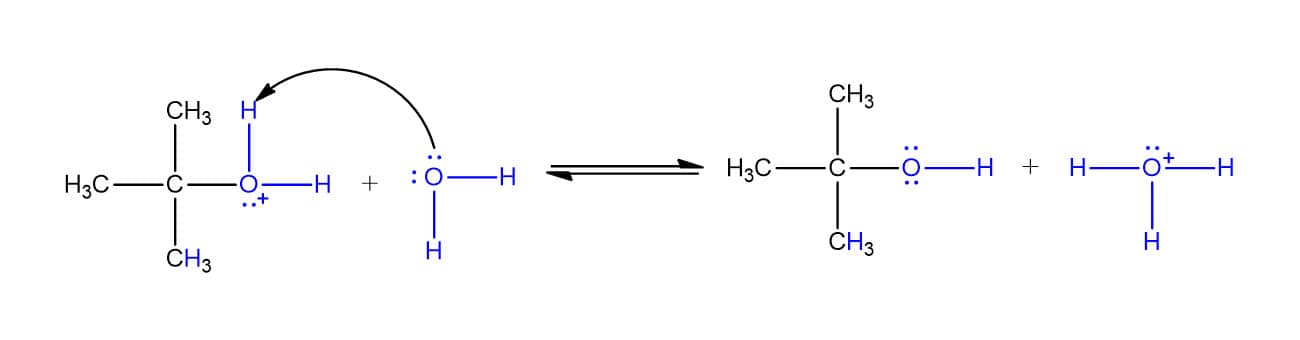
O mecanismo dessa reação se dá em três etapas. Vamos vê-las individualmente utilizando como exemplo a hidratação do 2-metilpropeno:
Embora as reações de hidratação dos alcenos pareçam simples, elas têm um diferencial: os compostos sofrem rearranjos para formar carbocátions mais estáveis. Na reação do 3,3-dimetil-1-buteno, por exemplo, o produto obtido é o 2,3-dimetil-2-butanol e não o 3,3-dimetil-2-butanol, como visto na reação a seguir:
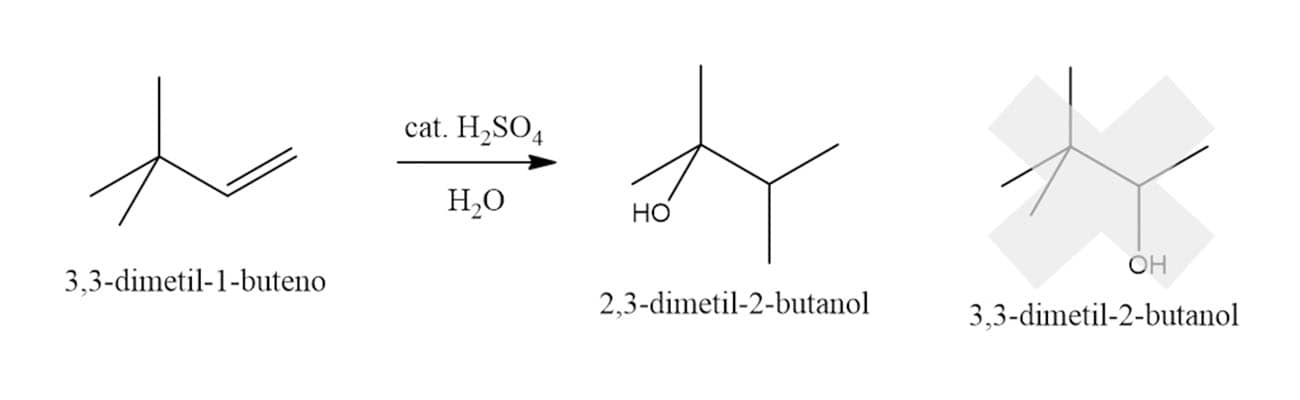
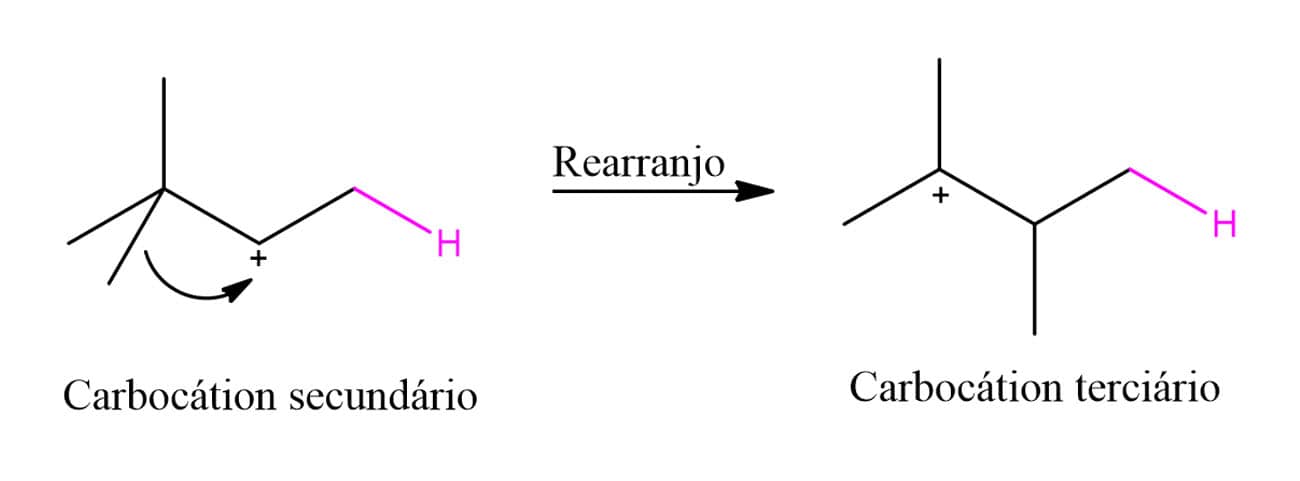
Por que isso acontece? Pelo mecanismo que vimos antes, um carbocátion secundário seria o intermediário da reação, porém, um rearranjo na molécula permite a formação de um carbocátion terciário que é mais estável e, por isso, favorecido.
Além disso, as reações de hidratação podem ainda ocorrer por processos conhecidos como oximercuriação, no qual o acetato de mercúrio é utilizado como eletrófilo inicial no lugar do ácido. Esse processo é mais utilizado em laboratórios de síntese orgânica, pois as condições de trabalho são mais simples. Apesar das diferenças nos reagentes, o fundamento e a ideia por trás do mecanismo são os mesmos dos vistos para os ácidos.
ADIÇÃO DE HALOGÊNIOS AOS ALCENOS
A adição de halogênios a alcenos leva à formação de 1,2-dihaletos. Falamos halogênios de maneira geral, mas, na realidade, o flúor é reativo demais para que as condições possam ser controladas adequadamente em laboratório. Além disso, o iodo não reage com alcenos, sobrando então o bromo e o cloro.
Essas reações são particularmente importantes para a indústria. A reação entre o eteno e o cloro (Cl2), por exemplo, leva à formação do 1,2-dicloroetano, que pode ser utilizado tanto como solvente quanto como produto de partida na produção de policloreto de vinila, o PVC.
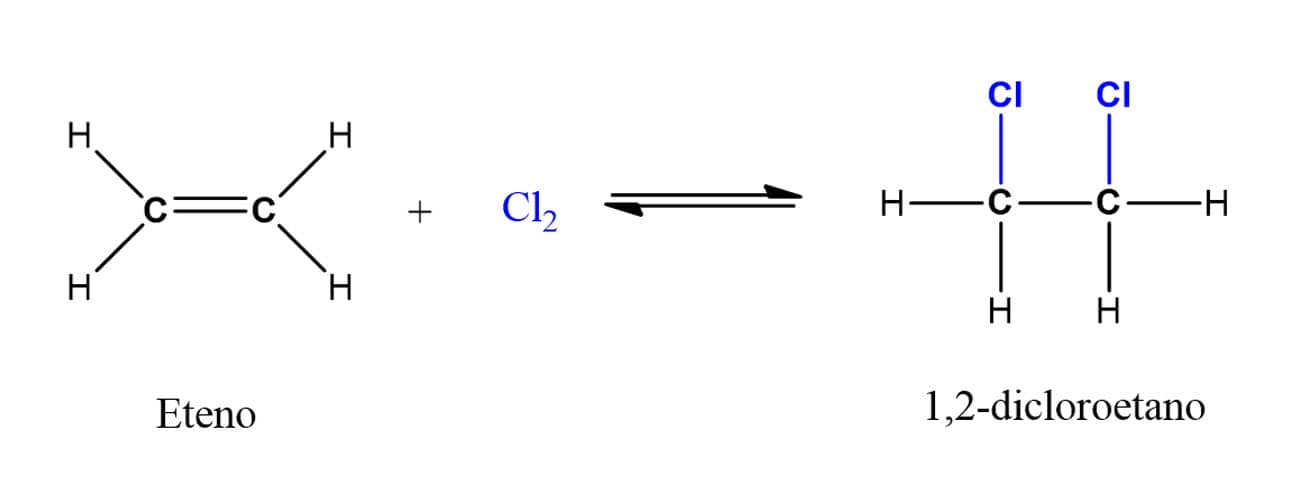
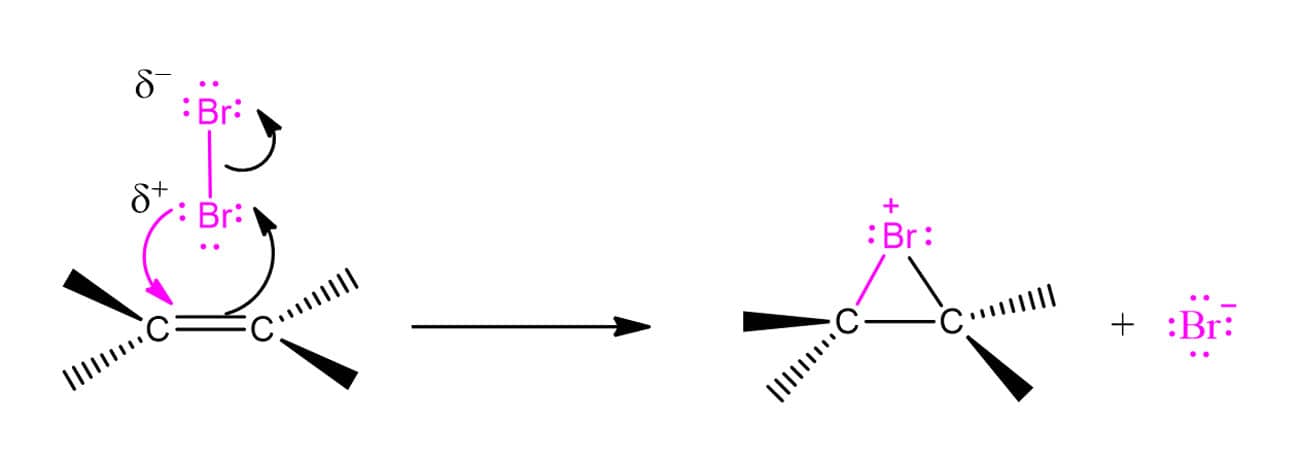
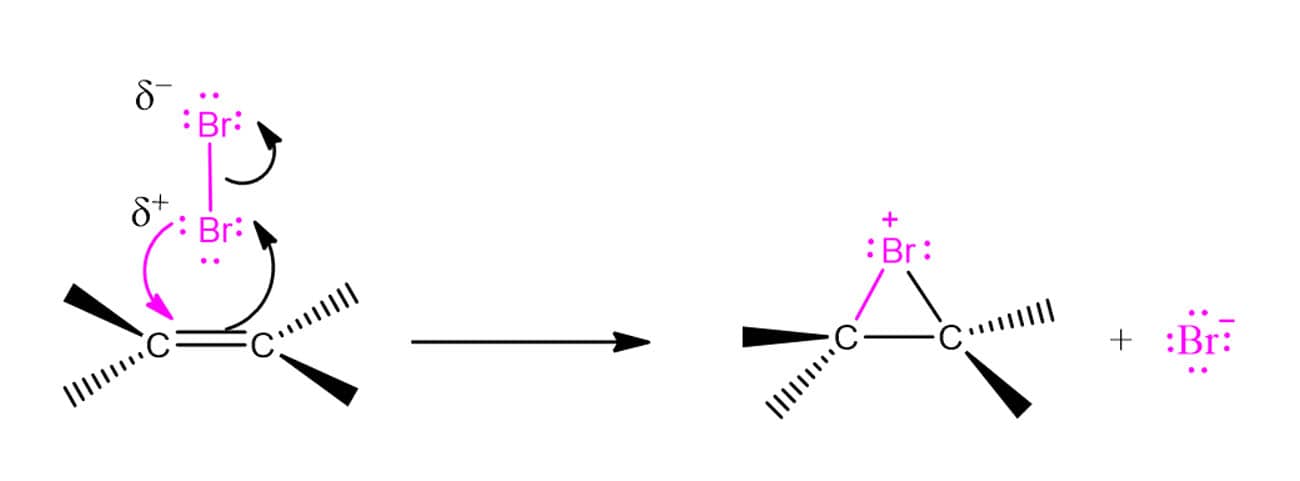
Todas as reações que vimos até o momento contavam com reagentes naturalmente polarizados, como a água e os HX. Agora, porém, estamos falando de moléculas nas quais não há diferença de eletronegatividade. Então, o que permite que essas reações ocorram mesmo assim? Um efeito de repulsão. Quando o halogênio molecular se aproxima dos elétrons da ligação dupla do alceno, há uma repulsão entre os elétrons do halogênio e do alceno, gerando um dipolo induzido na molécula de halogênio. Com isso, um átomo passa a apresentar carga parcial positiva e o outro, carga parcial negativa. Quando a cisão da ligação ocorre, formam-se um cátion e um ânion do mesmo elemento.
Isso quer dizer então que o mecanismo dessas reações vai seguir o mesmo padrão das que vimos antes? Não. As reações de adição de halogênios a alcenos apresentam algumas particularidades bastante importantes. A primeira delas é que essas reações apresentam esteroquímica anti, ou seja, os átomos de bromo ficarão o mais distantes possível um do outro. Em um composto cíclico, cada um estará em uma face – apenas o composto trans será formado. Vamos ver o caso do ciclopenteno para ilustrar o que estamos falando.
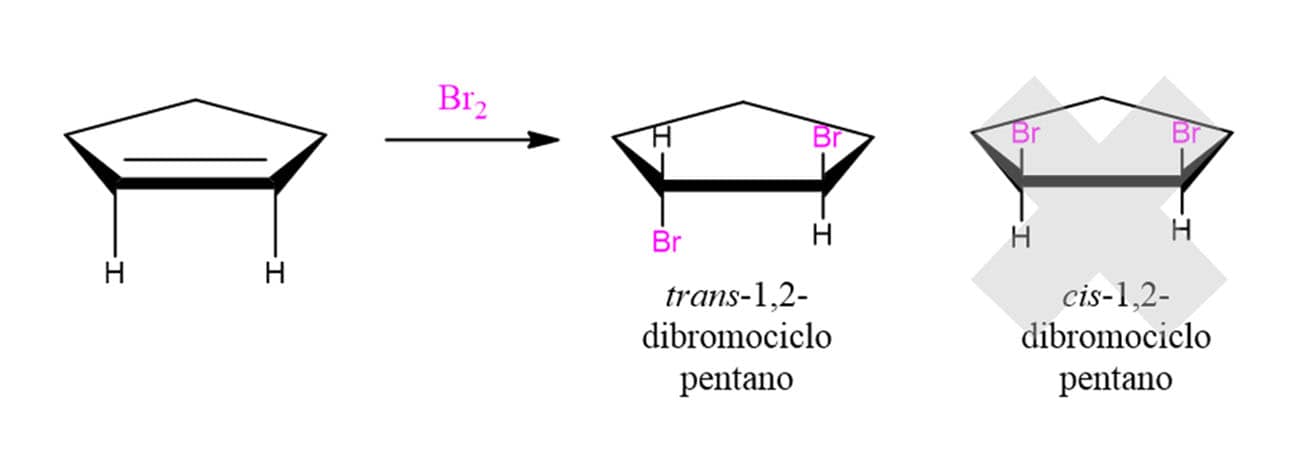
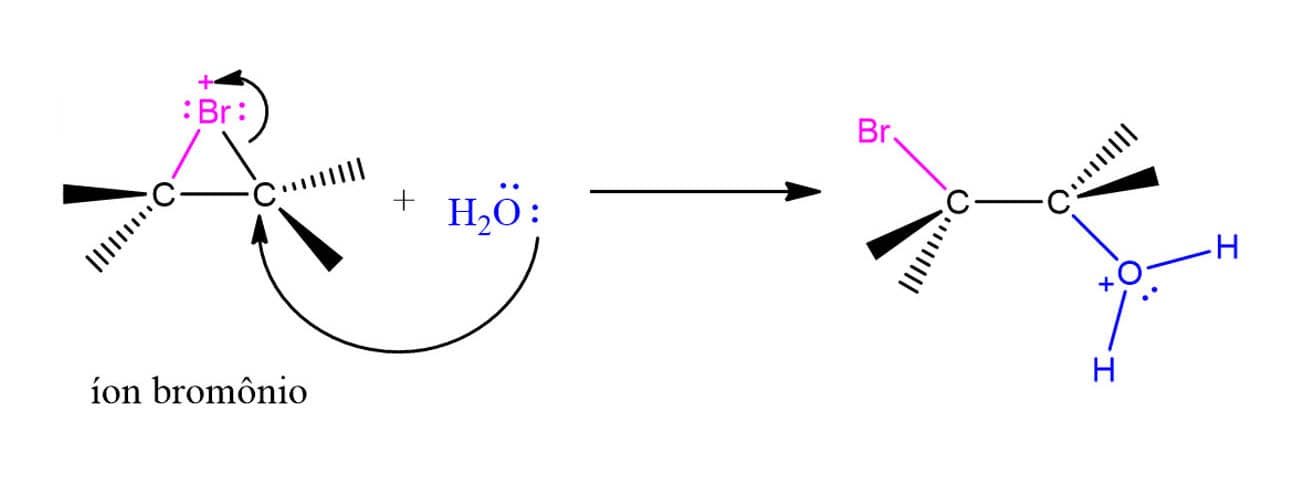
A explicação para isso foi sugerida na década de 1930 por George Kimball e Irving Roberts. Os químicos propuseram que, ao invés de formar um carbocátion, os intermediários da reação eram os íons bromônio (R2Br+) ou clorônio (R2Cl+), dependendo do halogênio utilizado. Aqui vamos tratar do bromônio por ser mais usual. O esquema abaixo ilustra a formação do bromônio, porém, é importante ressaltar que esta é apenas uma maneira ilustrativa de retratar a formação para fins didáticos. O íon bromônio é, na realidade, formado em uma única etapa.
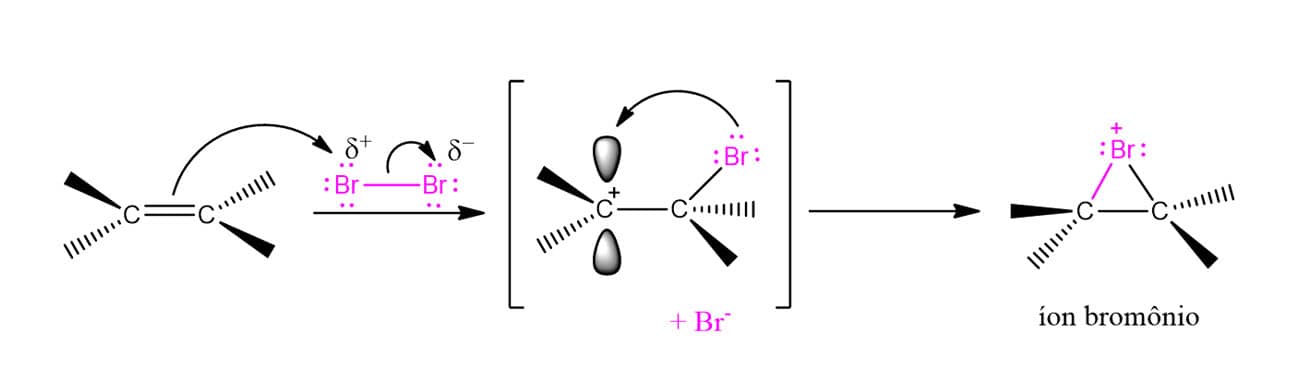
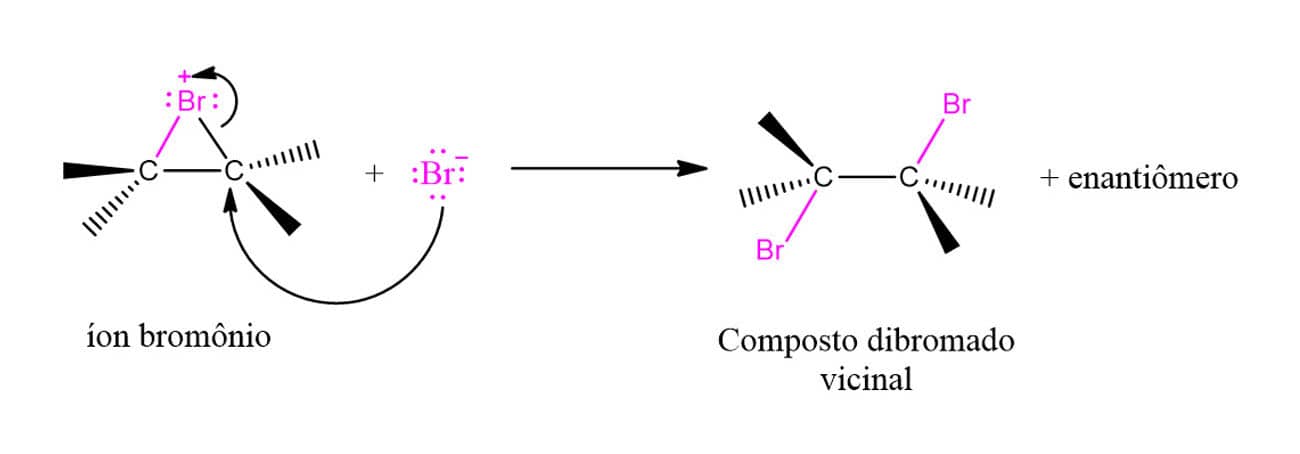
Agora que conhecemos o íon bromônio, vamos ver o mecanismo por trás da reação de adição de halogênios utilizando um alceno genérico como exemplo.
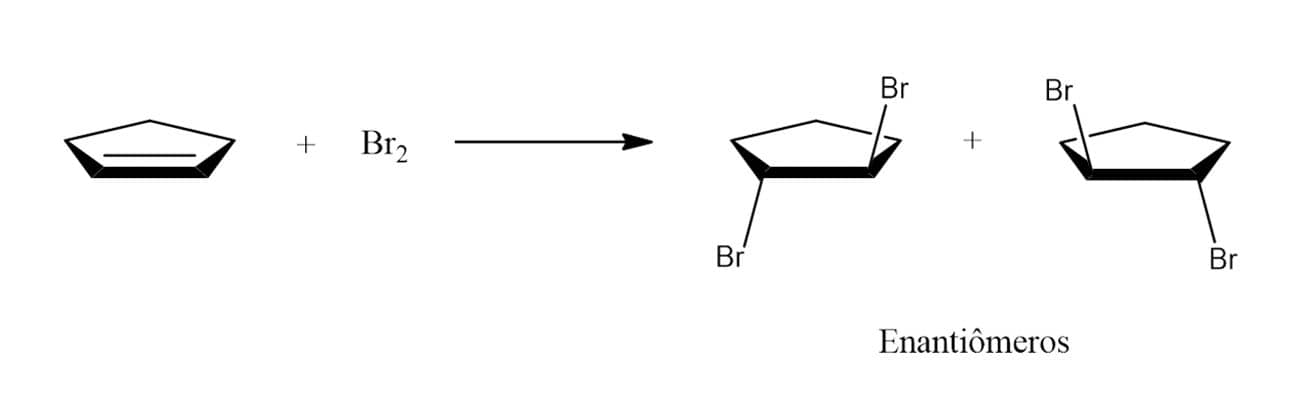
É importante observar que o ataque do brometo ao íon bromônio pode ocorrer em qualquer um dos dois carbonos, uma vez que a molécula é simétrica. Isso quer dizer que, em compostos cíclicos, por exemplo, será formado apenas o composto trans em uma mistura racêmica, como pode ser visto a seguir:
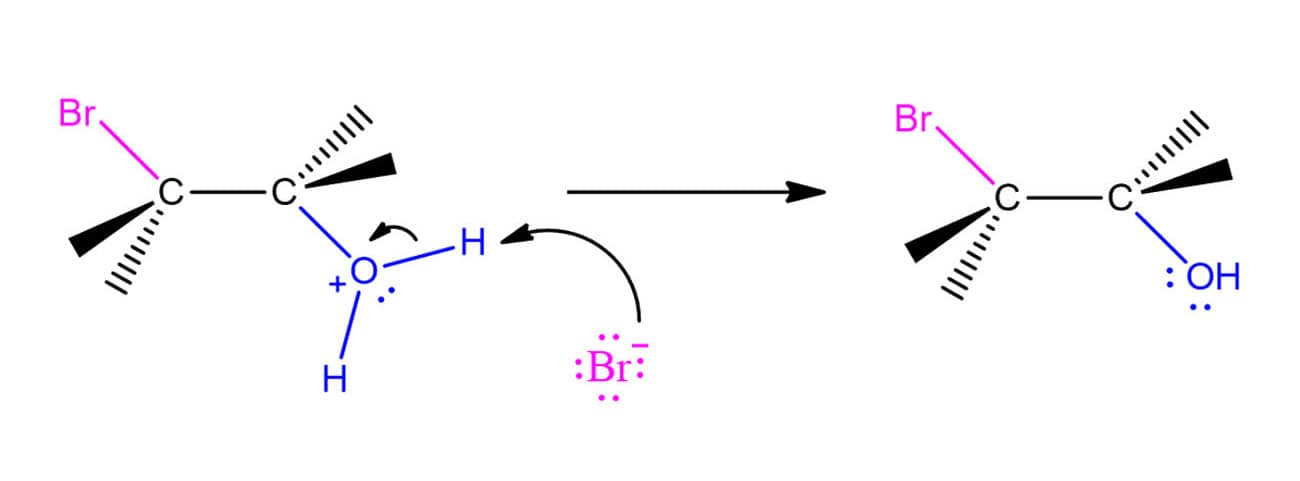
Formação de haloidrinas
As haloidrinas são formadas quando a reação de adição eletrofílica do halogênio molecular ocorre na presença de água. O mecanismo dessa reação é uma mistura da reação de adição de halogênios e da hidratação de alcenos. Vamos ver a seguir, etapa por etapa, utilizando o bromo como exemplo:
REAÇÕES DE ADIÇÃO ELETROFÍLICA A DIENOS
Agora que compreendemos as reações de adição eletrofílica aos alcenos simples, vamos ver o que acontece quando a molécula apresenta mais de uma dupla ligação. A primeira coisa que precisamos observar é a distância entre as duplas ligações.
Se o mesmo carbono estiver participando de duas duplas ligações, dizemos que esse é um dieno acumulado, como é o caso do 1,2-propadieno.
Se um ou mais carbonos saturados estiverem presentes entre as duplas ligações, dizemos que são dienos isolados, como é o caso do 1,4-pentadieno.
Já quando as duplas ligações estão alternadas com ligações simples, dizemos que esses alcenos são conjugados, como é o caso do 1,3-butadieno.
Os dienos isolados se comportam e reagem da mesma forma que os alcenos simples, com a diferença de que podem reagir duas vezes. Os dienos acumulados podem dar origem a compostos quirais e são menos estáveis do que dienos isolados, mas, ainda assim, podem ser encontrados em alguns compostos naturais. São os dienos conjugados, no entanto, que apresentam as maiores diferenças em suas reações, pois suas ligações duplas interagem uma com a outra.
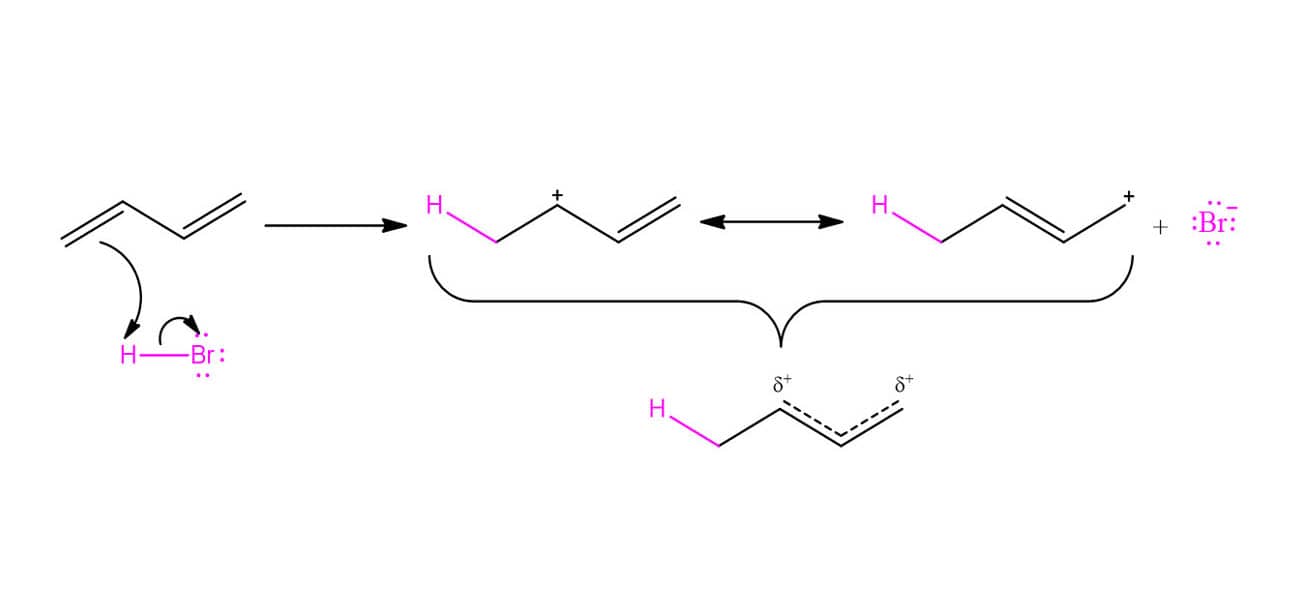
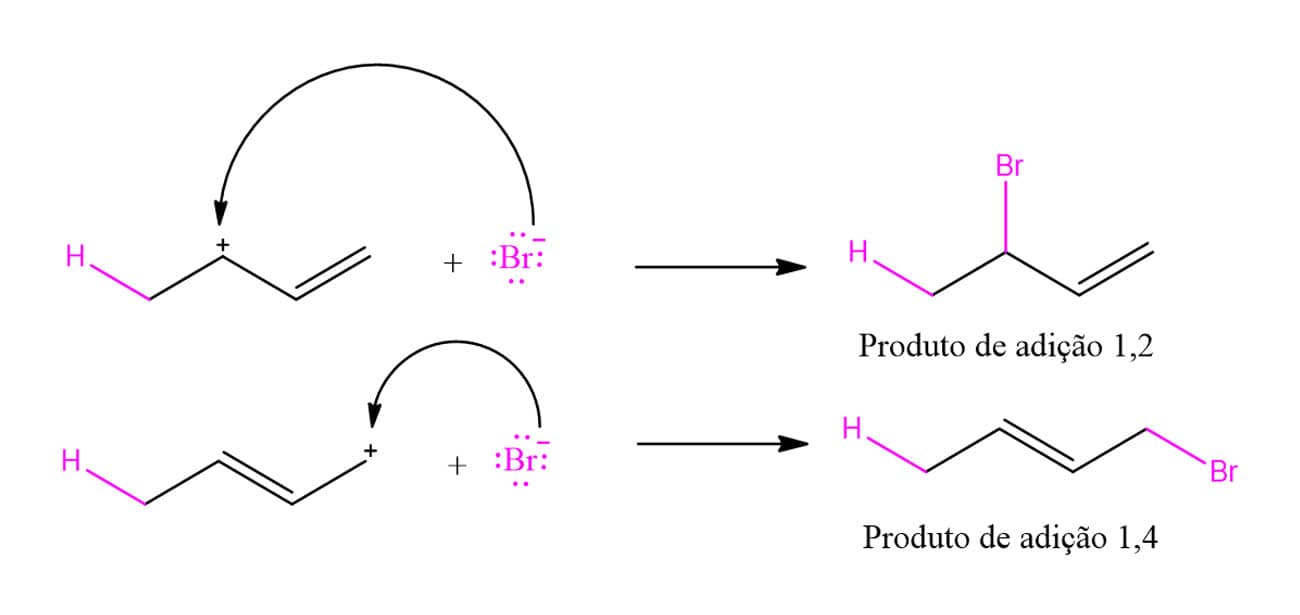
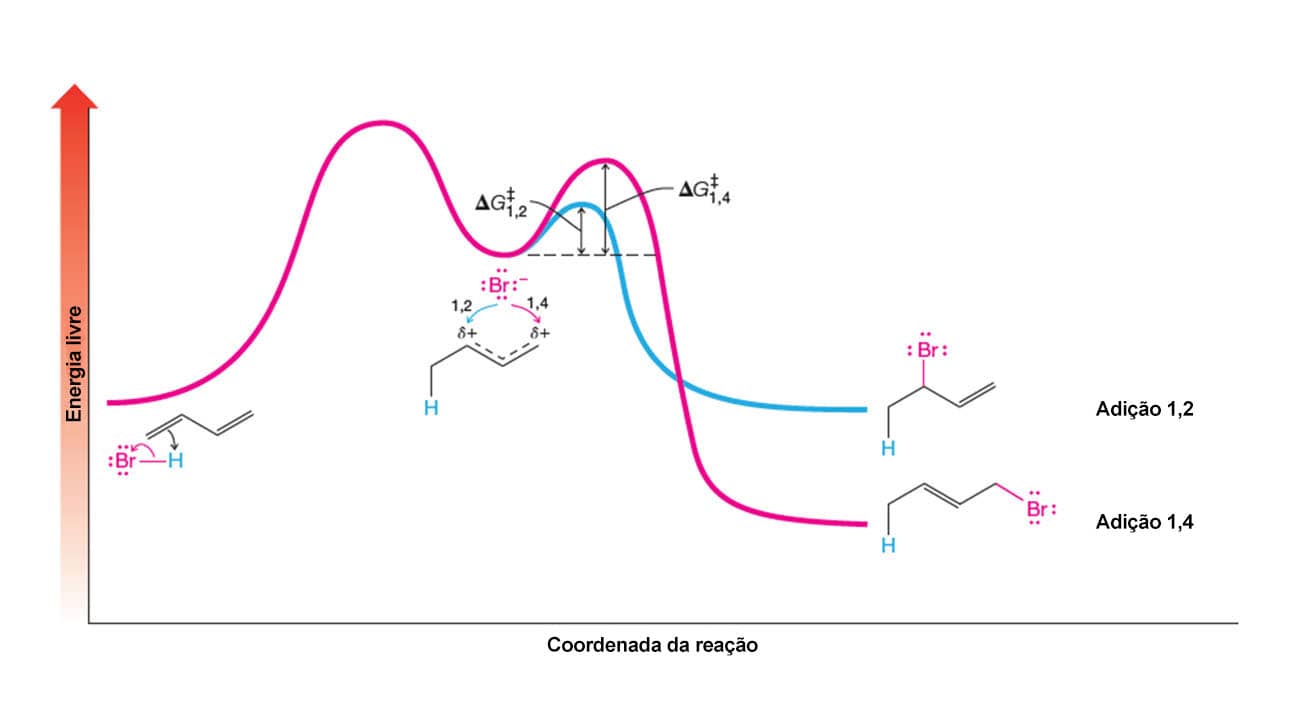
A reação entre um dieno conjugado e um reagente eletrofílico, como HBr ou Br2, leva à formação de dois produtos: os produtos de adição 1,2 e 1,4. O esquema a seguir traz um exemplo desse tipo de reação:
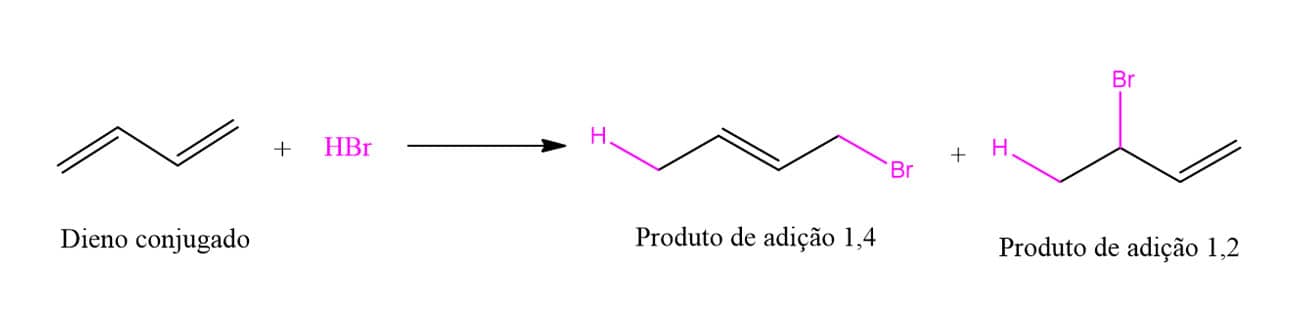
Uma vez que vimos as reações de adição a alcenos, o produto 1,2 deve parecer familiar, enquanto o 1,4 parece não fazer sentido. Mas, calma, existe uma explicação! Vamos ver o mecanismo passo a passo para entender como a formação desses produtos acontece.
E qual é a proporção em que esses produtos são formados?
A baixas temperaturas, o produto majoritário é produto de adição 1,2; enquanto a altas temperaturas favorecemos a formação do produto de adição 1,4. Se o produto de adição 1,2 puro for aquecido, o equilíbrio também levará à formação majoritária do produto 1,4. Isso nos traz outros conceitos importantes: de produto termodinâmico e de produto cinético. Nesse caso, o produto de adição 1,4 é o produto termodinâmico, ou seja, sua energia de ativação é maior, porém, o produto final tem menor energia. Já o produto 1,2 tem menor energia de ativação, mas o produto final terá maior energia. Isso quer dizer que, quando houver energia suficiente para ultrapassar a energia de ativação do produto de adição 1,4, ele será preferencialmente formado devido à sua maior estabilidade. Essas relações estão resumidas no seguinte diagrama de energia:
REAÇÕES DE ADIÇÃO ELETROFÍLICA A ALCINOS
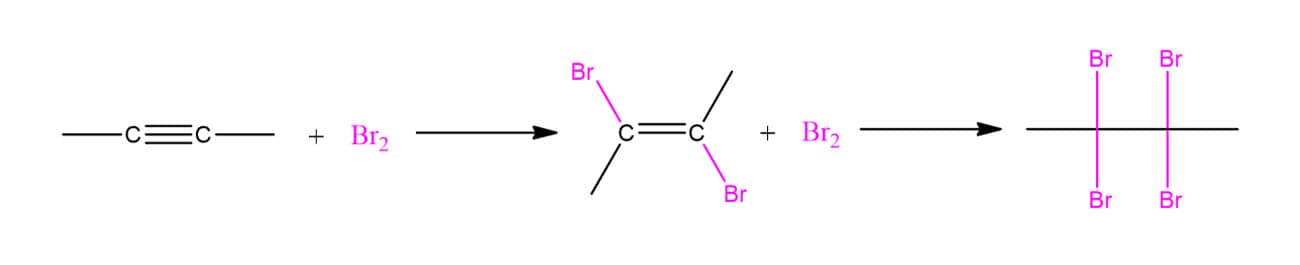
Os alcinos vão apresentar o mesmo tipo de reação eletrofílica que vimos anteriormente para os alcenos simples, com a diferença de que podem reagir com um ou dois mols do reagente. Podemos ver a adição de bromo molecular no esquema a seguir:
Atenção
Isso quer dizer que, se forem adicionados 2 mols de bromo, a reação procederá até a formação do composto tetrahalogenado, porém, se apenas 1 mol de bromo for utilizado, a reação fornecerá o composto trans-dihalogenado.
Para concluir, com a ajuda do especialista Luiz Mota, aprenderemos um pouco mais a respeito da Regra de anti-Markovnikov e suas aplicações, bem com conheceremos exemplos e mecanismos de reação de adição eletrofílica.

ADIÇÃO ELETROFÍLICA A ALCENOS, DIENOS E ALCINOS
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste conteúdo, pudemos conhecer os componentes termodinâmicos que regem uma reação orgânica e as informações que podem ser obtidas por meio dela, como a espontaneidade da reação, por exemplo. Vimos também os diagramas de energia e os conceitos de energia de ativação e de estado de transição e as informações que podem ser obtidas a partir da leitura desse diagrama.
Pudemos aprender as regras universais de representação gráfica dos mecanismos de reação, os tipos de quebra que podem ocorrer em ligações covalentes e conhecer melhor a estabilidade dos intermediários formados e que nos possibilitam entender os mecanismos das reações. Por fim, começamos o estudo dos mecanismos das reações orgânicas pelas reações de adição eletrofílica a alcenos, dienos e alcinos, passando por conceitos importantes como a regra de Markovnikov.

PODCAST
Para encerrar o assunto abordado, o podcast contribuirá com mais informações sobre a Regra de Markovnikov e exceções e sobre os produtos de adição 1,2 e 1,4.
CONQUISTAS
Você atingiu os seguintes objetivos:
Identificou os aspectos termodinâmicos que afetam uma reação química e as informações presentes em um diagrama de energia
Reconheceu nucleófilos e eletrófilos, além de símbolos utilizados em mecanismos, e a estabilidade de intermediários
Descreveu as principais reações de adição eletrofílica a alcenos, dienos e alcinos