Descrição
Conceito de saúde, doença, patologia e aspectos gerais da agressão, defesa, adaptação e lesão celular. Tipos e características da degeneração celular. Princípios fundamentais do processo de necrose e apoptose.
PROPÓSITO
Conhecer os conceitos de saúde, doença, patologia e compreender os processos de agressão, defesa, adaptação, os tipos de degeneração celular e os princípios fundamentais dos processos de necrose e apoptose é importante para entender as bases patológicas das doenças.
OBJETIVOS
Módulo 1
Descrever os conceitos de saúde, doença, patologia e as características dos processos de agressão, defesa, adaptação e lesão celular
Módulo 2
Identificar os principais tipos de degeneração celular, seus mecanismos e aspectos morfológicos
Módulo 3
Descrever as etapas de progressão da lesão celular e os princípios da morte celular por apoptose e necrose
Introdução
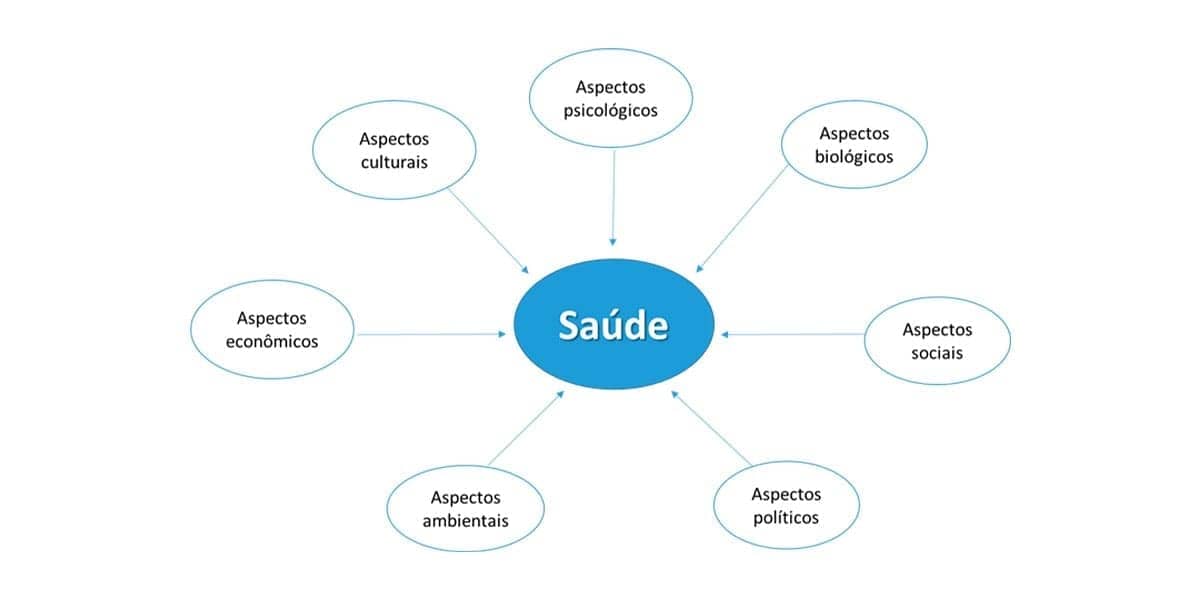
Entender a complexidade do processo saúde-doença tem que ser um dos objetivos iniciais básicos de todo profissional da área da Saúde, de modo que o organismo humano não seja visto como uma máquina, na qual apenas os eventos de natureza biológica tenham relevância.
Dessa forma, nós iniciaremos nossa jornada pelos conceitos fundamentais em Patologia Básica: entenderemos os processos de agressão e mecanismos de defesa do organismo, tipos de adaptação e de lesão celular. Vamos nos aprofundar nas degenerações, lesões celulares reversíveis nas quais as células conseguem retornar ao seu estado inicial, uma vez cessada a agressão.
Discutiremos também a evolução para a lesão irreversível, conhecendo as principais características e diferenças entre a necrose e apoptose. São muitos conceitos interessantes que você aplicará em toda a sua jornada acadêmica e profissional. Está pronto para começar?
MÓDULO 1
Descrever os conceitos de saúde, doença, patologia e as características dos processos de agressão, defesa, adaptação e lesão celular
Conceito de saúde, doença e patologia
Ao lado do desemprego e da violência, questões relacionadas à saúde sempre se apresentaram como destaque entre as preocupações ditas como prioritárias em debates político-sociais. Apesar de muito importante, o processo saúde-doença é complexo e muitas vezes mal compreendido.
Para você, o que é ter saúde? O que é doença?
Durante séculos, o aparecimento de doenças foi atribuído a forças sobrenaturais e castigo de divindades, sendo instituições religiosas e seus sacerdotes os promotores da cura. O Renascimento cultural e científico possibilitou uma maior compreensão sobre a constituição do corpo humano e sobre o processo de adoecimento. O corpo humano, então, passou a ser enxergado como uma máquina passível de falhas, que quando compreendidas, poderiam ser corrigidas. Saúde era ausência de doença e doença era ausência de saúde.
Em 1947 esse conceito mudou e, segundo a Organização Mundial da Saúde (OMS), a saúde passou a ser definida como um estado de completo bem-estar físico, mental e social, não apenas a ausência de doença ou enfermidade.
Essa definição é motivo de críticas e reflexões de muitos pesquisadores e profissionais, que dizem que essa é mais uma declaração que propriamente uma definição, mas apesar disso, é utilizada até os dias atuais. KUMAR et al. (2016), define a saúde como:
Um estado de adaptação do organismo ao ambiente físico, psíquico ou social em que vive, de modo que o indivíduo se sente bem (saúde subjetiva) e não apresenta sinais ou alterações orgânicas (saúde objetiva).
(KUMAR, 2016)
Atenção
Saúde e normalidade não são sinônimas. Enquanto o conceito da saúde refere-se ao indivíduo, o termo normal é utilizado em relação a parâmetros preestabelecidos (número de batimentos cardíacos, peso dos órgãos e nível de transaminases no sangue) a partir da média de várias observações de um determinado aspecto dentro de populações homogêneas.
A ideia de doença é historicamente anterior à concepção de saúde, estando presente de diversas formas em todas as organizações sociais conhecidas. Sua definição pode ser entendida a partir do conceito biológico de adaptação, que é uma propriedade geral dos seres vivos de serem sensíveis às variações do meio ambiente e de produzir respostas adaptativas. Essa capacidade varia em diferentes indivíduos de uma mesma espécie, dependendo de inúmeros fatores biológicos, ambientais e sociais.
A doença é um estado de falta de adaptação ao ambiente físico, psíquico ou social, no qual o indivíduo se sente mal (tem sintomas) e/ou apresenta alterações orgânicas evidenciáveis objetivamente (sinais clínicos).
Assim, entendemos o processo saúde-doença sendo dinâmico, complexo e multidimensional, abrangendo aspectos biológicos, psicológicos, socioculturais, ambientais, econômicos e políticos.
E o que é a Patologia?
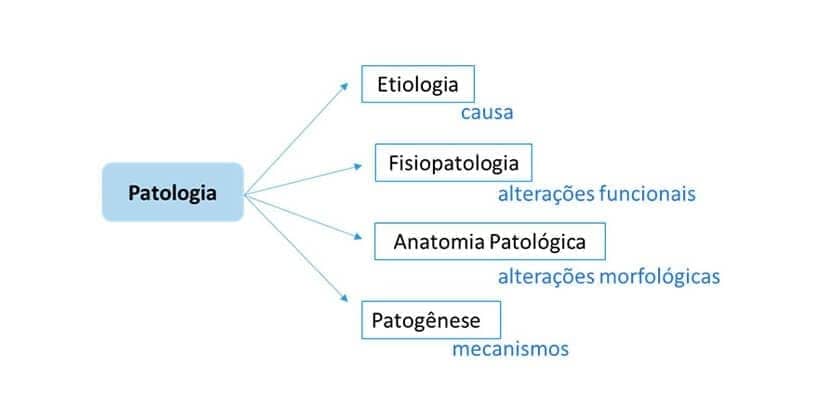
A partir de uma perspectiva biológica, a Patologia (pathos = doença + logos = estudo) pode ser entendida como uma ciência que estuda as causas (etiologia) e mecanismos (patogênese) das doenças, bem como os órgãos e sistemas afetados e as alterações moleculares, morfológicas (anatomia patológica) e funcionais (fisiopatologia) que apresentam.
Abrangendo todos esses aspectos, a Patologia apresenta grande importância na compreensão global das doenças, fornecendo bases para entendermos a prevenção, manifestações clínicas, diagnóstico, tratamento, prognóstico e evolução.
Conceito de agressão, defesa, adaptação e lesão
Dependendo da intensidade, tempo de atuação e da capacidade de reação do organismo, qualquer estímulo da natureza pode representar uma agressão. De fato, as agressões podem ser provocadas por agentes externos (químicos, físicos ou biológicos) ou a partir do próprio organismo, como alterações na expressão gênica ou mecanismos de defesa.
Porém, qualquer que seja sua natureza, os agentes agressores agem diretamente, por meio de alterações moleculares que resultam em modificações morfológicas ou indiretamente, por meio dos mecanismos de adaptação do próprio organismo. Nesses casos, ao serem ativados para eliminar ou neutralizar a agressão, os mecanismos de defesa induzem alterações moleculares que resultam em modificações morfológicas.
Os mecanismos de defesa do organismo são muito variados. Contra os agentes externos, contamos com a existência de barreiras mecânicas e químicas nos revestimentos interno e externo (pele e mucosas). Contra os agentes infecciosos, temos a fagocitose, a resposta imune inata e a resposta imune adaptativa, cujo importante representante é a resposta inflamatória.
Fagocitose
Processo de ingestão e destruição de partículas, como bactérias ou restos de células necróticas. É realizada por células chamadas de fagócitos (monócitos, macrófagos, neutrófilos e células dendríticas), que usam sua membrana plasmática para englobar essas partículas, dando origem a um compartimento interno chamado fagossoma.
Resposta imune inata
Primeira barreira contra infecções. Seus componentes incluem, além dos leucócitos de forma geral e das proteínas do sistema complemento, células dendríticas e epiteliais. Juntos, eles também atuam na eliminação de células danificadas do próprio organismo e de corpos estranhos.
Resposta imune adaptativa
As respostas imunes adaptativas são aquelas geradas ao longo da vida e ativadas após um contato inicial dos componentes da reposta imune inata com diferentes agentes invasores. Elas têm a propriedade de reconhecer especificamente um determinado microrganismo, gerando uma memória imunológica, que confere proteção contra reinfecções pelo mesmo antígeno. As células da imunidade adaptativa são os linfócitos B e linfócitos T.
Contra as agressões ao genoma, existe o sistema de reparo de DNA. Contra compostos químicos, como os radicais livres, contamos com sistemas enzimáticos eficazes de detoxificação e antioxidantes.
São muitos os mecanismos de defesa, voltados a vários tipos de agressão. Porém, a desregulação da resposta imune, assim como de outros mecanismos de defesa, pode se tornar a origem da agressão, como ocorre nas doenças autoimunes.
Se a agressão não for fatal, ela gera estímulos que induzem respostas adaptativas nos tecidos, de modo que eles se tornem mais resistentes às próximas agressões. Logo, o conceito de adaptação diz respeito à capacidade que as células, tecidos ou o próprio organismo possuem de modificar suas funções (dentro de certos limites) para ajustar-se às modificações induzidas pelo estímulo. As respostas adaptativas podem ocorrer apenas em células e suas organelas, ou no organismo como um todo.
Dentre as respostas adaptativas que ocorrem nas células, temos o precondicionamento à hipóxia, hipertrofia do retículo endoplasmático liso e hipertrofia muscular, por exemplo. Já a resposta adaptativa sistêmica do organismo, frente a diferentes agressões, sejam elas de natureza física, química, biológica ou até emocional, é conhecida como estresse.
hipóxia
É uma condição de baixa concentração de oxigênio nos tecidos e órgãos.
O conjunto de alterações morfológicas, moleculares e/ou funcionais que surgem nas células e tecidos após as agressões é denominado de lesão:
As alterações morfológicas podem ser vistas a olho nu (macroscópicas) ou somente por meio de microscópios (microscópicas e ultra estruturais).
As alterações moleculares, que são refletidas nas alterações morfológicas, podem ser detectadas por métodos bioquímicos ou moleculares.
As alterações funcionais caracterizam-se por alterações na função de células até sistemas completos, representando os fenômenos fisiopatológicos.
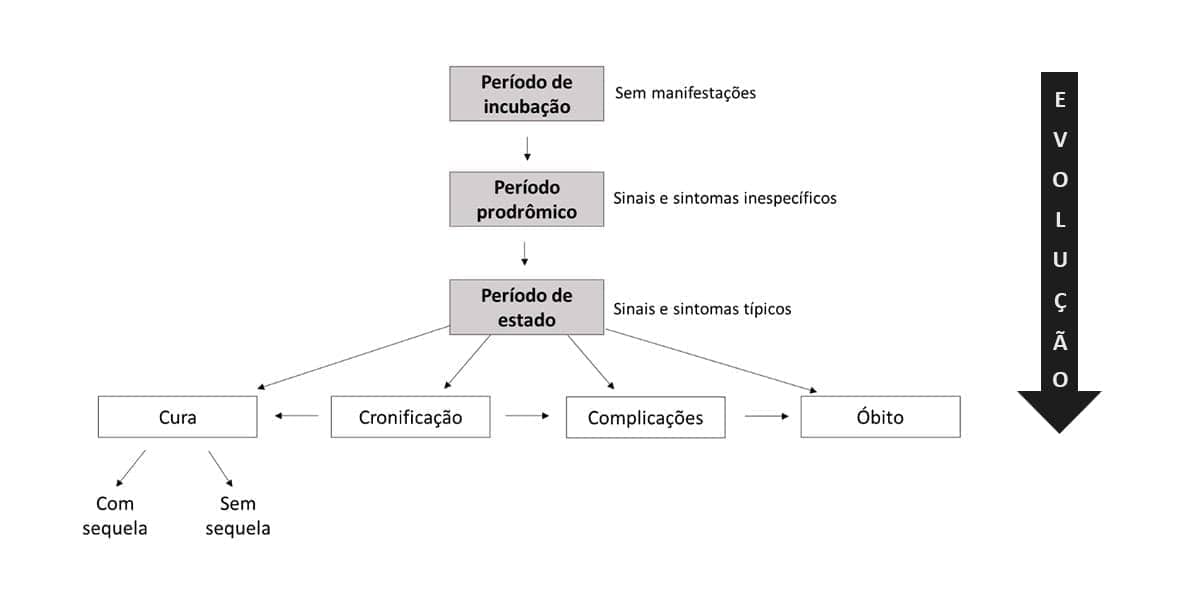
As lesões são dinâmicas: têm início, evoluem, e tendem para a cura, cronicidade ou para o óbito. Desse modo, são conhecidas também como processos patológicos, indicando uma sucessão de eventos. O aspecto morfológico de uma determinada lesão, por exemplo, pode variar de acordo com o momento no qual é avaliado.
Você já sabe que há uma grande diversidade de agentes lesivos existentes na natureza. Porém, a variedade das lesões encontradas nas doenças não é muito grande. Isso porque os mecanismos de agressão às moléculas são comuns a diferentes tipos de agressões.
Por exemplo, muitos agentes lesivos agem pela redução do fluxo sanguíneo, diminuindo assim o fornecimento de oxigênio para as células e reduzindo a produção de energia. Por outro lado, os mecanismos de defesa do organismo geralmente são inespecíficos, o que significa que são semelhantes frente a agressões distintas. Podemos citar também as reações inflamatórias, que são respostas frequentes do organismo frente a agressões de naturezas variadas, como a necrose tecidual, presença de corpos estranhos e infecções.
As lesões possuem um componente que resulta tanto da ação do agente agressor quanto dos mecanismos de defesa. Como já mencionamos, em muitas situações as respostas de defesa são os causadores das lesões, como ocorre nas doenças autoimunes.
Classificação e nomenclatura das lesões
As agressões comprometem um tecido ou órgão que é formado por diversos componentes, como as células do estroma e do parênquima; componentes intercelulares, como o interstício ou matriz extracelular; a circulação sanguínea e linfática e uma rede de nervos. Desse modo, um ou mais componentes podem ser afetados simultaneamente e, por isso, as lesões podem ser classificadas de acordo com o alvo atingido. Porém, antes de comentarmos essa classificação, é importante lembrar que dada a interdependência entre os componentes teciduais, nas doenças as lesões não surgem isoladamente.
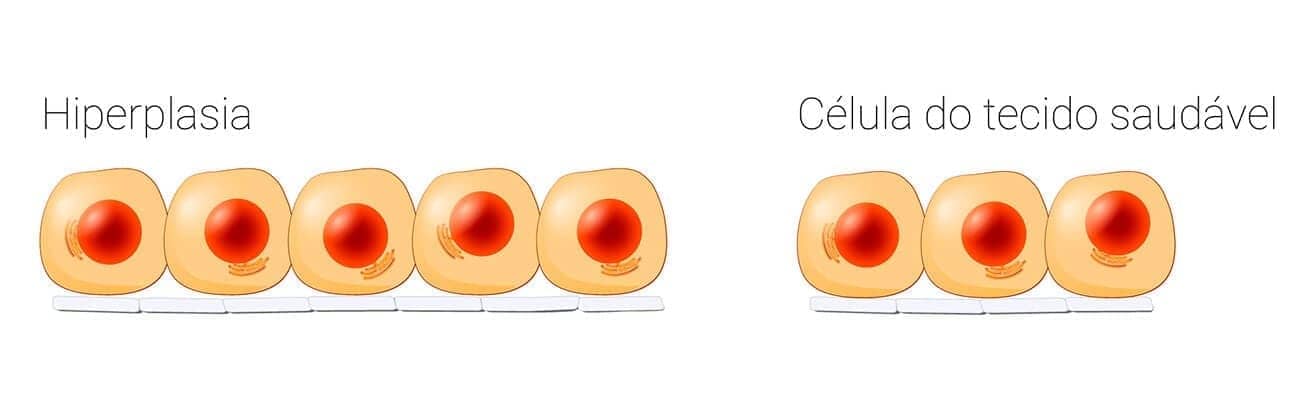
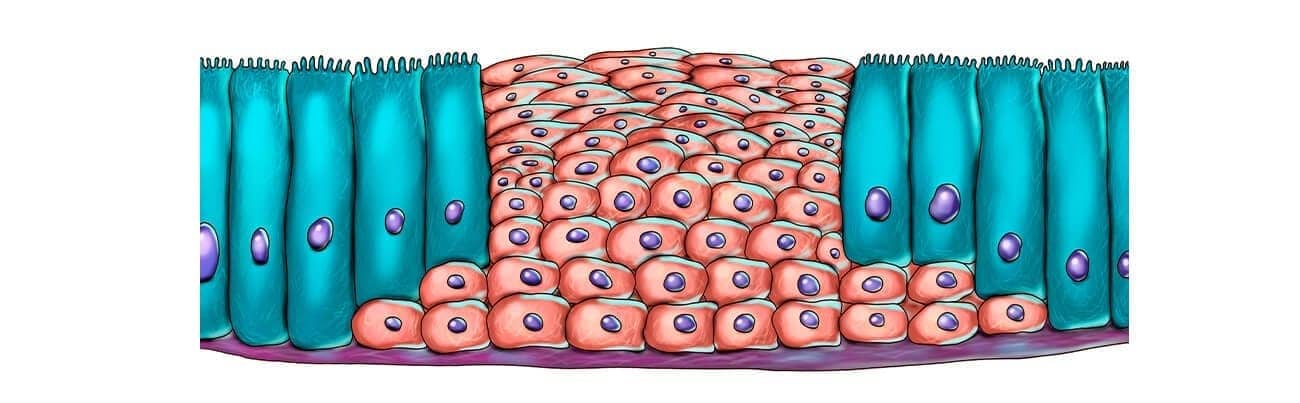
Podem ser letais ou não letais, onde a letalidade está relacionada à qualidade, intensidade e duração da lesão, bem como ao estado funcional e tipo de célula atingida. Nas lesões não letais, as células continuam vivas e podem retornar ao estado de normalidade uma vez cessada a lesão. Exemplos são agressões que alteram os mecanismos de regulação e proliferação celular, gerando hipotrofias, hipertrofias, hiperplasias, hipoplasias, metaplasias, displasias e neoplasias. O acúmulo de substâncias intracelulares, as degenerações, são resultado de agressões que modificam o metabolismo celular. Já as lesões letais são representadas pela necrose, apoptose e outros tipos de morte celular, temas que também veremos mais para frente. Essas lesões estudaremos nos próximos módulos.
Envolvem modificações da substância fundamental amorfa, alterações estruturais de fibras elásticas, colágenas e reticulares e depósito de substâncias formadas localmente ou vindas da circulação.
Incluem alterações do fluxo sanguíneo (hiperemia e isquemia), da coagulação (trombose) e da drenagem de líquido intersticial (edema), além do aparecimento de substâncias que causam obstrução vascular (embolia) e extravasamento de sangue da vasculatura (hemorragia).
Representam lesões importantes, por causa do papel integrador do sistema nervoso. Porém, as lesões locais dessas estruturas ainda são pouco conhecidas.
É a lesão mais complexa, que envolve todos os componentes teciduais e se caracteriza por alterações da microcirculação, migração de leucócitos, lesões celulares e intersticiais. A inflamação é o componente efetor da resposta imune, acompanhando a maioria das lesões produzidas por diferentes agentes lesivos.
Assim como as lesões, as doenças também precisam ser nomeadas e catalogadas. De maneira ideal, as doenças devem receber um nome que traduza a característica essencial da sua natureza, tarefa essa que é bem complexa.
Muitas vezes, a nomenclatura segue certa lógica, já que inclui o nome do órgão afetado e algum prefixo ou sufixo esclarecedor, como as gastrites e glomerulonefrites, por exemplo. Em outros casos, a denominação indica a natureza e também as características principais do processo, como na enteropatia perdedora de proteínas.
Você sabia
Em muitos casos, somente o nome não é suficiente para indicar uma doença. São os chamados epônimos, em que a doença leva o nome de quem a descreveu ou o local onde foi descrita. Nesses casos, o nome pouco tem a ver com a essência das lesões e da doença em si.
De modo a uniformizar a nomenclatura, evitando que as doenças recebam nomes com base em critérios diferentes em diferentes países, a OMS criou a Classificação Internacional das Doenças (CID). As doenças são classificadas de acordo com alguns sinais, sintomas e lesões, que caracterizam uma determinada condição. A CID deve ser mencionada e registrada toda vez que o diagnóstico é estabelecido.
Tanto a nomenclatura quanto a classificação das doenças são extremamente importantes, pois os profissionais da Saúde precisam utilizar termos e princípios consensuais para que as informações obtidas em qualquer parte do mundo possam ser comparadas e para que haja o avanço do conhecimento em Saúde.
Agressão celular
Este vídeo apresenta os principais mecanismos bioquímicos e moleculares das agressões celulares.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar os principais tipos de degeneração celular, seus mecanismos e aspectos morfológicos
Degeneração hidrópica
A degeneração hidrópica, também conhecida por tumefação celular, é a lesão celular reversível caracterizada pelo acúmulo de água e eletrólitos no interior das células. Além disso, é a lesão não letal mais comum que ocorre diante dos mais variados tipos de agressão, seja ela de natureza física, química ou biológica.
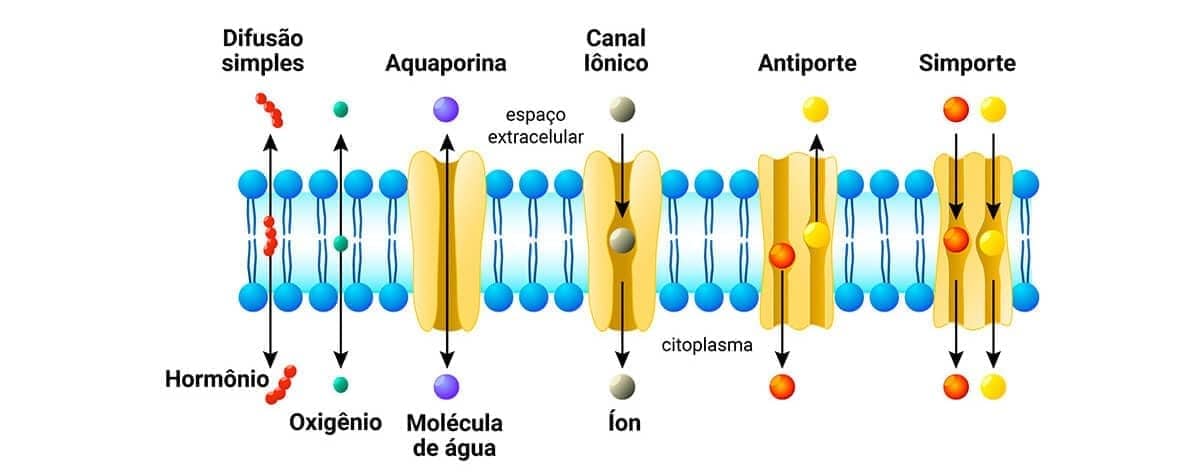
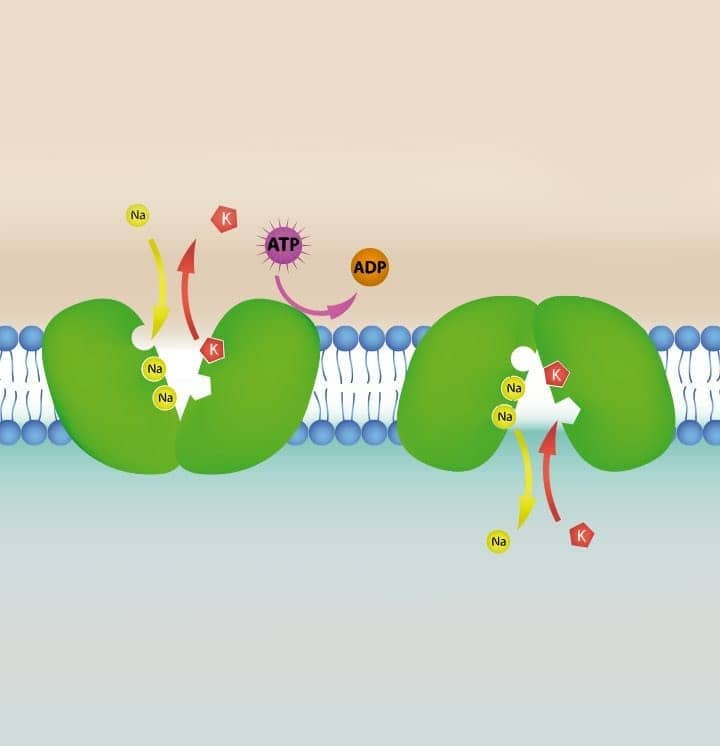
O transporte de eletrólitos através das membranas, tanto a plasmática quanto a das organelas, é realizado por bombas eletrolíticas. Algumas delas dependem da energia na forma de Adenosina trifosfato (ATP), porém outras dependem da estrutura da membrana e da integridade das proteínas que formam o complexo enzimático da bomba. Esse transporte de água e eletrólitos ocorre contra um gradiente de concentração, para o interior dos compartimentos celulares.
Portanto, distúrbios nesse equilíbrio hidroeletrolítico resultam na retenção de água e eletrólitos nas células, que se apresentam aumentadas de volume. Nesse contexto, diversos agentes lesivos podem causar a degeneração hidrópica, como agentes tóxicos que lesam a membrana mitocondrial e reduzem a produção de ATP; agentes que levam à hipertermia, por causa do aumento do consumo de ATP; agressões que levam à formação de radicais livres que lesam as membranas diretamente e substâncias inibidoras da bomba sódio/potássio ATPase, como a ouabaína.
Embora as causas possam ser variadas, a consequência é a mesma: retenção de sódio, redução de potássio e aumento da pressão osmótica intracelular, levando à entrada de água no citoplasma e à expansão isosmótica da célula.
A degeneração hidrópica é a primeira manifestação em quase todas as formas de agressão às células. Em geral, os órgãos apresentam aumento de peso e volume, embora seu aspecto macroscópico varie de acordo com a intensidade da lesão. A coloração também muda, ficando mais pálida. Isso ocorre porque as células tumefeitas comprimem os capilares sanguíneos, reduzindo a quantidade de sangue no órgão.
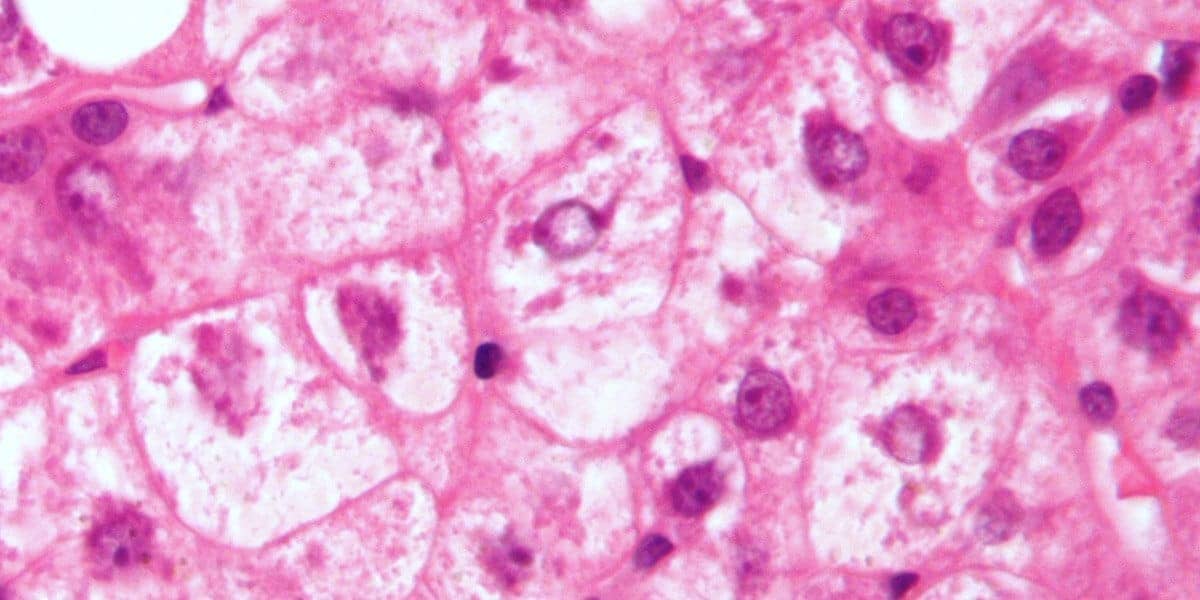
Microscopicamente, as células apresentam aumento de volume com citoplasma mais acidófilo e com aspecto granuloso, após coloração com hematoxilina eosina, corante amplamente empregado para analise tecidual de cortes histológicos. Em algumas células, a característica mais marcante é a acidófila, que se torna mais pronunciada com a progressão para a necrose. Já em um estado avançado, é possível observar pequenos vacúolos de água dispersos irregularmente pelo citoplasma. Porém, grandes vacúolos também podem ser formados, como no caso dos hepatócitos (degeneração baloniforme).
A degeneração hidrópica, assim como todas as outras degenerações que veremos a seguir, é um processo reversível. Isto é, quando eliminamos a causa da lesão, as células tendem a voltar para seu aspecto normal. Por isso, a tumefação celular quase sempre não está associada a consequências funcionais mais graves, a menos que ela seja muito intensa. No fígado, a degeneração hidrópica intensa nos hepatócitos pode resultar em alterações funcionais no órgão. Porém, raramente resultará em insuficiência hepática exclusivamente degenerativa.
Degeneração hialina
O termo “hialina” tem origem na palavra grega hyalos, que significa vítreo, homogêneo, translúcido. A degeneração hialina consiste no acúmulo de material proteico e acidófilo no interior das células ou no espaço extracelular, conferindo a eles uma aparência rósea, vítrea e homogênea, que podemos observar nos cortes histológicos corados com hematoxilina e eosina. Em alguns casos, a degeneração é consequência da condensação de filamentos intermediários e proteínas associadas, formando corpúsculos no interior das células. Porém, também pode ser resultado do acúmulo de material decorrente de uma infecção ou da endocitose de proteínas.
Filamentos intermediários
Compõem um sistema de estruturas proteicas filamentosas no citoplasma e núcleo de células eucarióticas, formando uma rede estrutural que conecta as organelas citoplasmáticas e o núcleo.
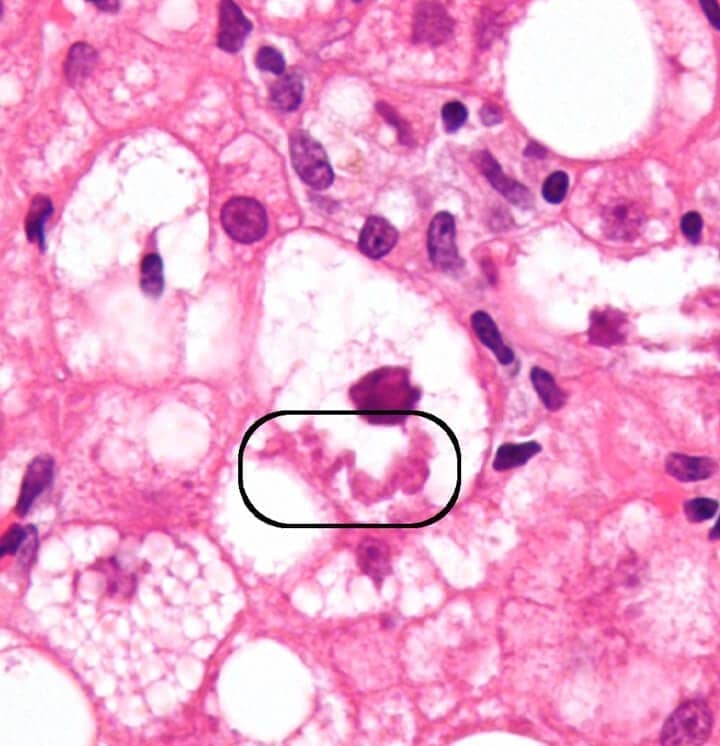
Um exemplo de depósito hialino celular é o chamado corpúsculo hialino de Mallory-Denk, que é encontrado normalmente em hepatócitos de indivíduos alcoólatras crônicos, mas também em casos de carcinoma hepatocelular e esteato-hepatite não alcoólica. Resumidamente, esse corpúsculo é formado pela ação dos radicais livres sobre as proteínas do citoesqueleto induzindo sua peroxidação e formação de ligações transversais resultando na formação de aglomerados proteicos precipitados. Quando o analisamos por microscopia eletrônica, vemos um aspecto filamentoso em algumas áreas e amorfo (sem forma) em outras.
Outro exemplo são os corpúsculos hialinos de Councilman-Rocha Lima, encontrados em hepatócitos nas hepatites virais, especialmente na febre amarela.
Em fibras musculares, tanto esqueléticas quanto cardíacas, a degeneração hialina é resultado da ação de endotoxinas bacterianas e agressão por células imunes. Acredita-se que o aspecto morfológico seja decorrente da desintegração de microfilamentos, relacionada à liberação e à ação de citocinas. Em indivíduos com proteinúria, a degeneração hialina no epitélio tubular renal ocorre pela endocitose excessiva de proteínas.
Saiba mais
Os corpúsculos de Russel caracterizam-se pelo acúmulo excessivo de imunoglobulinas em plasmócitos e são frequentes em inflamações associadas a infecções, como na salmonelose e leishmaniose tegumentar.
Plasmócitos
São células derivadas dos linfócitos B que sofreram diferenciação após respostas imunitárias exercidas por algum antígeno, que é responsável pela produção dos anticorpos circulantes.
As bases bioquímicas que possam explicar a degeneração hialina no interstício ainda permanecem em debate. Em indivíduos com hipertensão crônica ou diabetes melito, as paredes arteriolares renais tornam-se hialinas por causa do extravasamento e depósito de proteína plasmática na membrana basal.
Degeneração gordurosa
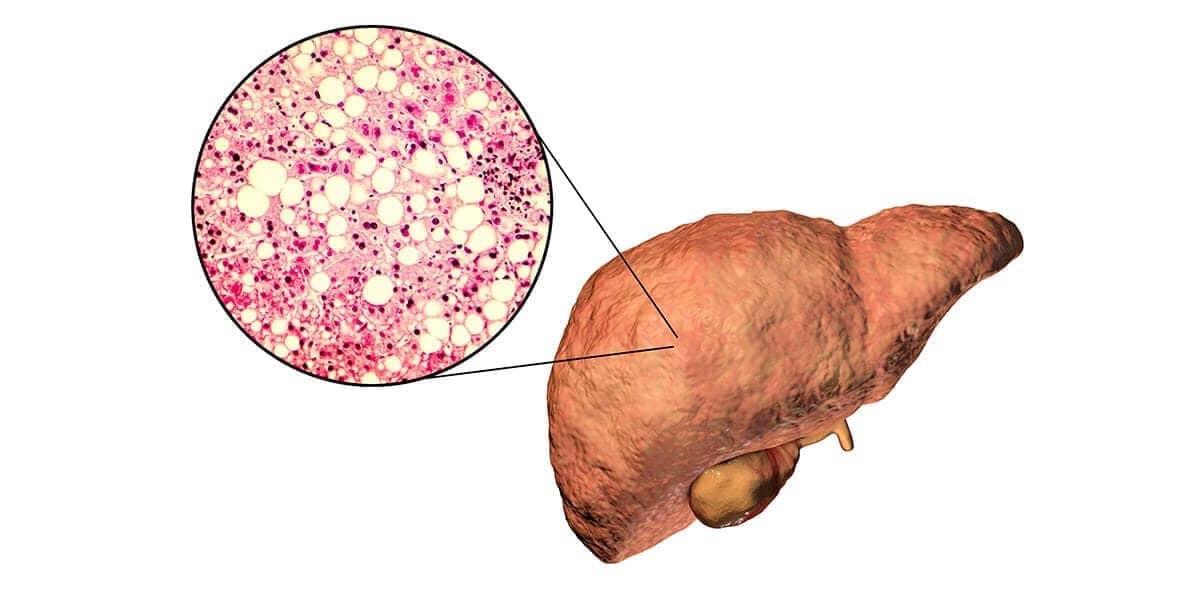
A degeneração gordurosa refere-se ao acúmulo anormal de gordura no citoplasma celular. Os dois principais tipos são a esteatose e a lipidose.
A esteatose é o acúmulo de gorduras neutras (mono, di ou triglicerídeos) em células parenquimatosas. De maneira geral, a degeneração gordurosa ocorre mais frequentemente no fígado, pois é o principal órgão envolvido na metabolização de gorduras, porém também pode acometer o epitélio tubular renal, pâncreas, músculos esquelético e cardíaco.
A lesão gordurosa é resultado da interferência do metabolismo celular de ácidos graxos por algum agente agressor, que pode: aumentar a captação ou síntese dos ácidos graxos; dificultar a utilização, transporte ou excreção dos ácidos graxos.
Parenquimatosas
O parênquima, nos animais, refere-se ao tecido que forma a parte funcional de muitos órgãos, em oposição ao estroma, que se refere aos tecidos de suporte.
Causas da esteatose
As causas da esteatose são variadas e incluem o uso de substâncias tóxicas, como o álcool; hipóxia, desnutrição proteica e distúrbios metabólicos, como o diabetes e obesidade.
Etanol
O etanol é a causa mais conhecida e estudada da esteatose e, resumidamente, o etilismo causa a degeneração gordurosa por meio de alguns fatores, como a redução de Nicotinamida Adenina Dinucleotídeo (NAD), molécula necessária para a oxidação de lipídeos; excesso de acetil-CoA, que induz a síntese de ácidos graxos; redução da disponibilidade de proteínas para a síntese de lipoproteínas, quando associado à desnutrição; e comprometimento do transporte das lipoproteínas, por meio da ação de acetaldeído e radicais livres gerados pela metabolização do etanol.
Nicotinamida Adenina Dinucleotídeo (NAD)
Aceptor de hidrogênios e elétrons, carregando a energia para a produção de ATP.
Agentes tóxicos
Podem levar à esteatose pela lesão do retículo endoplasmático rugoso e redução de proteínas, resultando na deficiência de lipoproteínas. Outros fatores incluem o bloqueio na utilização de triglicerídeos, sem que a síntese proteica seja reduzida.
Hipóxia
Em estados de hipóxia, como anemia ou insuficiência cardíaca/respiratória, há uma menor disponibilidade de oxigênio e, dessa forma, redução na síntese de ATP. Com isso, a síntese de lipídeos complexos fica dificultada e há diminuição da utilização de ácidos graxos e triglicerídeos, que se acumulam. A esteatose também resulta, em boa parte, do aumento da síntese de ácidos graxos, por causa do excesso de acetil-CoA gerado pela diminuição da oxidação no ciclo de Krebs.
Obesidade e síndrome metabólica
Associada à síndrome metabólica, a obesidade é hoje um dos principais problemas de saúde pública global e deve-se principalmente à associação da ingestão excessiva de energia na forma de lipídeos e carboidratos e do sedentarismo. O termo “síndrome metabólica” inclui uma série de fatores de risco metabólicos, como hipertensão arterial, hiperglicemia, excesso de gordura corporal em torno da cintura e níveis de colesterol anormais. Na síndrome metabólica, ocorre esteatose visceral no fígado, nos músculos esqueléticos e no miocárdio, devido a fatores como aumento dos radicais livres, transporte dificultado de lipoproteínas e síntese aumentada de triglicerídeos e de ceramida, potente indutora da apoptose.
Desnutrição proteico-energética
A falta de proteínas, resumidamente, leva à redução da formação de lipoproteínas e da excreção de triglicerídeos. Além disso, a dieta deficiente em calorias resulta na mobilização de lipídeos do tecido adiposo, aumentando o aporte de ácidos graxos para o fígado.
Saiba mais
Em crianças com desnutrição proteica grave, a esteatose pode acometer vários órgãos além do fígado, como os rins, coração, músculo esquelético e pâncreas.
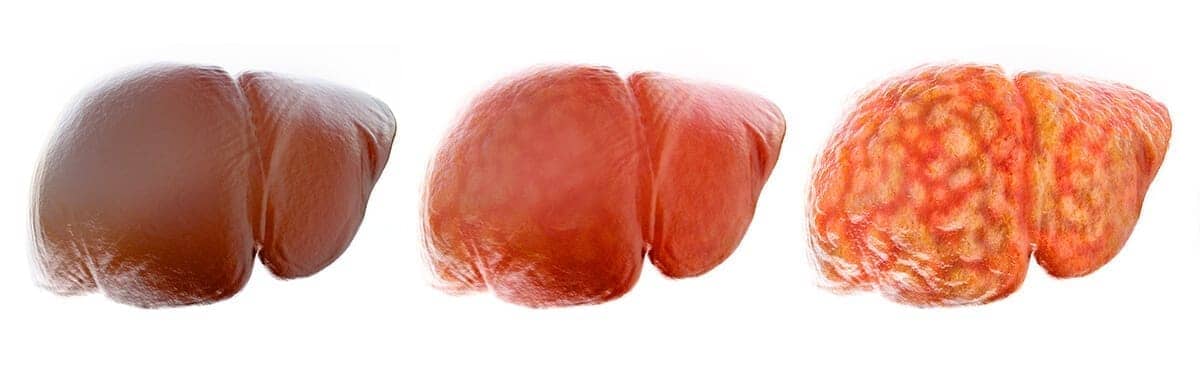
A morfologia de um órgão com esteatose é variável. No fígado, podemos notar aumento de volume e peso, diminuição da consistência, coloração amarelada e bordas arredondadas.
Os rins apresentam morfologia semelhante, com aumento de volume, peso e coloração amarelada. O coração pode apresentar palidez e diminuição da consistência (na miocardite diftérica) ou apresentar faixas amareladas visíveis no endocárdio, nos casos de hipóxia prolongada.
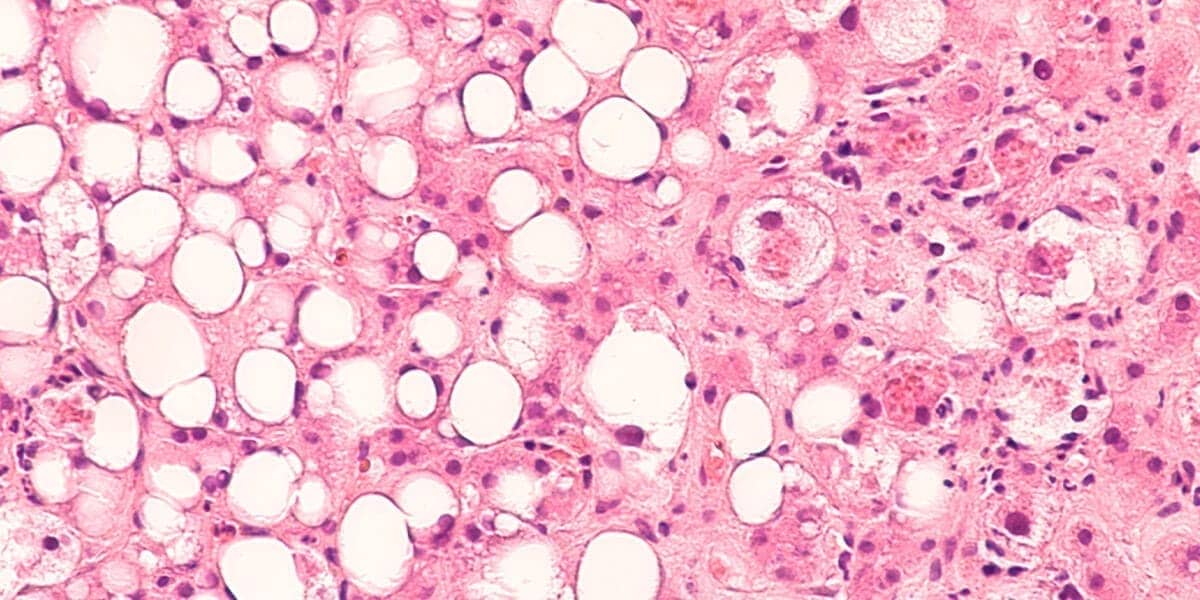
Se observarmos ao microscópio de luz, notaremos o acúmulo de triglicerídeos em pequenas vesículas revestidas por membrana. Na esteatose em fase inicial, os vacúolos são de tamanhos variados e apresentam tendência a se unirem, formando vesículas cada vez maiores.
No fígado, podem ser observadas a esteatose microgoticular, quando pequenas vesículas de gordura se distribuem na periferia celular e a esteatose macrogoticular, quando há uma grande vesícula de gordura que desloca o núcleo para a periferia.
Nos rins, podemos observar pequenas vesículas nas células tubulares, que raramente produzem deformidade celular. No coração, os triglicerídeos se depositam em vesículas dispostas ao longo das células.
Saiba mais
Devido à característica dos triglicerídeos de se dissolverem em álcool e xilol, que são substâncias utilizadas na preparação de amostras para análise em microscópio de campo claro, os “espaços vazios” que vemos podem ser confundidos com os vacúolos da degeneração hidrópica. Por isso, para que possamos ter certeza da natureza lipídica da vesícula, é necessária a realização de colorações especiais.
Apesar de ser uma lesão reversível, o excesso de ácidos graxos pode gerar ceramida, que já comentamos ser um potente indutor de apoptose. No fígado, pode haver formação dos chamados cistos gordurosos, que podem romper e causar embolia gordurosa. Em alguns casos de esteatose difusa e grave, podemos ter manifestações de insuficiência hepática. Em indivíduos etilistas crônicos, a esteatose hepática é frequentemente acompanhada de fibrose, evoluindo para a cirrose.
Os acúmulos intracelulares de gorduras que não são triglicerídeos, como o colesterol e seus ésteres, são chamados de lipidoses. Também podemos encontrar depósitos de lipídeos mais complexos, como esfingolipídeos e gangliosídeos, embora sejam raros. As lipidoses podem ser localizadas ou sistêmicas.
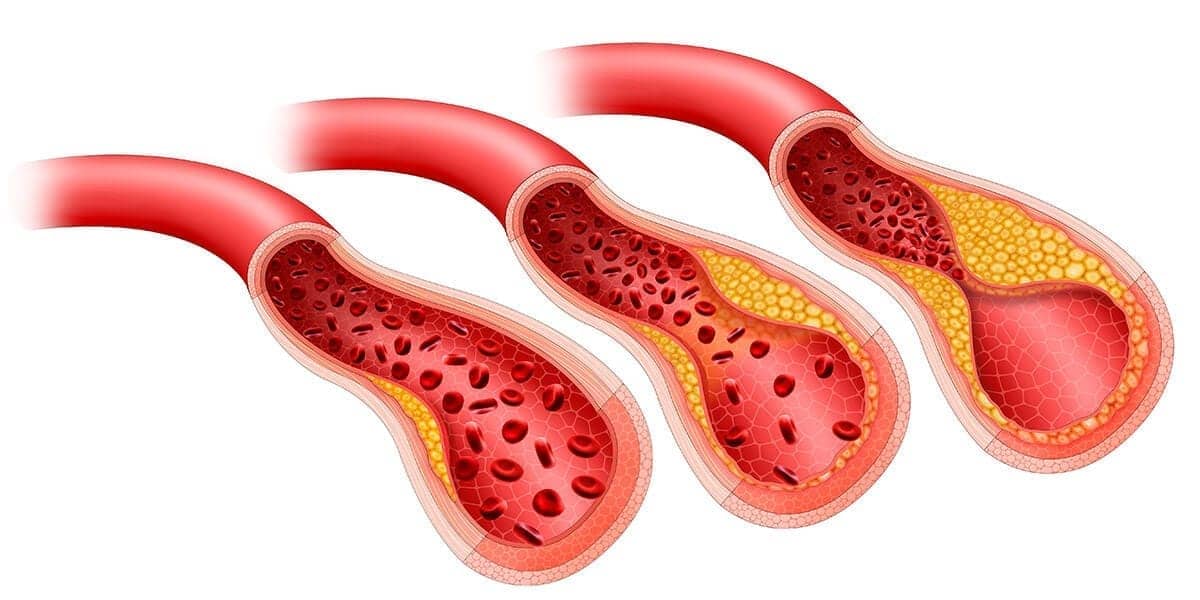
A aterosclerose é uma doença de grande importância clínica e é caracterizada por depósitos localizados de colesterol e seus ésteres, principalmente, na camada íntima de artérias de grande e médio calibres. O aumento de triglicerídeos e colesterol plasmáticos representa o principal fator de risco para o desenvolvimento da aterosclerose, embora a hipertensão arterial, tabagismo e a síndrome metabólica também estejam envolvidos.
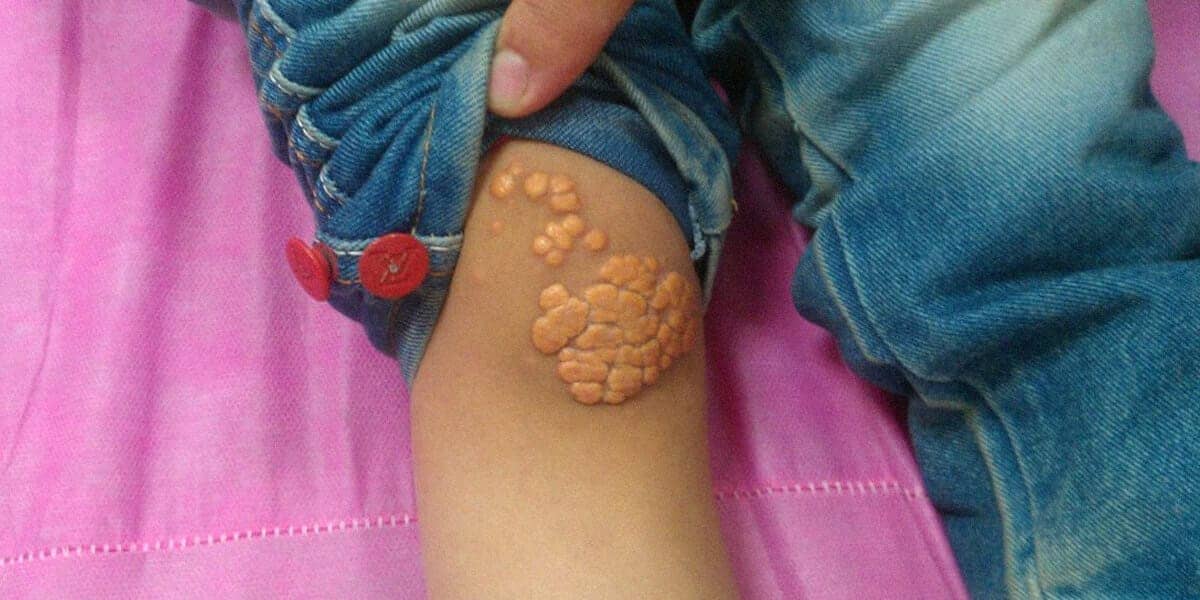
Os xantomas são outro exemplo de lipidose, caracterizados por nódulos ou placas na pele formados por aglomerados de macrófagos carregados de colesterol, com aspecto espumoso.
Degeneração cálcica
A degeneração cálcica, também conhecida como calcificação patológica, refere-se à deposição anormal de sais de cálcio, com quantidades menores de ferro e outros sais minerais nos tecidos. Quando a deposição se dá de forma local nos tecidos mortos, ela é chamada de calcificação distrófica. Já a calcificação metastática é a deposição de sais de cálcio em tecidos normais e é quase sempre resultado de hipercalcemia secundária devido a algum desequilíbrio no metabolismo do cálcio.
Outras formas de degeneração celular
Assista ao vídeo que trata sobre a natureza de outros acúmulos anormais na célula.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever as etapas de progressão da lesão celular e os princípios da morte celular por apoptose e necrose
Resposta celular ao estímulo/agressão: adaptação, lesão reversível e lesão irreversível
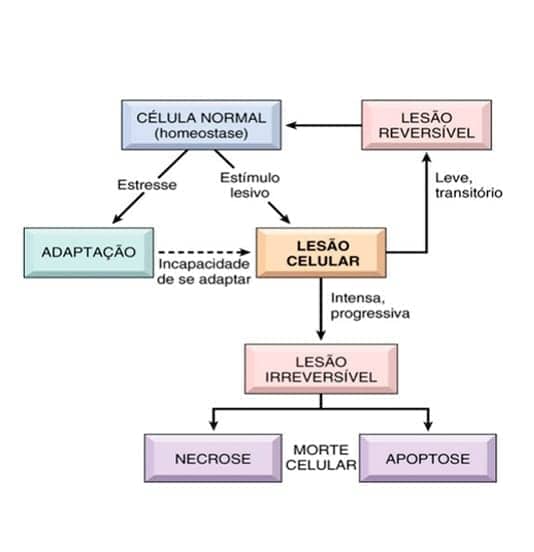
Nosso organismo é uma orquestra perfeita que necessita que cada componente esteja ajustado para que seu funcionamento ocorra de maneira correta. Nesse sentido, a homeostase caracteriza-se pela habilidade do nosso corpo em manter um equilíbrio fisiológico interno quase sempre constante, independente das alterações que possam ocorrer no meio externo.
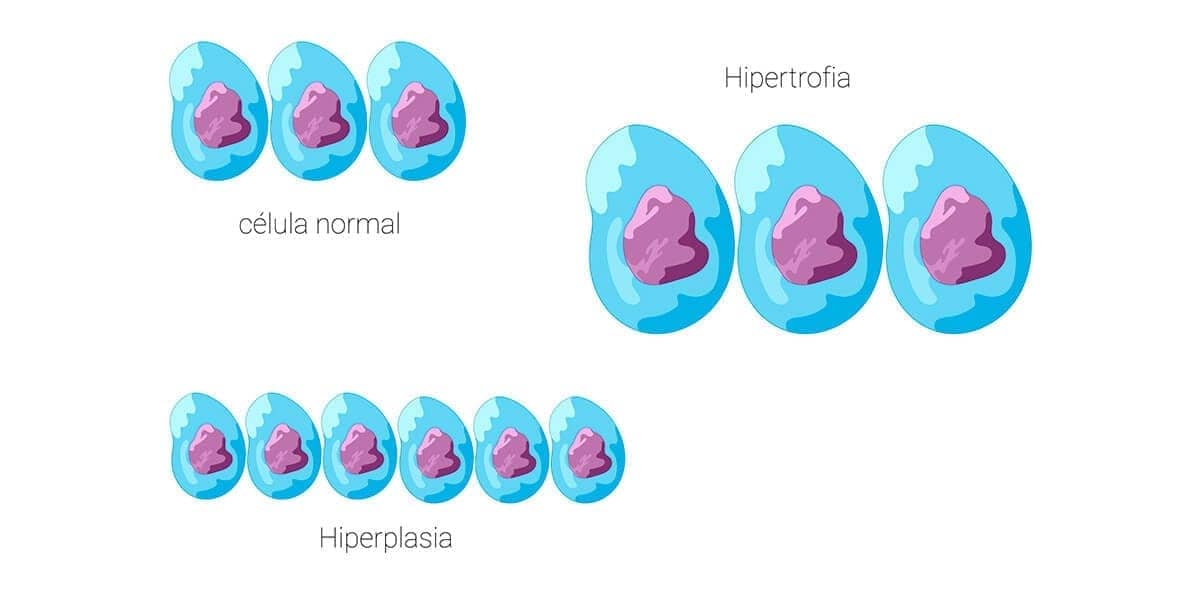
As adaptações são respostas celulares a alterações fisiológicas, como a gestação, ou a alguns estímulos patológicos. Com isso, um novo estado de equilíbrio fisiológico é alcançado, permitindo a sobrevivência e atividade funcional celular. As adaptações englobam alterações reversíveis no tamanho, número, fenótipo, atividade ou funções celulares. Quando o estímulo cessa, a célula pode retornar ao seu estado original.
Atenção
Embora hiperplasia e hipertrofia sejam processos distintos, frequentemente ocorrem juntas e podem ser induzidas pelos mesmos estímulos.
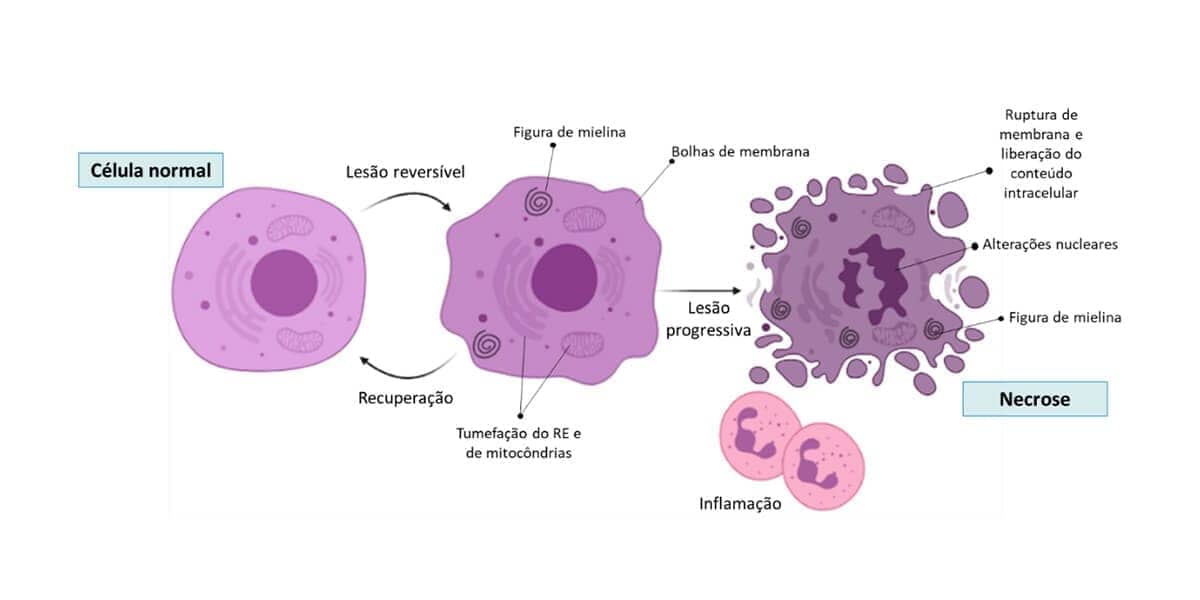
Caso os limites das respostas adaptativas sejam excedidos, ou haja o comprometimento de nutrientes e componentes celulares, ocorre uma série de eventos que caracterizam a lesão celular. A lesão é reversível até determinado ponto, mas caso o estímulo persista ou seja intenso o suficiente desde o início, a lesão celular é irreversível e ocorre morte celular. Dessa forma, a resposta adaptativa, lesão reversível, lesão irreversível e morte celular podem ser etapas de um dano progressivo.
Nos estágios iniciais ou nas lesões leves, as alterações celulares podem ser revertidas caso o estímulo nocivo seja removido. As principais características da lesão reversível são: tumefação celular generalizada, por causa das alterações de concentração de íons e influxo de água; formação de bolhas na membrana plasmática; “descolamento” dos ribossomos do retículo endoplasmático e agregação da cromatina nuclear. Soma-se às alterações morfológicas a redução do armazenamento de energia na forma de ATP, por causa da redução da fosforilação oxidativa.
Como já comentamos, até certo ponto, a célula ainda consegue reparar os danos. Porém, uma vez que a célula ultrapassa o ponto de “não retorno”, que ainda é debatido, a lesão evolui para irreversibilidade e morte celular. A morte celular representa um dos mais importantes eventos na evolução de qualquer doença, em qualquer tecido ou órgão.
Saiba mais
A morte celular também faz parte de processos fisiológicos, como a embriogênese, desenvolvimento de órgãos e manutenção da homeostase. A partir de agora, nós falaremos sobre as duas principais vias de morte celular: a necrose e a apoptose.
Necrose: morfologia e tipos
A morte celular que ocorre em um organismo vivo, seguida de um processo de autólise, é denominada necrose. Ela ocorre quando a agressão é suficiente para interromper as funções vitais celulares. Nesse caso, há extravasamento de hidrolases lisossomais para o citoplasma e, nesse local, são ativadas pela alta concentração de íons cálcio e iniciam a autólise. As hidrolases são capazes de digerir todos os substratos celulares: as proteases digerem proteínas, lipases digerem lipídeos, ribonucleases digerem ácido ribonucleico, por exemplo. Além disso, no processo de necrose são liberadas moléculas chamadas de alarminas (uratos, fosfatos, por exemplo), que são reconhecidas por receptores celulares e induzem a inflamação.
As principais características microscópicas da necrose, quando observados os cortes histológicos são:
Alterações nucleares:
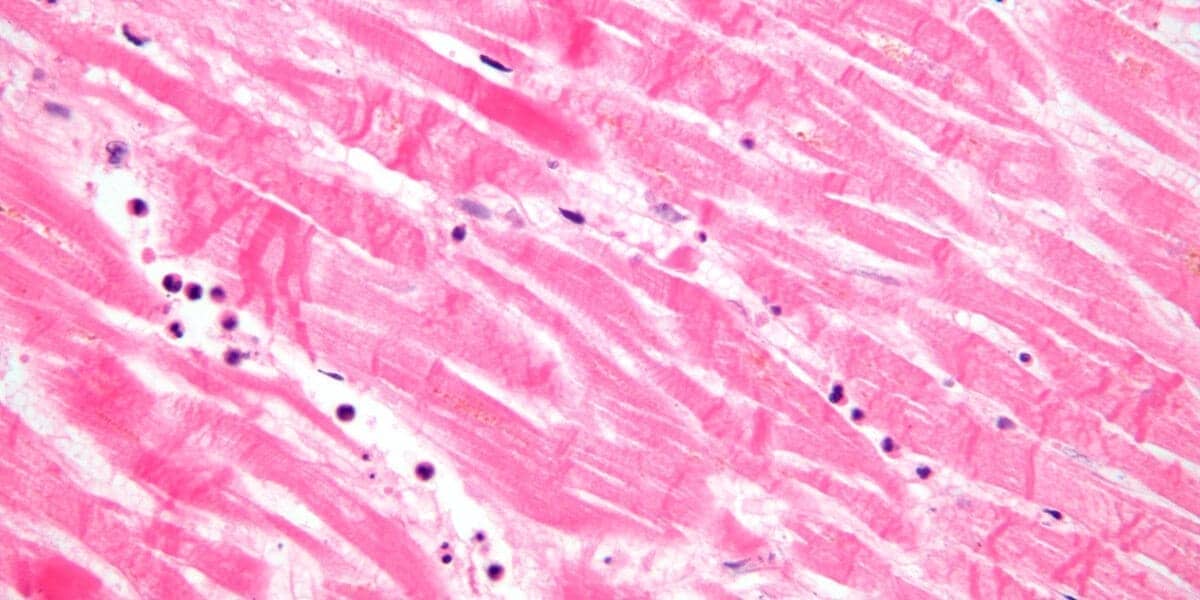
Podem se apresentar sob três aspectos: intensa condensação e contração da cromatina, tornando o núcleo intensamente basófilo e bem menor que o normal (picnose nuclear); digestão da cromatina, que acarreta na indistinção dos núcleos na coloração histológica (cariólise) e fragmentação e dispersão do núcleo no citoplasma (cariorrexe). Todos esses aspectos resultam da diminuição excessiva do pH celular, que condensa a cromatina, e da ação das desoxirribonucleases e outras proteases que digerem a cromatina e destroem a membrana nuclear.
Alterações citoplasmáticas:
Com o desacoplamento de ribossomos e desnaturação proteica, há o aumento da acidofilia que é evidenciado pelo aspecto eosinofílico ao microscópio de campo claro. Com a evolução da necrose, o citoplasma apresenta um aspecto granuloso e a célula morta pode ser visualizada como uma massa amorfa espiralada (originada pelas membranas danificadas), as chamadas figuras de mielina. Na microscopia eletrônica, ainda poderemos notar a descontinuidade das membranas celulares, dilatação anormal de mitocôndrias, figuras de mielina citoplasmáticas e proteínas desnaturadas.
Agora que entendemos as características da necrose de uma forma geral, vamos comentar sobre os principais tipos e suas causas:
Uma vez que sua causa mais frequente é a isquemia, também pode ser chamada de necrose isquêmica. Na macroscopia, a área necrótica é esbranquiçada e protuberante, geralmente circundada por um halo vermelho (que reflete a hiperemia compensatória). Microscopicamente, podemos observar cariólise, citoplasma com aspecto de substância coagulada (acidófico e gelificado). Com a progressão, perde-se toda a arquitetura tecidual.
Caracterizada pela digestão das células mortas, devido à grande quantidade de enzimas lisossomais liberada. A região necrosada apresenta consistência mole ou liquefeita. É comum após a anóxia do tecido nervoso e da suprarrenal, sendo observada também em infecções bacterianas e fúngicas focais. As bactérias estimulam a migração de leucócitos e liberação de suas enzimas lisossômicas. O resultado é uma área necrótica amarelo cremosa, que chamamos de pus.
Caseoso significa semelhante a queijo e denomina a aparência da área necrótica, que é fria e esbranquiçada. Comum na tuberculose, a necrose caseosa apresenta uma área de células rompidas ou fragmentadas e restos granulares amorfos formando uma massa homogênea. A aparência é característica do granuloma, que ainda apresenta borda inflamatória.
Saiba mais
A gangrena é uma forma de evolução da necrose, resultado da ação de agentes externos sobre a área necrosada. A desidratação da região, especialmente em contato com o ar, origina a gangrena seca. A gangrena úmida é causada pela invasão de microrganismos anaeróbios na área necrosada, produzindo enzimas que liquefazem o tecido morto e produzem gases de odor fétido. Já a gangrena gasosa é secundária à contaminação por bactérias do gênero Clostridium, que produzem enzimas proteolíticas e grande quantidade de gás, formando bolhas.
Apoptose: causas, funções, mecanismos e morfologia
A apoptose é uma via de morte celular na qual a célula é estimulada a acionar mecanismos, rigorosamente controlados, que culminam na sua morte. Ao contrário do que vimos na necrose, na apoptose não há autólise e nem descontinuidade da membrana: a célula é fragmentada, seus fragmentos são envolvidos pela membrana citoplasmática formando os corpos apoptóticos e finalmente são endocitados por células vizinhas, sem induzir um processo inflamatório.
Causas e funções
A apoptose ocorre em processos fisiológicos e patológicos.
Processos fisiológicos:
Na Fisiologia, a apoptose é um fenômeno normal que objetiva eliminar as células que não são mais necessárias, além de participar do controle de proliferação celular nos tecidos. São exemplos de situações fisiológicas em que há a participação da apoptose: remodelamento de tecidos durante a embriogênese, período pós-natal e pós-lactação, morte de leucócitos depois do processo inflamatório e eliminação de linfócitos autorreativos.
Processos patológicos:
Já em condições patológicas, a apoptose é desencadeada por inúmeras causas, como infecções virais; hipóxia, radiação ionizante e substâncias químicas, que podem causar danos irreversíveis ao DNA e pela ação de radicais livres, que além de afetarem o material genético celular, podem levar ao acúmulo de proteínas mal dobradas.
Mecanismos
Qualquer que seja sua causa, a apoptose resulta da ativação sequencial de enzimas chamadas caspases, responsáveis pelas alterações morfológicas que comentaremos mais adiante. As caspases existem como proenzimas inativas e precisam sofrer clivagem enzimática para se tornarem ativas. A ativação depende de um equilíbrio fino entre a produção de proteínas pró-apoptóticas e anti-apoptóticas. Portanto, a presença de caspases clivadas constitui um marcador importante da apoptose.
Caspases
São proteases que possuem cisteína no sítio ativo e clivam proteínas em sítios com resíduos de aspartato.
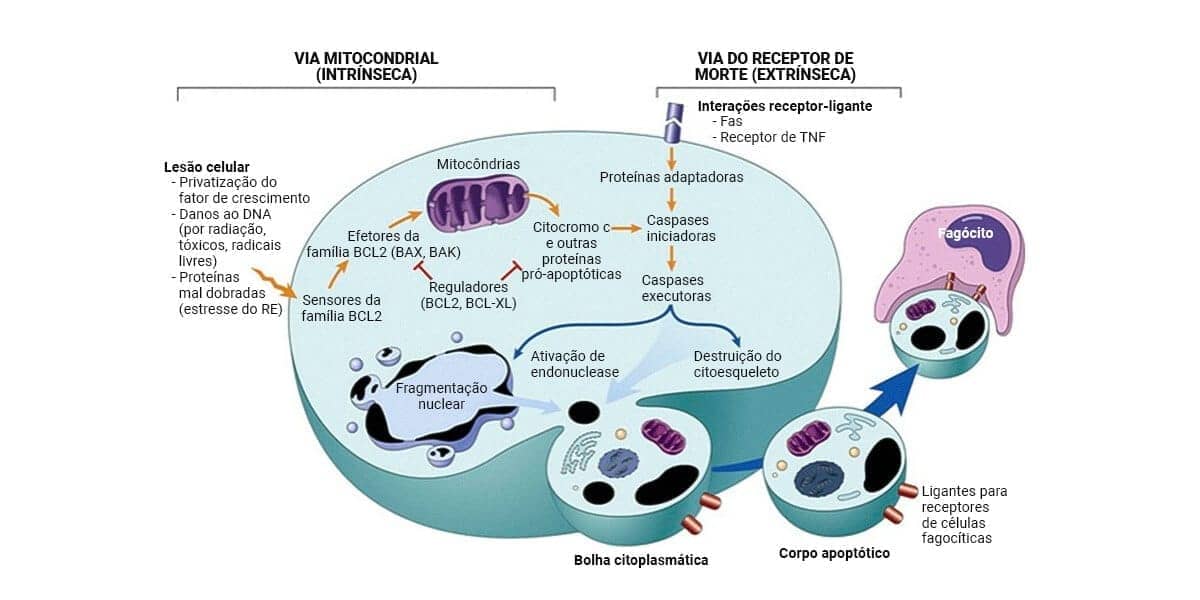
O processo de apoptose pode ser resumido em uma fase de iniciação, na qual as caspases iniciadoras se tornam ativas, e fase de execução, na qual inicia-se a degradação de componentes celulares críticos pelas caspases executoras. A ativação de caspases, evento-chave da apoptose, pode ocorrer por duas vias distintas:
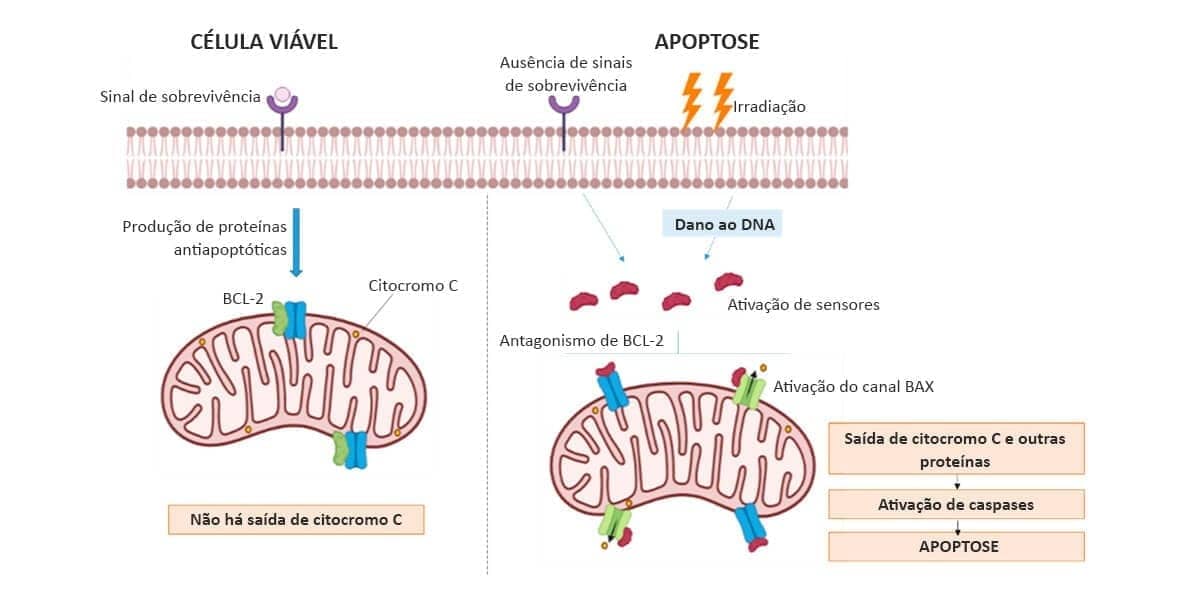
Via intrínseca ou mitocondrial: é a principal via de apoptose nas células de mamíferos. Ocorre pelo aumento da permeabilidade da membrana externa mitocondrial. Com isso, há a liberação de proteínas pró-apoptóticas (como o citocromo C, endonuclease G e fator indutor de apoptose - AIF) que estão presentes no espaço intermembranar, para o citosol, culminando na ativação das caspases. A liberação dessas moléculas é rigidamente controlada pela família de proteínas Bcl-2, que inclui proteínas com funções anti-apoptóticas (Bcl-2 e Bcl-XL) e pró-apoptóticas (conhecidas como proteínas BAX).
Quando as células são privadas de sinais de sobrevivência, têm seu DNA danificado ou possuem acúmulo de proteínas mal dobradas, provocando estresse do retículo endoplasmático, proteínas sensores percebem a lesão e são ativadas. Esses sensores ativam mecanismos que permitem que o citocromo C e outras proteínas mitocondriais saiam do espaço intermembranar e vão para o citoplasma, iniciando a cascata de ativação das caspases. Como o processo é finamente controlado, é importante comentarmos que existem proteínas mitocondriais que impedem a saída das proteínas pró-apoptóticas pela membrana, como a Bcl-2 e outras proteínas que funcionam como inibidores fisiológicos da apoptose (IAP), impedindo a ativação das caspases.
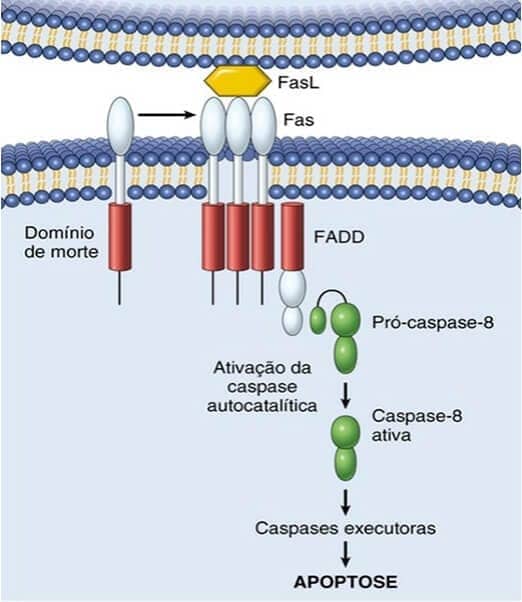
Via extrínseca (por receptor de morte)
Iniciada pela ativação de receptores de morte presentes na membrana plasmática de diversos tipos celulares. Os receptores de morte mais bem conhecidos são o receptor TNF tipo 1 e a proteína Fas. Eles possuem um domínio citoplasmático que é essencial para a entrega de sinais apoptóticos (domínio de morte). O mecanismo de apoptose por essa via é bem ilustrado com a interação de Fas e seu ligante (FasL). O FasL é expresso em células T que reconhecem autoantígenos e alguns linfócitos T citotóxicos que eliminam células tumorais e células infectadas por vírus. Quando o FasL se liga ao Fas, há a exposição de domínios de morte que recrutam proteínas adaptadoras (FADD – domínio de morte associado a Fas), formando uma base molecular ativadora de caspases. A via extrínseca pode ser inibida pela proteína FLIP, que se liga à primeira pró-caspase da via (pró-caspase 8) e a neutraliza.
As duas vias culminam na ativação de uma caspase iniciadora, que ativa o programa sequencial de caspases executoras, que atuam em diversos componentes celulares, fragmentando a célula nos chamados corpos apoptóticos. Com isso, há a promoção ativa da fagocitose, de tal modo que os resíduos celulares são removidos antes de sofrer necrose e iniciar um processo inflamatório.
Morfologia
As células apoptóticas apresentam algumas características morfológicas importantes:
Retração celular:A célula apresenta tamanho menor, citoplasma denso e compactação de organelas. É importante lembrar que a característica inicial de outras formas de lesão celular é a tumefação, e não a retração.
Condensação da cromatina: é o aspecto morfológico mais marcante da apoptose. A cromatina se agrega na periferia, sob a membrana nuclear, formando massas densas de diversos formatos e tamanhos. O núcleo se rompe, produzindo dois ou mais fragmentos.
Formação de bolhas citoplasmáticas e corpos apoptóticos: primeiramente, ocorre a formação de bolhas superficiais extensas, com posterior fragmentação celular em corpos apoptóticos envoltos por membrana, compostos de restos de citoplasma, organelas e possivelmente fragmentos nucleares.
Acredita-se que as membranas celulares permaneçam intactas até os estágios finais do processo apoptótico, quando se tornam permeáveis.
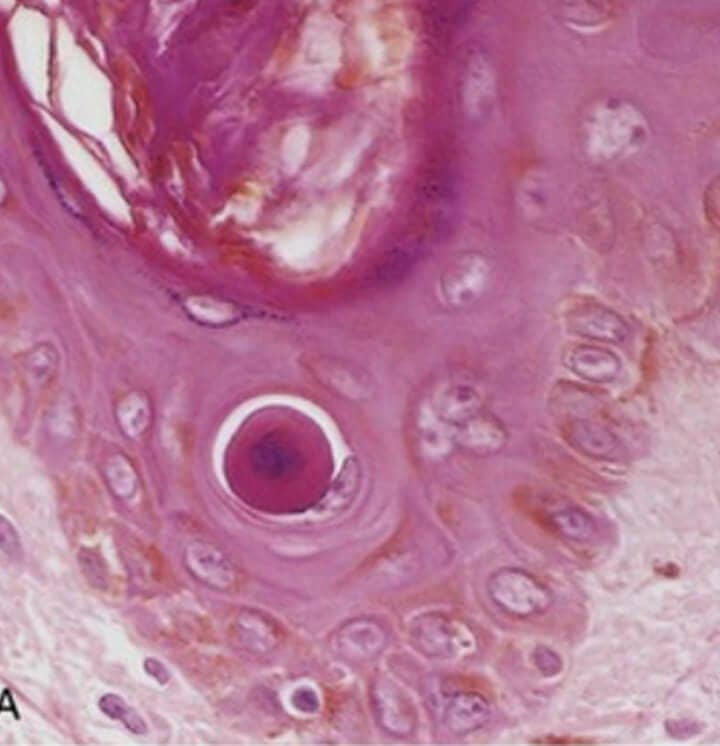
Na histologia (e coloração por hematoxilina e eosina), as células apoptóticas aparecem como massas ovais ou redondas de citoplasma intensamente eosinófilo com fragmentos de cromatina nuclear condensada. Além disso, como o processo é rápido, a apoptose precisa ser extensa para que se torne evidente nos cortes histológicos. A ausência de inflamação também dificulta a identificação microscópica.
Outros tipos de morte celular.
Este vídeo apresenta outras formas de morte celular, além dos processos de necrose e apoptose.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Chegamos ao fim de uma jornada repleta de aprendizados. Nela, nós debatemos sobre a complexidade do processo saúde-doença e entendemos os conceitos de agressão, defesa, adaptação e lesão, iniciais e fundamentais para o estudo da Patologia.
Aprofundamos nossos conhecimentos em lesão reversível, identificando os principais tipos de degeneração celular, suas causas e características morfológicas. Porém, também vimos que, caso a agressão persista ou atinja componentes celulares fundamentais, temos a progressão para a morte celular. Nesse contexto, identificamos os mecanismos e aspectos morfológicos da necrose e apoptose.
Todos esses conceitos e processos são fundamentais para a formação do profissional da Saúde, sendo aplicáveis em todos os estudos posteriores, na pesquisa e na clínica.
Podcast
Antes de encerrar, a especialista Gabriela Caldas responde a algumas perguntas em um breve resumo sobre o tema.
CONQUISTAS
Você atingiu os seguintes objetivos:
Descrever os conceitos de saúde, doença, patologia e as características dos processos de agressão, defesa, adaptação e lesão celular
Identificar os principais tipos de degeneração celular, seus mecanismos e aspectos morfológicos
Descrever as etapas de progressão da lesão celular e os princípios da morte celular por apoptose e por necrose