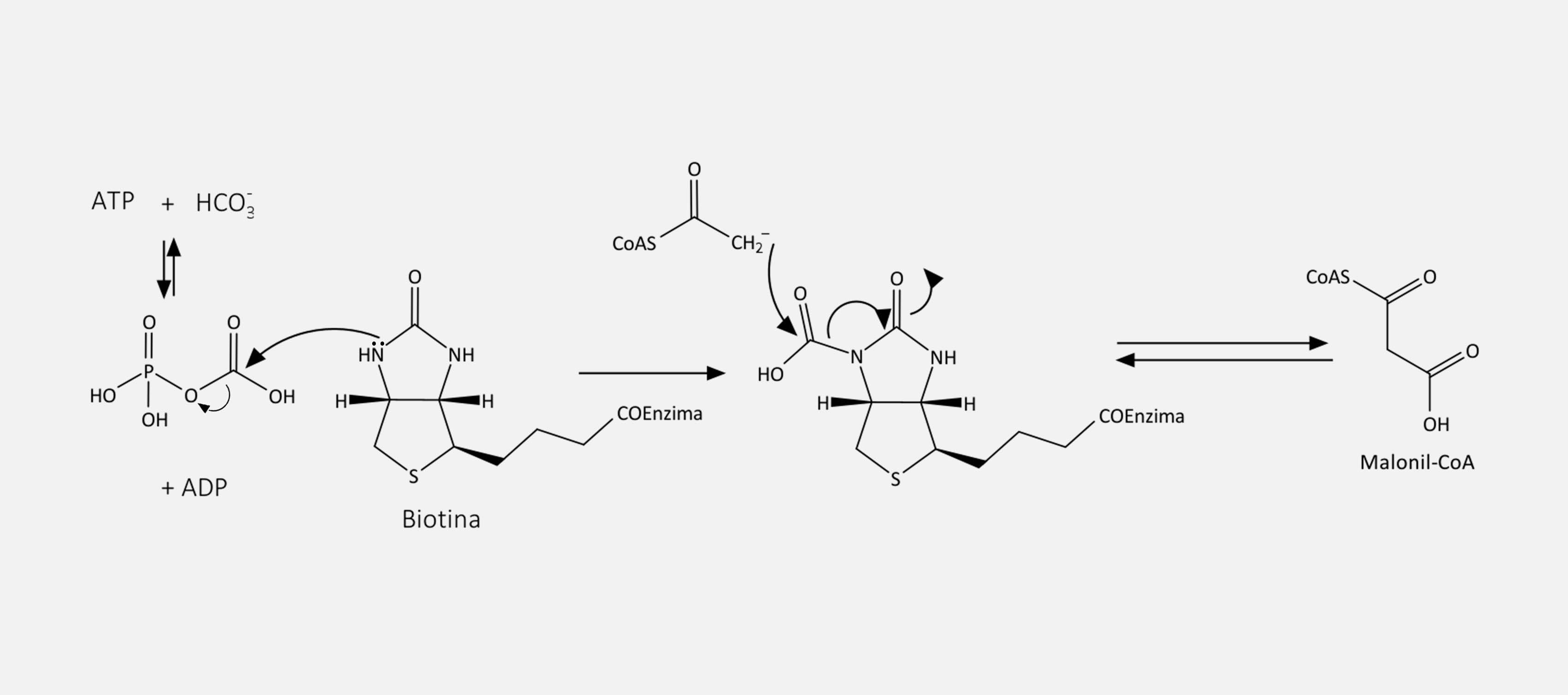
Descrição
Biossíntese, distribuição e papel fisiológico, estrutura, propriedades físico-químicas e métodos de extração de fenilpropanoides, lignanas, cumarinas, flavonoides, taninos. Drogas vegetais clássicas contendo lignanas, cumarinas, flavonoides e taninos.
PROPÓSITO
Conhecer noções básicas da biossíntese vegetal e principais métodos de extração de fenilpropanoides, lignanas, cumarinas, flavonoides e taninos, dando ênfase à estrutura e às propriedades físico-químicas, é importante para entender o perfil fitoquímico de plantas que sintetizam essas substâncias, suas aplicações fitoterápicas e os estudos farmacológicos desses compostos isolados.
OBJETIVOS
Módulo 1
Descrever a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de fenilpropanoides e lignanas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Módulo 2
Caracterizar a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de cumarinas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Módulo 3
Identificar a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de flavonoides, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Módulo 4
Descrever a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de taninos, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Introdução
Fenilpropanoides, lignanas, cumarinas, flavonoides e taninos integram a classe dos compostos fenólicos e são considerados umas das mais importantes classes dos metabólitos secundários, sendo amplamente distribuídos no reino vegetal. Possuem grande variedade estrutural, tendo pelo menos um anel aromático, no qual ao menos um hidrogênio é substituído por um grupamento hidroxila (-OH).
A farmacognosia é um dos braços mais antigos da farmácia e até hoje é grande o uso de plantas medicinais, tanto na forma de medicamento fitoterápico quanto nas preparações caseiras com a droga vegetal. Entender como essas plantas funcionam está diretamente relacionado com conhecer sua constituição química. Seus constituintes químicos são os responsáveis pela ação farmacológica e, por isso, é importante entender um pouco mais sobre suas características.
Neste tema aprenderemos mais sobre os compostos fenólicos e falaremos sobre sua biossíntese vegetal, suas atividades farmacológicas, suas características estruturais e propriedades físico-químicas. Também reconheceremos os métodos de extração mais utilizados para esses compostos e, por fim, falaremos um pouco sobre as principais drogas vegetais contendo essas substâncias.
MÓDULO 1
Descrever a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de fenilpropanoides e lignanas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
FENILPROPANOIDES, LIGNANAS E SEUS ANÁLOGOS
Compostos fenólicos e seus aspectos gerais
Compostos fenólicos são o grupo mais abundante de metabólitos secundários em plantas e estão amplamente distribuídos no reino vegetal. São potentes agentes antioxidantes, e suas classes apresentam diversas atividades biológicas, como anticarcinogênicas, anti-inflamatórias e antibacterianas. Geralmente ajudam a proteger as plantas de danos causados pelo estresse oxidativo.
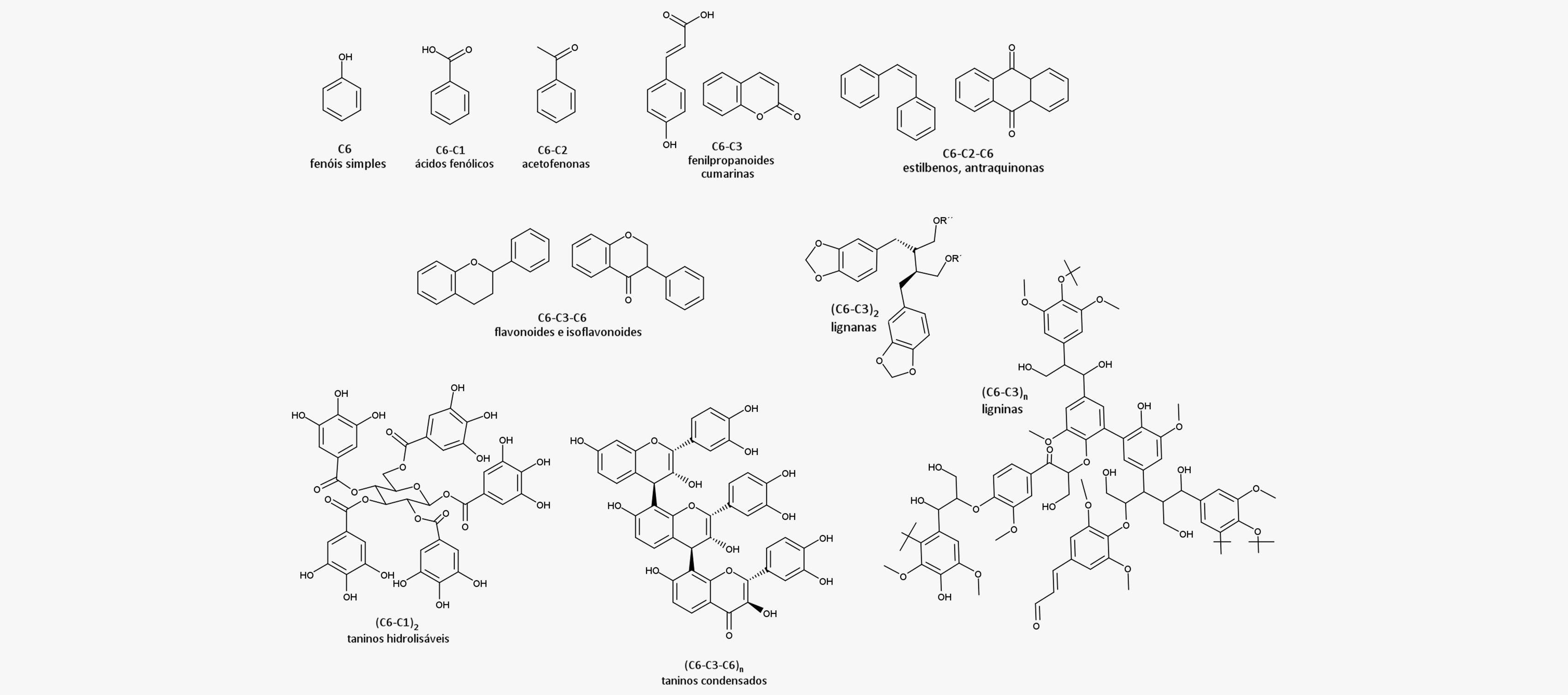
Possuem na sua estrutura um anel aromático com uma ou mais hidroxilas e são divididos em diversas classes, como:
Saiba mais
Atualmente, mais de 8 mil compostos fenólicos naturais são conhecidos e classificados de acordo com sua origem biossintética e suas características estruturais. Sua ampla variedade estrutural se dá devido à presença de diferentes substituintes, como hidroxilas (-OH), metoxilas (-OCH3) ou glicosídeos, e uma vez que os esqueletos das classes são diferentes, também temos diferenças entre as suas propriedades físico-químicas e suas atividades farmacológicas.
A imagem abaixo apresenta os esqueletos químicos básicos e as classes dos compostos fenólicos:
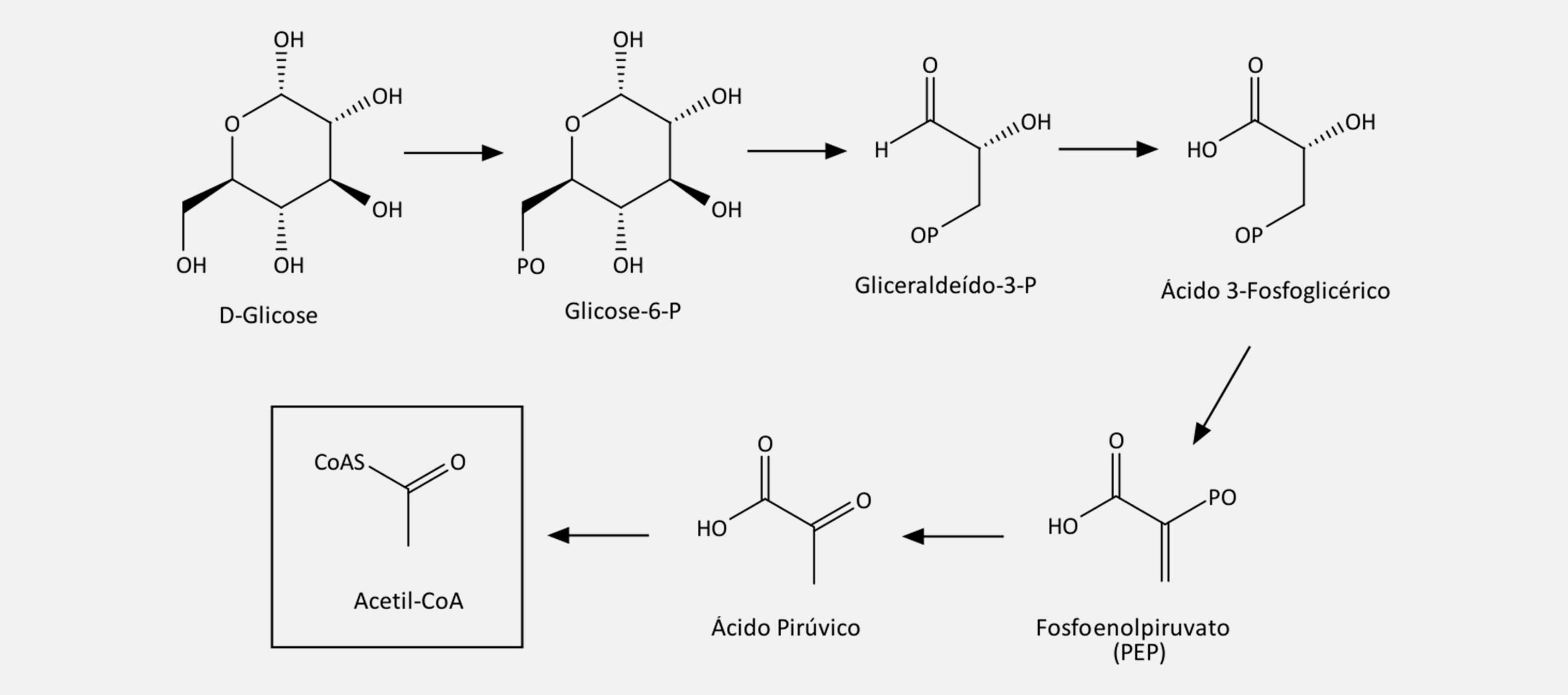
A via do chiquimato e classificação geral dos compostos fenólicos
A via do chiquimato é a via biossintética para formação dos blocos básicos de construção que formam uma gama de metabólitos e aminoácidos aromáticos. Essa via, presente em microrganismos, plantas e fungos, não está presente nos animais.
Os metabólitos produzidos pela via do chiquimato são muito importantes, uma vez que, entre outras atividades, fornecem proteção ultravioleta, atuam no transporte de elétrons e como moléculas de sinalização nas plantas.
Saiba mais
O chiquimato é a base conjugada do ácido chiquímico. Eles se diferenciam apenas pela presença de um próton (H+) a mais na espécie ácida. Por isso, neste tema, em alguns momentos faremos referência ao ácido chiquímico em vez do chiquimato.
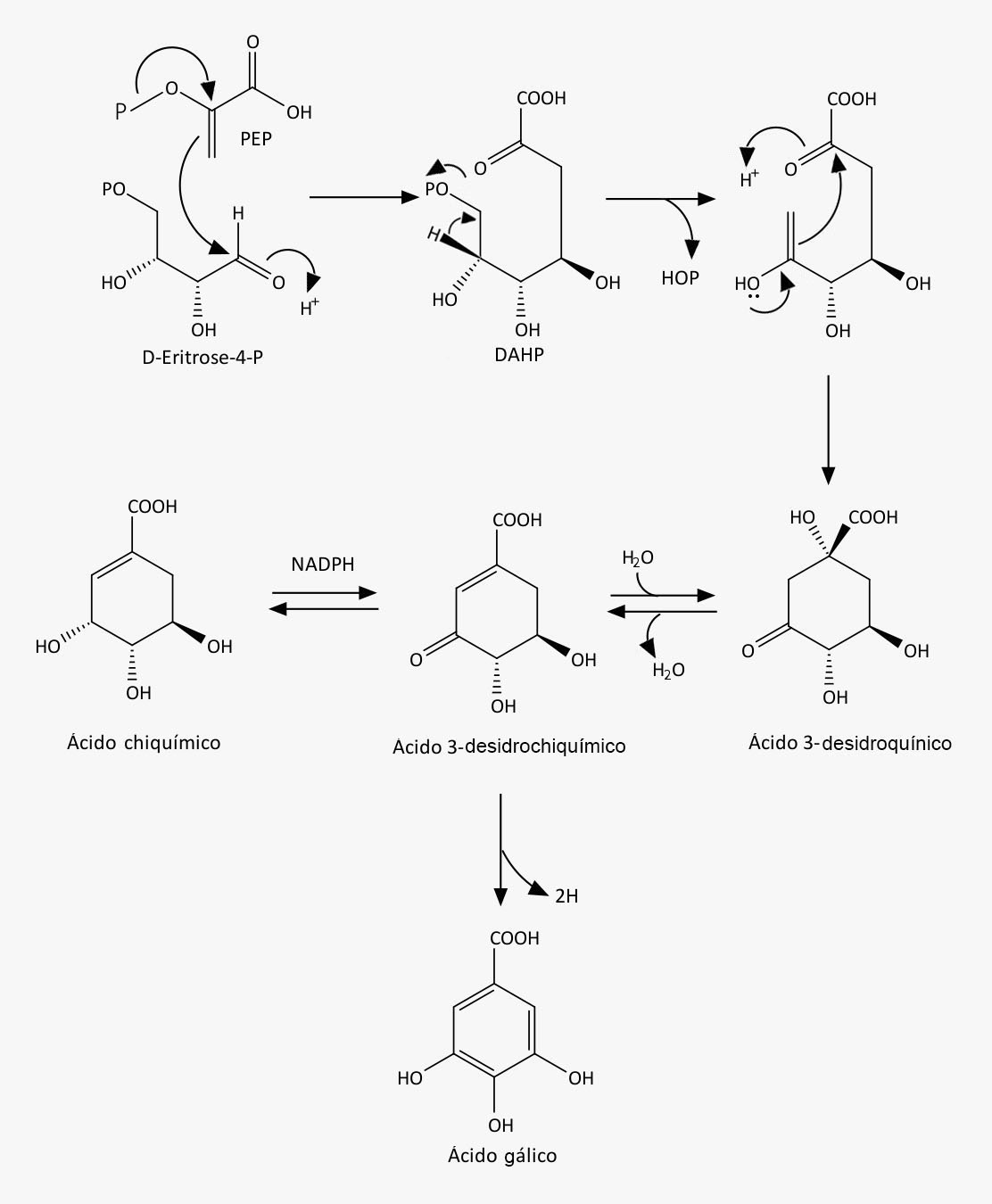
Veja a seguir como acontece a biossíntese do ácido chiquímico:
Etapa 1
A via começa com a ligação do fosfoenolpiruvato (PEP) com a D-eritrose-4-fosfato, formando um intermediário de sete carbonos chamado 3-deoxi-D-arabino-heptulosonato (DAHP).
Etapa 2
Com a saída do ácido fosfórico do DAHP e posteriormente uma reação aldol intramolecular, o 3-desidroquinato é formado.
Etapa 3
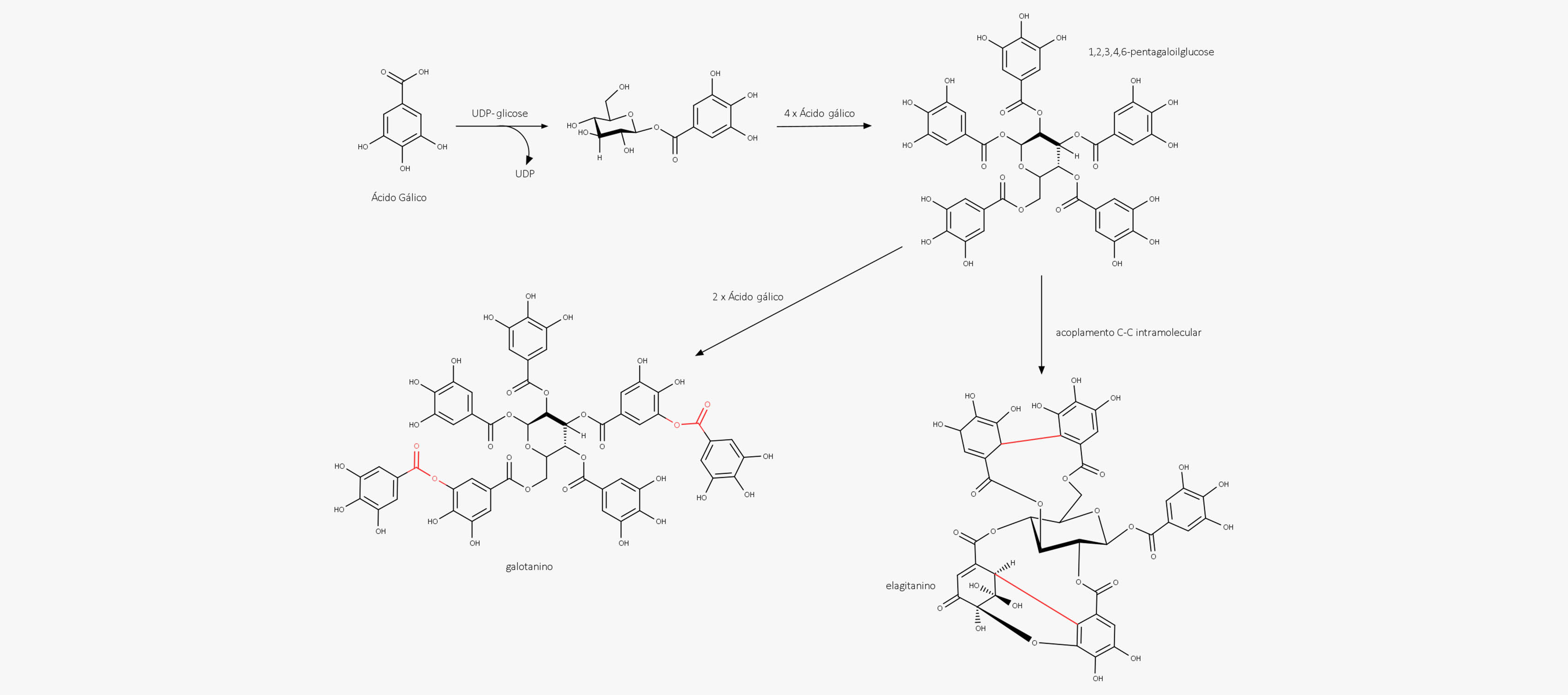
O 3-desidroquinato, após sofrer uma desidratação, forma o 3-hidroxi-chiquimato, que, por sua vez, ao sofrer uma redução pelo NADPH, forma o ácido chiquímico. O 3-desidrochiquímico pode formar outros produtos, como o ácido gálico, formado após sofrer oxidação e enolização. Todas essas etapas estão representadas na imagem a seguir.
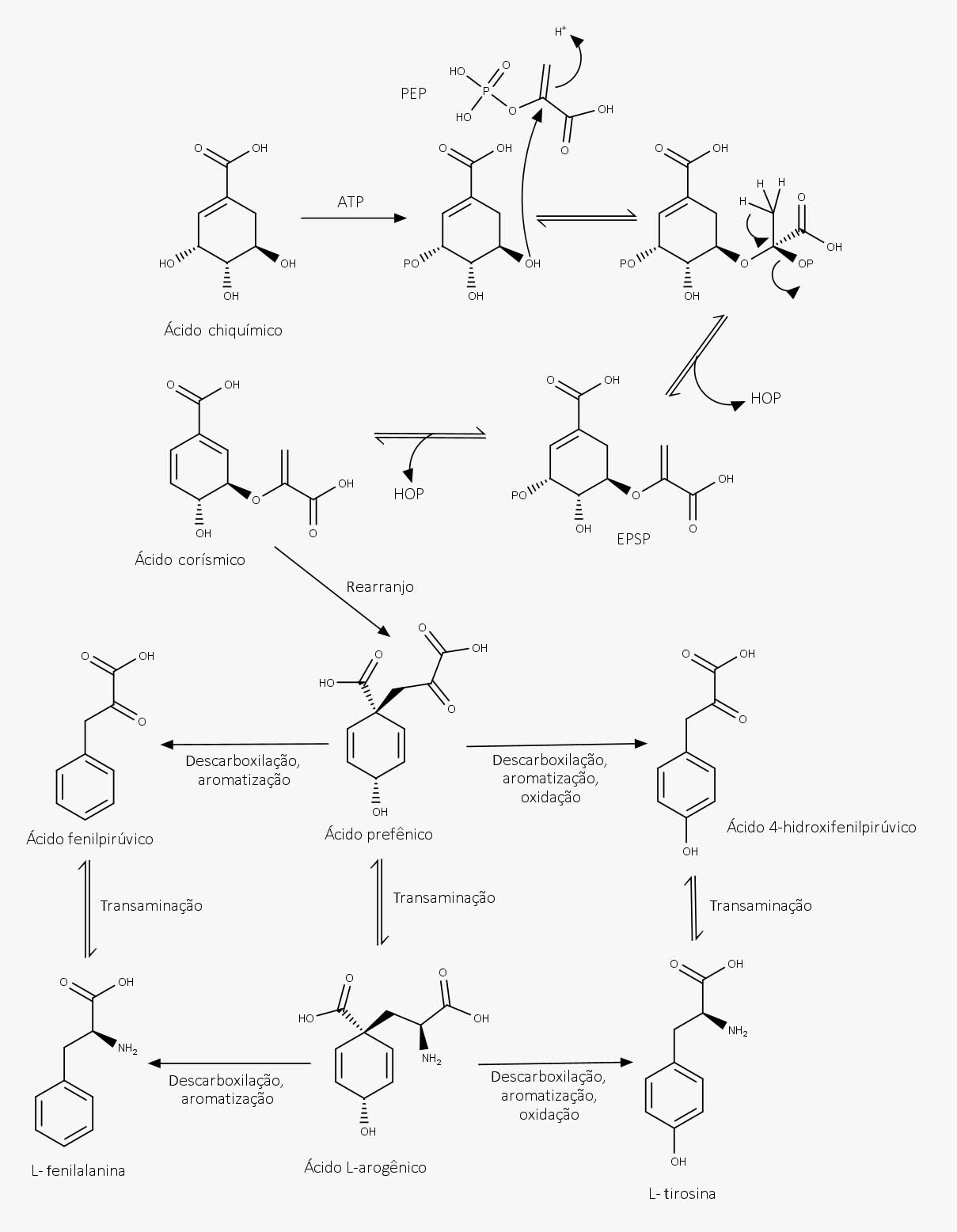
A partir do ácido chiquímico, uma sequência de reações dá origem aos metabólitos fenólicos. Essas etapas são descritas a seguir e representadas na rota biossintética da imagem abaixo:
Etapa 1
O ácido chiquímico, depois de uma fosforilação na posição 3, reage com o PEP por meio de uma reação de adição seguida de eliminação, formando o 3-enolpiruvil-chiquímico-3-fosfato (EPSP).
Etapa 2
Com a eliminação do ácido fosfórico do EPSP, é formado o ácido corísmico, que sofre um rearranjo, formando o ácido prefênico.
Etapa 3
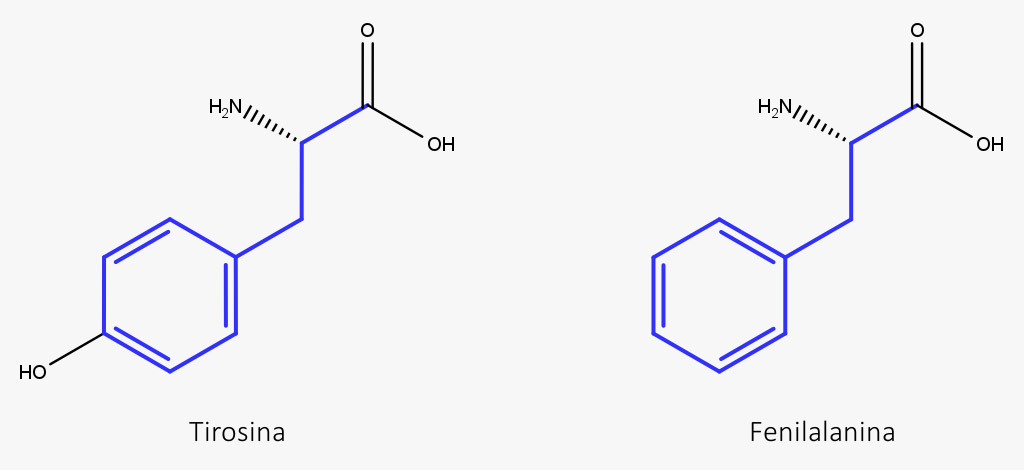
A biossíntese da fenilalanina a partir do ácido prefênico varia de organismo para organismo, pois depende das enzimas envolvidas. De um modo geral, duas reações estão envolvidas: na formação da fenilalanina, uma aromatização pela descarboxilação – formando o ácido fenilpirúvico – e uma transaminação, que converte o grupamento cetona em um grupamento amina; e para a tirosina uma oxidação. A ordem em que essas reações ocorrem depende do organismo.
A partir dos esqueletos C6-C3 da fenilalanina e da tirosina são formados, então, os metabólitos fenólicos.
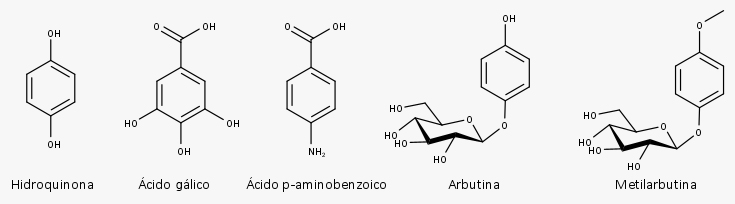
Outros metabólitos, derivados simples do ácido benzoico, como o ácido gálico, a hidroquinona, a arbutina, a metilarbutina e o ácido p-aminobenzoico (ácido 4-aminobenzoico) são produzidos por meio de pontos de ramificação na via do chiquimato.
Agora que já conhecemos as reações de biossíntese dos precursores a partir dos quais são obtidos os metabólitos secundários fenólicos, vamos explorar detalhadamente as características dos fenilpropanoides, lignanas e seus análogos.
FENILPROPANOIDES
Aspectos gerais e distribuição
Os fenilpropanoides são amplamente distribuídos no reino vegetal, sendo principalmente encontrados nas famílias:
Nos vegetais, encontram-se em praticamente todos os tecidos vegetais, porém em diferentes concentrações.
São considerados compostos aromáticos e sua formação acontece por meio de uma sequência de reações promovidas por enzimas redutases, oxigenases e transferases, resultando em metabólitos específicos e característicos de cada espécie vegetal.
Também são usados como base para a biossíntese de outros compostos fenólicos. Os fenilpropanoides exercem nas plantas importantes papéis, como sinalização celular e resposta ao estresse biótico e abiótico.
Saiba mais
Estresse biótico é aquele causado por agentes bióticos, tais como: pragas, bactérias, insetos e vírus. O estresse abiótico é aquele causado por fatores físicos, químicos ou físico-químicos, como radiação solar, deficit hídrico, vento e composição do solo.
Biossíntese e estrutura
Os fenilpropanoides são uma grande e diversificada classe de metabólitos derivados da fenilalanina. Eles desempenham importantes papéis na interação das plantas com outros organismos vivos, e sua diversidade estrutural ocorre por causa de diversas reações enzimáticas, como acilação, condensação, ciclização, glicosilação, hidroxilação, metilação e prenilação.
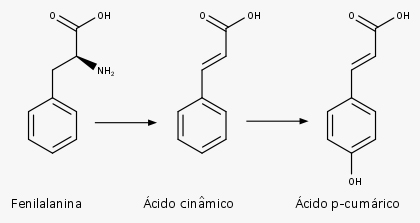
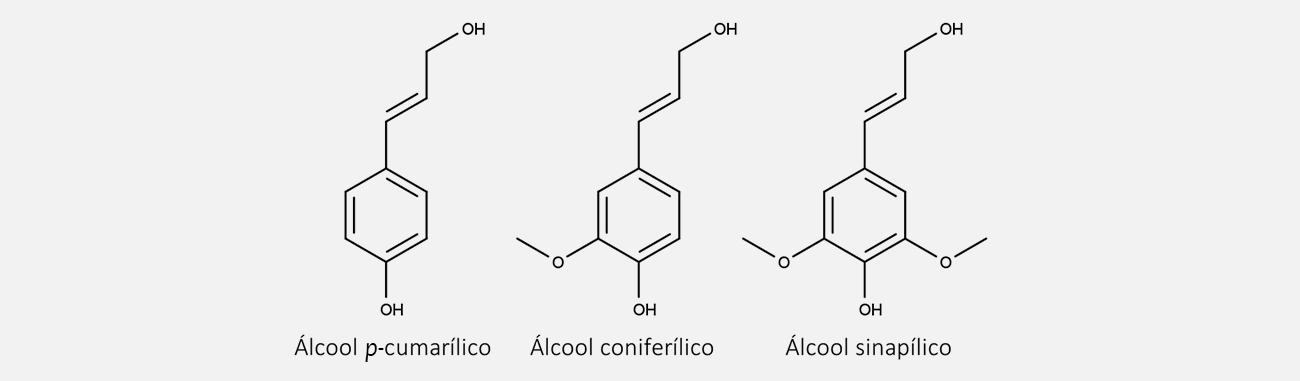
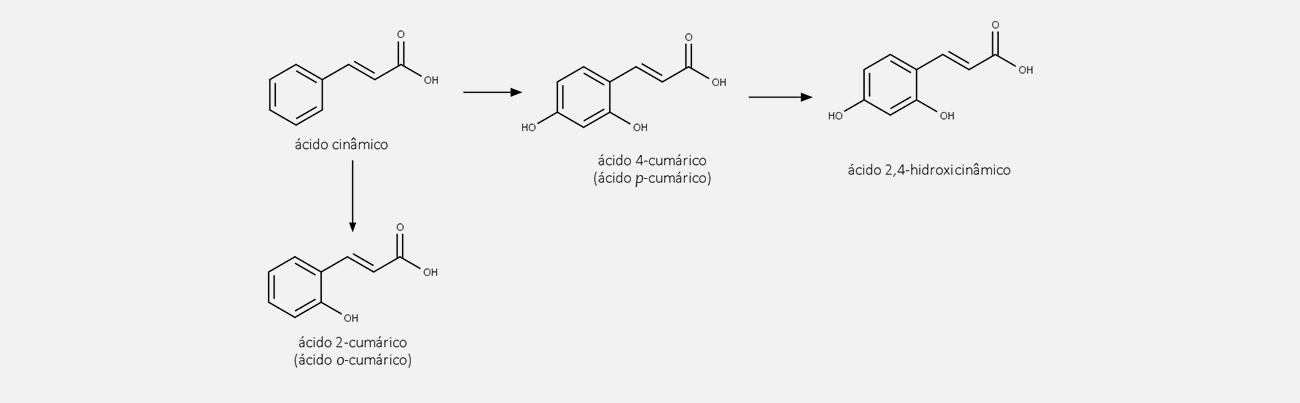
A fenilalanina elimina amônia através da enzima fenilalanina-amônia-liase (PAL), formando o ácido cinâmico. Esse composto, por meio da reação enzimática promovida pela enzima cinamato-4-hidroxilase (C4H), forma o ácido p-cumárico.
O ácido p-cumárico sofre, então, outras reações enzimáticas, como hidroxilação, metilação e redução, formando uma grande variedade de produtos. Você pode ver algumas das estruturas dos fenilpropanoides mais conhecidos na imagem a seguir:
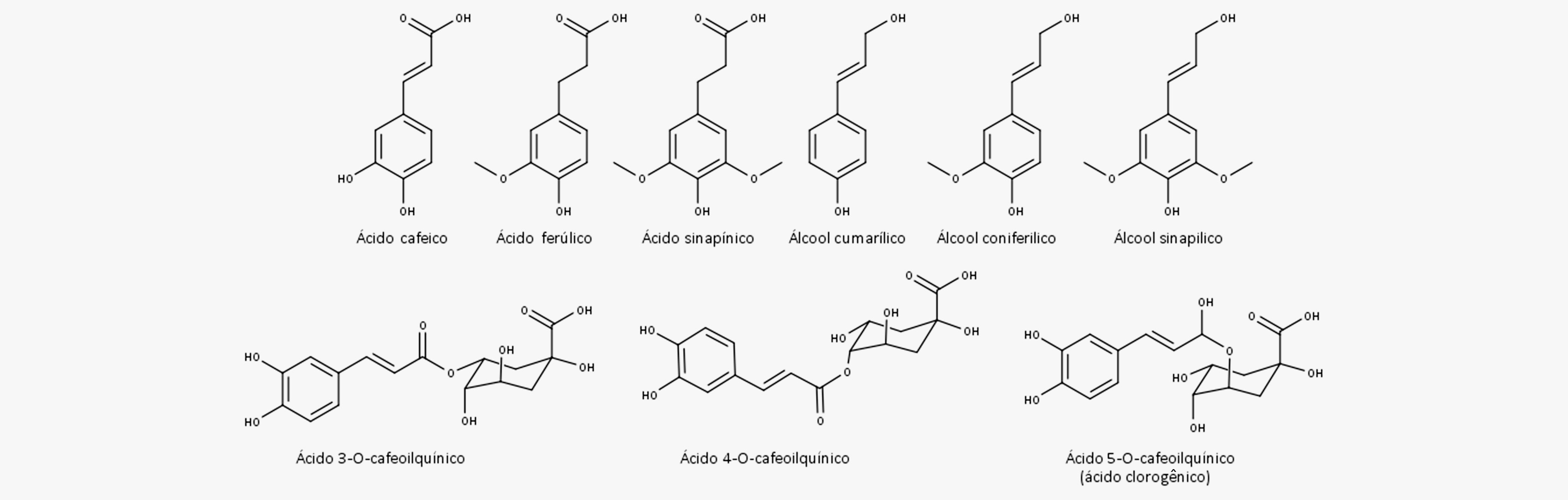
Características químicas e métodos de extração
Fenilpropanoides normalmente são encontrados sob a forma de ésteres e heterosídeos, sendo solúveis em água e em solventes orgânicos polares.
Por serem aromáticos, absorvem luz na região do ultravioleta e são visualizados em cromatografia em camada delgada com auxílio de luz ultravioleta e reagentes cromogênicos. Também são facilmente oxidáveis, podendo se isomerizar (E/Z) e formar isômeros de posição (ácidos cafeoilquínicos) em soluções ácidas e básicas.
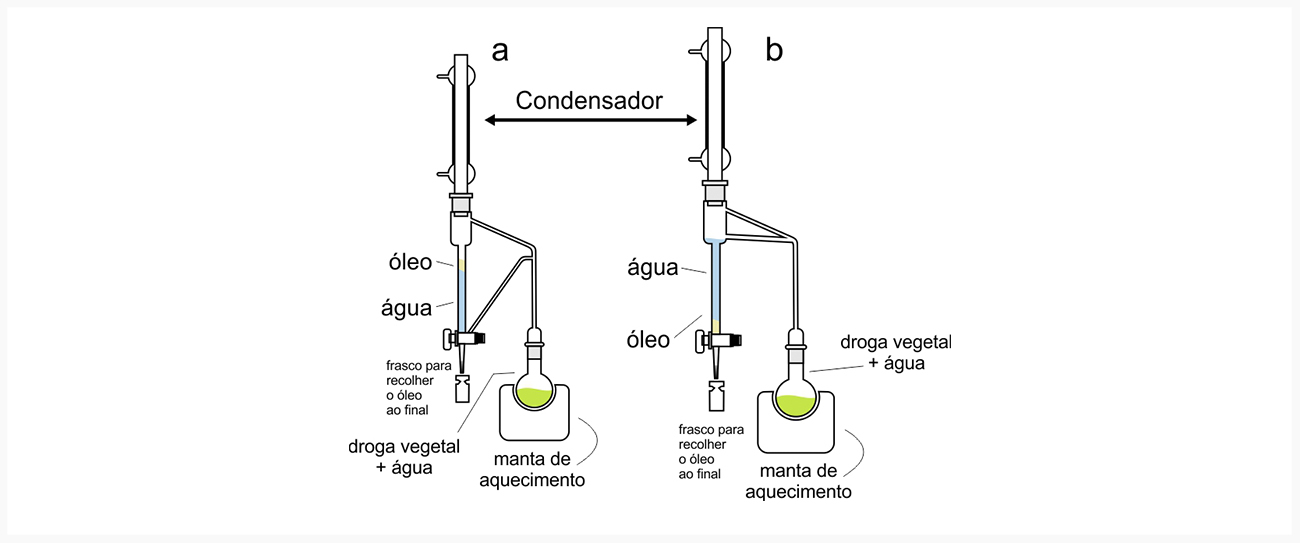
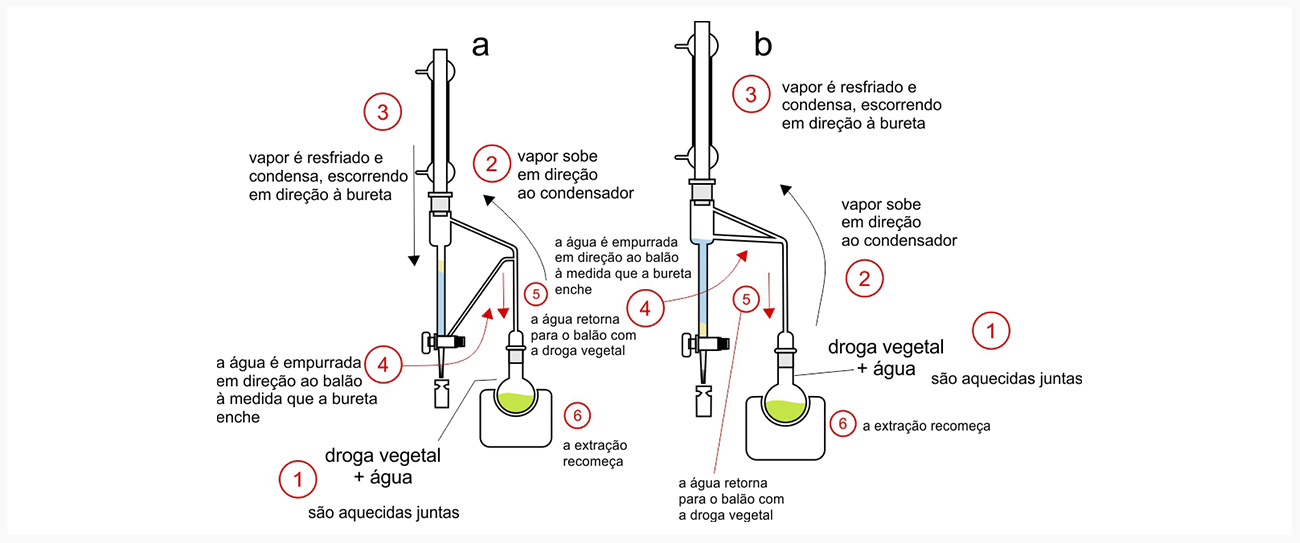
São extraídos por maceração e percolação usando solventes polares ou soluções com água e álcoois (metanol ou etanol). Por possuírem baixo peso molecular, os fenilpropanoides são muito voláteis, fazendo parte da constituição dos óleos essenciais da planta, e são extraídos por técnicas como a hidrodestilação, usando um aparelho de Clavenger.
Maceração
Processo de extração a frio, onde a planta é colocada em contato com o solvente, em temperatura ambiente, durante um longo período ‒ de 10 a 24 horas, dependendo da parte da planta utilizada.
Percolação
Processo de extração em que a planta ou droga vegetal é triturada e acondicionada em um recipiente cônico ou cilíndrico de material poroso (metal ou vidro) pelo qual o líquido de extração atravessa.
Vantagem
Uma vez que a água retorna ao balão, destilada e sem o óleo extraído, ela pode carrear novamente mais óleo quando for vaporizada, o que faz com que seja possível por meio deste se ter os valores totais de óleo essencial em drogas vegetais.
Desvantagem
Por mais que possa aumentar o tamanho do balão, você não poderá aumentá-lo muito, e por isso não é possível extrair a partir de grandes quantidades de droga vegetal.
Após a extração, os óleos são purificados com colunas cromatográficas e analisados por cromatografia gasosa (CG); e, após derivatização, por cromatografia líquida de alta eficiência (CLAE) em fase reversa, utilizando solventes orgânicos polares e água, espectrometria de massas e ressonância magnética nuclear de carbono e hidrogênio.
Atividade biológica de fenilpropanoides
Apesar de diferentes atividades biológicas já terem sido atribuídas aos fenilpropanoides – tais como neuroprotetora, imunorreguladora, antiviral, antibacteriana, hepatoprotetora, anti-inflamatória e analgésica –, a principal ação desses compostos é como antioxidantes. Aliás, muito provavelmente, é por meio dessa ação biológica que as demais acontecem.
Diferentes doenças e processos inflamatórios geram estresse ao organismo, formando espécies radicalares livres. Os fenilpropanoides conseguem reagir e neutralizar essas espécies e, assim, diminuir ou prevenir o estresse oxidativo, evitando a incidência de algumas doenças, como as neurodegenerativas e cardiovasculares.
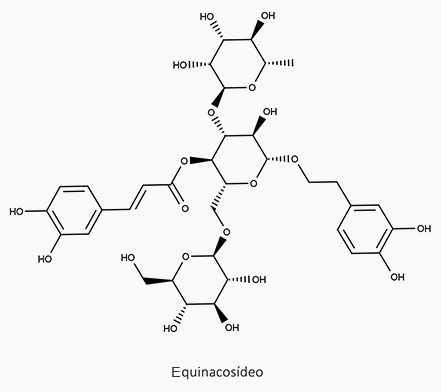
O equinacosídeo, por exemplo, isolado de Echinacea angustifolia, é efetivo ante a doença de Parkinson e Alzheimer devido à sua atividade antioxidante, tanto em ensaios com linhagens de células quanto em ensaios com animais.
Drogas vegetais com fenilpropanoides e compostos fenólicos simples
Veremos agora alguns exemplos de plantas que apresentam em sua composição fitoquímica fenilpropanoides e outros compostos fenólicos simples, bem como outras informações importantes sobre suas aplicações terapêuticas.
Nome Popular: Alcachofra
Nome Científico: Cynara scolymus L. Asteraceae
Droga Vegetal: Folhas Secas
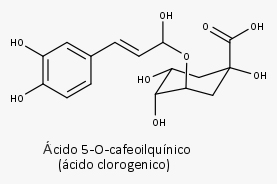
Extrato seco aquoso com as folhas secas contendo, no mínimo, 0,7% de derivados do ácido cafeoilquínico expressos em ácido clorogênico.
- Ácidos fenólicos e fenilpropanoides: até 2%
- Saponinas
- Flavonoides
- Sesquiterpernos
- Esteroides
Diuréticas, coleréticas, colagogas, hipocolesterolêmicas, hipolipidêmica e hepatoestimulante.
Facilitar a digestão e aliviar o desconforto abdominal de deficiência na produção e eliminação da bile, assim como tratamento para hiperlipidemia.
Coleréticas
Aumento da quantidade de bile segregada pelo fígado que fica armazenada na vesícula biliar, até que a passagem dos alimentos provoque o seu esvaziamento para o intestino. Aumentando a produção de bile, as plantas coleréticas descongestionam o fígado, favorecendo a digestão.
Colagogas
Facilita a transferência de bile contida na vesícula biliar para o duodeno. Essas plantas suprimem o espasmo da vesícula, aliviando a dor e facilitando o correto funcionamento do sistema biliar.
Nome Popular: Uva-ursi
Nome Científico: Arctostaphylos uva-ursi (L.) Spreng
Droga Vegetal: Folhas Secas
Extrato seco aquoso das folhas secas contendo, no mínimo, 7,0% de arbutina anidra.
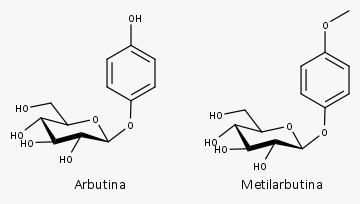
- Quinonas: pelo menos 6% no total, sendo arbutina (5%-15%) e metilarbutina principalmente
- Ácidos málico e quínico
- Taninos
- Flavonoides
- Iridoides
- Terpenoides
Diuréticas, antissépticas urinárias e adstringentes.
Tratamento de doenças do sistema urinário, como cistite e uretrite.
O efeito adstringente ocorre por causa da presença dos taninos e os efeitos antisséptico, urinário e diurético por causa dos derivados de hidroquinona, principalmente a arbutina.
Nome Popular: Cápsico
Nome Científico: Capsicum spp.
Droga Vegetal: Frutos
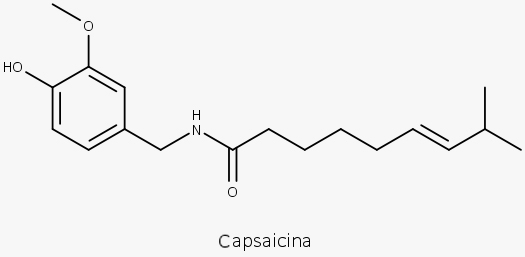
Medicamento alopático com capsaicina.
- Capsaicinoides, sendo a capsaicina a principal
- Carotenoides
- Ácido ascórbico
- Aumento da secreção gástrica e estímulo do peristaltismo.
- Diminuição da substância P (mensageiro químico dos impulsos da dor periférica para SNC) em aplicações tópicas.
Neuralgia pós-herpética, neuropatia diabética, dores pós-mastectomia, nas dores associadas à artrite reumatoide e osteoartrite.
Capsaicina.
Nome Popular: Cúrcuma
Nome Científico: Curcuma longa L. syn. Curcuma domestica Valeton
Droga Vegetal: Rizomas secos
Extrato contendo, no mínimo, 2,5% de óleo volátil e, no mínimo, 2,5% de derivados do dicinamoilmetano expressos em curcumina.
- Óleo volátil, com monoterpenos e sesquiterpenos.
- Curcuminoides, sendo 50%-60% uma mistura de curcumina, monodemetoxicurcumina e bisdemetoxicurcumina.
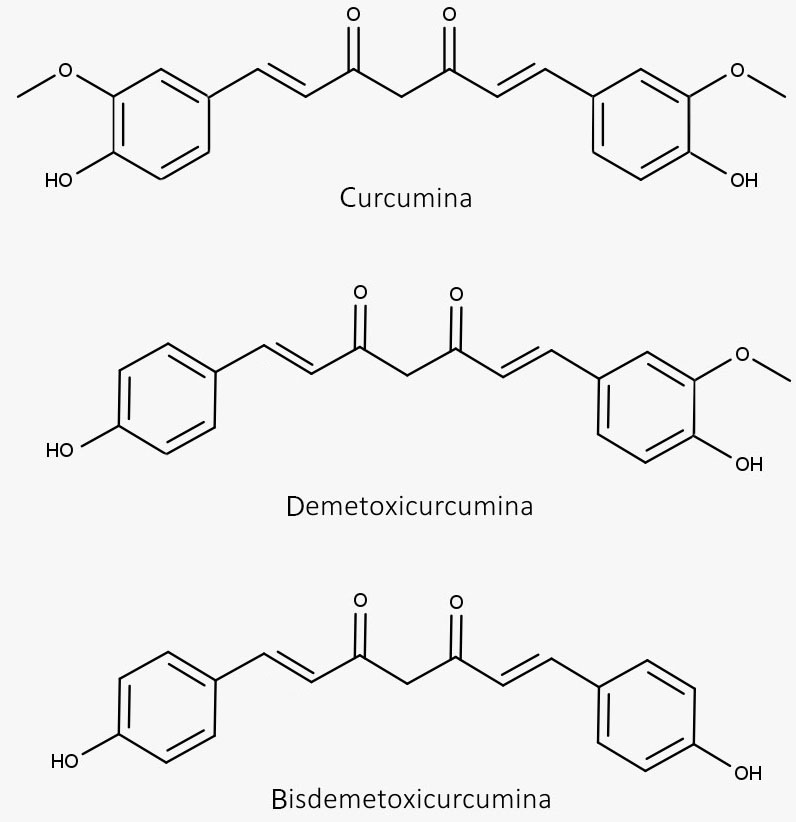
- Ação anti-inflamatória e antioxidante.
- Inibição da atividade das moléculas responsáveis pela mediação da dor e da inflamação pelos curcuminoides.
Tratamento da osteoartrite e artrite reumatoide.
Curcuminoides.
LIGNANAS E ANÁLOGOS
Aspectos gerais e distribuição
Lignanas e ligninas são dímeros e polímeros de fenilpropanoides, formados por meio de reações de acoplamento oxidativo.
A linhaça (semente do Linum usitatissimum) é considerada a fonte mais rica de lignanas, contendo secoisolariciresinol, lariciresinol, pinoresinol e matairesinol, onde o secoisolariciresinol é o constituinte majoritário. Em média, a linhaça contém aproximadamente 3,7 mg de lignanas/100 g.
Gergelim, grãos inteiros, alguns legumes, chá preto, damascos, morangos, pêssegos, alho, cenoura e aspargos também contêm lignanas em quantidades razoáveis. De um modo geral, tanto as lignanas quanto as ligninas são amplamente distribuídas no reino vegetal e consideradas indicadores do processo evolutivo em angiospermas.
Saiba mais
As ligninas são um polímero vegetal, fortalecedor da parede celular vegetal, que atua como matriz para a celulose. A quantidade de ligninas presente na Terra é muito grande e só é menor que a quantidade de carboidratos.
Veja agora as estruturas dos:
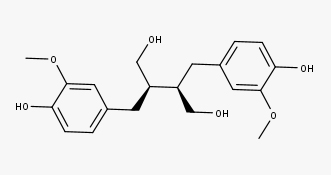
Secoisolariciresinol
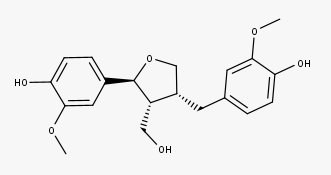
Lariciresinol
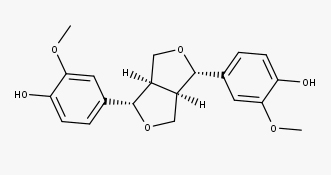
Pinoresinol
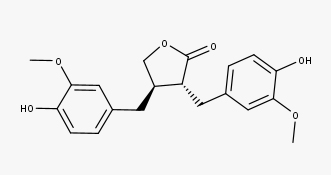
Matairesinol
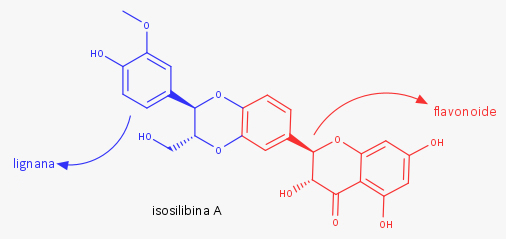
Flavonolignanas são compostos fenólicos formados por uma parte de flavonoide e uma parte de lignana. São encontrados em plantas das famílias Asteraceae, Berberidaceae, Chenopodiaceae, Fabaceae, Poaceae e Scrophulariaceae, e são o grupo de lignanas mais amplamente estudado, por causa de suas aplicações medicinais e atividades farmacológicas.
Entre as diversas lignanas existentes, algumas se destacam mais devido às suas atividades farmacológicas, como a silibina, presente em Silybum marianum (L.) Gaertn., e a podofilotoxina, presente nas espécies de Podophyllum, que foi usada como fonte de inspiração para alguns agentes antineoplásicos utilizados hoje em dia, como o etoposide.
Exemplo de lignanas com importância farmacológica:
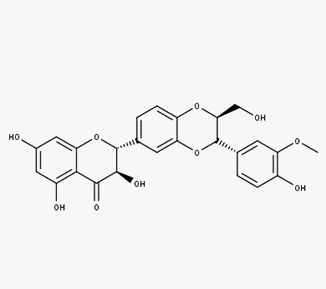
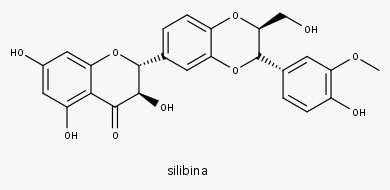
Silibina
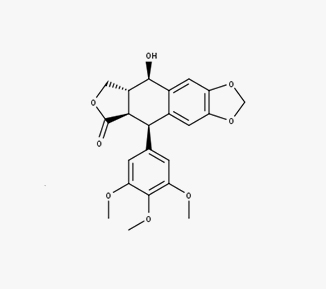
Podofilotoxina
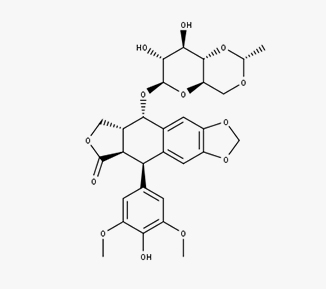
Etoposide
Biossíntese e classificação estrutural
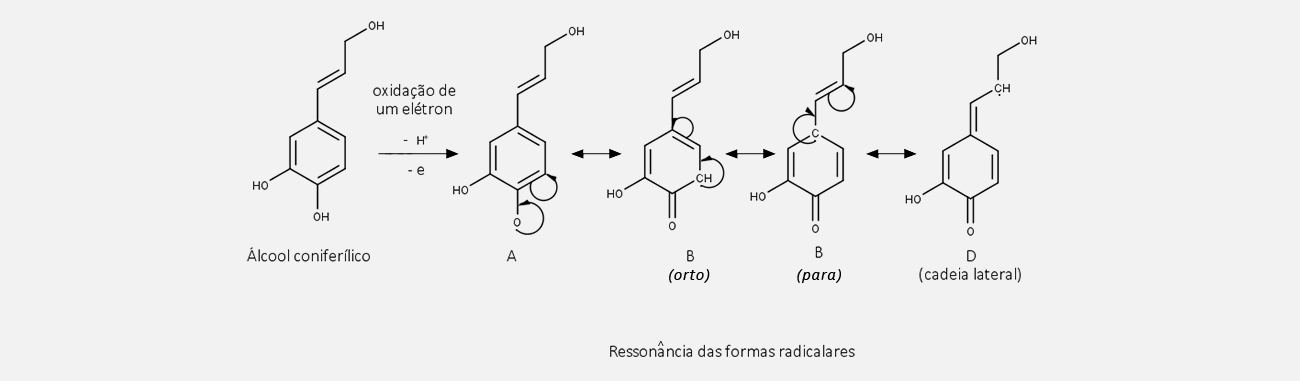
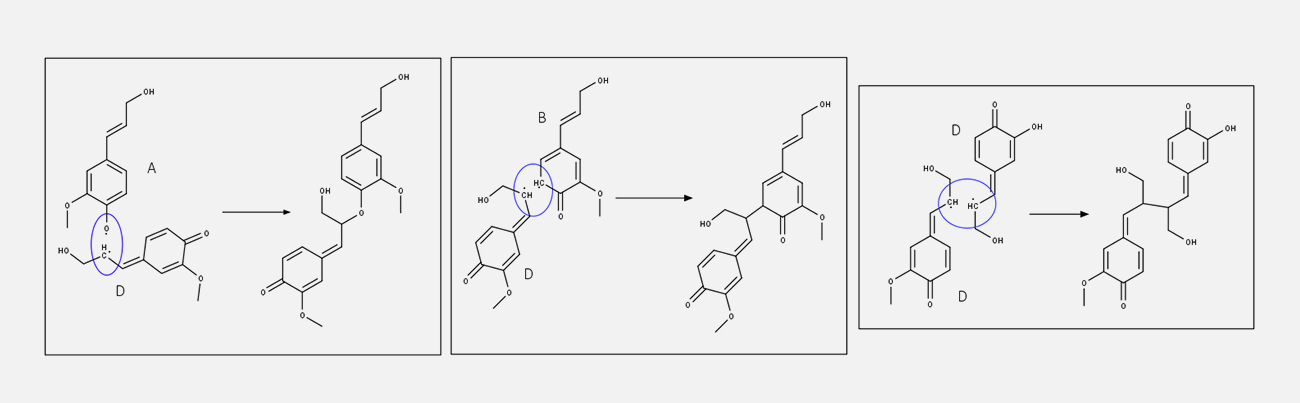
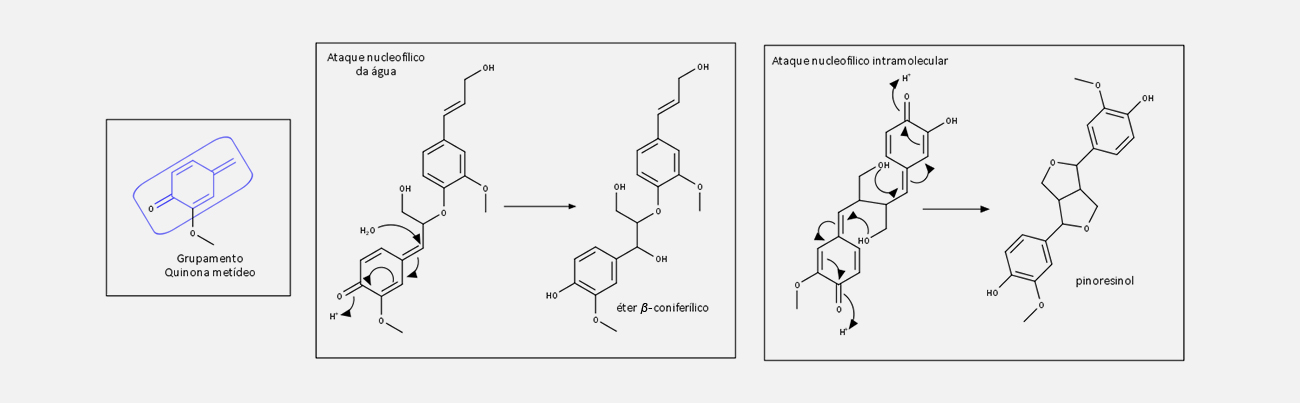
Uma vez formadas as estruturas radicalares, o emparelhamento das estruturas de ressonância pode gerar diferentes estruturas diméricas, as lignanas, contendo em sua estrutura quinonas metídeos, que são reativas e suscetíveis ao ataque nucleofílico de grupos hidroxila presentes na própria estrutura ou por moléculas de água externas. Reações posteriores, como ciclização e outras reações, fornecem uma grande variedade de lignanas estruturalmente diferentes.
Acompanhe nas imagens a seguir:
Saiba mais
Alguns autores restringem o termo lignana especificamente a moléculas nas quais as duas unidades de fenilpropano estão acopladas ao carbono central da cadeia lateral, como o pinoresinol.
Outros compostos, oriundos de outros tipos de acoplamento, como o éter β-coniferílico e o álcool desidrodiconiferílico, são chamados de neolignanas.
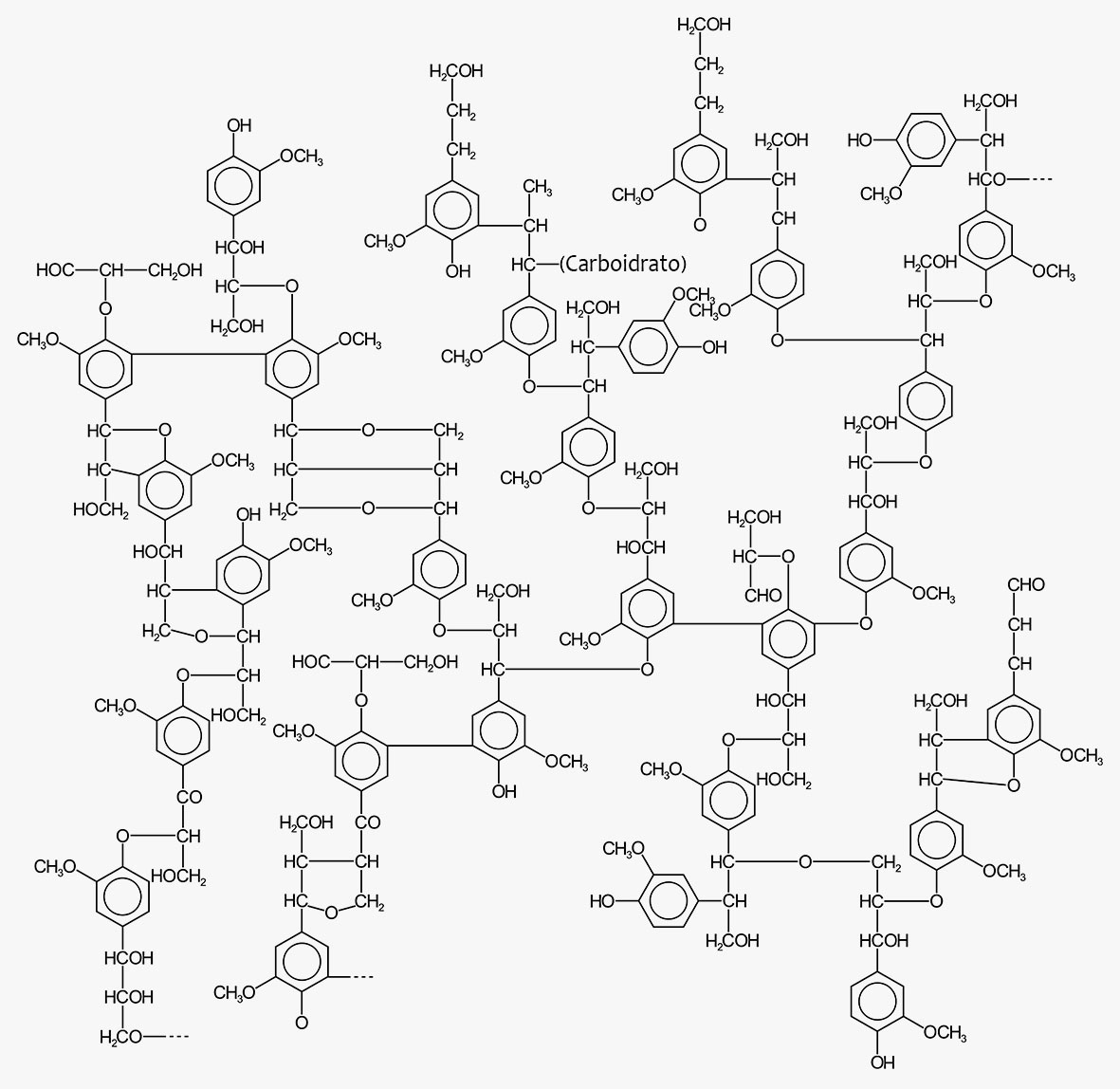
Os dímeros formados ainda reagem, por mecanismos semelhantes, produzindo um polímero, chamado de lignina, contendo uma série heterogênea de ligações intermoleculares, como visto nos vários dímeros.
Essas reações, utilizadas na formação das lignanas, neoliganas e ligninas, são catalisadas por diferentes enzimas, e por isso lignanas e neolignanas naturais são normalmente enantiomericamente puras porque surgem do acoplamento estereoquimicamente controlado. Isso não ocorre com as ligninas, uma vez que os mecanismos de controle da sua biossíntese são menos definidos.
As flavolignanas são formadas de maneira semelhante à formação das lignanas. Uma enzima peroxidase remove um hidrogênio radical da estrutura de um flavonoide e este, ao emparelhar com um fenilpropanoide radicalar, forma a flavolignana.
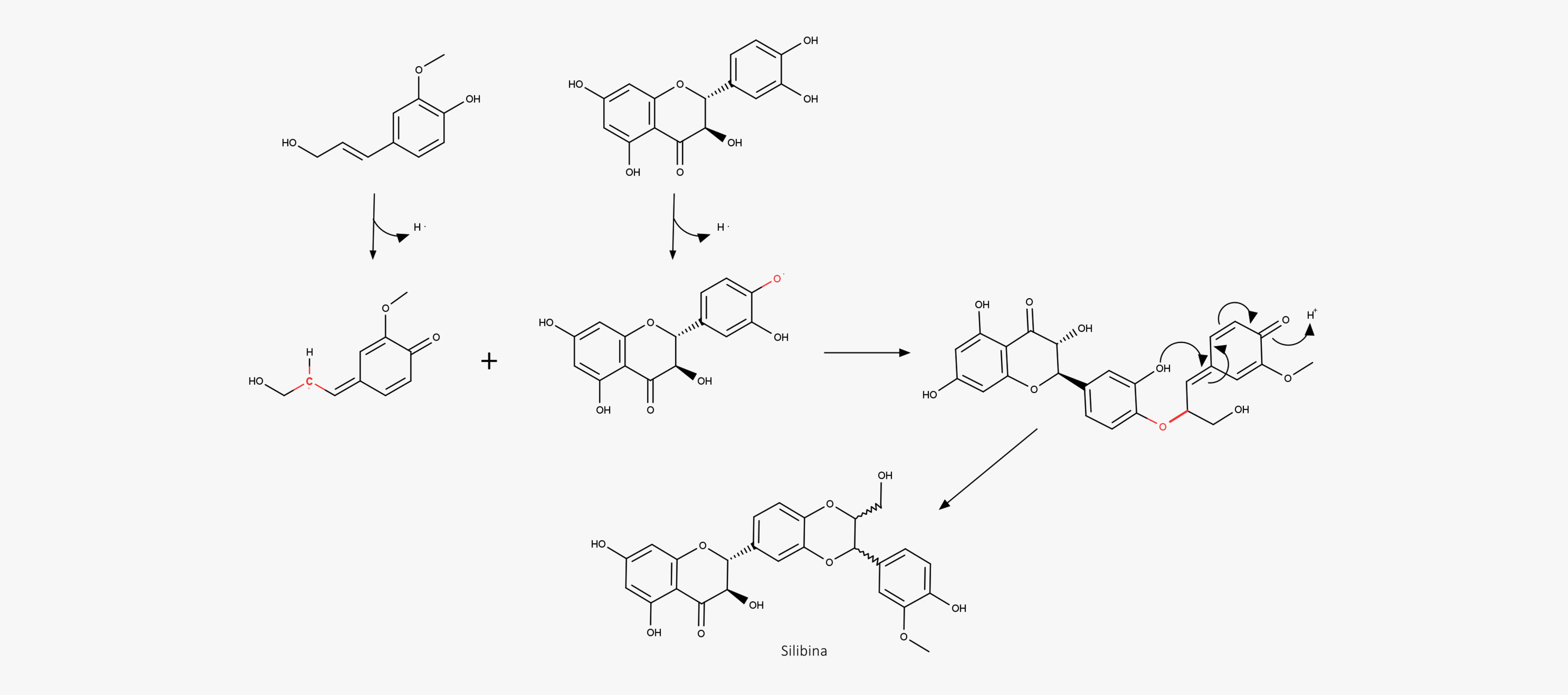
Características químicas e métodos de extração
Lignanas
As lignanas são, em temperatura ambiente, sólidos incolores com ponto de fusão entre 60-300°C e apresentam polaridade intermediária.
Neolignanas
As neolignanas são solúveis em solventes apolares, como éter de petróleo, principalmente se possuírem no anel aromático um grupo metoxila, como ocorre na maioria das vezes. Em temperatura ambiente, elas são um óleo de alta viscosidade.
Saiba mais
As lignanas glicosiladas são solúveis em álcoois, como metanol, etanol e butanol, e as lignanas que possuem o grupo hidroxila ligado ao seu anel aromático possuem um caráter ácido e por isso são solubilizadas em soluções diluídas de bases.
Não há um método de extração que seja específico para lignoides, sendo, portanto, recomendada uma extração com solvente (como maceração ou percolação) seguida por outros processos de separação e análise, como coluna cromatográfica e cromatografia em camada delgada, por exemplo. Por causa das diferenças estruturais, as lignanas também são separadas por meio das suas solubilidades em diferentes solventes, empregando-se extração líquido-líquido, por exemplo.
Como os demais compostos fenólicos, as lignanas e flavolignanas são analisadas por cromatografia em camada delgada e reagentes cromogênicos. A cromatografia líquida de alta eficiência (CLAE) é mais escolhida para as lignanas do que os métodos por cromatografia gasosa, uma vez que para estes há a necessidade de tornar as amostras mais apolares por meio de reações de derivatização.
Na CLAE, normalmente, são utilizadas colunas de fase reversa e detecção por ultravioleta a 280nm. A identificação dos compostos pode ser feita utilizando-se técnicas de ressonância magnética nuclear, espectrometria de massas e infravermelho.
Atividade biológica
As bactérias existentes no intestino convertem lignanas obtidas na alimentação em:
Enterolignanas
Enterodiol
Enterolactona
Esses compostos têm propriedades hipotensoras, antioxidantes, hipolipidemiante e anti-inflamatórias. Por isso, o consumo regular de lignanas na dieta é considerado um auxiliar na diminuição do risco de doenças cardiovasculares.
Também foram descritas propriedades de inibição viral, antitumoral, antibacteriana, antioxidante, estimulador da imunidade e hepatoprotetor, sendo para esta última propriedade a silimarina a flavolignana mais conhecida.
Drogas vegetais com lignanas e flavolignanas
Veremos agora alguns exemplos de plantas que apresentam em sua composição fitoquímica lignanas e flavolignanas, bem como outras informações importantes sobre suas aplicações terapêuticas.
Nome Popular: Podofilo
Nome Científico: Podophyllum hexandrum Royle e Podophyllum peltatum L.
Droga Vegetal: Rizoma e Raízes Secas
Raízes secas e rizomas, após extração com etanol, fornecem uma resina conhecida como podofilina.
- P. hexandrum: 6%-12% de resina (50%-60% lignanas)
- P. peltatum: 2%-8% de resina (14%-18% lignanas)
- Componentes da podofilina: podofilotoxina, α-peltatina, β-peltatina, demetilpodofilotoxina, desoxipodofilotoxina e podofilotoxona
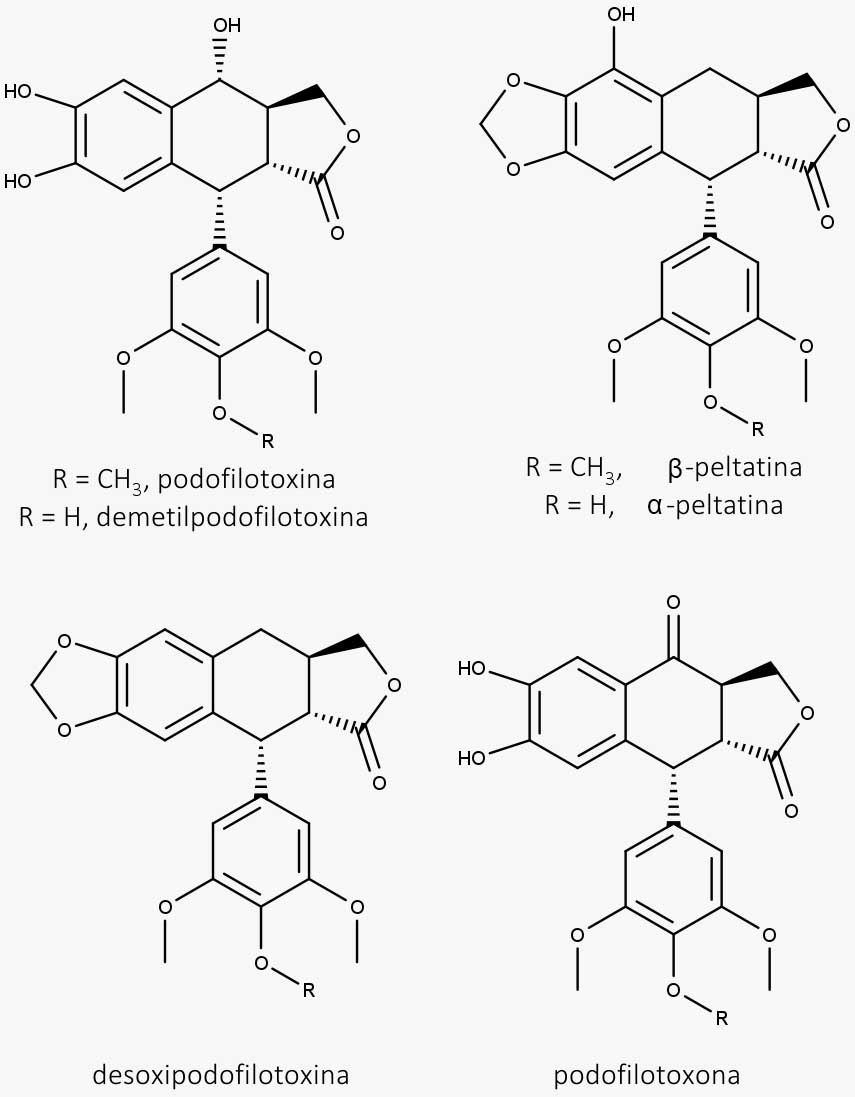
O efeito antitumoral da podofilotoxina e das outras lignanas se dá pela ligação à proteína tubulina durante a mitose, evitando que ocorra a polimerização e a formação dos microtúbulos.
- Podofilina: tratamento tópico dos condilomas venéreos.
- Derivados semissintéticos: atividade antineoplásica.
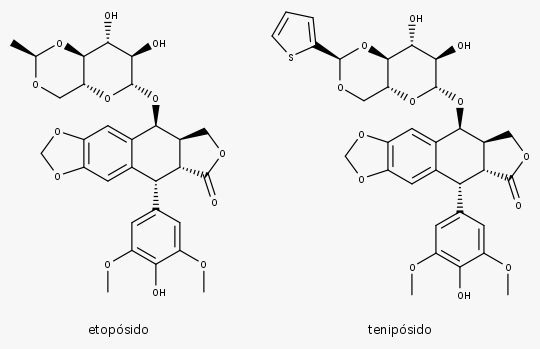
- Lignanas da podofilotoxina.
- Derivados semissintéticos: etopósido e tenipósido.
Nome Popular: Cardo mariano
Nome Científico: Silybum marianum L. Asteraceae
Droga Vegetal: Frutos
Extrato seco, contendo cerca de 50% de silimarina expressos em silibina.
- Flavolignanas: 1,5%-3,0% de silimarina, uma mistura contendo cerca de 50% de silibina, silicristina e silidianina, e outras substâncias da mesma classe em menor quantidade
- Flavonoides
- Lipídios
- Esteróis
Hepatoprotetora, antioxidante e colagoga.
Tratamento de problemas no fígado, baço e vesícula biliar.
Silimarina.
A seguir, a especialista comentará um pouco mais a respeito da importância da via do chiquimato para a biossíntese dos fenólicos, as diferenças estruturais entre as substâncias formadas, o que são fenilpropanoides e lignanas, bem como sua importância.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Caracterizar a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de cumarinas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
CUMARINAS
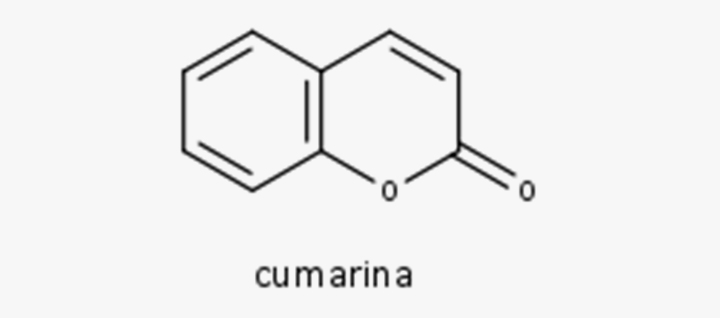
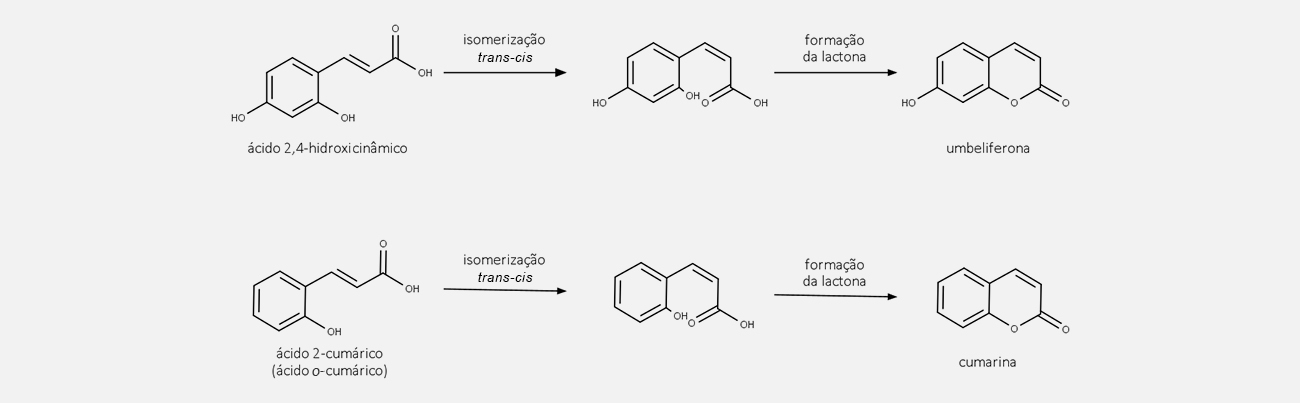
Aspectos gerais e distribuição
Cumarinas são 1,2-benzopironas derivadas da via dos fenilpropanoides, sendo produtos da
lactonização do ácido
As cumarinas de ocorrência natural, identificadas pelo seu núcleo benzopiran-2-ona, foram isoladas de numerosas plantas, particularmente de membros das:

Apiaceae

Rutaceae

Rubiaceae

Leguminosae
Vários membros dessas famílias de plantas são usados como especiarias e vegetais, como chá-verde, hortelã-pimenta, mel, cenouras, coentros e salsa. Tal grupo de metabólitos também é encontrado em diversas frutas, como mirtilo, amora silvestre, morangos, damasco e cerejas, e em diferentes espécies utilizadas para fins medicinais.
Saiba mais
Muitos estudos foram realizados a fim de investigar os efeitos benéficos e os potenciais riscos dos metabólitos cumarínicos, bem como dos derivados sintéticos relacionados. Eles são usados principalmente na indústria de fragrâncias como intensificadores e estabilizadores.
BIOSSÍNTESE E CLASSIFICAÇÃO ESTRUTURAL
De acordo com sua estrutura, as cumarinas são classificadas como cumarinas simples, furanocumarinas, piranocumarinas e cumarinas substituídas no anel da lactona; e seus derivados hidroxilados, alcoxilados e alquilados e seus glicosídeos.
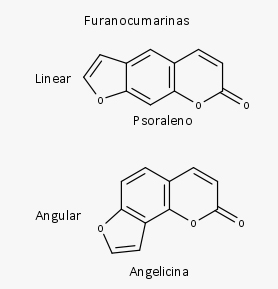
As furanocumarinas são subdivididas em tipo:
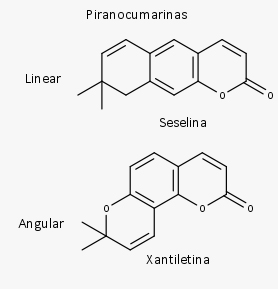
As piranocumarinas são compostas por um anel de pirano fundido com o núcleo cumarínico e são subdivididas em lineares e em angulares.
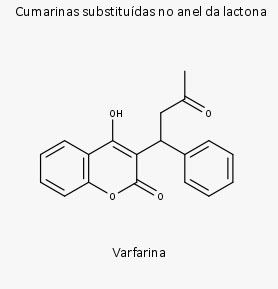
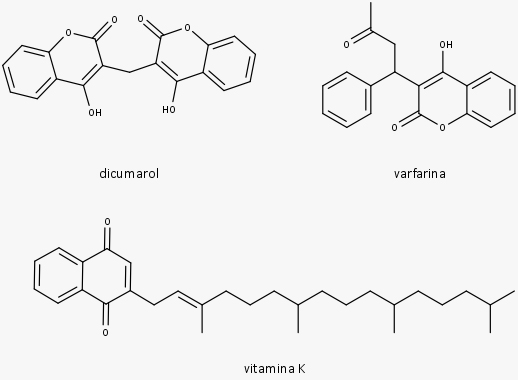
As cumarinas substituídas no anel de lactona são compostos que apresentam substituintes de funcionalidade variada ligados a C3 e/ou C4 do anel de lactona, como a varfarina, uma cumarina sintética.
Subclasses das Cumarinas
Vejamos, em etapas a biossíntese das furanocumarinas.
Etapa 1
As furanocumarinas são formadas pela incorporação de carbonos extras, derivados de uma unidade de isopreno (DMAPP).
Etapa 2
O anel aromático na umbeliferona é ativado nas posições orto em relação ao grupo hidroxila (posição 6’ e 8’) e pode assim ser alquilado pelo DMAPP em uma reação catalisada por enzimas específicas.
Etapa 3
Quando a alquilação ocorre na posição 6’, temos a formação das furanocumarinas lineares. Quando a alquilação ocorre na posição 8’, temos a formação das furanocumarinas angulares.
Etapa 4
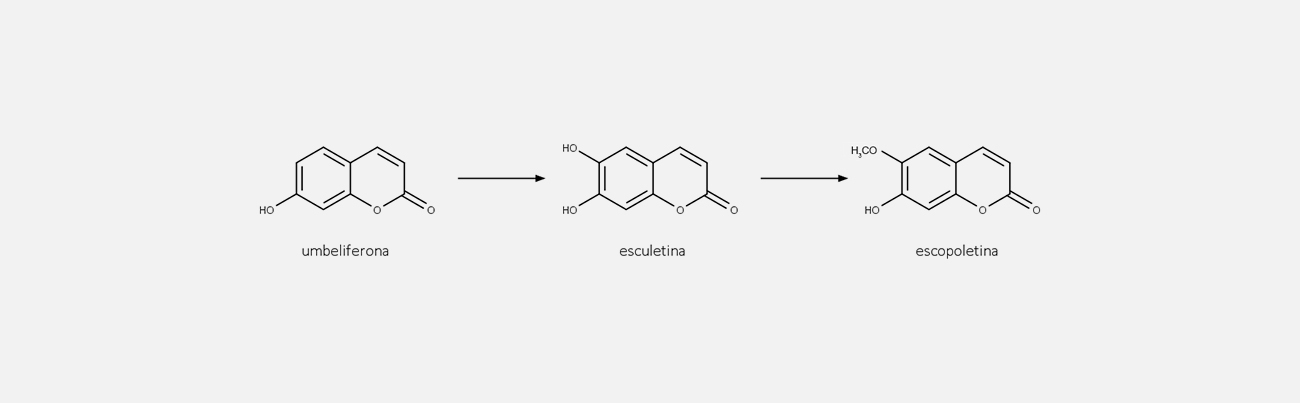
Psoraleno (furanocumarina linear) e angelicina (furanocumarina angular) podem sofrer reações de hidroxilação, metoxilação, entre outras, formando diversos outros compostos.
Esse processo é esquematizado na imagem abaixo:
Biossíntese das furanocumarinas
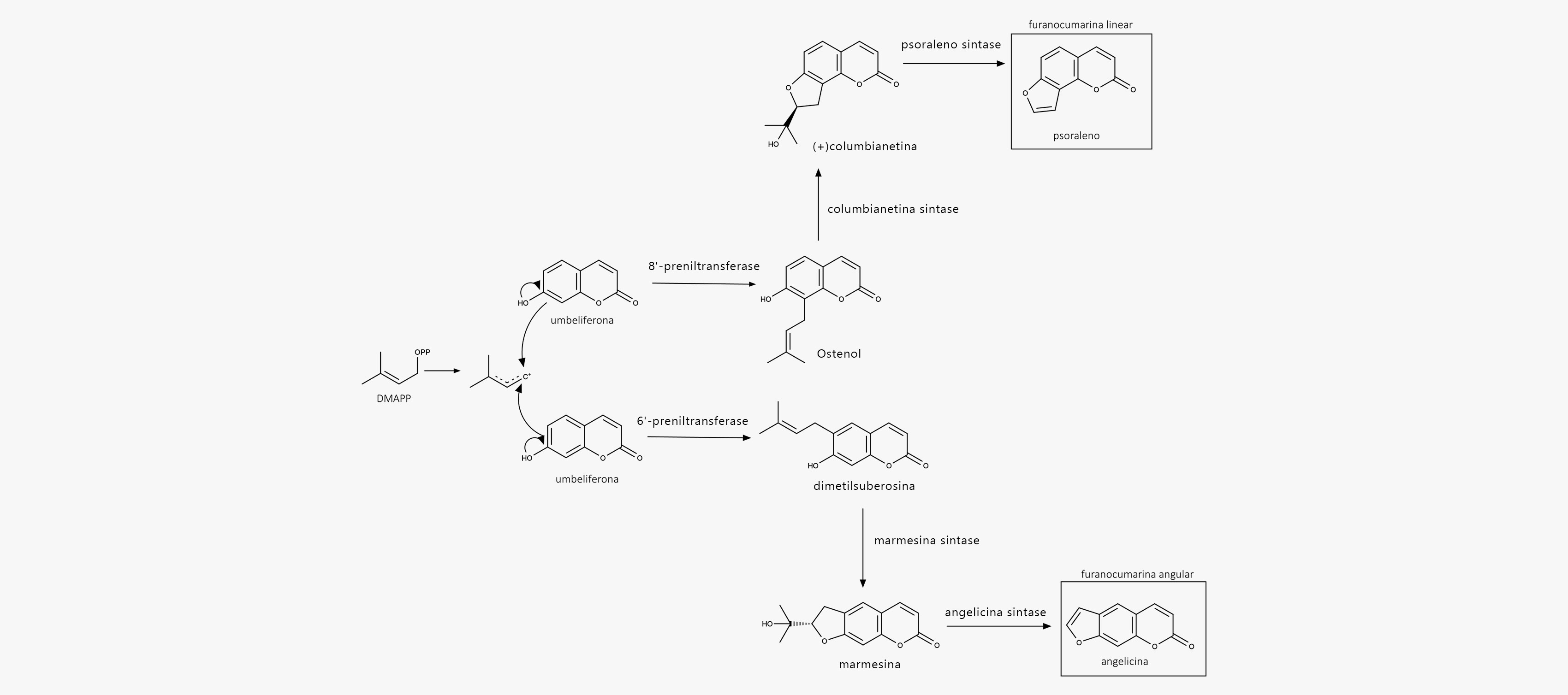
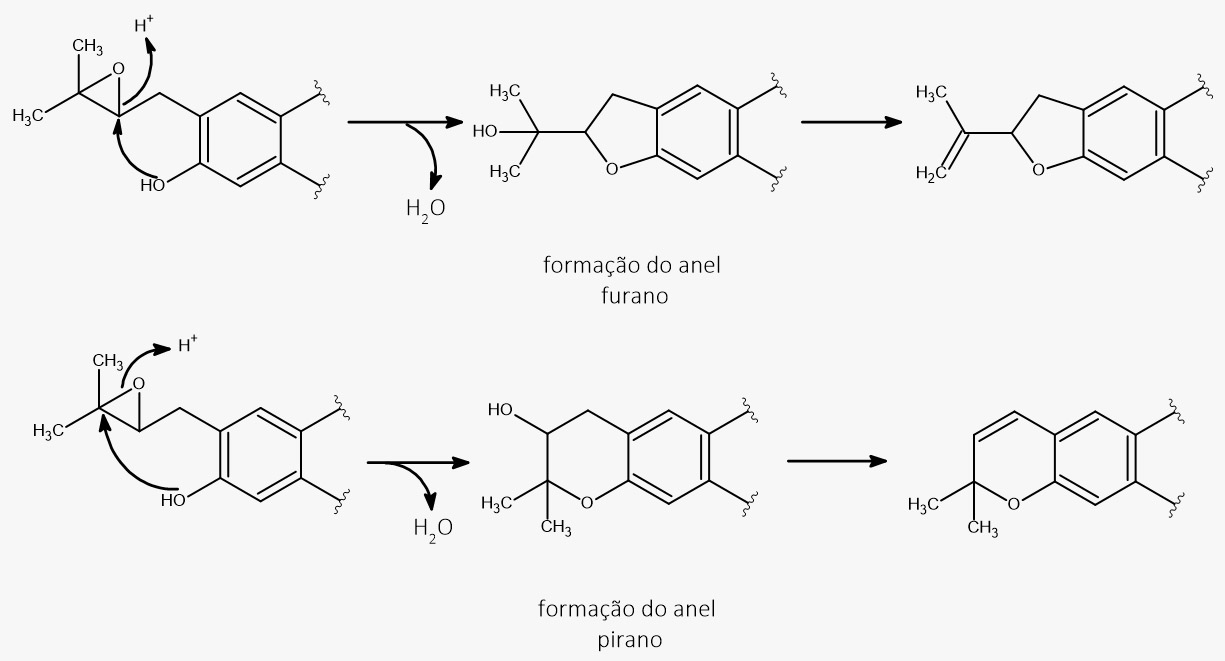
A biossíntese das piranocumarinas segue, basicamente, a mesma rota apresentada para a formação das furanocumarinas. A diferença, entretanto, encontra-se na posição em que acontece o ataque nucleofílico do fenol ao grupo epóxido.
Como podemos observar na imagem a seguir, esse ataque pode levar à formação de um anel furano, de cinco membros, e um anel pirano, de seis membros.
As furanocumarinas lineares (psoralenos) são fotossensíveis à luz ultravioleta, podendo levar a queimaduras solares. Entretanto, essa característica é muito utilizada medicinalmente para a pigmentação da pele e no tratamento da psoríase.
CARACTERÍSTICAS QUÍMICAS E MÉTODOS DE EXTRAÇÃO
A cumarina é um composto cristalino branco e volátil, com aroma de baunilha. É bem solúvel em solventes orgânicos (álcool etílico, éter dietílico e clorofórmio) e em gorduras e óleos, sendo o solvente mais comum na preparação dos extratos das soluções aquosas de etanol.
Os extratos, depois de evaporados e concentrados, são tratados com clorofórmio e éter de petróleo (ou éter dietílico), podendo formar furanocumarinas em suas formas cristalinas.
Para uma melhor separação e purificação de cumarinas simples, pode-se fazer extrações líquido-líquido com etanol:clorofórmio (3:97), acetato de etila e butanol e, em seguida, cromatografia em coluna com gel de sílica e eluição com solventes apolares.
Para furanocumarinas, pode-se utilizar coluna com óxido de alumínio e éter (ou clorofórmio:éter de petróleo 1:2) como eluente. O óxido de alumínio também é o melhor absorvente para a separação em cromatografia em camada delgada (normalmente feita com gel de sílica).
Saiba mais
As cumarinas absorvem no ultravioleta entre 220-350 nm e apresentam um espectro característico, influenciado pelo tipo e pelas posições dos seus substituintes. Por causa disso, as cumarinas são visualizadas na cromatografia em camada delgada, e o uso da espectrofotometria é um dos melhores métodos para determinação de cumarinas. Para identificação, a cromatografia líquida acoplada ao espectrômetro de massas é a melhor opção.
ATIVIDADE BIOLÓGICA
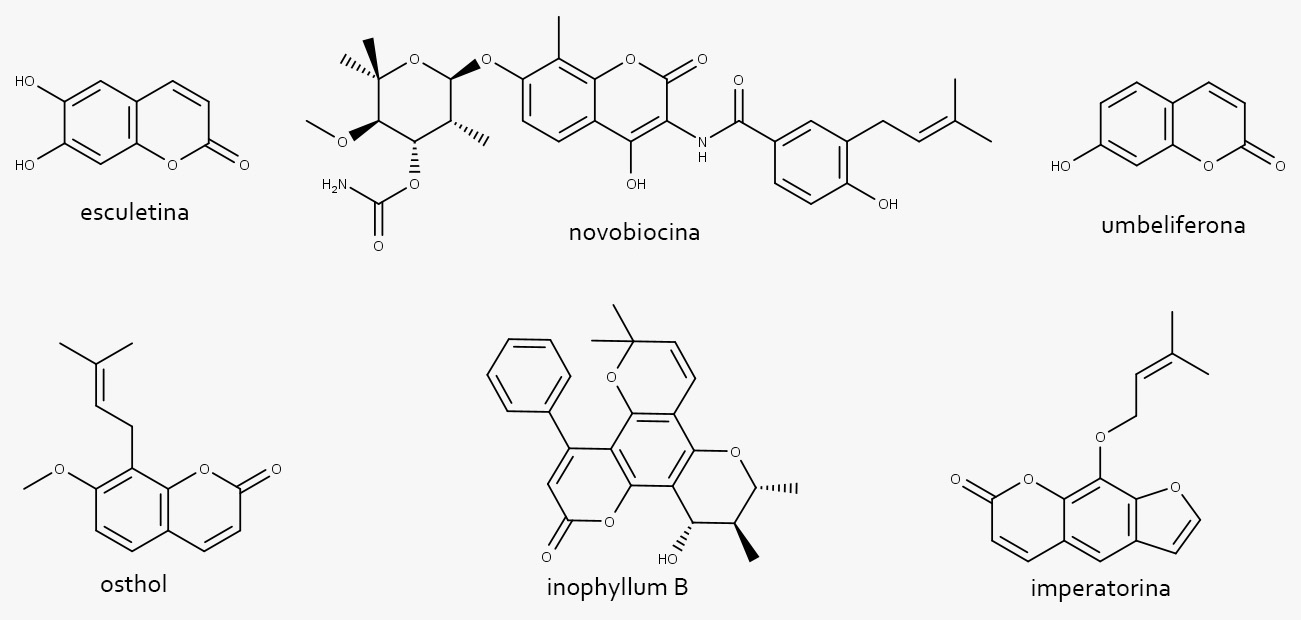
Algumas cumarinas e alguns de seus derivados apresentam importantes atividades biológicas descritas:
Estruturas de cumarinas com importantes atividades biológicas
Uma atividade muito conhecida das cumarinas é a atividade anticoagulante. Não pertence à cumarina natural, e sim a um de seus derivados, o dicumarol.
Dicumarol
O dicumarol é um antagonista da vitamina K que induz sua atividade anticoagulante devido à inibição da redução enzimática de vitamina K. Após a descoberta da ação anticoagulante do dicumarol, diversos derivados de cumarina foram sintetizados e testados, destacando-se entre eles a varfarina.
As furanocumarinas são utilizadas tradicionalmente no tratamento de doenças de pele, como psoríase e vitiligo. Entretanto, possuem alta toxicidade por conta da sua capacidade de se ligar às bases pirimídicas do DNA após absorver a luz ultravioleta, causando mutações.
A toxicidade é observada comumente na forma de fitofotodermatite, que se caracteriza por uma reação epidérmica com a formação de bolhas, hiperpigmentação, eritema e formação de vesículas. O tamanho da reação depende da concentração das cumarinas e pode acontecer tanto pela ingestão de vegetais ricos em cumarinas quanto pelo contato direto dos vegetais na pele.
Embora a toxicidade seja um problema, o uso de furanocumarinas para a repigmentação da pele leva a bons resultados, quando feito de maneira adequada pelo médico e pelo paciente. O paciente faz uso de cumarinas por via oral ou tópica e é submetido a uma exposição controlada de radiação ultravioleta.
A terapia PUVA, como é chamada, consiste na administração de uma furanocumarina e exposição do paciente à luz UVA. O resultado pode ser observado em determinado tempo de tratamento e deve ser cuidadosamente acompanhado por conta do risco de câncer de pele, devido ao alto potencial carcinogênico da terapia.
DROGAS VEGETAIS COM CUMARINAS
Veremos agora alguns exemplos de plantas que apresentam em sua composição fitoquímica compostos da classe das cumarinas, bem como outras informações importantes sobre suas aplicações terapêuticas.
Nome Popular: Guaco
Nome Científico: Mikania glomerata Sprengel
Droga Vegetal: Folhas Secas
Tintura e extrato contendo, no mínimo, 0,15% de cumarina.
- Cumarina
- Diterpenoides
- Fenilpropanoides
- Triterpenoides
- Flavonoides
- Saponinas
Ação broncodilatadora, antitussígena, expectorante e edematogênica sobre as vias respiratórias.
Tratamento da asma, bronquite e como adjuvante no combate à tosse.
Cumarinas.
Nome Popular: Gerânio sul-africano
Nome Científico: Pelargonium sidoides DC
Droga Vegetal: Raiz Seca
Extrato padronizado contendo 0,08%-0,32% de fenóis totais, expressos em epicatequina ou o equivalente a 6 μg de umckalina por mL da tintura.
- Taninos (cerca de 9%)
- Cumarinas (incluindo umckalina)
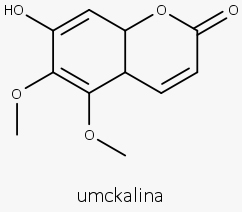
Atividade antibacteriana, antiviral, imunomoduladora.
Tratamento de infecções agudas e crônicas do trato respiratório e ouvido, infecções de nariz e garganta como rinofaringites, amigdalites, sinusites e bronquites.
Cumarinas.
Para conhecer mais profundamente a biossíntese das cumarinas e os tipos de cumarinas formados, assista ao vídeo apresentado pela especialista Barbara Rocha.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Identificar a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de flavonoides, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
FLAVONOIDES
Aspectos gerais e distribuição dos flavonoides
O termo flavonoide corresponde a um grupo grande de substâncias polifenólicas caracterizadas por uma estrutura benzo-γ-pirano e a 60% dos polifenóis presentes na alimentação humana.
Flavonoides polifenóis bioativos apresentam potencial antioxidante e ação imunomoduladora. Diversos estudos indicam que uma dieta rica em flavonoides pode reduzir a incidência de doenças relacionadas ao envelhecimento.
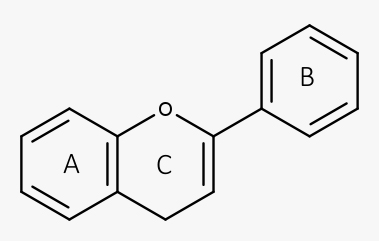
Estruturalmente, possuem um esqueleto comum C6-C3-C6, em que os dois anéis aromáticos são unidos por três carbonos e um oxigênio.
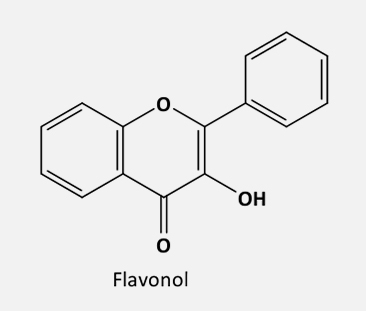
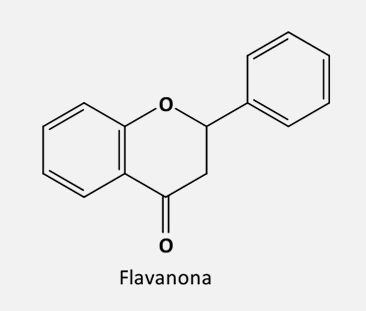
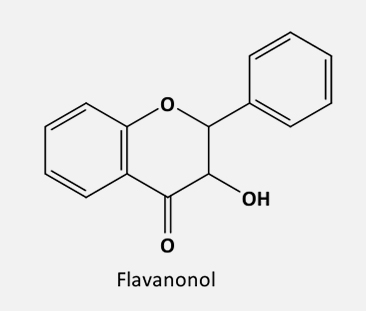
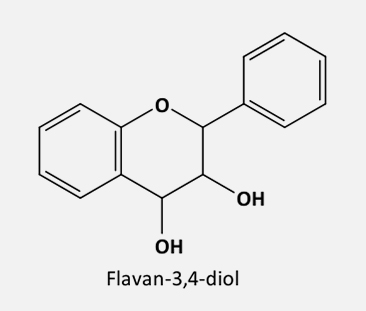
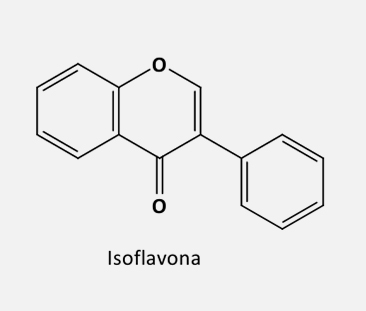
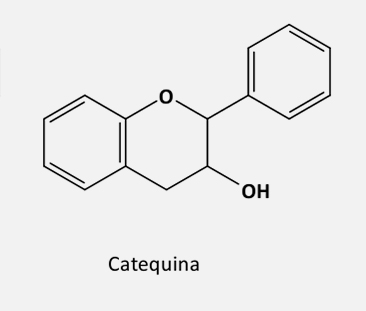
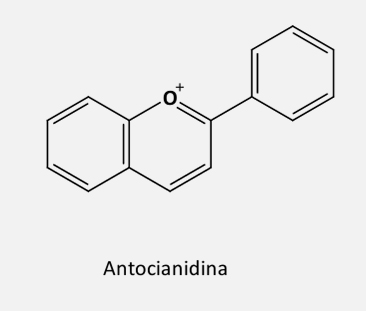
De acordo com o grau de insaturação e oxidação do anel C, os flavonoides são divididos em várias subclasses:
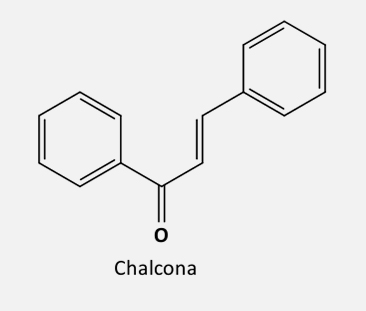
Chalconas são precursoras de flavonoides e possuem em sua estrutura dois anéis de aromáticos conectados por uma estrutura carbonila α, β-insaturada, de três carbonos.
Saiba mais
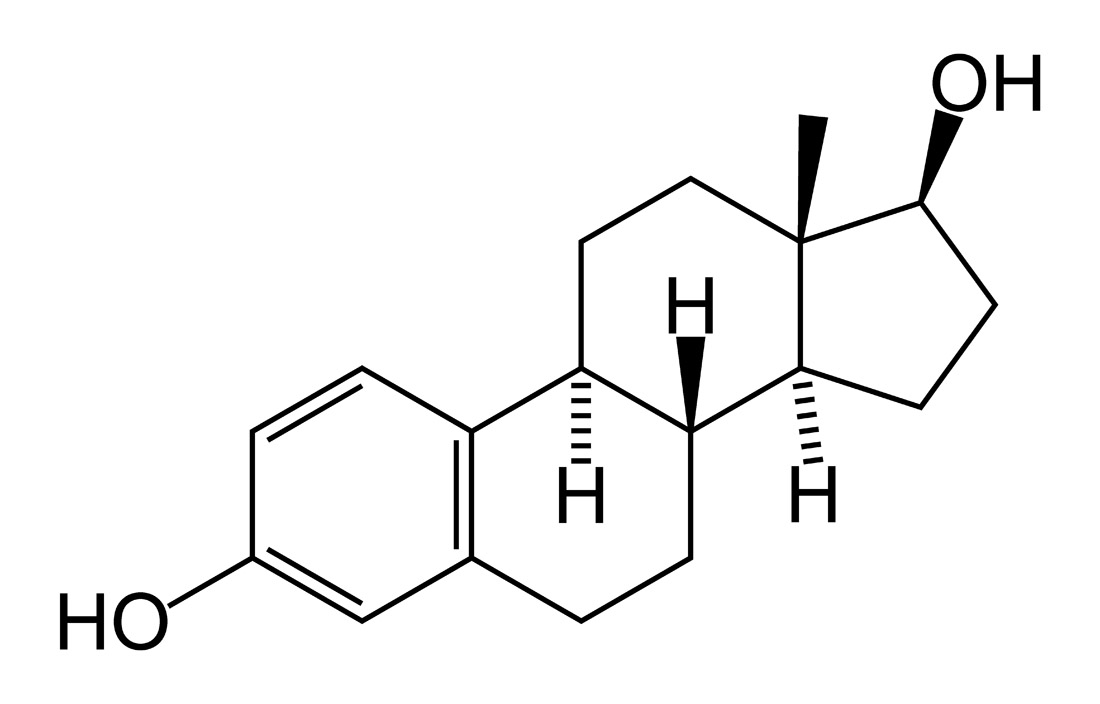
A estrutura da isoflavona é muito semelhante à do estrogênio.
1
Os flavonoides são, normalmente, hidroxilados nas posições 3, 5, 7, 3’, 4’ e 5’ e frequentemente um ou mais grupos hidroxilas podem estar metilados, acetilados, prenilados, glicosilados ou sulfatados. Quando não possuem açúcares ligados, os flavonoides são chamados de agliconas; quando possuem, são chamados de glicosídeos.
Os glicosídeos podem estar na forma O- ou C-glicosídeos. Porém, ligações O-glicosídicas são mais comuns do que ligações C-glicosídicas. Os O-glicosídeos possuem a porção açúcar ligada a um dos grupos hidroxilas da aglicona (mais comumente nas posições 3 e 7), ao passo que os C-glicosídeos possuem a ligação glicosídica através de um carbono (geralmente na posição C-6 ou C-8). Podem existir ainda resíduos acila como malonato, acetato e cinamato, entre outros, ligados aos açúcares.
2
3
Os flavonoides estão presentes em todas as plantas que realizam fotossíntese e por isso fazem parte de quase todas as plantas do reino vegetal. A maioria das plantas vasculares contém flavonoides, e já há relatos, na literatura, de isolamento desses compostos a partir de briófitas, pteridófitas, gimnospermas e angiospermas. São encontrados em frutas, folhas, sementes, troncos, flores, assim como em produtos obtidos a partir de plantas, como chás, vinhos, mel e própolis.
De um modo geral, os flavonoides são necessários para o desenvolvimento normal das plantas. Encontram-se nos cloroplastos e estão envolvidos com a expressão de diversas enzimas. São um grupo de substâncias coloridas, podendo gerar cores desde as mais claras, como branco e marfim, até as mais vibrantes, como vermelhos e laranjas, e, por conta disso, uma de suas funções nas flores é promover uma coloração e um odor atrativos aos polinizadores, para que seja feita a dispersão das sementes.
4
5
Também estão correlacionados com o papel de defesa, sinalização química e regulação de enzimas da planta. Seu papel de defesa consiste na proteção frente a microrganismos patógenos, como fungos e bactérias, a insetos e outros animais herbívoros, da radiação UV-B ou ao efeito de outras plantas (atividade alelopática). Como sinalizadores químicos, atuam como uma resposta às condições de estresse biótico e abiótico.
BIOSSÍNTESE E CLASSIFICAÇÃO ESTRUTURAL
A biossíntese dos flavonoides está esquematizada na imagem abaixo. Note que os compostos estão identificados pela classe à qual pertencem:
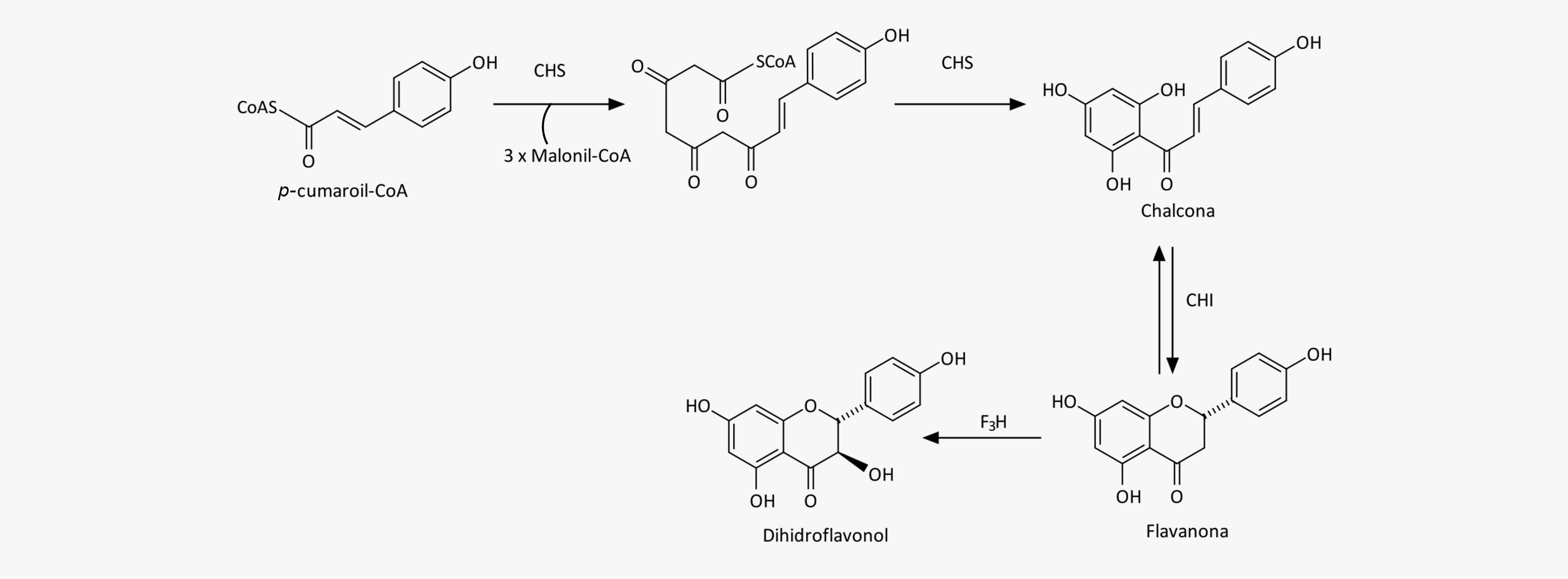
Vejamos a seguir como ela ocorre, etapa por etapa:
Etapa 1
A biossíntese dos flavonoides começa, de fato, com a condensação de uma unidade do p-cumaroil-CoA com três unidades do malonil-CoA por descarboxilações sequenciais promovidas pela enzima chalcona sintase (CHS), formando uma chalcona. As hidroxilas nas posições 5 e 7 do anel A, muito comuns nos flavonoides, são geradas por essa enzima nesse estágio.
Etapa 2
O próximo passo é a formação de uma flavanona pela ação da enzima chalcona isomerase (CHI), que converte a chalcona em uma (2S)-flavanona ao fechar o anel C por uma isomerização estereoespecífica.
Etapa 3
Em seguida, a enzima flavanona 3-hidroxilase (F3H) faz uma 3-hidroxilação estereoespecífica, gerando o di-hidroflavonol.
Tanto a chalcona quanto a flavanona e o dihidroflavonol servirão de intermediários para a biossíntese das outras classes de flavonoides, de acordo com o metabolismo de cada espécie vegetal. Porém, quando a enzima F3H não é expressa ou então é inativa, as flavanonas serão predominantes e as demais classes de flavonoides não serão encontradas.
As flavonas são derivadas das flavanonas por uma redução no anel C, catalisada por duas enzimas flavona sintase (FNSI e FNSII), enquanto os flavonóis são sintetizados a partir dos dihidroflavonóis pela ação da enzima flavonol sintase (FLS).
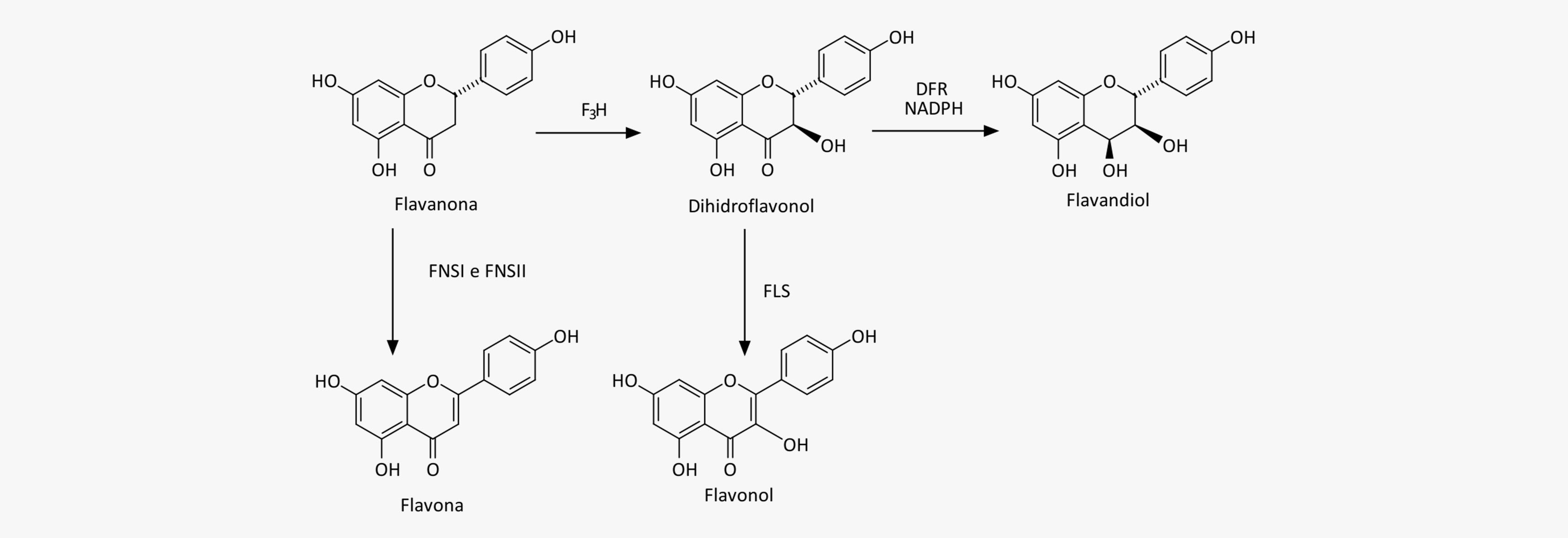
Você sabia
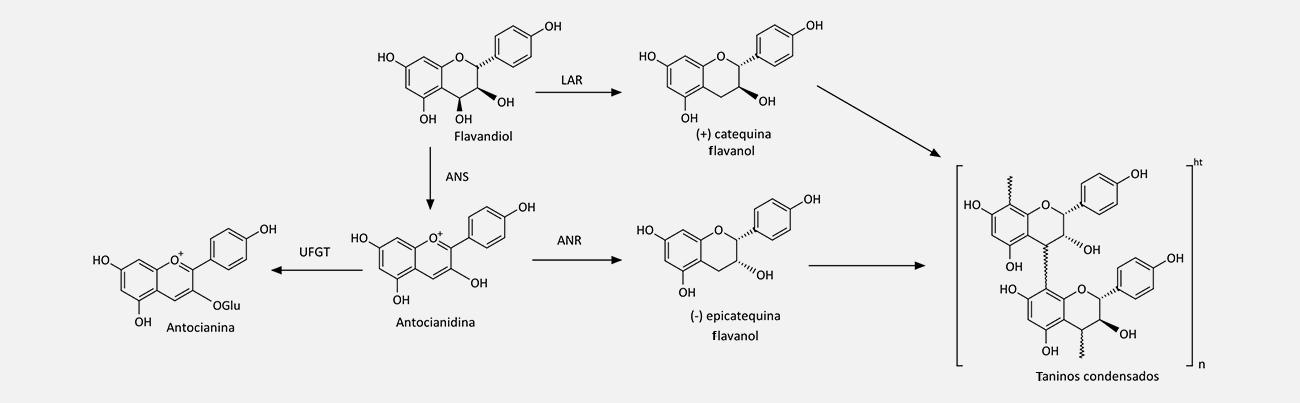
Os flavandióis não são tão facilmente encontrados no reino vegetal, uma vez que atuam como precursores de outras classes de flavonoides. Eles são formados a partir dos dihidroflavonóis através da enzima dihidroflavonol redutase (DFR), em uma reação NADPH-dependente.
As isoflavonas são sintetizadas a partir das chalconas, primeiramente a partir da ação da enzima chalcona redutase, formando uma deoxichalcona. Esse intermediário sofre ação das enzimas chalcona isomerase (CHI) e isoflavona sintase (IFS), formando a isoflavona.
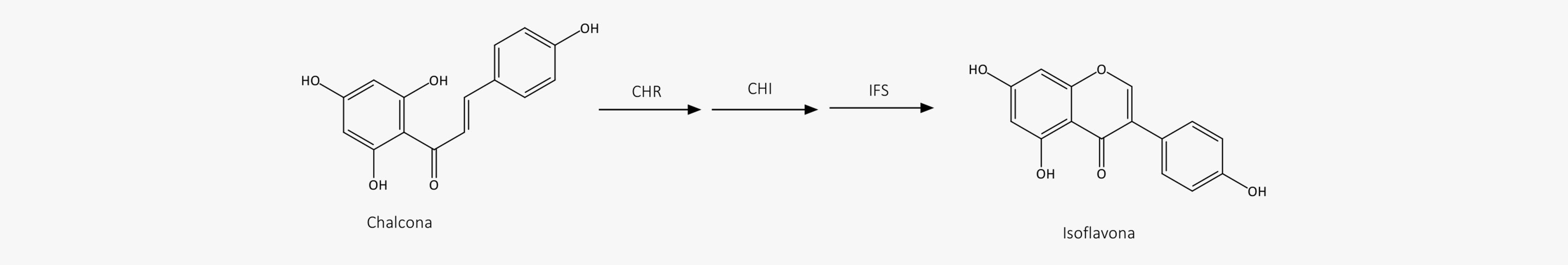
As isoflavonas são um grupo de fitoestrógenos que apresentam semelhança estrutural e/ou funcional com o 17-estradiol, sendo conhecidos por terem importante ação estrogênica ou antiestrogênica. Esse é um grupo de flavonoides com o anel B ligado em C-3 em vez de C-2. Alguns dos principais isoflavonoides são:
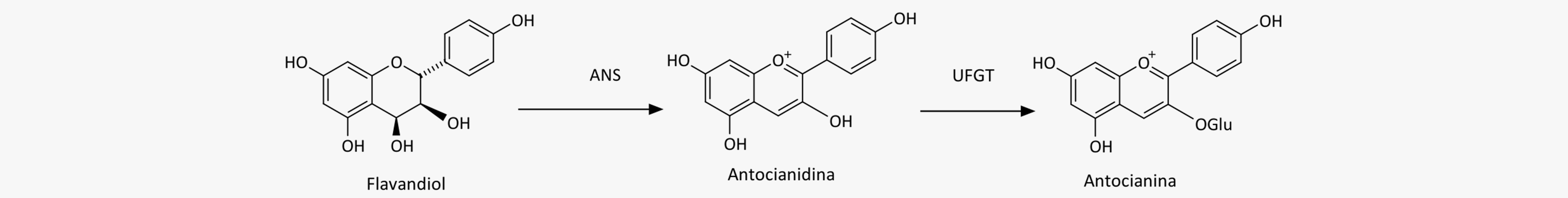
As antocianidinas são sintetizadas a partir do flavandióis pela ação da enzima antocianidina sintase (ANS). Através da enzima UDP-glicose-flavonoide 3-O-glicosiltransferase (UFGT) formam as antocianinas.
As antocianidinas são bem conhecidas por suas cores características em frutas e flores, variando de azul e roxo à laranja e vermelho, por conta da presença de conjugados a partir das reações entre agliconas antocianidinas e ácidos orgânicos. Esses compostos se localizam, principalmente, na epiderme vegetal e atuam tanto como fotoprotetores quanto como atrativos para polinizadores ou organismos dispersores de sementes.
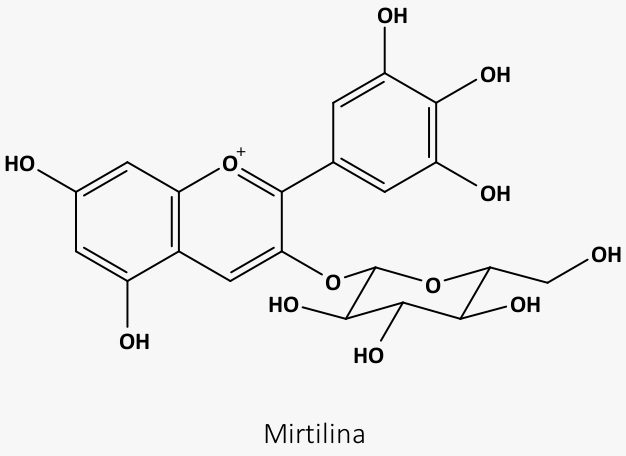
Uma antocianina conhecida é a mirtilina, presente nas flores de hortênsias (Hydrangea macrophylla). Essa espécie apresenta flores rosadas ou azuis, dependendo do pH do solo:
Essa variação se dá devido à formação de complexos organometálicos entre íons de alumínio e a mirtilina.
Em solos de pH mais ácido, o alumínio está mais disponível, complexando com a antocianina, o que a torna azul. Em solos de pH mais básico, o alumínio está menos disponível e a antocianina fica em seu estado livre, que é de cor rosa.
CARACTERÍSTICAS QUÍMICAS E MÉTODOS DE EXTRAÇÃO
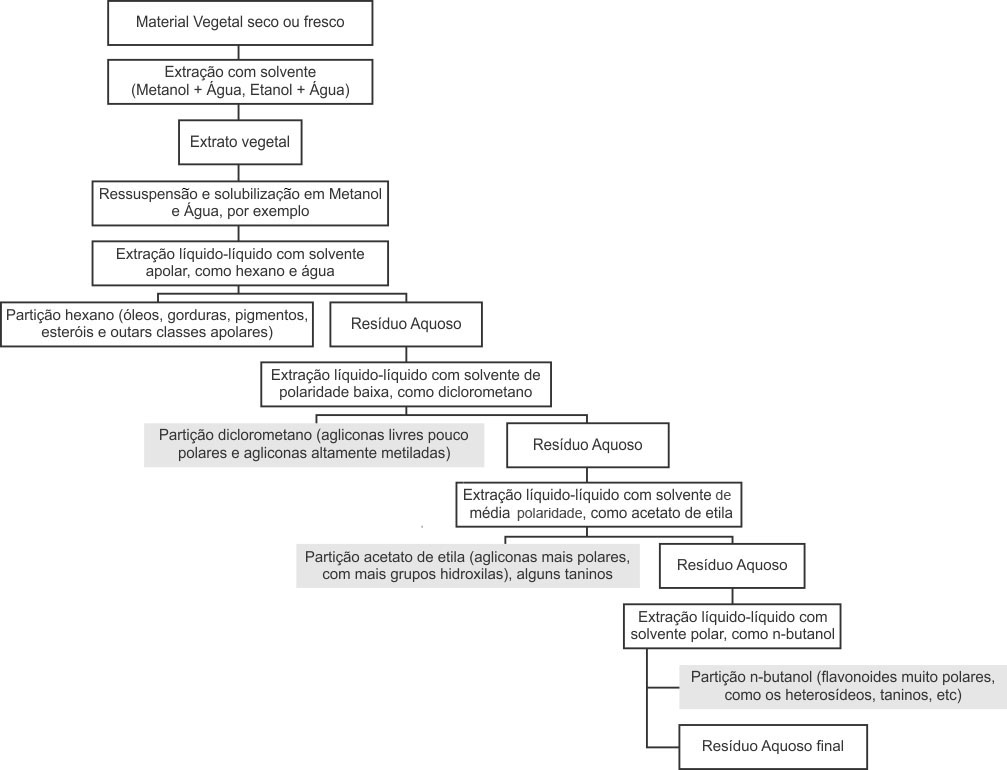
Uma vez que o grupo dos flavonoides é bem diversificado, sua completa extração e isolamento precisa de muitas etapas.
A primeira envolve secar, congelar ou liofilizar o material vegetal e mantê-lo longe da luz, uma vez que pode reagir com a luz e o oxigênio. A extração pode ser feita com etanol e água por maceração ou percolação, por exemplo, sendo essa solução uma mistura capaz de extrair quase todos os flavonoides da amostra.
Depois de preparado o extrato bruto, são necessárias purificações para se obter um flavonoide específico. Por causa da ampla variedade estrutural encontrada nessa classe de compostos, a extração líquido-líquido com solventes de diferentes graus de polaridade é muito utilizada para a separação das subclasses de flavonoides presentes em um mesmo extrato vegetal. O que torna isso possível é que cada tipo de flavonoide terá mais ou menos solubilidade em determinado solvente, assim como a presença de grupos substituintes pode tornar o flavonoide mais apolar (como ocorre com a presença de grupos metoxilas) ou mais polar (como ocorre com a presença de glicosídeos).
Etapas para isolamento e identificação de um flavonoide
Os flavonoides, assim como outros compostos fenólicos, absorvem no ultravioleta, podendo também ser observados por meio de cromatografia em camada delgada.
Seu sistema de eluição depende das características estruturais dos flavonoides presentes na amostra, podendo ser mais ou menos polares.
Após a eluição e a secagem, a placa cromatográfica deve ser observada sob luz ultravioleta nos comprimentos de onda curto (254 nm) e longo (365 nm) e, em seguida, podem ser utilizados também reagentes cromatogênicos.
Por exemplo:
NP “Natural Products” (solução de 2-aminoetildifenilborato em etanol a 1mg/ml) + PEG (solução de polietilenoglicol 4000 a 5% em etanol): amarelo, laranja e verde para flavonoides.
Cloreto de ferro (III) (FeCl3) 1% alcoólico: azul, verde, marrom ou vermelho para todos os compostos fenólicos.
Cloreto de ferro (III) (FeCl3) 1% aquoso: azul para todos os compostos fenólicos.
Nitrato de prata (AgNO3), amoniacal 5% em acetona: preto para todos os compostos fenólicos.
Vanilina clorídrica 0,1%: rosa para muitos compostos fenólicos.
Há também a possibilidade de realizar ensaios cromáticos nas amostras em ensaios preliminares de análise. Os compostos fenólicos reagem de maneira distinta entre si frente a um mesmo reagente, possibilitando a distinção entre as classes presentes na amostra.
Para flavonoides utiliza-se muito o teste de cianidina ou shinoda. O teste consiste em adicionar à amostra um ácido, como o clorídrico, e em seguida um fragmento de magnésio. Os flavonoides presentes na amostra são reduzidos e geram compostos de coloração avermelhada e azulada (antocianidinas).
Atenção
Essa reação não ocorre com chalconas e isoflavona.
Outro ensaio cromático é com adição de ácido sulfúrico concentrado:
Formam sais de oxônio, que se precipitam com adição de água.
Formam soluções amarelas.
Formam soluções vermelhas e laranjas.
Formam soluções de cor vermelha e vermelho-escuro.
Um método muito popular para determinar o teor de flavonoides é com o reagente de Folin-Ciocalteau. Apesar de muito utilizado, ele dá positivo para outros polifenóis, podendo fornecer valores diferentes da real quantidade de flavonoides. O método consiste na determinação espectrofotométrica de polifenóis totais em uma amostra pela medida da absorbância de uma mistura da solução da amostra, reagente Folin-Ciocalteu e solução de NaOH-Na2CO3.
Essa mistura, quando em contato com uma amostra contendo fenólicos, resulta em uma coloração azul, que pode ser medida no espectrofotômetro a 660 nm. Esse método pode ser utilizado para determinações espectrofotométricas e quantificação dos fenóis totais, a partir da construção de uma curva de calibração. O resultado é expresso como g EAG/ 100 g de extrato, onde EAG = equivalente de ácido gálico.
Os flavonoides são analisados e identificados por cromatografia líquida de alta eficiência (CLAE) com detector de ultravioleta ou com o CLAE acoplado a um espectrômetro de massas. O CLAE/UV é muito útil, uma vez que as subclasses de flavonoides absorvem a luz ultravioleta em diferentes comprimentos de onda, podendo assim diferenciá-las pelo seu espectro de ultravioleta.
O espectro de absorção característico, conforme o esquema representativo abaixo, possui dois máximos de absorção (chamados de bandas): o primeiro entre 300-400 nm (banda I) e o segundo entre 240-285 nm (banda II).
Em geral, atribui-se a banda II ao anel A da estrutura do flavonoide, e a banda I ao anel B. Com isso, temos os valores de absorção para as subclasses de flavonoides indicados na tabela:
|
Subclasse |
Estrutura básica |
Absorção (nm) – Banda I |
Absorção (nm) – Banda II |
|
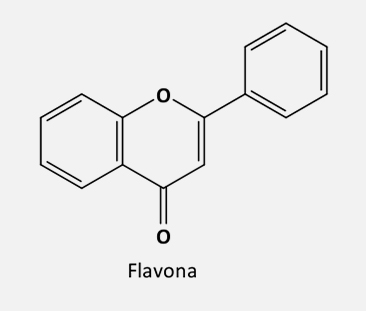
Flavona |
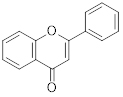
|
304-350 |
240-285 |
|
Flavonol |
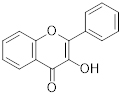
|
352-385 |
240-285 |
|
Dihidroflavonol |
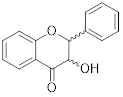
|
240-285 |
|
|
Flavanona |
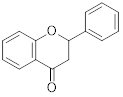
|
Baixa intensidade/ ombro na banda II |
240-285 |
|
Isoflavona |
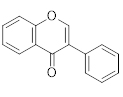
|
240-285 |
|
|
Chalcona |
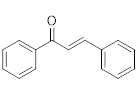
|
340-390 (grande) |
220-270 (pequena) |
|
Aurona |
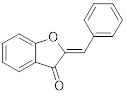
|
Alta absorção |
Muito pequena |
|
Antocianinas |
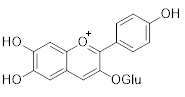
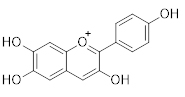
|
465-550 |
270-280 (pequeno) |
|
Antocianidinas |
|
465-550 |
270-280 (pequeno) |
Valores de absorção para as subclasses de flavonoides. Extraída de: Zuanazzi e Montanha (2004).
A presença de substituintes nos anéis altera os valores dos comprimentos de onda. Em geral, um aumento do número de hidroxilas faz com que a absorção ocorra em um comprimento de onda mais alto.
Metilação e esterificação não alteram os valores dos comprimentos de onda, exceto quando nas posições C-3 e C-4’, onde ocorre a diminuição dos valores dos comprimentos de onda.
ATIVIDADE BIOLÓGICA
Suas atividades farmacológicas estão relacionadas às suas características estruturais, principalmente sua capacidade de eliminar radicais livres e de formar complexos com metais.
As hidroxilas em posição orto no anel B conferem uma alta capacidade de deslocalizar elétrons, uma vez que estão conjugadas à carbonila, o que também funciona como sítio de ligação com metais.
Além disso, a atividade antioxidante aumenta à medida que o número de hidroxilas aumenta, especialmente nas posições 3, 4 e 5 do anel B. A presença de um grupo carbonila na posição 4 e de uma hidroxila na posição 3 do anel C, conjugados juntamente com uma ligação dupla na posição C-2 e C-3 do anel C, aumenta ainda mais a atividade antioxidante.
O efeito antioxidante também é considerado um dos motivos pelo qual os flavonoides possuem um papel na diminuição do risco de doenças cardiovasculares. Flavonoides são capazes de:
- Reduzir a oxidação de lipoproteínas de baixa densidade (LDL).
- Prevenir a disfunção endotelial, a agregação e adesão de plaquetas, a migração e a proliferação de células musculares lisas.
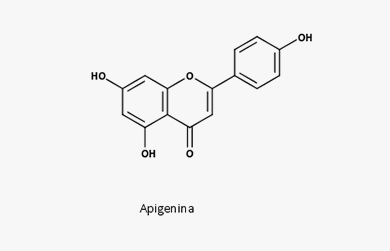
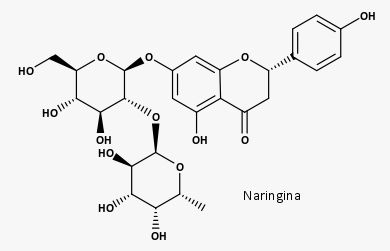
Sua atividade antidiabética, principalmente da naringina, se dá pela regulação da secreção de insulina, sinalização da insulina e digestão de carboidratos. Há ainda atividade neuroprotetiva (como isoquercitrina e rutina, os glicosídeos da quercetina) e antiepilética (derivados de flavona), antibacteriana (flavonas e flavononas), antitumoral e anti-inflamatória (apigenina, por exemplo) e antienvelhecimento cutâneo (por exemplo, glicosídeos de isorhamnetina).
Você sabia
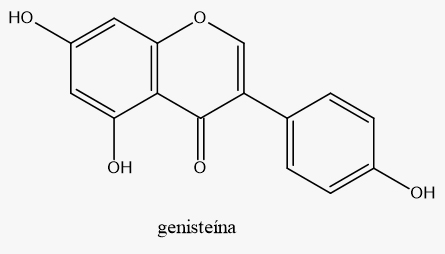
Os isoflavonoides são capazes de, além da atividade fitoestrogênica, promover diversos processos biológicos e eliminar os radicais livres.
A genisteína desempenha um papel importante na prevenção do câncer de próstata e de mama e foi sugerida como um suplemento dietético para mulheres na menopausa.
DROGAS VEGETAIS COM FLAVONOIDES
Veremos agora alguns exemplos de plantas que apresentam em sua composição fitoquímica compostos da classe dos flavonoides, bem como outras informações importantes sobre suas aplicações terapêuticas.
Nome Popular: Ginkgo
Nome Científico: Ginkgo biloba L.
Droga Vegetal: Folhas
Extrato padrão contendo flavonoides (22% a 27%) expressos em quercetina, kaempferol e isoramnetina; e terpenolactonas (5% a 7%) expressos em ginkgolídeos A, B, C e bilobalídeo.
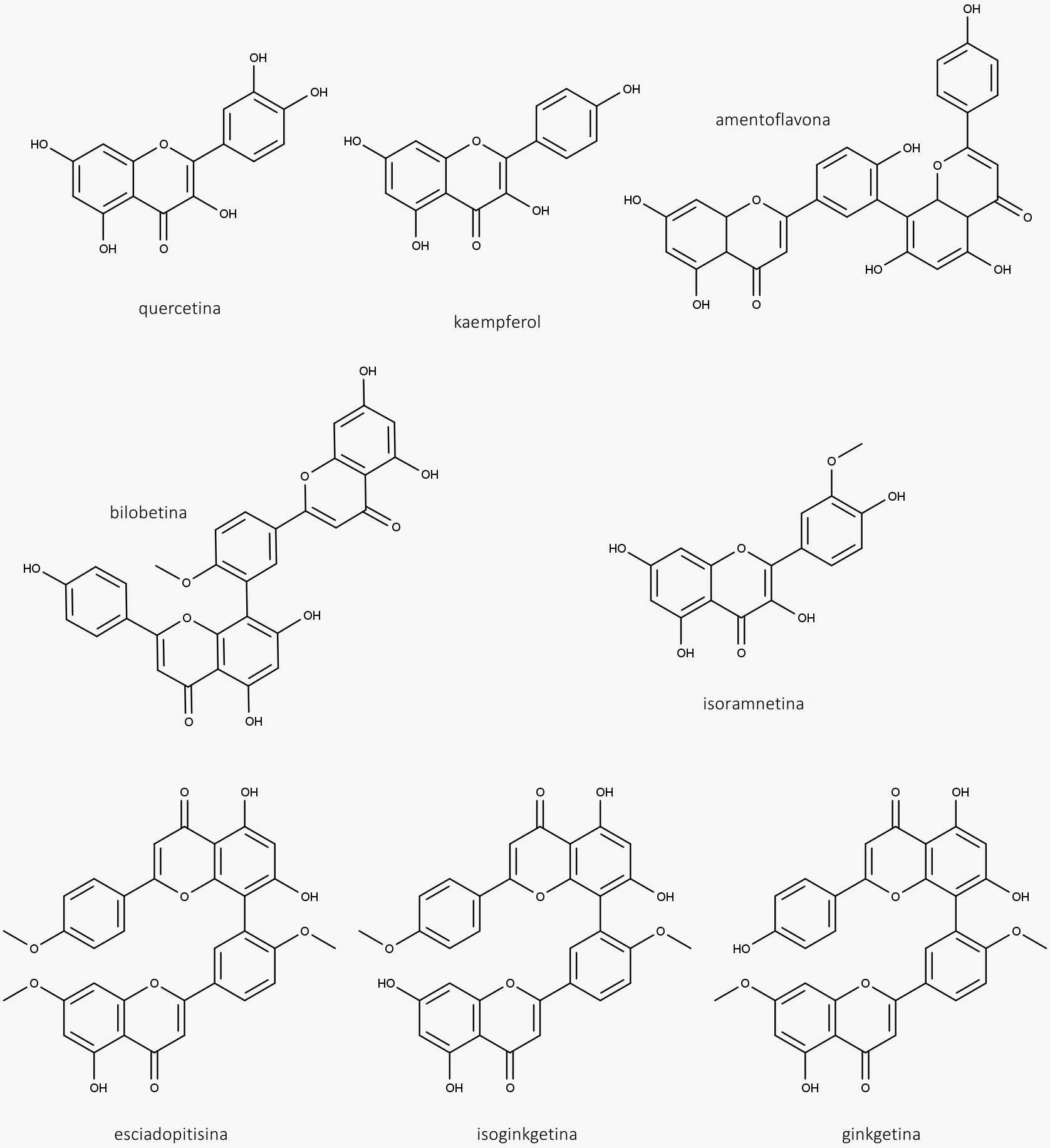
- Flavonoides e biflavonoides (derivados da quercetina, kaempferol e isoramnetina)
- Terpenolactonas (ginkgolídeos e bilobalídeos)
Aumenta o fluxo sanguíneo e, também, a oferta de oxigênio para as células, protegendo os tecidos dos danos da falta de oxigênio, além de inibir a agregação plaquetária e combater os radicais livres.
Usada tradicionalmente no tratamento da diminuição intelectual patológica de idosos; e no tratamento de vertigens e zumbidos resultantes de distúrbios circulatórios, distúrbios circulatórios periféricos e insuficiência vascular cerebral.
Diterpenos e flavonoides.
Nome Popular: Maracujá
Nome Científico: Passiflora alata Curtis e Passiflora edulis Sims
Droga Vegetal: Folhas Secas
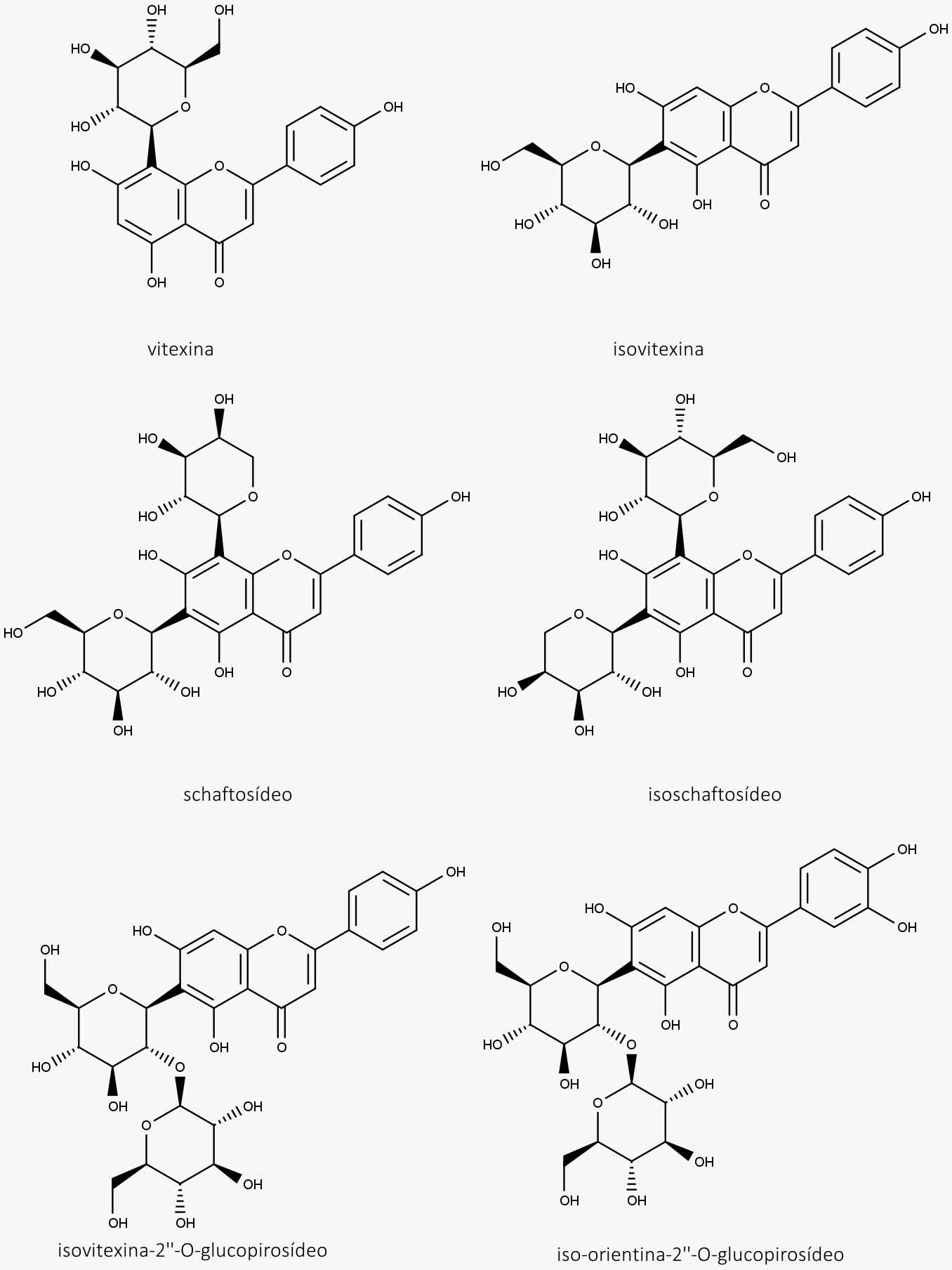
Extrato e tintura devem conter, no mínimo, 1% de flavonoides totais, expressos em vitexina.
- Fitosteróis
- Heterosídeos cianogênicos
- Alcaloides indólicos (menos de 0,03%)
- Flavonoides (di-C-heterosídeos de flavonas até 2,5%, vitexina e apigenina)
- Cumarinas
Efeito ansiolítico/sedativo leve.
Ansiolítico/sedativo leve.
No vídeo a seguir, a especialista Barbara Rocha apresentará mais detalhes sobre a biossíntese dos flavonoides, suas classes, sua importância e citará algumas plantas que os contêm.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de taninos, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
TANINOS
Aspectos gerais e distribuição dos taninos
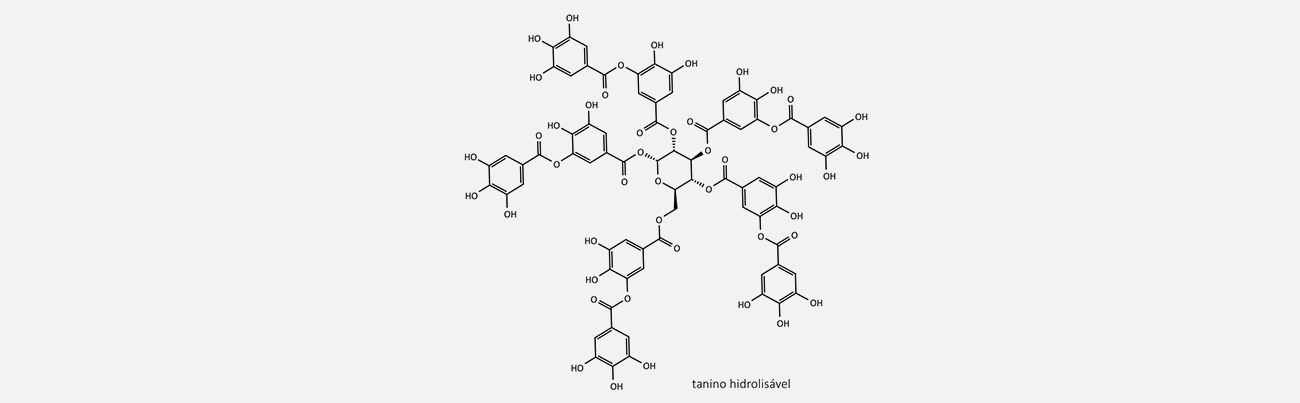
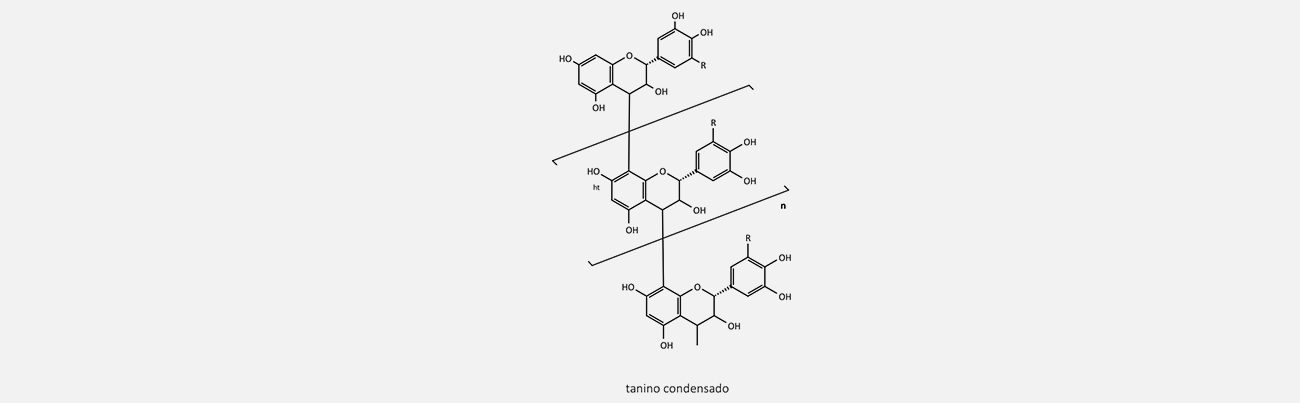
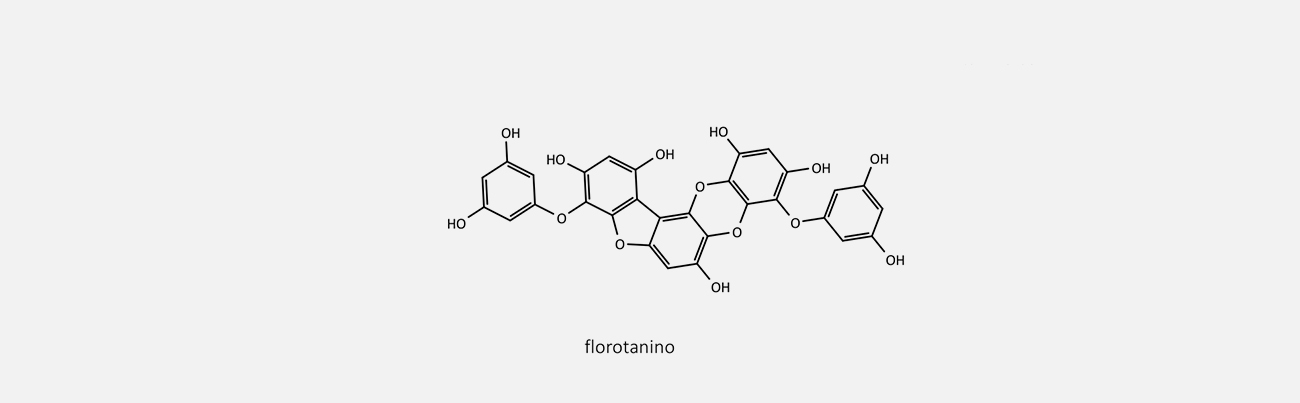
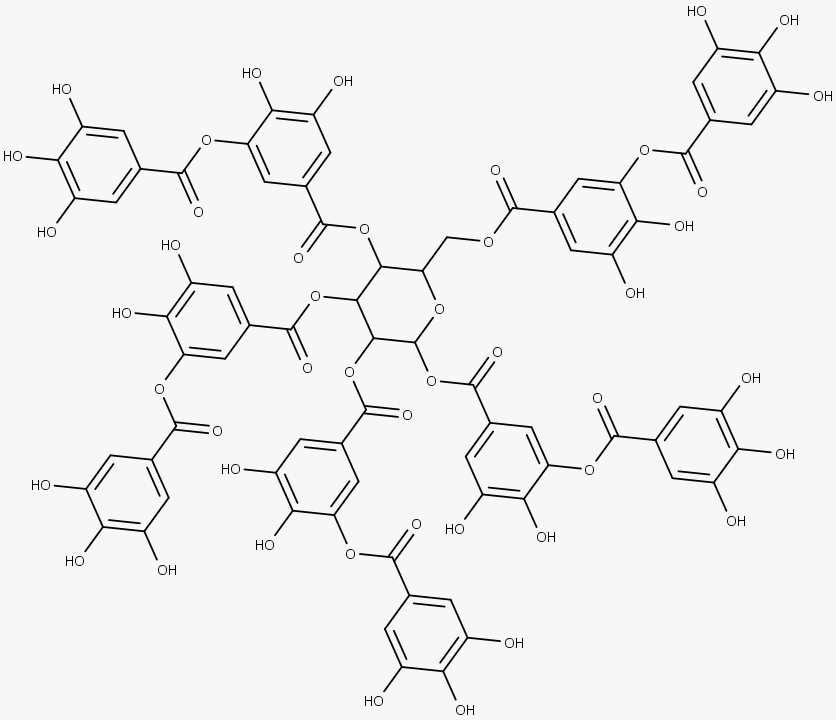
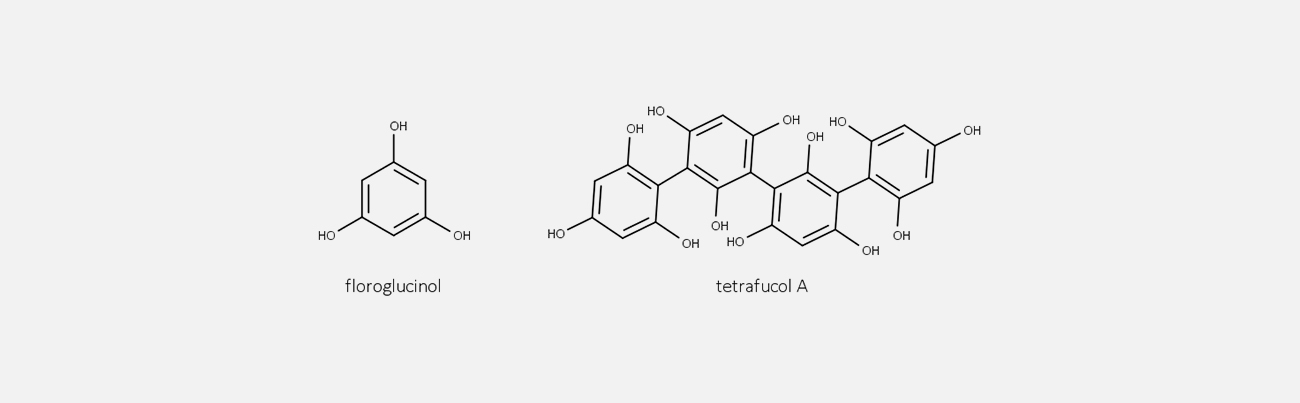
Os taninos são polifenóis complexos que se dividem em três classes: taninos hidrolisáveis, proantocianidinas (também conhecidos como taninos condensados) e florotaninos.
São caracterizados por possuírem em sua estrutura múltiplos ésteres de ácido gálico.
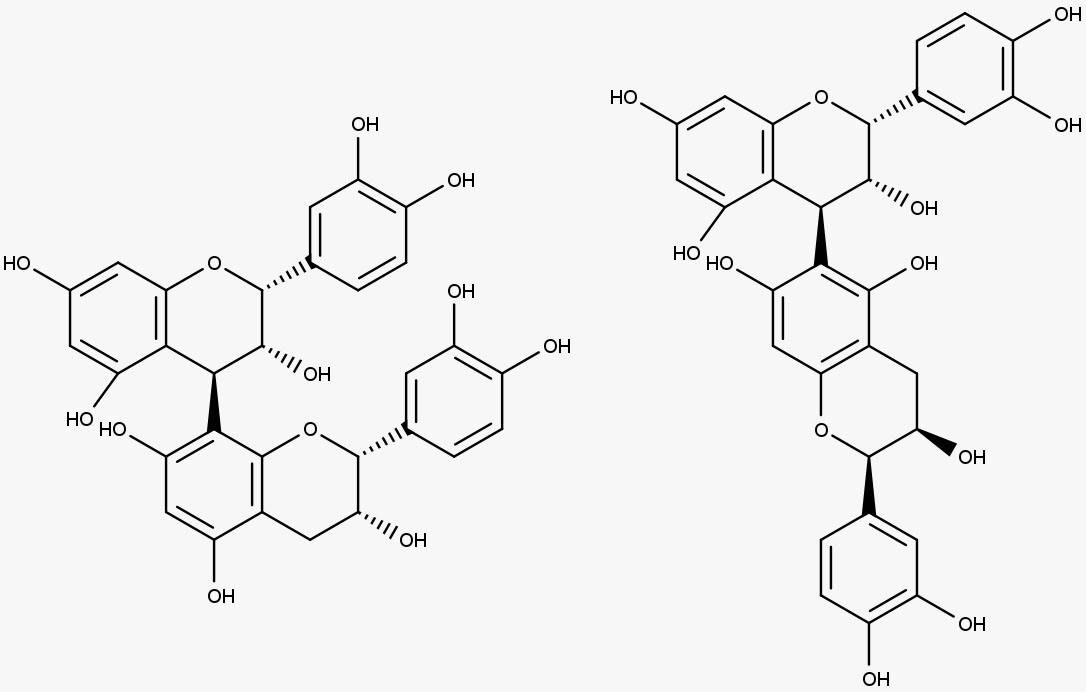
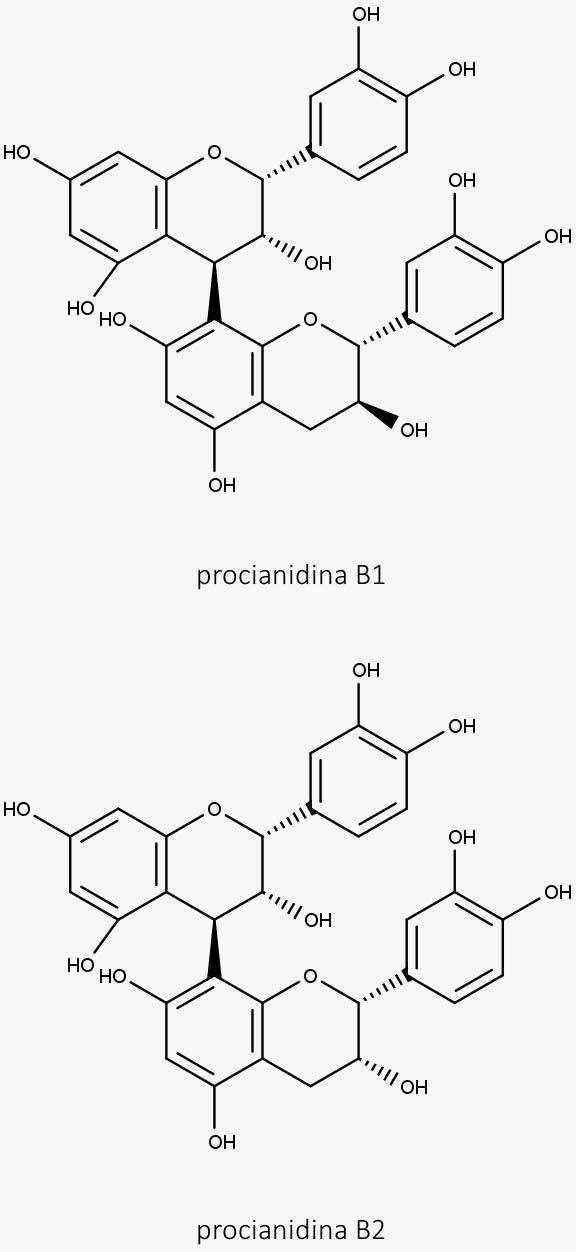
São polímeros formados por unidades monoméricas de flavan-3-ols conectadas por ligações C-4-C-8 e às vezes C-4-C-6.
São polímeros formados a partir de unidades floroglucinol e apresentam algumas características semelhantes às dos taninos condensados e hidrolisáveis.
Os taninos fazem parte de um dos metabólitos secundários mais presentes nas plantas, sendo o quarto grupo mais presente, estando apenas em menor quantidade que a celulose, hemiceluloses e ligninas. Tradicionalmente, as plantas ricas em taninos são utilizadas no curtimento de couro.
Os taninos condensados são os mais encontrados nos alimentos.
Exemplo
Nas sementes de uva, maçãs, frutas vermelhas, vinho tinto, chocolate, cacau e outros. Eles estão em maior quantidade nas plantas do que os taninos hidrolisáveis e possuem estruturas complexas em comparação com taninos hidrolisáveis.
BIOSSÍNTESE E CLASSIFICAÇÃO ESTRUTURAL
Os taninos hidrolisáveis são amplamente distribuídos na natureza e caracterizados por múltiplos ésteres de ácido gálico com glicose, dividindo-se em duas classes:
Galotaninos
Elagitaninos
Os galotaninos são compostos de ésteres de ácido gálico, enquanto os elagitaninos são compostos de ésteres de ácido elágico. O mais comum dos galotaninos é o ácido tânico.
Enquanto os galotaninos são formados quando os grupos galoíla são esterificados, os elagitaninos são formados por meio de acoplamento intramolecular, formando ligações C-C e C-O-C entre os resíduos galoíla de glucogaloíla.
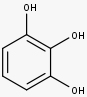
Os taninos condensados são polímeros formados por unidades flavan-3-ols conectadas via ligações C-4-C-8 e, às vezes, pelas ligações C-4-C-6.
CARACTERÍSTICAS QUÍMICAS E MÉTODOS DE EXTRAÇÃO
Os diversos grupos hidroxila que existem na estrutura dos taninos condensados são responsáveis pela forte interação dos taninos com proteínas e íons metálicos, precipitando-os.
As interações entre taninos e proteínas podem ocorrer por meio de ligações covalentes ou iônicas, interação hidrofóbica ou ligações de hidrogênio. A estabilidade do complexo tanino-proteína vai depender do número de taninos ligados e número de sequências de aminoácidos repetidas. De um modo geral, quanto maior o número de grupos polifenóis galoíla, maior a eficácia da ligação.
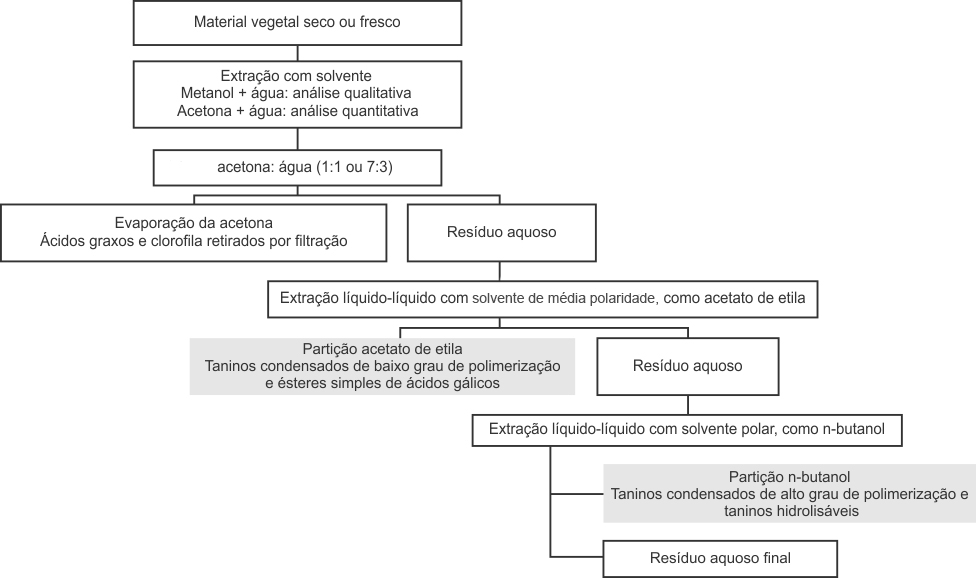
Taninos são solúveis em água, bases diluídas, álcool, glicerol e acetona, mas muito pouco solúveis em solventes orgânicos. Desse modo, a extração de taninos de plantas é feita, normalmente, utilizando-se solventes polares como etanol, metanol, acetona ou misturas aquosas destes solventes.
Taninos condensados de baixo grau de polimerização e ésteres simples de ácido gálicos são extraídos com acetato de etila. A extração de taninos pode seguir um processo muito semelhante ao processo de extração de flavonoides, porém os taninos se concentram nas partições mais polares, como acetato de etila e n-butanol.
Esquema do processo de extração de taninos
Saiba mais
Após a extração por solvente, a separação dos taninos pode ser feita com cromatografia em coluna. Deve-se atentar que, devido à sensibilidade à luz, a extração de taninos condensados deve ser feita protegida da luz, para diminuir o risco de hidrólise durante o processo.
Não existe nenhum teste específico para detecção colorimétrica de todos os taninos. Entretanto, existem alguns métodos bastante utilizados. Em soluções com sais de ferro (FeCl3), taninos hidrolisáveis (gálicos e elágicos) formam um precipitado de azul a negro, enquanto taninos condensados formam precipitados de marrom a verde. Conheça dois desses métodos:
Utilização de solução de vanilina-HCl
Em contato com os taninos condensados, reage formando uma coloração vermelha.
Tratamento de dimetilaminobenzaldeído
Na presença de taninos condensados, formam compostos de coloração azulada.
Esses métodos são utilizados para determinações espectrofotométricas e quantificação desses taninos, a partir da construção de uma curva de calibração.
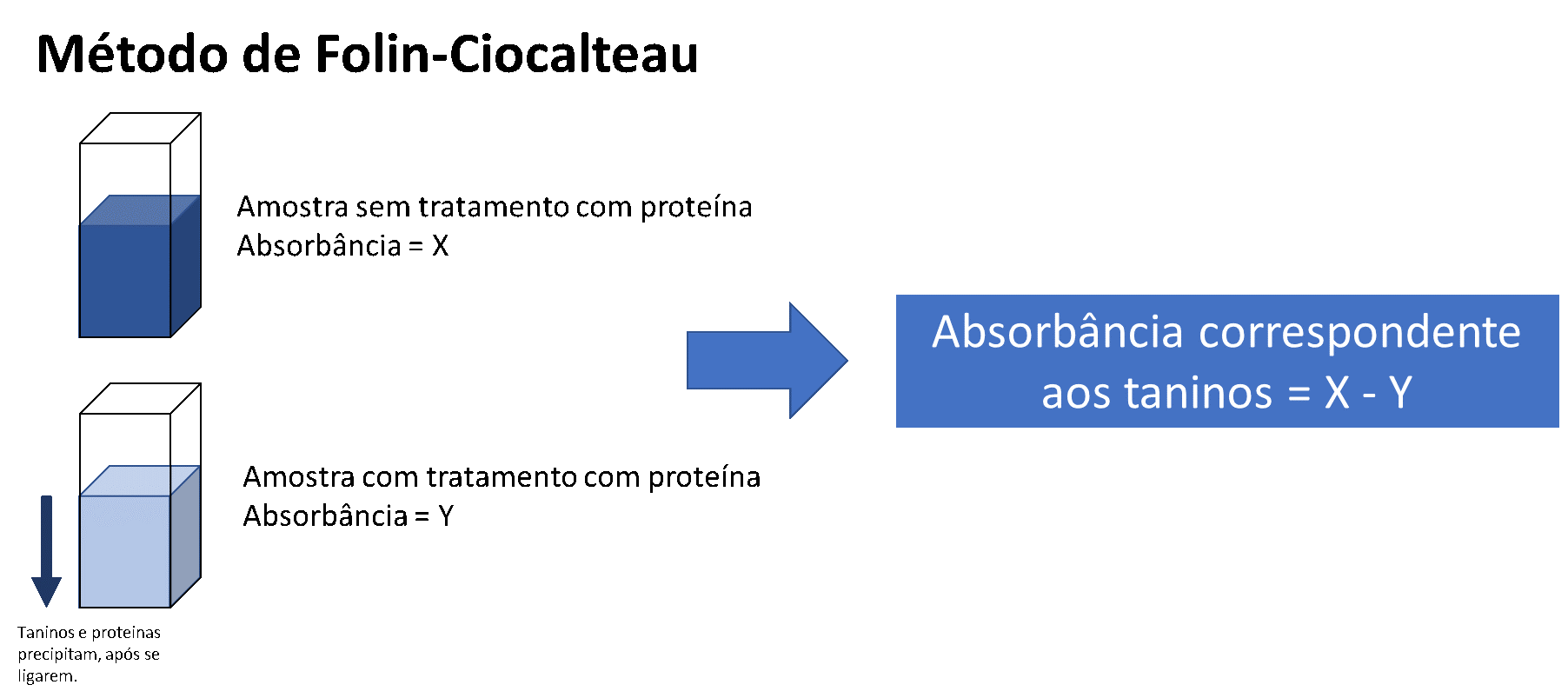
Outro método muito popular é com o reagente de Folin-Ciocalteau. Apesar de muito utilizado, ele dá positivo para outros polifenóis, podendo fornecer valores diferentes da real quantidade de taninos. Uma maneira de calcular a quantidade de taninos presentes em uma amostra é por meio da diferença de absorbância entre a amostra antes e após adição de uma proteína.
A medida da absorbância de uma amostra sem a proteína representa a quantidade total de fenólicos na amostra.
Após a adição de uma proteína, como a caseína, os taninos se complexarão e precipitarão, e a quantidade de fenóis livres na amostra pode ser calculada pela absorbância. Sendo assim, a diferença na absorbância da solução sem a adição de proteína e a solução com adição de proteína representam a quantidade de taninos totais na amostra. O resultado é expresso como g EAG/100 g de extrato, onde EAG = equivalente de ácido gálico.
ATIVIDADE BIOLÓGICA DOS TANINOS
A atividade biológica mais conhecida é a capacidade de precipitar proteínas. É utilizada desde os tempos mais remotos para produção de couro. Os taninos se ligam às proteínas de colágeno na pele animal, que ao se precipitar formam um grande filme protetor, resistente à água e ao ataque de microrganismos. Esse processo também torna o material mais flexível e esse couro é utilizado em acessórios, malas, móveis e calçados.
Você sabia
Tradicionalmente, os taninos são utilizados contra diarreia, hipertensão arterial, reumatismo, hemorragias, feridas, queimaduras, problemas estomacais, urinários e processos inflamatórios em geral.
1
Acredita-se que as atividades biológicas dos taninos acontecem por causa de suas atividades antioxidantes e capacidades de se complexar com íons metálicos e proteínas.
Suas propriedades antiulcerativas, especialmente contra úlcera péptica, se dão porque os taninos em contato com as proteínas presentes na mucosa formam um filme protetor, protegendo a úlcera de ataque de enzimas proteolíticas, inclusive de enzimas de H. pylori, bactéria responsável por causar gastrite e úlceras.
2
3
Mecanismo semelhante ocorre nas feridas e queimaduras. O filme formado sob a pele protege a ferida/queimadura de agentes do ambiente e permite que o processo natural de cura ocorra abaixo dele.
Outra atividade biológica relacionada com a precipitação de proteínas é a propriedade adstringente causada pela interação entre os taninos e a saliva, que resulta em uma sensação de secura causada pela contração do tecido epitelial da língua.
4
5
Como grande parte dos compostos fenólicos, os taninos também possuem grande atividade antioxidante e são capazes de reduzir o risco de desenvolvimento de doenças cardiovasculares, doenças degenerativas relacionadas ao envelhecimento e câncer. Foram descritas ainda propriedades de inibição da agregação plaquetária, atividade antibacteriana e antiviral.
DROGAS VEGETAIS COM TANINOS
Veja alguns exemplos importantes de drogas vegetais que possuem tanino em sua composição.
Nome popular: Hamamelis
Nome científico: Hamamelis virginiana L.
Droga vegetal: Folhas secas, inteiras ou fragmentadas
Extratos e tinturas contendo, no mínimo, 3,0% de taninos, expressos em pirogalol.
- Taninos, principalmente hidrolisáveis
- Flavonoides
- Óleo essencial
Formação de um filme protetor oclusivo ao precipitar proteínas e atividade antioxidante.
Usada tradicionalmente no tratamento de hemorroidas, úlceras, hemorragias internas e externas e contra inflamações.
Taninos.
Nome popular: Crataego (folha e flor)
Nome científico: Crataegi folium cum flore
Droga vegetal: Flores e folhas secas
Tintura contendo, no mínimo, 1,5% de flavonoides totais expressos como hiperosídeos.
- Aminas: feniletilamina, O-metoxifenetilamina, tiramina
- Flavonoides (até 1%): flavonol, flavona, glicosídeos da vitexina
- Taninos condensados
- Aumento do fluxo sanguíneo coronariano e da irrigação do miocárdio, melhora da contratilidade do músculo cardíaco, regulação do ritmo cardíaco, diminuição da pressão arterial.
- Leve efeito depressor do sistema nervoso central, aumento do tempo do sono induzido por barbitúricos e diminuição da motilidade basal espontânea.
Calmante e sedativo, como auxílio no alívio de sintomas decorrentes da ansiedade cardíaca, como palpitações provocadas por estresse e desconforto precordial, desde que não sejam condições graves.
Fenólicos presentes, em especial os taninos.
Nome popular: Espinheira-santa
Nome científico: Maytenus ilicifolia Mart. ex Reissek e M. aquifolium Mart
Droga vegetal: Folhas secas
Extrato contendo, no mínimo, 3,1% de taninos totais, expressos em pirogalol, e, no mínimo, 0,28% de epicatequina.
- Terpenos, triterpenos
- Óleos essenciais
- Taninos hidrolisáveis e condensados
- Glicolipídeos
- Alcaloides
Ações tônicas, analgésicas, antissépticas, cicatrizantes, diuréticas e laxativas.
No tratamento de dispepsias, como coadjuvante no tratamento de gastrite e úlcera gastroduodenal.
Taninos, principalmente epigalocatequina, e óleos essenciais.
Agora, a especialista Barbara Rocha sintetizará a biossíntese dos taninos, suas subclasses, sua importância e ainda citará algumas plantas que os contêm.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste tema, abordamos os compostos aromáticos formados na biossíntese vegetal pela via do chiquimato. Conhecemos a biossíntese e como são formadas as classes dos fenilpropanoides, lignanas, cumarinas, flavonoides e taninos.
Estudamos, também, suas características químicas, assim como suas diferenças estruturais, e exploramos como os compostos pertencentes a essas classes são extraídos e analisados.
Vimos ainda as propriedades biológicas de fenilpropanoides, lignanas, cumarinas, flavonoides e taninos e seus derivados. Além disso, conhecemos algumas plantas com fenilpropanoides, lignanas, cumarinas, flavonoides e/ou taninos, consideradas drogas vegetais, bem como a relação entre suas propriedades farmacológicas e esses compostos.
Podcast
Agora, a especialista encerrará o conteúdo destacando as particularidades das classes e substâncias pertencentes a essas classes e as drogas vegetais relacionadas.
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de fenilpropanoides e lignanas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Caracterizou a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de cumarinas, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Identificou a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de flavonoides, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais
Descreveu a biossíntese vegetal, as características químicas e farmacológicas e os métodos de extração de taninos, bem como a ocorrência desses compostos em plantas medicinais e drogas vegetais