Descrição
Definições gerais do metabolismo (biotransformação) de fármacos a partir de conceitos químicos, farmacocinéticos e farmacodinâmicos e seus processos e reações de metabolismo de fase I e fase II.
PROPÓSITO
Compreender os conceitos relacionados ao processo de biotransformação de fármacos, sendo de suma importância para entender os processos farmacocinéticos e farmacodinâmicos envolvidos com os medicamentos, como a metabolização e a eliminação de fármacos e suas interações medicamentosas relacionadas.
OBJETIVOS
Módulo 1
Identificar os conceitos gerais importantes sobre a biotransformação de fármacos
Módulo 2
Descrever os processos e reações de metabolismo de fase I
Módulo 3
Descrever os processos e reações de metabolismo de fase II
Introdução
Neste tema, vamos definir conceitos importantes envolvidos no metabolismo de fármacos, como os conceitos de biotransformação, metabolismo de fase I e fase II, bioativação, bioinativação, toxificação, metabólitos ativos, inativos e tóxicos, entre outros. Ainda abordaremos os diferentes processos e reações associados aos metabolismos de fase I (oxidação, redução e hidrólise) e II (glicuronidação, sulfatação, metilação, acetilação e conjugação).
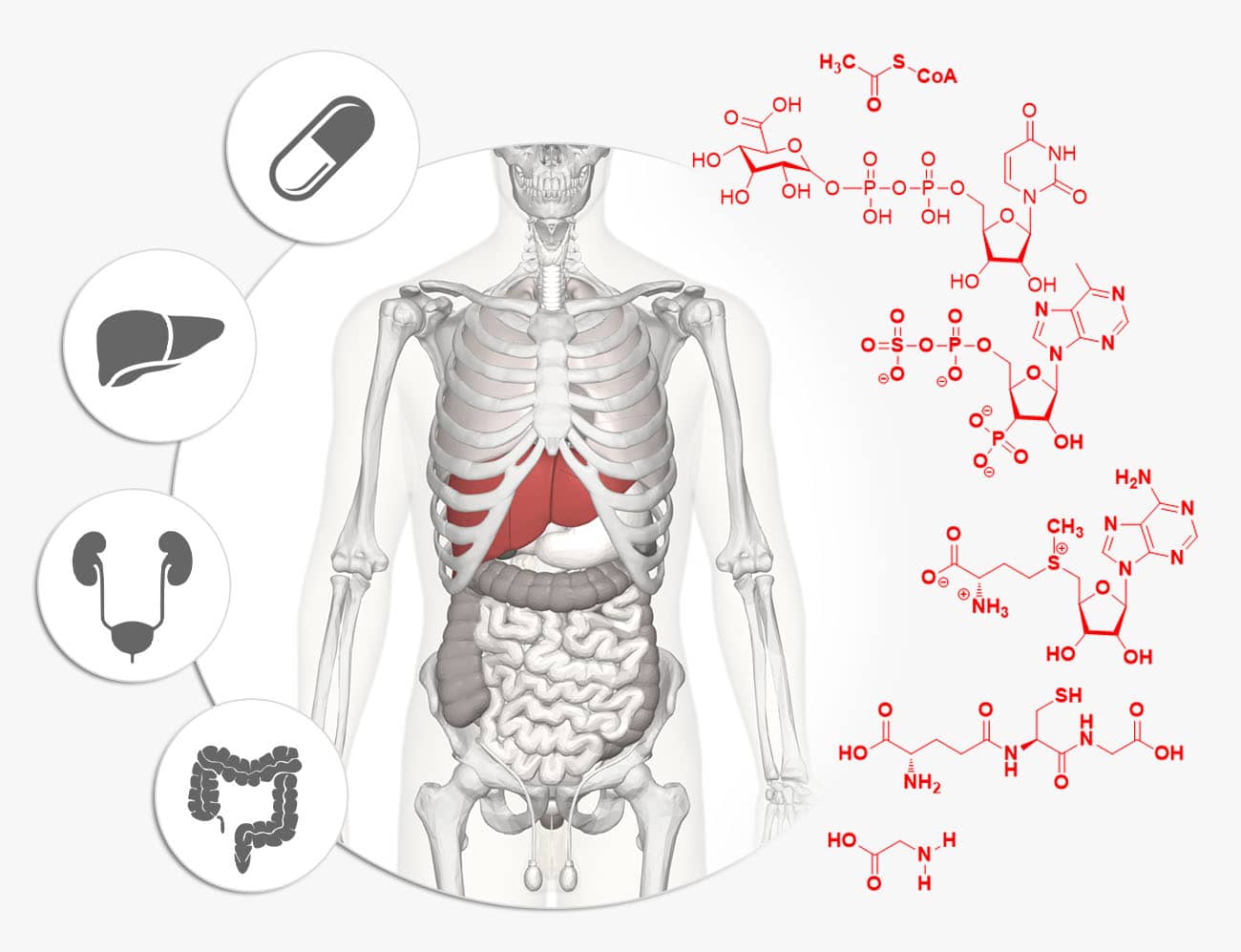
Toda substância química, seja ela o princípio ativo de um medicamento (fármaco) seja outros compostos químicos estranhos ao nosso organismo (solventes industriais, pesticidas, corantes, flavorizantes, aromatizantes, poluentes atmosféricos etc.), necessita sofrer metabolização para que seja eliminada. Esse processo farmacocinético envolve diversas reações enzimáticas (de fase I e II) que irão biotransformar essas substâncias em metabólitos de polaridade aumentada para que possam ser eliminados por via renal ou fecal.
Dessa forma, o metabolismo ou biotransformação é um processo de suma importância na eliminação de fármacos, impedindo que essas substâncias permaneçam por muito tempo em nosso organismo.
Assim, o estudo do metabolismo de fármacos possibilita determinar: a estabilidade metabólica do fármaco e a cinética envolvida no processo de formação de seus metabólitos; a principal via de eliminação do fármaco; a estrutura, a atividade e toxicidade dos metabólitos associados; as informações importantes para o desenvolvimento otimizado de fármacos; entre outros.
MÓDULO 1
Identificar os conceitos gerais importantes sobre a biotransformação de fármacos
CONCEITOS GERAIS DE METABOLISMO

Propriedades farmacocinéticas
A especialista Cristiane Soares fala sobre as propriedades farmacocinéticas, enfatizando a importância do metabolismo dos fármacos nesse processo.
Para compreendermos o processo de metabolismo ou biotransformação de fármacos ou mesmo de substâncias estranhas ao nosso organismo (xenobióticos), devemos lembrar que, anteriormente a esse processo farmacocinético, temos as etapas de absorção e distribuição dessas substâncias. Assim, após o contato por via dérmica, inalatória ou, em grande parte, via gastrointestinal, a substância pode passar para a etapa de distribuição e, então, sofrer biotransformação, estando suscetível à ação de uma gama de enzimas que participam desse processo.
O efeito farmacodinâmico dos medicamentos pode ser medido pelos parâmetros farmacocinéticos de biodisponibilidade e clearance, segundo os quais o primeiro será influenciado pelo metabolismo pré-sistêmico, ou seja, anterior a sua distribuição, e o segundo, pelo metabolismo pós-sistêmico.
O metabolismo de primeira passagem pode ocorrer para substâncias administradas por via enteral (via oral), isso porque os fármacos são transportados diretamente do intestino ao fígado pela circulação porta (circulação êntero-hepática), antes de alcançarem a circulação sistêmica e sua distribuição. Sendo assim, a estabilidade metabólica de um fármaco será inversamente proporcional ao seu clearance.
Por definição, biotransformação ou metabolismo são sinônimos e consistem em qualquer alteração química de um fármaco por um sistema biológico, com o propósito principal de transformar as substâncias metabolizadas em compostos (metabólitos) mais facilmente eliminados pelo organismo no qual se encontram, evitando seu acúmulo indesejado. De forma geral, esses metabólitos apresentam maior caráter hidrofílico, o que tendencia a sua eliminação por via renal junto à urina. Os metabólitos que porventura não apresentarem caráter hidrofílico serão eliminados pelas fezes (via biliar).
Outro aspecto importante que devemos salientar é o fato de que o processo de biotransformação de fármacos influencia diretamente na farmacodinâmica e toxicologia dessas substâncias. Isso porque o tempo de meia-vida delas estará associado ao seu metabolismo e à consequente eliminação, diminuindo ou aumentando seu efeito farmacológico, ou mesmo levando a efeitos tóxicos, associados a reações adversas.
O metabolismo de fármacos de acordo com as vias e os tipos de reações atreladas ao processo pode ser classificado em dois tipos:
- Metabolismo de fase I
- Metabolismo de fase II
Recentemente, uma terceira classificação foi adicionada, o metabolismo de fase III, sendo este representado por proteínas de efluxo, e não por enzimas.
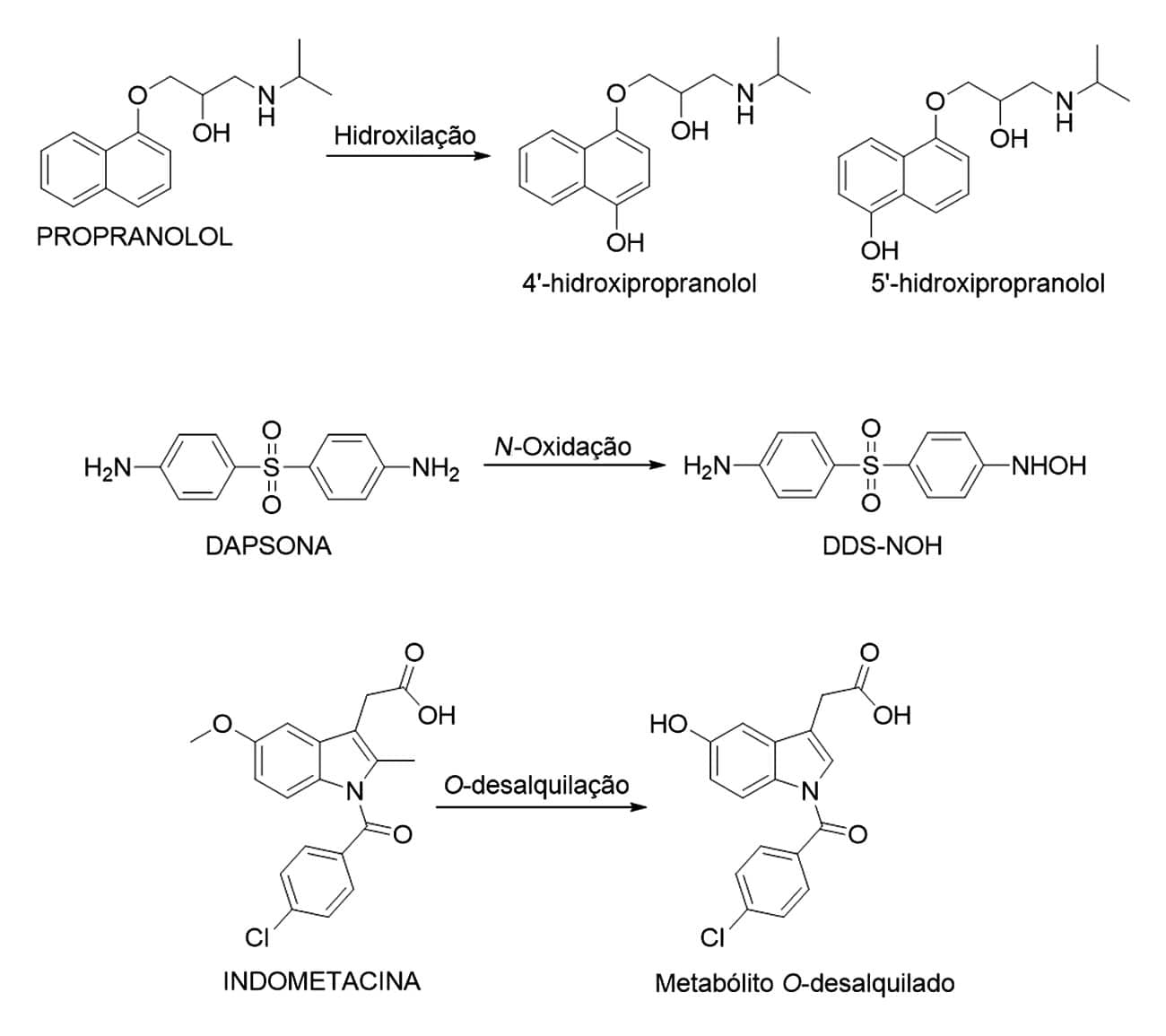
Dentre as principais reações envolvidas no metabolismo de fase I, temos as oxidações, reduções e hidrólises. As reações oxidativas (Figura 2), estão entre as mais comuns na fase I; elas incluem reações do tipo: hidroxilação, como nos fármacos propranolol, ciclosporina e varfarina; N- e S-oxidação como nos fármacos dapsona, paracetamol e cimetidina; ou N- e O-desalquilação, como no diazepam, na morfina e na indometacina. As reações de desalquilação são consideradas reações oxidativas, uma vez que necessitam da hidroxilação do grupamento alquil adjacente ao heteroátomo para ocorrerem.
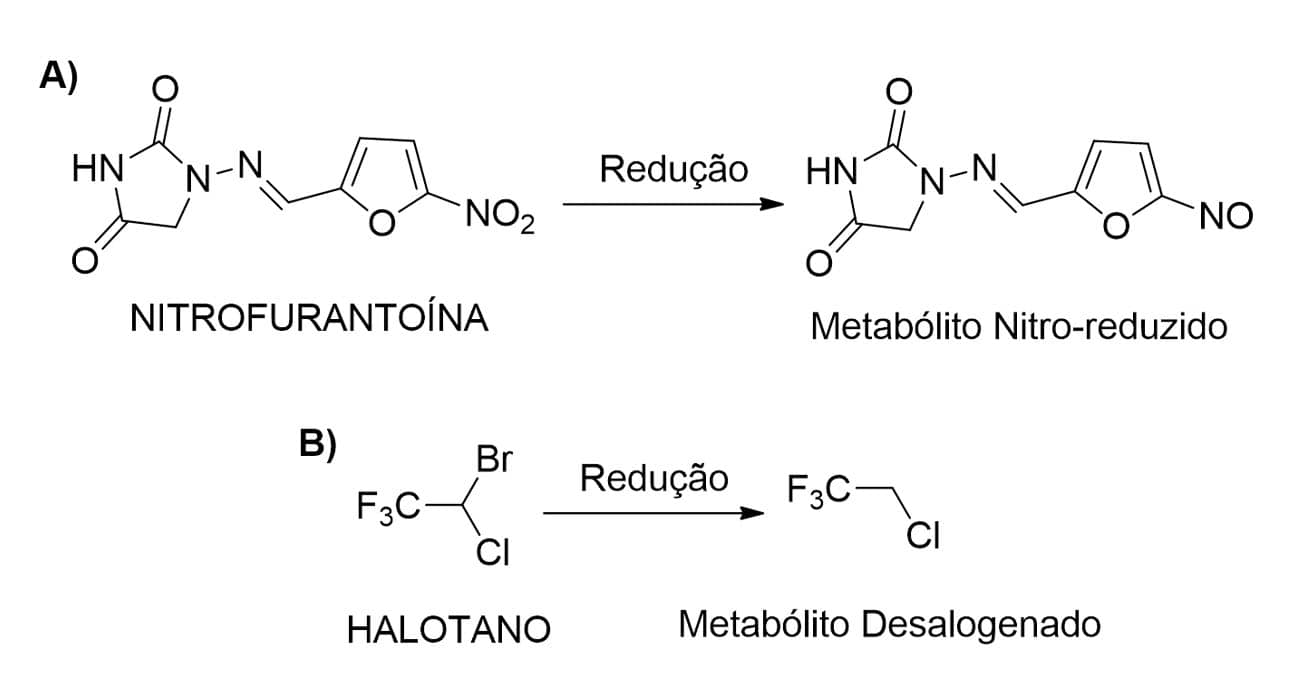
As reações de redução (Figura 3A) de grupamentos nitro ou carbonila, presentes na estrutura de fármacos, levam à formação de aminas e álcoois, respectivamente, com aumento da hidrofilicidade desses metabólitos.
Exemplo
Entre os fármacos que sofrem as reações de redução, temos a nitrofurantoína, a metadona e a naloxona.
Existem, ainda, reações de redução do tipo desalogenação, que ocorrem em fármacos como o cloranfenicol e o halotano (Figura 3B).
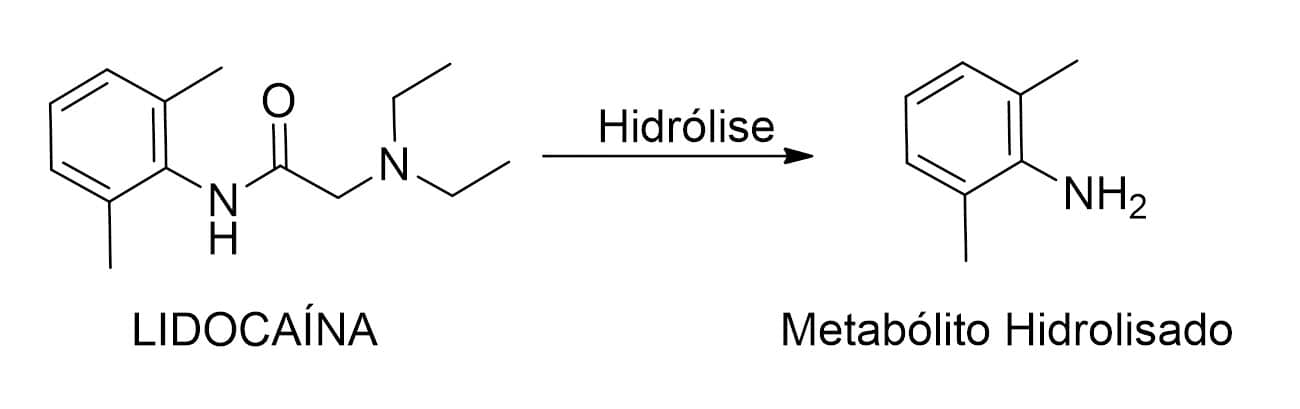
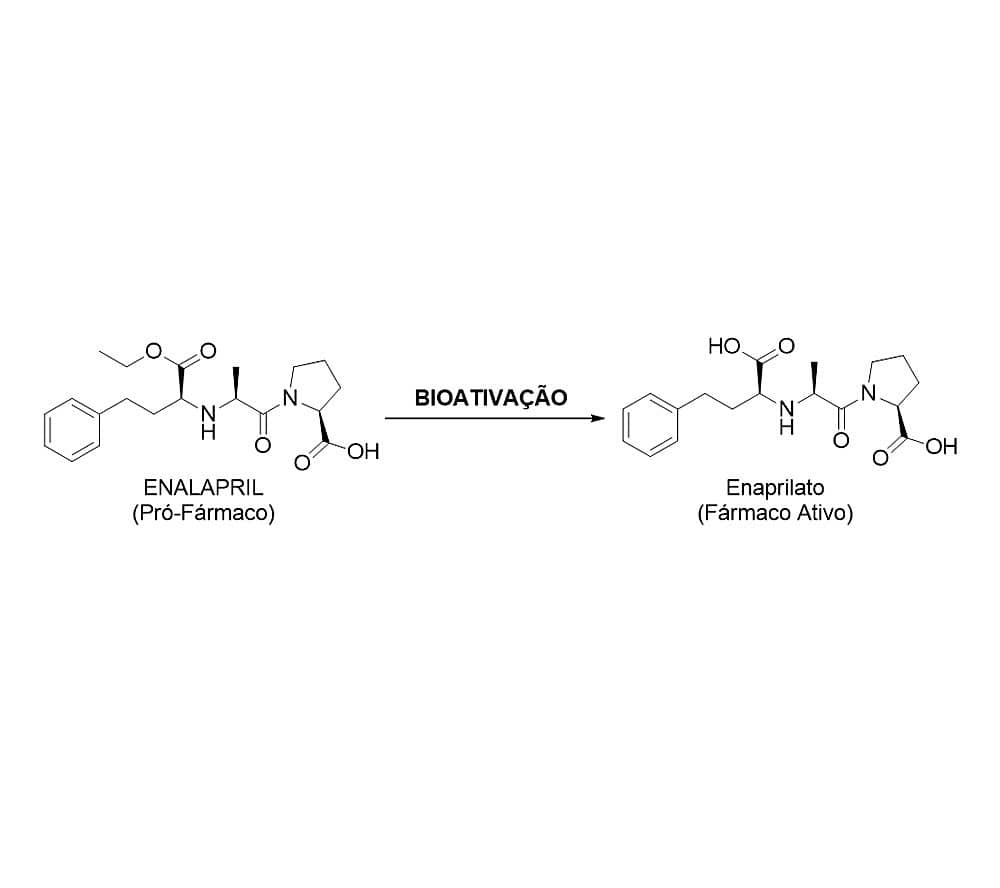
Por fim, as reações de hidrólise de ésteres, amidas ou hidrazidas também levam ao aumento do caráter hidrofílico de seus respectivos metabólitos, pela formação de ácidos, álcoois, aminas e hidrazinas, respectivamente. Como exemplo de fármacos que sofrem esse tipo de metabolismo de fase I, temos o ácido acetilsalicílico, a lidocaína (Figura 4) e o enalapril.
As reações do metabolismo de fase II diferem das reações de fase I, uma vez que estas, de forma geral, estão atreladas ao processo de conjugação dos fármacos propriamente dito, ou mesmo de seus metabólitos provenientes da fase I com moléculas endógenas, como ácido glicurônico, sulfato ou aminoácidos. Para que as reações de fase II ocorram, é necessário que existam, na estrutura do fármaco ou de seu metabólito de fase I, grupos químicos suscetíveis ao acoplamento com essas moléculas endógenas, como hidroxilas, aminas ou ácidos carboxílicos.
Dessa forma, as reações de fase II compreendem reações de conjugação, sulfatação, metilação e acetilação e, com exceção das duas últimas, contribuem para o aumento da hidrofilicidade de seus produtos, facilitando sua eliminação. Isso ocorre porque as reações de N-acetilação de aminas e O-, N- e S-metilação tendem a formar produtos com caráter mais lipofílico.
Os complexos enzimáticos encontrados em ambas as fases I e II da biotransformação de fármacos podem estar presentes em diversas localizações celulares, como nas organelas — retículo endoplasmático e mitocôndria — ou mesmo dispersos no citosol (Figura 5). Como a maioria das reações de biotransformação de fase I e II ocorre no meio intracelular e os metabólitos formados por essas etapas tendem a ser hidrofílicos, é interessante pensarmos nas dificuldades que essas substâncias terão para permear as membranas celulares, sair de dentro delas e conseguir ser eliminadas.
Nesse cenário, as proteínas de efluxo, como a glicoproteína-P, são de suma importância, pois auxiliam no processo de detoxificação, transportando para a circulação sistêmica fármacos e seus metabólitos para que sejam eliminados.
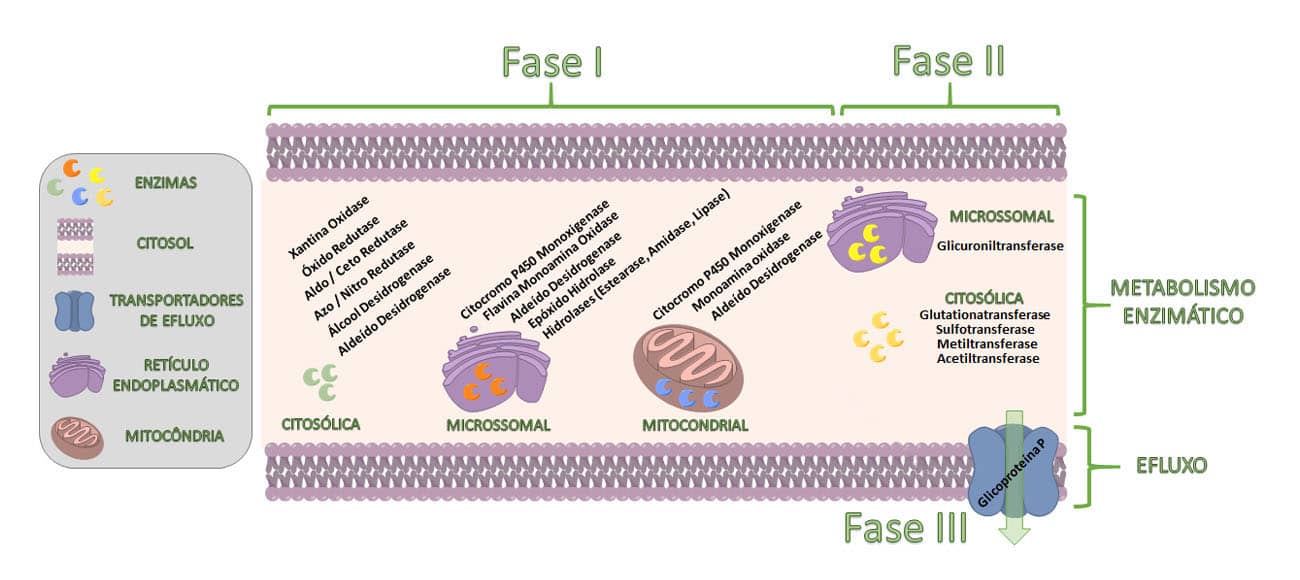
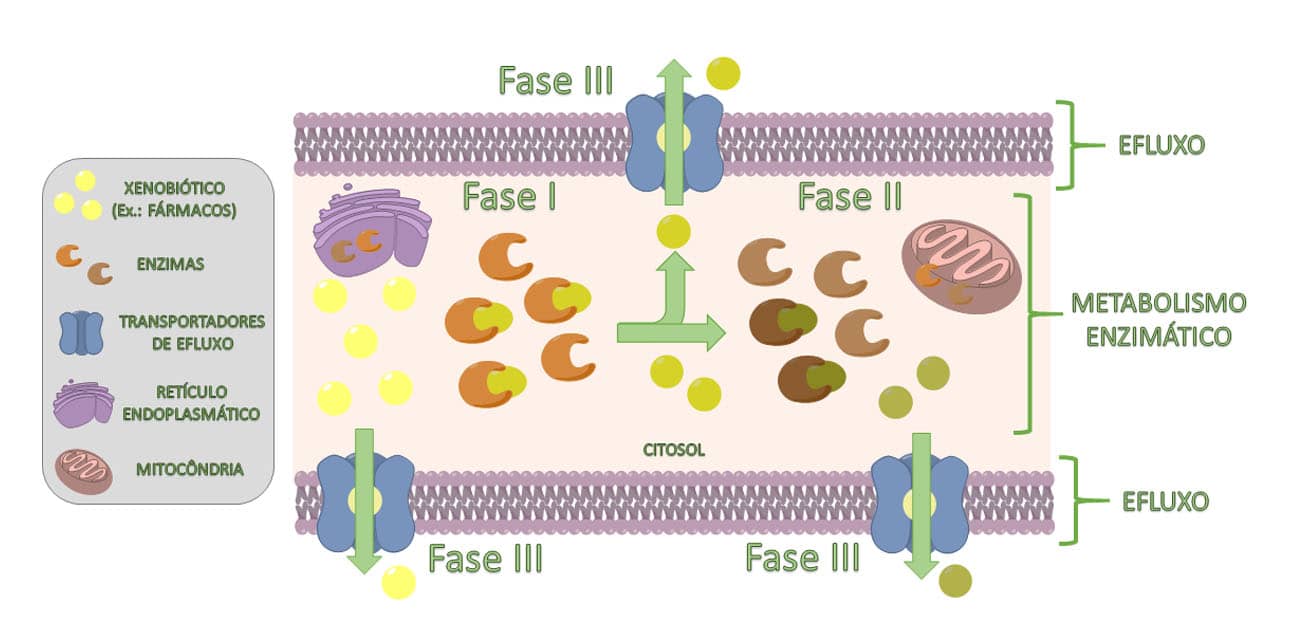
Assim, podemos perceber que os metabolismos de fases I, II e III estão integrados e convergem de forma a possibilitar a eliminação de substâncias estranhas (xenobióticos) ao organismo (Figura 6).
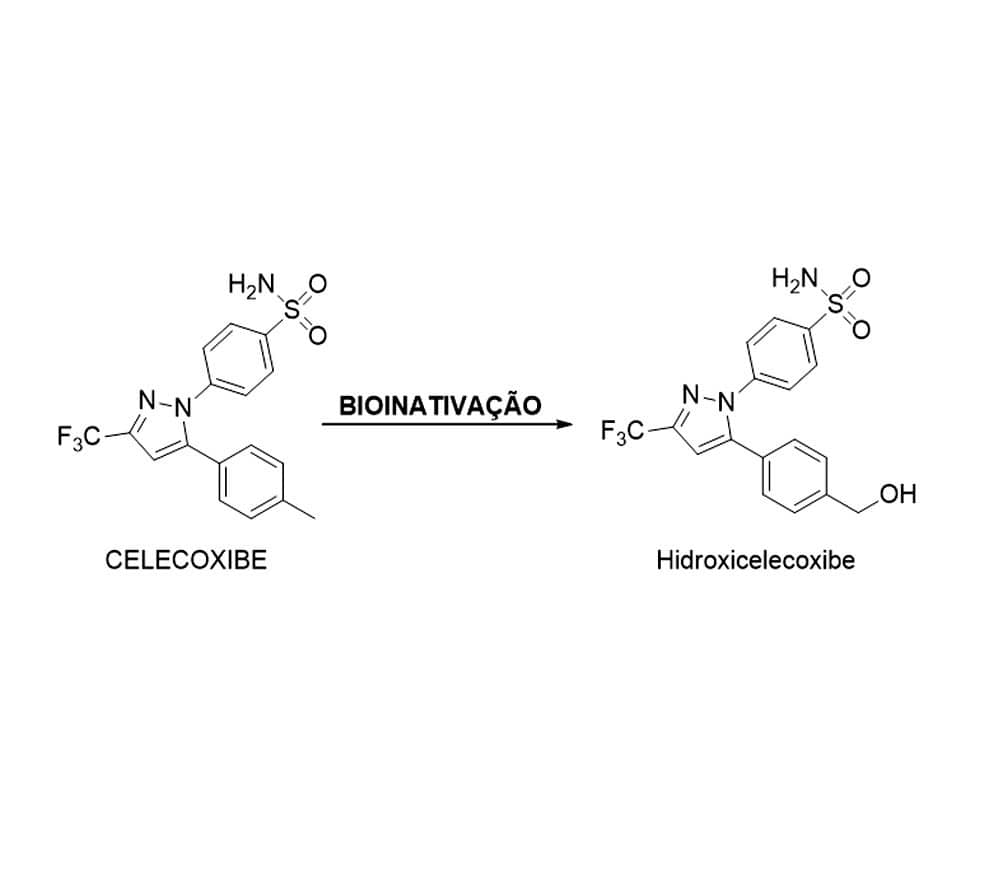
Estudar a relação da estrutura do fármaco com a biotransformação, assim como de seus metabólitos formados, é fundamental ao processo de planejamento e desenvolvimento de novos fármacos, pois o metabolismo dessas substâncias pode levar à produção de compostos de reatividade muito distinta (Figura 7). O metabolismo de fármacos não necessariamente leva apenas à inativação (bioinativação) pela produção de metabólitos inativos (p. ex., celecoxibe — AINE); pode levar também à produção de compostos de maior atividade ou mesmo ações biológicas diferentes.
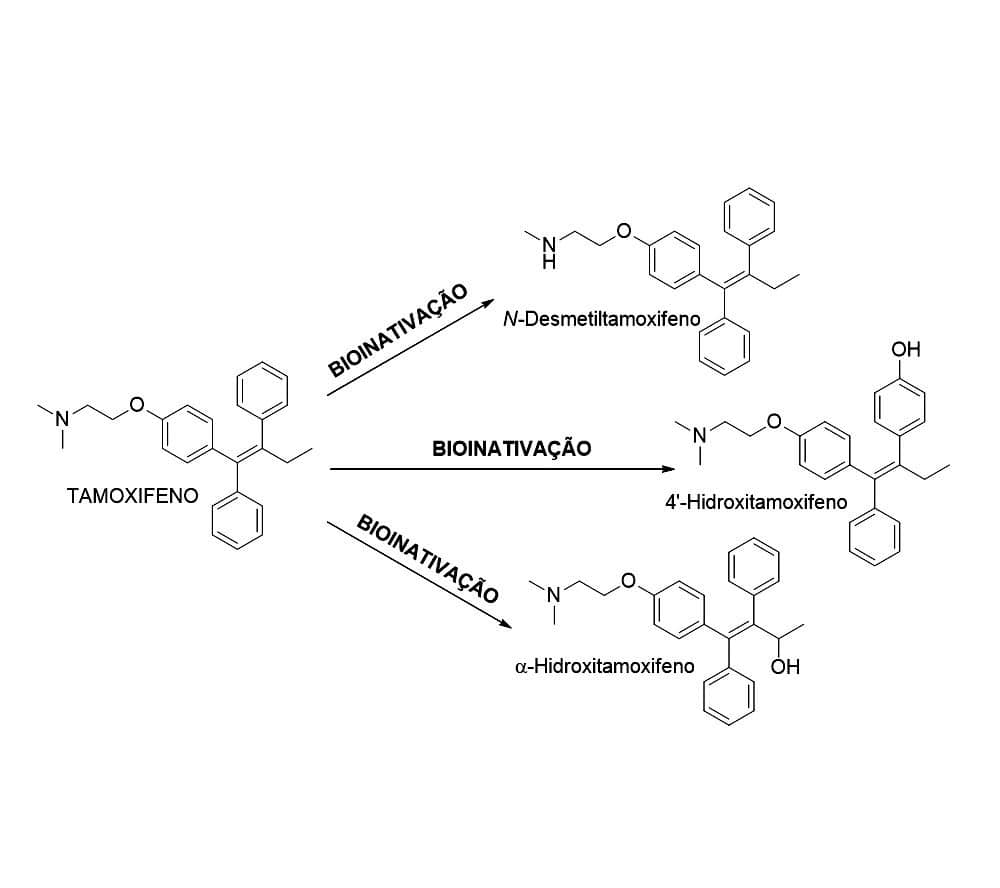
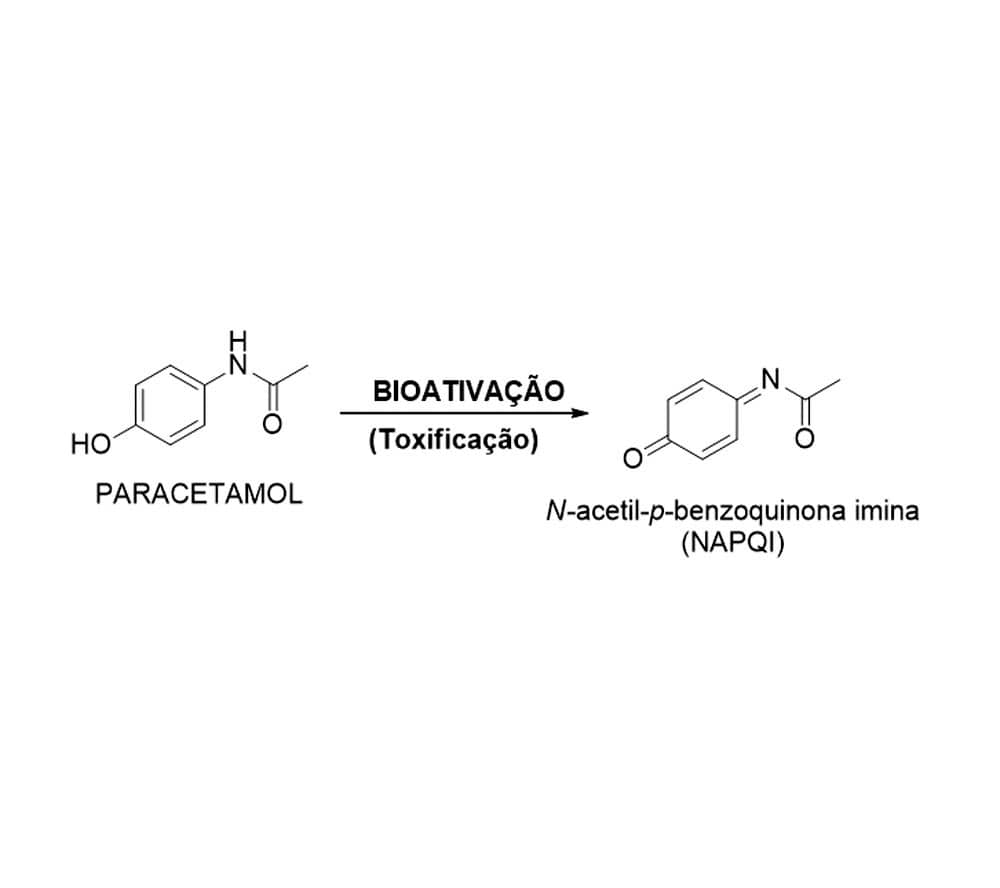
Por exemplo, a biotransformação do tamoxifeno, medicamento usado no tratamento do câncer de mama, leva à produção de metabólitos reativos em um processo chamado de bioativação. A bioativação pode ocorrer, ainda, formando metabólitos de atividade distinta do fármaco metabolizado, levando a interações diferentes que podem ocasionar efeitos tóxicos como no caso dos metabólitos hepatotóxicos do paracetamol (antipirético e analgésico).
Por fim, a bioativação pode estar relacionada ao surgimento do efeito biológico de fármacos do tipo pró-fármaco (p. ex., enalapril — anti-hipertensivo IECA), o qual encontra-se na sua forma inativa e, após a biotransformação, sofre modificações que irão culminar no aparecimento do efeito farmacodinâmico desejado.
CARACTERÍSTICAS DE SELETIVIDADE ENZIMÁTICA NAS BIOTRANSFORMAÇÕES E ESTUDOS DO METABOLISMO DE FÁRMACOS
Uma condição interessante sobre o metabolismo de fármacos relaciona-se a uma das três peculiaridades envolvidas nas reações catalisadas por enzimas: quimiosseletividade, regiosseletividade e enantiosseletividade.
A quimiosseletividade relaciona-se com a especificidade enzimática para uma função orgânica em detrimento de outras presentes no fármaco, por exemplo: em um fármaco que contém duas carbonilas, uma de aldeído e outra cetônica, estas apresentam reatividades diferentes frente a uma reação de redução a álcoois e, assim, a enzima pode ter seletividade para apenas uma dessas carbonilas.
A característica de regiosseletividade refere-se à preferência enzimática entre dois grupos químicos idênticos, porém de reatividades diferentes devido a localizações distintas na estrutura do fármaco.
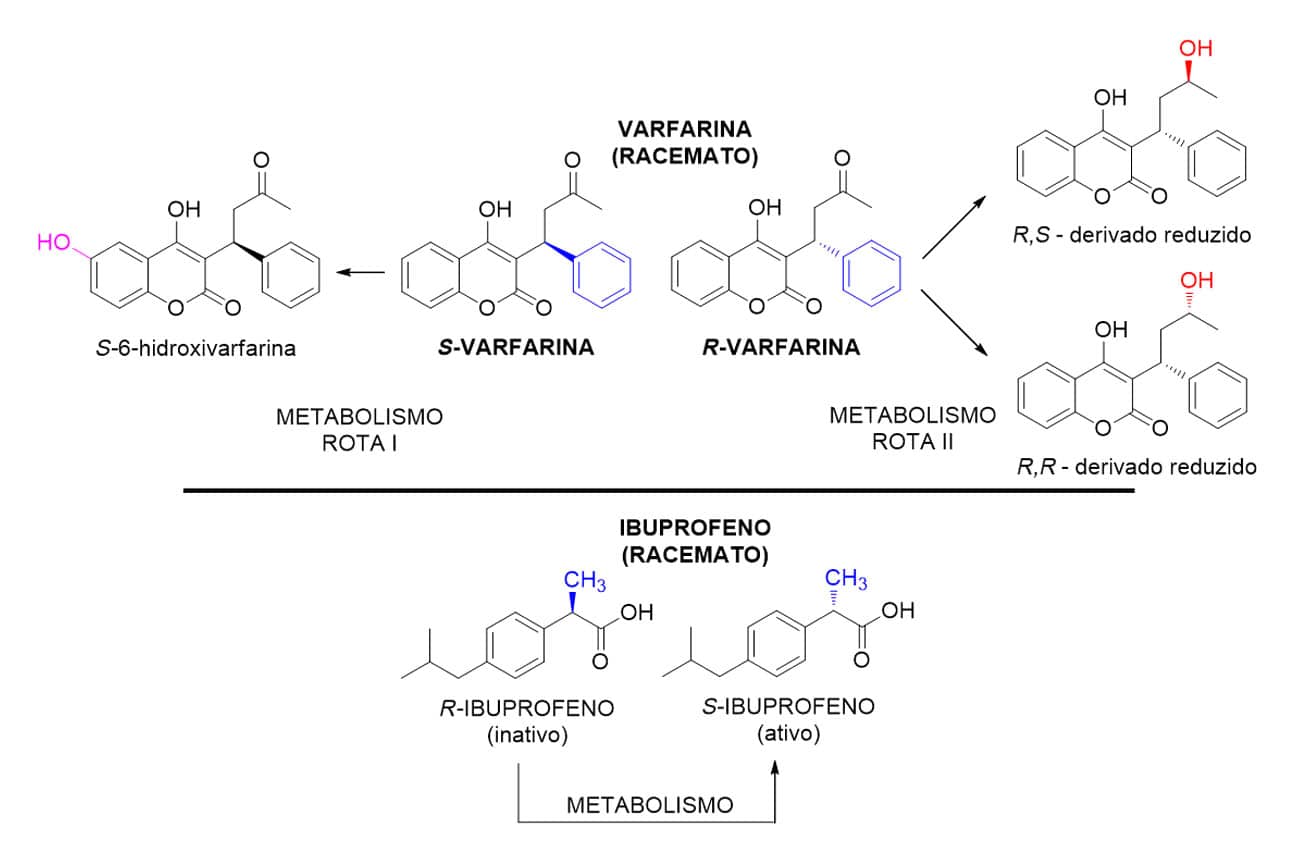
Por último, a condição de enantiosseletividade é bastante curiosa no quesito biotransformação, pois faz com que uma enzima tenha preferência por um substrato com estereoquímica definida, por exemplo S ou R, levando a diferentes metabólitos, tanto ativos como inativos. Por exemplo, o fármaco varfarina, administrado na forma racêmica (apresentando 50% de cada estereoisômero R e S), sofre metabolismo distinto para cada um de seus isômeros devido à enantiosseletividade enzimática.
O Ibuprofeno (administrado na forma de racemato) também sofre um processo semelhante, porém o metabolismo enantiosseletivo ocorre somente sobre a forma do isômero R (inativo), transformando-o no isômero S responsável pela atividade anti-inflamatória do fármaco (Figura 8).
O estudo do metabolismo de fármacos pode ser realizado a partir de métodos in vitro, in vivo, ou mesmo in silico (por simulação computacional). As metodologias que utilizam sistemas biológicos ou parte deles devem empregar técnicas analíticas de alta sensibilidade associadas a etapas pré-analíticas de extração eficientes para que mesmo as quantidades ínfimas de metabólitos possam ser isoladas, detectadas e caracterizadas em componentes biológicos como fluidos, frações subcelulares ou cultura de células.
Saiba mais
Já os estudos in silico funcionam como métodos preditivos de metabolização dessas substâncias, apresentando vantagens frente aos outros nos aspectos de custo e velocidade de execução, porém tendem a apresentar baixa correlação entre o resultado teórico predito e o experimental. De forma geral, os métodos computacionais baseiam-se na estrutura do alvo (p. ex., docagem molecular), como a estrutura das enzimas relacionadas ao processo de biotransformação, ou na estrutura do ligante (p. ex., QSAR), como na estrutura de substâncias já conhecidas que sofrem metabolização já descrita.
Apesar das diversas técnicas relacionadas aos métodos de estudos do metabolismo de fármacos, o sucesso da análise estará baseado no indispensável conhecimento prévio da reatividade química dos diferentes grupos funcionais que compõem a estrutura do fármaco.
FATORES QUE AFETAM O METABOLISMO DE FÁRMACOS
Antes de entendermos os conceitos e as reações que envolvem o metabolismo de fase I e II dos fármacos, devemos compreender quais fatores intrínsecos ao fármaco — como sua concentração — ou ao próprio organismo no qual o medicamento se encontra afetam os processos de biotransformação dessa substância.
Concentração do Fármaco
Da mesma forma que os alvos dos fármacos podem se tornar saturados perante a interação fármaco-ligante, os processos envolvidos na biotransformação também. Por exemplo, conforme a concentração do fármaco no organismo aumenta, a capacidade metabólica dos sistemas enzimáticos tende a saturar, tanto pelo número de enzimas em atividade catalítica como pelo consumo de substratos e cofatores necessários para essas reações.

As vias metabólicas tanto de fase I como de fase II são diretamente afetadas pela concentração do fármaco disponível, o que explica situações em que, ao ocorrer a saturação de uma das vias reacionais, um novo metabólito pode ser formado pelo metabolismo de uma segunda via reacional disponível. A previsão da característica desse segundo metabólito é importante, uma vez que este pode ter caráter inativo, ativo ou mesmo tóxico.
O fármaco paracetamol exemplifica bem esse processo, pois, em doses usuais, é eliminado do organismo preferencialmente via reação de conjugação com o ácido glicurônico ou sulfatação, ambas biotransformações de fase II. Porém, quando o paracetamol se encontra em altas doses, essas duas vias passam a um estágio de saturação e o metabolismo de fase I via CYP2E1 é ativado, levando à formação do metabólito hepatotóxico N-acetil-p-benzoquinona imina (NAPQI).
No intuito de eliminar esse metabólito tóxico, o organismo ativa, então, uma terceira via reacional da conjugação com glutationa, eliminando-o na forma de metabólito inativo. Caso essas três reações de fase II se saturem por um aumento excessivo na concentração do paracetamol, o intermediário reativo pode se acumular, levando a danos em macromoléculas intracelulares, implicando a toxicidade hepática.
Assim, como a concentração dos fármacos pode afetar a saturação e a ativação de diferentes vias metabólicas, levando à formação de novos compostos, esse efeito deve ser levado em consideração na realização dos estudos de metabolismo de novas drogas.
Via de Administração
Medicamentos administrados por via enteral estão suscetíveis a sofrer metabolismos diversos antes de alcançarem a circulação sistêmica. Os microrganismos da flora intestinal e as enzimas metabolizadoras presentes na parede do intestino podem metabolizar alguns fármacos ainda em nível intestinal.
Outro efeito importante associado a fármacos administrados por essa via é o efeito do metabolismo de primeira passagem, pois esses compostos, ao serem absorvidos no intestino, migram diretamente para o fígado via circulação êntero-hepática, estando suscetíveis às enzimas de metabolização presentes nesse órgão.
O metabolismo de primeira passagem pode reduzir drasticamente a concentração biodisponível do fármaco, sendo necessária sua administração por outras vias que evitem o efeito de primeira passagem, tais como a transdérmica, a sublingual, a retal e a inalatória.
Diferença de espécies quanto ao metabolismo
O metabolismo de fármacos apresenta diferenças quantitativas importantes para cada espécie animal, sendo difícil, às vezes, a extrapolação de dados sobre estudos de metabolismo in vivo em animais para estudos clínicos em humanos.
Comentário
De maneira geral, o metabolismo humano tende a ser mais lento do que o de animais como ratos e camundongos, em parte devido às diferenças de peso e à área de superfície corpórea, assim como a diferentes níveis de expressão das enzimas relacionadas à biotransformação.
Algumas espécies podem ser incapazes de realizar algum tipo de reação metabólica, como cães, que não metabolizam aminas aromáticas via acetilação, ou gatos, que não utilizam a via da glicuronidação. Outro fator associado a essas diferenças entre espécies relaciona-se ao metabolismo via biliar, pois a excreção de bile pode ser muito diferente entre as espécies, necessitando de diferentes parâmetros de peso molecular e lipofilicidade do fármaco para que essa via de eliminação ocorra.
Diferenças relacionadas ao gênero
Algumas espécies de roedores, como os ratos, podem apresentar diferenças significativas entre gêneros relacionadas ao metabolismo.
Exemplo
O fármaco hexobarbital necessita de doses maiores para induzir ratos machos ao sono do que em ratos fêmeas, pois os machos parecem ser melhores metabolizadores de fármacos por via da hidroxilação alifática.
Nos ratos, esse efeito está associado à expressão do citocromo P450 em níveis diferentes entre machos e fêmeas.
Estudos relacionados em humanos também detectaram diferenças metabólicas entre gêneros, sendo necessários mais estudos sobre o tema para melhor elucidação dessa influência.
Idade
Um dos fatores que influenciam o metabolismo humano mais estudado é a idade.
Estudos apontam que idades avançadas tornam as células do fígado e de outros órgãos menos capazes de realizar reações metabólicas do que em indivíduos mais jovens.
Indivíduos recém-nascidos podem apresentar algumas rotas metabólicas inativas, como a conjugação do cloranfenicol via glicuronidação.
Esses achados levantam um ponto importante nos estudos de metabolismo de fármacos indicados para tratamento de patologias pediátricas ou geriátricas.
Doenças podem afetar o metabolismo
Doenças hepáticas podem influenciar drasticamente o metabolismo dos fármacos. Por exemplo, pacientes com cirrose hepática tendem a apresentar maior biodisponibilidade de propranolol devido à redução do metabolismo de primeira passagem causada pelo fígado danificado. Entretanto, essa relação entre doença hepática e metabolismo ainda não é muito clara, sendo difícil estimar o metabolismo de fármacos em pacientes com essas doenças. Assim, é importante o conhecimento das características de ADME (absorção, distribuição, metabolismo e eliminação) do fármaco para dar suporte à avaliação de segurança do uso de fármacos nesses pacientes.
Fatores Genéticos
A expressão enzimática de cada pessoa pode levar à produção de diferentes quantidades de isoenzimas envolvidas no processo de biotransformação de fármacos. Essas diferenças genéticas alocam grupos de pessoas em diferentes populações, deixando-as suscetíveis a diferentes comportamentos metabólicos. Diferenças genéticas podem levar, por exemplo, a modificações na capacidade de N-acetilação de caucasianos, que apresentam menor metabolismo por essa via.
Uma modificação genética importante associada ao metabolismo é o polimorfismo 2D6, que determina alterações nas taxas de metabolização de fármacos via isoenzima do citocromo P450, CYP2D6.
| 1. Metabolizador normal. | 2. Metabolizador intermediários. |
| 3. Metabolizador lento. | 4. Metabolizador ultrarrápido. |
1. Metabolizador normal.
Um indivíduo que apresenta dois alelos normais associados à CYP2D6 tem um metabolismo normal, sendo considerado um metabolizador normal.
2. Metabolizador intermediários.
Alguns indivíduos podem apresentar um fenótipo associado a uma metabolização mais lenta se comparada a um indivíduo normal, sendo chamados de metabolizadores intermediários. Estes podem, em longo prazo, apresentar reações adversas devido ao acúmulo de metabólitos em seu organismo.
3. Metabolizador lento.
O terceiro tipo de indivíduo, o metabolizador lento , apresenta fatores genéticos associados que acarretam a deficiência funcional dessa isoenzima, levando a um aumento da ocorrência de efeitos adversos nesses indivíduos devido ao acúmulo do fármaco no organismo.
4. Metabolizador ultrarrápido.
Por fim, um indivíduo que tem múltiplas cópias do gene relacionado pode apresentar uma hiperatividade dessa isoenzima, levando rapidamente a uma diminuição na concentração dos fármacos, podendo atingir níveis subterapêuticos e prejudicando o tratamento realizado. Esse indivíduo é chamado de metabolizador ultrarrápido.
Nesse cenário, a farmacogenômica é de suma importância na identificação desses indivíduos, para que sejam realizadas as adequações necessárias dos regimes terapêuticos, evitando reações adversas e ineficácia terapêutica devidas a subdoses.
Interações medicamentosas
Assim como outros processos biológicos, as enzimas envolvidas na biotransformação de fármacos são passíveis de sofrer mecanismos de indução e inibição por outros compostos, principalmente alguns fármacos. A capacidade indutiva ou inibitória das enzimas do metabolismo pode afetar diretamente diversos parâmetros farmacocinéticos e, consequentemente, farmacodinâmicos.
Saiba mais
O conhecimento sobre interações medicamentosas relacionadas ao metabolismo tem crescido bastante nos últimos anos, principalmente com a introdução de novas tecnologias de estudos in vitro que possibilitam trabalhar com citocromos humanos recombinantes e utilizar microssomas e hepatócitos com seletividade para substratos e inibidores. Esses estudos permitiram identificar as principais isoenzimas da CYP450 humana que estão associadas a esses processos de inibição e indução via interação medicamentosa.
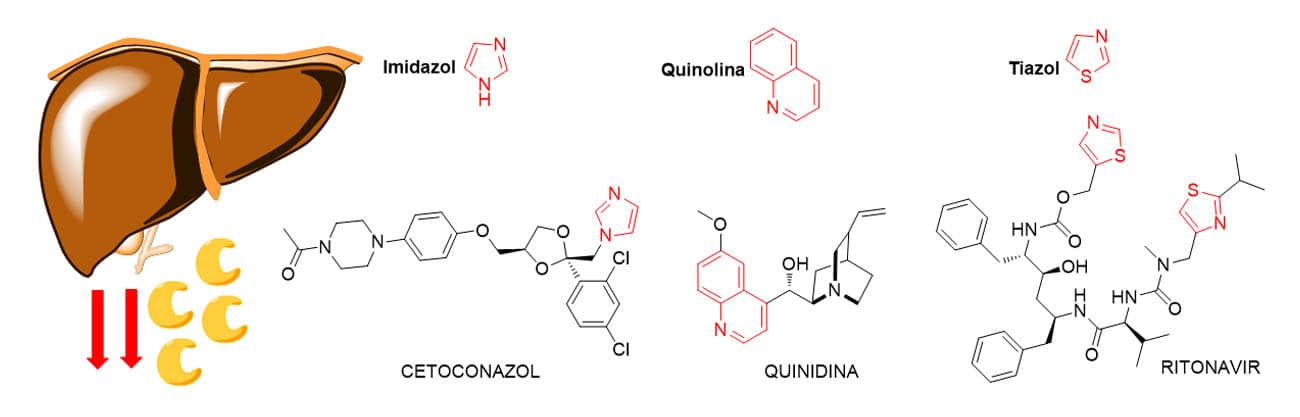
Comparando as estruturas químicas dos fármacos inibidores e indutores da CYP, foi possível observar a amplitude estrutural de compostos que pode afetar essas enzimas. Como inibidores, esses parecem apresentar uma tendência em grupos que contêm nitrogênio básico disponível para ligar fortemente ao ferro do grupo heme do sítio ativo da enzima. Como exemplo, temos o heterociclo imidazol presente no cetoconazol, a função quinolina presente na quinidina e o grupo aromático tiazol encontrado na estrutura do ritonavir (Figura 9).
Já em relação aos indutores, estes apresentam estruturas mais distintas, variando desde substâncias como o etanol a fármacos como fenobarbital, carbamazepina, rifampicina (Figura 10), entre outros.
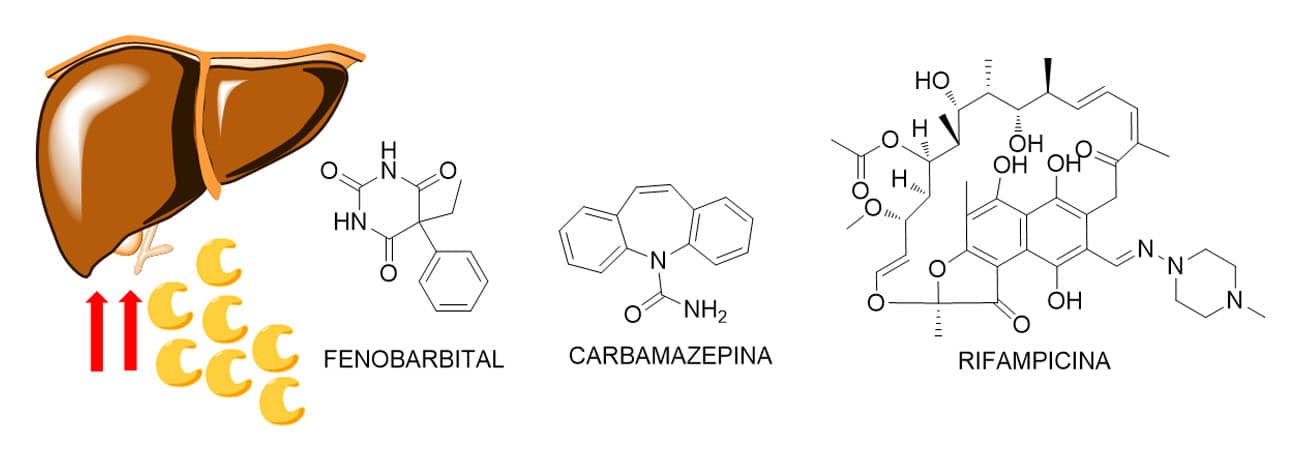
O processo de interação medicamentosa associada a fármacos pode ocorrer de duas maneiras. A primeira ocorre quando o fármaco ou composto candidato é o próprio agente causador da inibição ou indução, ou ainda o propagador da interação. Já a segunda ocorre quando o fármaco ou composto candidato é o alvo da interação medicamentosa, ou seja, quando irá sofrer o efeito das enzimas induzidas ou inibidas por um segundo composto.
O processo de inibição enzimática pode ocorrer de forma competitiva reversível, em que dois fármacos competem pela mesma enzima metabolizadora, levando ao aumento do fármaco de menor afinidade. A inibição pode ocorrer, ainda, de forma irreversível, o que leva à inativação permanente da enzima, ocasionando efeitos de diminuição do metabolismo por períodos mais longos, pois requerem a síntese de novas enzimas. Essas situações podem colocar o paciente em quadros de longa exposição ao fármaco, ocasionando reações adversas importantes.
Quanto ao processo de indução enzimática, alguns fármacos podem interagir com receptores nucleares associados ao processo de expressão dessas enzimas, levando a um aumento em sua expressão gênica, aumentando o processo de metabolização realizado por elas. Essa situação leva a uma diminuição da concentração de fármacos metabolizados por essas enzimas, podendo colocar o paciente em situações de subdose com comprometimento do tratamento.
Assim, diante dos diversos fatores que podem influenciar o metabolismo dos fármacos, é muito importante o conhecimento químico e farmacológico desses compostos e das reações envolvidas na sua biotransformação para que situações adversas ao paciente possam ser identificadas e prevenidas.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Descrever os processos e reações de metabolismo de fase I
METABOLISMO DE FASE I
As principais reações relacionadas ao metabolismo de fase I de fármacos contemplam oxidações (hidroxilação; epoxidação; N- O- ou S-desalquilação; e oxidação de heteroátomos), reduções e hidrólises, podendo ocorrer, ainda, reações de desacetilação, desaminação, hidratação e isomerização. Essas reações frequentemente levam à produção de metabólitos mais polares, em geral pela inclusão de grupos OH, NH2 e SH, funcionalizações que, além de tornar o composto mais hidrofílico, preparam a molécula para as reações de biotransformação de fase II.
As reações do tipo desacetilação e desalquilação ocorrem no sentido de expor grupos mais polares, como na desalquilação do grupamento metóxi à hidroxila (R-OCH3 -> R-OH) ou na desacetilação do grupo amida à amina (R-NHCOCH3 - > R-NH2).
Vias de regra, a sequência de metabolismo de fase I anterior à fase II pode não ocorrer, pois alguns compostos podem apresentar em sua estrutura grupos funcionais já suscetíveis às reações de fase II.
ENZIMAS RELACIONADAS AO METABOLISMO DE FASE I E SUAS REAÇÕES
O metabolismo de fármacos pode ocorrer em diversos tecidos e órgãos espalhados por todo o corpo, como fígado, rins, intestino, sangue e plasma. De longe, o fígado é o órgão de maior representatividade nas reações de biotransformação, seguido dos rins e do intestino delgado, locais importantes de ocorrência das reações de fase I. Muitas enzimas hidrolíticas de ésteres e amidas podem ser encontradas ainda circulando no plasma e no sangue. No meio intracelular, as reações de metabolismo podem ocorrer diretamente no citosol, nas membranas mitocondriais ou nos microssomos, presentes no retículo endoplasmático (biotransformações microssomais).
As biotransformações de fase I microssomais estão associadas à ação das enzimas da superfamília do citocromo P450 e das flavinas monoxidase, enquanto as demais reações de fase I não microssomais ocorrem por oxidorredutases mitocondriais como nas monoaminoxidases e algumas CYP450 ou por enzimas citosólicas como álcool desidrogenases, aldeído desidrogenases, xantinas oxidorredutases, aldocetorredutases, quinona redutases, prostaglandina redutases, dentre outras. As hidrolases, enzimas também importantes da biotransformação de fase I, podem ser encontradas no citosol ou no retículo endoplasmático.
Reações de Oxidação
Dentre as reações de fase I mais importantes, temos a oxidação, reação que envolve um sistema enzimático denominado oxidase de função mista
ou monoxigenases. Essas enzimas são encontradas principalmente no retículo endoplasmático liso em células do fígado e de outros órgãos, como rins,
vias nasais, cérebro, pele e intestino. As monoxigenases são enzimas pouco específicas que catalisam o metabolismo de uma gama de compostos,
sendo representadas por duas superfamílias de
enzimas do citocromo P450 e da
flavina monoxigenase.
Muitas reações catalisadas pelas enzimas dessas famílias necessitam da presença de oxigênio molecular e de coenzimas como NADH e NADPH para que ocorram. Quanto à localização celular dessas enzimas, as CYPs e FMO relacionam-se ao processo de biotransformação microssomal, devido à sua principal localização nos microssomos encontrados no retículo endoplasmático.
Enquanto as demais enzimas do metabolismo de fase I são consideradas enzimas do metabolismo não microssomal, uma vez que se encontram distribuídas por outros compartimentos celulares, como na membrana mitocondrial ou citosol, algumas poucas hidrolases e aldeído desidrogenases ainda podem ser encontradas nos microssomas.
Citocromo P450 E Biotransformação Microssomal
O nome citocromo P450 ou CYP450 é derivado das palavras gregas Kyto, que significa célula, e Khrōm(at), que significa cor. A letra P representa a palavra pigmento, enquanto o número 450 é derivado do fato de que essas proteínas apresentam absorção espectrofotométrica máxima na região de 450 nanômetros, quando em seu estado reduzido e complexadas com monóxido de carbono.
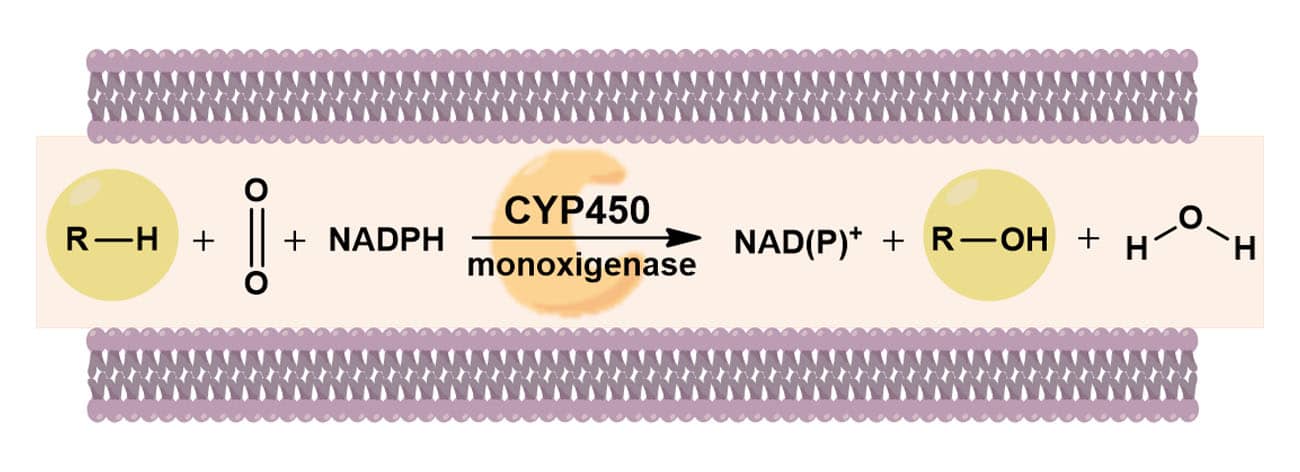
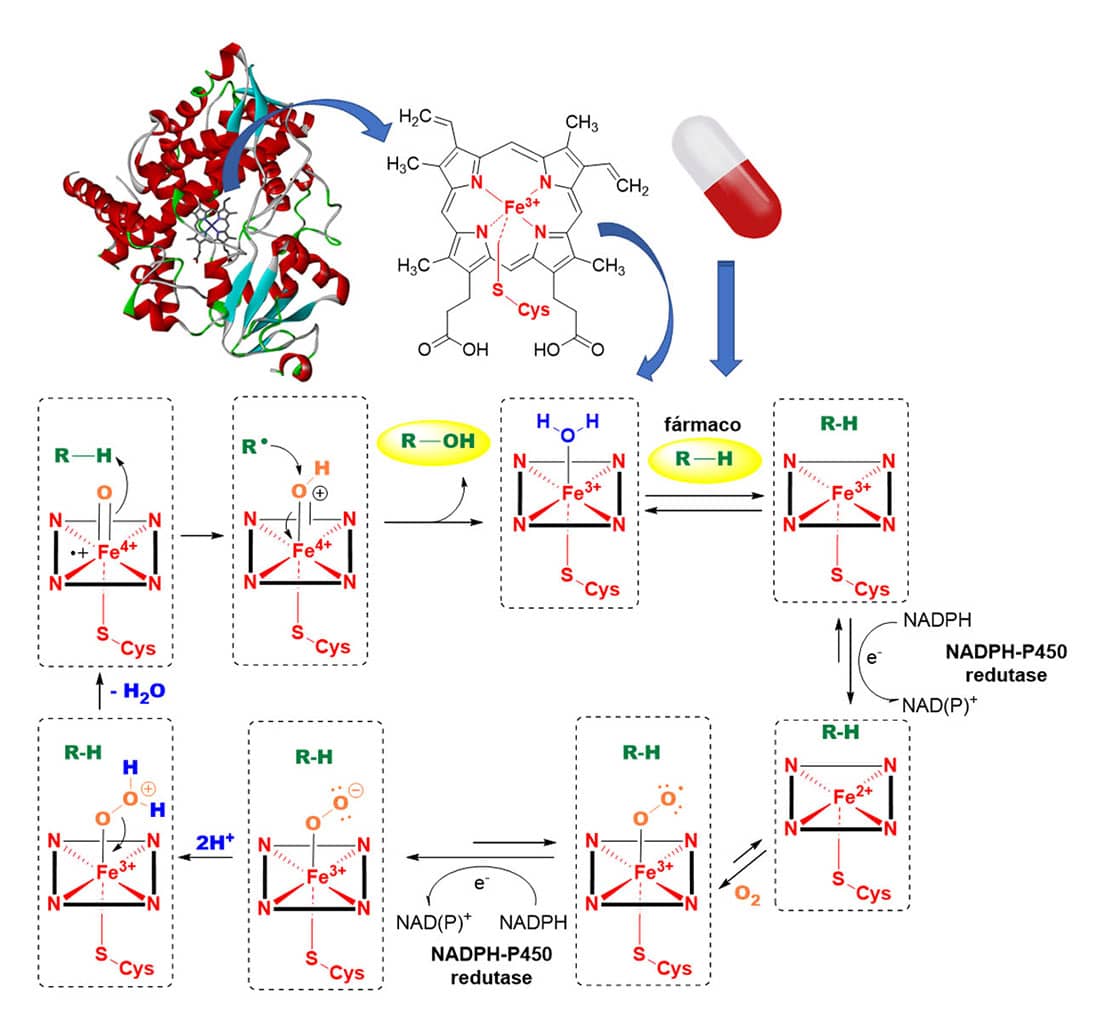
A superfamília da CYP450 são enzimas que apresentam em seu sítio ativo o grupamento heme, sendo suas representantes encontradas tanto em células procariontes como em eucariontes. Em relação à bioquímica do processo enzimático das monoxigenases, estas promovem a oxidação de substratos pela inserção de um átomo de oxigênio enquanto o outro átomo de oxigênio é reduzido à água (Figura 12).
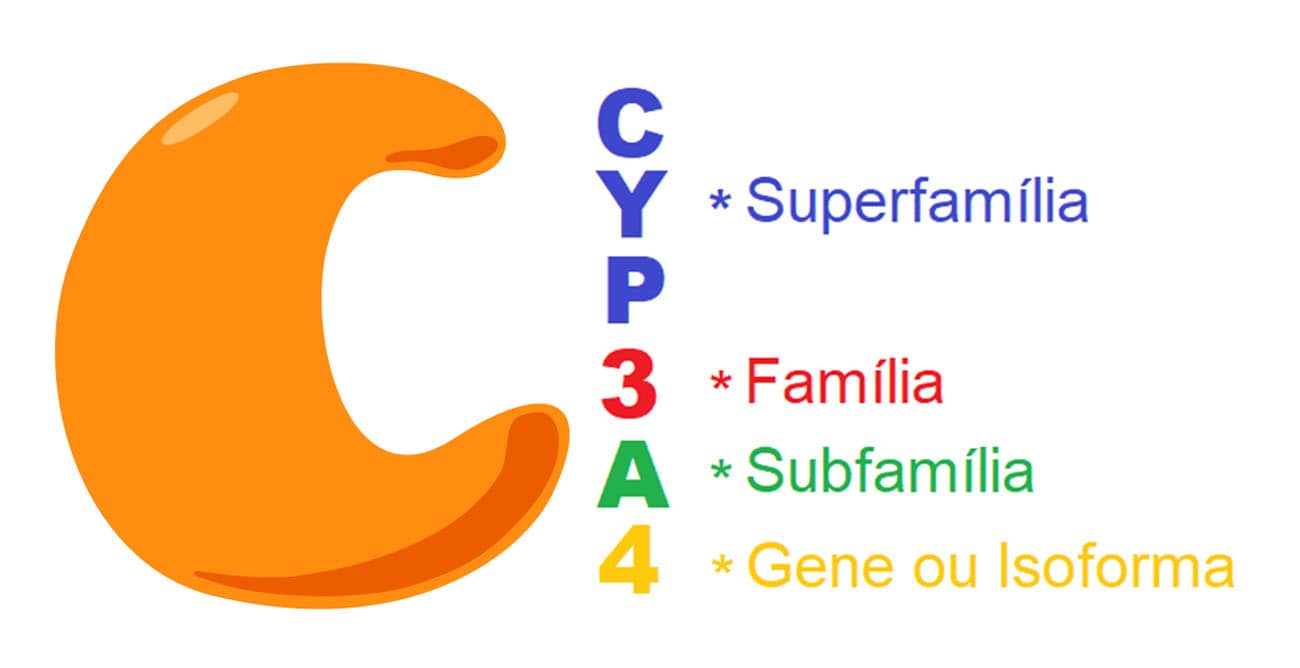
Até o momento, um total de 57 genes funcionais relacionados à CYP450 foram identificados para a espécie humana, sendo esses genes responsáveis pela codificação de um total de 18 famílias e 44 subfamílias de CYP. A nomenclatura dessas enzimas é dada pela abreviação do citocromo P450 pela sigla CYP, seguida de um número responsável pela identificação da família genética, uma letra relacionada à subfamília e, por último, outro número que determina o gene específico pela codificação ou isoenzima (Figura 13).
Apesar da ampla diversidade de enzimas que compõem as famílias e subfamílias da superfamília citocromo P450, apenas as famílias CYP1, CYP2 e CYP3 estão envolvidas no processo de biotransformação de fármacos. Dentre essas, as enzimas CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 e CYP3A4 respondem por cerca de 90% de todas as reações de metabolismo de fase I de fármacos do tipo oxidativo.
De forma resumida, a estrutura proteica das CYP450 apresenta quatro elementos fundamentais, sendo eles:
- Um grupo proteico heme do tipo ferroprotoporfirina IX, cujo átomo de ferro encontra-se no seu estado férrico (Fe3+).
- Uma cadeia polipeptídica, contendo de 480 a 560 aminoácidos, de codificação determinada por um único gene.
- Uma enzima do tipo flavoproteína dependente de NADH.
- O citocromo b5, responsável pelo transporte do segundo elétron proveniente da oxidação catalisada pela enzima.
As CYPs são capazes de realizar diversas reações do tipo oxidação como hidroxilações aromáticas, alílicas, benzílicas, alquílicas e α-heteroátomo; oxidação de heteroátomos; epoxidações e desalquilações.
O mecanismo reacional das CYPs envolve diversas etapas reacionais, iniciando pela entrada do substrato (p. ex. fármaco) no sítio catalítico da enzima, deslocando a molécula de água que se encontra coordenada ao grupo heme em seu estado inativo. A partir daí, é formado um complexo binário substrato-enzima, o que torna sua estrutura suscetível ao recebimento de um elétron (e-) proveniente da redução do NADPH à NAD(P)+ pela NADPH-CYP450 redutase.
Ao receber esse elétron, o átomo de ferro é reduzido de sua forma férrica (Fe3+) à forma ferrosa (Fe2+), mais reativa frente ao oxigênio molecular (O2), possibilitando a sequência reacional.
Ao reagir com o O2, o complexo ternário O2-enzima-substrato é formado na forma radicalar, que sofre novamente redução pela NADPH-CYP450 redutase formando o ânion Fe(III)-peróxido.
Esse ânion sofrerá dupla protonação do meio devido a seu caráter nucleofílico e consequente perda de água (H2O), acarretando a formação de uma espécie eletrofílica e altamente reativa com o ferro em estado de oxidação +4.
O complexo enzimático promove, então, a cisão homolítica da ligação carbono-hidrogênio (C-H) do substrato (fármaco), formando uma espécie radicalar reativa que reagirá com a hidroxila (OH), formando o metabolito oxidado e regenerando a enzima ao seu estado inicial (Figura 14).
Hidroxilação
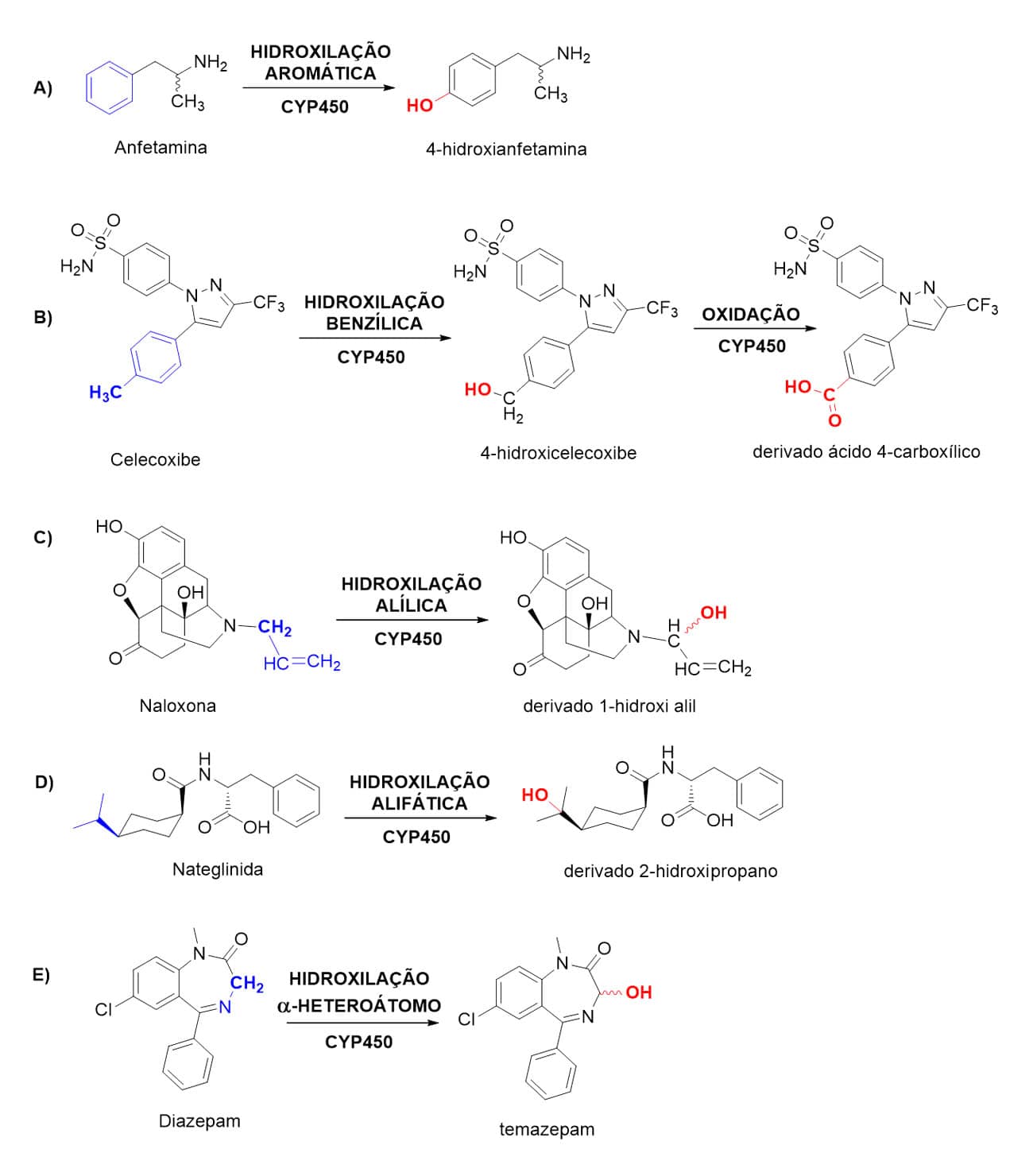
Dentre as reações de metabolismo de fase I catalisadas pelas CYPs, as hidroxilações respondem pela maioria das biotransformações realizadas por essas enzimas. Dependendo da estrutura dos fármacos contendo carbonos passíveis de oxidação, as hidroxilações podem ser do tipo aromática, benzílica, alílica; alifática ou α-heteroátomo.
Em relação à estrutura química dos fármacos disponíveis, muitos apresentam ao menos um anel aromático em sua estrutura, por isso a hidroxilação aromática se torna uma das biotransformações mais prevalentes. Uma vez que os substituintes presentes no anel aromático influenciam na reatividade de cada posição do anel, a regiosseletividade da reação de hidroxilação dependerá da natureza desses grupamentos e de sua consequente interação com o sítio catalítico da enzima.
A densidade eletrônica de suas diferentes posições, assim como fatores associados a impedimentos estéricos, aumentarão ou diminuirão a reatividade dessas posições, orientando a posição em que ocorrerá a hidroxilação aromática. Como exemplo de biotransformação de fase I do tipo hidroxilação aromática, temos o metabolismo da anfetamina, que gera o metabólito 4-hidroxianfetamina (Figura 15A).
Em relação à hidroxilação benzílica, esta ocorre em carbonos de posição benzílica, ou seja, diretamente ligados ao benzeno. Isso acontece porque esses carbonos se tornam pontos de labilidade metabólica devido à estabilização do radical benzílico formado durante o mecanismo de hidroxilação nesses compostos.
Dessa forma, essas reações levam à formação inicial do álcool benzílico, que, por ação de outras CYP ou da enzima álcool desidrogenase, é metabolizado a seu ácido carboxílico correspondente. Muitos medicamentos sofrem esse tipo de hidroxilação, como celecoxibe (Figura 15B), zolpidem e a tolazamida.
Nos casos de fármacos que contêm a função alceno em sua estrutura, a hidroxilação alílica ocorrerá de forma semelhante à hidroxilação benzílica. A dupla ligação do alceno torna essa posição reativa de forma semelhante à posição benzílica, ocorrendo a hidroxilação no carbono alílico, ou seja, vizinho à dupla ligação. O mecanismo envolvido nesse tipo de hidroxilação ocorre via radicalar e pode ser observado no metabolismo da naloxona (Figura 15C), um importante antagonista opioide utilizado em intoxicações por opiáceos.
A hidroxilação alifática, apesar de menos reativa que as anteriores, ocorre comumente em fármacos que contenham grupamentos isopropila ou tert-butila, pois esses grupamentos estabilizam de forma mais eficiente os radicais formados em carbonos secundários e terciários, respectivamente, no processo de biotransformação oxidativa desse tipo. Os medicamentos ibuprofeno e nateglinida são exemplos de fármacos que sofrem esse tipo de hidroxilação (Figura 15D).
Fármacos que apresentam heteroátomos como nitrogênio, oxigênio ou enxofre em sua estrutura podem apresentar carbonos alfa a esses átomos, sendo estes substratos das reações de hidroxilação α-heteroátomos. Carbonos em posição α a heteroátomos são reativos para reações de hidroxilação, ocorrendo em diversos fármacos da classe dos benzodiazepínicos, como o diazepam (Figura 15E).
As reações de hidroxilação podem ocorrer ainda nos carbonos α a carbonos sp ou sp2, como nas funções alcino e carboniladas que apresentem carbono α à carbonila. Como exemplo de fármaco contendo grupo alcino que sofre esse tipo de oxidação, temos o antiviral efavirenz; como exemplo de fármaco contendo o grupo cetônico passível dessa reação, temos a nabumetona.
Epoxidação
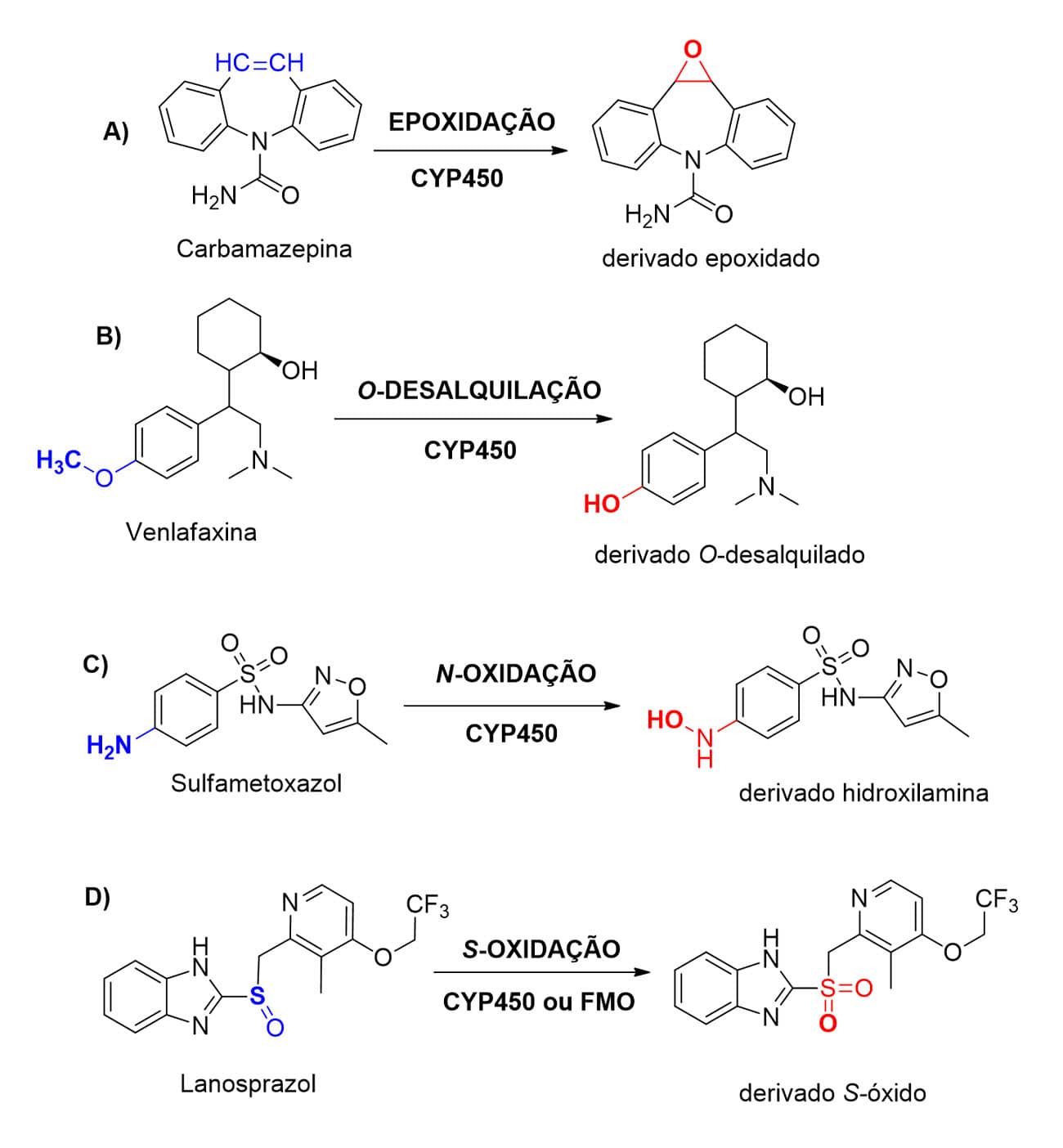
As reações de oxidação do tipo epoxidação formam o grupo epóxido a partir da biotransformação de compostos contendo ligação dupla ou tripla alifática, e seguem um mecanismo reacional similar ao ocorrido para as reações de oxidação em anéis aromáticos via formação de complexo-π entre os elétrons da dupla ligação e a porção oxidante do sítio catalítico da CYP450.
O medicamento carbamazepina sofre essa biotransformação pelo metabolismo de fase I (Figura 16A). É interessante ressaltar que, dentre as reações de fase I, a epoxidação, diferentemente das demais, forma uma espécie eletrofílica passível de interação com alvos celulares importantes que podem levar à toxicidade devido a esse grupamento toxicofórico.
N-, O- OU S-DESALQUILAÇÃO
Para que a reação de N-, O- ou S-desalquilação ocorra, é necessário que, previamente, o fármaco sofra uma reação de hidroxilação α-heteroátomo em funções como aminas (R1-CH2-NH-R2), éteres (R1-CH2-O-R2) ou tioéteres (R1-CH2-S-R2), pois acarretarão a formação de metabólitos instáveis como hemiaminal, semicetal e tio-álcool, respectivamente. Então, esses compostos sofrerão, via rearranjo intramolecular, a reação de X-desalquilação pela perda do grupamento alquila ligado ao heteroátomo.
Os metabólitos formados nesse processo são respectivamente aminas (NH2-R2), álcoois (HO-R2) e tióis (HS-R2). Como exemplo de fármacos que sofrem desalquilação desse tipo, temos a sertralina e a venlafaxina (Figura 16B).
Oxidação de Heteroátomos (N, S)
Fármacos que apresentam em sua estrutura química funções nitrogenadas do tipo aminas ou amidas ou que contêm o enxofre como heteroátomo, como tióis, tioéteres, sulfóxidos e derivados tiocarbonilados, são passíveis de sofrer oxidação desses heteroátomos. As funções que contêm nitrogênio podem ser oxidadas de aminas terciárias (alifáticas ou aromáticas) em metabólitos do tipo N-óxidos, enquanto aminas ou amidas primárias ou secundárias são oxidadas à hidroxilamina.
Como exceção às amidas 1ª e 2ª, as terciárias tendem a ser resistentes a processos de oxidação. Diferentemente das reações para compostos nitrogenados, as reações de oxidação com compostos contendo enxofre podem ocorrer tanto via enzimas da superfamília do citocromo-P450 como via flavinas monoxigenases (FMO). Sulfametoxazol (Figura 16C) e lanosprazol (Figura 16D) são fármacos que sofrem esses tipos de biotransformação.
Flavina Monoxigenase
Outra enzima importante no processo de biotransformação de fármacos via oxidação é a flavina monoxigenase (FMO), responsável pelas mesmas modificações químicas oxidativas realizadas pelas CYPs. Apesar de utilizarem oxigênio molecular e NADPH como cofator para suas reações, as FMOs apresentam seletividade e mecanismos catalíticos distintos das CYPs.
Uma diferença relacionada ao seu mecanismo ocorre pela presença de dinucleotídeo de flavina e adenina (FAD) como parte da estrutura catalítica, diferente do grupo heme, e em seu sítio ativo, as FMOs apresentam um resíduo de arginina essencial para sua atividade. Assim como as enzimas da superfamília do citocromo-P450, as flavinas monoxigenases também podem ser encontradas por diversos tecidos e órgãos e, assim como a maioria das CYPs, sua estrutura também se encontra ancorada nas membranas. As FMOs realizam oxidação de grupos funcionais contendo heteroátomos como aminas, sulfetos, selênio, fosfina, além de oxidação do carbono de alguns aldeídos benzílicos.
Outras Enzimas Oxidativas Envolvidas Na Biotransformação Não Microssomal
Diversas outras enzimas além das CYP450 e FMO estão envolvidas no metabolismo de fármacos via reações de oxidação como as monoaminoxidases (MAO), envolvidas na desaminação de catecolaminas e na oxidação de alguns fármacos, a álcool desidrogenase, aldeído desidrogenase, β-oxidase e a xantina oxidase. Essas enzimas não microssomais tendem a ser mais específicas, oxidando fármacos que apresentem estruturas relacionadas a seus substratos naturais.
As monoaminoxidases apresentam duas isoenzimas: MAO-A e MAO-B, sendo flavoenzimas mitocondriais de diferentes seletividades para seus substratos.
Após a oxidação do carbono α ao nitrogênio de aminas, as MAOs eliminam a
função nitrogenada na forma de amônia ou amina funcionalizada. Alguns fármacos biotransformados pelas monoaminoxidases são a anfetamina e sertralina.
REAÇÕES DE REDUÇÃO E SUAS ENZIMAS ENVOLVIDAS
As biotransformações de fármacos do tipo redução ocorrem por meio da adição de hidrogênio a funções que contêm ligações duplas como em grupos nitros, nas carbonilas de aldeídos e cetonas, alcenos, ligações dissulfeto (S-S) ou em azocompostos (N=N) (Figura 17).
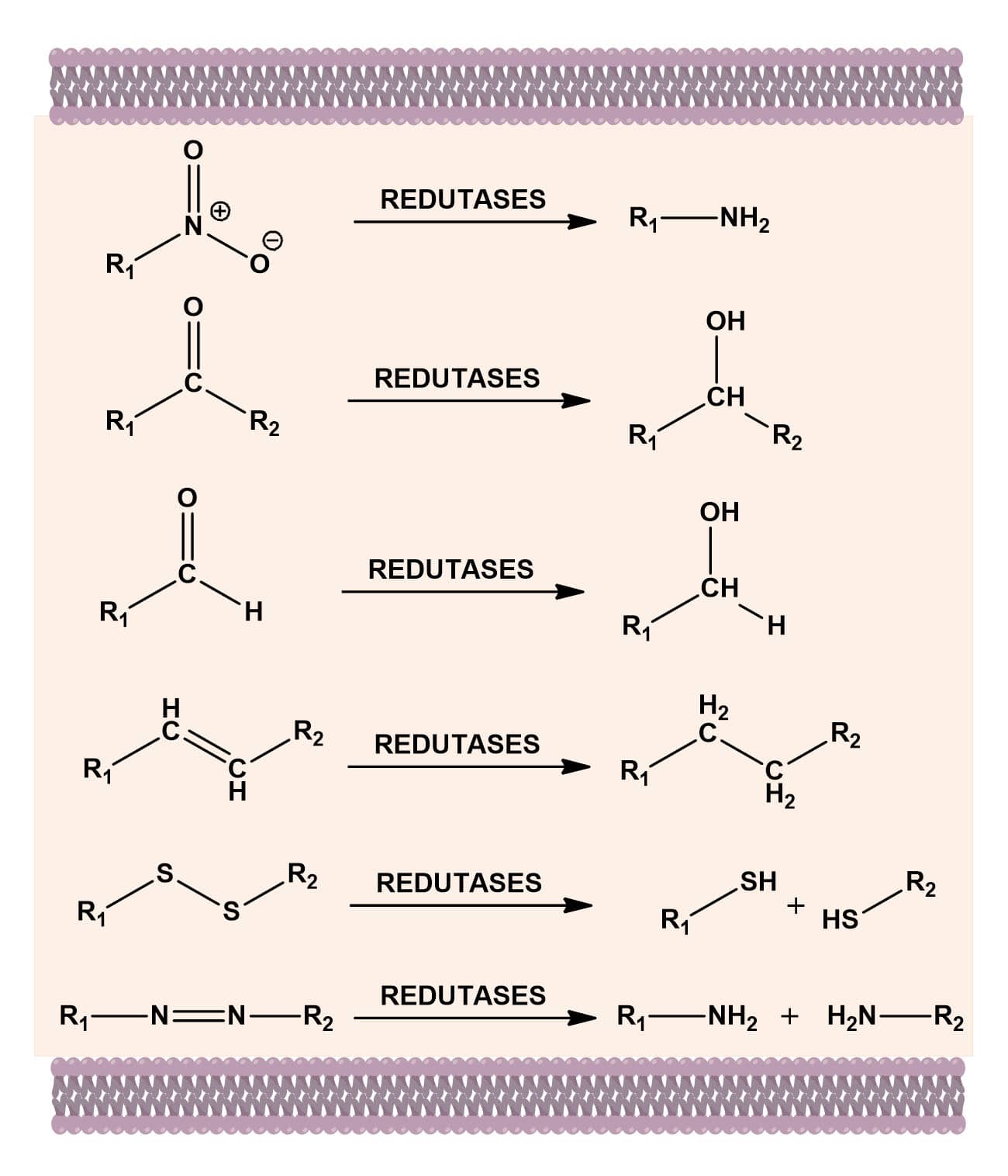
Essas reações podem ser microssomais, como para a NADPH-citocromoP450 redutase, enzima que se encontra ancorada na membrana microssomal no retículo endoplasmático.
Os mecanismos reacionais das diferentes redutases é bastante distinto, variando para cada tipo de redutase e substrato envolvido na biotransformação, mas, de forma resumida, culminam na adição de hidrogênio às funções passíveis de sofrer redução, formando os metabólitos reduzidos.
As NADPH-citocromoP450 redutases catalisam a redução de substratos contendo o grupo nitro (R-NO2) a intermediários do tipo hidroxilamina ou nitroso (R-N=O) e, por fim, a metabólitos contendo a função amina (R-NH2). O fármaco nimesulida (Figura 18), por conter em sua estrutura química uma função nitroaromática (Ar-NO2), está suscetível à reação de redução dessas enzimas de fase I.
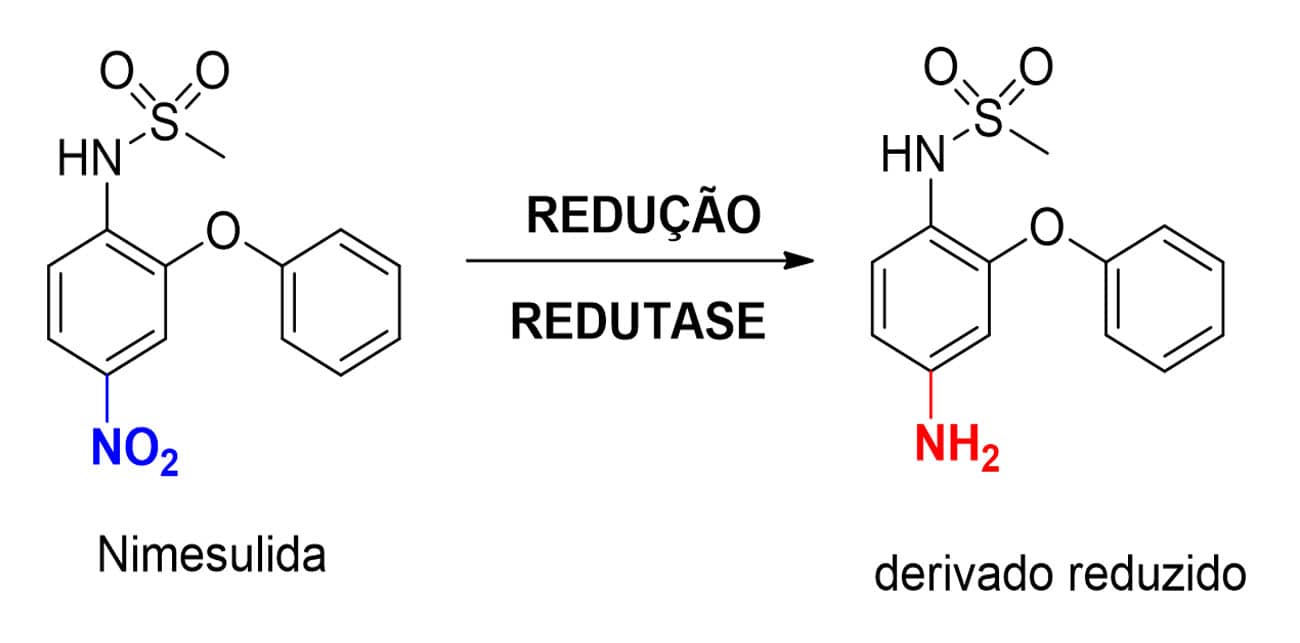
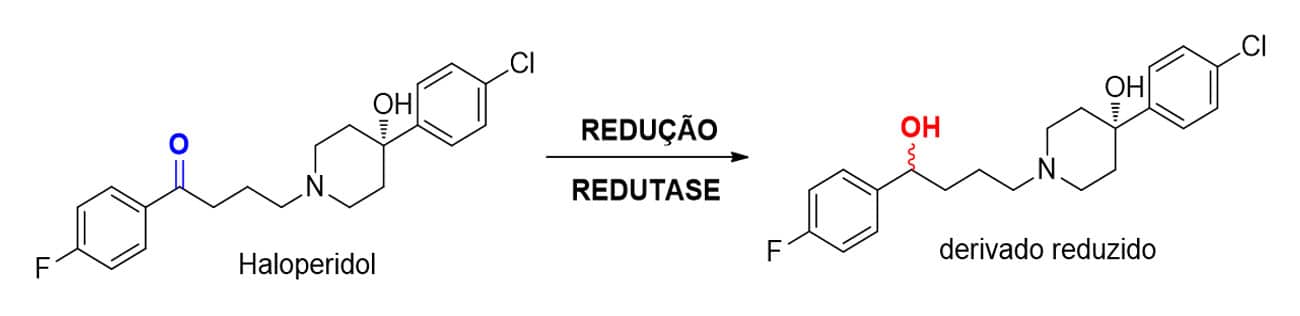
Redutases do tipo aldocetorredutases reduzem carbonilas de aldeídos (R-HC=O) e cetonas (R-CO-R`) a seus respectivos álcoois, tendo como exemplos fármacos que sofrem esse metabolismo a oxcarbazepina e o haloperidol (Figura 19).
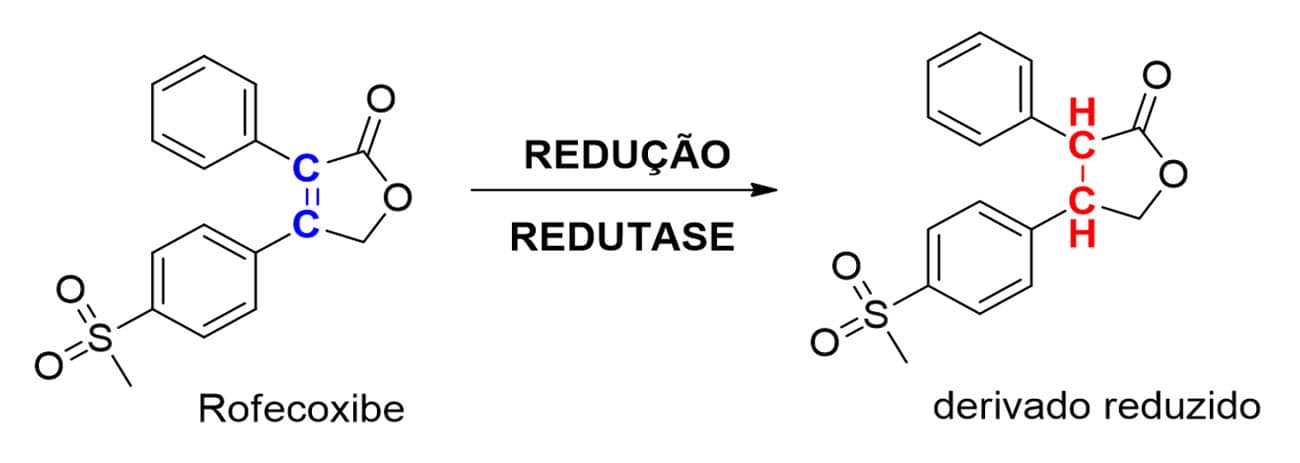
Fármacos que apresentam hidrocarbonetos insaturados do tipo alceno (C=C) em sua estrutura, tanto em sistemas cíclicos como em acíclicos, podem ser reduzidos ao alcano correspondente pela ação de redutases do metabolismo de fase I. O fármaco anti-inflamatório não esteroidal rofecoxibe (Figura 20) exemplifica esse tipo de reação de biotransformação.
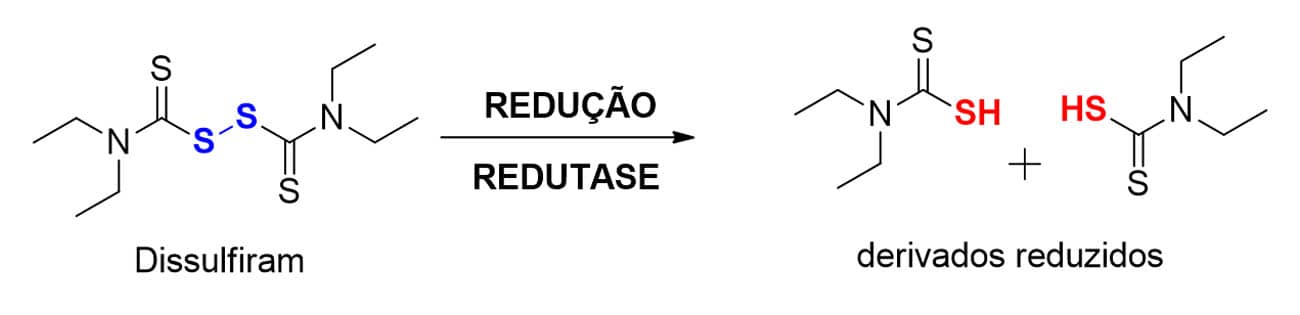
Ligações do tipo dissulfeto (R-S-S-R`), que podem ser obtidas a partir de oxidação de grupos sulfidrila (R-SH) por enzimas oxidativas do metabolismo de fase I, ou já estarem presentes na estrutura original do fármaco, podem ser reduzidas a metabólitos com função tiol, como para a biotransformação do dissulfiram (Figura 21).
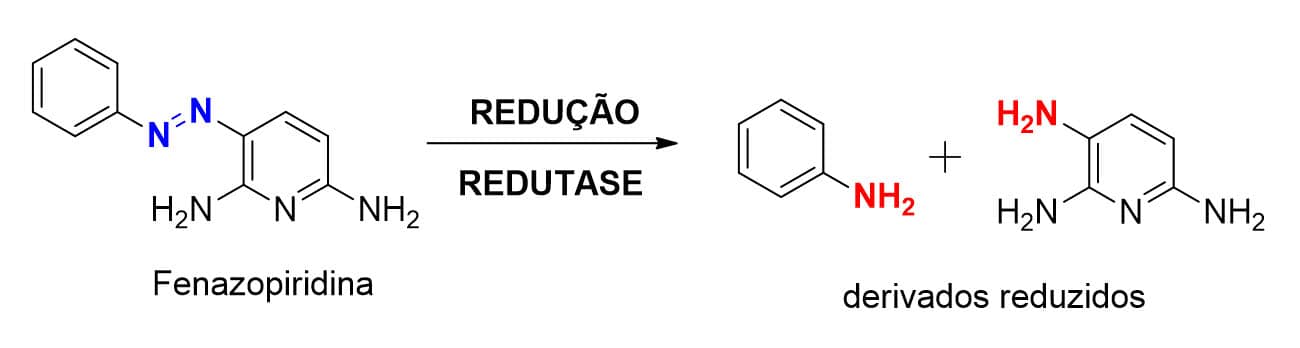
Uma classe de enzimas redutoras microssomais chamadas de azorredutases promove o metabolismo de azocompostos pela clivagem da ligação N=N com formação de duas aminas primárias. O fármaco fenazopiridina (Figura 22) sofre esse tipo de metabolismo de fase I redutivo.
REAÇÕES DE HIDRÓLISE E SUAS ENZIMAS ENVOLVIDAS
Uma terceira reação relacionada ao metabolismo de fase I tão importante quanto os processos redox é a reação de hidrólise. As hidrolases, enzimas que participam desse processo de biotransformação, podem ser encontradas em níveis hepático, gastrintestinal ou mesmo plasmático, tanto em localizações microssomais como mitocondriais ou citosólicas.
Essas enzimas realizam reações de clivagem hidrolíticas de diversos grupos funcionais derivados do ácido carboxílico, como ésteres, tioésteres, amidas, hidrazidas, carbamatos, imidas, ureias, entre outros a metabólitos de maior caráter polar (Figura 23).
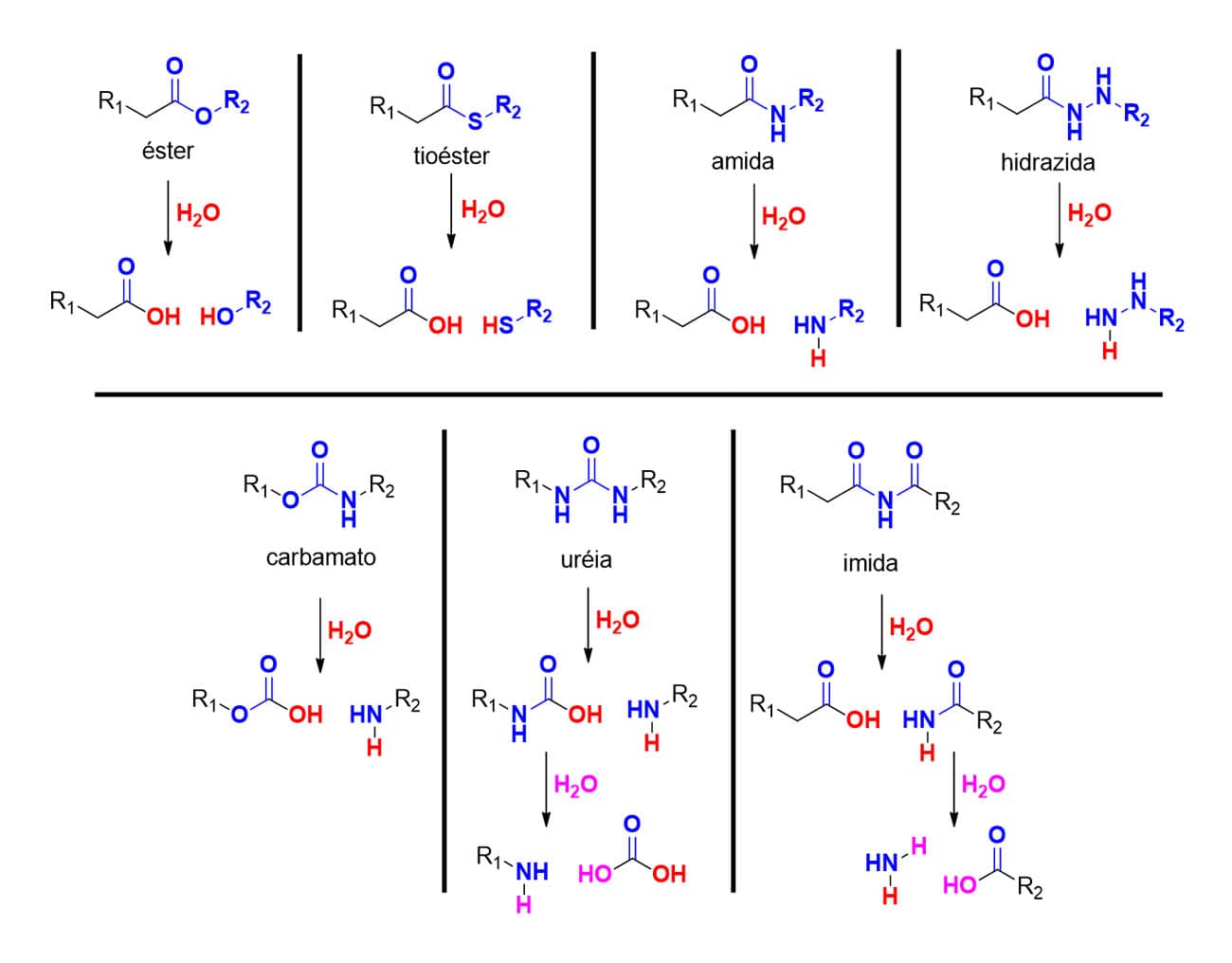
Diante da gama de substratos e enzimas envolvidos no processo de hidrólise, as reações de hidrólise seguirão diferentes mecanismos catalíticos, porém de forma geral envolvendo o ataque nucleofílico de uma molécula de água à carbonila do substrato complexado ao resíduo catalítico da enzima, formando um intermediário que, ao regenerar a carbonila, forma um ácido carboxílico.
Saiba mais
Uma enzima bastante conhecida e alvo de alguns fármacos voltados para o tratamento do Alzheimer, como a rivastigmina e a donepezila, chamada de acetilcolinesterase, pertence à classe de enzimas esterases, responsáveis pela hidrólise de ésteres. Quando a reação de hidrólise ocorre em substratos do tipo lipídeos, as enzimas recebem a denominação de lipases.
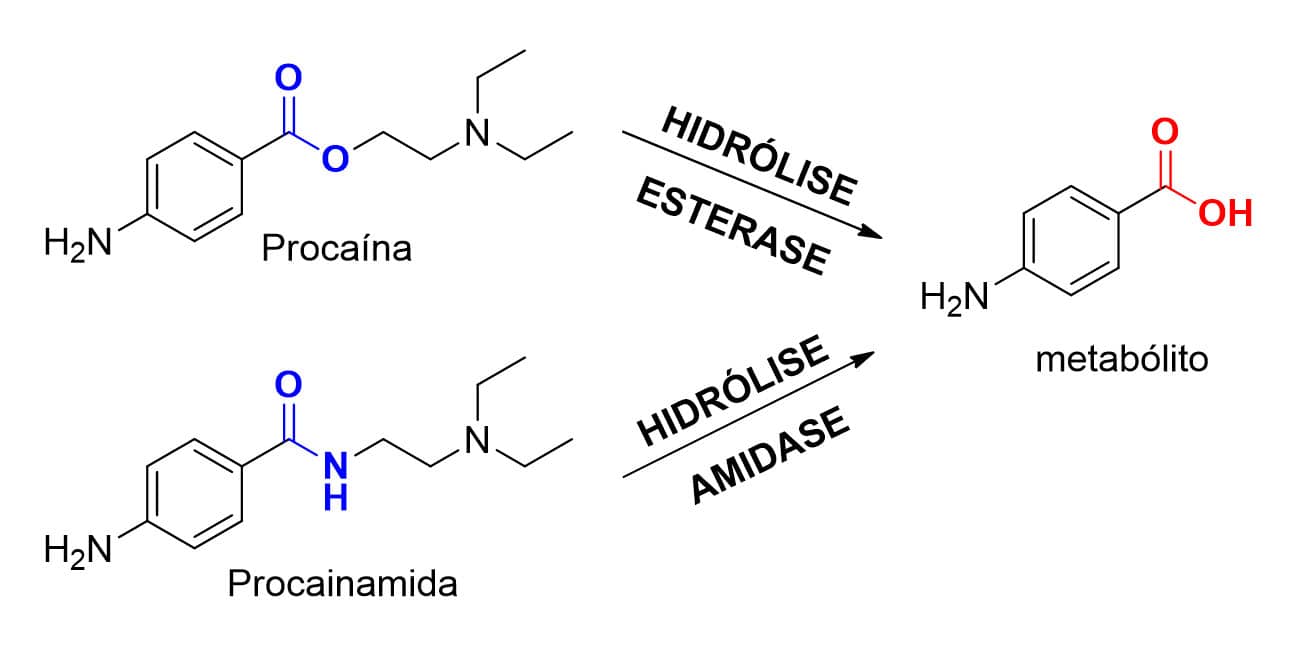
Reações de hidrólise ocorridas em grupos funcionais do tipo amida são catalisadas pelas enzimas amidases, amplamente encontradas no plasma e no trato gastrointestinal. Tanto as esterases quanto as amidases são sensíveis aos diferentes tipos de efeitos estéricos e eletrônicos de seus substratos, pois substituintes volumosos ou com alta liberdade conformacional podem dificultar a interação desses substratos carbonilados com o sítio catalítico da enzima. Modificações nas porções alquílicas dessas funções podem aumentar, diminuir ou mesmo impedir o processo de metabolização via hidrólise.
Exemplo
Entre os fármacos que sofrem metabolismo de fase I via hidrólise, podemos citar os anestésicos procaína e seu derivado procainamida, cuja diferença estrutural se dá apenas entre as funções carboniladas presentes em ambos (Figura 24).
OUTRAS REAÇÕES DO METABOLISMO DE FASE I
O universo reacional relacionado às reações de metabolismo de fase I é bastante diverso, incluindo, além das reações estudadas, reações de desacetilação, desaminação, descarboxilação, isomerização, hidratação, entre outras.
Saiba mais
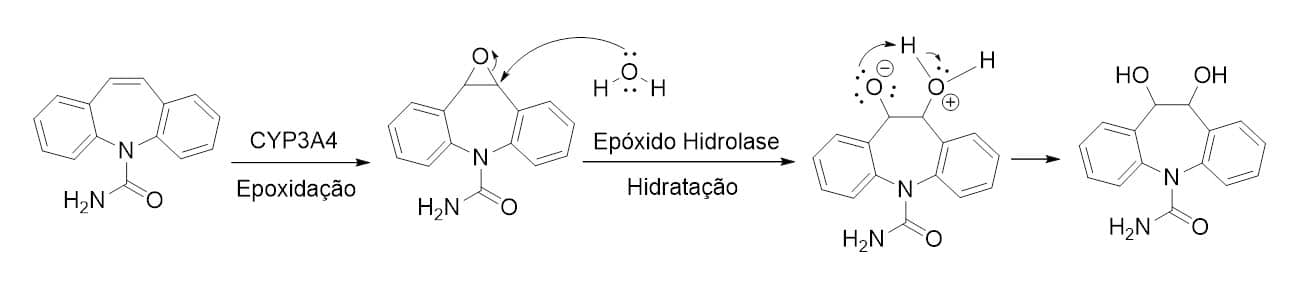
A reação de hidratação no contexto do metabolismo de fármacos se dá pela adição de molécula de água a sua estrutura. Os fármacos que apresentam a função epóxido em sua estrutura são altamente suscetíveis à reação de hidratação, a qual, pela abertura do epóxido, forma o grupo diol, sendo catalisada pela enzima epóxido hidrolase. O anticonvulsivante carbamazepina, após sofrer metabolização formando seu metabólito epoxidado, pode sofrer uma reação consecutiva pela epóxido hidrolase, formando o diol correspondente (Figura 25).
Dessa forma, muitas outras reações metabólicas de fase I podem ocorrer frente aos diferentes xenobióticos existentes, não estando, portanto, limitadas apenas às reações clássicas discutidas. Isso porque, na teoria, qualquer reação orgânica passível de ocorrência poderá acontecer pelas enzimas do metabolismo de fase I, como a reação de descarboxilação ocorrida na L-dopa, formando a dopamina.
Devemos, portanto, sempre ter em mente o propósito dessas reações, as quais tendem a aumentar a hidrofilicidade de seus metabólitos gerados, além de prepará-los para as reações de metabolismo de fase II que culminarão na produção de compostos passíveis de eliminação do organismo no qual se encontram.

Reações de metabolismo de fase I
O especialista Emerson Peçanha fala sobre as principais reações de fase I.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever os processos e reações de metabolismo de fase II.
METABOLISMO DE FASE II
Geralmente, a maioria dos fármacos que entram na fase II do metabolismo é formada por moléculas que já sofreram alguma modificação de fase I. Esses metabólitos formados na fase I tendem a apresentar um caráter hidrofílico mais elevado do que o fármaco original, sendo essa característica associada ao tipo de reação enzimática sofrida e à consequente modificação química adquirida.
Mesmo com as devidas modificações de biotransformação de fase I, a maioria desses metabólitos ainda não apresenta a polaridade necessária para ser eliminada do corpo, sendo importante que esses metabólitos sofram outras modificações estruturais que adequem sua estrutura para que sejam excretados pelas principais vias: urinária ou fecal. Nesse contexto, a principal função do metabolismo de fase 2 é concluir as modificações iniciadas na fase I que formarão um metabólito suficientemente hidrofílico para ser eliminado do organismo.
As reações de biotransformação de fase II são do tipo conjugação, uma vez que conjugam fármacos ou seus metabólitos a moléculas endógenas, como o ácido glicurônico, os aminoácidos glicina ou glutationa, moléculas de sulfato, metilas ou acetilas via enzimas denominadas transferases.
As enzimas transferases são enzimas que catalisam a reação de transferência de moléculas ou porções de moléculas endógenas a diferentes substratos com participação de cofatores. Os compostos conjugados via biotransformação de fase II apresentam maior hidrossolubilidade, podendo ser excretados preferencialmente pela urina ou por via biliar, pelas fezes.
Dentre as diferentes reações de fase II, temos a glicuronidação catalisada pela enzima UDP-glicuroniltransferase (UGT), a sulfatação catalisada pela sulfotransferase, a conjugação com glicina catalisada pela acil-sintetase, as reações de metilação e acetilação pelas enzimas metiltransferase (MT) e acetiltransferase (AC), respectivamente, e, por fim, a conjugação com glutationa catalisada pela glutationa-S-transferase (GTS).
A Figura 27 explicita as reações do metabolismo de fase II, suas respectivas enzimas envolvidas e cofatores ou doadores ativos participantes de cada reação.
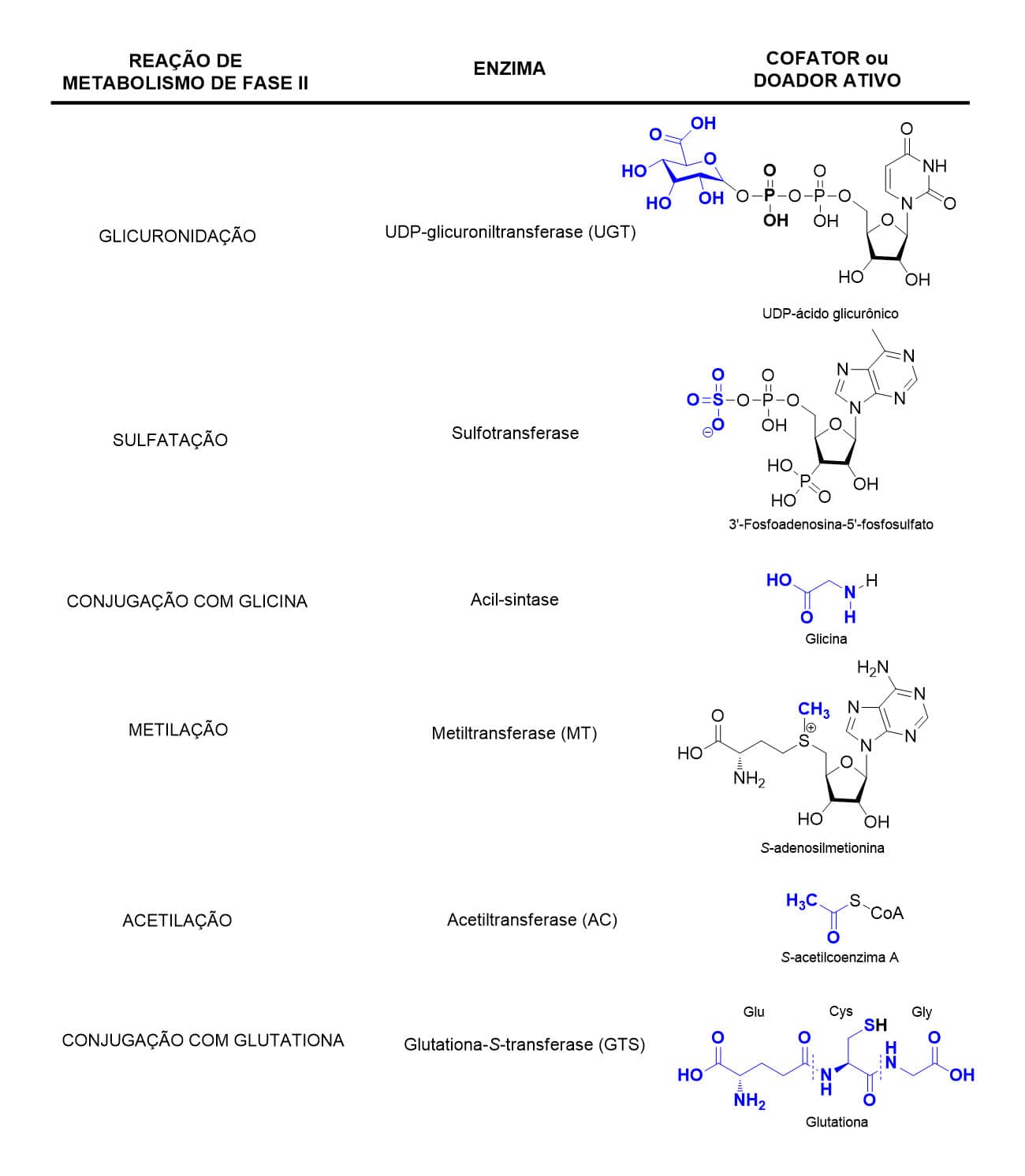
Quanto a essas reações de fase II, devemos relembrar que as reações de metilação e acetilação, diferentemente das demais, não aumentam a polaridade do metabólito formado, apesar de contribuírem para a bioinativação dos compostos, considerando que tendem a modificar pontos de interação do composto com o alvo terapêutico. Sobre a localização celular dessas enzimas, com exceção da UDP-glicuroniltransferase presente no microssoma, as demais se encontram dispersas no citosol.
Reações de glicuronidação
As reações de glicuronidação serão catalisadas em substratos que contenham, em sua estrutura, grupos funcionais do tipo hidroxila (R-OH), ácido carboxílico (R-CO2H), amina 1ª ou 2ª (R-NH2 ou R-NH-R`), hidroxilamina (R-NH-OH) ou tiol (R-SH). Esses grupos, ao sofrerem reação da transferase, irão conjugar sua estrutura a uma molécula de ácido glicurônico.
Reações de sulfatação
Para que reações de sulfatação ocorram, é importante que o substrato da enzima apresente grupos funcionais como hidroxila (R-OH), ácido carboxílico (R-CO2H), amina 1ª ou 2ª (R-NH2 ou R-NH-R`) ou hidroxilamina (R-NH-OH), que serão conjugados a uma molécula de sulfato substrato via catálise enzimática entre a transferase e seu cofator 3’-fosfoadenosina-5’-fosfossulfato.
Conjugação com o aminoácido glicina
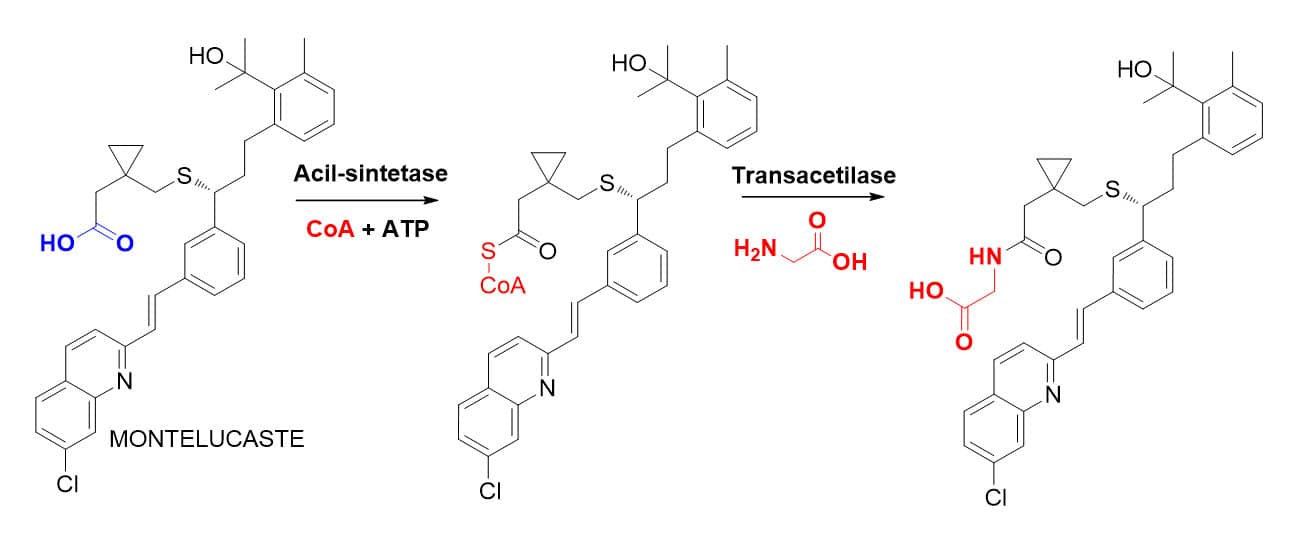
A conjugação com o aminoácido glicina poderá ocorrer em substratos que apresentem função do tipo ácido carboxílico em sua estrutura química, uma vez que estes serão conjugados ao aminoácido via ação da acil-sintetase, que catalisará a formação da ligação peptídica entre a função ácido carboxílico e a função amina da glicina.
Reações de conjugação do tipo metilação
As reações de conjugação do tipo metilação dependerão da presença de grupos funcionais do tipo hidroxila (R-OH), amina 1ª ou 2ª (R-NH2 ou R-NH-R`), tiol (R-SH) ou N-heterociclo, funções passíveis de serem alquiladas pela transferase, que utiliza como cofator a molécula endógena de S-adenosilmetionina.
Reações do tipo acetilação
Já as reações do tipo acetilação dependerão da presença de funções contendo nitrogênio ou oxigênio do tipo álcool (R-OH), amina 1ª ou 2ª (R-NH2 ou R-NH-R`), hidrazina (R-HN=NH2) ou sulfonamida (R-SO2NH2). Esses substratos reagirão com a S-acetilcoenzima A, via transferase, formando os metabólitos acetilados.
Reações de conjugação com glutationa
Diferentemente das reações de metabolismo de fase II anteriores, que necessitam de substratos contendo grupos funcionais de caráter nucleofílico para que ocorram, as reações de conjugação com a glutationa necessitam que o substrato a ser metabolizado apresente grupos funcionais eletrofílicos, como óxidos de areno, epóxido, enonas, quinonas, iminoquinonas, entre outros.
Essa característica das reações de conjugação com glutationa ocorre por conta da estrutura química do cofator, que é um tripeptídeo formado por resíduos de ácido glutâmico, cisteína e glicina, que conferem um caráter nucleofílico a essa molécula. Essa peculiaridade é de suma importância na bioinativação e detoxificação de metabólitos formados que possam apresentar grupos funcionais de caráter eletrofílico, facilitando sua eliminação.
GLICURONIDAÇÃO
A reação de conjugação de fármacos com o ácido UDP-glicurônico é uma das principais reações de biotransformação de fase II. A enzima UDP-glicuroniltransferase (UGT) catalisa o processo de transferência do ácido UDP-glicurônico para alguma função química de caráter nucleofílico presente no substrato. Dependendo da função por parte do substrato que participa da catálise, esta poderá formar metabólitos do tipo O-glicuronato, N-glicuronato ou acil-glicuronato.
Os metabólitos formados nessa etapa de biotransformação apresentam alta polaridade e consequente hidrofilicidade, devido às múltiplas hidroxilas presentes na unidade do glicuronato, sendo, portanto, facilmente excretados pelo trato urinário. Dentre as reações de metabolismo de fase II, a glicuronidação é a única biotransformação que ocorre no nível microssomal, no retículo endoplasmático.
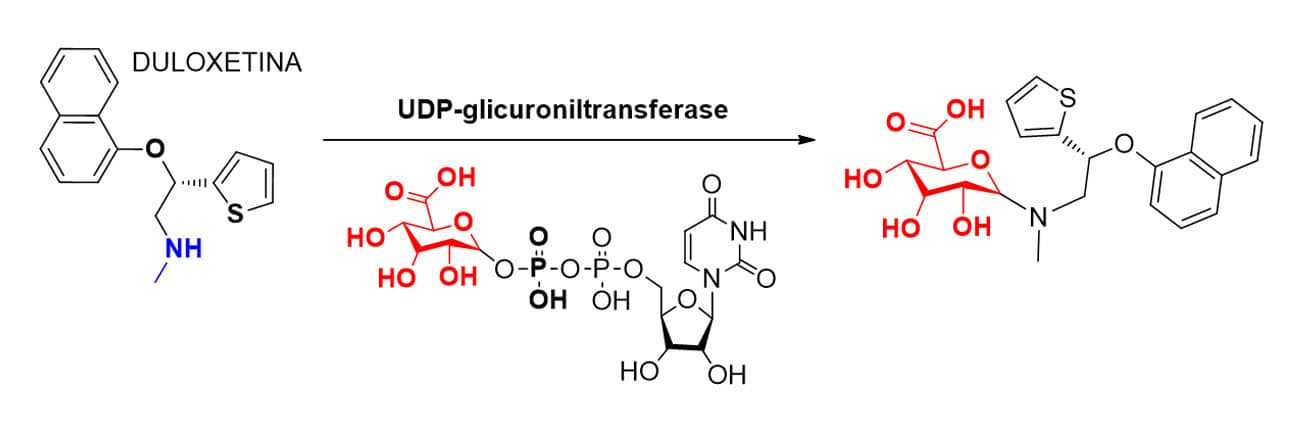
De forma resumida, o mecanismo da glicuronidação ocorre a partir da interação do fármaco e do doador ativo com o sítio catalítico da transferase, propiciando o ataque da porção nucleofílica das funções do tipo álcool/fenol, ácido carboxílico, amina 1ª ou 2ª, hidroxilamina ou tiol, ao carbono 6 do ácido glicurônico com consequente liberação da porção UDP do doador ativo e formação de metabólito éter-, éster- ou amino-glicuronato.
Fármacos como enalapril e duloxetina (Figura 28) são exemplos de substâncias que sofrem esse tipo de metabolização de fase II, enquanto o enalapril precisa sofrer reação de metabolismo de fase I do tipo hidrólise convertendo a função éster em ácido carboxílico para, só então, sofrer a glicuronidação, a duloxetina pode ser biotransformada diretamente pela fase II na sua forma conjugada ao ácido glicurônico.
SULFATAÇÃO
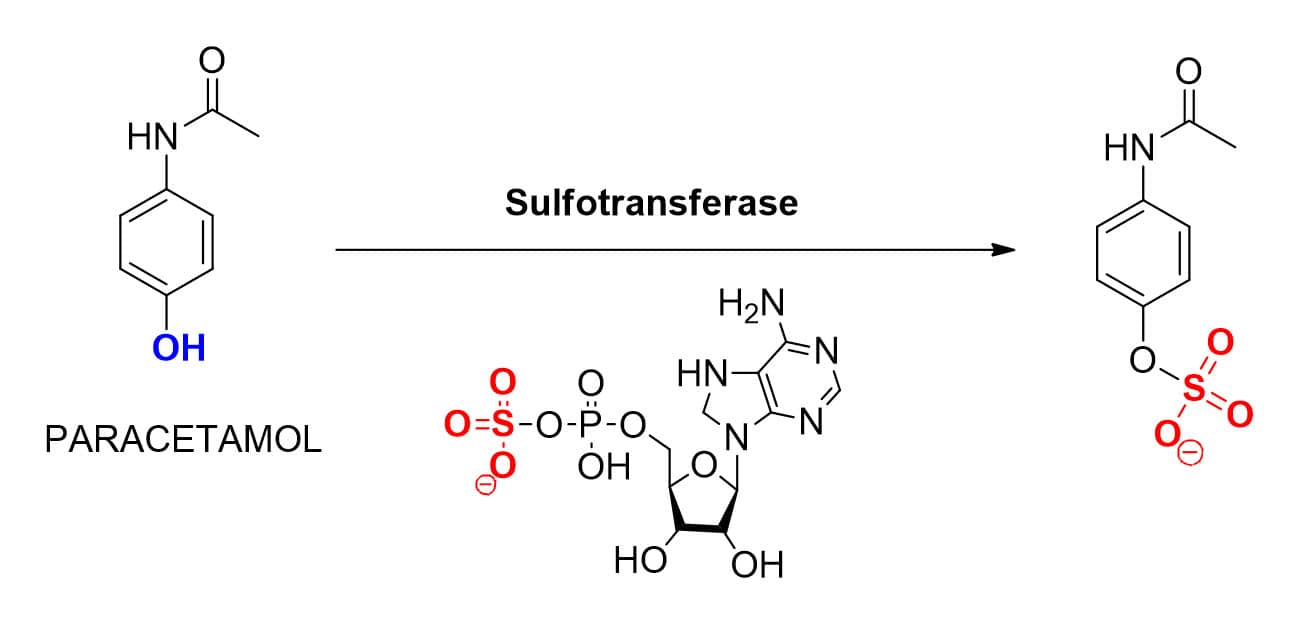
Também chamada de sulfoconjugação, a sulfatação é uma reação de biotransformação de fase II catalisada por enzimas do tipo sulfotransferases. Essas enzimas utilizam o cofator 3’-fosfoadenosina-5’-fosfosulfato como doador ativo, transferindo o sulfato deste para porções nucleofílicas de substratos como fármacos ou metabólitos contendo as seguintes funções orgânicas: álcool/fenol , ácido carboxílico, amina 1ª ou 2ª ou hidroxilamina. A disponibilidade do cofator dessa reação, assim como de seu precursor inorgânico, o sulfato, determina a taxa reacional da sulfatação.
Em relação ao mecanismo de sulfatação, este ocorre pelo ataque da porção nucleofílica do substrato ao enxofre presente no cofator, formando o metabólito sulfatado. O antipirético e analgésico paracetamol é um fármaco que sofre o processo de sulfatação durante seu metabolismo (Figura 29).
CONJUGAÇÃO COM GLICINA
A reação de conjugação de fármacos com aminoácidos, principalmente a glicina, apesar de comum, ocorre com pouca frequência, pois, para que essa biotransformação aconteça, é necessária uma etapa de ativação prévia do grupo funcional ácido carboxílico do substrato. Dessa forma, a reação de conjugação com glicina ocorre em duas etapas.
Na primeira, a enzima acil-sintetase, utilizando a coenzima-A e ATP, transforma a função ácido carboxílico na função mais reativa do tioéster de coenzima-A.
Depois, ocorre a reação de conjugação do substrato com a glicina ou outro aminoácido, via construção da ligação peptídica pela transacetilase.
Em geral, a conjugação com glicina ocorre preferencialmente para fármacos que contêm a função ácido carboxílico em baixas doses, pois, quando em altas doses, esse ácido tende a ser metabolizado por glicuronidação.
O montelucaste, fármaco antiasmático, é um exemplo de substância que sofre o metabolismo de fase II por conjugação com a glicina (Figura 30).
METILAÇÃO
As reações de fase II do tipo metilação são passíveis de ocorrer em substratos que contenham funções químicas do tipo amina, álcool ou tiol. As enzimas relacionadas a esses tipos de reação são denominadas metiltransferases e utilizam como cofator a molécula de S-adenosilmetionina, que apresenta o grupamento metil ligado a um átomo de enxofre positivo, tornando-o bastante reativo para esse tipo de reação.
Dependendo do átomo que sofrerá a reação de metilação, as enzimas podem ser chamadas de S-metiltransferase, quando a reação ocorre sobre átomos de enxofre, de N-metiltransferases, quando em átomos de nitrogênio, ou de O-metiltransferase, quando em átomos de oxigênio.
A metilação é um processo bioquímico muito comum também em processos além do metabolismo, como na biossíntese ou no catabolismo de moléculas endógenas, como adrenalina, melatonina, dopamina, entre outras. Nesse contexto, temos uma enzima importante chamada de catecol-O-metiltransferase ou COMT, que, além de participar de diversas reações bioquímicas importantes, também está envolvida no metabolismo do fármaco tadalafila, uma vez que metila uma de suas hidroxilas formadas no metabólito proveniente da biotransformação de fase I (Figura 31).
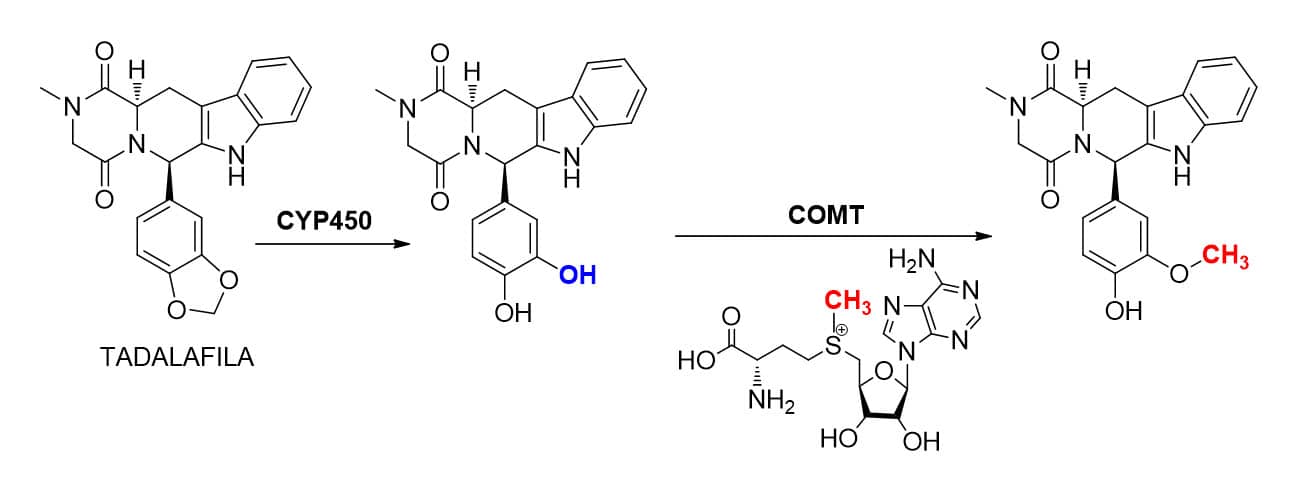
Atenção
Devemos lembrar que, diferentemente das demais reações de biotransformação, a reação de metilação tende a formar metabólitos de menor polaridade devido à inserção da metila em grupos que aumentam a polaridade da molécula, como hidroxilas, aminas ou sufidrilas. Ao alquilar esses grupos, o grupo metil tende a cessar pontos de interação de hidrogênio do substrato com o sítio catalítico, estando essas reações mais relacionadas à bioinativação de fármacos do que ao preparo da molécula para sua eliminação.
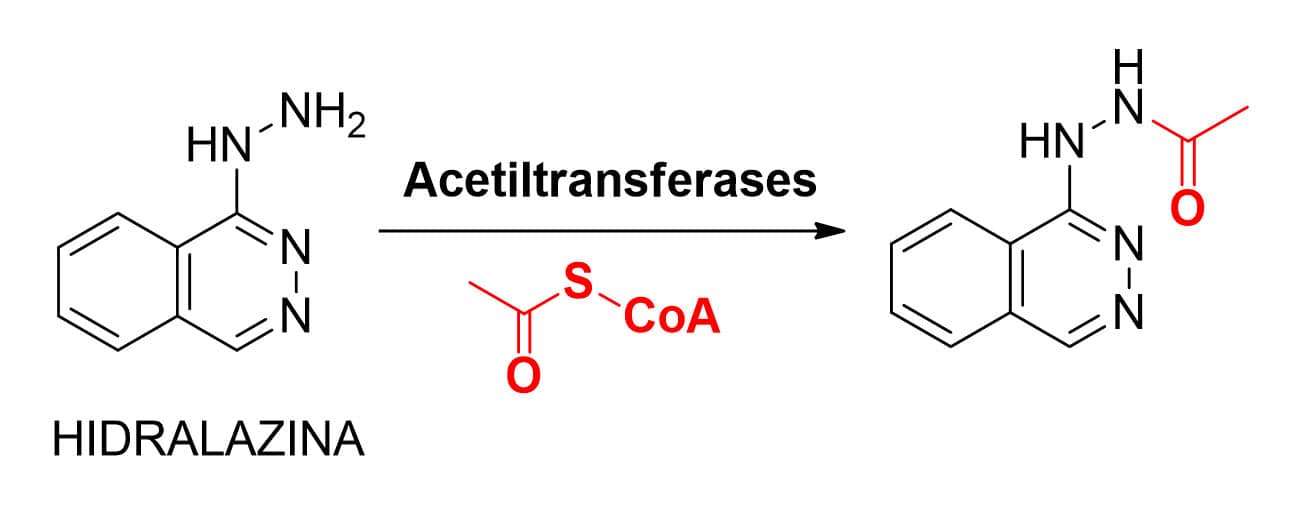
ACETILAÇÃO
Outro exemplo de reação metabólica de fase II que também leva à formação de metabólitos de menor polaridade é a acetilação. Essa reação catalisada por acetiltransferases (O- ou N-acetiltransferases) ocorre em substratos que apresentem grupos do tipo amino, sulfonamida, hidrazina ou hidrazidas, álcoois e fenóis. Para transferir o grupamento acetil, essas enzimas utilizam como doador ativo o S-acetil-CoA, formando metabólitos apolares. Alguns fármacos, após serem biotransformados por acetilação, podem formar metabólitos tóxicos, devido ao caráter eletrofílico que o grupamento acetil apresenta.
Os fármacos hidralazina (anti-hipertensivo) e tacrina (inibidor da acetilcolinesterase usado no tratamento do Alzheimer) são exemplos de compostos que sofrem metabolização de fase II via acetilação (Figura 32).
CONJUGAÇÃO COM GLUTATIONA
O metabolismo de fase II apresenta uma etapa primordial no processo de biotransformação de fármacos e outras substâncias, pois, dentre as reações de fase II, a conjugação com glutationa é a única reação na qual o substrato a ser metabolizado necessita apresentar um caráter eletrofílico e não nucleofílico. Da mesma forma, o cofator participante dessa reação apresenta um caráter nucleofílico, e não eletrofílico como nos demais doadores ativos: UDP-ácido glicurônico, 3’-fosfoadenosina-5’-fosfosulfato, glicina ou outros aminoácidos, S-adenosilmetionina ou S-acetilcoenzima A.
Como exemplos de funções presentes nesses substratos eletrofílicos, temos os epóxidos, alguns heterociclos, haletos de alquila e arila, compostos aromáticos nitrados e compostos alifáticos insaturados como alcenos e alcinos, entre outros. Os compostos com caráter eletrofílico devido a esses grupos funcionais podem se ligar a nucleófilos críticos intracelulares, como proteínas e ácidos nucleicos, levando a lesões celulares e mutações gênicas, sendo, portanto, considerados subunidades toxicofóricas (Figura 33).
Nesse contexto, devemos salientar que, em geral, diversos metabólitos do tipo eletrofílico apresentam elevado potencial de toxicidade, como o caso do metabólito epoxidado da carbamazepina, reafirmando a importância dessa reação na detoxificação do organismo.
Saiba mais
A reação de conjugação com glutationa é catalisada pela enzima citoplasmática glutationa-S-transferase e, como as demais reações do metabolismo de fase II, depende de um cofator, neste caso, a glutationa. A molécula de glutationa é um tripeptídeo (peptídeo formado por apenas 3 aminoácidos) sintetizado no fígado. A síntese desse cofator inicia-se pela junção de dois aminoácidos: o glutamato ou ácido glutâmico, com a cisteína pela enzima γ-glutamil-cisteína-sintetase formando a γ-glutamilcisteína, que será unida a uma molécula de glicina pela glutationa-sintetase, formando então a molécula de glutationa.
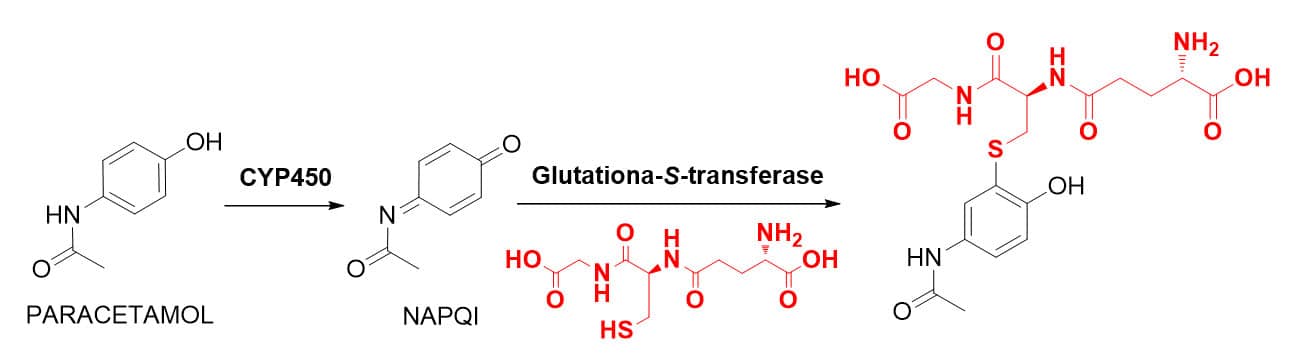
Nosso organismo utiliza-se bastante dessa biotransformação para a metabolização e eliminação do metabólito tóxico do fármaco paracetamol (ou acetoaminofeno). Pelo metabolismo de fase I, o paracetamol tem sua função fenol, oxidada a uma cetona aromática, formando o metabólito hepatotóxico N-acetil-p-benzoquinona imina. Esse metabólito, em altas concentrações, pode levar a lesões irreversíveis no fígado, causando falência hepática. O metabólito NAPQI de caráter eletrofílico é metabolizado via conjugação com glutationa em um metabólito derivado do ácido mercaptúrico inativo que pode, então, ser eliminado (Figura 34).

REAÇÕES DE METABOLISMO DE FASE II
O especialista Emerson Peçanha fala sobre as principais reações de fase II.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Diante dos conceitos estudados sobre os processos de biotransformação de fármacos e suas respectivas reações de fase I e II, é possível entender a amplitude das reações enzimáticas relacionadas a esse tão importante processo farmacocinético.
O entendimento de conceitos como xenobióticos, bioativação, bioinativação, toxificação, hidrofilicidade/lipofilicidade dos fármacos e dos diferentes fatores que influenciam toda a maquinaria da biotransformação nos prepara para observar de forma crítica os caminhos que o fármaco e seus metabólitos poderão percorrer em nosso corpo, além de ampliar a noção da importância do metabolismo no planejamento de fármacos.
As reações de oxidação, redução, hidrólise e as diferentes formas de conjugação são mecanismos biológicos importantes no processo de detoxificação tanto de fármacos como de outros xenobióticos, visando, assim, impedir o acúmulo dessas substâncias e evitando efeitos indesejáveis.

PODCAST: Reações de metabolismo de fase I e fase II
Agora, o especialista Emerson Peçanha encerra o tema falando sobre as definições gerais do metabolismo de fármacos e seus processos e reações de metabolismo de fase I e fase II.
CONQUISTAS
Você atingiu os seguintes objetivos:
Identificou os conceitos gerais importantes sobre a biotransformação de fármacos.
Descreveu os processos e reações de metabolismo de fase I.
Descreveu os processos e reações de metabolismo de fase II.
