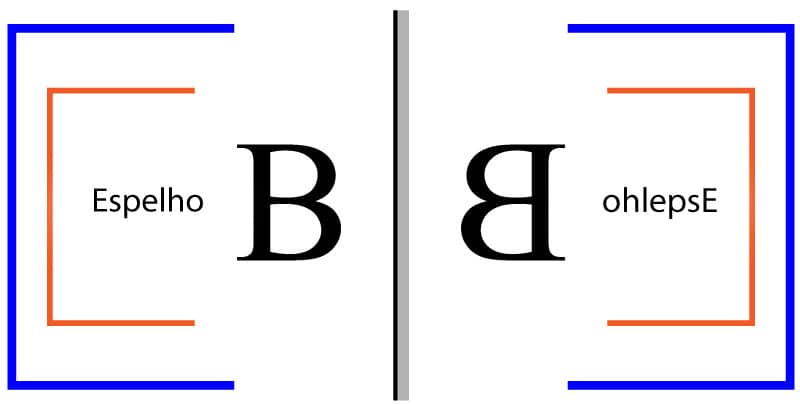Descrição
Conceitos de isomeria plana e estereoisomeria. Definição de quiralidade, carbono assimétrico e atividade óptica de substâncias quirais.
PROPÓSITO
Compreender os conceitos de isomeria plana e estereoisomeria permite o entendimento das diferenças de propriedades físico-químicas de substâncias, bem como de outras características como a atividade óptica, levando à possibilidade de identificação de compostos. Além disso, permite compreender a importância da estereoquímica em fármacos e outras moléculas biologicamente ativas.
OBJETIVOS
Módulo 1
Reconhecer isômeros planos e os tipos de isomeria constitucional
Módulo 2
Reconhecer isômeros cis/trans, bem como os designados E/Z em alcanos de cadeia aberta e fechada
Módulo 3
Reconhecer as características e propriedades físico-químicas de moléculas quirais
Introdução
Neste conteúdo, conheceremos uma parte da química que trata de compostos que podem parecer muito similares à primeira vista, mas que acabam por apresentar propriedades muito distintas em um segundo momento.
A isomeria plana nos mostra como a diferença na organização dos átomos em uma estrutura pode levar a propriedades físico-químicas, como pontos de fusão e ebulição, polaridade e reatividades completamente diferentes.
Veremos também como a organização desses átomos no espaço influencia suas características.
Quem nunca ouviu dizer que gorduras trans são maléficas à saúde?
Ou talvez você já tenha ouvido falar da tragédia da talidomida causada por um enantiômero desse fármaco. Entenderemos o que são esses conceitos e a importância deles para a nossa realidade.
MÓDULO 1
Reconhecer isômeros planos e os tipos de isomeria constitucional

Isomeria: conceito base
Existem diversos tipos de isomeria na química, mas elas são separadas em dois grupos principais: a isomeria plana (ou constitucional) e a estereoisomeria. A isomeria constitucional trata do arranjo das ligações e dos átomos em determinada molécula, enquanto a estereoisomeria trata das diferenças na orientação espacial desses compostos.
A pergunta-chave que devemos responder para iniciar nosso estudo em isomeria é: o que é um isômero?
Isômeros são compostos que apresentam fórmula química igual, porém possuem estruturas diferentes. Consequentemente, esses compostos apresentarão características físico-químicas também distintas.
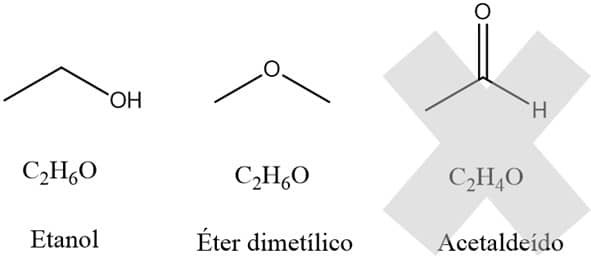
O éter metil metílico e o etanol, por exemplo, possuem fórmula química C2H6O e, em temperatura ambiente (25°C):
25°C
É importante que você saiba que as normas preconizadas pelo INMETRO estabelecem que as unidades de medida devem estar separadas dos números por um espaço. No entanto, limitações tecnológicas nos fazem juntar algumas das unidades aos números para tornar o entendimento do nosso material didático mais fácil. Assim, se você encontrar número e unidades juntos, saiba que foi feito para melhorar a sua visualização, mas que relatórios técnicos e demais materiais escritos por você devem seguir o padrão internacional de separação dos números e unidades.
O éter encontra-se no estado gasoso.
O álcool encontra-se no estado líquido.
Compostos isômeros também podem apresentar diversas características diferentes, tais como sabor e odor, além de propriedades biológicas e químicas também distintas.
Neste módulo, concentraremos nossas atenções na isomeria constitucional (ou plana). Existem cinco tipos de isomeria plana possíveis. Vamos conhecê-las?
Isomeria de cadeia
O primeiro tipo possível de isomeria que trataremos é a isomeria de cadeia. Como o próprio nome diz, a diferença entre os isômeros está na possibilidade de compostos de mesma fórmula química apresentarem cadeias diferentes, como cadeias lineares e ramificadas, por exemplo.
Digamos que queremos escrever a estrutura de um composto de fórmula C4H10.
Que estrutura escreveríamos?
Teríamos duas opções, na verdade:
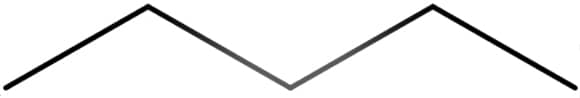
Butano
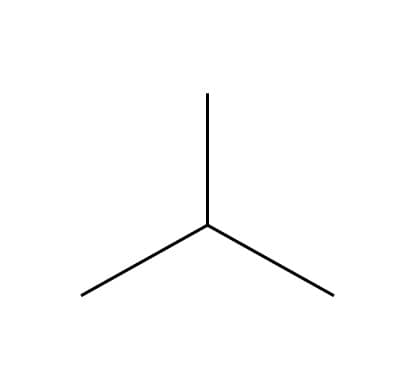
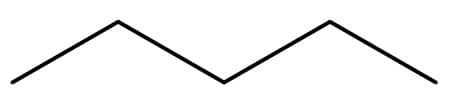
Isobutano
Tanto o butano quanto o isobutano apresentam 4 átomos de carbono e 10 átomos de hidrogênio em sua estrutura e são, portanto, isômeros.
E se fosse o composto de fórmula C5H10?
Lembra da fórmula geral dos alcanos? Um alcano linear tem fórmula geral CnH2n+2, como vimos no caso do butano e do isobutano. No caso do composto C5H10, então, não poderíamos ter um alcano linear, mas poderíamos ter um alcano cíclico, como o ciclopentano, ou um alceno. Veja abaixo os isômeros de fórmula C5H10:
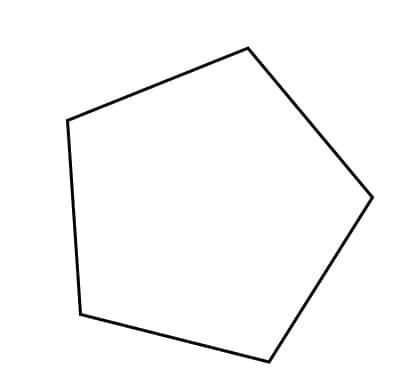
Ciclopentano
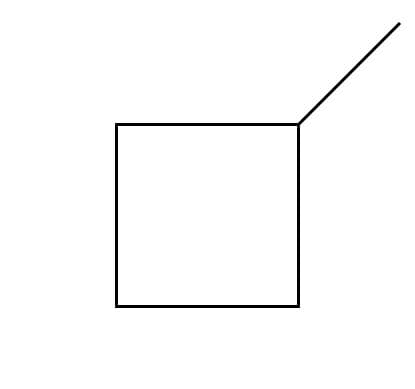
1-metil-ciclobutano
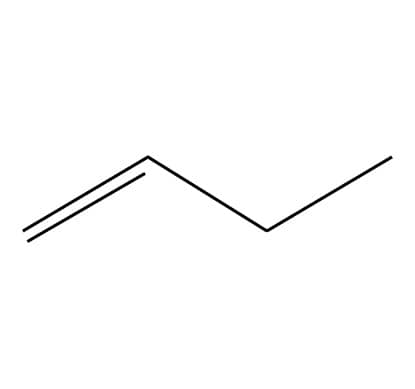
1-Penteno
Digamos que você se depare com uma situação em que é necessário saber quem são os isômeros planos possíveis que apresentam determinada fórmula molecular. Como você procederia? Vamos pensar juntos?
Vamos usar como exemplo a fórmula C5H12.
1º Passo: Analisar a fórmula molecular - No nosso exemplo, temos apenas átomos de carbono e hidrogênio e, por isso, sabemos que os isômeros serão todos hidrocarbonetos. Mas será que pode ser insaturado? Cadeia fechada ou aberta? Vamos olhar para o número de hidrogênios. Você acha que o composto será saturado ou insaturado?
Saturado
Isso mesmo! Compostos que apresentam número de hidrogênios igual a 2n+2, sendo n o número de átomos de carbono, serão saturados. No caso do nosso composto: 2×5+2=12, nossos isômeros serão hidrocarbonetos saturados.
Insaturado
Que pena! Na verdade, compostos que apresentam número de hidrogênios igual a 2n+2, sendo n o número de átomos de carbono, serão saturados. No caso do nosso composto: 2×5+2=12, nossos isômeros serão hidrocarbonetos saturados.
2º Passo: Montar a fórmula estrutural mais simples possível - Sabemos que os nossos isômeros são hidrocarbonetos saturados. Qual é o hidrocarboneto saturado mais simples possível?
Pentano
Isso mesmo! O hidrocarboneto de 5 carbonos mais simples possível é o pentano, um hidrocarboneto linear e saturado.
Isopentano
Não é bem assim! O hidrocarboneto de 5 carbonos mais simples possível é o pentano, um hidrocarboneto linear e saturado.
3º Passo: Remover carbonos para criar ramificações - Como assim? Agora, os próximos isômeros deverão ser ramificados e a única maneira de fazer isso sem aumentar o número de carbono da fórmula é diminuindo o tamanho da cadeia principal. Qual seria nossa primeira opção?
Butano substituído
Exatamente! O cuidado necessário nessa etapa é o de não criar dois compostos iguais achando que são isômeros. As duas estruturas abaixo representam o mesmo composto: 2-metilbutano. As ramificações devem estar sempre no carbono de menor número possível, então, temos, em ambos os casos, a metila na posição 2.
Pentano substituído
Não é bem assim! Vamos, então, ver as possibilidades com butano substituído:
O cuidado necessário nessa etapa é o de não criar dois compostos iguais achando que são isômeros. As duas estruturas acima representam o mesmo composto: 2-metilbutano. As ramificações devem estar sempre no carbono de menor número possível, então, temos, em ambos os casos, a metila na posição 2.
Sim
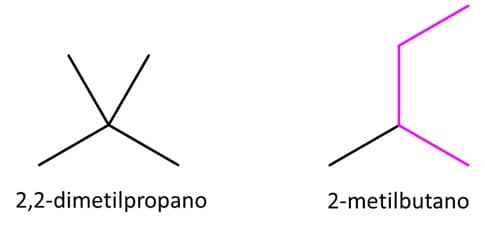
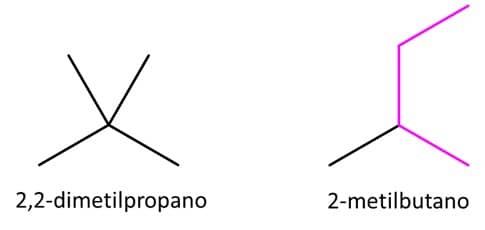
Muito bem! O propano é uma cadeia principal de 3 carbonos, com isso, precisaríamos alocar mais 2 na forma de ramificações. É importante lembrar que as ramificações devem ficar no meio da estrutura. Se adicionarmos um desses carbonos na ponta, voltamos a ter o butano, pois estamos aumentando a cadeia principal. Da mesma forma, se tentarmos substituir um etil no carbono 2 do propano, teremos mais uma vez o 2-metilbutano.
Com isso, o último isômero possível é o 2,2-dimetilpropano. E podemos concluir que existem 3 isômeros possíveis para essa fórmula molecular.
Não
Não é bem assim! O propano é uma cadeia principal de 3 carbonos, com isso, precisaríamos alocar mais 2 na forma de ramificações. É importante lembrar que as ramificações devem ficar no meio da estrutura. Se adicionarmos um desses carbonos na ponta, voltamos a ter o butano, pois estamos aumentando a cadeia principal. Da mesma forma, se tentarmos substituir um etil no carbono 2 do propano, teremos mais uma vez o 2-metilbutano.
Com isso, o último isômero possível é o 2,2-dimetilpropano. E podemos concluir que existem 3 isômeros possíveis para essa fórmula molecular.
É importante lembrar que, se o número de hidrogênios na fórmula molecular for igual a 2n, poderemos ter um alceno ou um composto cíclico e, se for 2n-2, pode ser um alcino ou um composto com duas ligações duplas ou ainda um hidrocarboneto cíclico com uma ligação dupla, por exemplo. A relação entre o número de hidrogênios e carbonos é sempre um forte indicativo em termos do tipo de cadeia do composto.
Isomeria de função
Os isômeros que vimos até aqui eram compostos apenas de átomos de carbono e hidrogênio, mas o que acontece se tivermos um composto que apresenta um átomo de oxigênio, por exemplo?
Não só os átomos de carbono poderão estar em posições diferentes levando a isômeros de cadeia, mas os átomos de oxigênio poderão estar em mais de uma posição e formar compostos que pertencem a funções orgânicas diferentes. Vamos ver um exemplo?
Quais são os possíveis isômeros do composto de fórmula C2H6O?
Com dois carbonos apenas na fórmula, não é possível formar uma cetona, já que a carbonila (C=O) precisa estar entre dois carbonos e a menor cetona possível é a propanona.
Um aldeído, por outro lado, apresenta a carbonila na ponta, portanto é possível de existir numa molécula com 2 carbonos. Ficamos, então, com 3 possibilidades:
Álcool
Éter
Aldeído
A fórmula molecular nos mostra que o número de hidrogênios é igual a 2n+2, ou seja, o composto não apresenta ligações duplas. Assim, descartamos a possibilidade do aldeído.
Para confirmar, podemos desenhar as três estruturas. O que percebemos é que o acetaldeído não apresenta a mesma fórmula química dos demais e, por isso, não é isômero deles.
O etanol e o éter dimetílico, por outro lado, apresentam fórmula molecular C2H6O e diferem um do outro pela função orgânica a qual pertencem, por isso são isômeros de função.
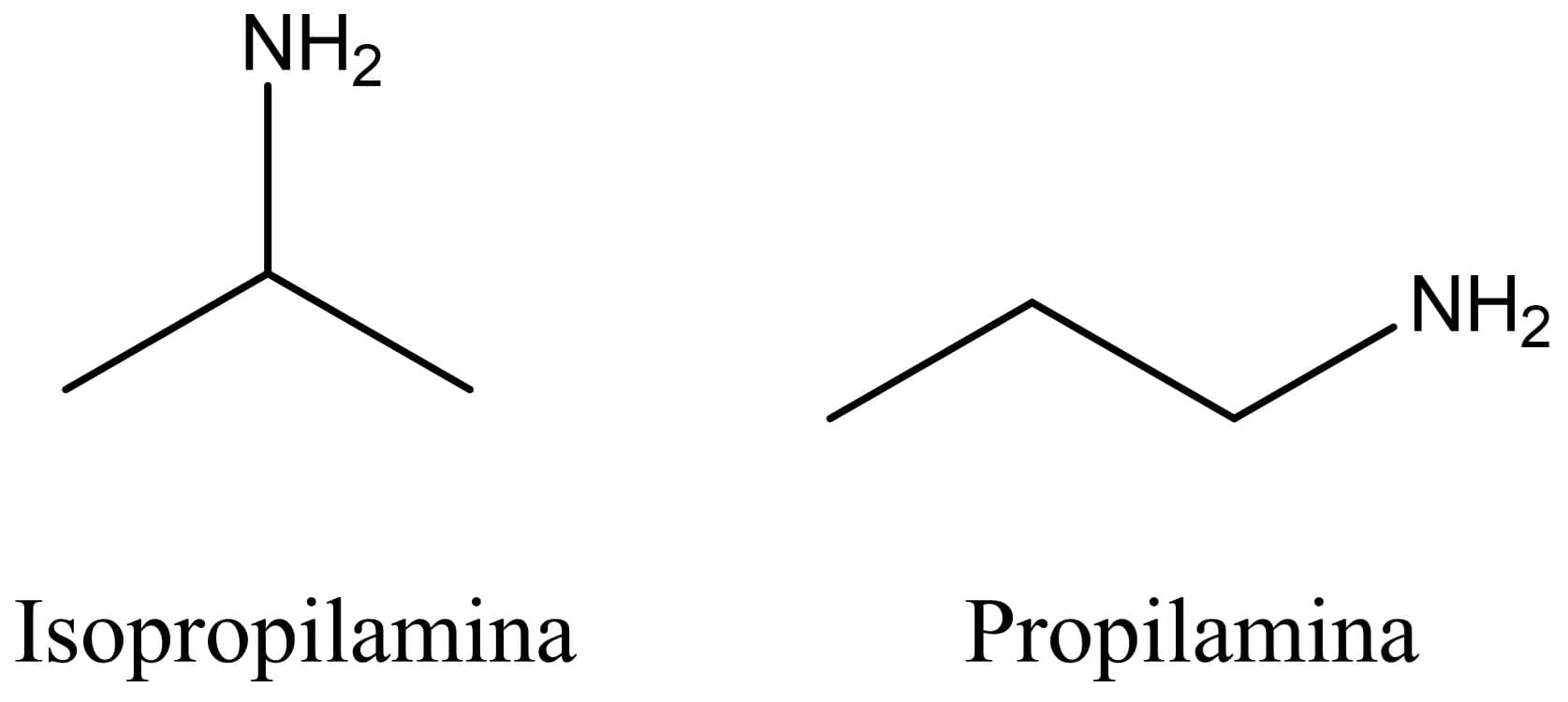
Isomeria de posição
Neste tipo de isomeria, além de apresentarem a mesma fórmula química (definição de isômero), os compostos devem também pertencer à mesma função orgânica, porém o grupo funcional está em posições diferentes – vale também para ligações duplas ou triplas.
Temos como exemplo desse tipo de isomeria a isopropilamina, que tem o grupo amina no carbono 2, e a propilamina, na qual o grupo amina está ligado ao carbono 1. Veja as estruturas abaixo:
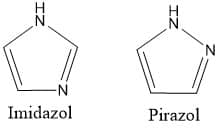
Isomeria de compensação (metameria)
A isomeria de compensação está presente em compostos que apresentam heteroátomos em pontos distintos de suas estruturas.
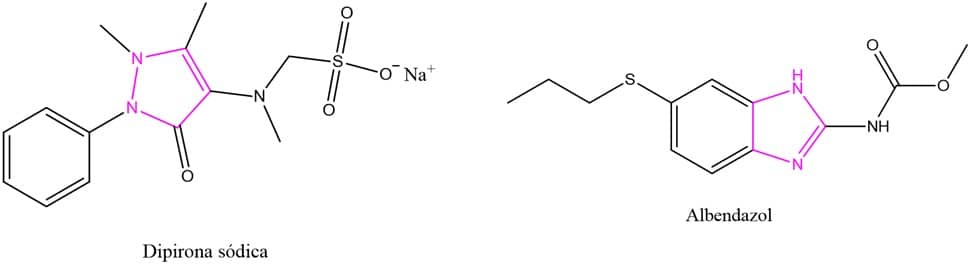
Um bom exemplo desse tipo de isomeria e que é muito importante na indústria farmacêutica são os anéis de imidazol e pirazol. Ambos apresentam 2 átomos de nitrogênio em sua estrutura e fórmula molecular C3H4N2, porém o imidazol é o 1,3-diazol e o pirazol é o 1,2-diazol, como mostram as estruturas ao lado.
Embora pareça uma diferença pequena, esses dois anéis são partes importantes da estrutura de fármacos completamente diferentes, como é o caso da dipirona sódica, utilizada como antipirético e antitérmico, e do albendazol, um antiparasitário de grande relevância na prática clínica.
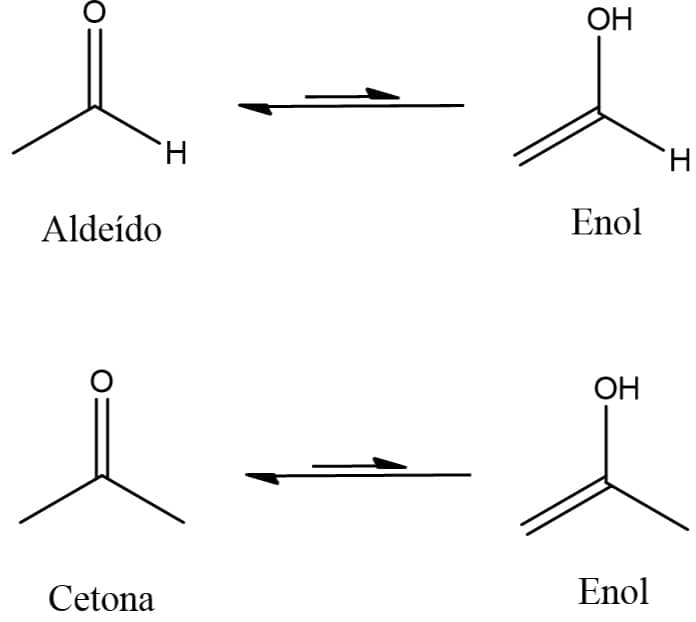
Tautomeria
A tautomeria é um caso específico de isomeria de função na qual existe um equilíbrio dinâmico entre os isômeros
Eles se interconvertem de uma função para outra e existem em equilíbrio.
O exemplo clássico de tautomerismo e que tem enorme importância na química orgânica é o tautomerismo ceto-enólico. Nesse tipo de tautomerismo, o grupo carbonila de um aldeído ou cetona se interconverte a um álcool no qual a hidroxila está ligada a um carbono insaturado, ou seja, um enol. A imagem abaixo traz exemplos desse tipo de isomeria.
O enol, em geral, existe em quantidades muito pequenas quando comparado ao aldeído ou cetona, porém a possibilidade de sua existência permite que uma série de reações possam ocorrer, chegando a ter capítulos de livros dedicados a reações que apresentam enóis e enolatos (seu ânion) como intermediário-chave.

Consequências da isomeria plana
Talvez as mudanças que vimos entre os isômeros tenham parecido simples e até irrelevantes para você, afinal, mesmo com as ligações entre os átomos sendo diferentes, ainda temos os mesmos átomos e na mesma quantidade.
Isso é um engano.
Propriedades como solubilidade e ponto de ebulição são altamente dependentes da organização dos átomos dentro da estrutura. Vamos voltar ao butano e isobutano que vimos como exemplo de isômeros de cadeia. Ambos são compostos apolares que apresentam as forças de dispersão (London) como força intermolecular.
Será, então, que eles têm o mesmo ponto de ebulição?
Resposta
Não! O butano tem ponto de ebulição de -1°C enquanto o isobutano tem ponto de ebulição igual a -11,7°C. E isso se deve ao fato de os átomos estarem ligados de maneira diferente. A ramificação diminui a área superficial disponível para a ocorrência das forças intermoleculares e torna o ponto de ebulição do composto mais baixo.
Voltemos ao exemplo do éter dimetílico e do etanol citados no início deste módulo. Esses compostos são isômeros de fórmula química C2H6O, ou seja, apresentam a mesma massa molecular. No entanto...
O éter dimetílico tem ponto de ebulição igual a -24°C.
O etanol tem ponto de ebulição igual a 78,4°C.
E é por isso que em temperatura ambiente essas substâncias estão em estados físicos da matéria diferentes.
Essa diferença se deve, mais uma vez, ao arranjo diferenciado dos átomos nos dois compostos. A existência da hidroxila no álcool permite que ele faça ligações de hidrogênio, enquanto o éter tem como força intermolecular entre suas moléculas as forças do tipo dipolo-dipolo, que são mais fracas e levam a menores pontos de ebulição.
Note, então, que, embora tenham a mesma fórmula química, os isômeros planos (ou constitucionais) apresentam propriedades distintas.
Agora que conhecemos a isomeria plana (ou constitucional), é hora de estudarmos o efeito das diferentes organizações dos átomos nas estruturas no espaço e as diferenças que podem ocorrer.
Classificação de Isômeros constitucionais
Neste vídeo, a especialista Gabriela de Andrade Danin Barbosa falará sobre a classificação dos isômeros constitucionais e a construção da estrutura molecular de isômeros a partir da fórmula química. Assista!
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer isômeros cis/trans, bem como os designados E/Z em alcanos de cadeia aberta e fechada
Estereoisomeria
Sabemos que a isomeria é dividida em isomeria plana ou constitucional e a estereoisomeria. Neste módulo, vamos nos concentrar no segundo tipo.
Na estereoisomeria, a diferença entre as moléculas está na disposição dos átomos no espaço, ou seja, a estrutura tridimensional é diferente.
Vamos começar vendo como classificar alguns desses isômeros que são formados a partir das diferentes estruturas de alcenos e cicloalcanos, moléculas que não apresentam rotação livre.

Isomeria cis-trans
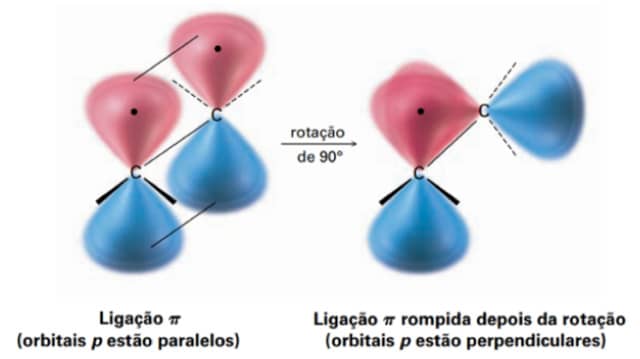
Nos alcanos lineares, temos apenas ligações simples que apresentam rotação praticamente livre em torno de seu eixo, de forma que a barreira de rotação na molécula do etano, por exemplo, é de apenas 12kJ/mol, uma barreira facilmente transponível, que permite que os vários confôrmeros existam em equilíbrio.
No caso das duplas ligações, para que a rotação ocorra, é necessário que a ligação π seja rompida, pois, na rotação, os orbitais p deixarão de estar paralelos, e isso requer uma energia de aproximadamente 350kJ/mol, uma barreira energética bem mais difícil de ser ultrapassada.
Essa diferença energética e a impossibilidade de rotação livre em torno da dupla ligação confere aos alcenos dissubstituídos duas possibilidades de isômeros: os isômeros cis e os isômeros trans, que apresentam propriedades físico-químicas distintas.
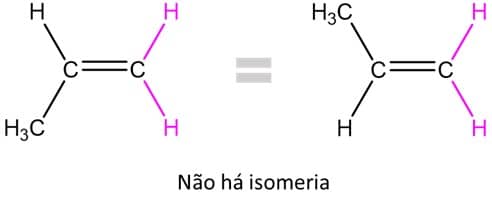
Para que a isomeria cis-trans exista, ambos os carbonos devem ter substituintes diferentes, ou seja, se um dos carbonos estiver ligado a dois ligantes iguais, não há isomeria. É o que acontece com o propeno, no qual um dos carbonos está ligado a dois átomos de hidrogênio, portanto a molécula não possui isomeria cis-trans.
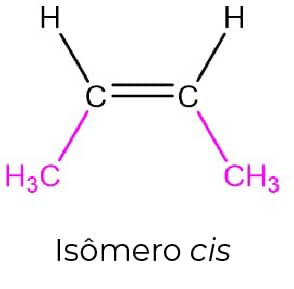
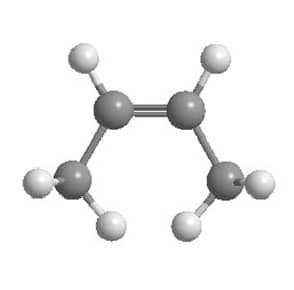
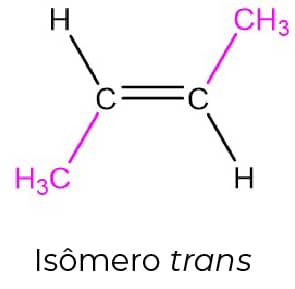
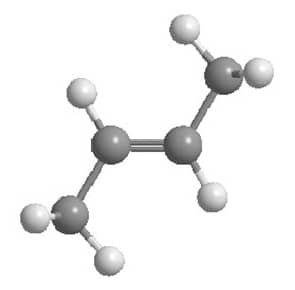
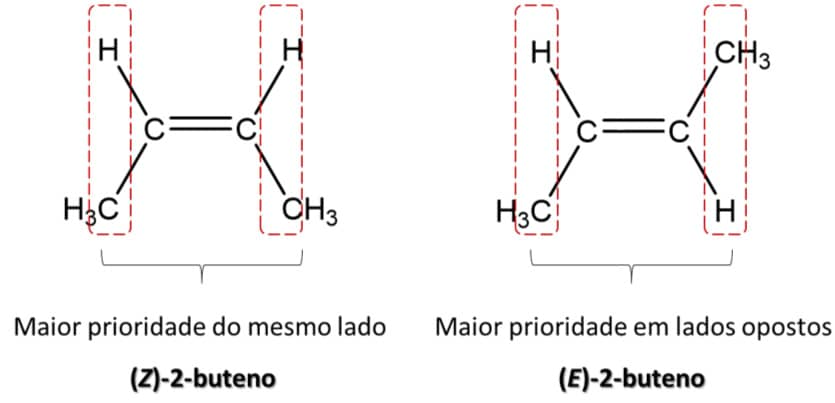
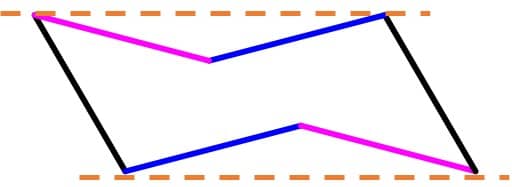
O alceno mais simples no qual podemos ver a isomeria cis-trans é o 2-buteno, pois podemos ter as metilas terminais do mesmo lado da dupla ligação (isômero cis) ou em lados opostos (isômero trans), como podemos ver nas imagens abaixo:
Essa diferença na estrutura tridimensional dos compostos se reflete na estabilidade deles. O trans-2-buteno apresenta as metilas terminais o mais longe possível uma da outra e isso faz com que seja mais estável que o cis-2-buteno, no qual a proximidade das metilas terminais leva a uma tensão estérica que diminui sua estabilidade.
Esse tipo de isomeria é muito discutido na química de alimentos.
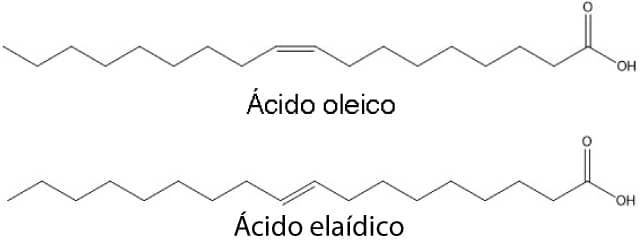
Isso porque os óleos de origem natural, como os óleos vegetais, por exemplo, apresentam gorduras poli-insaturadas na forma do isômero cis, porém podem ser convertidos aos isômeros trans devido às condições dos processos e essa mudança leva a alterações nas propriedades físico-químicas dos compostos.
O ácido oleico, também conhecido como ômega 9, por exemplo, é um composto de fórmula C18H34O2 que apresenta uma insaturação no carbono 9, isomeria cis e ponto de fusão igual a 14°C, ou seja, é um líquido à temperatura ambiente. Já o isômero trans, conhecido como ácido elaídico, tem ponto de fusão igual a 44°C, sendo um sólido à temperatura ambiente. Podemos ver a fórmula estrutural dos dois na imagem a seguir:
Essa mudança nas propriedades físico-químicas é explorada na indústria de alimentos no processo de hidrogenação dos ácidos graxos.
Isso porque os óleos vegetais são líquidos à temperatura ambiente devido à presença de múltiplas ligações duplas com isomeria cis, mas podem ser hidrogenados completamente levando a gorduras saturadas sólidas de alto ponto de fusão ou, ainda, serem parcialmente hidrogenados levando à formação de insaturações com isomeria trans, que tornam a gordura sólida, mas com ponto de fusão intermediário, dando a essas gorduras uma consistência cremosa à temperatura ambiente.

Designação E/Z
Você deve ter observado que nos exemplos já vistos os substituintes ligados aos carbonos da dupla eram parecidos, senão iguais.
O que acontece se tivermos substituintes muito diferentes ou três substituintes ao invés de apenas dois? Será que a designação cis/trans ainda funciona?
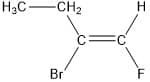
A verdade é que não. Nesses casos, a designação cis/trans pode ser ambígua, assim, foi criado um sistema, a designação E/Z. Nessa designação, os substituintes ligados aos carbonos da dupla ligação são priorizados de acordo com as regras de Cahn-Ingold-Prelog, que vamos ver a seguir, utilizando o 2-bromo-1-fluorobut-1-eno.
Regra n° 1
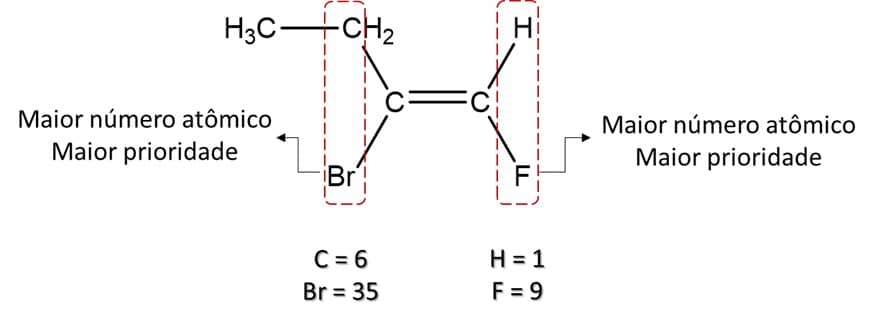
Compare os átomos imediatamente ligados aos carbonos da dupla ligação; aquele que tiver o maior número atômico terá maior prioridade. No caso do nosso exemplo, temos:
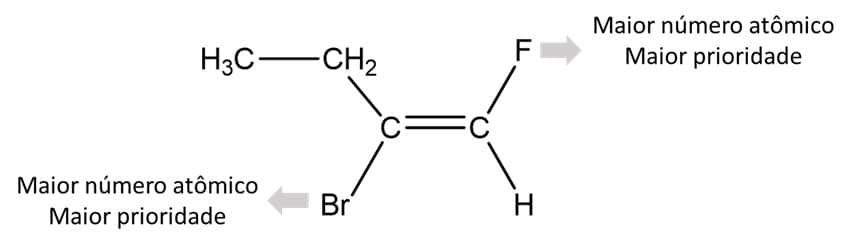
No caso dessa substância, podemos ver, então, que os substituintes de maior prioridade estão do mesmo lado da dupla ligação e, por isso, esse é o composto Z (do alemão zusammen, que significa “juntos”). A imagem abaixo mostra o composto E (do alemão entgegen, que significa “oposto”):
Regra n° 2
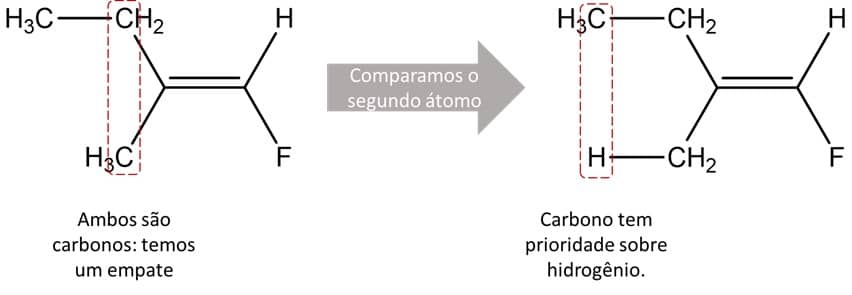
Essa regra é válida quando a primeira não é suficiente para definir o substituinte de maior prioridade. Caso os primeiros átomos dos dois substituintes ligados ao carbono da dupla ligação sejam iguais, passamos aos próximos átomos. A imagem abaixo traz um exemplo desse tipo:
Na estrutura, podemos ver que o carbono da ponta direita é de fácil resolução: flúor tem maior número atômico que o hidrogênio e, por isso, tem prioridade. Já no caso do carbono à esquerda da dupla ligação, ele está ligado a ambos os substituintes que têm como primeiro átomo o carbono. Assim, precisamos ir andando na cadeia a fim de resolver o empate.
No caso do substituinte de cima (etila), o átomo seguinte é outro carbono, porém, no de baixo, temos apenas átomos de hidrogênio, já que se trata de uma metila. Carbono tem um número atômico maior que o hidrogênio, então tem prioridade sobre ele. Logo, o composto mostrado é o (E)-1-fluoro-2-metil-1-buteno.
Caso o segundo átomo não seja capaz de definir o substituinte de maior prioridade, passa-se ao terceiro, quarto, quinto, e assim sucessivamente, até que haja uma diferença que resolva o empate.
Regra n° 3
Átomos ligados entre si através de ligações múltiplas equivalem a várias ligações simples entre aqueles átomos. Ou seja, C=O equivale a um átomo de carbono ligado a dois átomos de oxigênio por meio de ligações simples. A imagem abaixo mostra como seria isso:
Note que os compostos classificados usualmente como cis e trans também podem ser classificados na designação E/Z. Vamos ver o caso do 2-buteno novamente:
Atenção
Ao escrever o nome dos isômeros, note que a designação cis/trans não precisa estar entre parênteses, mas deve estar em itálico. Na designação E/Z, deve-se colocar a letra entre parênteses e em itálico antes do nome IUPAC do composto.
Agora que discutimos os alcenos, vamos ver como funciona a isomeria em compostos cíclicos.

Isomeria em cicloalcanos
No caso de cicloalcanos, a isomeria cis/trans é possível pelo mesmo motivo que nos alcenos:
Não existe rotação livre nas ligações sigma que compõem o anel.
Desse modo, assim como nos alcenos, os isômeros cis e trans só são passíveis de se interconverterem se houver quebra das ligações sigma, o que não ocorre à temperatura ambiente. Essa característica implica propriedades físico-químicas diferentes para os compostos, que podem ser isolados separadamente.
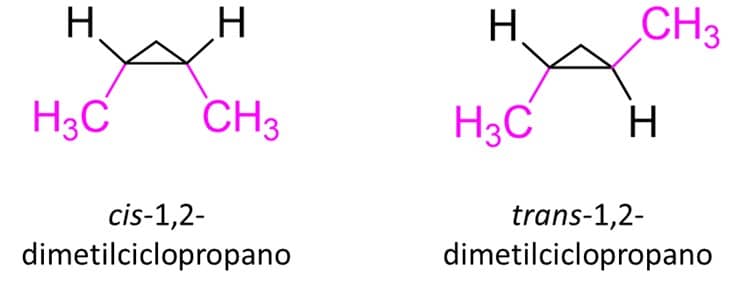
O menor cicloalcano possível de existir é o ciclopropano, que é também o composto no qual a visualização da isomeria cis/trans é mais fácil.
Ciclobutanos e ciclopentanos dissubstituídos, embora não sejam tão planares quanto o cicloproprano, ainda apresentam planaridade suficiente para facilitar a visualização dos isômeros cis/trans. Por isso, podemos simplesmente dizer que, assim como no caso dos alcenos:
Quando os dois substituintes estão do mesmo lado do plano do anel, temos o isômero cis
Quando os substituintes estão em planos opostos, temos o isômero trans
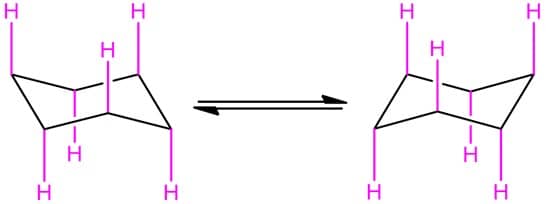
A isomeria dos cicloalcanos começa a ficar mais difícil de visualizar com os cicloexanos, devido às diferentes conformações que eles podem assumir, e ao fato de sua conformação mais estável, a cadeira, não ser plana e ter substituintes nas posições axial e equatorial. Vamos começar entendendo quem são essas posições.
Os carbonos do cicloexano apresentam geometria tetraédrica e, quando desenhamos sua estrutura, devemos respeitar a geometria colocando seus substituintes na posição certa.
1
Para começar, vamos ver como desenhar a conformação cadeira do cicloexano. A imagem ao lado mostra as linhas que compõem essa estrutura coloridas de maneira a facilitar a visualização: as linhas azuis são paralelas entre si, da mesma forma que as rosas e as pretas. Note também que as pontas do cicloexano na conformação cadeira ficam no mesmo nível.
Em seguida, precisamos colocar os substituintes nas posições axial e equatorial. Aqui, vamos utilizar hidrogênios apenas e desenhar o cicloexano, mas qualquer substituinte seguiria a mesma lógica de desenho. Primeiro colocamos os hidrogênios axiais. Esses hidrogênios estarão em linha reta, acima ou abaixo do anel, de maneira intercalada, conforme a imagem a seguir:
2
3
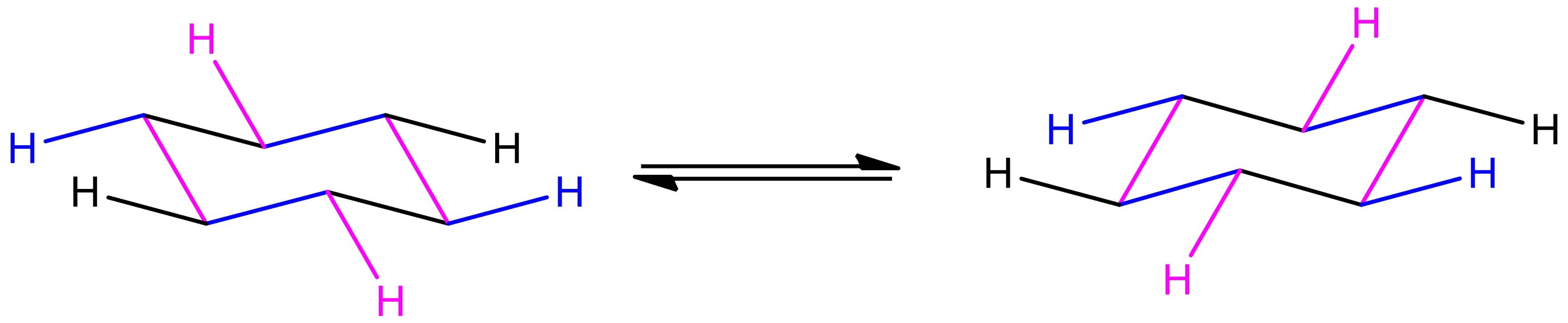
Os hidrogênios equatoriais não são tão óbvios de serem desenhados quanto os axiais. No entanto, as ligações equatoriais estarão sempre paralelas a pelo menos duas ligações C-C, conforme podemos ver na imagem ao lado.
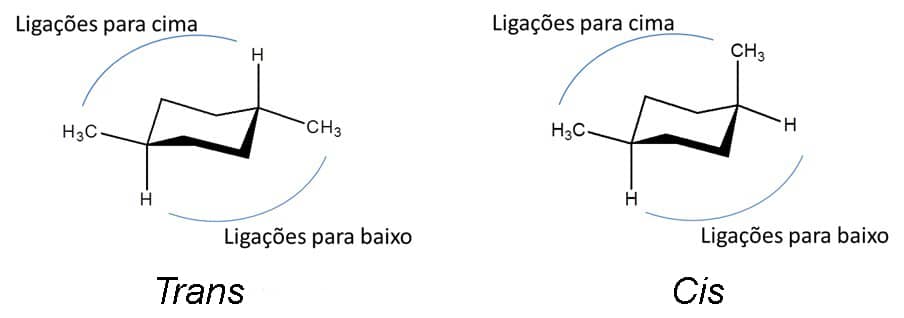
Agora que entendemos como desenhar o cicloexano e quem são as ligações equatoriais e axiais, vamos ver a isomeria cis/trans propriamente dita. Existem três possibilidades de dissubstituições no cicloexano:
- os compostos 1,2-dissubstituídos;
- os 1,3-dissubstituídos;
- os 1,4-dissubstituídos.
Todos com isômeros cis e trans.
A determinação do isômero depende se os substituintes estão ambos em ligações que vão para cima ou um para cima e um para baixo, conforme a imagem a seguir:
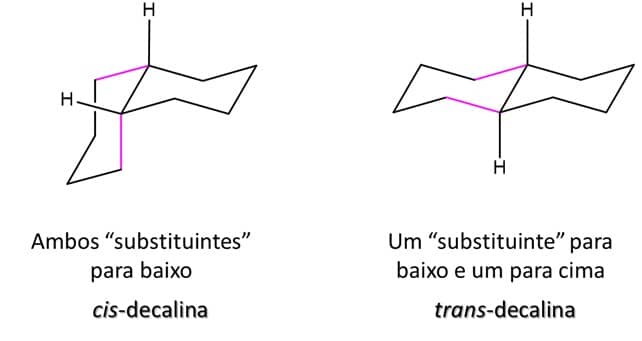
Essa diferenciação das ligações para cima e para baixo funciona também para compostos cíclicos ainda maiores. A decalina, por exemplo, um composto bicíclico, também apresenta isomeria cis/trans, como podemos ver a seguir:
Note que o anel da direita (todo em preto) pode ser considerado o anel principal, e que as ligações entre esse anel e o segundo seguem a mesma lógica de ter ambas as ligações na mesma direção para o composto cis e ligações na direção contrária para o composto trans.
Isomeria em compostos insaturados e cíclicos
Vejamos, através de exercícios, a identificação e classificação de isômeros cis/trans em alcenos e compostos cíclicos; a classificação cis/trans de compostos cicloexano substituídos e a relação de tal classificação com os locais de substituição (1,2/1,3 e 1,4) e as configurações axial e equatorial.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer as características e propriedades físico-químicas de moléculas quirais
Estereoisomeria
Até o momento, vimos os isômeros constitucionais ou planos, a isomeria cis/trans e designação E/Z. Agora, vamos continuar nos aprofundando na estereoisomeria. Para isso, precisamos conhecer um conceito importantíssimo: a quiralidade.

Quiralidade
Mesmo sem saber, o conceito de quiralidade é familiar para você. Já acordou de manhã e tentou calçar o sapato errado? Tentou colocar uma luva e percebeu que estava colocando a mão errada? O fato de que existe um sapato e uma luva errados para nossas mãos e pés é resultado da quiralidade desses membros.
Um objeto ou molécula quiral é aquele que não é sobreponível à sua imagem especular.
Como assim?
Falamos antes que as nossas mãos são quirais. Vamos, então, fazer um experimento?
Coloque a sua mão esquerda em frente a um espelho. Note que a imagem refletida é igual à sua mão direita, mas que se você tentar sobrepor as duas mãos com a palma para cima, por exemplo, isso não será possível.
O que acontece quando olhamos na frente do espelho é apresentado na imagem abaixo:
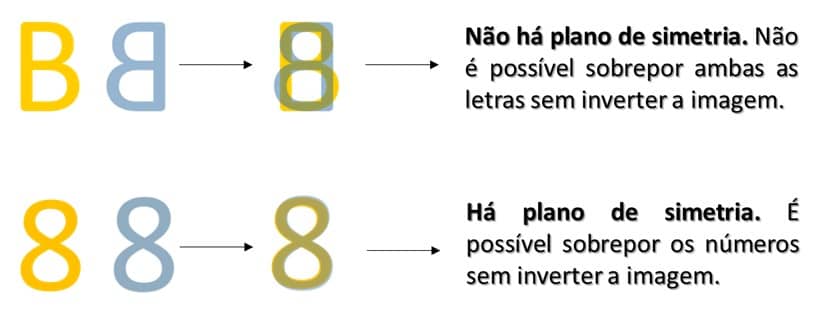
Isso quer dizer que, se a imagem refletida não apresentar um plano de simetria, as imagens especulares não serão sobreponíveis, como é o caso da letra B mostrada na imagem acima. O número 8, por outro lado, é simétrico e, por isso, suas imagens especulares são sobreponíveis, conforme pode ser visto na imagem a seguir:
A quiralidade, no entanto, vai muito além das nossas mãos e de objetos como luvas e sapatos. A natureza está repleta de exemplos de quiralidade, desde plantas que crescem sempre para o mesmo lado até nossos aminoácidos que, com a exceção da glicina, são quirais e apresentam, geralmente, desvio da luz polarizada para a esquerda, enquanto os açúcares naturais apresentam desvio da luz polarizada para a direita. Essas diferenças são cruciais, pois afetam a interação dessas substâncias com as enzimas e receptores do nosso organismo.
Moléculas quirais
Como identificar a quiralidade em uma molécula orgânica?
A regra é: moléculas quirais não são sobreponíveis à sua imagem especular.
Porém, existem algumas outras maneiras de se chegar a essa conclusão. A primeira é a presença de um centro de quiralidade na molécula. O centro de quiralidade em uma substância orgânica é, em geral, marcado por um asterisco (*) e dado pela presença de um carbono assimétrico.
Um carbono assimétrico é nada mais que um carbono tetraédrico ligado a quatro substituintes distintos entre si.
Carbono Tetraédrico
Carbono com hibridização sp3 e que, por isso, faz 4 ligações simples.
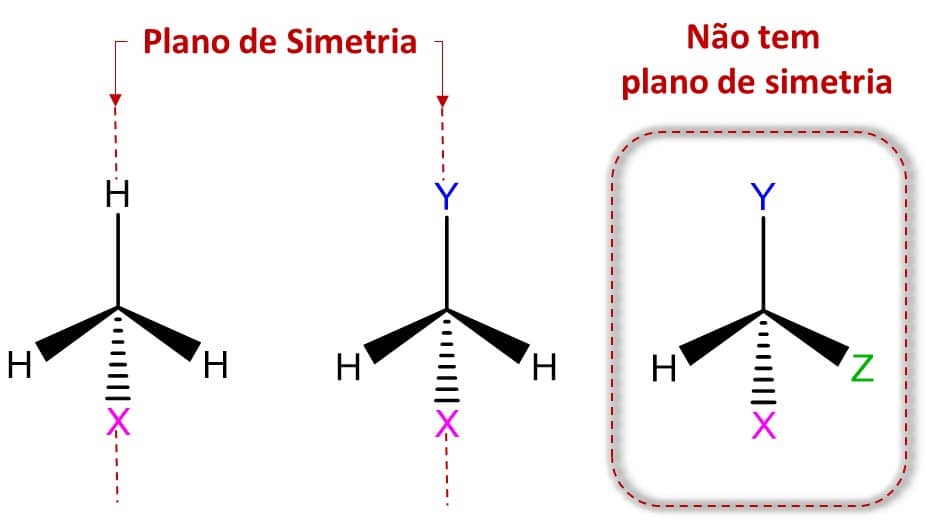
É importante observarmos que uma molécula só será certamente quiral caso haja apenas um centro de quiralidade em sua estrutura. Caso dois ou mais estejam presentes, é necessário avaliar a molécula como um todo e ver se ela é ou não sobreponível à sua imagem especular.
A necessidade da presença de um carbono assimétrico na estrutura da molécula deriva do fato de que moléculas que apresentem um plano de simetria não serão quirais, como vimos quando discutimos o conceito de quiralidade, e esse cenário só existe quando todos os quatro substituintes são diferentes entre si. Veja na imagem abaixo:
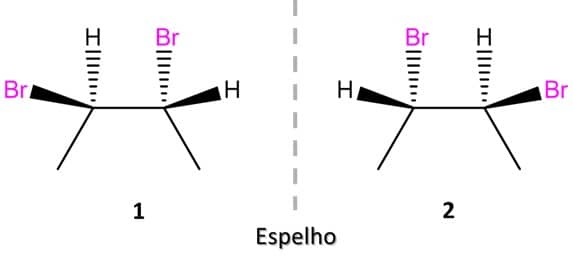
Uma vez que a molécula é identificada como quiral, sabemos que ela poderá existir na forma das duas imagens especulares, que são denominadas enantiômeros.
Os enantiômeros são um tipo de estereoisômero em que as moléculas não são sobreponíveis às suas imagens especulares, ou seja, são quirais.
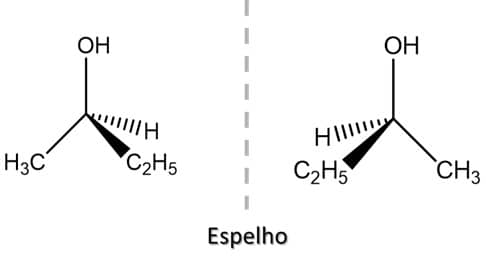
Na imagem, podemos ver os dois enantiômeros do 2-butanol:
Os enantiômeros, assim como os outros isômeros que vimos, apresentam nomes diferentes para que possamos saber a qual deles estamos nos referindo ao ler um texto, por exemplo.
Vamos ver como nomeá-los?
Nomenclatura de enantiômeros: Sistema R,S
Para nomear os enantiômeros de acordo com a IUPAC, devemos utilizar as regras de Cahn-Ingold-Prelog que vimos quando discutimos a designação E/Z, lembra delas? Vamos fazer um resumo para refrescar a memória:
Regra nº 1
Compare os átomos imediatamente ligados aos carbonos. Aquele que tiver o maior número atômico terá maior prioridade.
Regra nº 2
Essa regra é válida quando a primeira não é suficiente para definir o substituinte de maior prioridade. Caso os primeiros átomos dos substituintes ligados ao carbono sejam iguais, passamos aos próximos átomos.
Regra nº 3
Átomos ligados entre si através de ligações múltiplas equivalem a várias ligações simples entre aqueles átomos. Ou seja, C=O, por exemplo, equivale a um átomo de carbono ligado a dois átomos de oxigênio através de ligações simples.
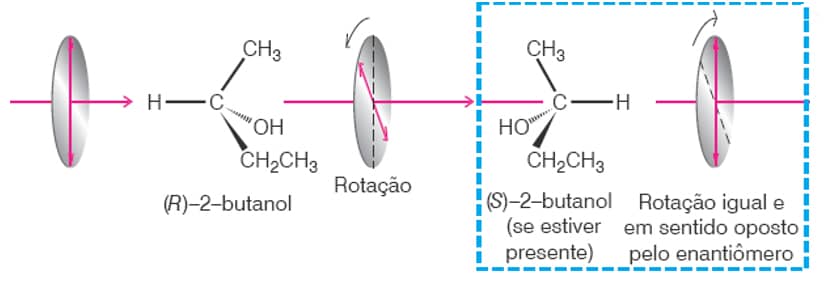
Agora que lembramos das regras, vamos ver como designar se um enantiômero é o R ou o S, etapa por etapa, utilizando um enantiômero do 2-butanol como exemplo:
1
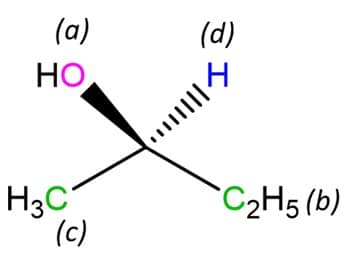
Assinale a ordem de prioridade dos substituintes do carbono assimétrico de acordo com as regras de Cahn-Ingold-Prelog (vamos utilizar letras para facilitar: “a” possui maior prioridade e “d” possui menor prioridade):
Lembrando que a etila tem preferência sobre a metila, pois, comparando o segundo átomo, sabemos que carbono tem preferência sobre hidrogênio.
Giramos a estrutura de modo que o substituinte de menor prioridade fique o mais longe possível do observador. Nessa etapa e na seguinte, o uso da projeção de Newman facilita a designação e o entendimento
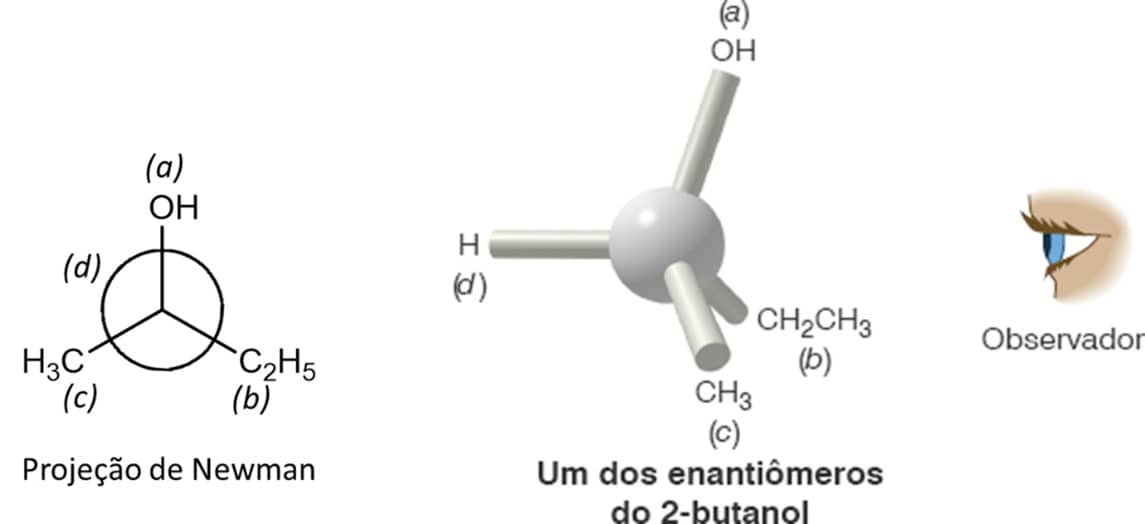
2
3
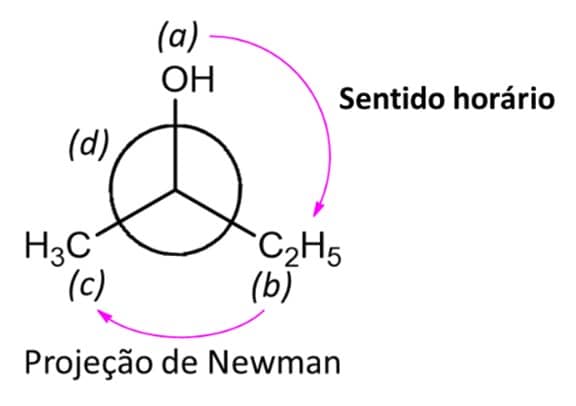
Traçamos um giro que vai de a até c (d está para trás do carbono, então não será considerado nessa etapa). Se as setas mostrarem que a molécula gira para direita (sentido horário), estamos frente ao enantiômero R; caso as setas apontem para a esquerda (sentido anti-horário), estamos frente ao isômero S.
Como aqui as setas estão no sentido horário, temos o (R)-2-butanol.
Note que na nomenclatura de enantiômeros, a designação R,S deve vir entre parênteses, antes do restante do nome e sempre em itálico.
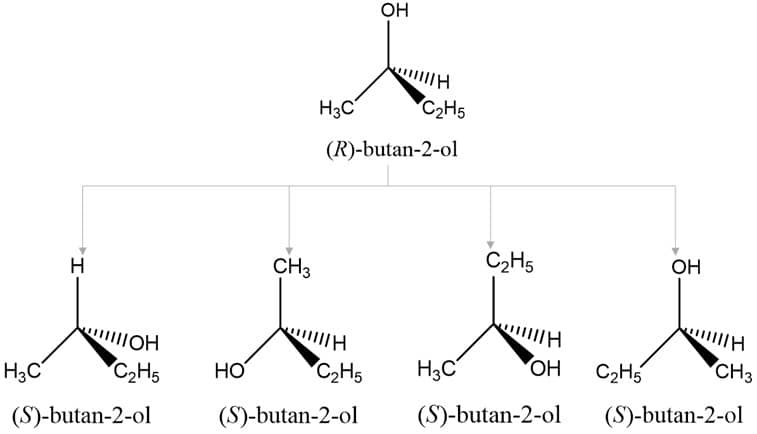
No caso de compostos que apresentam mais de um centro de quiralidade, cada centro deve ser tratado e nomeado de maneira individual para designar se aquele centro é R ou S. Uma vez estabelecida a designação, o centro é numerado como se fosse um substituinte. Temos, por exemplo, o composto (2R,3R)-2,3-dibromobutano.
Como desenhar os enantiômeros
Agora que sabemos identificar se estamos frente ao enantiômero R ou S, digamos que você queira desenhar o outro enantiômero. Para compostos que apresentam apenas um centro de quiralidade, como o 2-butanol, é bastante simples: a inversão de quaisquer dos dois substituintes na estrutura de um isômero levará ao outro. A imagem traz o exemplo do 2-butanol:
E o que acontece quando temos mais de um carbono assimétrico na molécula?
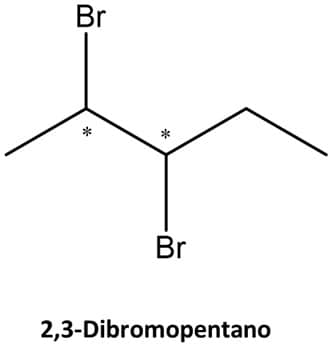
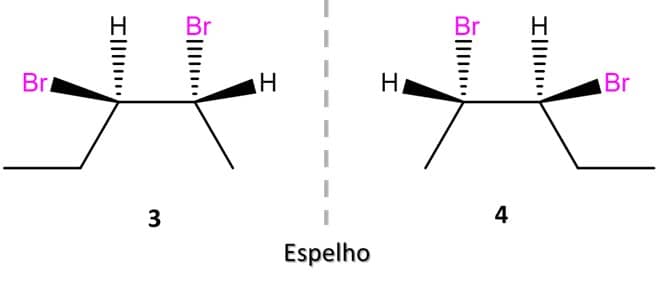
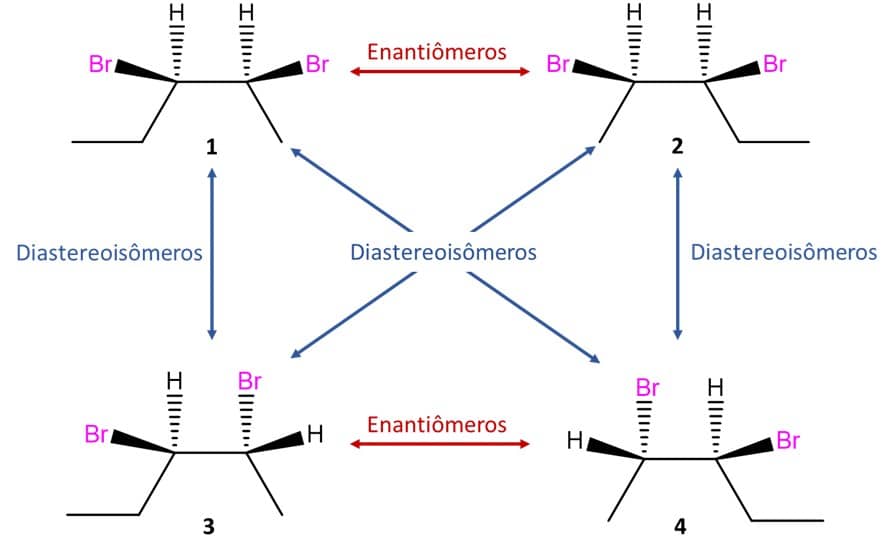
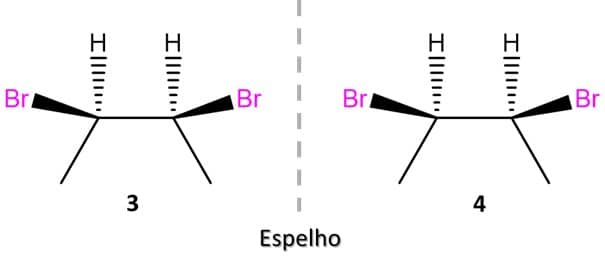
Vamos ver o caso do 2,3-dibromopentano, que tem 2 centros de quiralidade:
Nesse caso, o primeiro passo é saber que o número máximo de enantiômeros que um composto pode ter é 2n, em que n é o número de centros de quiralidade. No caso do 2,3-dibromopentano, então, podemos ter um máximo de 4 enantiômeros para o composto.
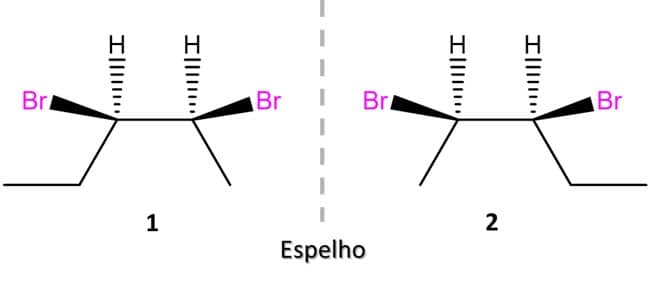
Para desenhar os primeiros dois isômeros, podemos escolher a posição que quisermos, mas é sempre melhor se o desenho da estrutura estiver de tal forma que facilite a visualização de um possível plano de simetria. A imagem abaixo traz o exemplo do par de enantiômeros 1 e 2 do 2,3-dibromopentano:
Como podemos ver, as duas estruturas acima não são sobreponíveis e, portanto, são enantiômeros. Para encontrarmos o outro par de enantiômeros possível, vamos inverter a posição de dois substituintes em um dos carbonos e espelhar a imagem, conforme a imagem:
A análise das estruturas dos quatro estereoisômeros possíveis do 2,3-dibromopentano nos leva a uma outra diferença importante.
Note que os compostos 1 e 2 são a imagem especular um do outro e não são sobreponíveis, ou seja, são enantiômeros. O mesmo acontece entre as estruturas 3 e 4. Mas e se compararmos 1 e 4? Ou 2 e 3? Vamos descobrir.

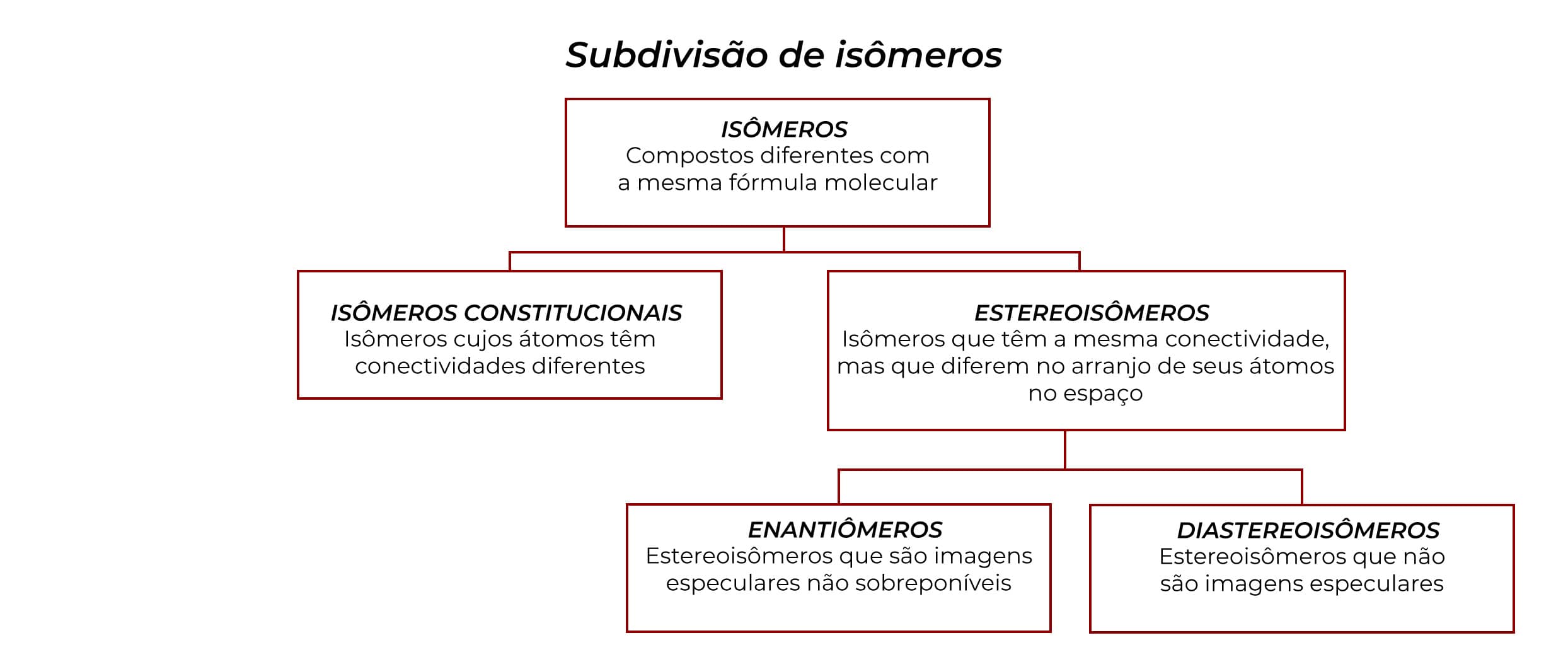
Diastereoisômeros, enantiômeros e compostos meso
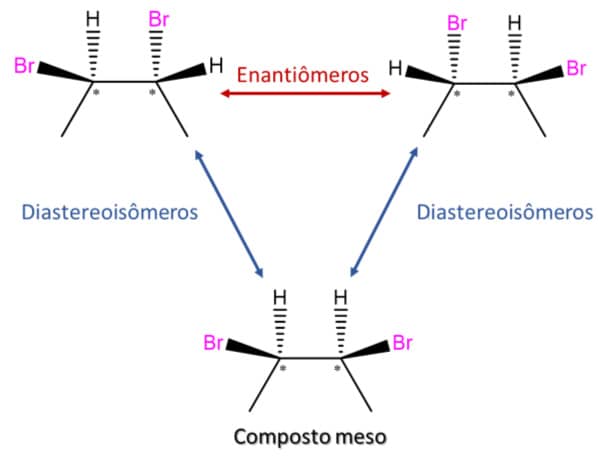
O fluxograma abaixo mostra como todas essas formas de isomeria que vimos até o momento estão relacionadas:
Os compostos 1 e 4 que vimos anteriormente são estereoisômeros do 2,3-dibromopentano, porém não são a imagem especular um do outro, entao são diastereoisômeros. Quando comparamos novamente os quatro estereoisômeros do 2,3-dibromopentano, chegamos às seguintes relações:
Existe, ainda, um terceiro tipo de composto muito importante de ser mencionado: o composto meso. Para entender quem é esse composto, vamos analisar o 2,3-dibromobutano.
Esse composto, assim como o 2,3-dibromopentano já visto, apresenta 2 centros de quiralidade, então também existe um máximo de quatro isômeros possíveis para ele.
Começamos escolhendo uma estrutura e desenhando sua imagem especular.
Em seguida, vamos inverter um dos centros quirais para obter o diastereoisômero 3 e sua imagem especular 4.
Agora, podemos observar que 1 e 2 são a imagem especular não sobreponível um do outro e, portanto, são enantiômeros. Porém, 3 e 4 são sobreponíveis e apresentam um plano de simetria que corta a ligação σ carbono-carbono entre os dois centros quirais ao meio. Isso quer dizer que 3 e 4 são uma única estrutura que apresenta dois centros de quiralidade e não é quiral, ou seja, é um composto meso.
Da mesma forma que fizemos para o 2,3-dibromopentano, vamos olhar as relações entre os isômeros do 2,3-dibromobutano?
Para resumir:
Se os enantiômeros apresentam as mesmas propriedades físico-químicas, como sabemos que eles existem? Como sabemos que não são todos iguais? Sabemos porque esses compostos apresentam uma diferença que está relacionada a uma propriedade que ainda não vimos: a atividade óptica.

Atividade óptica
Os estudos relacionados à atividade óptica começaram no século XIX com os trabalhos do físico francês Jean-Baptiste Biot sobre a natureza da luz polarizada.
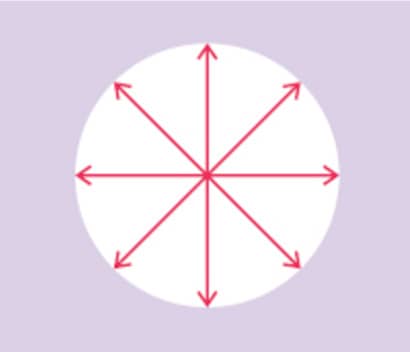
O feixe de luz, em geral, é um fenômeno eletromagnético que apresenta oscilações em um número infinito de planos, como visto na imagem.
No entanto, é possível passar a luz por um dispositivo denominado polarizador, que filtra o feixe de luz de maneira que a luz que atravessa tem suas oscilações no mesmo plano, ou seja, a luz se torna polarizada.
O que Biot observou a princípio foi que algumas substâncias eram capazes de desviar o plano da luz polarizada em determinado ângulo α. Atualmente, contamos com um equipamento denominado polarímetro para fazer essas observações.
Um polarímetro apresenta uma fonte de luz não polarizada, um polarizador, um espaço onde pode-se colocar soluções de substâncias orgânicas para serem analisadas e um analisador que nada mais é que um segundo polarizador, conforme pode ser visto na imagem abaixo:
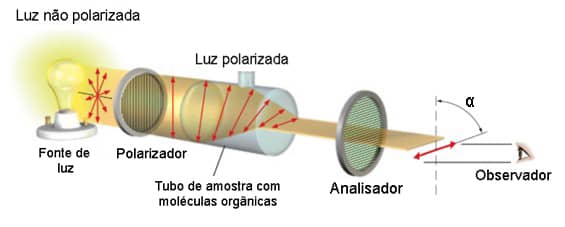
Rotação específica
O lado para o qual uma substância gira a luz polarizada é indicado pelo sinal de positivo ou negativo, como já vimos, mas agora veremos o quanto essa substância vai desviar a luz polarizada.
O grau do ângulo de desvio é influenciado diretamente pela quantidade de moléculas quirais as quais a luz polarizada encontra durante sua passagem pelo tubo contendo a amostra, ou seja, a concentração da substância influencia diretamente o ângulo de rotação. Da mesma forma, se mantivermos a concentração, mas aumentarmos ou diminuirmos o tamanho do tubo que contém a amostra, o ângulo será alterado de maneira proporcional. O comprimento de onda da luz e a temperatura também podem influenciar.
Por todos esses motivos, os químicos decidiram elaborar um padrão para que pudéssemos comparar diferentes substâncias e, por isso, criou-se a ideia de rotação específica de uma substância. Essa rotação é medida a 25°C utilizando uma luz de 586,6nm de comprimento de onda (lâmpada de sódio comum), o caminho ótico l é de 1dm (ou 10cm) e a concentração da substância é de 1g/mL.
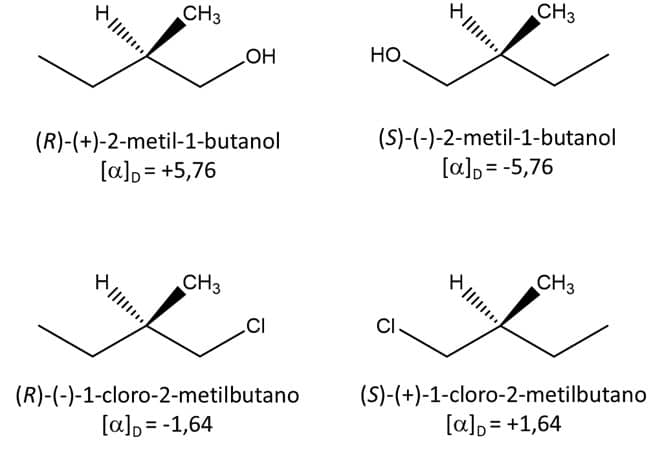
Vamos ver os exemplos de dois pares de enantiômeros, os do 2-metil-1-butanol e os do 1-cloro-2-metilbutano e suas rotações específicas:
Nessa imagem, podemos observar duas informações muito importantes:
1
A rotação específica de um par de enantiômeros vai ter o mesmo valor numérico e sinais invertidos.
2
A configuração R/S não determina se um composto será dextrógiro ou levógiro – note que o (R)-2-metil-1-butanol é dextrógiro (+), enquanto o (R)-1-cloro-2-metilbutano é levógiro (-).
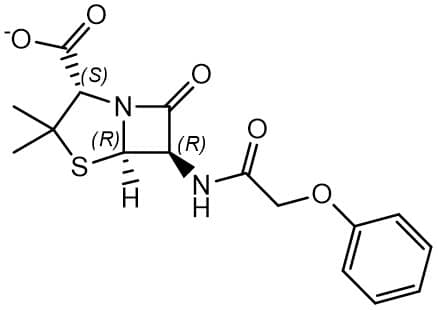
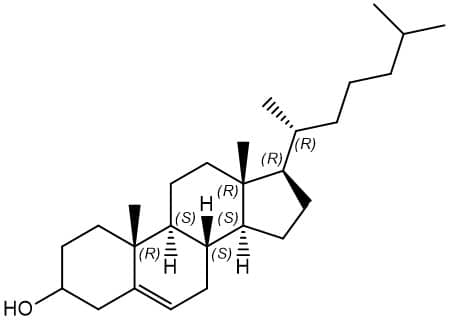
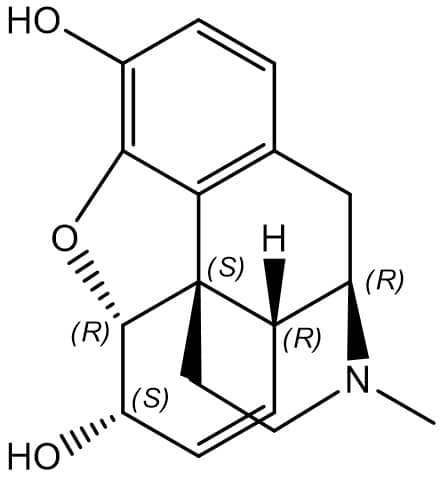
A rotação específica de um composto é importante, pois é uma maneira de caracterizar tal substância e sua pureza. A tabela abaixo traz exemplos de rotações específicas de algumas substâncias de grande importância clínica:
| Composto | Estrutura | [α]D |
|---|---|---|
| Penicilina V |
|
+233 |
| Colesterol |
|
-31,5 |
| Morfina |
|
-132 |
Elaborada por Anna Claudia Silva

Mistura racêmica
Já vimos que um par de enantiômeros terá o mesmo valor numérico de rotação específica com variação apenas no sinal, pois um será dextrógiro e o outro levógiro.
Isso quer dizer que, quando uma solução de um composto quiral apresentar quantidades equimolares do par de enantiômeros, essa solução será chamada de mistura racêmica e não será capaz de desviar o plano da luz polarizada.
Isso acontece porque enquanto um enantiômero vai desviar a luz polarizada em +x, o outro irá desviá-la em -x, e o resultado será zero de desvio. A imagem abaixo mostra essa situação:
A mistura racêmica de dois enantiômeros pode ser representada pelo símbolo (±) antes do nome da substância. Por exemplo, uma mistura racêmica do (R)-2-butanol e (S)-2-butanol é representada como (±)-2-butanol.

Excesso enantiomérico
Chamamos uma solução na qual só existe um enantiômero de solução opticamente pura ou enantiomericamente pura e de mistura racêmica uma solução com proporções iguais de enantiômeros.
Como vimos, as soluções opticamente puras desviarão a luz polarizada e a rotação observada será equivalente à rotação específica da substância, no sentido correspondente ao enantiômero que estiver presente na solução. A mistura racêmica, por outro lado, tem rotação nula.
Diferente desses dois casos, uma solução constituída por quantidades diferentes de dois enantiômeros será opticamente ativa, porém, ao ser analisada em polarímetro, apresentará rotação diferente da rotação específica da substância.
Vamos voltar ao exemplo do 2-butanol para entender melhor como isso funciona. Se em uma solução tivermos 70% do (R)-2-butanol e 30% do (S)- 2-butanol, podemos dizer que existe um excesso de 40% de enantiômero R (70% - 30% = 40%). As demais partes da solução são constituídas por uma mistura racêmica dos dois enantiômeros. Chamamos esse excesso de um dos enantiômeros de excesso enantiomérico (ee%).
Experimentalmente, podemos calcular o excesso enantiomérico da seguinte maneira:
Vamos ver como isso ocorre na prática:
A rotação da adrenalina opticamente ativa pura em água (a 25°C) é de – 53°. O resultado da rotação específica obtido pela análise de uma solução formada por uma mistura da adrenalina e seu enantiômero foi de – 45°. Qual é o excesso enantiomérico (ee%) nessa solução?
58%
Não é bem assim! Vamos inserir os valores das rotações específicas do enantiômero puro e da mistura de enantiômeros na equação apresentada para o cálculo de ee%:
85%
Muito bem! Vamos inserir os valores das rotações específicas do enantiômero puro e da mistura de enantiômeros na equação apresentada para o cálculo de ee%:
A partir desse resultado, podemos dizer que temos um excesso enantiomérico de 85% da adrenalina. Os outros 15% referem-se à mistura racêmica da adrenalina e seu enantiômero (7,5% de adrenalina e 7,5% do seu enantiômero).
Se quisermos saber qual o percentual total de adrenalina que temos nessa mistura, basta somarmos o excesso enantiomérico (85%) e o percentual da substância na mistura racêmica (7,5%). Logo, podemos dizer que essa mistura é composta por 92,5% de adrenalina e 7,5 % do seu isômero.

Resolução de enantiômeros
Na natureza, a maior parte das moléculas quirais que encontramos estão na forma de um dos enantiômeros. Os aminoácidos, por exemplo, são majoritariamente encontrados na forma de L-aminoácidos (levógiros), enquanto os açúcares naturais são dextrógiros (D-açúcares).
No entanto, quando produzimos substâncias quirais em laboratório, em geral, obtemos uma mistura racêmica dos enantiômeros e a separação deles pode ser necessária.
Mas como podemos separar compostos que não apresentam propriedades físico-químicas diferentes?
A maneira mais fácil de fazer essa separação é utilizando os compostos naturalmente quirais que estão disponíveis na natureza.
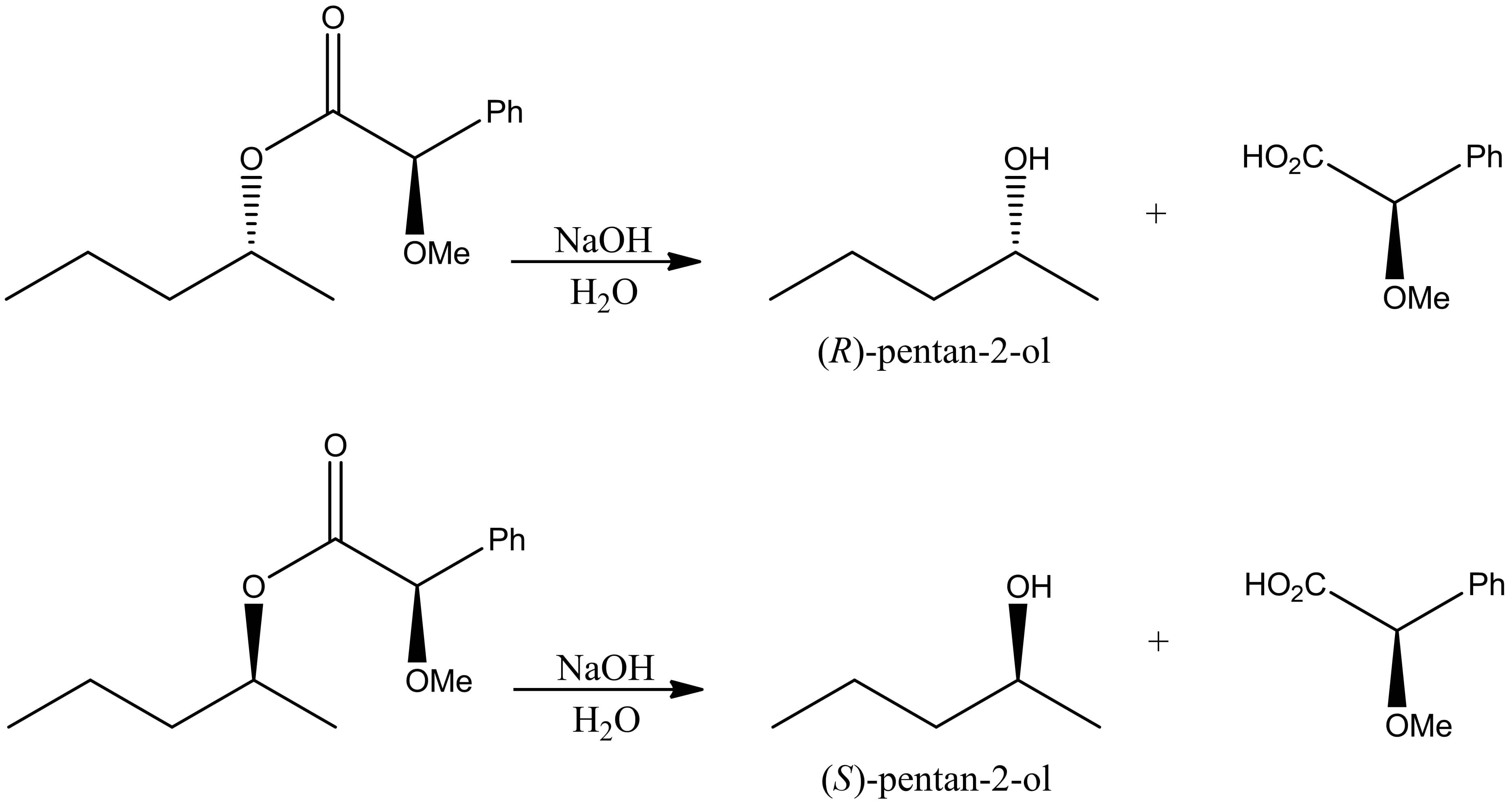
Digamos, por exemplo, que queremos separar enantiômeros da mistura racêmica de um álcool. Podemos fazer isso utilizando o ácido (R)-mandélico proveniente de amêndoas em uma reação de esterificação em que um dos produtos de partida está na forma enantiomericamente pura.
A esterificação levará à formação de dois diastereoisômeros que apresentam propriedades físico-químicas diferentes e podem ser separados por cromatografia, por exemplo, conforme o esquema:
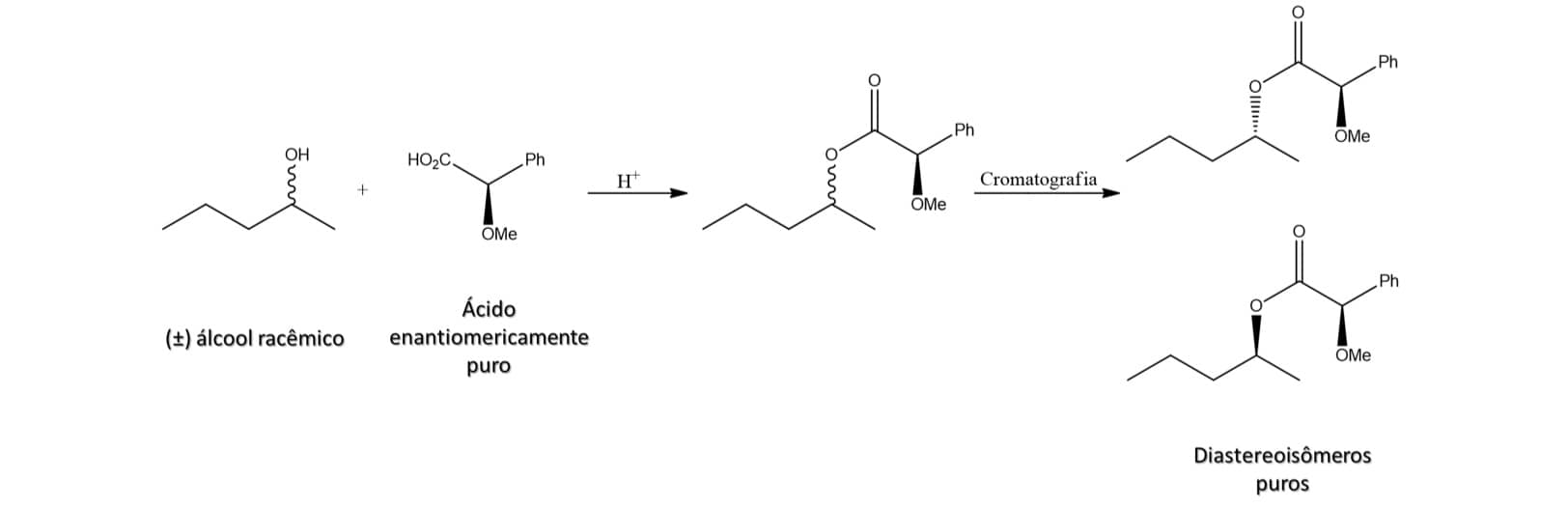
Uma vez que temos os diastereoisômeros puros, podemos reverter a esterificação através de reação de hidrólise, recuperando tanto o ácido quanto o álcool na forma enantiomericamente pura, conforme esquema abaixo:
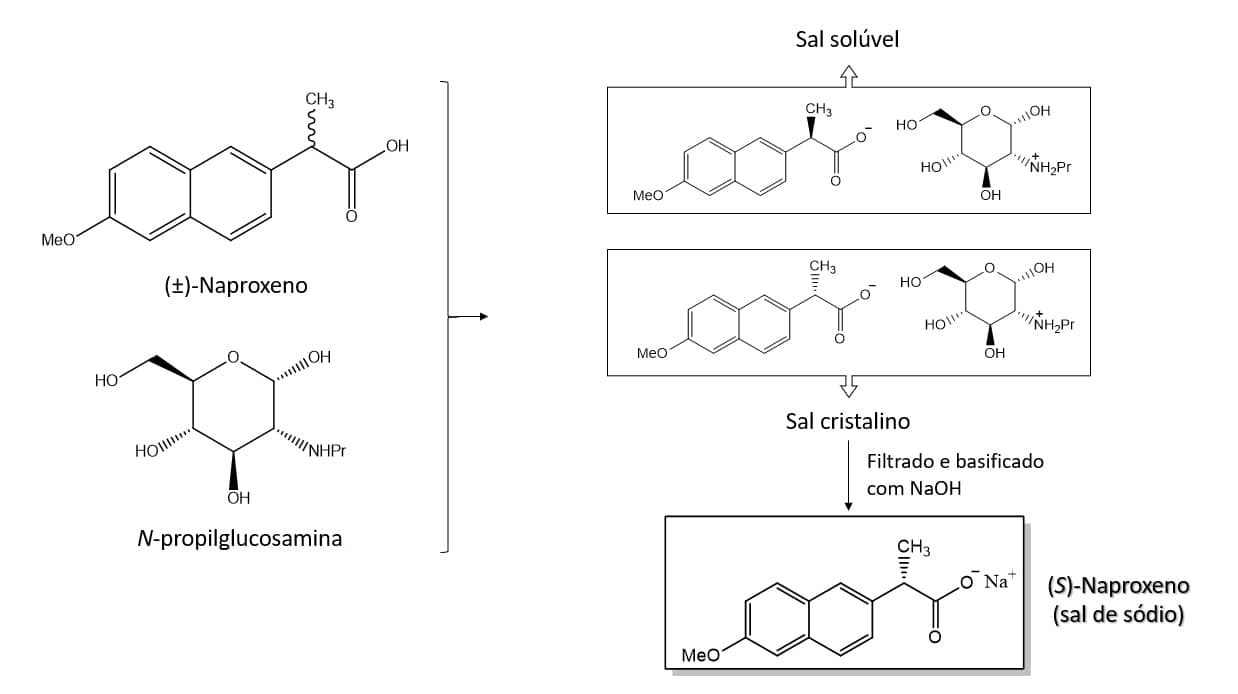
Uma segunda possibilidade de fazer a resolução dos enantiômeros é através da formação de sais de diastereoisômeros. Esse tipo de resolução é utilizado na separação dos enantiômeros de fármacos como naproxeno e ibuprofeno.
O ibuprofeno sofre enantiomerização no organismo, por isso é vendido na forma de mistura racêmica.
O naproxeno apresenta atividade anti-inflamatória apenas no seu isômero (S), por isso deve ser comercializado na forma enantiomericamente pura.
Aproveitando-se do fato de que o naproxeno é um ácido carboxílico, reage-se ele com uma amina enantiomericamente pura, no caso a N-propilglucosamina, e os sais diastereoisômeros são formados. Um dos sais apresenta solubilidade enquanto o outro se mantém na forma cristalina, podendo então ser filtrado para fora da solução, separando os enantiômeros, e a posterior basificação com hidróxido de sódio permite a recuperação do sal de sódio do (S)-naproxeno, conforme esquema abaixo:
O que podemos fazer caso os enantiômeros a serem resolvidos não contenham grupos funcionais capazes de serem reagidos de maneira a formar diastereoisômeros diferentes?
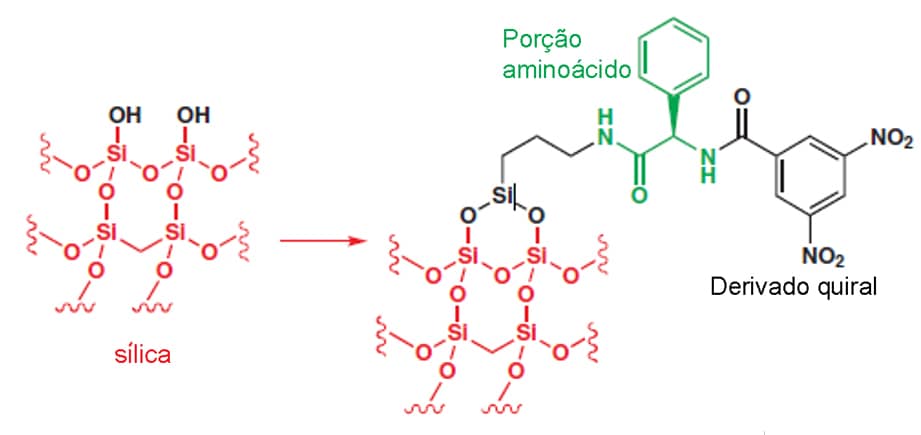
Nesse caso, podemos recorrer à cromatografia, na qual a fase estacionária é quiral por reação da sílica com um composto enantiomericamente puro, conforme mostra a imagem:
O que acontece nesse caso é que um dos enantiômeros a ser resolvido terá maior afinidade pela fase estacionária quiral do que o outro, portanto sairão da coluna cromatográfica em tempos diferentes, permitindo a resolução dos enantiômeros. A imagem abaixo mostra como esse processo acontece:
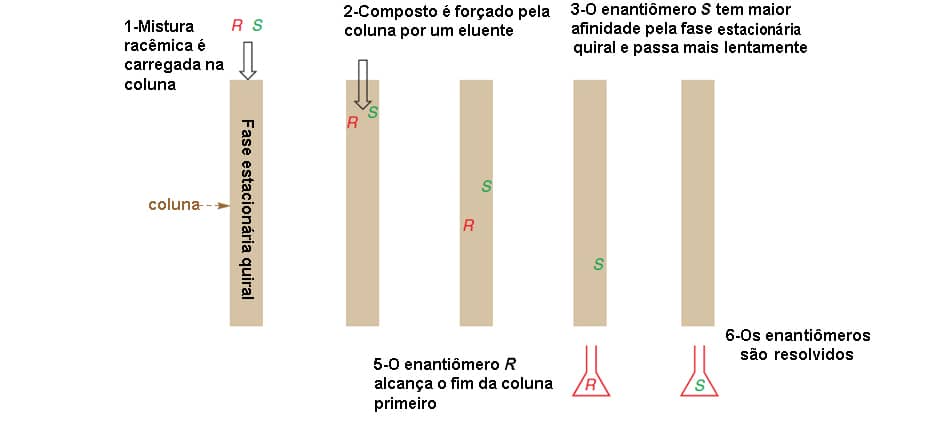
Por que é importante fazer a resolução dos enantiômeros?
Principalmente na área de medicamentos, a resolução de enantiômeros pode ser a diferença entre atividade biológica ou a falta dela, porém, mais do que isso, pode ser a diferença entre o uso seguro de uma medicação e seus efeitos tóxicos.
Vamos ver alguns exemplos?
β-bloqueadores
O primeiro exemplo que podemos citar é o dos fármacos β-bloqueadores. Estudos mostram que os enantiômeros levorrotatórios desses fármacos chegam a ser 100 vezes mais ativos que suas contrapartes dextrorrotatórias. Apesar disso, a maior parte dos fármacos β-bloqueadores seguem sendo comercializados na forma de racematos.
Dopa
Por outro lado, a dopa, utilizada no tratamento da doença de Alzheimer, era comercializada sob a forma de mistura racêmica, porém foram observados efeitos tóxicos graves relacionados à D-Dopa e, por esse motivo, atualmente o fármaco corresponde à forma enantiomericamente pura da L-Dopa.
Nem sempre, no entanto, a resolução dos enantiômeros é o suficiente para eliminar os efeitos tóxicos de um dos enantiômeros. Isso acontece porque alguns fármacos podem ser convertidos ao enantiômero tóxico dentro do nosso organismo.
É o caso da talidomida, por exemplo, um fármaco que foi muito usado na década de 1960 para o tratamento de enjoos matinais em gestantes. Na época, a medicação foi amplamente utilizada e desencadeou o que ficou conhecido como a “Tragédia da talidomida”, na qual várias crianças nasceram com deficiências em razão do efeito teratogênico da (S)-talidomida.
Atualmente, o fármaco é utilizado no tratamento de doenças como lúpus eritematoso e mieloma múltiplo.
O quadro a seguir traz exemplos de fármacos e as diferentes ações farmacológicas dos enantiômeros:
|
Composto |
Efeito |
|---|---|
|
Estrona |
(+): hormônio estrogênico |
|
(-): inativo |
|
|
Penicilamina |
D: Antirreumático |
|
L: Extremamente tóxico |
|
|
Talidomida |
(R): Sedativo |
|
(S): Teratogênico |
|
|
Cetamina |
(+): Anestésico |
|
(-): Estimulante do SNC |
|
|
Bupivacaína |
(±): Ambos os isômeros têm ação anestésica local, porém apenas o enantiômero (-) tem ação vasoconstritora prolongando o efeito anestésico. |
|
Timolol |
(S): Escolha correta como bloqueador β-adrenérgico em hipertensão, angina pectoris e algumas arritmias |
|
(R): Ação mais localizada no β-adrenoceptor, melhorando a eficácia do timolol no tratamento do glaucoma |
|
|
Prilocaína |
(S): é lentamente hidrolisado |
|
(R): é rapidamente hidrolisado formando a toluidina, que causa metemoglobinemia. É um caso de biointoxicação estereoespecífica. |
Adaptado de: FASSIHI, A. R., 1993, pág. 1-14.
Identificação e classificação de moléculas quirais
A especialista Gabriela de Andrade Danin Barbosa falará de exemplos e exercícios que envolvam a identificação e classificação de enantiômeros quanto à configuração absoluta dos carbonos assimétricos (regras de Cahn-Ingold-Prelog) e quanto ao desvio da luz polarizada. Também abordará a classificação comparativa entre compostos estereoisômeros (diastero, enantio e composto meso). Assista!
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste conteúdo, conhecemos os diferentes tipos de isomeria que existem e aprendemos a reconhecer esses compostos e a importância que eles têm na nossa vida.
Vimos que a isomeria plana pode apresentar cinco tipos diferentes, com propriedades físico-químicas distintas apesar das fórmulas moleculares iguais.
Pudemos também conhecer os isômeros cis e trans de alcenos e cicloalcanos, aprendemos a identificar e nomear esses compostos e as diferenças entre as suas propriedades, assim como a designação E/Z, tão útil na identificação de compostos nos quais a isomeria cis/trans seria ambígua.
Por fim, vimos o conceito de quiralidade e a diferença entre enantiômeros, diastereoisômeros e compostos meso, além de termos visto a importância desses compostos, principalmente na indústria farmacêutica, e como separá-los.
Podcast
Para encerrar, a especialista Gabriela de Andrade Danin Barbosa faz um resumo do estudo apresentado com destaque para a importância da estereoisomeria no desenvolvimento de fármacos. Ouça!
CONQUISTAS
Você atingiu os seguintes objetivos:
Reconheceu isômeros planos e os tipos de isomeria constitucional
Reconheceu isômeros cis/trans, bem como os designados E/Z em alcanos de cadeia aberta e fechada
Reconheceu as características e propriedades físico-químicas de moléculas quirais