Descrição
Inflamação aguda e crônica. Princípios fundamentais do processo de regeneração e cicatrização. Conceitos gerais, aspectos epidemiológicos e clínicos das neoplasias benignas e malignas.
PROPÓSITO
Compreender o processo inflamatório nos permite diferenciar as características das respostas inflamatórias aguda e crônica, as formas de reparo tecidual e os princípios gerais da neoplasia, sua epidemiologia e seus aspectos moleculares e clínicos.
OBJETIVOS
Módulo 1
Descrever as características gerais dos processos inflamatórios agudo e crônico
Módulo 2
Reconhecer o processo de reparo tecidual, as características fundamentais da regeneração e cicatrização de lesões
Módulo 3
Identificar os conceitos gerais, a epidemiologia e as características das neoplasias benignas e malignas
Módulo 4
Descrever os agentes carcinogênicos e os aspectos moleculares e clínicos das neoplasias
Introdução
Quase todos os seres vivos, desde o procarionte mais simples até o ser humano, possuem estratégias adaptativas para responder a estímulos prejudiciais, com objetivo de manter o bom funcionamento do organismo. Essa resposta abrange uma série de alterações imunes, bioquímicas e fisiológicas, conjuntamente denominadas de inflamação. Vamos visitar as características gerais do processo inflamatório e nos aprofundar nos dois tipos de resposta inflamatória: a aguda e a crônica.
Em seguida, trabalharemos o processo de reparo tecidual, importantíssimo para a sobrevivência do organismo. Veremos os mecanismos de regeneração de órgãos parenquimatosos e os tipos de cicatrização, classificados por primeira e segunda intenção.
Vamos estudar também as neoplasias. Como você deve saber, os processos de proliferação e diferenciação são extremamente complexos e regulados. Alterações nesse sistema regulatório apresentam crucial importância, além da alta prevalência e gravidade. Vamos então nos familiarizar com a nomenclatura das neoplasias, as suas características gerais, a epidemiologia do câncer, entender o papel dos proto-oncogenes, dos genes supressores de tumor, os tipos de agentes carcinogênicos e os aspectos clínicos das neoplasias.
MÓDULO 1
Descrever as características gerais dos processos inflamatórios agudo e crônico
Visão geral da inflamação: definição e características gerais
Inflamação (do latim inflamare, que significa “pegar fogo”) é uma resposta dos tecidos vascularizados a lesões e agentes agressores. Embora, à primeira vista, pareça apenas uma reação nociva, a reação inflamatória é essencial à nossa sobrevivência. Ela tem por objetivo eliminar do nosso organismo tanto a causa inicial da lesão celular, que pode ser um microrganismo ou algum tipo de toxina, quanto as possíveis consequências dessa lesão, que são células e tecidos necrosados. Porém, embora a reação inflamatória seja um dos componentes mais importantes da resposta imunológica, combatendo muitos agressores, ela própria pode causar danos ao organismo.
A reação inflamatória é conhecida há muito tempo, tendo algumas de suas características clínicas descritas em papiro egípcio, aproximadamente no ano 3000 a.C. Porém, somente no século I d.C., foram descritos os quatro sinais cardinais da inflamação. São eles: rubor (vermelhidão), tumor (edema), ardor (calor) e dolor (dor). A caracterização do processo inflamatório baseado em sinais cardinais, deu-se exclusivamente a partir de observações de inflamações agudas, em locais onde era possível a observação a olho nu, como a pele e a garganta. No século XIX, um quinto sinal – perda de função – foi adicionado.
Um dos primeiros trabalhos de observação do processo inflamatório foi realizado no final do século XVIII e, além da descrição macroscópica, esse estudo levantou a hipótese da relação entre a inflamação e a circulação sanguínea. No século seguinte, foram realizados os clássicos trabalhos experimentais de inflamação, que mostravam as alterações vasculares e o processo exsudativo celular após irritação direta da pele, utilizando um modelo de membrana interdigital de rã. Após a descoberta da histamina – o primeiro mediador da inflamação –, logo no início do século XX, os estudos experimentais progrediram e multiplicaram-se, possibilitando o melhor entendimento do processo inflamatório e do tratamento das inflamações. Até metade do século XX, aproximadamente, os conhecimentos sobre inflamação ainda eram considerados separados dos de Imunologia, que eram baseados, até então, quase inteiramente na ação dos anticorpos.
Uma das características-chave do processo inflamatório é o recrutamento de leucócitos, anticorpos e proteínas do sistema complemento, que estão na circulação, para os locais onde é necessário eliminar os agentes agressores. Essas agressões podem ser externas ao organismo, de natureza física, química ou biológica, ou internas, como o estresse metabólico celular. Ou seja: a inflamação é um evento frequente e pode ser causada por uma diversidade de estímulos, e não necessariamente de natureza infecciosa.
Leucócitos
Os leucócitos, também conhecidos como glóbulos brancos, são um conjunto de células que atuam principalmente na defesa do nosso organismo, protegendo-o contra organismos invasores e desencadeando respostas imunológicas. Eles podem ser divididos em células mononucleares (linfócitos T, linfócitos B, células natural killer, monócitos, macrófagos e células dendríticas) ou polimorfonucleares (neutrófilos, eosinófilos, basófilos e mastócitos).
Sistema complemento
O sistema complemento é composto por uma série de proteínas solúveis que atuam nas imunidades inata e adaptativa contra os microrganismos patogênicos e nas reações Inflamatórias.
Você sabia
A chamada imunidade inata é a primeira barreira contra infecções. Seus componentes incluem, além dos leucócitos e das proteínas do sistema complemento, células dendríticas e epiteliais. Juntos, eles atuam na eliminação de células danificadas do próprio organismo e de corpos estranhos.
Uma vez enviados aos tecidos lesados, ou com presença dos agentes agressores, os leucócitos e outros componentes da defesa são ativados, para que possam eliminar essas moléculas indesejadas. Caso o processo inflamatório não ocorresse, as infecções passariam despercebidas, e os ferimentos ou tecidos lesados nunca cicatrizariam.
Dentre as causas mais comuns e clinicamente importantes da inflamação, estão as infecções, causadas diretamente por bactérias, vírus, fungos, parasitas ou indiretamente por toxinas microbianas.
Porém, o processo inflamatório pode possuir causas variadas. São elas:
Necrose tecidual
Leva à inflamação independentemente da causa da morte celular, podendo ser por isquemia (redução do fluxo sanguíneo), trauma, lesões físicas (queimaduras, por exemplo) e químicas (exposição a algumas substâncias tóxicas).
Presença de corpos estranhos
Como suturas e sujeiras, que podem causar inflamação à medida que levam ao dano tecidual ou transportam microrganismos. Além disso, algumas substâncias endógenas, presentes no próprio organismo, podem ser depositadas nos tecidos, como os cristais de colesterol na aterosclerose, e causar essa reação.

Reações de hipersensibilidade
Ocorrem quando o sistema imune causa danos ao próprio indivíduo. As respostas lesivas são direcionadas contra antígenos próprios, no caso de doenças autoimunes, ou são reações excessivas contra alguma substância, como ocorre nas alergias.
De forma genérica, o processo inflamatório é dividido em etapas:
O reconhecimento de agentes agressores é a primeira etapa da resposta inflamatória. Ele é feito por células epiteliais, células dendríticas, macrófagos residentes, leucócitos ou outros tipos celulares que possuam receptores capazes de reconhecer microrganismos e produtos de dano celular. Essas células, juntamente a seus receptores, representam uma adaptação evolutiva dos organismos frente à presença de agentes indesejados.
Ocorre após o reconhecimento do agente agressor pelos tipos celulares descritos anteriormente, quando há a liberação de mediadores, como citocinas e quimiocinas, que vão atuar no recrutamento de leucócitos e proteínas plasmáticas. Durante o recrutamento, os vasos sanguíneos se dilatam e aumentam sua permeabilidade, causando a redução do fluxo sanguíneo. Com isso, os leucócitos e outras moléculas recrutadas podem aderir à parede vascular e migrar para o local da lesão.
Após recrutamento e ativação dos leucócitos, eles fagocitam e destroem os agentes agressores nos tecidos, assim como as células mortas durante a lesão. A ativação, assim como o recrutamento dos leucócitos, é feita tanto por mediadores liberados pelas células reconhecedoras do agente agressor quanto por proteínas plasmáticas circulantes.
Uma vez que o agente agressor é eliminado, inicia-se a conclusão do processo inflamatório. Ela ocorre porque os mediadores e componentes de defesa esgotam-se e são dissipados. Mas não é só isso! Temos também a ativação de mecanismos anti-inflamatórios, que entram em ação para controlar a resposta inflamatória e evitar que sejam causados danos excessivos ao organismo.
Quando o objetivo de eliminar o agente agressor é alcançado, há a restauração do local da inflamação à sua normalidade. Porém, outros desfechos para o processo inflamatório existem e dependem da natureza da lesão, intensidade, do local e da resposta do hospedeiro. Veremos isso quando discutirmos a inflamação aguda.
Dica
As etapas do processo inflamatório podem ser lembradas como os “5 Rs”:
Reconhecimento do agente agressor
Recrutamento de leucócitos
Remoção do agente agressor
Regulação e resolução da resposta
Restauração do tecido
A figura a seguir mostra um resumo dessas etapas.
Como aprendemos, a inflamação é um processo útil na remoção e eliminação de agentes agressores, com posterior reparo tecidual. Porém, a resposta inflamatória é capaz de causar danos aos tecidos normais. Existem diversas doenças nas quais a reação inflamatória é mal direcionada (contra antígenos próprios nas doenças autoimunes, ou contra antígenos ambientais geralmente inofensivos nas alergias) ou mal regulada. Nesses casos, a inflamação, que deveria ser protetora, torna-se a causa da doença.
Saiba mais
A reação inflamatória é causa de doenças crônicas comuns, como artrite reumatoide, aterosclerose e fibrose pulmonar.
Etapas do processo inflamatório
Neste vídeo, você conhecerá um pouco sobre as etapas do processo inflamatório e os efeitos sistêmicos da inflamação.
Existem dois tipos de inflamação: a inflamação aguda e a crônica. Vamos conhecê-las?
Inflamação aguda
A inflamação aguda é uma resposta rápida à lesão ou à presença de microrganismos invasores. Ela possui dois componentes principais: as alterações vasculares e os eventos celulares.
As alterações vasculares são caracterizadas pela dilatação de pequenos vasos, levando ao aumento do fluxo sanguíneo (vasodilatação), e pelo aumento da permeabilidade dessa vasculatura, que permitirá que proteínas plasmáticas e leucócitos saiam da circulação em direção ao local da lesão ou inflamação. Essas alterações iniciam-se logo após a agressão.
A vasodilatação é induzida pela ação de vários mediadores químicos (principalmente a histamina) na musculatura lisa dos vasos sanguíneos. Ela ocorre, primeiro, nas arteríolas, seguida do aumento dos outros capilares ao redor. O resultado imediato é o aumento do fluxo sanguíneo, que é justamente a causa do calor e da vermelhidão no local da inflamação. Uma vez que os vasos são dilatados, ocorre o aumento da permeabilidade da vasculatura, com extravasamento de fluido, que é rico em proteínas para os tecidos extravasculares.
Histamina
A histamina é uma amina biogênica, que atua como um mediador da inflamação. É uma substância vasodilatadora envolvida em processos bioquímicos de respostas imunológicas, como o extravasamento plasmático, que resulta no aparecimento de edemas, vermelhidão, coceira etc.
Arteríolas
As arteríolas são vasos sanguíneos de pequeno calibre, que resultam da ramificação das artérias. A partir das arteríolas, o sangue é direcionado aos capilares sanguíneos.
Saiba mais
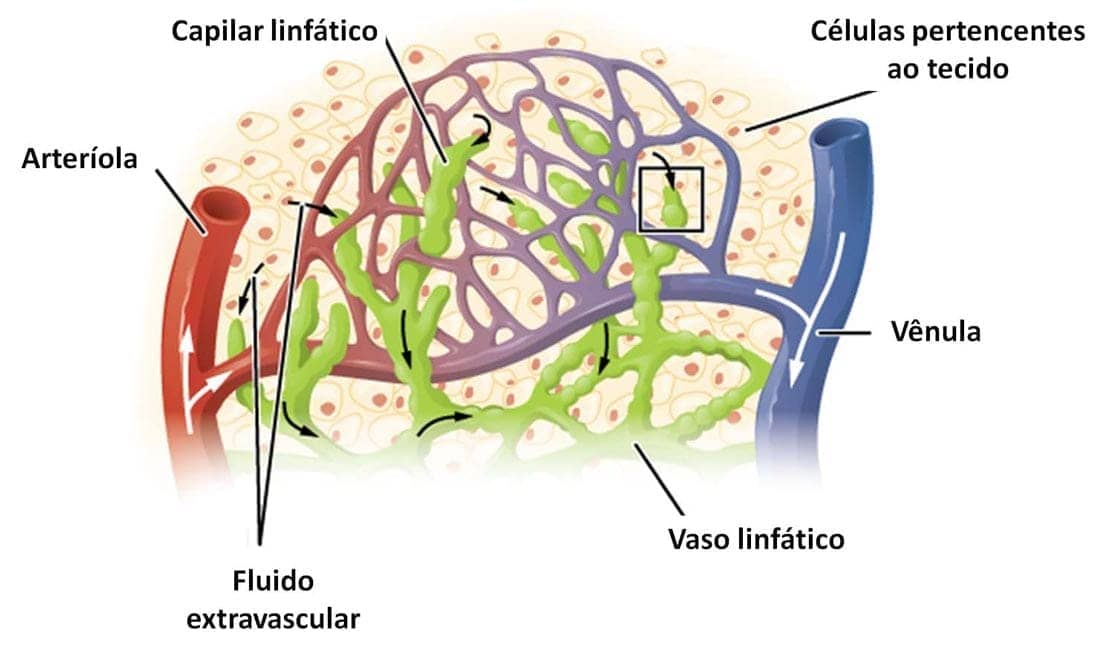
A saída de fluidos, células e proteínas do sistema vascular para o interior de tecidos é chamada de exsudação. O exsudato, então, é um fluido extravascular que possui elevada concentração de proteínas. Ele resulta do aumento da permeabilidade dos vasos sanguíneos, que pode ser provocada por uma reação inflamatória. Porém, quando há desequilíbrio osmótico ou hidrostático ao longo da parede vascular, mas sem o aumento da permeabilidade, ocorre o que chamamos de transudato: um fluido com baixo teor proteico e pouco ou nenhum material celular. O edema é o acúmulo de fluidos extravasculares no tecido, que pode ser ou um exsudato ou um transudato. O pus é um exsudato inflamatório, rico em leucócitos, restos celulares e microrganismos.
A permeabilidade vascular é resultado da abertura de espaços entre as células endoteliais, com consequente saída de fluidos através do endotélio. Vários mecanismos são responsáveis pelo aumento de permeabilidade, e o mais comum é a contração das células endoteliais, induzida pela histamina, resultando no aumento dos espaços entre células. Porém, a lesão endotelial, direta ou induzida por leucócitos, também pode ocorrer, resultando em necrose e separação das células endoteliais.
Embora a vasodilatação cause inicialmente o aumento do fluxo sanguíneo, a perda de fluidos através do endotélio e o diâmetro aumentado do vaso levam a um fluxo sanguíneo mais lento, com aumento da concentração de hemácias nos pequenos vasos e consequente aumento da viscosidade do sangue. Essas alterações caracterizam o que chamamos de estase, que é conhecida como congestão vascular e é a causa da vermelhidão localizada no tecido inflamado. A vasodilatação é rapidamente seguida pelo aumento da permeabilidade vascular, que culmina no extravasamento de fluidos e na consequente diminuição do fluxo sanguíneo.
Células endoteliais
As células endoteliais são células achatadas, com espessuras variadas, que recobrem todo o interior dos vasos sanguíneos, principalmente dos capilares, formando a parede do vaso.
Durante o desenvolvimento da estase, os leucócitos circulantes vão se acumulando ao longo do endotélio, da parede vascular. Ao mesmo tempo, ocorre a ativação das células endoteliais por mediadores produzidos no local da lesão ou infecção. Uma vez ativadas, essas células passam a apresentar altos níveis de moléculas de adesão, às quais os leucócitos aderem, e, logo depois, migram através do endotélio para dentro do tecido.
Atenção
Os vasos linfáticos também participam da inflamação aguda. Uma das funções do sistema linfático é filtrar e fiscalizar os fluidos extravasculares. Durante a reação inflamatória aguda, tanto os vasos linfáticos como os sanguíneos se proliferam, para lidar com o aumento da carga. O fluxo linfático, portanto, é aumentado e auxilia na drenagem do edema, resultado do aumento da permeabilidade vascular. No processo de resolução da infecção, os vasos linfáticos atuam na reabsorção do fluido extravascular. No entanto, leucócitos, restos celulares e microrganismos também podem ser drenados pela linfa.
Os eventos celulares incluem o acúmulo dos leucócitos na parede vascular, migração para o sítio da lesão e posterior ativação, com o objetivo de eliminar o agente agressor. Trata-se de uma consequência das alterações vasculares. Por isso, os leucócitos mais importantes na reação inflamatória são aqueles que realizam a fagocitose, como os neutrófilos e macrófagos. Essas células ingerem e destroem microrganismos, tecidos necróticos e outras substâncias indesejadas. Além disso, também produzem fatores de crescimento que atuarão no processo de reparo tecidual. No entanto, não podemos esquecer que, quando essas células são fortemente ativadas, podem ocorrer danos nos tecidos.
O caminho dos leucócitos, desde o endotélio vascular até o tecido, é um processo regulado e mediado por moléculas de adesão e quimiocinas. Ele pode ser dividido da seguinte forma:
Marginação, rolamento e adesão ao endotélio:
Em uma condição normal, no vaso sanguíneo, o fluxo de hemácias ocorre de maneira central, deslocando os leucócitos em direção à parede do vaso. No início de um processo inflamatório, o fluxo sanguíneo torna-se mais lento, e mais leucócitos assumem uma posição periférica ao longo da parede vascular. Esse processo é chamado de marginação. Depois, os leucócitos começam a fazer ligações transitórias com o endotélio, separando-se e ligando-se novamente às células endoteliais, fazendo o rolamento. Por fim, os leucócitos param em certo ponto da parede vascular, onde realizam a adesão de maneira mais firme. A ligação de leucócitos às células endoteliais é mediada por moléculas de adesão presentes nos dois tipos celulares e que são reforçadas por citocinas, secretadas pelas células sentinelas nos tecidos como resposta aos agentes agressores, garantindo que os leucócitos sejam recrutados para os locais onde os estímulos estão presentes.
Quimiocinas
São uma família de proteínas com baixo peso molecular e que agem primeiramente como atraentes químicos para tipos específicos de leucócitos.
Citocinas
Citocinas são proteínas produzidas por muitos tipos celulares (principalmente linfócitos, células dendríticas e macrófagos ativados, mas também células endoteliais, epiteliais e do tecido conjuntivo), que têm por função mediar e regular as respostas imunológicas inflamatórias.
Atenção
Os grupos mais relevantes de moléculas que participam da adesão e migração de leucócitos são formados pelas selectinas e integrinas, presentes tanto na superfície dos leucócitos quanto das células endoteliais.
Migração nos tecidos em direção aos estímulos quimiotáticos:
Após atravessarem o endotélio, os leucócitos penetram nos tecidos lesionados e continuam migrando em direção ao local da lesão por um processo chamado de quimiotaxia. Várias moléculas (exógenas ou endógenas) podem atuar como quimioatraentes, como produtos bacterianos, citocinas, componentes do sistema complemento e alguns metabólitos. Todos eles se ligam a receptores específicos na superfície dos leucócitos, induzindo a migração dessas células e seguindo os estímulos inflamatórios.
A natureza do infiltrado inflamatório varia conforme o tempo e o tipo do estímulo. Normalmente, em infecções agudas, ocorre o predomínio de neutrófilos nas primeiras 24 horas, que são substituídos por monócitos e macrófagos em até 48 horas. A razão disso é que os neutrófilos são mais numerosos no sangue e respondem rapidamente às quimiocinas. Entretanto, possuem vida curta nos tecidos, entrando em apoptose e sendo substituídos por monócitos, que, além de sobreviverem por mais tempo, proliferam-se nos tecidos.
Quimiotaxia
Locomoção seguindo um gradiente químico. Nesse caso, um gradiente químico de quimiocinas e outras moléculas quimioatraentes.
Atenção
Em certas infecções, como as causadas por bactérias do gênero Pseudomonas, os neutrófilos são continuamente recrutados para os infiltrados inflamatórios. Já em infecções virais, os linfócitos costumam ser as primeiras células a chegarem ao local. Em reações alérgicas, os eosinófilos podem ser o tipo celular predominante no infiltrado inflamatório.
Uma vez recrutados para o local de infecção ou morte celular, os leucócitos precisam ser ativados para realizarem suas funções. O reconhecimento de microrganismos ou de produtos de morte celular presentes nos receptores de leucócitos induz a ativação dessas células. As respostas funcionais mais importantes na destruição de microrganismos e outros agentes agressores são a fagocitose e a morte intracelular. A fagocitose é um processo complexo, que envolve o remodelamento da membrana plasmática e alterações no citoesqueleto. Ela compreende três principais fases: o reconhecimento e a ligação da partícula a ser ingerida pelo fagócito, a ingestão dessa partícula e, por fim, a morte ou degradação do material ingerido.
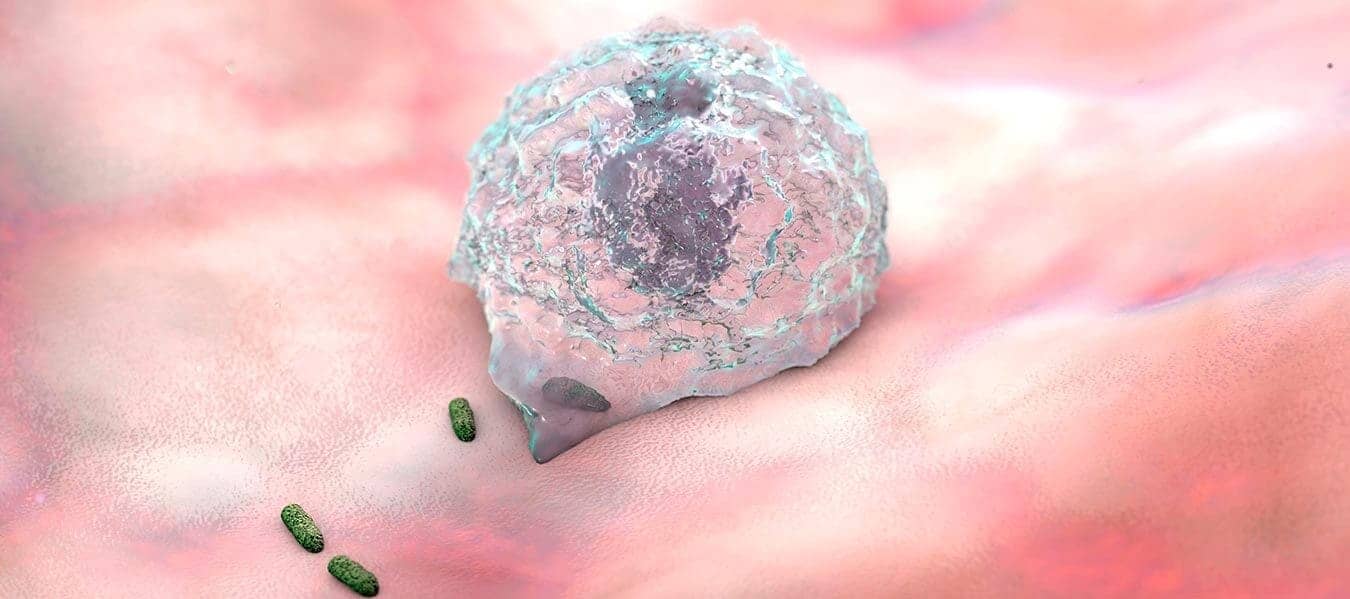
Após a ligação da partícula aos receptores do fagócito, há a emissão de pseudópodes ao redor dela e, em seguida, a membrana plasmática do fagócito se fecha, formando uma vesícula (fagossomo) que engloba a partícula. O fagossomo, então, funde-se ao lisossomo celular, formando o fagolisossomo. A destruição dos microrganismos e de outros agentes agressores fagocitados é realizada tanto pelas enzimas lisossômicas liberadas quanto pelas espécies reativas de oxigênio e de nitrogênio. Essa é a etapa final da eliminação dos agentes infecciosos e das células necrosadas. Todas as moléculas envolvidas na destruição do material fagocitado são concentradas no fagolisossomo, fazendo com que essas substâncias, que são potencialmente lesivas, sejam separadas do restante do citoplasma e do núcleo do fagócito.
Você sabia que os neutrófilos possuem um mecanismo especial de defesa, em resposta a agentes infecciosos (principalmente bactérias e fungos) e mediadores inflamatórios?
As armadilhas extracelulares de neutrófilos (as NETs) são redes fibrilares extracelulares que possuem alta concentração de substâncias antimicrobianas e são liberadas nos locais de infecção, prendendo os microrganismos e evitando que eles se espalhem pelo organismo.
Como já aprendemos, os leucócitos podem causar lesão em células e tecidos normais, e isso ocorre pela ação dos mediadores inflamatórios nesses tecidos. Em algumas infecções de difícil eliminação, como a tuberculose, a resposta imune prolongada e contínua contribui mais para a doença que o próprio agente etiológico. Além disso, o dano pode ser causado quando a resposta inflamatória é inapropriadamente direcionada contra tecidos saudáveis do hospedeiro, como no caso das doenças autoimunes, ou quando ela é excessiva contra substâncias ambientais geralmente inofensivas, como nas doenças alérgicas. Em todas essas situações, os mecanismos envolvidos na ação antimicrobiana são os mesmos que causam lesões em tecidos normais. Isso porque, uma vez ativados, os leucócitos e seus mecanismos não distinguem o hospedeiro do agressor.
Atenção
Os leucócitos ativados, especialmente macrófagos, possuem várias outras funções na defesa do organismo, pois produzem citocinas, que atuam tanto na amplificação quanto na limitação da resposta inflamatória; fatores de crescimento, que estimulam a síntese de colágeno; proliferação de células endoteliais e fibroblastos, além de produzirem enzimas, que vão atuar na remodelação do tecido conjuntivo. Por isso, os macrófagos são células muito importantes na inflamação crônica e no reparo tecidual.
O processo inflamatório precisa ser rigorosamente regulado para minimizar os danos aos tecidos. Normalmente, a inflamação tende a diminuir com a remoção do agente agressor, porque os mediadores que a induzem são produzidos somente enquanto o estímulo permanece, sendo degradados pouco tempo depois. Além disso, como já comentamos, os neutrófilos possuem curta duração nos tecidos. Por fim, à medida que a resposta inflamatória vai cumprindo seu papel, há a produção de vários sinais de alerta para o fim da reação.
Esse fim, em um cenário ideal, significa que houve sucesso na eliminação do estímulo agressor e a restauração do local da inflamação à sua normalidade. Esse processo é chamado de resolução, quando a lesão é eliminada, ou de curta duração, quando houve pouca destruição dos tecidos envolvidos e as células que restaram puderam se regenerar. Porém, muitas variáveis, como a natureza, intensidade, o local e a resposta do hospedeiro, podem modificar o processo básico da inflamação; assim, podemos ter outros dois finais para a inflamação, além da resolução:
Reparo por meio de cicatrização ou fibrose:
Ocorre após grande destruição tecidual, ou quando a lesão envolve tecidos que apresentam baixa ou nenhuma capacidade de regeneração ou quando existe exsudato abundante de fibrina no tecido. Nesses casos, o tecido conjuntivo prolifera para dentro das áreas de dano ou exsudato, substituindo o tecido anterior por massa de tecido fibroso.
Fique tranquilo, pois, no próximo módulo, vamos conhecer e entender como isso ocorre.
Evolução da resposta aguda para a inflamação crônica:
A cronificação do processo inflamatório ocorre quando há a persistência do agente agressor ou alguma interferência no processo de reparo, impedindo a resolução da resposta inflamatória aguda.
Saiba mais
Como vimos, as respostas inflamatórias agudas são caracterizadas principalmente pela
dilatação dos vasos sanguíneos de menor calibre e pelo acúmulo de leucócitos e fluidos
no tecido extravascular. Porém, alguns outros padrões morfológicos dependem da causa da
inflamação, do tipo de tecido e do local envolvido (para conhecer mais sobre esses
padrões, não deixe de visitar o
Inflamação crônica
Como aprendemos, a inflamação crônica pode representar uma evolução da inflamação aguda, ou pode ter início como uma resposta de baixo grau e contínua, sem qualquer manifestação aguda anterior. A inflamação crônica é uma inflamação onde a lesão do tecido e as tentativas de reparo dessa lesão vão existir conjuntamente, em várias formas, e por bastante tempo, podendo chegar a meses de ocorrência.
O que pode causar a inflamação crônica?
Essas infecções causadas por microrganismos que são difíceis de eliminar, como alguns vírus (o vírus da hepatite C, por exemplo), microbactérias (causadoras da tuberculose), fungos e parasitas. Algumas vezes, a resposta inflamatória apresenta um padrão específico, que é chamado de reação granulomatosa. Já em outros casos, uma vez que a inflamação aguda não se resolve, evolui para a inflamação crônica. Um exemplo é a ocorrência de uma infecção bacteriana pulmonar que não foi eliminada e evolui para a formação de um abscesso pulmonar crônico (para conhecer mais sobre a inflamação granulomatosa, visite o Explore +).
Esses agentes podem ser endógenos ou exógenos, como as partículas de sílica, que, quando inaladas de forma recorrente, geram, a longo prazo, uma doença pulmonar conhecida como silicose.
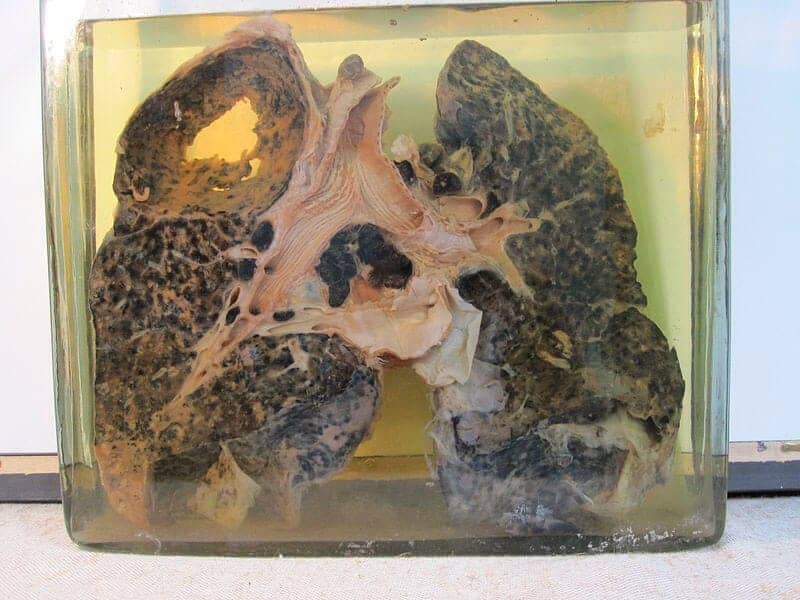
tuberculose e silicose.
A aterosclerose, por exemplo, nada mais é do que um processo inflamatório crônico da parede arterial causado parcialmente pelo excesso de produção e deposição de colesterol e outros lipídeos endógenos.
Como já visto anteriormente, sob certas circunstâncias, reações imunológicas são ativadas de maneira inapropriada ou excessiva contra tecidos do próprio indivíduo, levando às doenças autoimunes. O que ocorre é o estímulo de uma reação crônica por autoantígenos, que se retroalimenta e se perpetua, causando danos teciduais crônicos e inflamação. A artrite reumatoide é um bom exemplo dessas doenças. Há também as doenças alérgicas, que são respostas imunológicas que ocorrem de maneira inapropriada contra substâncias ambientais comuns. A asma brônquica é um exemplo de doença alérgica crônica.
Alguns tipos de resposta inflamatória crônica podem desempenhar papéis importantes na patogênese de algumas doenças que normalmente não são consideradas inflamatórias, como a doença de Alzheimer, o diabetes do tipo 2 e algumas neoplasias, em que o estímulo inflamatório promove o desenvolvimento de tumores.
Ao contrário da inflamação aguda, a inflamação crônica é caracterizada por infiltrado inflamatório de células mononucleares, como macrófagos, linfócitos e plasmócitos; pela destruição tecidual, que é induzida tanto pelo agente agressor quanto pela própria reação inflamatória; e pelas tentativas de reparo, por meio da substituição do tecido lesado por tecido conjuntivo. Essa substituição é realizada pela proliferação de vasos sanguíneos, a angiogênese, e principalmente pela fibrose.
Angiogênese
A angiogênese é o processo de desenvolvimento de novos vasos sanguíneos a partir dos vasos sanguíneos existentes.
O tipo celular predominante em grande parte das inflamações crônicas são os macrófagos. Eles normalmente são encontrados espalhados pela maioria dos tecidos conjuntivos, além de locais específicos, como fígado, baço, pulmões e linfonodos. Os macrófagos contribuem para a resposta crônica ao secretarem citocinas e fatores de crescimento, que vão atuar em várias células, destruindo os agentes agressores e tecidos, assim como na ativação de outras células, especialmente os linfócitos T. Os macrófagos ativados participam ativamente da eliminação dos agentes lesivos e do início do reparo tecidual, porém também são responsáveis por grande parcela da destruição tecidual que ocorre na inflamação crônica. Quando o agente agressor é eliminado, os macrófagos podem deixar o local da lesão ou persistir continuamente, através da circulação e proliferação no sítio da inflamação.
Outro tipo celular presente nas reações inflamatórias crônicas são os linfócitos T e B. Os macrófagos, entre outras funções, produzem citocinas que estimulam as respostas de células T. Uma vez ativadas, as células T também produzem citocinas, que recrutam e ativam macrófagos. Essas interações resultam, então, em um ciclo de respostas celulares que estimulam e sustentam a inflamação crônica.
Além dos macrófagos e linfócitos, outros tipos celulares também podem participar da resposta crônica, como os eosinófilos, mastócitos e neutrófilos.
Algumas respostas inflamatórias crônicas, como a inflamação granulomatosa, dependem das respostas de células T. Além disso, essas células podem ser a população celular dominante em doenças autoimunes e de hipersensibilidade.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer o processo de reparo tecidual, as características fundamentais da regeneração e cicatrização de lesões
Introdução ao reparo tecidual
O reparo tecidual refere-se à restauração da arquitetura e função tecidual após uma lesão e é fundamental para a sobrevivência do organismo. Ele ocorre a partir de dois tipos de reação, que resumiremos aqui e discutiremos com detalhes mais adiante:
Regeneração
Ocorre em tecidos que apresentam capacidade de substituir os componentes lesados e retornar à normalidade. O processo de regeneração ocorre a partir da proliferação de células que sobreviveram à lesão e mantiveram sua capacidade multiplicativa, como é o caso dos epitélios da pele e do intestino e alguns órgãos parenquimatosos, em especial o fígado. A proliferação celular é rigidamente controlada por sinais promovidos pelos fatores de crescimento (produzidos especialmente por macrófagos ativados pela lesão tecidual, células epiteliais e estromais) e pela matriz extracelular.
Processo de regeneração
Durante a regeneração tecidual, a proliferação celular é acompanhada pelo desenvolvimento de células maduras a partir das células-tronco teciduais. Essas células vivem em nichos especializados e atualmente acredita-se que a lesão desencadeie sinais nesses locais, ativando a proliferação e a diferenciação das células-tronco quiescentes em células maduras que irão repovoar o tecido lesado.
Os mamíferos apresentam capacidade regenerativa de tecidos e órgãos limitada. Apenas alguns componentes da maioria dos tecidos conseguem recuperar-se completamente.
Cicatrização
Caso os tecidos não consigam restituírem-se ou se a lesão das estruturas de suporte tecidual for extensa, o reparo ocorre por meio da cicatrização, que é a deposição de tecido conjuntivo ou fibroso. Nós sabemos que a cicatriz não é normal, mas ela fornece uma estabilidade estrutural para que o tecido lesado possa voltar a funcionar.
Vários tipos celulares se proliferam durante o reparo tecidual, como os fibroblastos, células endoteliais vasculares e as próprias células teciduais remanescentes. Os fibroblastos atuarão principalmente na formação da cicatriz, caso o tecido lesado não possa ser reparado por regeneração. As células endoteliais vasculares se proliferam para criação de novos vasos sanguíneos (angiogênese) que forneçam nutrientes para o processo de reparo. Já as células remanescentes se proliferam com o objetivo de tentar restaurar o tecido danificado.
A forma de reparo é determinada em parte pela capacidade de proliferação intrínseca desse tecido. Com base nisso, podemos dividir os tecidos do corpo (e suas células) em três grupos:
Lábeis ou instáveis
Células de tecidos lábeis são constantemente perdidas e substituídas pela maturação de células tronco e posterior proliferação das células maduras. Exemplos de células lábeis são as células hematopoiéticas da medula óssea e alguns tipos de células epiteliais, como as da epiderme, cavidade oral, as do trato biliar, gastrointestinal e urinário. Todos esses locais podem regenerar-se logo após a lesão tecidual, contanto que a reserva de células-tronco esteja devidamente preservada.
Células hematopoiéticas
Células progenitoras que dão origem a todas as células sanguíneas e do sistema imune, como os leucócitos.
Estáveis
Células de tecidos estáveis são quiescentes, no estágio G0 do ciclo celular, apresentando atividade proliferativa mínima em um ambiente normal. Porém, uma vez que haja a lesão tecidual, elas são capazes de se dividir e sua proliferação é particularmente importante na cura das feridas. Células estáveis constituem o parênquima da maior parte de órgãos sólidos, como pâncreas, rins e fígado. Células endoteliais, fibroblastos e células musculares lisas também são consideradas células estáveis. Esses tecidos e células apresentam capacidade regenerativa limitada após eventuais lesões, com exceção do tecido hepático.
Permanentes
Células de tecidos permanentes são consideradas terminantemente diferenciadas e não proliferativas, como é o caso da maioria dos neurônios e das células cardíacas. A lesão nesses órgãos é irreversível e caracteristicamente resulta em cicatriz, sendo insuficiente qualquer capacidade proliferativa existente para regenerá-los.
Saiba mais
Atualmente, acredita-se que a maioria dos tecidos contêm proporções variáveis de células lábeis, estáveis e permanentes, embora seja difícil quantificá-las. Além disso, a proliferação celular representa apenas uma via de regeneração e as células-tronco contribuem de forma importante para esse processo.
Agora vamos estudar o processo de regeneração e cicatrização de forma mais detalhada.
Regeneração parenquimatosa
A regeneração dos tecidos lesados varia de acordo com a classificação desse tecido e com a gravidade da lesão. Em tecidos lábeis, como é o caso dos epitélios da pele e do trato intestinal, as células danificadas são rapidamente substituídas pela proliferação das células residuais e diferenciação das células-tronco, como já comentamos. Porém, é importante ressaltar que esse processo só ocorre se a membrana basal, a matriz extracelular, estiver íntegra, pois será fonte dos fatores de crescimento necessários para o reparo.
Quando ocorre perda de hemácias, durante a lesão tecidual, essa perda é compensada pela proliferação de células-tronco hematopoiéticas da medula óssea e de outros tecidos, ativado por fatores estimuladores de colônia, que são produzidos em resposta ao baixo número de hemácias.
Você sabia
Em órgãos parenquimatosos com células estáveis, a regeneração ocorre, mas com exceção do fígado, é um processo limitado. O pâncreas, a tireoide e o pulmão, por exemplo, são tecidos que apresentam certa capacidade regenerativa. Quando um paciente é submetido à remoção de um rim, ocorre uma resposta compensatória do outro rim, pela hipertrofia e hiperplasia das células do ducto proximal. Ainda não sabemos ao certo quais são os mecanismos que possam explicar essa resposta, mas muito provavelmente envolvem fatores de crescimento e interação das células com a matriz extracelular.
Falamos que o fígado é a exceção à regra da regeneração limitada dos tecidos estáveis. Você sabe o porquê?
O fígado humano apresenta uma capacidade regenerativa extraordinária, conforme demonstrada por seu crescimento após hepatectomia parcial. A regeneração desse órgão acontece por meio de dois mecanismos muito importantes e que já foram comentados, que são a proliferação das células remanescentes, os hepatócitos, e o repovoamento celular a partir de células progenitoras.
É importante comentarmos que a arquitetura normal dos tecidos só pode ser regenerada se o tecido residual estiver estruturalmente ileso. Caso ocorra uma lesão extensa por uma inflamação ou infecção, que acometa o tecido como um todo, a regeneração é incompleta e vem acompanhada da formação de cicatriz, processo que falaremos a seguir. Em casos de abcesso hepático, com destruição extensa do fígado, por exemplo, ocorre a formação de cicatrizes fibrosas mesmo que os demais hepatócitos tenham capacidade de se regenerar.
Cicatrização sequência, fases, mecanismos, tipos e complicações
Caso ocorra uma lesão tecidual grave ou crônica, de modo que a regeneração não seja suficiente para reparar o dano tecidual, ou se os tecidos lesados sejam formados majoritariamente por células permanentes, acontece uma substituição das células lesadas por tecido conjuntivo, formando uma cicatriz. Porém, também podemos ter uma combinação, entre a regeneração de algumas células e a cicatrização.
Ao contrário da regeneração, que envolve a restituição dos componentes teciduais, a formação de cicatriz é como se fosse uma espécie de “remendo” nos tecidos lesados.
A cicatrização é um processo que ocorre após lesões causadas por traumatismos ou pela morte celular.
Ela é didaticamente dividida em três fases: inflamatória, proliferativa e de maturação.
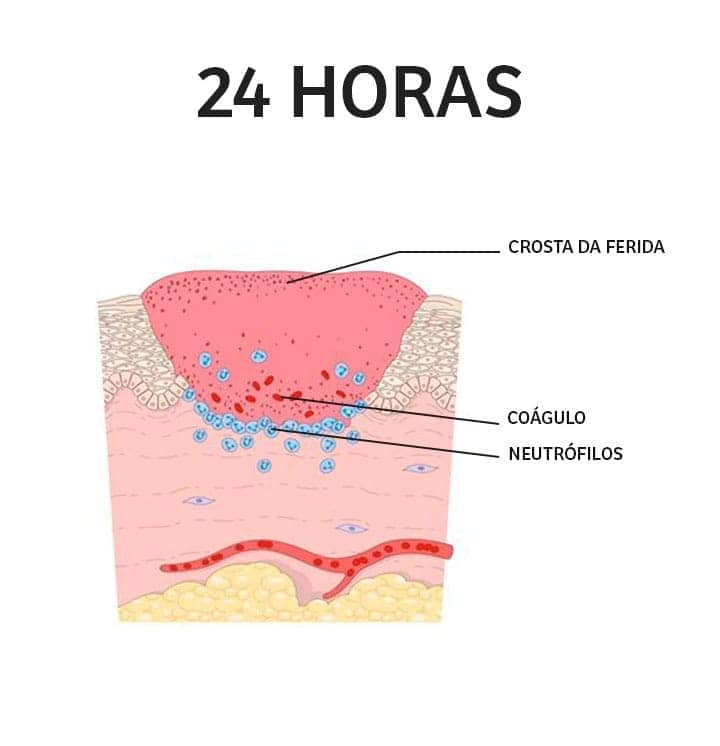
Fase inflamatória: tem início imediatamente após a lesão e envolve alterações vasculares e eventos celulares. Inicialmente, para reduzir a perda sanguínea, há a liberação de moléculas vasoconstritoras. A constrição vascular é transitória e imediatamente seguida pelo desencadeamento do processo de hemostasia, que culmina na formação de um coágulo formado por fibrina, colágeno e plaquetas ativadas. Uma vez que o coágulo (tampão fibrino-plaquetário) auxilia na prevenção de hemorragias, a resposta inflamatória se inicia. Ocorre um aumento da permeabilidade vascular, que favorece a migração de leucócitos, principalmente neutrófilos, para o local da lesão. De fato, os neutrófilos são as primeiras células a chegar no local de dano, iniciando a eliminação do agente agressor e de células mortas. Gradativamente são substituídos por macrófagos. Os macrófagos, além de ajudarem na remoção do tecido morto e combate a possíveis microrganismos, secretam citocinas e fatores de crescimento que atuam na angiogênese, na produção de colágeno por fibroblastos e na síntese de matriz extracelular, fatores fundamentais para a transição para a fase proliferativa.
Angiogênese
Processo de formação e proliferação de novos capilares sanguíneos.
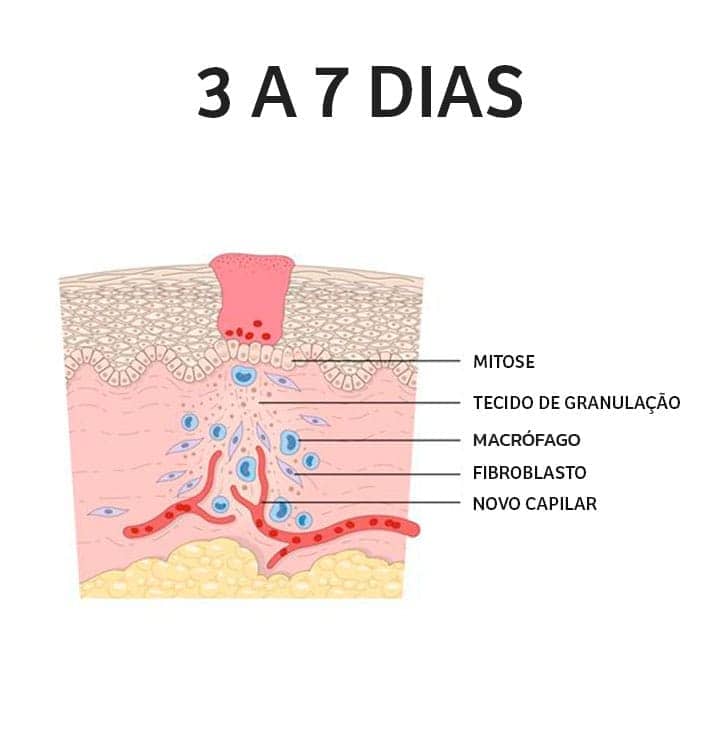
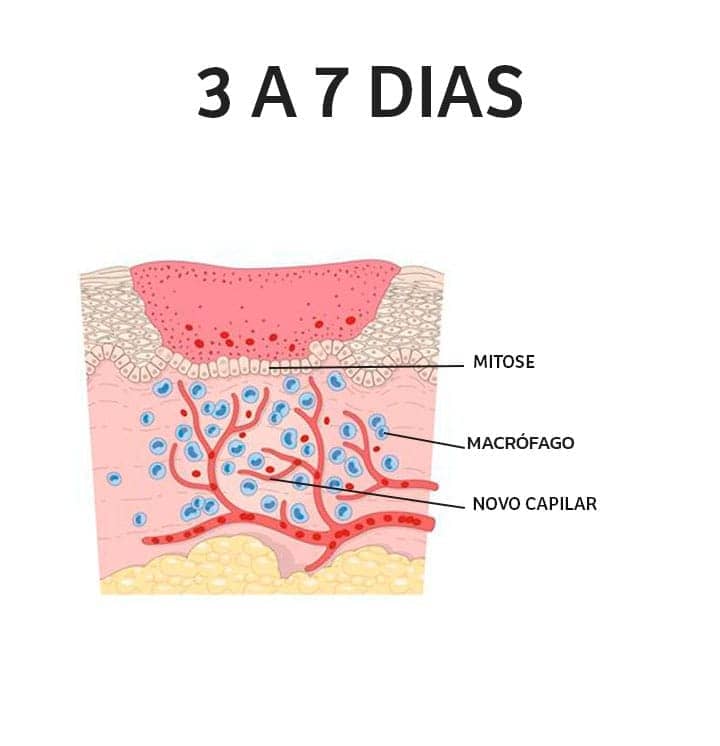
Fase proliferativa: também chamada de fase de granulação, a fase proliferativa é constituída das etapas de epitelização, angiogênese e formação de tecido de granulação. A epitelização é um processo que ocorre de maneira precoce. Caso a membrana basal esteja intacta, as células epiteliais migram em direção superior e as camadas superficiais são restauradas rapidamente, em aproximadamente 3 dias. Porém, caso a membrana basal tenha sofrido danos, as células epiteliais das bordas da lesão começam a se proliferar para tentar reestabelecer a barreira protetora. Já a angiogênese é caracterizada pela migração de células endoteliais e formação de capilares, essenciais para a adequada cicatrização. A etapa final é a formação do tecido de granulação, na qual os fibroblastos vizinhos migram para o local da lesão e são ativados, saindo do seu estado de quiescência. Há a liberação de fatores de crescimento, como o PDGF (fator de crescimento derivado de plaquetas) e de citocinas, como o TGF-β, que estimulam a proliferação dos fibroblastos, produção de colágeno e a transformação em miofibroblastos, promovendo a contração da ferida.
TGF-β
Fator de crescimento transformante beta é uma proteína que controla a proliferação, diferenciação celular e outras funções na maioria das células.
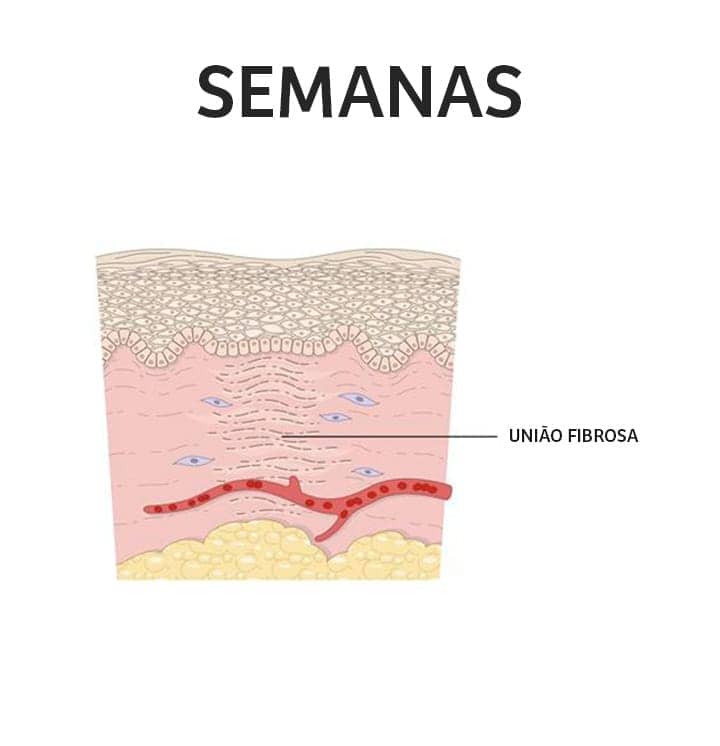
Fase de maturação: a característica mais importante dessa fase é a deposição de colágeno de maneira organizada. O colágeno produzido inicialmente é mais fino que o colágeno da pele normal. Com o tempo, esse colágeno inicial é reabsorvido e é produzido um colágeno mais espesso. Essas mudanças resultam no aumento da força tensora da ferida. A reorganização da nova matriz extracelular é uma etapa crucial do processo de cicatrização, na qual fibroblastos e leucócitos secretam colagenases que atuarão na degradação da matriz antiga. Portanto, em uma balança que equilibra a síntese da nova matriz e a degradação da matriz antiga, só veremos sucesso na cicatrização quando houver maior taxa de deposição de colágeno e síntese da nova matriz extracelular.
Você sabia
Usamos o termo tecido de granulação por causa da aparência rósea, macia e granular vista sob a crosta de uma ferida cutânea. Na histologia, observamos a proliferação de fibroblastos e capilares novos e delicados, em uma matriz extracelular frouxa, geralmente com a mistura de células inflamatórias, principalmente macrófagos.
Até aqui, nós aprendemos os princípios gerais e mecanismos de reparo por meio da regeneração e formação de cicatriz. Agora, comentaremos o processo de cicatrização de feridas cutâneas, que dependendo da natureza e do tamanho da lesão, pode ser classificado de duas formas:
Cicatrização por primeira intenção: ocorre quando a lesão acomete apenas a camada epitelial. O reparo consiste basicamente no processo de cicatrização que comentamos anteriormente: fase inflamatória, proliferativa e de maturação.
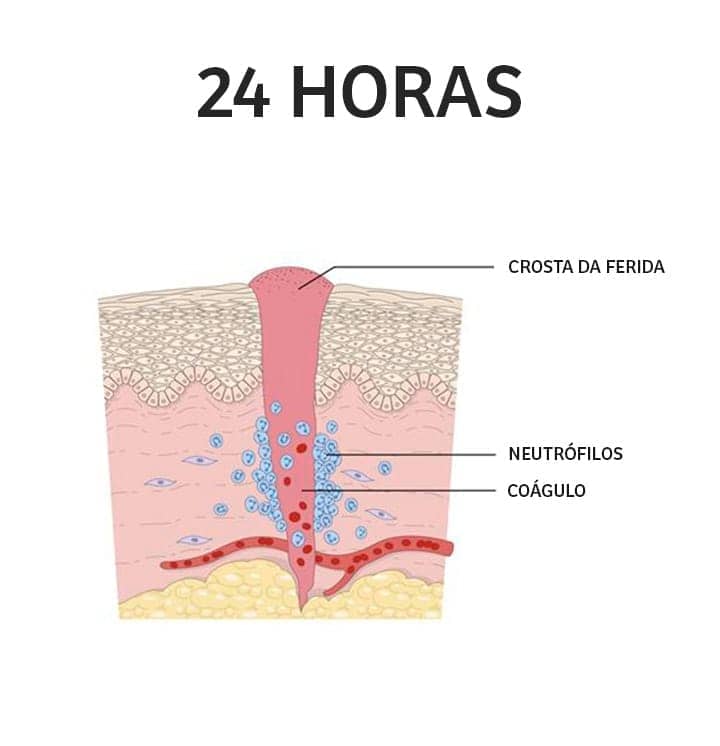
1
O coágulo é formado e ocupa o espaço do sangue extravasado pelo corte. A reação inflamatória é induzida pela liberação de mediadores liberados pelos componentes do tampão hemostático e das células remanescentes das bordas.
2
Há a proliferação de células epiteliais e de fibroblastos, além da fagocitose do coágulo pelos leucócitos oriundos do processo inflamatório.
3
Por fim, inicia-se a produção de tecido conjuntivo cicatricial e a regeneração do epitélio.
Exemplo
Um exemplo clássico é quando temos um corte limpo e sem infecção (normalmente cirúrgico) e suas bordas são aproximadas por suturas. Esse tipo de reparo é mais rápido e forma uma cicatriz menor, uma vez que a fenda da ferida causa apenas a interrupção focal da continuidade epitelial e a destruição tecidual nas bordas é menor.

Cicatrização por segunda intenção: ocorre em grandes feridas, abcessos, ulcerações e no infarto de órgãos parenquimatosos, onde há extensa perda celular e tecidual. Nesses casos, o reparo envolve uma combinação entre os processos de regeneração e cicatrização.
1
Os mecanismos da cicatrização por segunda intenção assemelham-se aos de primeira intenção, porém na cura por segunda intenção há a intensificação do processo inflamatório (especialmente se houver infecção).
2
Em seguida, ocorre o desenvolvimento abundante do tecido de granulação, acúmulo de matriz extracelular e formação de uma grande cicatriz.
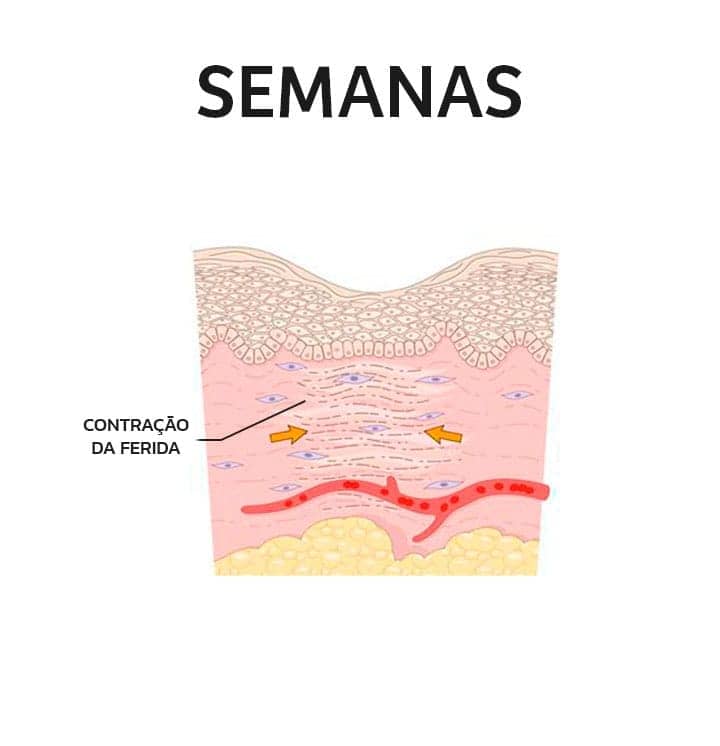
3
Além disso, a contração da ferida, pela ação dos miofibroblastos, geralmente ocorre nas lesões de grande superfície. O processo de contração ajuda a fechar a ferida, uma vez que diminui o espaço entre as bordas, e é uma característica importante desse tipo de cicatrização.
A formação da cicatriz e do tecido de granulação podem apresentar dois tipos de complicação: a ruptura da ferida, que chamamos de deiscência, e a ulceração. A deiscência não é muito comum, acometendo com maior frequência pacientes que passaram por uma cirurgia de abdômen. Vômitos e tosse podem produzir estresse mecânico sobre a ferida. A ulceração de feridas ocorre devido à vascularização inadequada durante o reparo, como é o caso das feridas de membros inferiores de indivíduos com aterosclerose.
Além disso, quando há a formação excessiva de componentes do processo de cicatriz, podemos ter como consequência as chamadas cicatrizes hipertróficas e os queloides. As cicatrizes hipertróficas são cicatrizes salientes, devido ao acúmulo excessivo de colágeno. Caso essa cicatriz cresça além dos limites da ferida original, sem apresentar regressão, é chamada de queloide. Em geral, as cicatrizes hipertróficas se desenvolvem após traumas ou lesões térmicas que envolvem as camadas mais profundas da derme.
Outra anormalidade envolvida na cicatrização das feridas é a granulação exuberante. O que ocorre é a formação excessiva de tecido de granulação, causando protusão acima do nível da pele e dificultando a reepitelização. Porém, a granulação excessiva pode ser removida por procedimentos de cauterização e excisão cirúrgica.
Saiba mais
Conforme já demonstramos, no processo normal de cicatrização, a contração da ferida é uma característica importante. Uma vez exacerbada, a contração resulta na contratura e deformidade da ferida e dos tecidos ao redor dela. Essas anormalidades são comumente observadas após queimaduras graves, geralmente na palma das mãos, planta dos pés e parte anterior do tórax, podendo comprometer o movimento das articulações.
Reparo tecidual:
Diferenças entre o sistema nervoso central e periférico
Neste vídeo, vamos discutir as características e as diferenças entre o reparo no sistema nervoso central e periférico.
Fatores que influenciam o reparo tecidual
Uma variedade de fatores pode alterar o processo de reparo tecidual, reduzindo sua qualidade e a adequação do processo de reparo ativo.
Fatores locais
- A infecção é um importante fator que leva à demora no processo de reparo.
- A presença direta ou indireta de microrganismos prolonga a resposta inflamatória, aumentando a lesão tecidual local.
- A presença de corpos estranhos, como pedaços de vidro, impede o reparo completo.
- Pressão local ou torção, assim como outros fatores mecânicos, podem provocar separação ou abertura espontânea (deiscência) das feridas.
- A perfusão tecidual insatisfatória, decorrente de lesões vasculares como na aterosclerose ou por distúrbios hemodinâmicos também retarda ou impede a cicatrização, pois reduz o fornecimento de O2 e nutrientes para os tecidos lesados.
Fatores sistêmicos
- O diabetes melito é uma das causas sistêmicas mais importantes de anormalidades no reparo de lesões, devido a lesões vasculares (hipóxia) e alterações em células fagocíticas que favorecem infecções.
- O estado nutricional do indivíduo também apresenta influência importante no reparo: a deficiência de proteínas, de vitamina C ou de zinco retarda a cicatrização, pois interfere diretamente nos processos de síntese de colágeno.
- O tabagismo pode prejudicar a cicatrização uma vez que a nicotina provoca vasoconstrição e o monóxido de carbono tem efeitos anti-inflamatórios.
- A administração de glicocorticoides (esteroides) pode levar ao enfraquecimento da cicatriz devido aos efeitos anti-inflamatórios e à diminuição da fibrose.
- O local da lesão e as características do tecido lesionado também são fundamentais para determinar o processo de reparo.
- A resposta inflamatória sistêmica, que acompanha infecções e queimaduras extensas, também reduz a eficiência da cicatrização pela baixa perfusão tecidual e aumento de moléculas anti-inflamatórias.
- Um último fator muito importante é, sem dúvidas, o tipo e a extensão da lesão. Vimos que tecidos lábeis e estáveis são capazes de restaurarem-se completamente. Porém, caso a lesão seja extensa, a regeneração será incompleta. Já nos tecidos compostos por células permanentes, a lesão resulta na cicatrização, podendo haver tentativas de compensação funcional pelos componentes íntegros, como ocorre no reparo do infarto do miocárdio.
Perfusão tecidual insatisfatória
Diminuição da irrigação de sanguínea em um determinado tecido.
Afinal, a inflamação é ou não é importante para o reparo?
Quando o desfecho da resposta inflamatória é a resolução, ou seja, quando a lesão é eliminada, de curta duração ou quando houve pouca destruição dos tecidos envolvidos, há a liberação de vários fatores de crescimento e as células remanescentes conseguem regenerar a área lesada. Porém, a acentuação da resposta inflamatória e sua desregulação podem prejudicar o reparo tecidual, aumentando a liberação de metaloproteinases que levam ao desequilíbrio da relação entre síntese e lise de componentes da matriz extracelular. Por isso, a inflamação é um processo que deve ser rigorosamente regulado, a fim de proporcionar um reparo tecidual satisfatório.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Identificar os conceitos gerais, a epidemiologia e as características das neoplasias benignas e malignas
Nomenclatura
A palavra neoplasia é derivada da junção das palavras gregas neo, que significa novo, e plasis, que significa formação. Apesar de bem conhecido pelos médicos e profissionais da saúde, definir adequadamente o termo neoplasia é uma tarefa complexa. Atualmente, neoplasia pode ser definida como um distúrbio de proliferação celular, acompanhado da redução ou perda de diferenciação, e desencadeado por uma série de mutações adquiridas que vão afetar uma única célula e sua respectiva progênie. Essas mutações oferecem para as células neoplásicas uma vantagem de sobrevivência e crescimento, por isso a proliferação dessas células é excessiva e independente dos sinais fisiológicos de crescimento, a que todas as outras células normais são submetidas.
Antigamente, o termo tumor (oncos, do grego) era sinônimo de edema causado pelo processo inflamatório. Porém, ao longo dos anos, chamamos de tumor um neoplasma, ou seja, um novo crescimento. A oncologia é o estudo dos tumores ou neoplasmas. Os componentes básicos de qualquer tumor são a presença de células neoplásicas clonais, que vão constituir o parênquima tumoral e o tecido conjuntivo, os vasos sanguíneos e as células do sistema imune inato e adaptativo, que juntos formam o estroma reativo do tumor.
Os oncologistas classificam os tumores e seu comportamento biológico com base principalmente no componente parenquimatoso. Porém, o crescimento e a disseminação dos tumores são altamente dependentes do seu respectivo estroma.
Um tumor é denominado benigno quando avaliamos seus aspectos macro e microscópicos e os consideramos relativamente inocentes. Ou seja, esse tumor vai se manter localizado, não se disseminando para outras áreas, podendo, dessa forma, ser removido por cirurgia local. Porém, mesmo que geralmente não causem a morte do paciente, tumores benignos podem ocasionar morbidade significativa, sendo fatais em algumas vezes.
Morbidade
Refere-se ao conjunto dos indivíduos que adquirem doenças (ou doenças específicas) num dado intervalo de tempo em uma determinada população. A morbidade mostra o comportamento das doenças e dos agravos à saúde na população.
Normalmente, os tumores benignos são denominados pela ligação do sufixo –oma ao nome do tipo celular que originou aquele tumor. Tumores de células mesenquimais geralmente seguem essa regra: condroma significa um tumor cartilaginoso benigno, enquanto fibroma refere-se a um tumor benigno em tecidos fibrosos. Os tumores epiteliais benignos são classificados a partir das células de origem, ou pelo padrão microscópico, e outros pela característica macroscópica. Tumores epiteliais benignos que produzem projeções visíveis, semelhantes a verrugas, a partir de suas superfícies, são denominados papilomas.
De forma diferente, os tumores malignos, que são conhecidos coletivamente como cânceres, apresentam capacidade de invadir e destruir o tecido à sua volta, disseminando-se para outros locais do corpo, levando à morte do indivíduo. Porém, uma vez diagnosticados precocemente, podem ser removidos cirurgicamente ou tratados de maneira eficaz com quimioterapia ou radioterapia. Atualmente, embora ter um câncer não seja sinônimo de morte, a designação “maligna” de um tumor deve ser investigada com atenção.
Quimioterapia
Quimioterapia é um tratamento que utiliza medicamentos para destruir as células neoplásicas que formam um tumor. Estes medicamentos são administrados por via intravenosa e são levados a todas as partes do corpo, destruindo as células tumorais e impedindo que elas se espalhem pelo corpo.
Radioterapia
Radioterapia é um tratamento no qual se utilizam radiações ionizantes (raio X, por exemplo) para destruir um tumor ou impedir que as células neoplásicas se proliferem. Pode ser utilizada em conjunto com a quimioterapia ou outros tratamentos.
Para nomear os tumores malignos, são usadas algumas expressões. Exemplos: sarcomas designam os tumores malignos que surgem de tecidos mesenquimais sólidos (fibrossarcoma, condrossarcoma etc.). Neoplasias malignas de células formadoras do sangue são chamadas de leucemias ou linfomas. Já o termo carcinoma denomina os tumores malignos originários de células epiteliais, de qualquer camada germinativa. Algumas vezes, o tecido ou o órgão que deu origem ao tumor pode ser identificado e é adicionado à sua descrição, como o carcinoma de células escamosas broncogênico. Porém, muitas vezes, a composição celular do tumor apresenta origem tecidual desconhecida. Nesses casos, chamamos de tumor maligno indiferenciado.
Você sabia
Quando uma neoplasia, seja ela benigna, seja maligna, apresenta projeções macroscopicamente visíveis acima da superfície da mucosa, projetando-se, é chamada de pólipo.
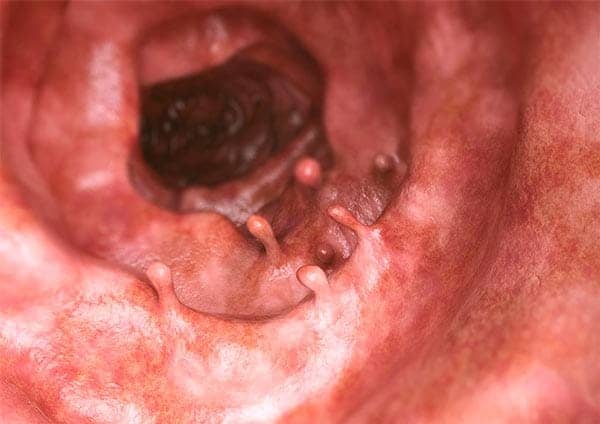
A nomenclatura de tumores contém alguns termos inapropriados, mas que ainda são muito utilizados na clínica médica. Linfoma e melanoma, por exemplo, que soam como benignos, são utilizados para designar certas neoplasias malignas.
Normalmente, as células que formam o parênquima de tumores benignos ou malignos são semelhantes entre si. Porém, em alguns poucos casos, ocorre uma diferenciação de um único clone celular neoplásico, que resulta em um tumor misto, como o tumor misto de glândula salivar, onde os componentes celulares são epiteliais, mas o estroma possui componentes ósseos e cartilaginosos. Todos esses elementos derivam de um único clone, que é capaz de produzir células epiteliais e mioepiteliais. A designação de preferência para esse tipo de neoplasia é adenoma pleomórfico.
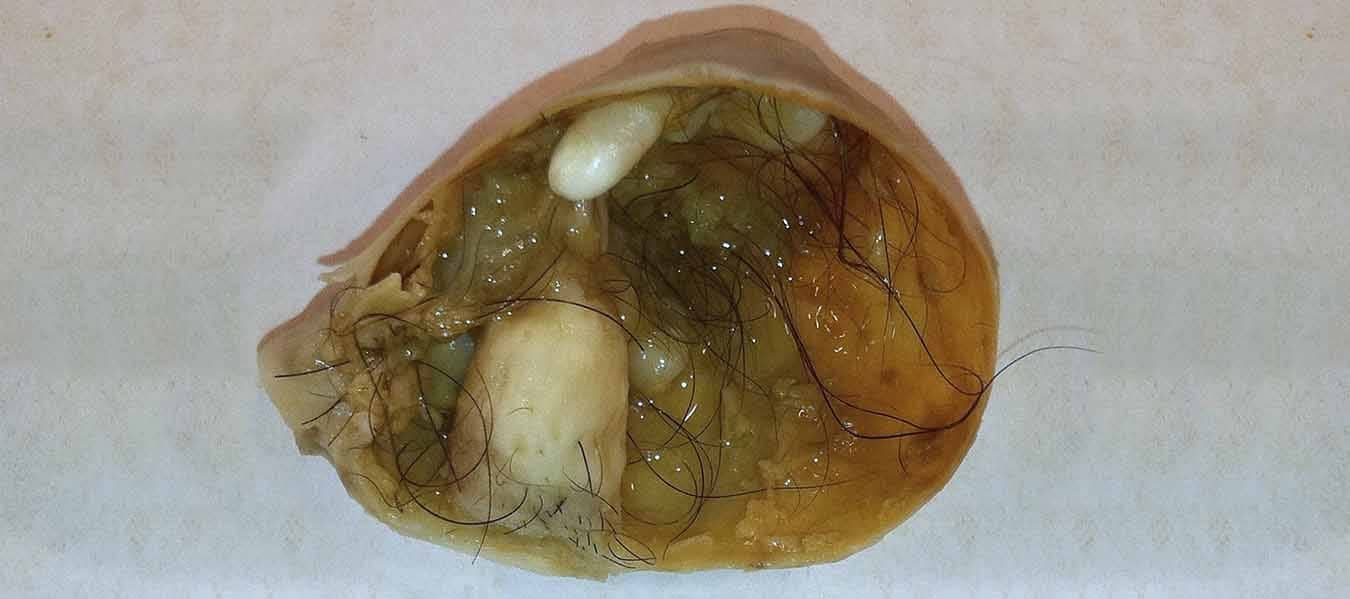
É importante ressaltar que, na grande maioria das neoplasias, os tumores são compostos por células de uma única camada germinativa (endoderma, mesoderma ou ectoderma). Porém, existe uma exceção: o teratoma é um tumor que contém células pertencentes a mais de uma camada germinativa. Ou seja, as células podem se diferenciar e originar neoplasias, que contêm osso, epitélio, gordura e até nervos, tudo de maneira desordenada.
Características das neoplasias benignas e malignas
A distinção entre tumores benignos e malignos geralmente é feita com base em uma série de características, entre elas o grau de diferenciação, a taxa de crescimento, invasão local e disseminação a distância.
Em geral, tumores benignos são bem diferenciados, sendo difícil distinguir microscopicamente as células neoplásicas das normais adjacentes. Por outro lado, tumores malignos são bem menos diferenciados ou completamente indiferenciados (anaplásicos), sendo a anaplasia uma das características da malignidade. A orientação de células anaplásicas também se mostra alterada, com crescimento desorganizado. Células cancerígenas normalmente apresentam variações em seu tamanho e sua morfologia, sendo denominadas pleomórficas. Além disso, a morfologia nuclear também se mostra anormal, com núcleos desproporcionalmente grandes e cromatina desorganizada. Em relação à funcionalidade, células neoplásicas benignas são mais propensas a manter as funções de suas células de origem, diferentemente de tumores malignos, que podem adquirir funções inesperadas devido aos distúrbios na diferenciação.
Tumores benignos normalmente apresentam crescimento progressivo e lento, e podem sofrer paralisação ou regressão. Além disso, as mitoses são normais, sendo raras as figuras mitóticas. Por outro lado, tumores malignos apresentam crescimento irregular, podendo ser lento ou muito rápido. A presença de mitoses não significa que o tumor seja maligno ou mesmo neoplásico, porém numerosas figuras mitóticas, atípicas e bizarras, como fusos mitóticos multipolares, são características morfológicas de tumores malignos.
A capacidade de invasão, assim como o desenvolvimento de metástases, é a característica mais confiável para diferenciarmos tumores benignos dos malignos. As neoplasias benignas costumam crescer como massas coesas, que permanecem bem demarcadas nos locais de origem, sem infiltrarem, invadirem ou causarem metástase. Por outro lado, tumores malignos costumam ser pouco demarcados, infiltrando-se no tecido ao redor.
Metástase refere-se à propagação de um tumor para outras áreas não relacionadas ao tumor primário. Neoplasias benignas não formam metástase, sendo essa uma característica de tumores malignos. Todos os tumores malignos possuem o potencial de causar metástase, porém alguns tipos raramente causam. Em geral, a probabilidade de um tumor causar metástase está relacionada ao baixo grau de diferenciação, invasão local agressiva e rápido crescimento. A disseminação dos tumores malignos pode ocorrer através do seu implante direto em cavidades ou superfícies corporais, por disseminação hematológica ou linfática.
Grau de diferenciação
Refere-se ao nível de semelhança das células do parênquima tumoral e das células parenquimatosas normais correspondentes, seja no aspecto funcional, seja no aspecto morfológico.
Epidemiologia do câncer
O câncer é uma das principais causas de morte em todo o mundo, sendo responsável por milhões de óbitos a cada ano. Estima-se que uma a cada seis mortes esteja relacionada à doença. Apesar da alta mortalidade em nível global, são os países mais pobres que concentram as maiores taxas de letalidade. Isso mostra como o fator econômico apresenta influência nas estratégias e políticas de prevenção, diagnóstico precoce e tratamento. A estimativa para as próximas duas décadas é o aumento do número anual de casos de câncer, mas com diminuição das mortes prematuras por diagnósticos tardios ou falta de acesso ao tratamento adequado.
Desde a década de 1960, observamos diminuição do número total de mortes provocadas por doenças infecciosas e o aumento das chamadas doenças crônicas não transmissíveis, como:

Hipertensão arterial
Diabetes
Câncer
Essas doenças são consideradas silenciosas e estão associadas a 72% dos óbitos no Brasil. A mudança do perfil epidemiológico está relacionada ao avanço tecnológico, que permitiu o desenvolvimento de novas vacinas e novos medicamentos, e às melhorias em saneamento básico nas cidades, que trouxeram mais qualidade de vida para a população.
As diferenças observadas entre as taxas de incidência de cada tipo de câncer em países de diferentes continentes indicam que as estratégias de enfrentamento devem ser desenhadas de acordo com o contexto de cada país.
Incidência
Número de novos casos surgidos em determinada população e em determinado intervalo de tempo.
Os cânceres de próstata e mama são aqueles que apresentam os maiores números de novos casos no mundo. Por esse motivo, políticas públicas de controle vêm sendo gradualmente implementadas e, hoje, são uma prioridade do nosso Sistema Único de Saúde, o SUS.
Pesquisas recentes têm demonstrado que alguns tipos de câncer, como o sarcoma de Kaposi – uma neoplasia endotelial –, o câncer de colo do útero e o câncer nasofaríngeo são mais frequentes em países com menor Índice de Desenvolvimento Humano (IDH). Por outro lado, os cânceres colorretal, de pulmão e tireoide são mais frequentes em países com alto IDH. É claro que essa relação não é determinante, mas é proveitosa para pensarmos como o acesso à saúde é importante no controle da doença. O sarcoma de Kaposi, por exemplo, é uma neoplasia associada a pacientes com a Síndrome da Imunodeficiência Adquirida (SIDA/AIDS).
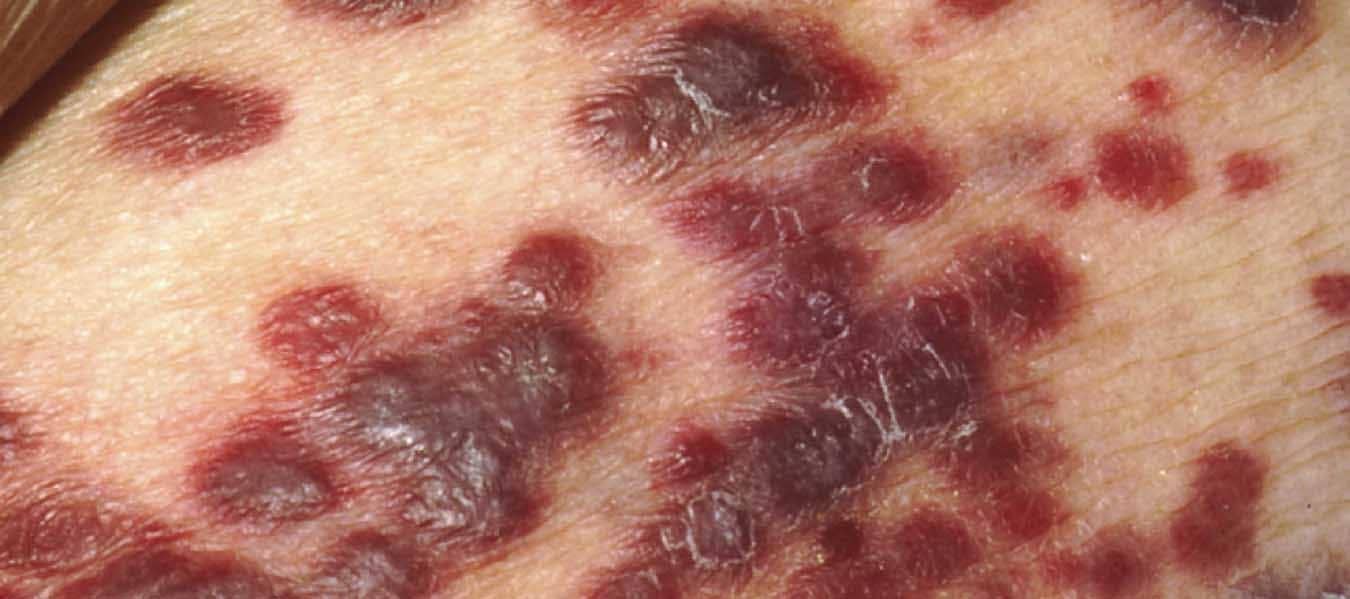
Para pensarmos nas mudanças na epidemiologia do câncer, podemos tomar como exemplo o caso do câncer de pulmão. Provavelmente, você já assistiu a algum filme ou série de época, principalmente os que se passam em meados do século XX, em que era comum fumar. O tabagismo era mais do que um hábito, tratava-se de um fator cultural muito presente. No final da década de 1980, cerca de 43% dos homens e 27% das mulheres eram fumantes no Brasil.
Com fortes políticas e estratégias de combate ao tabagismo implementadas pelo Ministério da Saúde, esses números diminuíram significativamente, o que reduziu também as doenças e as mortes relacionadas a esse problema. É muito provável que você já tenha visto nas embalagens de cigarros aquelas fotos que alertam para as consequências do uso, ou mesmo algum aviso proibindo fumar em locais fechados.
Essas e outras estratégicas combinadas colocaram o Brasil em destaque na luta antitabaco. Outro exemplo é a vacinação contra o papilomavírus humano (HPV) no Brasil, que certamente diminuirá as taxas de câncer de colo do útero nas próximas décadas.
Você verá mais adiante que muitos agentes estão associados ao processo de desenvolvimento do câncer (carcinogênese), inclusive os agentes infecciosos, como vírus e bactérias. Países do continente africano têm as maiores taxas globais de casos de câncer atribuídos a agentes infecciosos. A alta prevalência de HPV, vírus das hepatites B e C, herpes vírus humano tipo 8 e vírus Epstein-Barr associada à infecção pelo vírus HIV aumentam bastante o risco para aparecimento de diferentes cânceres. Os principais tipos relacionados a essa associação são o sarcoma de Kaposi, linfoma não Hodgkin e o câncer cervical invasivo. Fica evidente, então, que, embora fatores genéticos e ambientais contribuam conjuntamente para o desenvolvimento do câncer, as influências ambientais (agentes infecciosos, consumo de álcool, tabaco, dieta, história reprodutiva e carcinógenos ambientais) parecem ser os fatores de risco dominante para a maioria dos tipos de câncer.
Mas qual o principal fator de risco para o desenvolvimento do câncer?
Segundo o Observatório Global do Câncer da Organização Mundial da Saúde, o tabagismo é o principal fator de risco, sendo associado a cerca de 22% das mortes pela doença. O câncer de pulmão tem a maior taxa de mortalidade entre todos os tipos de câncer.
As estimativas globais indicam o aumento do número de novos casos no mundo: segundo a Organização Mundial da Saúde (OMS), em 2008 e 2018, foram notificados 12.6 e 18.1 milhões de novos casos, respectivamente. A projeção é que, em 2040, esse número alcance 29.4 milhões de casos. O aumento considerável será reflexo não apenas do real aumento de novos casos, mas da crescente sensibilidade dos sistemas de saúde, fruto de um claro e sólido investimento no controle da doença. Logo, mais pessoas terão acesso aos sistemas e ao diagnóstico precoce. Por outro lado, espera-se que a mortalidade diminua expressivamente, pelo fortalecimento das estratégias de controle e prevenção, maior acesso aos serviços de saúde e desenvolvimento de novos e mais eficazes tratamentos.
diagnóstico e epidemiologia do câncer
Neste vídeo, você conhecerá um pouco sobre o diagnóstico e epidemiologia do câncer no Brasil.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever os agentes carcinogênicos e os aspectos moleculares e clínicos das neoplasias
Bases moleculares do câncer
Ao longo das décadas, a ciência aprofundou consideravelmente o conhecimento dos mecanismos envolvidos nos processos celulares e moleculares da carcinogênese. As próprias tentativas de combate à doença resultaram em descobertas fantásticas, que, inclusive, foram reconhecidas com prêmios Nobel. Para entendermos a biologia do câncer, é necessário conhecer as características fenotípicas comuns dos tumores, que são passadas para as outras células cancerígenas por meio de alterações genéticas e epigenéticas.
Epigenéticas
Epigenética refere-se a outros fatores além da sequência de DNA, os quais regulam a expressão gênica (e, portanto, o fenótipo celular).
Estima-se que todos os cânceres apresentam oito alterações fundamentais em sua fisiologia celular. São elas:
Autossuficiência nos sinais de crescimento
Os genes que promovem a proliferação de células normais são chamados de proto-oncogenes. Nas células cancerígenas, por outro lado, encontramos os oncogenes, que são versões mutadas ou superexpressas dos proto-oncogenes. Os oncogenes codificam proteínas chamadas oncoproteínas, que possuem a capacidade de promover o crescimento celular independentemente dos sinais de crescimento normais, e, assim, fogem do controle do crescimento celular, proliferando continuamente.
Os proto-oncogenes participam das vias de sinalização que levam à proliferação, e os proto-oncogenes de pró-crescimento codificam, por exemplo, fatores de crescimento, transdutores de sinal ou componentes do ciclo celular. Já os oncogenes correspondentes codificam oncoproteínas que apresentam funções semelhantes às suas versões normais, mas elas, em geral, são constitutivamente ativas, resultado da contínua ativação dos proto-oncogenes mutados correspondentes, e favorecem as células autossuficientes em crescimento.
As mutações pontuais nos genes da família RAS são o tipo mais comum de anomalia envolvendo proto-oncogenes humanos. A proteína RAS, codificada pelos genes de mesmo nome, atua como um transdutor de sinal extracelular, ou seja, auxilia na comunicação da membrana celular com o núcleo, principalmente na transmissão de sinais estimulatórios de crescimento. A forma inativa da proteína RAS é ligada a GDP, enquanto a ligação a GTP promove sua ativação. Mutações em RAS fazem com que essa proteína permaneça ativada, ligada a GTP, promovendo continuamente o estímulo de pró-crescimento celular.
Estima-se que até 20% de todos os tumores humanos apresentam mutação das proteínas RAS, mas, em alguns tipos específicos, a frequência de mutação é muito maior. Cerca de 90% dos adenocarcinomas pancreáticos, por exemplo, apresentam mutação pontual em RAS.
proto-oncogenes
Neste vídeo, você conhecerá um pouco sobre proto-oncogenes: a importância do gene MYC.
Insensibilidade aos sinais inibidores de crescimento
Como aprendemos, os proto-oncogenes conduzem à proliferação normal das células. Já os genes supressores de tumor e seus respectivos produtos são responsáveis por frear essa proliferação. Logo, caso ocorram anomalias nesses genes, teremos a diminuição da inibição do crescimento, que é uma marca da carcinogênese. As proteínas codificadas pelos genes supressores de tumor formam um sistema de checagem de todos os pontos do ciclo celular, evitando o crescimento descontrolado. Muitas delas, como as proteínas RB e p53, reconhecem sinais de estresse celular, principalmente o dano ao DNA, e respondem finalizando a multiplicação celular.
O RB é um gene regulador negativo fundamental do ciclo celular, na transição da fase G1 para S, atuando também no controle da diferenciação celular. Quando hipofosforilada, RB exerce um efeito antiproliferativo e, uma vez que haja sinalização de fatores de crescimento, RB é hiperfosforilada e inativada. Na maioria dos cânceres humanos, esse gene está diretamente ou indiretamente inativado. Um dos mecanismos que comprometem a funcionalidade da RB são mutações em um dos quatro genes que regulam sua fosforilação. Com isso, praticamente todas as células cancerígenas apresentam desregulação no ponto de checagem G1/S, proliferando-se indefinidamente.
O TP53 regula a progressão do ciclo celular, o reparo do DNA, a senescência celular e a apoptose. Com todas essas funções, não é difícil imaginar que mutações de perda de função nesse gene ocorram em praticamente todos os tipos de câncer, incluindo os carcinomas de pulmão, de cólon e mama, as três principais causas de morte por câncer. Realmente, o TP53 é o gene que mais sofre mutação em cânceres humanos e, na maioria dos casos, as mutações estão presentes em ambos os alelos. A proteína p53, codificada pelo gene TP53, faz parte de um sistema de sinais que detectam danos ao DNA, encurtamento de telômeros, hipóxia e o estresse causado pelo excesso de sinalização pró-crescimento.
Você lembra onde isso pode ocorrer?
Nas células que apresentam mutações em genes RAS, por exemplo!
Atenção
É importante lembrar que tumores sem mutação no TP53 e RB apresentam, em vez disso, mutações que afetam proteínas que regulam a função de RB e da p53. Com a perda de função da p53, por exemplo, o dano genômico segue sem reparo, mutações em proto-oncogenes e em outros genes se acumulam, e a célula vai trilhando um caminho perigoso, rumo à transformação maligna.
Alteração do metabolismo celular
Mesmo em um ambiente com doses suficientes de oxigênio, as células tumorais apresentam uma mudança no metabolismo celular, caracterizado por altos níveis de absorção de glicose e aumento da conversão de glicose para lactose, pela via glicolítica. Esse fenômeno, chamado de efeito Warburg é conhecido como glicólise aeróbica, permite a síntese de macromoléculas e organelas que são necessárias para o rápido crescimento celular.
Evasão da apoptose
A morte celular pela apoptose é uma resposta protetora a condições patológicas que poderiam contribuir para a malignidade se as células defeituosas permanecessem viáveis. Vários sinais, como danos ao DNA, desregulação de algumas oncoproteínas e a perda de aderência celular à membrana basal, podem desencadear a apoptose. Anomalias nas vias da apoptose (intrínseca ou extrínseca) estão presentes em células cancerígenas, sendo as lesões que desativam via intrínseca (mitocondrial) as mais comuns. Nesse caso, o mecanismo de neutralização da ação das proteínas anti-apoptóticas, como a BCL2, é um dos mais estabelecidos. Em mais de 85% dos linfomas de células B foliculares, o gene anti-apoptótico da BCL2 é superexpresso, devido a uma translocação genômica.
Potencial de replicação ilimitado (imortalidade)
Assim como as células-tronco, os tumores possuem capacidade irrestrita de proliferação. Além disso, todos os cânceres contêm células que são imortais.
Três fatores, conjuntamente relacionados, parecem ser fundamentais para a imortalidade das células cancerígenas. São eles:
A grande maioria das células normais podem se dividir de 60 a 70 vezes. Após esse limite, essas células entram em senescência, deixando o ciclo celular e nunca mais se dividindo.
O estado de senescência está associado à regulação positiva de supressores de tumor, como a p53, que mantém a RB em um estado hipofosforilado, que favorece a interrupção do ciclo celular. Como já comentamos, o ponto de checagem do ciclo celular G1/S, que é dependente de RB, é interrompido em quase todos os cânceres, por meio de várias aberrações genéticas e epigenéticas.
A resistência à senescência aumenta a capacidade replicativa, mas não torna a célula imortal. Essas células entram em uma fase chamada crise mitótica e morrem, num fenômeno que está associado ao encurtamento progressivo dos telômeros. A manutenção dos telômeros é vista em quase todos os tumores pela regulação positiva da telomerase. Alguns outros tumores ainda utilizam outro mecanismo dependente da recombinação de DNA, denominado alongamento alternativo de telômeros.
Como os cânceres são imortais e se proliferam indefinidamente, acredita-se que eles devam conter células que possuem capacidade de autorrenovação, as chamadas células-tronco do câncer. O número dessas células em tipos específicos de câncer, assim como sua identidade, ainda é motivo de debate, e os pesquisadores permanecem incertos se essas células são comuns ou raras nos tumores.
Manutenção da angiogênese
As células neoplásicas não são capazes de crescer sem um suprimento vascular; assim, a angiogênese tumoral deve ser induzida. A vascularização de tumores é essencial para o fornecimento de nutrientes e remoção de resíduos do catabolismo, sendo controlada pelo equilíbrio entre fatores angiogênicos e antiangiogênicos, produzidos pelas células estromais e tumorais. Em tumores angiogênicos, a balança pesa para o lado dos promotores da angiogênese. Além disso, outros fatores regulam a angiogênese, como a p53, que induz a síntese do inibidor da angiogênese trombospondina-1. Por outro lado, a sinalização de RAS, por exemplo, regula positivamente a expressão de VEGF, que é um fator pró-angiogênico.
Apesar disso, a vasculatura tumoral não é totalmente normal, apresentando um padrão aleatório de conexão, com vasos permeáveis e dilatados. O acesso dos tumores a esses vasos anormais é um dos fatores que contribui para a metástase. Dessa forma, a angiogênese é considerada um fator fundamental para a malignidade.
Invasão e metástase
A invasão local de um tumor, assim como a metástase, é um marco da malignidade, resultado de interações entre as células tumorais e o estroma tecidual normal. Alterações nas moléculas de adesão intercelular resultam na dissociação entre as células, sendo o primeiro passo do processo de invasão. O segundo passo é a degradação da membrana basal, assim como do tecido conjuntivo intersticial, seguido das alterações na ligação das células tumorais e as proteínas da matriz extracelular. A última etapa da invasão é a locomoção, que impulsiona as células neoplásicas através das membranas basais e da matriz degradada. Em relação à migração, alguns tumores apresentam tropismo por algum órgão, por conta da expressão de receptores de adesão ou quimiocinas, que possuem seus ligantes expressos nas células endoteliais do local metastático.
Evasão da resposta imune
O tumor, bem como os antígenos tumorais (produtos de proto-oncogenes mutados e proteínas superexpressas ou expressas de forma aberrante, por exemplo), pode ser reconhecido pelo sistema imunológico do indivíduo como “não próprio” e ser destruído. Existem diversas formas de evasão tumoral da resposta imune, como o crescimento seletivo de variantes antígeno-negativas, redução ou perda da expressão de antígenos de histocompatibilidade e imunossupressão, mediada pela expressão de certos fatores pelas células tumorais, como o TGF- β.
As células tumorais também podem adquirir diversos tipos de mutações oncogênicas, caracterizadas por mutações cromossômicas pontuais e outras anomalias cromossômicas não aleatórias, como translocações, deleções e amplificações de genes. Além das alterações cromossômicas, as alterações epigenéticas possuem um papel importante na malignidade das células cancerígenas. Essas alterações incluem o silenciamento dos genes supressores de tumor pela hipermetilação do DNA e as alterações globais na metilação e em histonas. A aquisição dessas alterações, tanto genéticas quanto epigenéticas, pode ser acelerada pela instabilidade genômica tumoral e pela inflamação promotora do câncer.
Instabilidade genômica tumoral
Anomalias genéticas que aumentam as taxas de mutação são muito comuns em cânceres, acelerando a aquisição de mutações necessárias para a transformação e posterior progressão do tumor.
Inflamação promotora do câncer
A infiltração de um câncer provoca uma reação inflamatória crônica, comparada a uma ferida que não cicatriza. Em pacientes com estágios avançados de câncer, a reação inflamatória é tão intensa que pode causar sinais e sintomas sistêmicos, como veremos a seguir.
Agentes carcinogênicos
Carcinogênese química
A carcinogênese é um processo de múltiplas etapas e, para compreender a carcinogênese química, é necessário que você conheça seus principais estágios: a exposição das células a uma dose suficiente de agentes carcinogênicos resulta no que chamamos de iniciação. As células iniciadas são células alteradas, potencialmente capazes de gerar um tumor. A iniciação, que ocorre de maneira rápida e irreversível, provoca um dano permanente ao DNA (mutações), mas, de maneira isolada, não é suficiente para a formação do câncer. Após a exposição ao agente iniciador, o surgimento de tumores pode ser induzido por um agente promotor, que estimula a proliferação das células mutadas.
Os agentes promotores não são por si só carcinogênicos, sendo que as alterações celulares causadas por eles não afetam o DNA diretamente e são reversíveis. Porém, a proliferação celular das células iniciadas pode levar a outras mutações adicionais, resultando no aparecimento de um clone canceroso.
Os agentes químicos carcinogênicos iniciadores possuem, em sua estrutura, grupos eletrófilos altamente reativos, que danificam diretamente o DNA, resultando em mutações e, eventualmente, em câncer.
Eletrófilos
Um receptor de par de elétrons, um reagente que procura elétrons.
As substâncias químicas que podem causar a iniciação da carcinogênese são classificadas em duas categorias:
Nesta categoria, as substâncias não precisam da conversão metabólica para se tornarem carcinogênicos, como os agentes alquilantes utilizados na quimioterapia.
Nesta categoria, as substâncias não são ativas até que sejam convertidas para um carcinógeno final.
Os hidrocarbonetos policíclicos, presentes em combustíveis fósseis, são os mais potentes carcinógenos químicos indiretos. Os promotores carcinogênicos químicos, como ésteres de forbol, hormônios, fenóis e drogas, não são mutagênicos, mas sua aplicação leva à proliferação e expansão clonal das células iniciadas.

Carcinogênese por radiação
A radiação na forma de raios ultravioleta (UV) da luz solar ou na forma de radiação ionizante possui efeito carcinogênico. Acredita-se que os raios UVB sejam os responsáveis pela indução dos cânceres de pele, como carcinoma de células escamosas, carcinoma basocelular e melanoma da pele. A carcinogênese provocada pela luz UVB ocorre através da promoção de formação de dímeros de pirimidina no DNA. Essas ligações resultam na distorção da hélice do DNA, impedindo o pareamento adequado com a fita complementar. Esses dímeros são normalmente reparados pela via de reparo de DNA; com a exposição solar excessiva, as fitas mutadas tornam-se frequentes e superam a capacidade de reparo, levando ao câncer em alguns casos.
Além disso, as radiações ionizantes eletromagnéticas (raios X e raios γ) e particuladas (partículas α e β, prótons e nêutrons) também são carcinogênicas. A exposição a essa radiação de forma médica, ocupacional, os acidentes em usinas nucleares e até mesmo a explosão da bomba atômica culminaram no aparecimento de vários cânceres. Essa radiação gera ruptura do cromossomo, translocações e, com menos frequência, mutações pontuais, resultando em danos genéticos e carcinogênese.
Qualquer tipo celular pode ser transformado em uma célula cancerígena se houver exposição suficiente à radiação!
Carcinogênese microbiana
Diferentes microrganismos são capazes de induzir alterações no DNA, como é o caso do HPV, produzir proteínas que interferem na transcrição dos genes, como o HTLV-1, produzir oncoproteínas com a inativação de genes supressores e induzir uma inflamação crônica imunologicamente mediada, com proliferação e dano genômico a longo prazo, como ocorre com os vírus das hepatites B e C e com a bactéria Helicobacter pylori.
Para conhecer mais como esses organismos provocam a carcinogênese, não deixe de visitar o Explore+.
Aspectos clínicos das neoplasias
O câncer é compreendido como um conjunto de diferentes doenças de variadas localizações que podem, mesmo quando em uma única localização, apresentar alterações fenotípicas e genotípicas nos tipos celulares envolvidos na formação do tumor.
A localização do tumor, seja ele benigno, seja maligno, é um fator crítico para os efeitos clínicos. A presença e o crescimento da massa neoplásica podem prejudicar tecidos vitais, fornecendo um local apropriado para o aparecimento de infecções. Além disso, o conhecimento da localização do tumor é fundamental para o manejo do paciente oncológico.
Tumores pancreáticos e alguns tipos de tumores neurológicos são de difícil intervenção cirúrgica e medicamentosa, além de alto grau de agressividade e invasividade. Outro exemplo são os tumores em glândulas endócrinas, como a hipófise, que podem levar a disfunções hormonais de graves consequências. A secreção crônica excessiva de insulina em adultos pode ser indicativa de tumor nas células beta pancreáticas, chamado de insulinoma. Apesar de raro, a grande maioria dos insulinomas é benigno, sendo os malignos geralmente deficientes na excreção da insulina, tamanha a diferenciação fenotípica das células tumorais.
No caso dos tumores hipofisários, principalmente os adenomas, as manifestações clínicas estão relacionadas ao tipo celular secretor específico que está transformado. Por exemplo, existem adenomas hipofisários lactotróficos (secretor de prolactina), gonadotróficos (secretor de hormônio luteinizante e hormônio folículo estimulante), somatotrófico (secretor de hormônio do crescimento), entre outros. Os adenomas podem ter como consequência a manifestação de alterações visuais, pela compressão do nervo óptico, ou alterações endócrinas, como a interrupção do ciclo menstrual, produção de leite fora do período de lactação (podendo acometer também homens), impotência e perda da libido.
Outro aspecto clínico que pode ser observado em pacientes com câncer é a perda progressiva da gordura e massa magra corporal, associada à fraqueza profunda, anorexia e anemia. Esse processo é denominado caquexia e está associado à perda uniforme de gordura e músculo magro, elevada taxa metabólica basal e a algumas evidências de inflamação sistêmica.
Embora os mecanismos responsáveis pelo desenvolvimento da caquexia no câncer não sejam ainda bem compreendidos, estudos indicam que a associação da doença com o sistema imune, a partir da liberação de mediadores, pode ter papel importante na perda de massa corporal.
Em alguns pacientes oncológicos, há o desenvolvimento de sinais e sintomas que não são prontamente explicados pela localização anatômica do tumor, ou pelos aspectos hormonais provenientes do tecido no qual o tumor surgiu. Essas manifestações são conhecidas como síndromes paraneoplásicas e antecedem e acompanham o progresso do câncer, desaparecendo com a cura e reaparecendo se houver recidiva. No caso das dermatoses paraneoplásicas, existem as dermatoses reveladoras de câncer interno, como acantose nigricante maligna, pênfigos, eritema gyratum repens, tromboflebite migratória, entre outras.
Embora existam diversos tipos de câncer de pulmão, o carcinoma broncogênico é o mais comum, tendo a sua origem quase sempre relacionada ao fumo crônico. O sintoma mais recorrente e precoce é a tosse, sendo observada em até 70% dos pacientes. Outras manifestações, como obstrução dos brônquios, diminuição da capacidade respiratória, sibilos e expectoração hemóptica (expectoração de sangue), podem aparecer, dependendo do estágio e da localização pulmonar do tumor. Em situações mais graves de invasão do tumor para outras áreas intratorácicas, isso pode resultar no acometimento da pleura e de estruturas do sistema nervoso central, como o plexo braquial.
Acantose nigricante maligna
Refere-se a um padrão de reação inespecífica caracterizada por hiperqueratose e hiperpigmentação da pele relacionadas a alguma neoplasia maligna interna.
Pênfigos
Doença autoimune caracterizada pelo aparecimento de bolhas dérmicas.
Eritema gyratum repens
Múltiplas placas eritematosas descamativas, podendo vir acompanhadas de intenso prurido.
Tromboflebite migratória
Trombose venosa superficial que ocasiona um processo inflamatório local.

A dor no paciente oncológico é fator agravante na diminuição da qualidade de vida, e sua incidência aumenta com a progressão da doença, podendo afetar até 70% dos pacientes, sendo 90% destes em estado avançado. Curiosamente, cerca de 20% dos pacientes relatam que a dor está associada à terapia, e não propriamente à doença. Em muitos casos, é necessária a administração simultânea de analgésicos para conter a dor, incluindo opioides, como a morfina.
Não menos importante, é preciso atentar para os cuidados psicológicos do paciente com câncer. Frequentemente, sintomas como perda ou diminuição do convívio social, da integridade física, estreitamento do círculo social, incapacidade de manter a rotina pré-diagnóstico e descrença religiosa são descritos nos pacientes neoplásicos. Hostilidade, ansiedade, culpa, depressão e psicose também são reações comuns.
Você deve ter percebido que as manifestações clínicas do câncer se baseiam, em muitos casos, na localização do tumor, seja ele restrito ao órgão de origem, seja quando já se estende a outros tecidos. A classificação de um câncer é baseada no grau de diferenciação das células neoplásicas, no número de mitoses e na sua arquitetura celular. Os critérios para cada classificação variam para os diferentes tipos de tumores, mas geralmente são compostos de duas (baixo e alto grau) a quatro categorias. Entretanto, essa tarefa não é nada fácil. No caso dos tumores de mama, por exemplo, existe grande heterogeneidade fenotípica, com tumores de graus, estágios e tipos histológicos diferentes.
Atualmente, é imprescindível a associação de dados histológicos, anatômicos, imunológicos e genéticos para compreender por completo determinado fenótipo tumoral.
Outro método importante utilizado para inferir a provável agressividade clínica de um tumor é o estadiamento. O estadiamento dos cânceres sólidos baseia-se no tamanho da lesão primária, no grau de disseminação para os linfonodos regionais e na presença ou ausência de metástases via hematológica. Hoje em dia, o principal sistema de estadiamento é do American Joint Committee.
Esse sistema usa uma classificação chamada de TNM, onde:
✔ T significa tumor primário
✔ N, envolvimento dos linfonodos regionais
✔ M, metástase
Essa classificação também varia para tipos diferentes de câncer.
A lesão primária (T) varia de T1 a T4, com aumento crescente. Caso seja uma lesão in situ, ela é identificada como T0. O N0 significaria ausência de envolvimento de linfonodos, enquanto N1 a N3 representam envolvimento crescente de linfonodos. M0 significa ausência de metástases, enquanto M1 ou M2 indicam a presença de metástases. A identificação do tumor dentro dessas escalas é necessária para que o prognóstico seja o mais assertivo possível e para auxiliar na escolha terapêutica mais eficaz para o paciente.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Conhecemos os princípios fundamentais do processo inflamatório e as principais etapas e características da inflamação aguda e da inflamação crônica.
Estudamos ainda os princípios gerais do reparo tecidual, fundamental para a sobrevivência do organismo; os mecanismos de regeneração e de formação da cicatriz; bem como os fatores que influenciam no reparo e anormalidades que podem estar envolvidas.
Por fim, vimos a nomenclatura, as diferenças entre as neoplasias benignas e malignas, as principais marcas fenotípicas dos tumores malignos, sua epidemiologia, os agentes carcinogênicos e também alguns aspectos clínicos das neoplasias.
Podcast
Antes de encerrar, a especialista Gabriela Caldas responderá a algumas perguntas sobre o tema.
CONQUISTAS
Você atingiu os seguintes objetivos:
Lorem ipsum dolor sit amet, consectetur adipiscing elit
Ut enim ad minim veniam, quis nostrud exercitation ullamco
Duis aute irure dolor in reprehenderit in voluptate velit esse


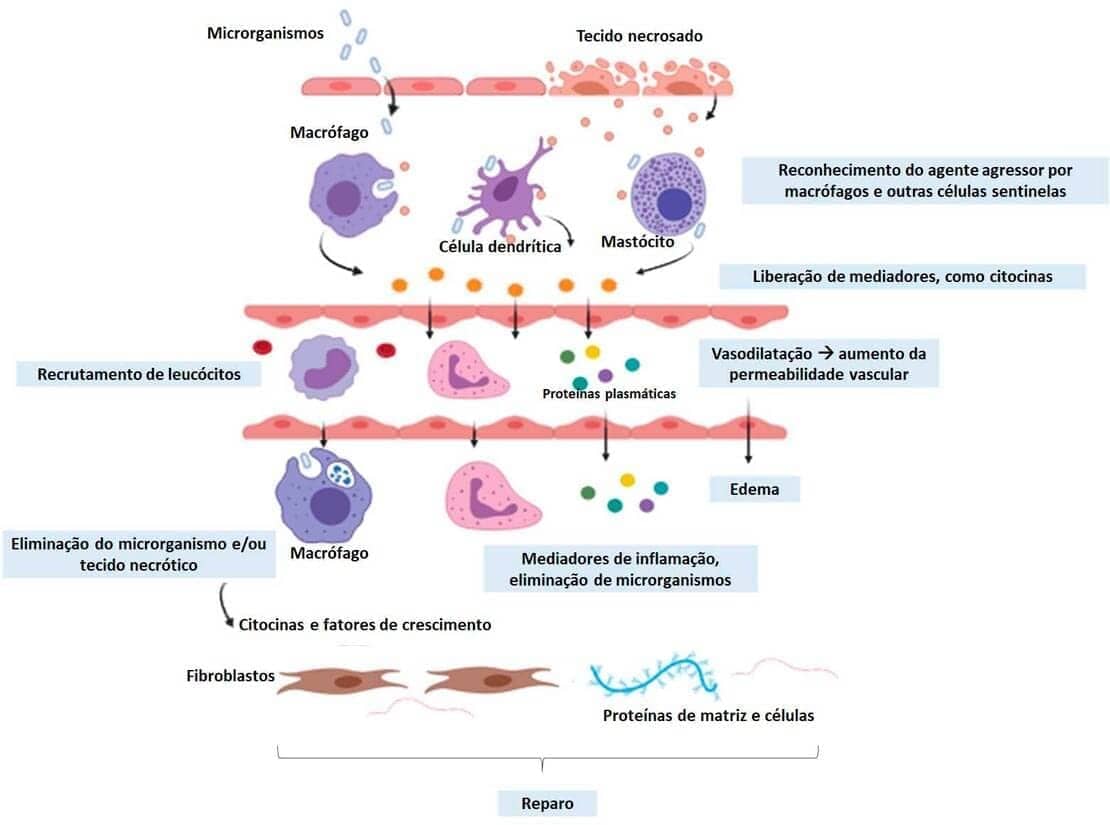
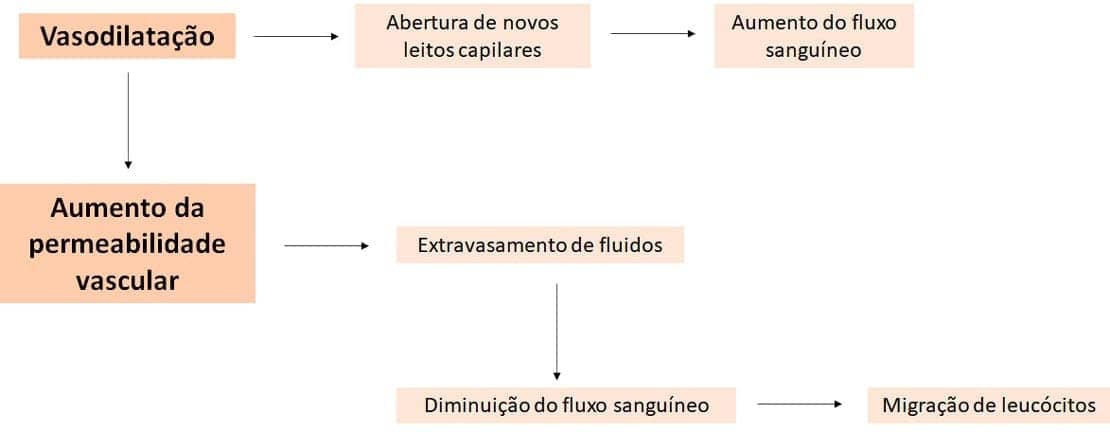
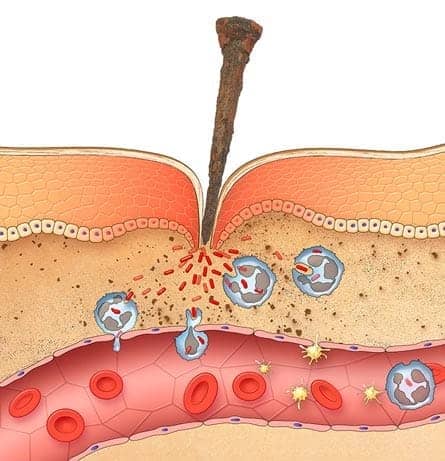
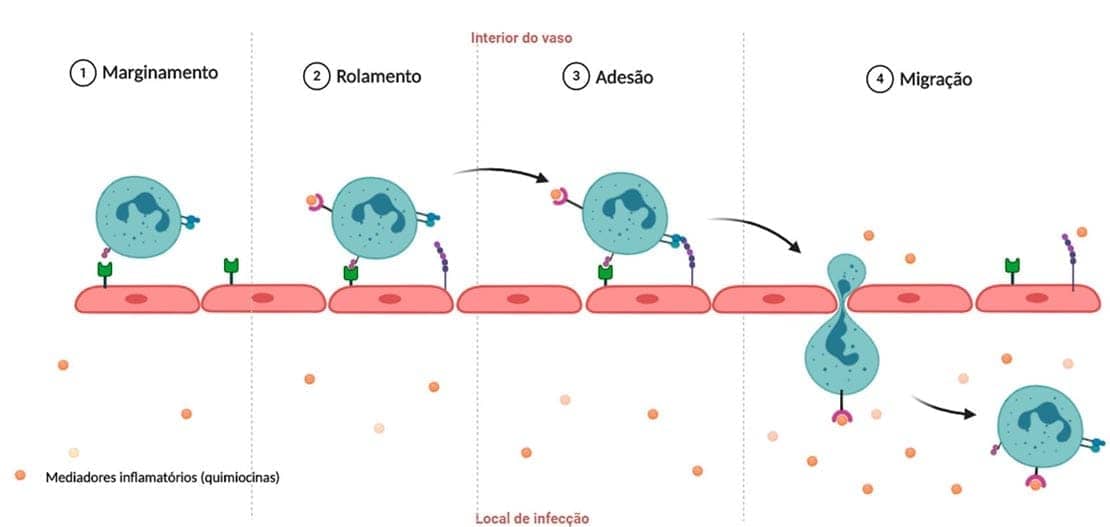
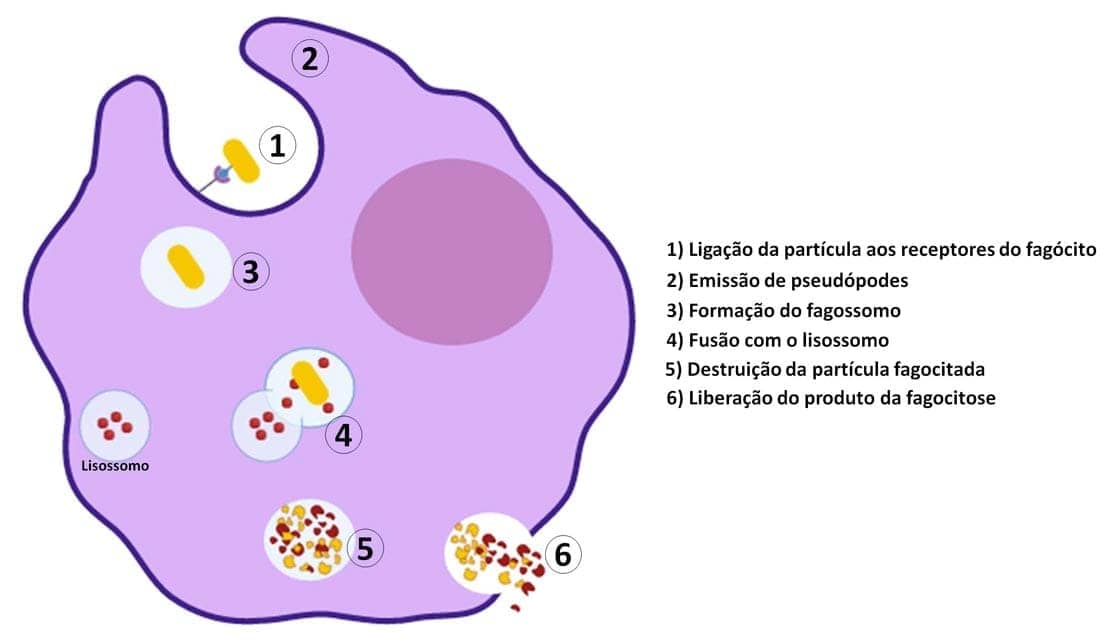
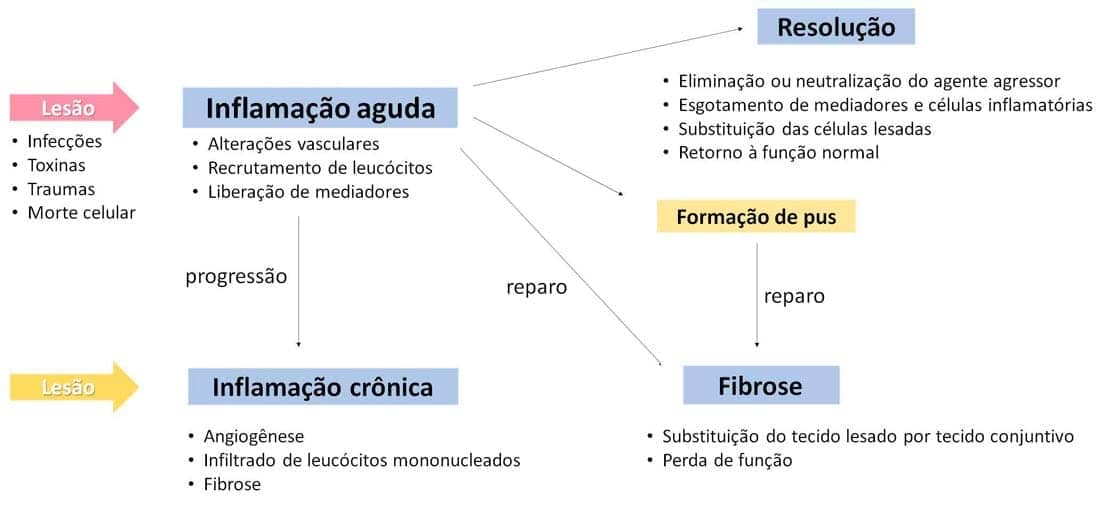
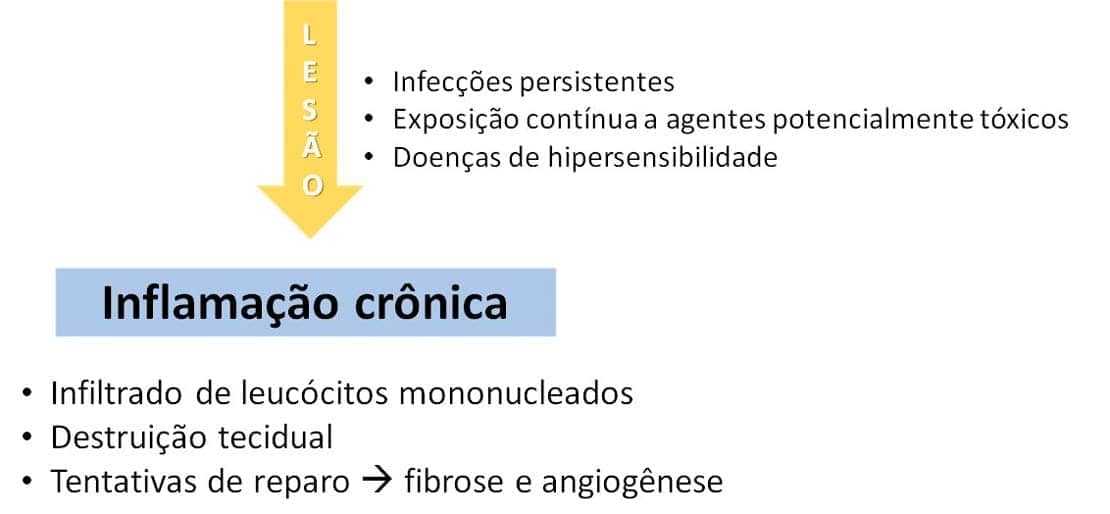
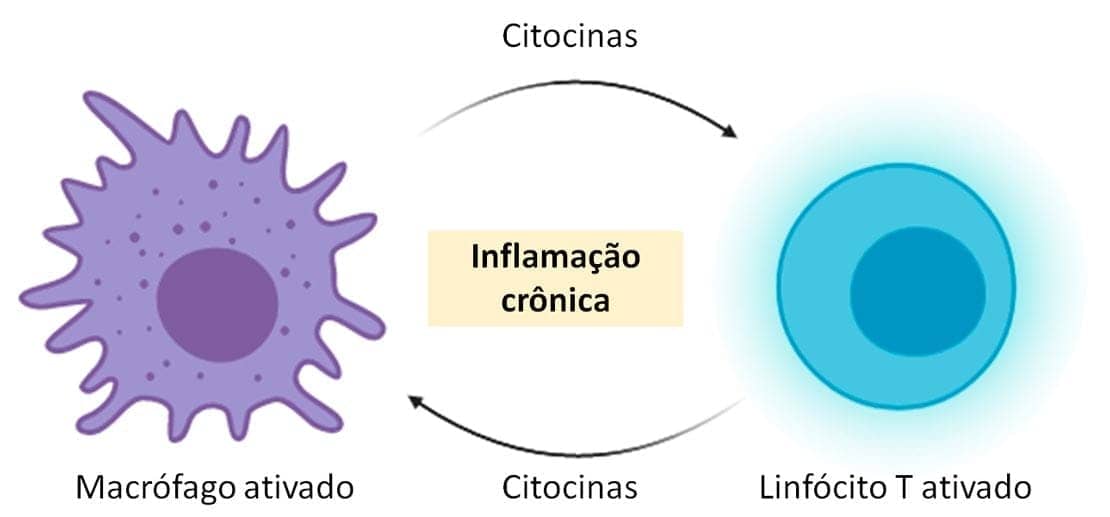
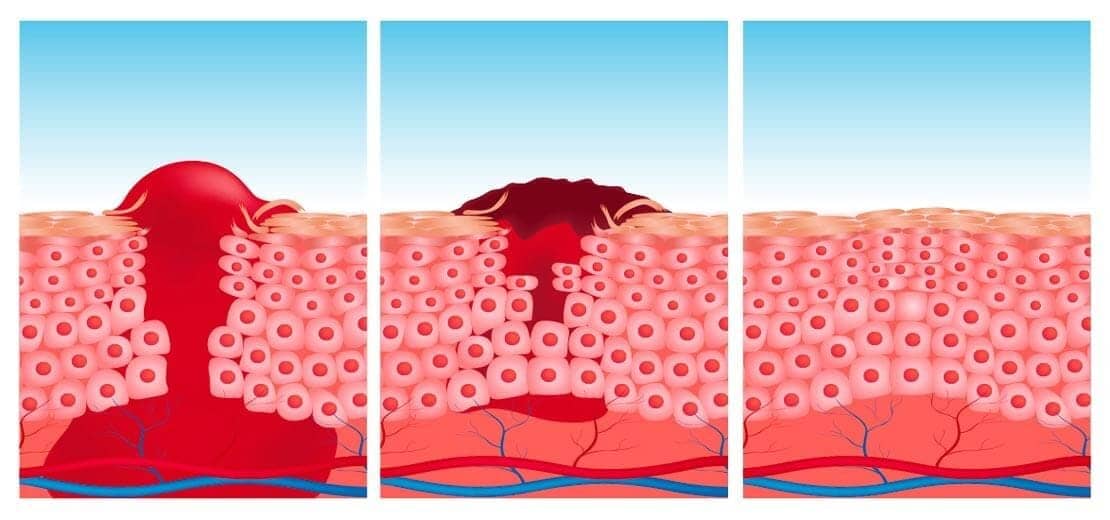
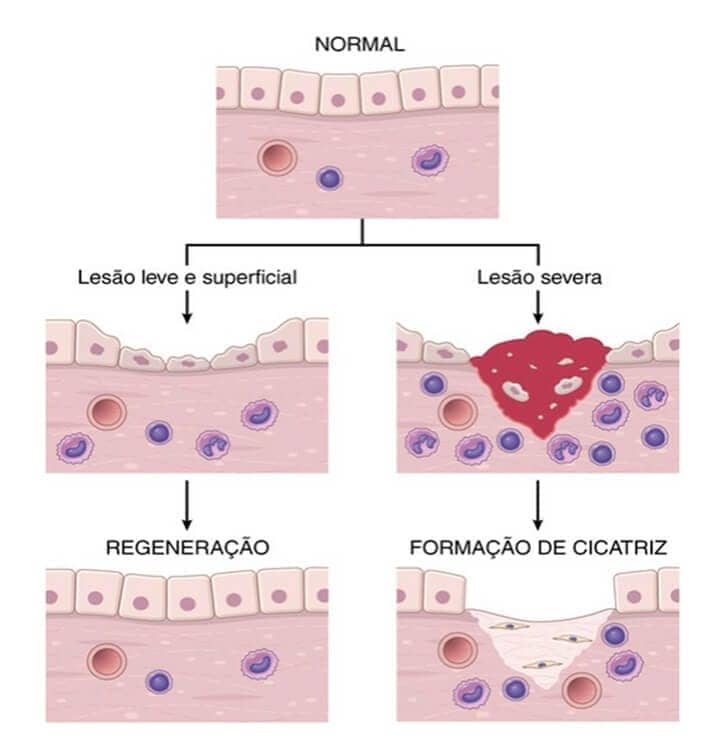
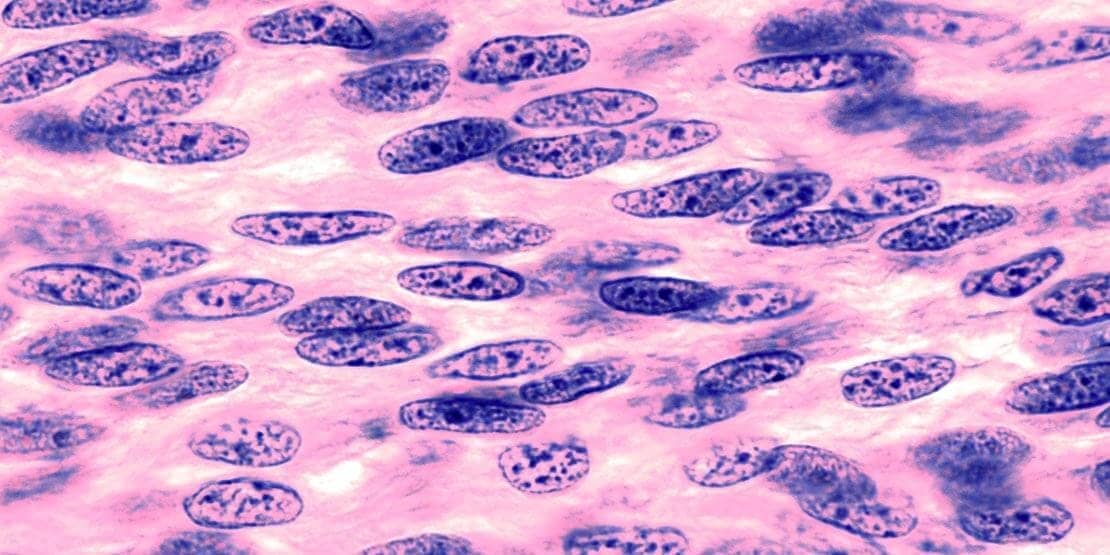
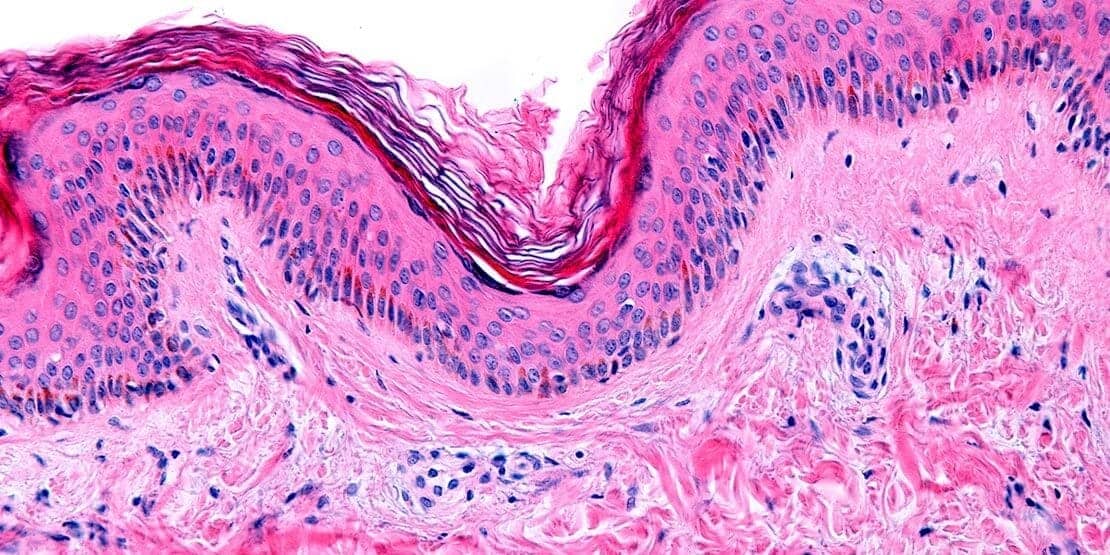
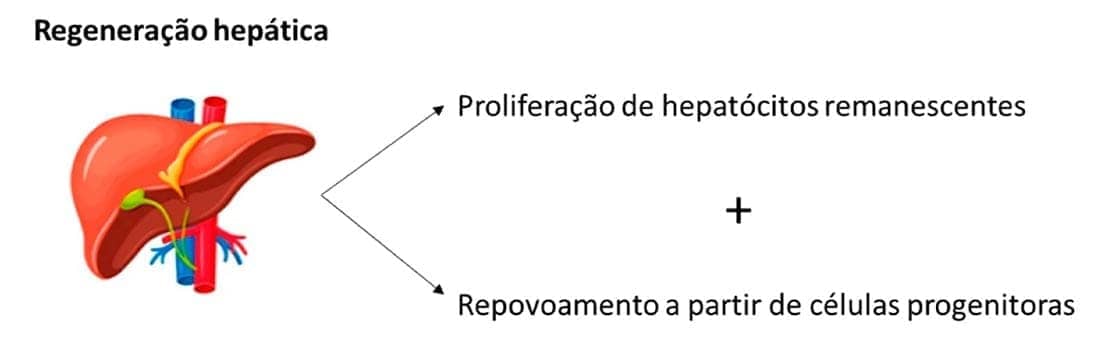
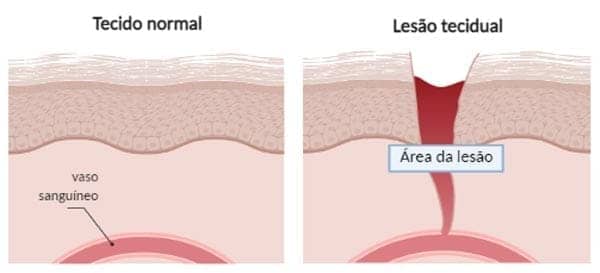
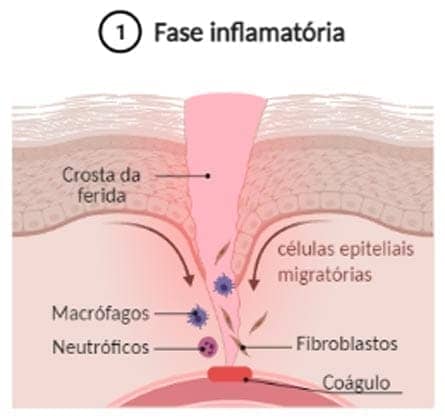
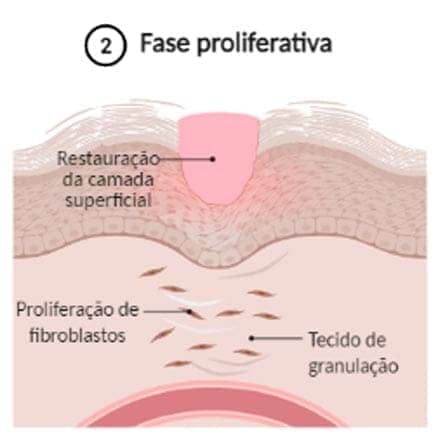
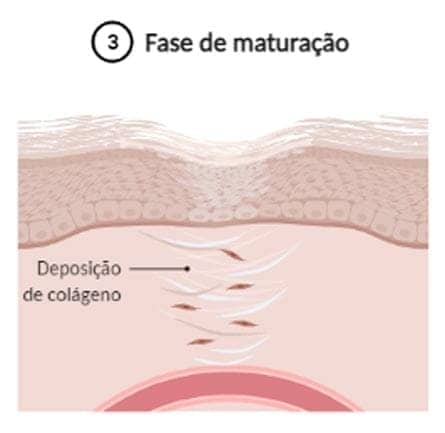
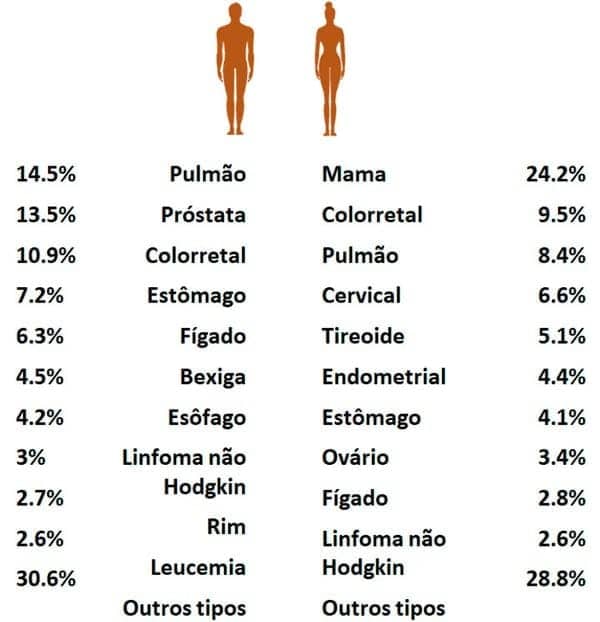

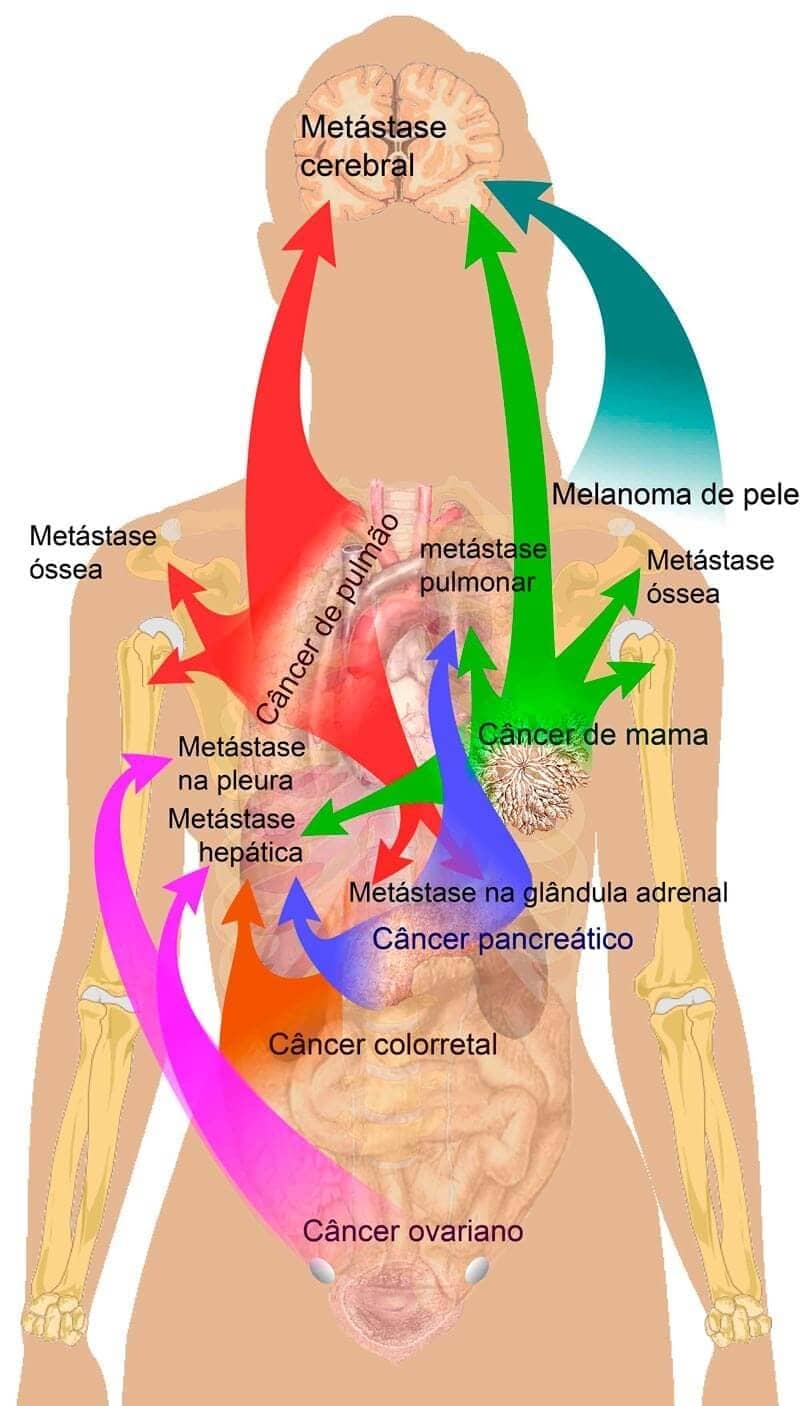
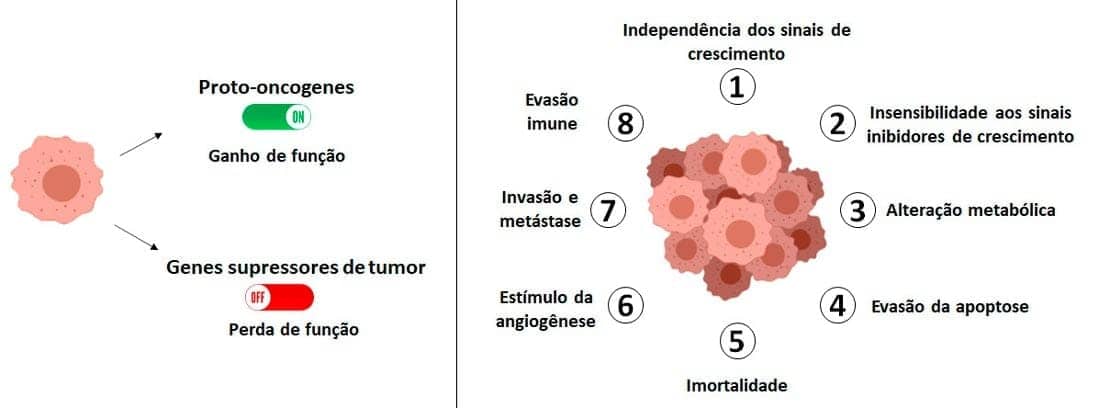
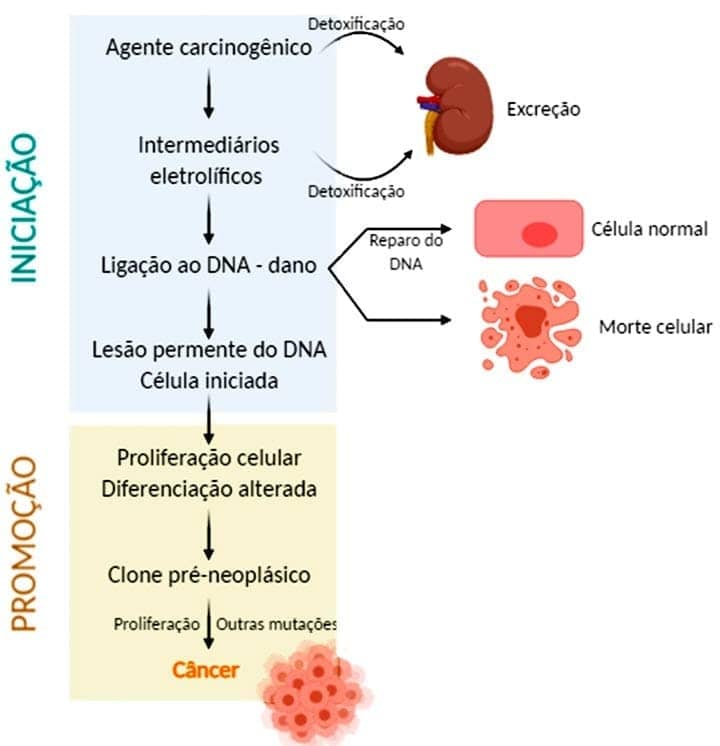


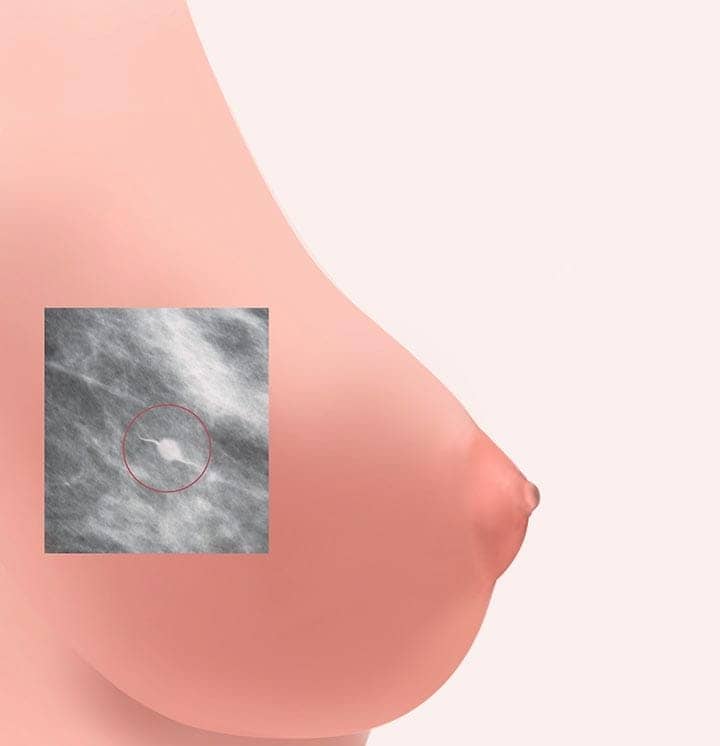
Esse termo é empregado para indicar a ocorrência da deposição excessiva de colágeno e outros componentes de matriz extracelular nos tecidos, normalmente em um processo patológico induzido por estímulos lesivos persistentes, como as infecções crônicas. Tipicamente associada à perda tecidual, a fibrose possui mecanismos idênticos aos da cicatrização da pele. Além disso, pode ser responsável pela disfunção e até insuficiência dos órgãos.