Descrição
O entendimento dos processos de combustão, da eletroquímica através de pilhas e do processo de eletrólise, bem como do mecanismo de corrosão.
PROPÓSITO
Compreender que, para muitos processos de engenharia, é essencial o entendimento da combustão, principalmente na geração de energia e no funcionamento da indústria de modo geral. Da mesma forma, é necessário entender a importância dos processos eletroquímicos na fração da indústria de manufatura metálica, bem como conhecer e evitar os processos corrosivos.
Preparação
Antes de iniciar o conteúdo deste tema, tenha em mãos papel, caneta e calculadora, ou use a calculadora de seu smartphone/computador.
OBJETIVOS
Módulo 1
Identificar os principais aspectos da combustão
Módulo 2
Reconhecer os princípios da eletroquímica
Módulo 3
Descrever os fundamentos da corrosão
Fala, mestre!
Fundamentos da combustão e corrosão
MÓDULO 1
Identificar os principais aspectos da combustão
Arrhenius
Químico sueco ganhador do prêmio Nobel de Química em 1903 devido à publicação da sua teoria eletrolítica da dissociação.
John F. Daniell
Físico e químico inventor da pilha de Daniell em 1836.
Fundamentos da combustão
Características gerais da combustão
Combustão é uma reação química de oxidação, com a conversão de energia química (oriunda das ligações que são quebradas) em energia térmica, autossustentável, ocorrendo liberação de luz, calor e gases.
A combustão, por se tratar de uma oxidação, irá sempre apresentar como um dos reagentes o gás oxigênio. Veja alguns exemplos para o etanol e o alumínio:
Usualmente, a combustão apresenta três componentes.
Combustível
O primeiro deles é o combustível, que é o material que será oxidado. Nos casos anteriores, o etanol e o alumínio são os combustíveis de suas respectivas reações. Geralmente compostos de carbono atuam como combustível, tais como hidrocarbonetos (compostos de carbono e hidrogênio somente) e demais compostos orgânicos oxigenados ou nitrogenados. Do ponto de vista tecnológico, combustível é todo o material capaz de gerar energia, por combustão, de forma econômica, podendo ser sólido, líquido ou gasoso.
Comburente ou oxidante
O comburente ou oxidante é o responsável pela oxidação do combustível. Embora o processo de combustão seja uma oxidação, pode haver outros comburentes que oxidem o combustível, como, por exemplo, o flúor.
Energia
A energia envolvida no processo é o componente que sustenta a queima. Esses três componentes formam o que é conhecido como triângulo do fogo.
Nos exemplos de reações de combustão mostrados, pudemos reparar que um dos combustíveis é um metal. Isso é perfeitamente possível, desde que o metal obedeça a alguns quesitos práticos, tais como:
Estar livre de recobrimentos.
Por exemplo, vernizes, tintas, óxidos, enfim, a superfície que é oferecida para reagir com o comburente deve ser do metal puro.
Estar pulverizado.
Ou seja, com a maior área de superfície reacional possível.
Modal
Voluptate consequat amet nostrud ullamco. Ut consectetur deserunt ea Lorem deserunt in aliqua nulla. Ullamco ut sint aliqua id eiusmod ipsum ex pariatur amet nulla. Do sit excepteur fugiat deserunt do occaecat ullamco.
Fonte:fonte.com.brTodavia a utilização de metais como combustíveis é muito útil para aproveitamento do calor gerado, que, em alguns casos, é muito alto (da ordem de milhares de graus). Isso significa que não ocorre liberação de nenhum tipo de gás, o que, em algumas aplicações, pode ser muito útil.
Uma obtenção clássica de gases numa combustão é conseguida, principalmente, quando se utiliza combustíveis à base de carbono. Nesse caso, em uma reação de combustão completa, os produtos formados sempre serão e
Mas o que queremos dizer com uma reação de combustão completa?
Vamos retomar o exemplo da queima do etanol:
Repare que para se queimar 1 mol de etanol são necessários 3 mols (o triplo!) de gás oxigênio. Agora observe a equação de queima do propanol, o álcool com 1 carbono a mais na sua cadeia que o etanol:
Saiba mais
Nesse caso, já serão necessários 5 mols de para queimar esse álcool. Ou seja, quanto maior a massa do combustível a ser queimada, maior quantidade de comburente () é requerida.
Se tivermos quantidade de oxigênio suficiente como requer a reação de combustão, dizemos que a queima é completa e realmente se cumpre o que dissemos, e os produtos serão sempre e . Mas nem sempre o fornecimento de oxigênio ou as condições do material combustível permitem o acesso da quantidade necessária do oxigênio para a queima. Nessa situação, os produtos da combustão serão monóxido de carbono e carbono elementar (). Temos, então, uma combustão incompleta. Isso é o que acontece quando observamos grande quantidade de fuligem sendo produzida na queima.
Combustíveis
Uma especial atenção deve ser dada aos combustíveis, uma vez que são a fonte de energia que se deseja obter de uma combustão. Os combustíveis podem ser divididos, num sentido mais amplo, como: sólidos, líquidos e gasosos. A tabela a seguir exemplifica alguns desses combustíveis e os classifica em naturais e artificiais.
Veja alguns exemplos de combustíveis de origem primária e secundária:
| Combustíveis | Naturais (primários) | Processados (secundários) | |
|---|---|---|---|
| Sólidos | Carvão mineral | Carvão vegetal | |
| Líquidos | Petróleo |
|
|
| Gasosos | Gás natural |
|
Combustíveis sólidos
Abordaremos, nos combustíveis sólidos, a classe mais representativa deles: o carvão. Inicialmente, veremos o carvão mineral, que é uma complexa e variada mistura de componentes orgânicos sólidos, ou seja, compostos à base de carbono notadamente, fossilizados ao longo de muitos anos (como ocorre também com o petróleo, outro combustível fóssil). Sua qualidade, determinada pelo conteúdo de carbono, varia de acordo com o tipo e o estágio de formação dos componentes orgânicos.
Saiba mais
O carvão betuminoso (hulha), mais utilizado como combustível, contém cerca de 75% a 85% de carbono, e o mais puro dos carvões, o antracito, apresenta um conteúdo carbonífero superior a 90%. Podemos notar, portanto, que o carbono se apresenta como uma das mais importantes fontes de combustível que conhecemos. Por isso, estaremos sempre falando dele nesse aspecto.
O carvão mineral é o mais abundante dos combustíveis fósseis no mundo. No Brasil, as principais reservas de carvão mineral estão localizadas no Sul do país, notadamente no estado do Rio Grande do Sul, que detém mais de 90% das reservas nacionais. No final do século passado, as reservas nacionais de carvão eram da ordem de 32 bilhões de toneladas, o que corresponde a cerca de 50% das reservas sul-americanas e a 1,2% das reservas mundiais.
No Brasil, o uso energético do carvão mineral na geração de eletricidade ainda é bastante restrito, representando apenas 1% da matriz energética nacional, em virtude do grande potencial hidráulico do país e das características físicas e geográficas das reservas. Entre outras restrições, os altos teores de impurezas, como o carbono elementar e enxofre (da ordem de 50% e 2,5%, respectivamente), são os principais responsáveis pelo baixo índice de aproveitamento do carvão no Brasil.
Por que estamos falando de tantos dados técnicos do carvão mineral?
Resposta
É porque ele representa a maior fonte de combustível sólido para geração de energia e fonte de calor no ramo industrial do país. Ele é amplamente utilizado na siderurgia para a obtenção do aço, por exemplo.
Por sua composição química e fonte de calor abundante, é utilizado em alto fornos nas siderúrgicas para a redução (veremos mais à frente o que significa esse termo) do minério de ferro.
Ele também encontra muita utilização em fornos industriais e para geração de energia em usinas termoelétricas.
Por outro lado, o carvão artificial talvez seja um dos combustíveis sólidos mais conhecidos da população em geral. Ele é resultante da combustão incompleta de materiais orgânicos. O carvão vegetal (aquele que utilizamos quando vamos fazer churrasco, por exemplo) é obtido pela combustão incompleta da madeira. Esta é inflamada e, então, a operação é interrompida, para se evitar que a madeira se transforme em cinzas.
Cálculo do poder calorífico
O poder de queima de um combustível e, por sua vez, sua eficácia são determinados pelo cálculo do poder calorífico, que veremos a seguir:
Em que , , e são, respectivamente: carbono, hidrogênio, oxigênio e enxofre, na análise elementar do combustível sólido.
Em que , e são, respectivamente: carbono fixo, matéria volátil e fator, que varia com o coeficiente relacionado com o % de matéria volátil, quando expresso para combustível seco e livre de cinzas.
Combustíveis líquidos
Podemos dividir os combustíveis líquidos em não renováveis (derivados do petróleo) e renováveis (álcoois).
Combustíveis líquidos não renováveis
Iniciando pelos não renováveis, na atualidade podemos dizer que o petróleo é considerado uma das principais matérias-primas, capaz de transformar as relações econômicas do mundo, dando impulso à industrialização e ao progresso tecnológico, diminuindo distâncias e aumentando o conforto das pessoas. Dele se produz gasolina, combustível de aviação, gás de cozinha, lubrificantes, borrachas, plásticos, tecidos sintéticos, tintas e até mesmo energia elétrica.
A alta proporção de carbono e hidrogênio existente no petróleo mostra que os hidrocarbonetos são seus principais constituintes, podendo chegar a mais de 90% de sua composição.
Os hidrocarbonetos presentes no petróleo são de três classes diferentes:
Parafínicos (cadeias retilíneas com ligações simples)
Naftênicos (cadeias fechadas com ligações simples)
Aromáticos
Tais hidrocarbonetos estão presentes desde compostos com um átomo de carbono até compostos com 60 ou mais átomos de carbono. Os petróleos brasileiros têm sido, predominantemente, de base parafínica.
Quanto ao aspecto, há petróleos pesados e viscosos e outros leves e voláteis, segundo o número de átomos de carbono existentes em sua composição. Os petróleos mais leves dão maior quantidade de gasolina e GLP, que são produtos leves. Já os petróleos pesados resultam em maiores volumes de óleos combustíveis e asfaltos. No meio da linha estão os derivados médios, como o óleo diesel e o querosene.
Mas como se obtêm os produtos que são conhecidos como derivados de petróleo?
Resposta
Uma vez que o petróleo é uma mistura de componentes, a nossa tarefa é separá-los e isso, normalmente, é chamado de refino do petróleo
Processo de refino do petróleo
A tarefa inicial no processo de refino consiste em conhecer, por meio de análises de laboratório, a composição do petróleo a ser processado, pois são variáveis a constituição e o aspecto do petróleo bruto, segundo a formação geológica do terreno onde é extraído. Algumas propriedades físicas gerais são utilizadas para identificação dos petróleos, como densidade e viscosidade. O refino do petróleo, portanto, constitui-se na série de beneficiamentos pelos quais passa o mineral bruto, para obtenção de vários produtos.
Refinar petróleo é, então, separar as frações desejadas, processá-las e industrializá-las em produtos vendáveis.
1
Nas refinarias, o petróleo é submetido a diversos processos pelos quais se obtém grande diversidade de derivados: gás liquefeito de petróleo (GLP) ou gás de cozinha, gasolina, óleo diesel, querosenes de aviação e de iluminação, óleo combustível, asfalto, lubrificantes, solventes etc.
Processa-se o petróleo com a finalidade de se obter a separação dos seus diversos componentes. Este processo é o que se chama de destilação fracionada. É executada com o auxílio de uma torre de fracionamento, uma coluna de aço inoxidável cheia de “obstáculos” em seu interior.
2
3
O petróleo aquecido é introduzido próximo à base da coluna. Moléculas maiores (de hidrocarbonetos de maior ponto de ebulição) não alcançam o topo, acumulando-se nos diversos níveis da coluna, em estágios de equilíbrio. Já as moléculas menores (hidrocarbonetos com baixo ponto de ebulição) conseguem vencer esses obstáculos e chegar ao topo da coluna.
Veja alguns produtos obtidos a partir da separação do petróleo:
| Fração | Moléculas com | Temperatura de ebulição (°C) | Usos |
|---|---|---|---|
| Gás de petróleo | 1 a 4 C | Até 20 | Combustível e matéria-prima para a obtenção de plásticos, detergentes etc. |
| Gasolina | 4 a 12 C | 40 – 200 | Combustível para motores a explosão. |
| Querosene | 11 a 18 C | 170 – 320 | Combustível para jatos e óleo para iluminação. |
| Óleo diesel | 13 a 17 C | Acima de 270 | Combustíveis para veículos pesados. |
| Óleos lubrificantes | 16 a 20 C | Ao redor de 350 | Óleos para lubrificação e para motores. |
| Graxas | Mais de 18 C | Sólidos | Graxas, vaselina. |
| Asfalto (piche) | Mais de 35 C | Resíduos | Parafinas, asfalto para pavimentação. |
O petróleo como fonte de energia elétrica
Além da importância absoluta no setor de transportes, o petróleo ainda é o principal responsável pela geração de energia elétrica em diversos países do mundo. Apesar da expansão recente da energia hídrica e da diversificação das fontes de geração de energia elétrica, o petróleo ainda é responsável por aproximadamente 10% de toda a eletricidade gerada no mundo.
A geração de energia elétrica a partir de derivados de petróleo ocorre por meio da queima desses combustíveis em caldeiras, turbinas e motores de combustão interna (automóveis, principalmente).
Saiba mais
No caso do Brasil, onde historicamente a geração de energia elétrica é predominantemente hídrica (mais de 90% atualmente), a geração térmica, particularmente com derivados de petróleo, é pouco expressiva no âmbito nacional. Contudo, tem desempenhado um papel importante no atendimento da demanda de pico do sistema elétrico e, principalmente, no suprimento de energia elétrica a municípios e comunidades não atendidos pelo sistema interligado.
Octanagem
Já ouviu esse termo em comerciais de TV ou em postos de combustíveis? Octanagem é a medida da capacidade da gasolina de resistir à iniciação de sua combustão, dada pelo percentual de octanos presentes na mistura, ou seja, quanto mais octanos, melhor o rendimento.
Gasolina
Sem dúvida, o produto do refino de petróleo mais destacado é a gasolina. Ela é utilizada em máquinas de combustão interna de ignição por centelha. A combustão gera energia, que está contida nos gases resultantes a alta temperatura e pressão. Essa energia é transferida pela expansão dos gases no interior do cilindro, produzindo o trabalho necessário ao movimento dos veículos, como, por exemplo, automóveis, embarcações aquáticas, motos etc.
Ela é uma mistura constituída predominantemente de hidrocarbonetos com sete e oito átomos de carbonos (denominados heptanos e octanos). Para indicar a maior ou menor eficiência de uma gasolina, utiliza-se o índice de octanagem.
Querosene de aviação
Outras frações importantes de uso industrial e comercial incluem o querosene de aviação, que é constituído de hidrocarbonetos de 6 e 16 átomos de carbono e é adequado, como o nome já indica, à geração de energia por combustão em motores de aeronaves. Deve ter como requisitos: permanecer líquido e homogêneo até a zona de combustão dos motores das aeronaves; ter poder calorífico o mais elevado possível; apresentar resistência física e química às variações de temperatura e pressão; e ter boas características lubrificantes.
Óleo diesel
Amplamente conhecido e também de grande importância é o óleo diesel, uma mistura constituída predominantemente de hidrocarbonetos com 13 C a 17 C. As atuais aplicações de óleo diesel são bastante amplas: podem ser usadas para movimentar automóveis, ônibus, caminhões, tratores e unidades geradoras de energia.
Combustíveis líquidos renováveis
Etanol
Fechando a lista dos combustíveis líquidos, analisaremos um combustível renovável muito utilizado no Brasil, embora não seja tão usado no resto do mundo: o etanol (álcool etílico).
| Fórmula molecular | Fórmula estrutura plana |
|---|---|
|
|
O etanol talvez seja o mais antigo produto químico produzido pelo homem. Nessa produção inicial, ele partia de determinadas matérias-primas e as fermentava, com o objetivo de produzir bebidas alcoólicas.
Na atualidade, o etanol é produzido por dois processos distintos: pela via química (síntese) e pela fermentação (microbiológico).
Na via química, o processo é ilustrado a seguir:
(acetileno) (etanol)
Na fermentação, talvez o método mais consagrado, podem ser utilizadas como matérias-primas substâncias açucaradas, substâncias ricas em amido ou substâncias celulósicas.
Saiba mais
Com relação às substâncias açucaradas, a fermentação conduz à formação do etanol a partir da sacarose.
Assim, partindo do caldo da cana-de-açúcar, inocula-se o micro-organismo Saccharomyces cereviseae e este, na presença da sacarose, produz uma enzima que catalisa a transformação do açúcar em álcool etílico. Essa reação é bastante exotérmica (libera calor) e libera gás carbônico, o que dá ao sistema um aspecto de “fervura”.
Etanol hidratado
O conhecido etanol hidratado é uma mistura álcool-água em diferentes graduações.
Atende às várias aplicações industriais, tais como a fabricação de bebidas. É usado como combustível para veículos movidos exclusivamente a álcool (de 12 a 14% de água).
Etanol anidrido
Existe, também, o etanol anidro, que é o etanol isento de água.
Sua importância é verificada no seu emprego em indústrias químicas, que necessitam de álcool com alto grau de pureza para as suas reações. Outro emprego importante é como combustível e aditivo antidetonante para ser adicionado à gasolina (caso haja água, ela não se mistura homogeneamente com a gasolina).
Em termos de combustível, é disponibilizado o etanol aditivado que, a exemplo da gasolina aditivada, não implica maior potência do motor, pois normalmente as substâncias empregadas só têm caráter detergente e anticorrosivo.
O Brasil é pioneiro e o país que mais amplamente utiliza o álcool como combustível. Isso se deve, em parte, às vantagens apresentadas por esse combustível líquido. Ele polui menos o ambiente, uma vez que sua queima gera como produtos somente gás carbônico e água. É de fácil obtenção, é uma energia de fonte renovável e é um produto unicamente dependente da produção nacional, o que diminui a dependência da instável indústria petrolífera internacional, sendo, portanto, um combustível altamente estratégico!
Além disso, industrialmente, o etanol tem uma importância considerável. É empregado na fabricação de bebidas, como solvente de tintas e vernizes, na fabricação de corantes, na preparação de extratos, perfumes e cosméticos. Encontra ampla aplicação como desidratante, como conservante de produtos sujeitos à deterioração e na fabricação de polímeros.
Combustíveis gasosos
Gás natural
Iniciaremos nossa discussão dos combustíveis gasosos por aquele que é, basicamente, a fonte deles: o gás natural.
É um combustível de origem fóssil, decorrente da decomposição da matéria orgânica fossilizada, encontrado acumulado em rochas porosas no subsolo, frequentemente acompanhado por petróleo, constituindo um reservatório.
Na verdade, entende-se que o gás natural é um produto formado junto com o petróleo, ou mesmo uma fração dele, muito leve, que se desprende da massa pastosa e se acumula nesses bolsões citados. Se o petróleo se encontra em um berço de rochas maciças, o gás natural é encontrado associado a ele; porém, se o óleo bruto está numa região de porosidade rochosa, esse gás pode migrar, difundindo-se por esses microtúneis, e se alojar em outra região impermeável a ele.
Em seu estado bruto ou natural, o gás natural é composto principalmente por metano (), aproximadamente 90%, com proporções variadas de etano (), propano (), butano (), hidrocarbonetos mais pesados e também , , , água, ácido clorídrico, metanol e outras impurezas.
Uma porção importante do gás natural, muito utilizada como combustível, inclusive em veículos, é o metano (). Ele é a base do GNV (Gás Natural Veicular), constituindo cerca de 90% dessa composição.
Obtenção comercial do metano
A obtenção comercial do metano pode ser natural nos poços de gás natural e de petróleo, nas emanações vulcânicas, nas minas de carvão, nos pântanos ou nos lixões. Ou pode ser artificial, pelo processo biológico (biogás) e processo sintético.
Processo biológico
No processo biológico, o metano é obtido através da decomposição anaeróbica (sem oxigênio), tendo como matérias-primas as substâncias de origem orgânica (biomassa) em biodigestores. Cada metro cúbico de biogás contém entre 50% e 55% de gás metano puro, que pode ser comparado aos combustíveis mais conhecidos pela relação a seguir:
de biogás (não purificado) equivale a:
| 0,613L de gasolina | 1,536Kg de lenha |
| 0,553L de óleo diesel | 0,790L de álcool hidratado |
| 0,454L de gás de cozinha | 1,428KW de eletricidade |
Processo sintético
O processo sintético de obtenção do metano se dá pela gaseificação do carvão − as matérias-primas básicas são o carvão pulverizado, o vapor de água e o oxigênio. O aquecimento do carvão em ambiente úmido leva à formação de uma mistura de CO, CO2 e H2O que, com a ação do hidrogênio, forma o metano.
Acetileno
Outro gás combustível industrial importante de ser citado é o acetileno. Esse é o componente mais simples da família dos alcinos (hidrocarbonetos com ligação tripla), e o seu nome oficial é etino.
O acetileno pode ser preparado pela reação da água com o carbureto de cálcio ():
Saiba mais
Um método que vem substituindo gradativamente o do carbureto de cálcio é conhecido como pirólise de hidrocarboneto. Ele se fundamenta em um aquecimento enérgico (cerca de 1500°C) dos hidrocarbonetos, os quais sofrem uma desidrogenação e um rearranjo dos seus átomos, com formação do acetileno.
Ele é um gás inodoro e incolor, mas, na prática, apresenta odor desagradável devido às impurezas, dentre elas compostos de enxofre. Queima com chama brilhante e grande liberação de calor. É altamente inflamável, chegando a ser explosivo, o que o faz ser aplicado como combustível industrial.
Também entra como insumo para a produção de PVC, borrachas sintéticas e solventes. Uma aplicação muito importante para o acetileno é no chamado maçarico oxi-acetilênico. Ele é empregado com o oxigênio na obtenção de elevadas temperaturas (até 3.500°C) nos processos de soldagem.
Poder energético de um combustível
Não se pode abordar o assunto combustíveis sem mencionar a energia envolvida em suas reações características. Inicialmente, falaremos do poder calorífico dos materiais combustíveis (ou calor de combustão). Ele é definido como sendo a quantidade de energia interna contida no material combustível.
Esse parâmetro é o mais importante para se determinar a eficiência macroscópica de um combustível, em termos da capacidade de geração de energia útil, que pode ser expresso tomando-se por base uma massa unitária (kg) ou um volume unitário (m³). Quanto mais alto for o poder calorífico, maior será a energia contida.
Atenção
No Brasil, costuma-se exprimir o poder calorífico de um gás em kcal/Nm³, kcal/m³ ou kcal/kg, embora o correto seja utilizar unidades do sistema internacional (kJ/m³).[
Para os combustíveis sólidos, o poder calorífico (Q’) corresponde à quantidade de calor liberada (Q) pelo combustível, na combustão, dividida pela massa do combustível (m). Assim, o poder calorífico é o calor produzido por unidade de massa do combustível:
Existem dois tipos de poder calorífico:
Poder calorífico inferior (PCI):
é a quantidade de calor liberada pela combustão completa de 1kg de combustível, admitindo-se que o vapor de água não se encontra condensado. Os produtos finais da combustão são e .
O PCS é sempre maior que o PCI, pois engloba o calor desprendido na condensação da em , conforme a tabela a seguir, que apresenta valores para alguns gases combustíveis. Conhecendo-se a composição de um combustível é fácil calcular o seu PCS e o seu PCI, a partir dos calores molares de combustão dos respectivos componentes que abordaremos a seguir.
Uma vez conhecido o calor molar de combustão, é possível avaliar o poder energético de combustíveis em termos moleculares na estequiometria das reações de combustão. O calor molar de combustão pode ser calculado a partir do calor molar de formação dos reagentes e produtos envolvidos. Vejamos o exemplo da combustão do etanol:
Lembrando que H é a chamada entalpia, ou, nesse caso, o calor contido numa substância (entalpia de formação,) ou envolvido num processo ( da reação). Assim, para se calcular o calor total liberado numa combustão, basta fazer o calor total contido nos produtos () menos o calor total que estava contido nos reagentes (), como ressalta a equação destacada.
Vamos aos cálculos:
O fornece energia liberada na queima de 1 mol do combustível. Para avaliar seu poder calorífico é necessário converter a unidade para kcal/kg, por exemplo: = 7100kcal/kg. Note que a reação utilizada anteriormente envolve a combustão completa (formação de ) do combustível.
Dentro dos motores ocorre, além da combustão completa, também a incompleta, com formação de . Motores desregulados favorecem também a formação de carbono ( ), que sai do escapamento na forma de fuligem.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Reconhecer os princípios da eletroquímica
Eletroquímica
Depois de falarmos de oxidação acompanhada de liberação de calor, estudaremos oxidações que não envolvem necessariamente o desenvolvimento de calor na sua ocorrência: os processos eletroquímicos.
REDOX
Começaremos consolidando alguns conceitos essenciais sobre a eletroquímica.
Comentário
Trataremos, neste módulo e no próximo, essencialmente, de fenômenos envolvendo metais. Embora os processos abordados possam ser realidade também para outros tipos de materiais, eles são mais característicos para os metais e, por isso, focaremos nossa atenção nessa classe.
Já vimos, quando estudamos ligação metálica, que ela é caracterizada por um “gás”, ou “mar” de elétrons que, na realidade, trata-se de uma densidade eletrônica deslocalizada que é fruto da alta eletropositividade desses elementos. Ou seja, os metais tendem a “perder” elétrons.
Os processos em que ocorre perda de elétrons são, oficialmente, denominados oxidação. Veja os exemplos a seguir:
O sobrescrito “0” simboliza o átomo neutro.
Comentário
Vimos um processo parecido com esses quando tratamos de energia de ionização. Dizemos parecido, pois, em essência, é o mesmo, mas motivado por outros fatores.
A energia de ionização era observada quando um aporte de energia externa era incidido no átomo e isso fazia com que esse elétron fosse “arrancado” do mesmo. Agora, o que queremos enfatizar na oxidação é que essa saída do elétron é motivada por outra espécie “retiradora” de elétrons, que sofrerá o processo inverso.
Acompanhe:
Aqui, vemos que os cátions metálicos , e recebem elétrons num processo denominado redução. É importante nos acostumarmos com esses termos, pois eles serão uma constante daqui para frente.
Atenção
No contexto da eletroquímica, sempre tratamos a oxidação/redução (REDOX) como um par associado, ou seja, uma espécie só se oxida porque outra estava pronta a receber seus elétrons e vice-versa. Portanto, uma vez que uma espécie se oxida, ela, naturalmente, vai reduzir outra. Logo, ela será um agente redutor, pois provocará a redução. Da mesma forma, temos a figura do agente oxidante, que é quem se reduz. Esses termos não devem ser confundidos!
Podemos visualizar esse processo de duas vias da eletroquímica através de uma reação global, representada por uma equação REDOX:
A equação REDOX representa a soma dos dois processos de oxidação e redução numa equação mais geral que, como se vê no exemplo anterior, traz embutida em si a transferência de elétrons. Note que cortamos, na equação global, os elétrons envolvidos, pois, nessa conduta de soma de equações, as espécies que se repetem em lados opostos das setas nas diferentes equações são anuladas. Assim, temos, na equação global, o magnésio se oxidando e o cátion cobre se reduzindo, portanto, o é o agente redutor e o é o agente oxidante.
Condutividade elétrica
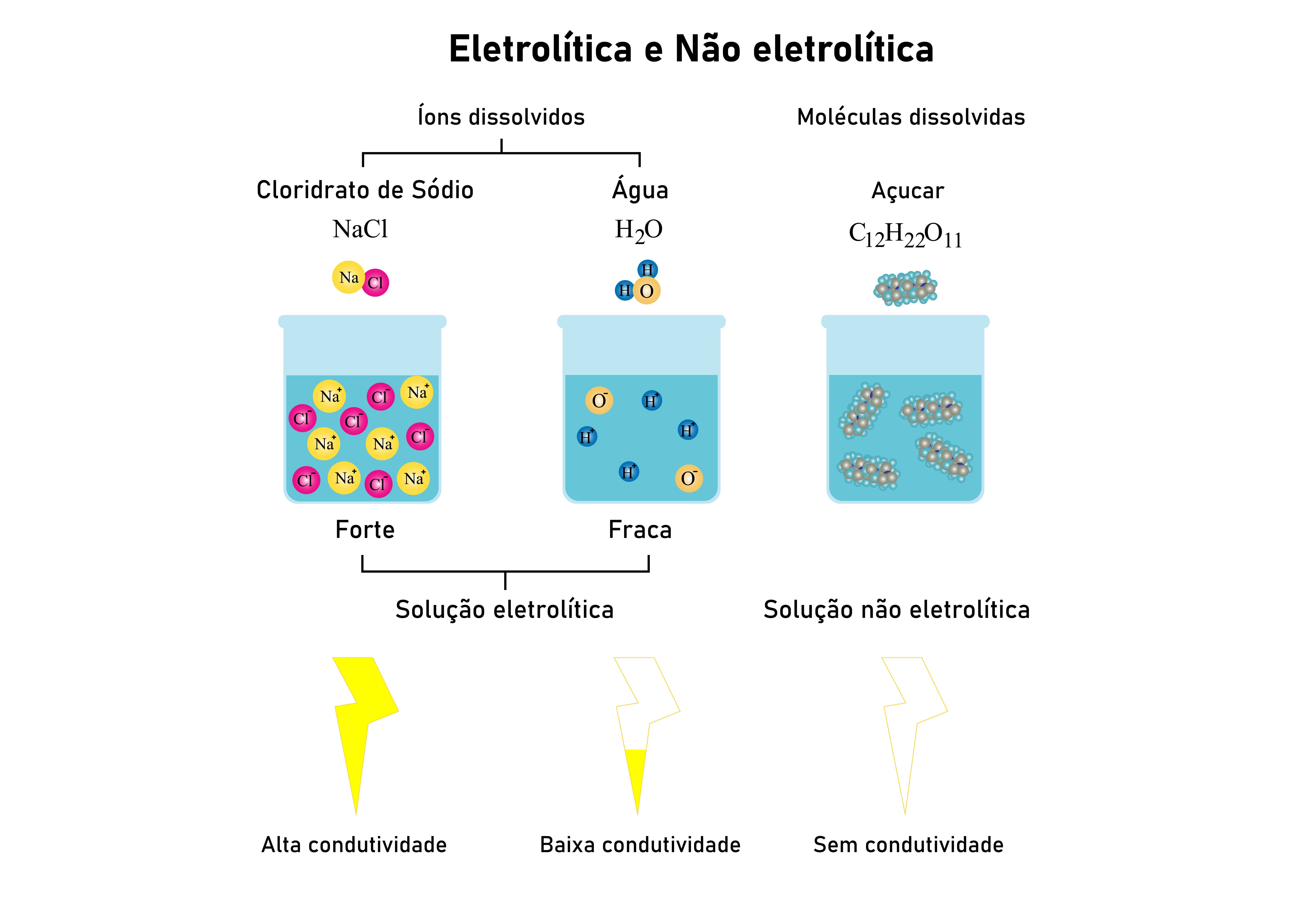
Arrhenius, de quem tomamos a definição de ácidos e bases, estabeleceu estudos acerca de condutividade de soluções e foi um dos primeiros a entender que para uma solução ser condutora elétrica era necessária a existência de espécies capazes de realizar o transporte de elétrons (corrente elétrica).
Ele estabeleceu que uma solução eletrolítica se tratava de uma solução capaz de conduzir corrente elétrica (que é definida, formalmente, como um fluxo contínuo e ordenado de elétrons) por apresentar íons livres em seu meio. Por outro lado, uma solução não eletrolítica não permite a condução elétrica por não apresentar esses íons. Ambas as soluções também são denominadas eletrólitos ou não eletrólitos.
Mas que substâncias podem, quando em solução, gerar soluções eletrolíticas?
Quando estudamos os compostos iônicos, vimos que eles são excelentes condutores elétricos exatamente por sofrerem dissociação, ou seja, em água eles liberam íons existentes em sua estrutura cristalina. Qualquer solução de composto iônico, portanto, é um potencial eletrólito, dependendo somente do grau de solubilidade daquele composto em água numa determinada temperatura. Também os ácidos, que sofrem ionização, são os compostos moleculares capazes de gerar esse tipo de solução pelo fenômeno da ionização.
Pode-se medir o quanto a substância estará dissociada ou ionizada em solução através de um parâmetro denominado grau de ionização (α) ou dissociação (β):
O grau de dissociação segue o mesmo padrão, mas se tratando de substâncias iônicas. Considera-se, de maneira geral, que:
| α < 5% | Eletrólito fraco | Ex: Soluções moleculares |
| 5% < α < 50% | Eletrólito moderado | Ex: Água pura |
| α > 50% | Eletrólito forte | Ex: Solução de HCl |
Atenção
Portanto, somente meios eletrolíticos são capazes de conduzir corrente elétrica, ou seja, são os meios em que se levam a cabo reações REDOX.
Pilhas eletroquímicas
Pilhas eletroquímicas (ou células galvânicas ou células voltaicas) são dispositivos que geram energia elétrica através de energia química. Esses dispositivos se valem das reações de oxidação e redução e do fluxo de elétrons envolvidos nelas para obter corrente elétrica para a geração de trabalho útil.
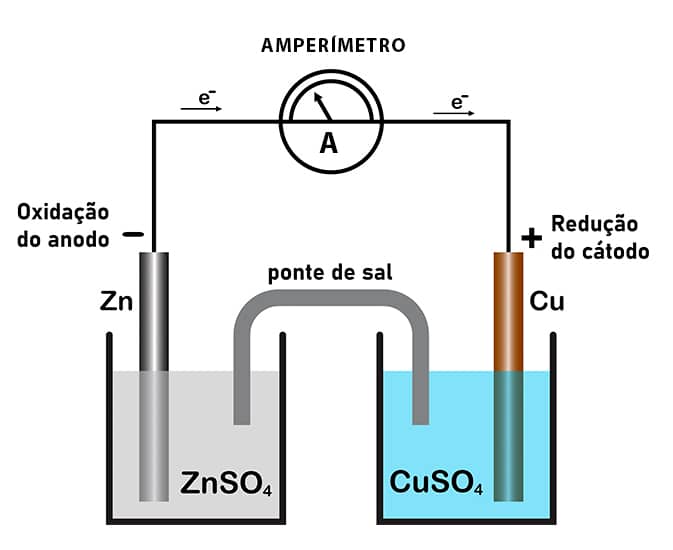
Um dos pioneiros a estabelecer um dispositivo realmente eficaz para esse fim foi o inglês John F. Daniell (1790-1845), que construiu a seguinte célula.
Como mostra a figura, a pilha de Daniell consistia em duas barras metálicas: uma de zinco e outra de cobre, cada uma delas imersa em soluções eletrolíticas de seus próprios sais (por exemplo, ). Esses sais em solução, como já sabemos, sofrerão dissociação segundo as equações:
Ao conjunto barra de metal + solução, os dois recipientes ilustrados na figura, denominamos eletrodo. Logo, temos 2 eletrodos numa pilha:
Ânodo
Eletrodo em que acontece a oxidação, ou seja, de onde saem elétrons; é denominado ânodo e, por convenção, ele é o polo negativo da pilha.
Cátodo
Eletrodo aonde chegam os elétrons, ou onde ocorre a redução; é denominado cátodo, o polo positivo do dispositivo.
Pela figura, vemos que, obviamente, o fluxo de elétrons vai do ânodo para o cátodo. Para a pilha de Daniell, os elétrons migram do zinco para o eletrodo de cobre. Portanto, a reação que ocorre no ânodo será a seguinte:
Repare que são formados cátions constantemente, conforme a reação de oxidação vai acontecendo. Esses íons não ficam na barra, mas vão para a solução em que o zinco está imerso, com o intuito de equilibrar essa carga positiva que adquiriram (lembre-se de que a água é um solvente polar e estabiliza bem espécies carregadas).
Acontece que, ao entrarem em solução, os íons causam um desequilíbrio de cargas com os íons . Quando o sal se dissociou na água, pela estequiometria da reação, sabemos que a mesma quantidade de e estavam presentes, mas, agora, mais íons vindos da oxidação da barra rompem esse equilíbrio e a solução vai ficando cada vez mais carregada de íons positivos. Guarde essa informação por enquanto.
Os elétrons liberados na oxidação são conduzidos pelo fio que une os dois eletrodos e, antes de chegar ao eletrodo de cobre, esses elétrons passam por um dispositivo qualquer onde são aproveitados para realização de algum trabalho. Depois, seguem seu caminho até o cátodo.
Ao chegarem no cátodo, o metal cobre da barra não tem afinidade por esses elétrons (sua eletropositividade é muito alta, ou eletroafinidade baixíssima, como qualquer outro metal neutro). Por isso, esses elétrons ficam acumulados na barra, sendo capturados, por sua vez, pelos cátions da solução em que a barra está imersa. Acontece, então, a redução desses íons:
Da mesma forma como ocorreu com o eletrodo de zinco, aqui também haverá um desequilíbrio entre os íons da solução salina. Isso porque, mais e mais, cátions cobre vão saindo da solução para virar cobre metálico (), restando apenas os íons em solução.
Notamos, então, que está havendo um progressivo desequilíbrio de cargas nas soluções dos eletrodos. Quando esse desequilíbrio atinge um ponto crítico, a pilha para de funcionar para não agravar esse quadro. Para evitar isso, é colocada uma ponte salina, que consiste num tubo de vidro contendo uma pasta condutora de íons. Ela permite o trânsito das espécies em excesso de ambos os lados, restaurando, assim, o equilíbrio de cargas nas soluções dos eletrodos.
Dessa maneira, enquanto existirem átomos de zinco na barra para se oxidarem e íons cobre no outro eletrodo para receber esses elétrons, a pilha continua funcionando e gerando uma corrente elétrica útil.
Por que, ao se colocar zinco e cobre em contato, o zinco perde elétrons para o cobre? E por que não acontece o contrário?
Essas perguntas são respondidas a partir do conhecimento da ideia de potencial eletroquímico, que veremos a seguir.
Potencial de eletrodo
Potencial eletroquímico, ou potencial de eletrodo, traduz a tendência que uma espécie química tem de se oxidar ou se reduzir, ou seja, quanto maior a tendência de uma espécie se oxidar, ou perder elétrons, maior será seu potencial de oxidação. Da mesma forma, o potencial de redução indica a maior ou menor tendência de uma espécie em ganhar elétrons.
Assim, percebemos que o potencial de oxidação do zinco é maior que o do cobre, ou o potencial de redução do cobre é maior que o do zinco. Isso precisa ser assim para justificarmos o sentido da corrente elétrica na pilha de Daniell. O potencial eletroquímico é medido em volts (V) e representado por , que indica o potencial em situação padrão (0°C e 1 atm de pressão). é o potencial padrão de oxidação e é o potencial padrão de redução.
Atualmente, já são conhecidos praticamente todos os potenciais de oxidação e oxidação das espécies químicas, conforme exemplificados abaixo:
| Potencial de redução (E°red), em V | Estado reduzido | α < 5% | Estado oxidado | Potencial de oxidação (E°oxi), em V |
|---|---|---|---|---|
| -3,04 | +3,04 | |||
| -2,92 | +2,92 | |||
| -2,90 | +2,90 | |||
| -2,89 | +2,89 | |||
| -2,87 | +2,87 | |||
| -2,71 | +2,71 | |||
| -2,37 | +2,37 | |||
| -1,66 | +1,66 | |||
| -1,18 | +1,18 | |||
| -0,83 | +0,83 | |||
| -0,76 | +0,76 | |||
| -0,74 | +0,74 | |||
| -0,48 | +0,48 | |||
| -0,44 | +0,44 | |||
| -0,28 | +0,28 | |||
| -0,23 | +0,23 | |||
| -0,13 | +0,13 | |||
| 0,00 | 0,00 | |||
| +0,15 | -0,15 | |||
| +0,34 | -0,34 | |||
| +0,40 | -0,40 | |||
| +0,52 | -0,52 | |||
| +0,54 | -0,54 | |||
| +0,77 | -0,77 | |||
| +0,80 | -0,80 | |||
| +0,85 | -0,85 | |||
| +1,09 | -1,09 | |||
| +1,23 | 1,23 | |||
| +1,36 | Ex: -1,36 | |||
| +2,87 | -2,87 |
Vamos, rapidamente, analisar os valores mostrados inicialmente com o Li, que está no topo da lista. Podemos analisar a reação em ambos os sentidos:
Se olharmos da esquerda para a direita, veremos a oxidação do e o valor desse potencial expresso, também, à direita (+3,04V).
| Potencial de redução (), em V | Estado reduzido | Estado oxidado | Potencial de oxidação (), em V | |
|---|---|---|---|---|
| -3,04 | Li | +3,04 |
Ao olharmos da direita para a esquerda, estaremos diante da redução do cátion lítio () e do valor do potencial de redução expresso, também à esquerda (-3,04V).
| Potencial de redução (), em V | Estado reduzido | Estado oxidado | Potencial de oxidação (), em V | |
|---|---|---|---|---|
| -3,04 | Li | +3,04 |
Valores de potenciais positivos indicam tendências favoráveis, ou espontâneas, de ocorrências, enquanto valores negativos indicam reações não espontâneas. Por isso, os valores de potenciais de oxidação e de redução para uma mesma espécie são sempre opostos, como vimos no caso do lítio.
Da relação mostrada, ele é o que apresenta o maior potencial de oxidação, ou seja, é o que tem maior tendência a se oxidar. Consequentemente, sua tendência a se reduzir será diametralmente oposta, ou grandemente desfavorável (da mesma magnitude, em módulo, da oxidação). A mesma análise se faz para todos os outros elementos da tabela, ou de qualquer outra lista de potenciais.
Exemplo
Se analisarmos o caso específico da pilha de Daniell, notamos que o zinco apresenta um potencial de oxidação de +0,76V, enquanto o cobre tem um potencial de oxidação de -0,34V. Assim, o zinco tem uma tendência maior em se oxidar do que o cobre, conforme mencionamos anteriormente. O cobre é mais tendencioso em se reduzir do que se oxidar, dado o valor negativo de seu potencial de oxidação. Por isso, o fluxo de elétrons na pilha de Daniell ocorre do zinco para o cobre.
De posse dos potenciais dos eletrodos, podemos determinar o potencial global da pilha, ou sua força eletromotriz (fem), por meio de uma equação muito simples:
Essa expressão é válida quando tomamos somente um tipo de potencial para ambos os eletrodos (ou ambos de oxidação ou ambos de redução). Para a pilha de Daniell, tomando os potenciais de oxidação, temos:
Se tomarmos os potenciais de redução:
Dica
Da mesma forma como fez John Daniell no passado, podemos montar a pilha que quisermos e obter os mais variados valores de fem admissíveis. Basta combinarmos os possíveis pares através de seus valores de potenciais.
Pilhas primárias e secundárias
Pilhas primárias ou não recarregáveis
Como já dissemos, a pilha de Daniell tem um fim. Ao findar os reagentes do dispositivo, a pilha cessa seu funcionamento e não gera mais corrente elétrica. Pilhas desse tipo são denominadas pilhas primárias ou não recarregáveis. Nessa mesma categoria se enquadram as conhecidas pilhas alcalinas.
As pilhas alcalinas representam um passo adiante das primeiras pilhas ácidas − assim chamadas em virtude dos cloretos presentes (principalmente de amônio, que tem um caráter ácido) −, conhecidas como pilhas de Leclanché.
Saiba mais
Elas também eram chamadas de pilhas de zinco/dióxido de manganês, pois o seu ânodo era um invólucro de zinco. Já seu cátodo era um bastão de grafite no centro do dispositivo envolto por uma camada de dióxido de manganês ( ), carvão em pó e uma pasta úmida de cloreto de amônio e cloreto de zinco. O cilindro de zinco ficava isolado do restante dos componentes e transferia seus elétrons para o manganês por meio da barra de grafite.
As pilhas alcalinas têm o mesmo princípio de funcionamento da pilha anterior, porém, com a diferença de que o eletrólito é uma base e não um sal com caráter ácido. No lugar dos cloretos é utilizado o hidróxido de sódio ou de potássio.
Pilhas secundárias ou recarregáveis
Mais úteis e mais modernas são as pilhas secundárias ou recarregáveis que, pela aplicação de um potencial externo, revertem as reações que ocorrem nelas, regenerando os reagentes.
Exemplo comum dessa categoria é a bateria de automóvel. Seu ânodo é composto de placas de chumbo metálico e o cátodo é formado por placas de chumbo revestidas por óxido de chumbo, . Essas placas são isoladas entre si e mergulhadas em uma solução de ácido sulfúrico concentrado, formando uma série de seis pilhas, com 2V cada e fornecendo um potencial total de 12V.
Nessa categoria também se encontram as baterias de celulares, notadamente as de íons lítio. Nesses dispositivos, o cátodo é uma mistura de óxidos de lítio e cobalto, e o ânodo é o carbono, sendo esses dois eletrodos separados por um material não condutor. Outros eletrodos também podem ser utilizados, como níquel/cádmio e hidreto/óxido de níquel.
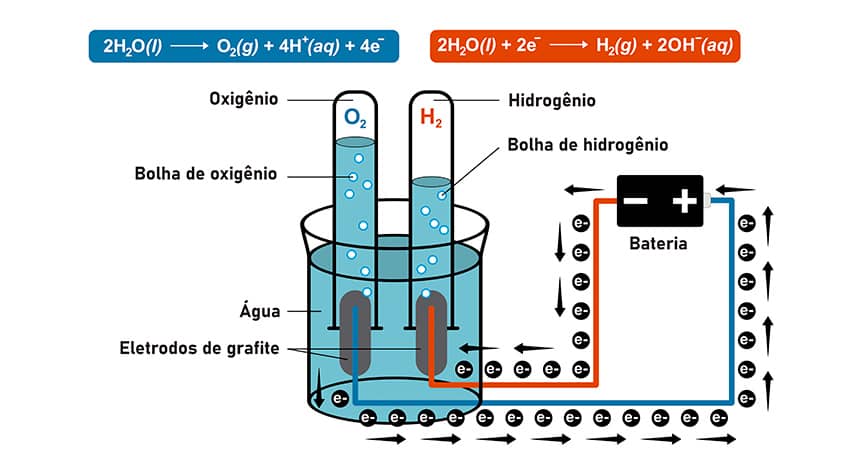
Células eletrolíticas e eletrólise
No sentido oposto ao das células galvânicas (pilhas) estão as células eletrolíticas. Esses dispositivos utilizam energia elétrica para produzir reações químicas. Esse processo é denominado eletrólise.
Ao analisarmos a figura, vemos que a formação dos gases a partir da água só foi possível pela ação de uma fonte de energia elétrica externa (uma bateria). Repare que a equação em azul representa a formação do gás oxigênio e é fruto da oxidação da água (elétrons são liberados) representando, portanto, o ânodo do dispositivo.
A equação em vermelho indica a formação do gás hidrogênio como consequência da redução da água (cátodo). Essa redução ocorre em virtude dos elétrons enviados pela fonte externa, e não pela espécie que compõe o ânodo.
Atenção
Notamos que existe uma inversão dos polos da célula eletrolítica; enquanto o polo negativo na pilha era o ânodo, aqui ele é o cátodo e vice-versa. É bom ressaltar, porém, que as reações que ocorrem em cada eletrodo continuam as mesmas que as da pilha: oxidação no ânodo e redução no cátodo.
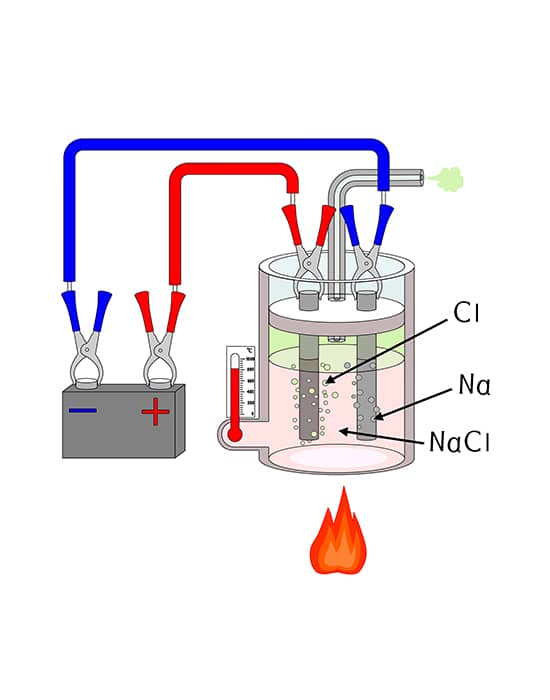
O processo de eletrólise é muito útil industrialmente para a produção de materiais com alto grau de pureza. A partir de sais fundidos, pode-se gerar os compostos elementares ou gasosos dos componentes daquele sal. Veja o caso do .
A fusão do cloreto de sódio gera um líquido constituído, unicamente, pelos íons componentes do material iônico: . Sendo esse líquido submetido à eletrólise, ou seja, recebendo uma tensão externa, as seguintes reações tomam lugar:
Ânodo:
Cátodo:
Esse processo constitui uma das principais fontes industriais de sódio metálico puro e de cloro gasoso. Íons , como vimos, são oxidados a no ânodo, e os íons são reduzidos à no cátodo. Os eletrodos, nesse caso, diferentemente do que ocorre na pilha, são inertes, ou seja, não regem diretamente no processo.
Uma vez que a eletrólise tem como finalidade produzir reações químicas, as quantidades de produtos gerados têm estreita relação com a quantidade de energia aplicada pela fonte externa. Por exemplo, se quisermos saber a quantidade de cobre metálico produzida a partir de seu sal fundido, podemos seguir o seguinte raciocínio:
Atenção
Significa, portanto, que 2 mols de elétrons produzirão 1 mol de Cu sólido. A carga de 1 mol de elétrons é 96.500 C. A carga de 1 elétron é, aproximadamente, ; logo, a carga de 1 mol, ou 6,02.1023 elétrons, será esses 96500 C, também conhecidos como 1 Faraday, 1F.
Logo, a quantidade de Cu pode ser calculada pela corrente (i) e o tempo (Δt) em que essa corrente foi aplicada. Ou seja, os parâmetros da energia aplicada nos indicam a quantidade, em massa, de produto formado.
Vejamos um exemplo: a partir da eletrólise do fundido, queremos determinar a quantidade de produtos formados no ânodo e no cátodo. Para isso, vamos supor que uma corrente de 0,452 A passe pela célula por um período de 1,5h.
Ânodo:
Cátodo:
As quantidades de Ca metálico e de cloro formadas dependem do número de elétrons que passam pela célula e, assim, da carga (Q):
Dado que 1 mol de elétrons corresponde a 96.500 C e que são necessários 2 mol de elétrons para produzir 1 mol de , a massa de Ca (massa atômica 40g/mol) formada no cátodo será de 0,507 g. A massa de cloro formada é calculada com o mesmo raciocínio.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever os fundamentos da corrosão
Fundamentos da corrosão
Corrosão
A maioria dos metais aparece na natureza em forma de compostos estáveis, os chamados minérios. Eles podem estar nas mais variadas formas, tais como óxidos − principalmente −, sulfetos, carbonatos etc. Isso não acontece por acaso, mas indica que os metais na forma de compostos, na maioria dos casos, são mais estáveis do que os metais puros.
Para as aplicações tecnológicas e industriais, porém, é necessária, na esmagadora maioria das vezes, a utilização do metal puro e não na forma combinada. Por isso, é necessário um tratamento do minério (composto metálico) com aplicação de energia e processos apropriados para se obter o metal na sua forma metálica elementar.
O processo de obtenção é denominado processo metalúrgico e pode ser esquematizado da seguinte maneira:
Composto do metal da natureza + Energia -> Metal
O homem produz o metal através de um processo artificial, forçando o estado natural mais estável a passar a outro menos estável, na maioria das vezes. Esse desequilíbrio não é duradouro, pois o metal produzido fica imerso na atmosfera, na água ou na terra, com tendência a voltar ao estado natural de composto mais estável. Esse processo espontâneo de retorno à situação combinada original pode ser entendido como corrosão.
Numa definição mais técnica, podemos dizer:
Corrosão é a deterioração de um metal por ação química ou eletroquímica do meio ambiente, havendo normalmente a formação de um composto mais estável.
O ferro aplicado na sua forma metálica (), se submetido à influência de um agente oxidante, sofrerá corrosão. Veja:
Se repararmos, o processo exemplificado anteriormente nada mais é do que uma reação REDOX:
Podemos dizer, ainda, que houve a formação de uma célula galvânica, ou pilha eletroquímica, entre o ferro como ânodo e o como cátodo.
Comentário
Lembra-se do caso da pilha de Daniell? O zinco, com o passar do tempo e o andamento das reações, ia se “corroendo”, ou seja, ia perdendo massa da barra. Isso porque o zinco metálico, ao se oxidar gerando , procurava estabilização na solução. Podemos dizer, então, que estávamos diante de um processo de corrosão do zinco. Com isso, podemos estabelecer que a corrosão nada mais é do que um processo de oxirredução, ou de formação de uma pilha, em que o material corroído é sempre o ânodo desse dispositivo. Para isso, o metal corroído precisa ter maior potencial de oxidação que a outra espécie quando ambos estiverem em contato (corrosão eletroquímica), ou ele sofrerá corrosão, sendo atacado diretamente num processo REDOX (corrosão química).
Como o contato do metal com o meio agressivo se dá na sua superfície, é aí, geralmente, que ocorrem as reações químicas ou eletroquímicas do processo. Logo, a velocidade e a extensão da corrosão dependem de fatores ligados ao próprio material e ao meio ambiente. Para tentarmos combater a corrosão, devemos colher informações sobre a natureza da corrosão e o seu mecanismo.
Nosso conhecimento sobre a eletroquímica nos permite fazer uma breve abordagem sobre os aspectos mais característicos dos mecanismos e da natureza da corrosão.
Fatores que influenciam a corrosão
Como vimos, dentre os fatores associados às propriedades dos metais para ocorrência da corrosão, podemos, evidentemente, citar o seu potencial de oxidação como o fator número um a se levar em consideração. Como a corrosão tem lugar no ânodo, de onde os íons metálicos passam para a solução, os valores de permitem uma estimativa da atividade anódica dos metais. Vejamos outros fatores:
O não conhecimento ou a negligência dos princípios fundamentais da eletroquímica dão lugar, em muitas ocasiões, a uma custosa corrosão. Com frequência, usam-se juntos materiais de potenciais eletroquímicos muito diferentes em situações que ensejam a corrosão. Por exemplo, novamente recorrendo ao princípio de funcionamento da pilha de Daniell, seria difícil imaginar uma estrutura de chapas de zinco, por exemplo, fixadas com parafusos de cobre. Se o meio onde esta estrutura estiver localizada for eletrolítico (condutor), certamente haverá corrosão.
Novamente o zinco, contendo impurezas como o chumbo, ferro ou carbono, formará minúsculas pilhas nas regiões em que as impurezas ficam em contato com o ar. A ação local causa a corrosão do zinco na área vizinha, aumentando a velocidade da corrosão à medida que mais impurezas vão aparecendo. Os metais puros, consequentemente, podem ser pensados, em princípio, como se não fossem corrosíveis.
A corrosão do ânodo é diretamente proporcional à superfície do cátodo. Quanto maior a superfície catódica, maior será a corrente e, portanto, maior a corrosão do ânodo. Esse é um fenômeno puramente físico, pois a oxidação do metal ocorrerá enquanto houver um cátodo com grande capacidade de receber seus elétrons.
Praticamente todos os metais, ao serem expostos ao ar, cobrem-se de uma película de óxido, resultado da corrosão superficial inicial, cuja espessura é de alguns angstrons (). Essa espessura varia com a temperatura e a natureza desse metal, podendo formar um ou mais óxidos diferentes.
Se o espaço ocupado pelo aglomerado de partículas do óxido do metal (tecnicamente denominado grão do óxido) for menor que o ocupado pelos átomos do metal (aglomerado de átomos de metal, ou grão metálico), a película será porosa, permitindo um fácil acesso do oxigênio externo e proporcionando pouca ou nenhuma proteção contra a corrosão do metal. No alumínio, por exemplo, a relação volume do grão do óxido/volume do grão do metal é de 1,24. A espessura dessa película cresce a partir de uma camada uniforme e é, portanto, protetora. O níquel nos dá 1,6; o cromo, 2,0; e o tungstênio, 3,6. A relação do ferro com o oxigênio, por exemplo, já é mais complexa, uma vez que se formam vários óxidos conforme a temperatura. Esses óxidos geralmente contêm um excesso de íons metálicos que diminuem o efeito protetor.
Devemos considerar, também, a influência do meio ambiente em que está inserido o metal para a sua corrosão. São itens muito importantes para o planejamento de engenharia e que não estão ligados à natureza do material a ser utilizado. Acompanhe:
Em geral, a corrosão aumenta com a temperatura. Como qualquer outro processo químico, a elevação da temperatura aumenta o grau energético do sistema, faz as partículas estarem mais agitadas, facilitando a interação entre as espécies e a troca de elétrons.
Um inibidor retarda ou paralisa a reação. É um método de luta contra diversos problemas de corrosão. Existe grande variedade de substâncias e métodos inibidores de corrosão que iremos abordar mais adiante.
A corrente produzida pela corrosão dependerá da condutividade do meio, fator importante na corrosão de estruturas enterradas ou aéreas. Por exemplo, a água do mar tem uma alta condutividade elétrica em virtude dos íons de sais dissolvidos nela; solos porosos permitirão maior penetração de e umidade até a superfície metálica.
É comum se observar que a corrosão atmosférica do ferro se produz muito mais lentamente no ar seco e mais rapidamente em presença de umidade. A água atua como solvente do (do ar) e de outros gases e sais que irão constituir o eletrólito de uma pilha de corrosão. É interessante atentar para o fato de a água pura não ser condutora elétrica, isso porque o oxigênio e íons não estão presentes e são os verdadeiros responsáveis pela corrosão. No entanto, como a água é um excelente solvente (denominada o solvente universal), dificilmente uma água ambiente natural estará efetivamente pura.
Todos admitem o efeito corrosivo de um ácido forte (alta concentração de íons hidrônio) sobre os metais ativos, mas prestam pouca atenção ao pH das águas ou dos fluídos em contato com estruturas, condutores ou equipamentos metálicos. O íon hidrônio () é altamente oxidante, pois é um ativo captador de elétrons. Para facilitar a visualização, vamos considerar esse íon como o em água, ou seja, um próton isolado. Essa espécie é extremamente ávida por elétrons:
Meios corrosivos
Em termos de análise do ambiente para a corrosão, temos que analisar, basicamente, dois cenários: um meio seco e um meio úmido.
Ambiente seco
O que caracteriza a corrosão a seco é a formação e manutenção de uma camada de óxido superficial no material. A maioria dos metais de engenharia não cria camadas de óxidos de grande espessura, a não ser em temperaturas elevadas.
Como os íons metálicos são geralmente menores do que os íons de oxigênio, a difusão dos íons metálicos para as regiões superficiais no material é mais rápida do que a difusão dos íons de oxigênio para as regiões interiores. A velocidade de oxidação do metal depende, em parte, dessa mobilidade dos íons através do filme de óxido, porém, também depende da velocidade de fluxo dos elétrons para as regiões externas.
Atenção
As taxas de oxidação também dependem da porosidade do filme de óxido. Alguns metais formam íons bem menores que os átomos originais. Em consequência disso, quando os íons se formam, ocorre uma redução no volume do filme de óxido. Como resultado disso, o filme torna-se poroso, permitindo que o acesso do oxigênio à superfície do metal se dê com mais facilidade.
A contração do filme de óxido também pode fazer com que ele se esfarele, expondo uma superfície nova do metal. Em alguns casos pode ocorrer expansão do filme, fazendo com que ele se trinque.
Um filme de óxido que adere firmemente à superfície do metal geralmente oferece boa proteção. A boa adesão é o resultado da coerência entre o filme e o próprio metal. Entendemos como coerência, no presente caso, quando existe um bom “ajuste” entre os íons na superfície do metal e os íons metálicos no filme de óxidos, de tal forma que a estrutura é virtualmente contínua. Quando as duas superfícies são não coerentes, o resultado é uma baixa adesão.
Ambiente úmido
No ambiente úmido, o ferro, por exemplo, rapidamente começa a desenvolver em sua superfície um depósito marrom-avermelhado de hidróxido férrico.
A reação química global que representa o enferrujamento pode ser simplesmente expressa por:
A facilidade de oxidação de um metal depende da facilidade com que seus elétrons de valência possam ser removidos de seus átomos. Assim, metais como o cálcio, o alumínio e o zinco não estão muito ligados a seus elétrons de valência nobres. Ouro, prata e platina estão mais fortemente ligados a seus elétrons de valência, tornando sua oxidação mais difícil do que a do ferro.
Atenção
O produto da corrosão em meio aquoso é o hidróxido e não o respectivo óxido, como no meio seco.
Mecanismos de corrosão
Pelo conhecimento que adquirimos até agora, de alguma forma já nos familiarizamos com os mecanismos pelos quais a corrosão acontece. Em um primeiro caso, o simples contato de um metal com uma solução eletrolítica pode proporcionar uma troca direta de elétrons, provocando a reação corrosiva.
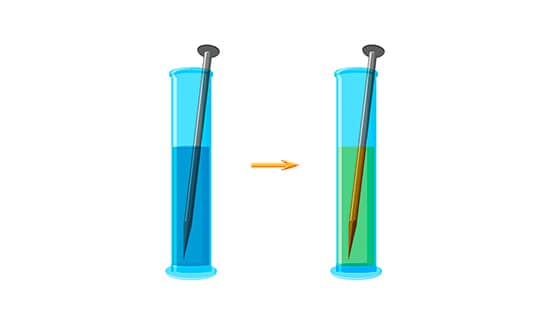
A solução de cobre () à esquerda (azul) recebe um prego (ferro), e a oxidação do ferro se inicia por ter maior potencial de oxidação que o cobre. A redução do cobre gera íons (verde). Esse é um exemplo do mecanismo de ação química.
Vimos, também, o processo de eletrólise, que é outro mecanismo de corrosão que já foi bastante explorado, assim como o mecanismo eletroquímico das reações REDOX.
Outro mecanismo que também é muito comum e que não citamos ainda é o de corrosão a altas temperaturas, no qual os metais em geral se combinam diretamente com o oxigênio da atmosfera oxidante. Há transferência direta dos elétrons produzidos pela oxidação do metal ao agente oxidante, incentivada pelo alto conteúdo energético proporcionado pela temperatura elevada. O processo para o magnésio, por exemplo, ocorre de acordo com as seguintes reações:
Esse ataque rápido é devido ao aumento de energia do sistema e, quanto mais endotérmica a reação de oxidação do metal, mais rápida a corrosão a altas temperaturas.
Proteção
Uma vez conhecidos os mecanismos e tudo o que está envolvido na ocorrência da corrosão, entendemos que quando o processo de oxidação não é de alguma forma inibido, pode trazer grandes prejuízos.
Exemplo
Por exemplo, estima-se que 20% do ferro produzido anualmente nos EUA seja usado para repor perdas decorrentes da ferrugem
Sabendo que a corrosão acontece pelo estabelecimento de uma pilha galvânica, a proteção contra sua ocorrência consiste em parar o funcionamento da pilha. Portanto, vamos abordar alguns dos procedimentos mais utilizados nesse sentido:
Trabalhar adequadamente a confecção da peça
Nem sempre é viável, ou mesmo tecnicamente permitido, utilizar outro metal como constituinte de alguma estrutura de um projeto. Mas, sempre que possível, pode-se evitar a corrosão através da escolha adequada de materiais. Além dessa escolha, deve-se atuar, também, no design das peças a serem confeccionadas para se evitar dobras e frestas, pois são condições de acúmulo de eletrólito ou agentes oxidantes. Da mesma maneira, deve-se tornar a área anódica (que sofrerá corrosão) a maior possível, para evitar corrosão localizada em pequenas áreas.
Metais como o ouro e a platina são adequados para processos nos quais a manutenção da integridade do material é essencial, tais como próteses.
Modificar o meio
Se o sistema operar em um meio extremamente agressivo em termos de corrosão (meio ácido, por exemplo), é interessante, quando possível, alterar essa situação. Nem sempre é possível essa alteração (pense numa plataforma marítima de extração de petróleo, por exemplo), mas a eliminação do eletrólito (meio condutor) é sempre buscada.
Criação de barreira física entre ânodo e cátodo
Esse, talvez, seja o método mais utilizado para se evitar a corrosão, e seu mais famoso representante é o recobrimento com tintas. Imagine a pilha de Daniell se cortarmos o fio que une as barras de zinco e cobre. A ausência de contato entre elas cessa imediatamente a troca eletrônica.
Atenção
É essencial que esse recobrimento obedeça a alguns critérios para que seja eficiente: deve ser contínuo, impermeável, indissolúvel no meio em que irá atuar, aderente à superfície que será protegida e não deve sofrer ruptura por choques mecânicos da peça.
Eliminação da diferença de potencial (ddp) entre as áreas anódicas e catódicas
É sempre desejável se utilizar o mesmo material para a confecção de dispositivos, de tal forma que seja eliminada por completo a ddp entre os materiais componentes. Já sabemos que a diferença de potenciais (de oxidação ou de redução) entre metais em contato é o que desencadeia todo o processo de troca eletrônica. Se não for possível essa condição, a ddp deve ser diminuída o mais possível.
Proteção catódica
É uma técnica bastante eficaz e sua execução é muito viável, sendo, por isso, amplamente utilizada atualmente. Ela pode ser de duas naturezas:
Visa proteger o material com o revestimento ou o uso de placas de maior potencial de oxidação. Um exemplo clássico é o uso da galvanização (recobrimento com zinco) sobre o ferro e algumas de suas ligas. Como o zinco é um agente redutor mais eficiente, ao se ligar eletricamente ao ferro (cerca, oleoduto, casco de navio etc.), permite ser oxidado preferencialmente, fornecendo assim elétrons ao ferro para redução do . O zinco constitui o ânodo da espécie de bateria galvânica e força o ferro a se tornar um cátodo, reduzindo ou , se a solução for suficientemente ácida. Como o ferro é um cátodo, não poderá ser corroído.
Outro exemplo é a utilização de barras de , fixadas nas laterais das embarcações perto da quilha, para proteger o casco (para embarcações de água doce), ou utilização de varetas de em caldeiras ou caixas d’água para evitar águas ferruginosas; para embarcações de água salgada usam-se varetas de ou como ânodo de sacrifício.

Consiste em se aplicar uma contracorrente à pilha ou ao sistema de corrosão, procedente de uma fonte externa, que converte o metal corrosível de ânodo em cátodo. A ideia é abastecer continuamente a estrutura com elétrons de uma bateria externa para que, caso haja perda por corrosão, esses elétrons sejam prontamente repostos. Esse tipo de proteção é de um valor particular em estruturas subterrâneas como oleodutos e tanques, torres de trans¬missão, pilares marinhos e embarcações ancoradas.
A proteção catódica é um dos mais eficientes e utilizados pro¬cessos, aplicando-se frequentemente em união com recobrimento protetor, visto que nenhum recobrimento dá uma proteção permanente.
Apresenta uma série de vantagens quanto ao custo, à instalação e manutenção. No entanto, é importante lembrar os cuidados no momento do dimensionamento do projeto, pois a corrente aplicada na proteção catódica de uma estrutura pode afetar adversamente um oleoduto vizinho ou outro metal enterrado, ao dar lugar a "correntes de fuga".
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Tratamos de um aspecto muito importante para a Química: a oxidação. Estudamos a oxidação especial que os materiais podem sofrer e que é acompanhada da emanação de energia na forma de calor, a combustão. Vimos a vasta gama de tipos de combustíveis que existem e suas principais propriedades. Em especial, os combustíveis fósseis, que são muito utilizados ainda nos dias atuais para a produção de energia.
Os princípios da eletroquímica foram explorados e os conceitos básicos das principais reações de oxidação e redução foram apresentados. Demos ênfase ao estudo das células galvânicas (pilhas eletroquímicas) e aos processos de eletrólise.
Por fim, tratamos da corrosão. Vimos sua definição, seus tipos e meios propícios para sua ocorrência. Ao estudarmos os mecanismos mais comuns de atuação da corrosão, pudemos entender, de maneira mais adequada, os processos de proteção contra esse fenômeno.