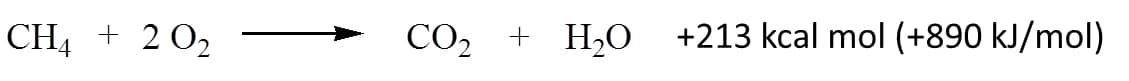Descrição
Apresentação das principais funções orgânicas, suas nomenclaturas e características mais importantes.
PROPÓSITO
Reconhecer as principais funções orgânicas, estabelecendo uma conexão entre seus nomes e suas estruturas, bem como as características mais importantes desses compostos, o que fornece a base fundamental para entendermos as reações orgânicas no laboratório e no nosso organismo.
OBJETIVOS
Módulo 1
Reconhecer os hidrocarbonetos e suas propriedades
Módulo 2
Identificar os confôrmeros dos diversos alcanos e cicloalcanos e suas estabilidades
Módulo 3
Descrever as principais funções oxigenadas e nitrogenadas em química orgânica e suas principais características
Módulo 4
Identificar as principais funções sulfuradas e halogenadas da química orgânica e suas características mais relevantes
Introdução
Importância das classes de compostos
Neste tema, vamos conhecer as classes de compostos mais importantes da química orgânica, as maneiras de representar estruturas químicas, de forma que todos possam entendê-las, e as principais características dessas substâncias. Vamos aprender a correlacionar o nome de uma substância à sua estrutura química, além de compreender as diferenças tridimensionais em cada molécula e a forma como isso afeta sua estabilidade. Veremos a maneira pela qual os compostos feitos apenas por átomos de carbono e hidrogênio são nomeados, bem como as substâncias mais complexas, contendo átomos de oxigênio, nitrogênio, enxofre e halogênios.
Vamos aprender a importância dessas classes de compostos não só para a química, mas para a natureza, o nosso organismo e o desenvolvimento de tecnologias na nossa sociedade.
MÓDULO 1
Reconhecer os hidrocarbonetos e suas propriedades
Os hidrocarbonetos
A química orgânica apresenta uma enorme variedade de substâncias divididas em diversas classes de compostos químicos, sendo os hidrocarbonetos os mais simples dentre eles.
Hidrocarbonetos são compostos orgânicos formados exclusivamente por átomos de carbono e hidrogênio, podendo conter apenas ligações simples (alcanos), pelo menos uma ligação dupla (alcenos), pelo menos uma ligação tripla (alcinos), ou ainda serem compostos aromáticos.
Vamos estudar o que são esses compostos, suas propriedades e seus nomes mais à frente. Em primeiro lugar, no entanto, é importante que saibamos como representar suas estruturas químicas.

Representação das moléculas orgânicas
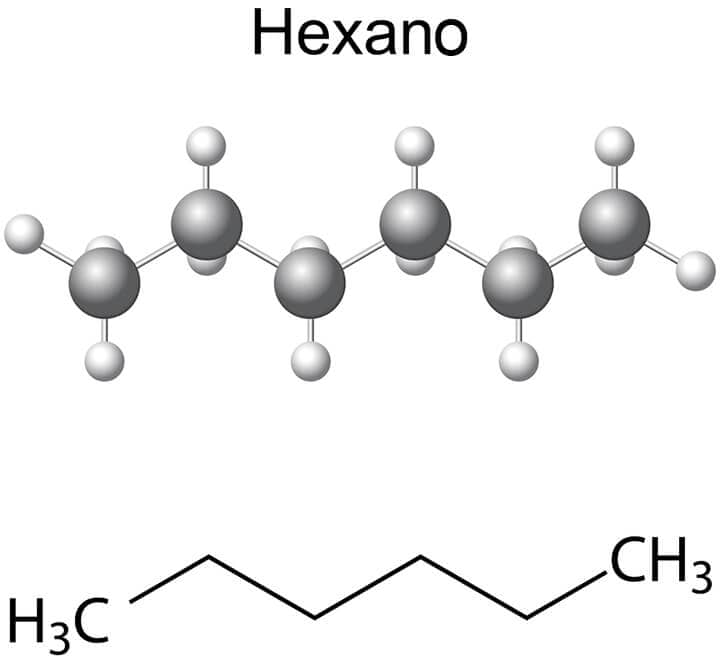
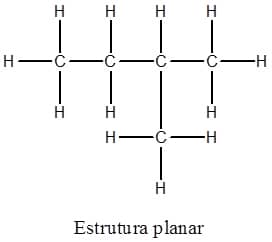
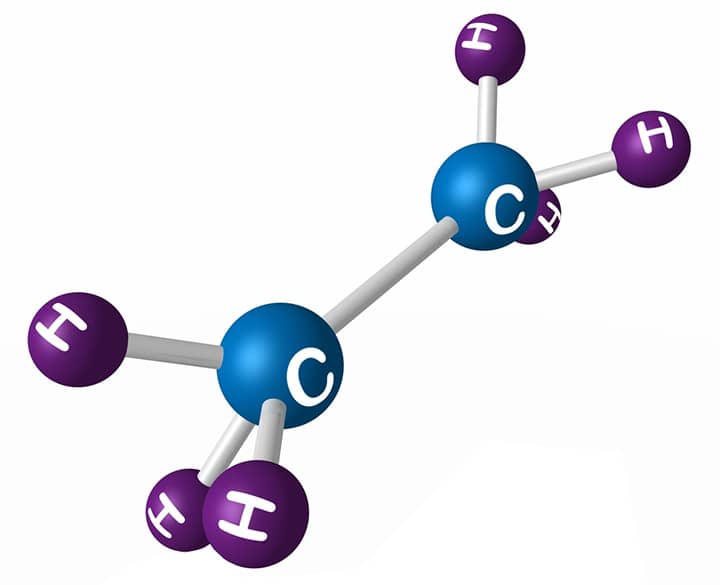
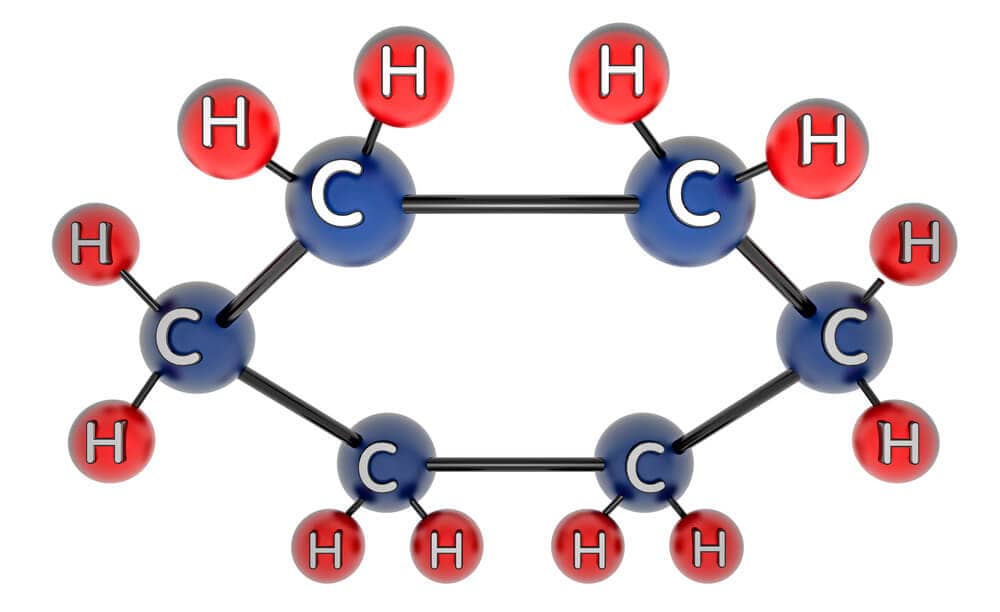
Existem várias maneiras de representar os compostos orgânicos. Em geral, as ligações covalentes entre os diferentes átomos são indicadas por linhas que os conectam. Um modo de representar seria através da estrutura planar, na qual cada um dos átomos é mostrado; porém, essa maneira é trabalhosa, entediante e, muitas vezes, acaba confundindo o leitor, em vez de facilitar o entendimento. A Figura 1 exemplifica esse tipo de representação (note que a ligação foi aumentada para permitir a representação dos átomos de hidrogênio sem que houvesse sobreposição).
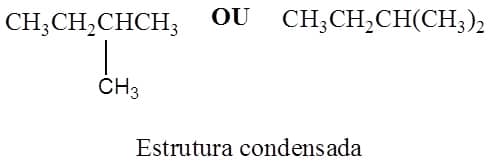
A segunda maneira de representação que veremos são as estruturas condensadas. Nesse tipo de estrutura, não há representação de todas as ligações covalentes presentes na molécula. Em vez disso, as ligações ficam subentendidas e faz-se uma representação mais simples utilizando CH3 para representar os átomos de carbono ligados a três átomos de hidrogênio, CH2 para representar aqueles ligados a dois átomos de hidrogênio e CH para átomos de carbono ligados a apenas um átomo de hidrogênio. Ramificações podem ou não ter a ligação covalente representada. Vamos ver o 2-metilbutano, mesma estrutura do composto da Figura 1, representado de forma condensada na Figura 2.
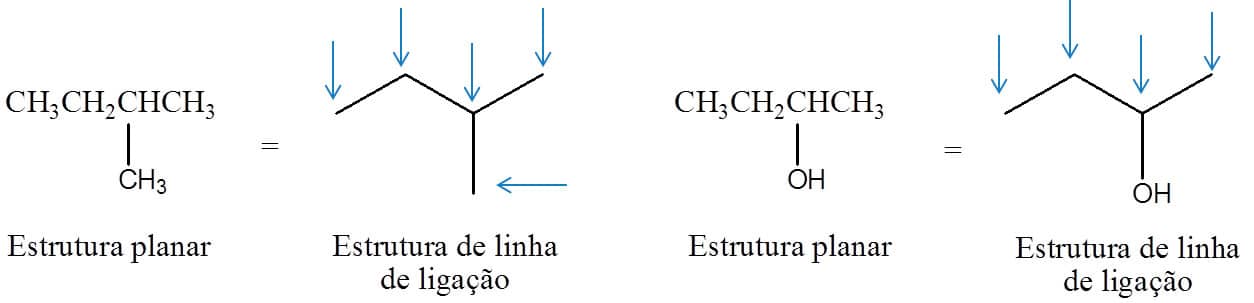
A forma mais simples de representar os compostos orgânicos, no entanto, é através da estrutura de linha de ligação. Nestas estruturas, os átomos de carbono são representados pelas pontas das linhas, e os hidrogênios ligados a eles ficam ocultos, respeitando o fato de que o átomo de carbono faz quatro ligações covalentes. Embora não seja necessário, os átomos de carbono e hidrogênio podem ser representados para evidenciar ou dar ênfase à parte da estrutura. Qualquer átomo que não seja de carbono ou hidrogênio deve ser obrigatoriamente representado. A Figura 3 traz dois exemplos:
As representações das estruturas de linha de ligação são, em geral, as mais utilizadas pela facilidade em desenhá-las e pela clareza, uma vez que há uma pequena quantidade de átomos evidenciados. Agora que já sabemos representar as estruturas orgânicas de maneira clara, vamos conhecer as diferentes classes de hidrocarbonetos, seus nomes e suas propriedades.
Alcanos
Alcanos são hidrocarbonetos compostos exclusivamente por carbono e hidrogênio e que contêm apenas ligações simples, ou seja, são compostos saturados. Sua fórmula estrutural segue a regra CnH2n+2, ou seja, um composto com um único carbono terá fórmula CH4, com dois carbonos C2H6, e assim sucessivamente. Vamos aprender a nomeá-los?
Nomenclatura de alcanos
A nomenclatura em química orgânica por muito tempo foi dada em homenagem a pessoas ou ao material do qual derivava o composto, como é o caso da ureia, presente na urina. Conforme a química evoluiu, no entanto, surgiu a necessidade de criar um parâmetro universal para nomear os compostos de maneira que todos fossem capazes de desenhar sua estrutura através do nome.
Várias tentativas foram feitas ao longo dos anos a fim de uniformizar os parâmetros, as medidas e os símbolos utilizados na química mundial e, hoje, temos a União Internacional de Química Pura e Aplicada.
Saiba mais
A IUPAC é uma organização internacional que é autoridade em determinar uma série de regras para a padronização da química, inclusive a nomenclatura de compostos. Como os alcanos são as estruturas com a nomenclatura mais simples na química orgânica, utilizaremos essa classe como exemplo para entender vários aspectos comuns a todos os compostos orgânicos.
É importante observar, no entanto, que, de tempos em tempos, a IUPAC reavalia o sistema de nomenclatura dos compostos orgânicos. Existem as recomendações de 1979, 1993 e, mais recentemente, de 2013. Aqui, procuramos seguir as recomendações mais recentes e, por isso, pode ser que, ao estudar por livro-texto ou outro material, haja divergências quanto à maneira de nomear alguns compostos.
Alcanos lineares
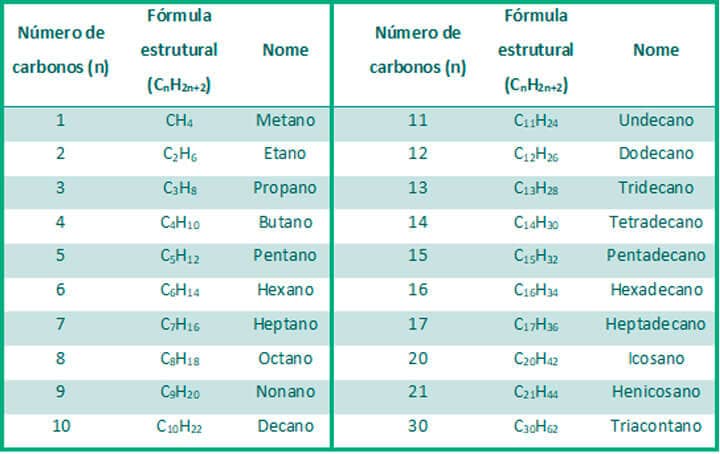
Vamos começar pelo fato de que o nome de todos os alcanos, sem exceção, terminará com o sufixo –ano. Em seguida, é necessário entender que a nomenclatura depende do número de carbonos da molécula e que eles são representados por radicais que derivam do latim e do grego e, por isso, podem soar pouco comuns a princípio. Compostos com um, dois, três, quatro e cinco carbonos terão, respectivamente, os seguintes radicais: met‒, et‒, prop‒, but‒ e pent‒. A Tabela 1 traz o nome do alcano linear e o número de carbonos em sua estrutura.
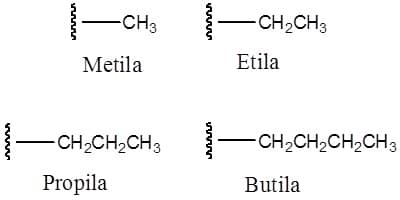
Existem ainda substituintes denominados grupo alquila. O grupo alquila é formado, essencialmente, por alcanos com um átomo de hidrogênio a menos, e apresenta os mesmos radicais de número de carbonos, porém com a terminação ‒ila (ou –il). Sendo assim, o CH3‒ derivado do metano é denominado metila, o CH3CH2‒ derivado do etano é etila e assim sucessivamente. A Figura 4 traz alguns exemplos (a linha ondulada mostra onde a ligação será formada).
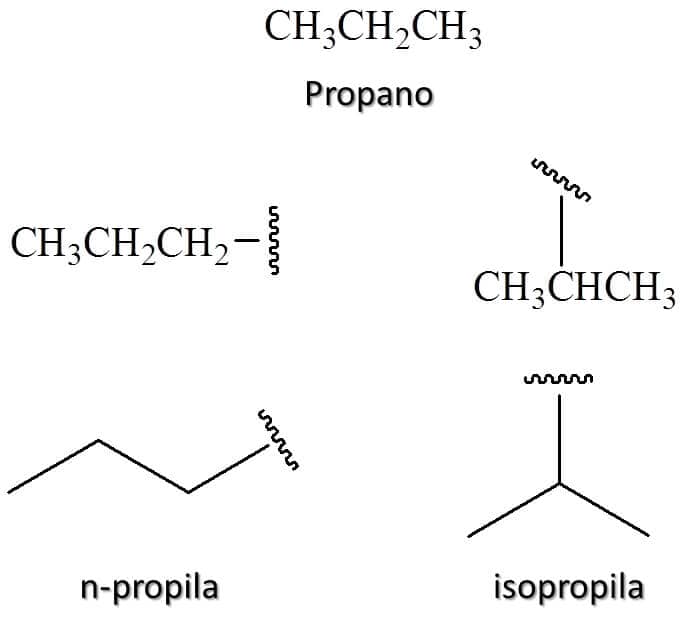
Os alcanos com três, quatro e cinco carbonos podem ainda perder um átomo de hidrogênio em mais de uma posição dando origem a diferentes grupos alquila. A IUPAC aceita alguns desses nomes, que são frequentemente utilizados no cotidiano da química e, portanto, serão apresentados aqui. Vimos na Figura 4 a propila formada pela perda de um hidrogênio na ponta da cadeia, porém um hidrogênio do carbono central também pode ser perdido, dando origem ao grupo isopropila (Figura 5).
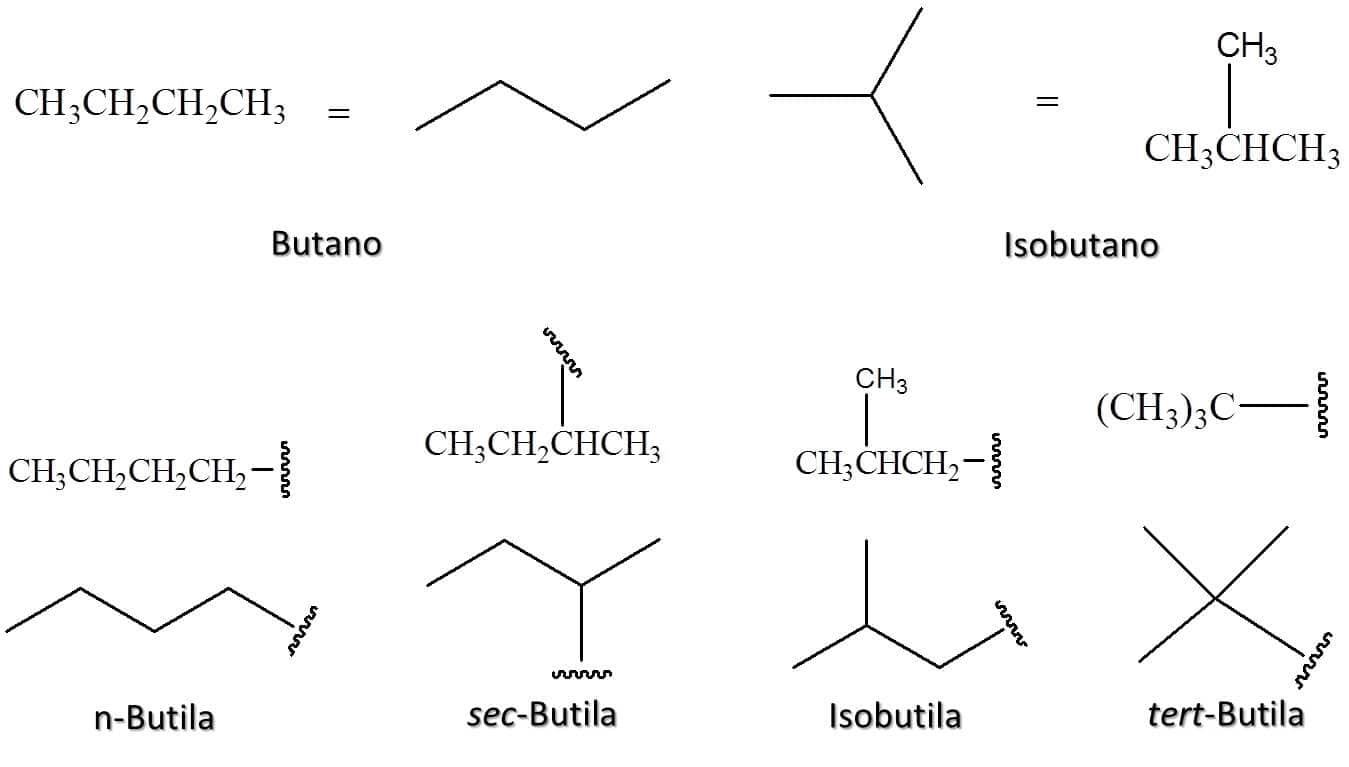
Da mesma forma, o butano e o isobutano podem perder um hidrogênio em quatro posições diferentes ao todo, dando origem a quatro grupos alquila distintos, a n-butila, a isobutila, a sec-butila e a tert-butila. A Figura 6 traz as estruturas desses grupos.
O grupo alquila será particularmente importante para a nomenclatura dos compostos ramificados que veremos a seguir.
Alcanos ramificados
Para alcanos ramificados, devemos obedecer a uma série de regras que analisaremos individualmente, etapa a etapa.
1ª etapa: identificar a cadeia principal da molécula, ou seja, aquela com o maior número de carbonos lineares. O número de carbonos nessa cadeia determinará o radical utilizado no nome do composto (met, et, prop, but etc.). É importante observar que nem sempre a cadeia principal estará óbvia. A Figura 7 traz exemplos:
marcada em rosa e substituintes em preto.
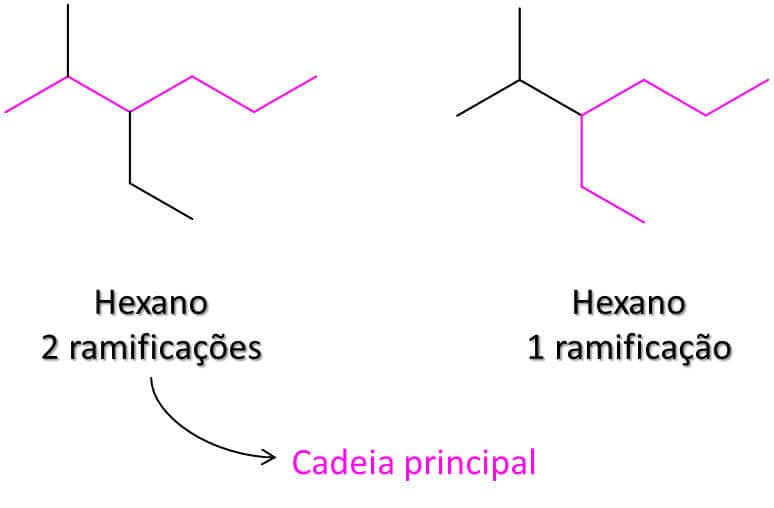
Pode ser que haja duas cadeias de mesmo tamanho. Neste caso, como decidir qual delas é a principal? Deve-se considerar como principal aquela com o maior número de ramificações, ou seja, se uma tem apenas uma ramificação e a outra tem duas, a última é a cadeia principal. Veja a Figura 8:
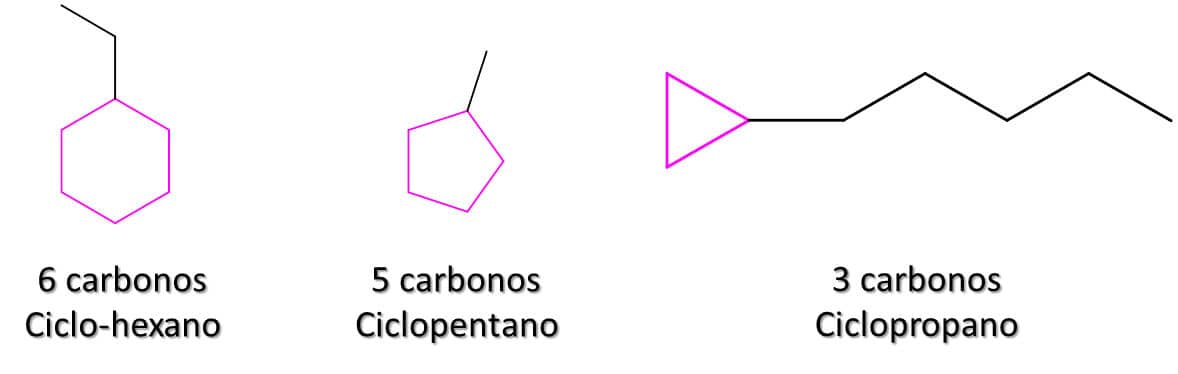
E se os carbonos formarem um anel, levando a um composto cíclico? Neste caso, o prefixo “ciclo” deverá ser adicionado antes do nome da cadeia principal. Um hexano cíclico, por exemplo, é, então, um ciclo-hexano, um pentano cíclico é um ciclopentano, e assim por diante. É importante notar que o anel tem preferência sobre a cadeia carbônica, mesmo que tenha menor número de carbonos (nos casos em que ambos são formados pelos mesmos elementos). Isso quer dizer que, se houver dez carbonos em cadeia aberta ligados a um ciclo-hexano, o composto será um ciclo-hexano substituído. Veja os exemplos da Figura 9.
2ª etapa: numerar os carbonos da cadeia principal. Essa numeração começa no carbono mais próximo ao substituinte. A Figura 10 exemplifica a numeração:
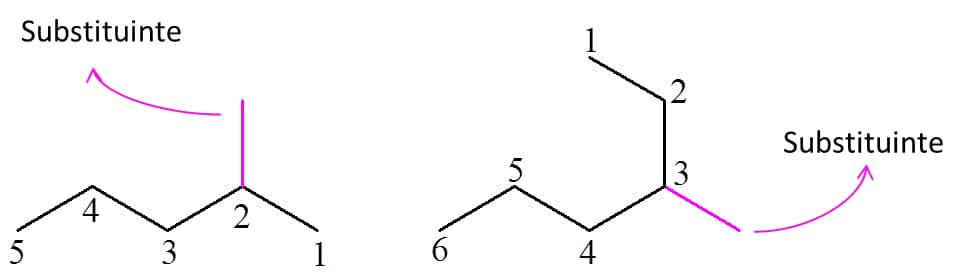
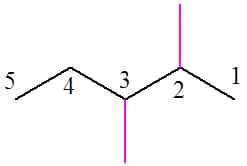
E se o composto tiver mais de uma ramificação? Comece a numeração pela extremidade que forneça as posições das ramificações nos carbonos de menor número possível. Veja o exemplo da Figura 11:
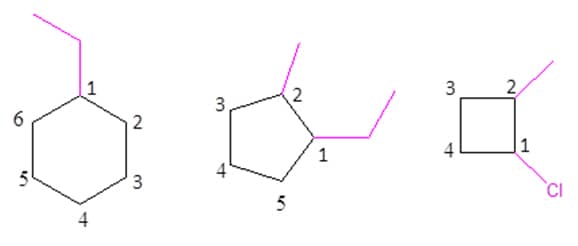
Caso o composto seja cíclico, comece a contar os carbonos de maneira que aquele que apresenta a substituição seja o número um. Caso haja mais de um substituinte, numere os carbonos de maneira que eles estejam sempre no carbono de menor número, assim como nos hidrocarbonetos de cadeia aberta. Se for possível que dois substituintes apresentem a mesma numeração, determine o número do carbono a partir da ordem alfabética. Os exemplos na Figura 12 vão facilitar seu entendimento.
3ª etapa: localize o(s) substituinte(s) e o número do carbono ligado a eles. Os grupos alquila que estiverem ligados à cadeia principal perdem a letra “a” quando passam a fazer parte do nome do composto, ou seja, metila vira metil, etila vira etil, e assim por diante. A Figura 13 mostra a identificação.
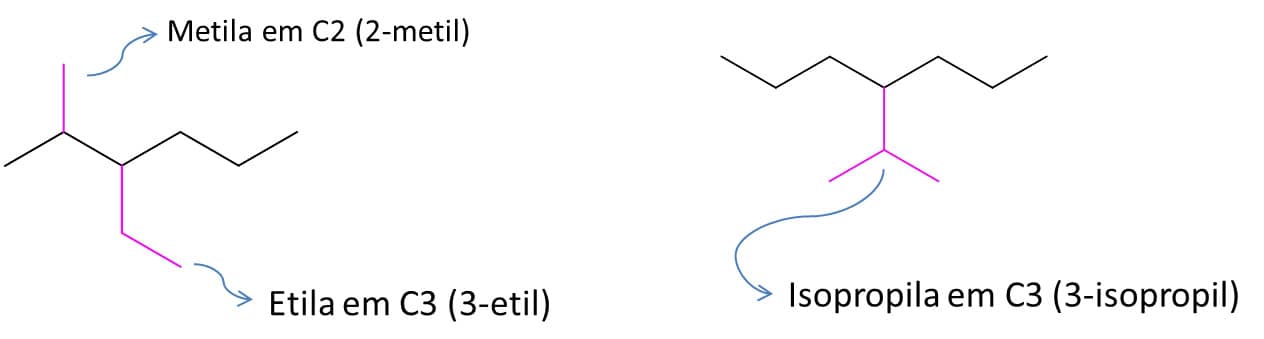
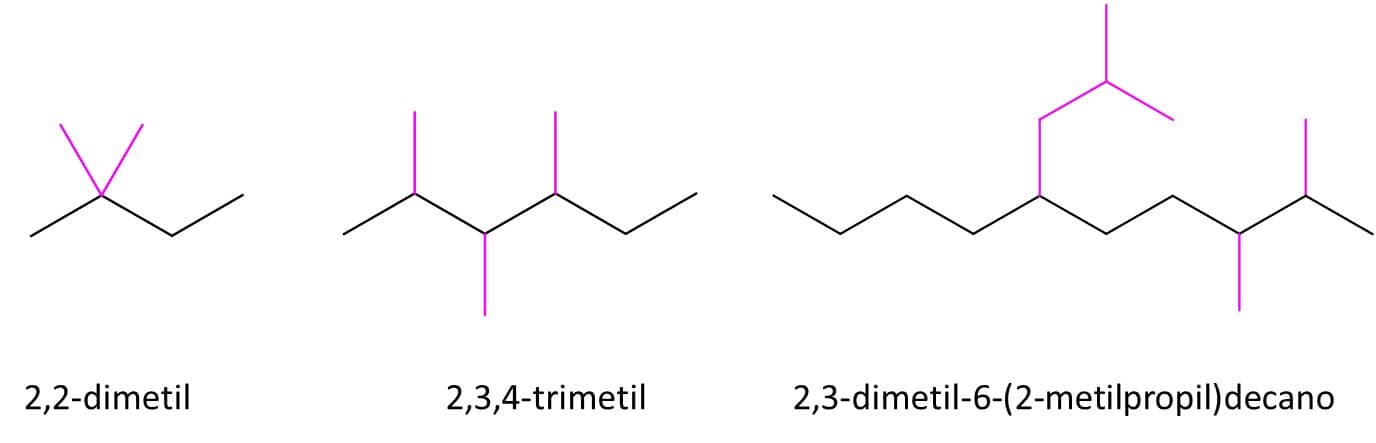
Se dois substituintes estiverem ligados ao mesmo carbono, eles receberão o número correspondente àquele carbono, e este número aparecerá duas vezes no nome. Além disso, se um composto tiver o mesmo substituinte ligado a carbonos diferentes, utilizam-se os prefixos di, tri, tetra etc. para nomeá-los, e o número se repete quantas vezes forem necessárias. Quando o substituinte é grande e não pode ser nomeado como um dos grupos alquila que vimos antes, trate-o como se fosse um composto à parte e ponha o nome entre parênteses. Na Figura 14, temos o exemplo do substituinte “2-metilpropil”.
Veja a Figura 14 para entender melhor:
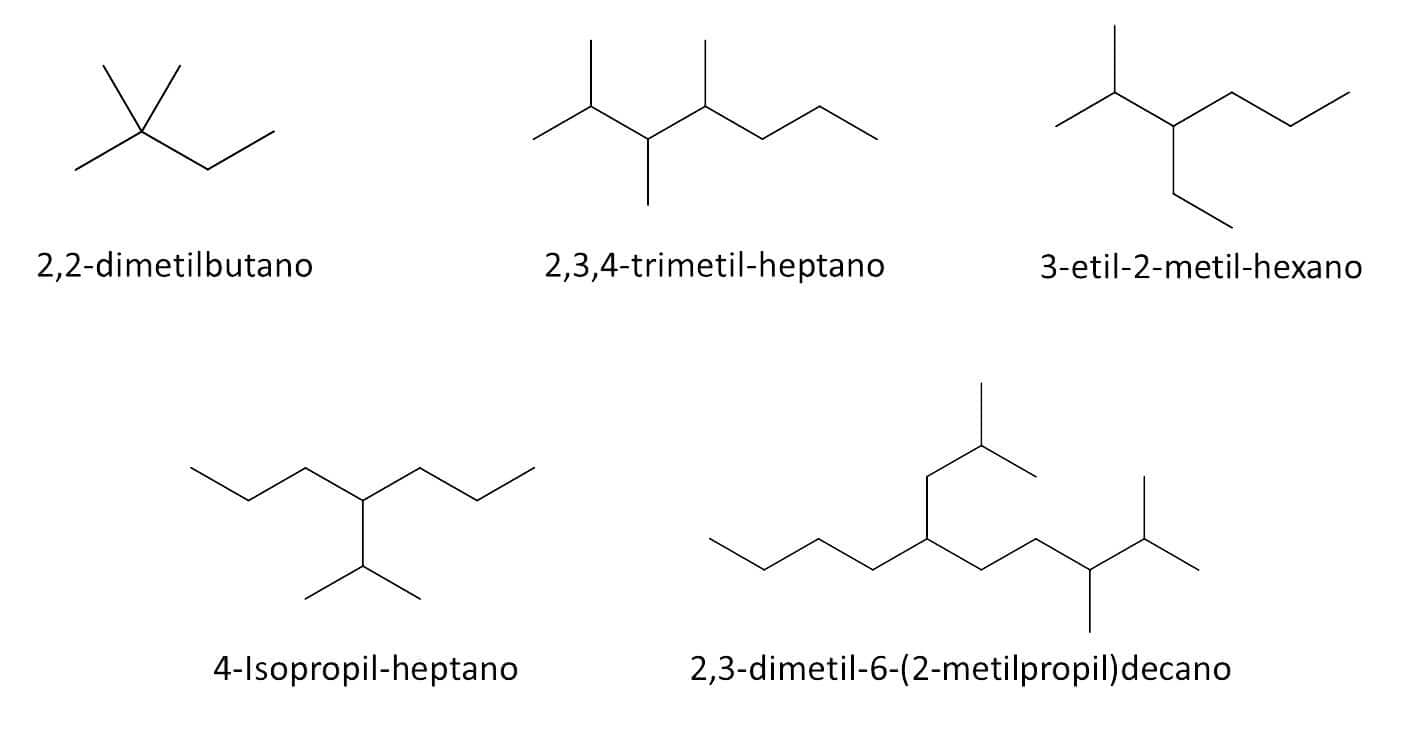
4ª etapa: escreva o nome do composto como se fosse uma única palavra. Não há espaços em nomes de compostos orgânicos. Os números devem ser separados entre si por vírgulas, e hifens separam as palavras dos números. A localização e nome dos substituintes (Etapa 3) aparecem primeiro e, em seguida, o nome do alcano da cadeia principal. No caso de compostos com vários substituintes, eles aparecem no nome do composto em ordem alfabética (não são considerados para a ordem alfabética os prefixos di, tri etc. nem os prefixos sec- e tert-). A Figura 15 traz alguns compostos com seus respectivos nomes seguindo as regras IUPAC:
Propriedades dos alcanos
Os alcanos eram também conhecidos como parafinas devido à sua baixa afinidade a outros compostos. Essa característica é importante e permite que os alcanos sejam muito utilizados como solventes apolares em laboratórios. No entanto, essa classe de compostos é capaz de reagir com oxigênio, halogênios e algumas outras substâncias se as condições forem ideais.
A reação entre alcanos e oxigênio é particularmente importante, pois permite a geração de energia. Essas reações são parte de nosso cotidiano quando acendemos o fogão ou dirigimos nossos carros e são chamadas de combustão.
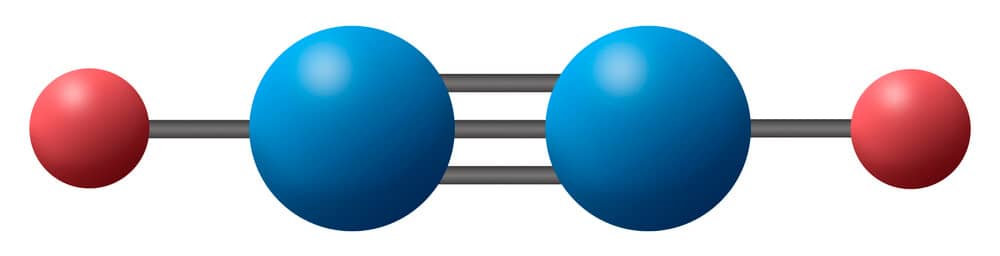
O butano e o propano são os principais componentes do gás de cozinha, e o metano é o principal componente do gás natural, enquanto a gasolina é uma mistura complexa de alcanos. A reação entre o metano e o oxigênio molecular é mostrada no Esquema 1, bem como a enorme quantidade de energia liberada.
Quanto aos pontos de ebulição e fusão, essas são propriedades que apresentam relação direta com o tipo de força intermolecular que os compostos fazem. No caso dos alcanos, essas forças são muito fracas e provêm de pequenas variações de distribuição nas nuvens eletrônicas das moléculas, levando a pequenos dipolos temporários. Isolados, esses dipolos são muito fracos, porém uma grande quantidade deles gera interação suficiente para que determinada substância permaneça coesa.
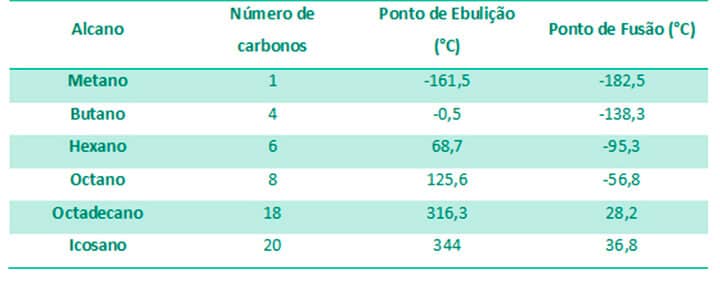
Isso quer dizer que, quanto maior a cadeia carbônica de um alcano, maior seu ponto de ebulição e de fusão, como podemos ver na Tabela 2. À temperatura ambiente (25°C), alcanos de até quatro carbonos são todos gases, o que justifica o uso do propano e do butano como gás de cozinha, por exemplo. Do pentano ao heptadecano, todos são líquidos e, por isso, utilizados como combustível na gasolina ou solventes em laboratórios. Alcanos com mais de 18 carbonos são sólidos e podem ser encontrados na parafina das velas, por exemplo.
O aumento no número de ramificações da cadeia, por outro lado, faz com que os pontos de fusão e ebulição sejam mais baixos, pois diminuem a área superficial dos compostos e prejudicam as interações entre as moléculas. O pentano, por exemplo, tem ponto de ebulição 36°C, enquanto o isopentano (2-metilbutano), também com cinco carbonos, tem ponto de ebulição igual a 27,8°C.
Para os cicloalcanos, a tendência no ponto de ebulição se mantém: quanto maior o anel, maior o ponto de ebulição. Além disso, seus pontos de ebulição e fusão são mais elevados que os de alcanos de cadeia aberta com o mesmo número de carbonos. O hexano, por exemplo, tem ponto de ebulição igual a 68,7°C, enquanto o do ciclo-hexano é 80,7°C. Já o octano tem ponto de ebulição igual a 125,6°C, enquanto o do ciclo-octano é 149°C. O ponto de fusão, no entanto, não segue tendência nenhuma, porque as diferentes formas dos cicloalcanos alteram a maneira como seus cristais estão empacotados, e essa característica é importante para o valor do ponto de fusão.
Os alcanos compõem a classe que apresenta menor densidade entre todos os compostos orgânicos, fazendo com que os mesmos flutuem em água, de maneira que quando ocorrem vazamentos de petróleo, por exemplo, vemos as manchas flutuando na superfície da água.
Alcenos
Alcenos são hidrocarbonetos que apresentam pelo menos uma dupla ligação em sua estrutura. A presença dessa ligação permite que os alcenos sofram reações de adição, oxidação e redução, por exemplo, sendo bem mais reativos que os alcanos.
Como dissemos antes, a nomenclatura de todos os compostos daqui para a frente serão baseadas nas regras vistas anteriormente. Para dar nome a esses compostos, as regras são as mesmas de antes, com pequenas variações:
- A terminação dos alcenos é sempre - eno.
- A cadeia principal será a maior cadeia carbônica, mesmo que esta não inclua a dupla ligação. Caso a cadeia principal não inclua a dupla ligação, o composto será nomeado como um alcano substituído.
- Os carbonos serão numerados a partir da extremidade mais próxima à dupla ligação. Se a dupla ligação estiver à mesma distância das duas extremidades, escolhe-se o carbono mais próximo à ramificação.
- A posição da dupla ligação deve ser indicada no nome do composto logo antes do nome da cadeia principal e pelo carbono de menor número.
- Se houver mais de uma dupla ligação, o composto deverá ser nomeado como dieno, trieno, e assim sucessivamente.
- Cicloalcenos deverão ter seus carbonos numerados de forma que a dupla ligação esteja sempre entre os carbonos um e dois e que os substituintes tenham o menor número possível.
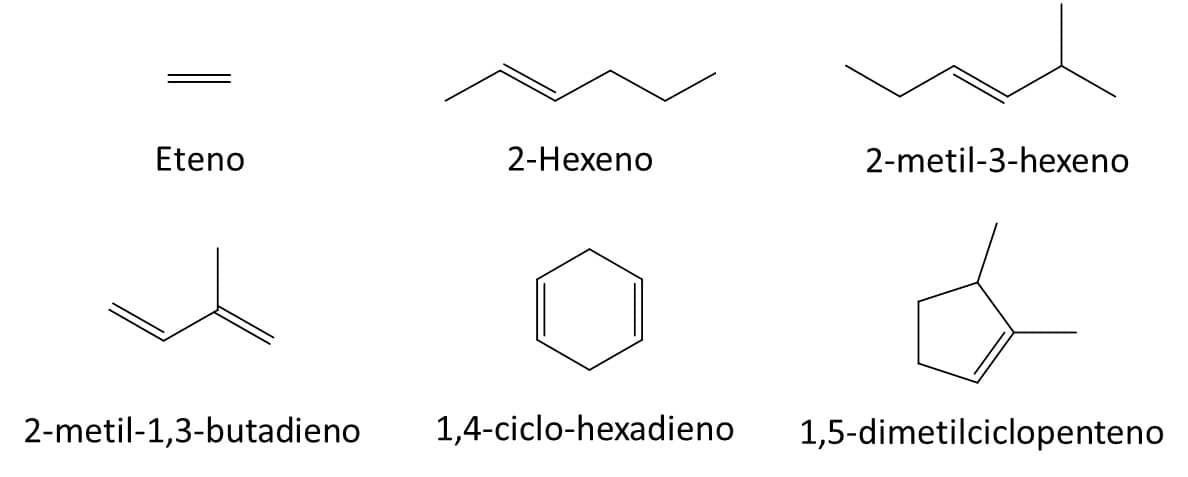
A Figura 16 traz alguns exemplos de alcenos e seus respectivos nomes.
As propriedades físico-químicas dos alcenos, como ponto de fusão e ebulição, seguem as mesmas tendências que vimos anteriormente para os alcanos. O eteno, o menor alceno possível, por exemplo, apresenta ponto de ebulição igual a -104°C, enquanto o do 1-hexeno é 63,4°C e o do ciclo-hexeno é 83°C.
Alcinos
Alcinos são hidrocarbonetos que apresentam pelo menos uma tripla ligação em sua estrutura. Assim como os alcenos, os alcinos são mais reativos que os alcanos, podendo participar de reações de adição, oxidação, redução e apresentando até certo caráter ácido devido à presença da tripla ligação. A nomenclatura desses compostos também segue os princípios determinados para os alcanos, com algumas pequenas diferenças:
- A terminação dos alcinos é sempre - ino.
- A cadeia principal será a maior cadeia carbônica, mesmo que a tripla ligação não esteja incluída. No caso da tripla ligação não fazer parte da cadeia principal, o composto deverá ser nomeado como um alcano substituído.
- A numeração dos carbonos começa pelo que estiver mais próximo à tripla ligação, de forma que os carbonos tenham os menores números possíveis.
- Se houver mais de uma tripla ligação, eles deverão ser denominados di-inos, tri-inos, e assim por diante.
- Se houver duplas e triplas ligações na mesma estrutura, a numeração dos carbonos deve começar pela extremidade que estiver mais próxima a uma das duas ligações múltiplas. Caso as ligações dupla e tripla estejam à mesma distância das extremidades, a contagem se inicia pela extremidade mais próxima à dupla ligação.
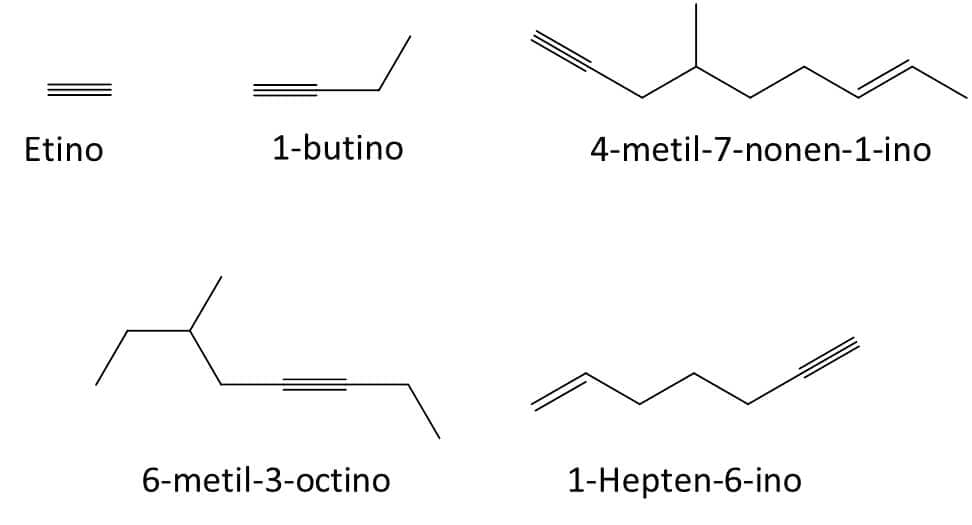
As propriedades físico-químicas dos alcinos seguem a mesma tendência dos alcanos e alcenos, ou seja, os pontos de fusão e ebulição aumentarão com o tamanho da cadeia, e ramificações diminuirão esses valores. A Figura 17 traz alguns exemplos de alcinos e seus respectivos nomes.
Agora que sabemos dar nome e identificar os alcanos, alcenos e alcinos, vamos ver, no módulo 2, como os alcanos se comportam no espaço e sua estabilidade.
O especialista Luiz Américo Mota faz uma apresentação, por meio de exemplo, da nomenclatura e das propriedades dos hidrocarbonetos:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar os confôrmeros dos diversos alcanos e cicloalcanos e suas estabilidades
Estereoquímica de alcanos e cicloalcanos
Até o momento, vimos como nomear os hidrocarbonetos, a classe de compostos orgânicos mais simples e suas propriedades. Quando falamos desses compostos, indicamos suas estruturas no plano do papel, ou seja, em duas dimensões. Na vida real, por outro lado, esses compostos existem em três dimensões, e seus átomos podem variar de posição espacial. A estereoquímica estuda exatamente essas variações tridimensionais que podem ocorrer e a forma como elas afetam as propriedades dos compostos, o que é particularmente importante no meio biológico.
Dois grupos conectados por uma ligação simples podem girar em torno do eixo da ligação de maneira que os átomos vão assumir posições diferentes no espaço e darão origem a diferentes confôrmeros (isômeros conformacionais).
Esses confôrmeros têm exatamente a mesma conexão entre os átomos, modificando apenas a geometria, e se interconvertem tão rapidamente que, em geral, não é possível isolá-los separadamente.
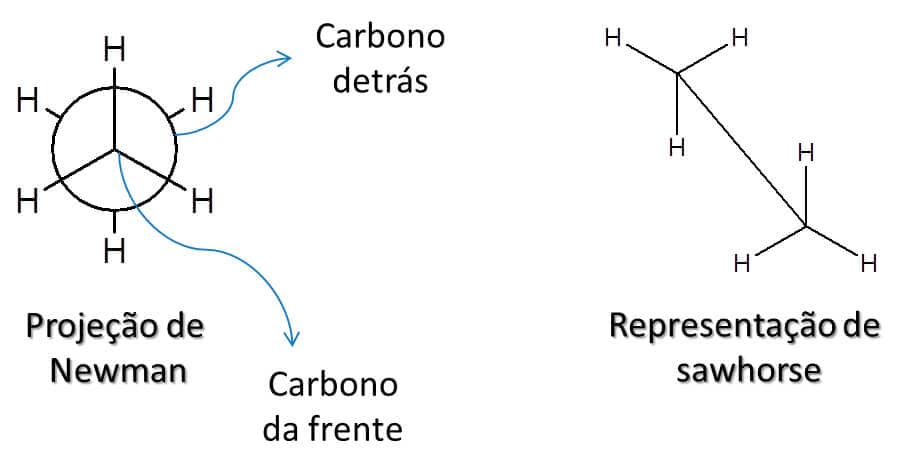
Existem duas maneiras de representar os confôrmeros: através das representações de sawhorse (em português, cavalete) ou das projeções de Newman, sendo essa última a mais utilizada.
Sawhorse
Nas representações de sawhorse, é como se estivéssemos vendo a estrutura de linhas de ligação de uma maneira tridimensional.
Newman
Já na projeção de Newman, é como se tivéssemos colocado a ligação simples transversalmente a nossos olhos e estivéssemos encarando o carbono de frente, de modo que o outro carbono fica atrás.
A Figura 18 exemplifica as duas representações.
Sabendo como funcionam as representações, vamos ver a estabilidade e os diferentes confôrmeros dos alcanos.
Conformações do etano
O etano é o alcano mais simples em que podemos fazer uma análise conformacional, e começaremos nossa análise por ele. Em geral, dizemos que as ligações simples permitem aos átomos conectados ter rotação livre em torno do eixo da ligação. No entanto, sabemos pela prática que existe uma pequena barreira de rotação que torna alguns confôrmeros mais estáveis.
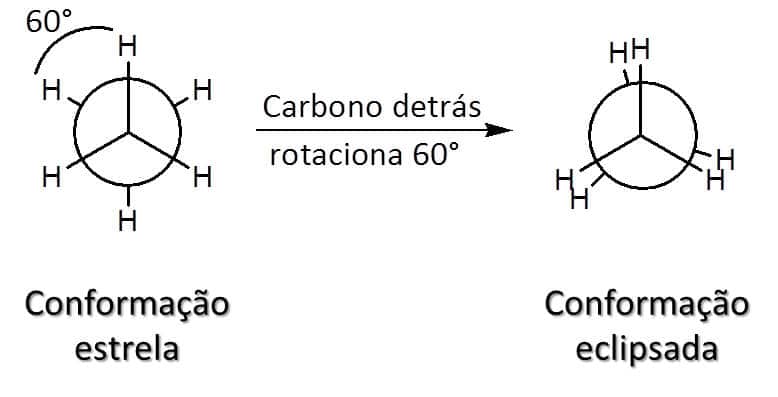
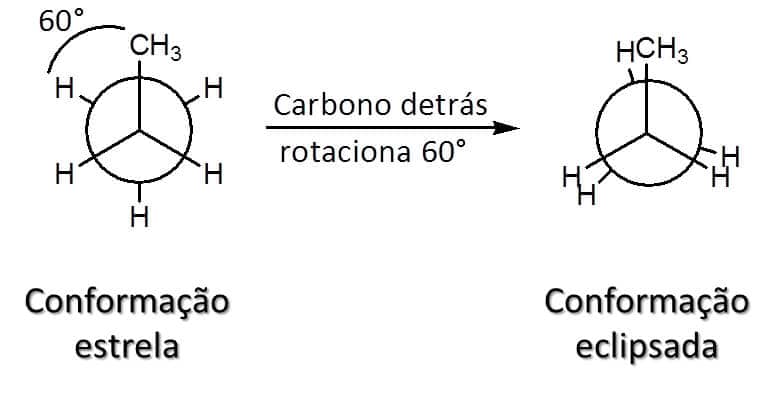
No caso do etano, existem duas possibilidades de conformação: estrela (ou alternada), na qual os átomos estão tão longe quanto possível uns dos outros, levando à menor energia (mais estável), e eclipsada, em que os átomos estão o mais próximo possível uns dos outros, levando a um estado de maior energia (menos estável). A Figura 19 mostra as conformações possíveis.
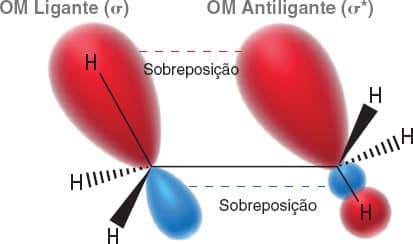
A conformação eclipsada é menos estável, pois apresenta a tensão de torção que confere 12kJ/mol a mais de energia para esse confôrmero. Dois fatores contribuem para essa diferença de energia entre os confôrmeros. O primeiro é a hiperconjugação, uma sobreposição favorável dos orbitais ligantes e antiligantes dos carbonos, que estabiliza melhor a conformação estrela, diminuindo sua energia (Figura 20).
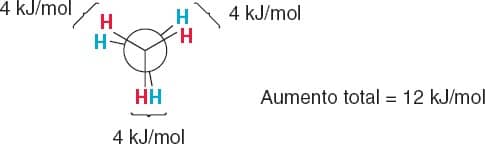
Segundo, a conformação eclipsada apresenta ainda um pequeno impedimento estérico, uma vez que as nuvens eletrônicas das ligações C-H estão mais próximas umas das outras. Como sabemos que todas as ligações C-H do etano são iguais, podemos estabelecer que cada interação hidrogênio-hidrogênio na conformação eclipsada é responsável por um aumento de 4 kJ/mol no nível de energia da estrutura (Figura 21).
Conformações do propano
O propano é um alcano de três carbonos e também pode apresentar as conformações estrela e eclipsada. No entanto, o nível de energia da conformação eclipsada é ligeiramente maior do que vimos para o etano, chegando a 14 kJ/mol. Isso se dá porque o propano, por apresentar três átomos de carbono, terá duas interação hidrogênio-hidrogênio de 4 kJ/mol cada uma, mas terá também uma interação entre uma ligação C-C (ligação entre C2 e C3 do propano) e uma ligação C-H que aumenta a tensão de torção para 6 kJ/mol. Veja a figura 22 as conformações estrela e eclipsada do propano.
Conformações do butano
O butano apresenta quatro carbonos em sua estrutura, e sua análise conformacional é um pouco mais elaborada que as dos compostos vistos anteriormente. Vamos analisar a ligação entre os carbonos dois e três (C2 e C3) para entender um pouco melhor sua disposição espacial.
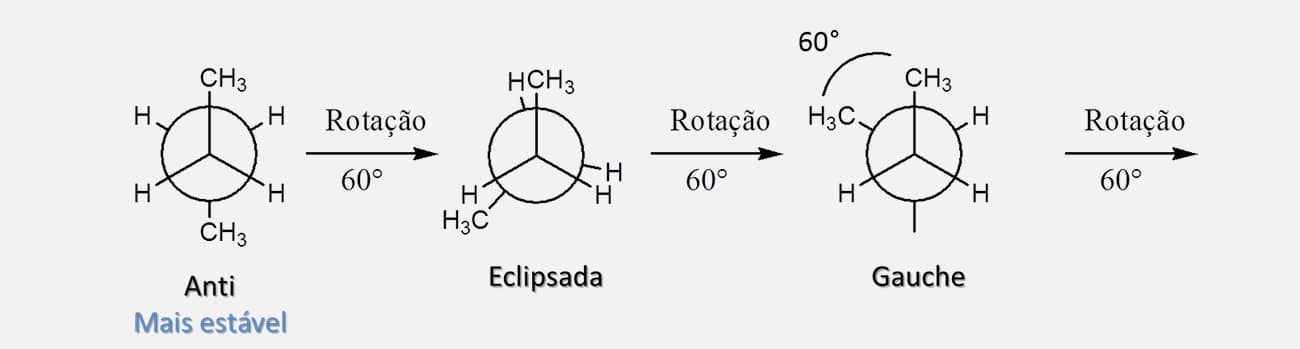
ANTI
confôrmero estrela onde as duas metilas terminais estão tão distantes quanto possível uma da outra.
GAUCHE
confôrmero estrela na qual as duas metilas terminais estão a 60° uma da outra.
ECLIPSADA
confôrmero eclipsado que conta com variações, uma vez que é possível ter a interação entre as duas metilas terminais ou entre as metilas e hidrogênios, além de uma hidrogênio-hidrogênio.
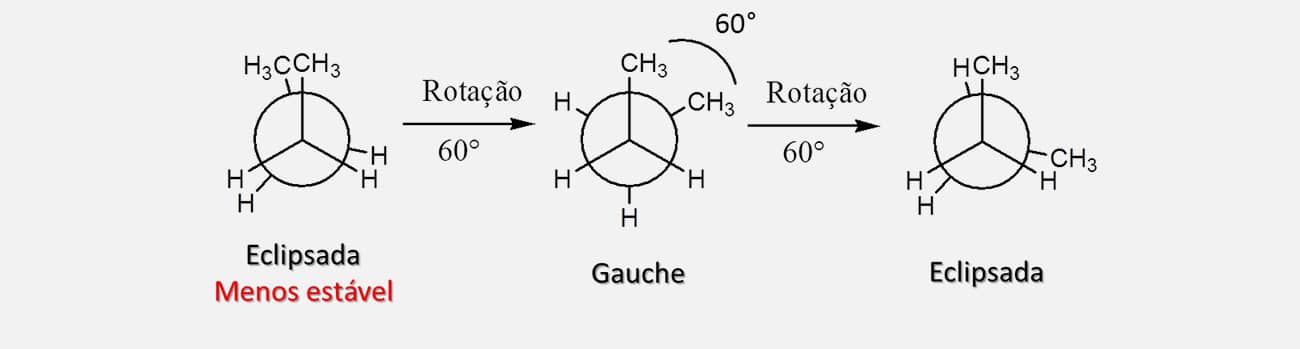
A Figura 23 mostra todos os possíveis confôrmeros do butano considerando rotações de 60° por vez no carbono de trás.
Como é possível ver na Figura 23, a forma anti é a de menor energia, mais estável, e a forma eclipsada, em que as duas metilas estão próximas, é a de maior energia, menos estável. Isso acontece porque, quando temos a interação entre dois grupos metila, o impedimento estérico se soma consideravelmente à tensão de torção, elevando a energia e diminuindo a estabilidade da estrutura. As formas gauche e eclipsada em que as duas metilas estão afastadas apresentam estados de energia intermediários, sendo a forma gauche ainda menos energética (e, portanto, mais estável) que qualquer uma das formas eclipsadas.
Atenção
É importante ainda pontuar que, quando falamos em maior ou menor estabilidade, não quer dizer que o composto fique apenas em uma das conformações. Os valores de energia são baixos o suficiente para que em temperatura ambiente seja possível ultrapassar essas barreiras energéticas, fazendo com que o composto constantemente mude de confôrmero.
No entanto, é provável que em um dado momento muito mais moléculas anti sejam encontradas em relação às eclipsadas, por exemplo. Além disso, o modelo de análise conformacional visto para o butano se aplica a alcanos de cadeia aberta ainda maiores. Ou seja, para qualquer alcano de cadeia aberta, a conformação estrela com grupos volumosos anti um ao outro será a mais estável.
Cicloalcanos: estabilidade do anel
Assim como nos alcanos de cadeia aberta, as estabilidades dos cicloalcanos são diferentes entre si devido à tensão do anel formado. Existem essencialmente três motivos pelos quais um anel apresenta tensão:
Vamos analisar os casos individualmente, para entender como esses fatores afetam a estabilidade.
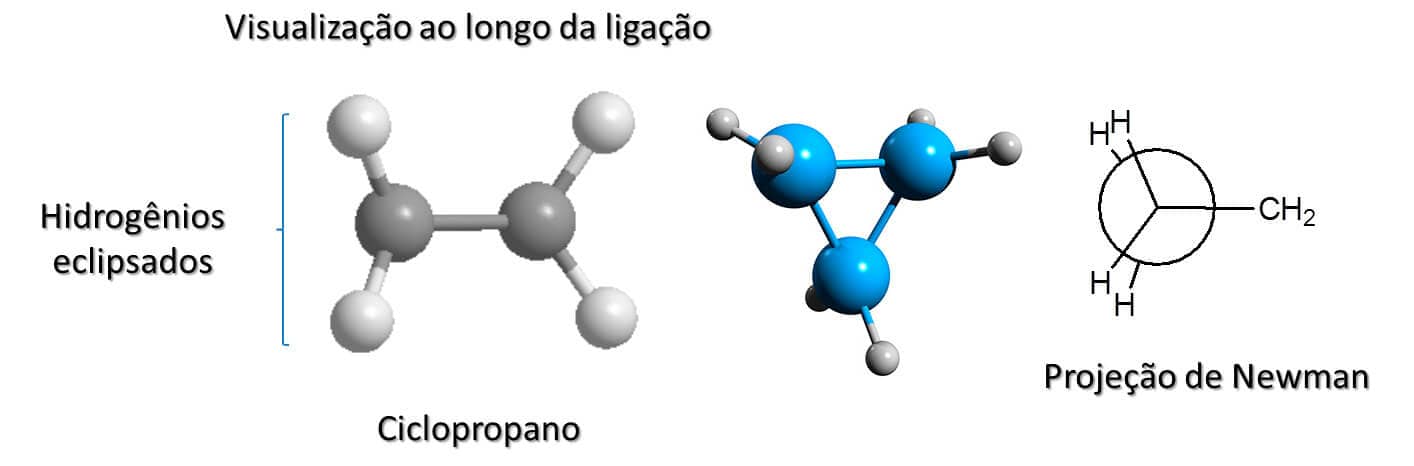
Ciclopropano
Por ser formado por apenas três átomos de carbono, o ciclopropano é plano e tem a forma de um triângulo. Isso quer dizer que seus ângulos internos têm exatamente 60° cada um, o que leva a uma imensa tensão angular. A existência do ciclopropano é possível, no entanto, pois ele apresenta ligações angulares, ou seja, os orbitais dos carbonos que fazem a ligação sigma não se sobrepõem completamente, apenas em pequenas partes e a certo ângulo. Isso faz com que a molécula apresente ligações mais fracas e maior energia potencial em relação a outros cicloalcanos.
Embora a tensão angular seja responsável pela maior parte da energia desse composto, há ainda uma pequena parte que deriva da tensão de torção, uma vez que seus hidrogênios estão eclipsados. A Figura 24 mostra a projeção de Newman e a estrutura tridimensional do ciclopropano para facilitar a visualização. Utilizando o modelo de bola e linha, fica claro que, ao olharmos para dois carbonos, transversalmente à ligação que os une, o de trás fica omitido e se torna evidente o quão eclipsados estão os hidrogênios dessa estrutura.
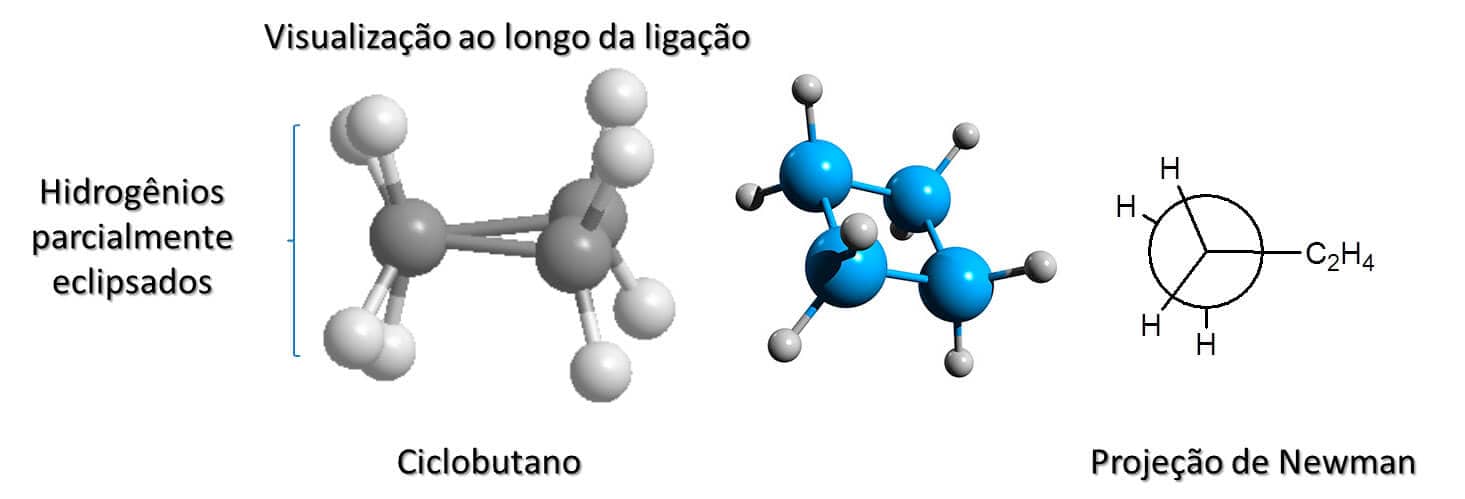
Ciclobutano
O ciclobutano, diferentemente do ciclopropano, não é plano, mas ligeiramente dobrado. Um de seus carbonos está 25° acima do plano dos demais e, embora isso aumente a tensão angular, diminui a tensão de torção do anel, pois permite que os hidrogênios do composto não fiquem completamente eclipsados.
A Figura 25 mostra a projeção de Newman do ciclobutano, bem como a visualização em três dimensões do que seria a projeção de Newman. Utilizando o modelo de bola e linha, fica claro que, ao olharmos para dois carbonos, transversalmente à ligação que os une, o de trás fica omitido e é possível ver que os hidrogênios estão apenas parcialmente eclipsados.
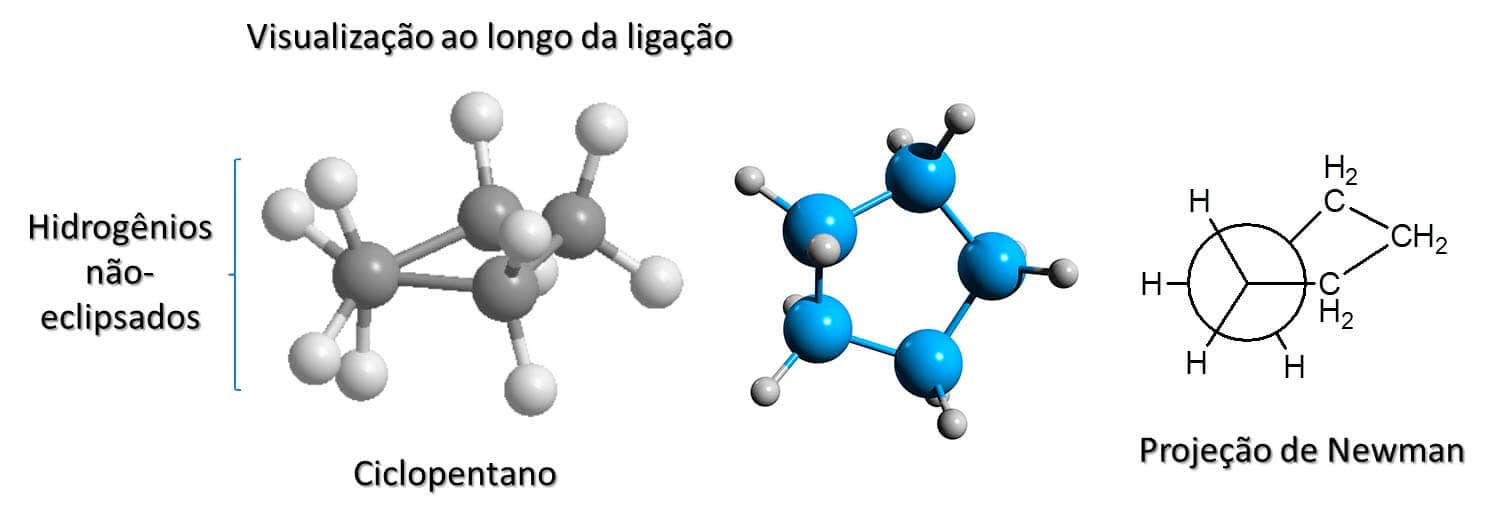
Ciclopentano
Como falamos anteriormente, o ângulo que um carbono 3 sup faz em uma geometria tetraédrica é de 109,5° e, quanto mais longe desse valor, maior a tensão angular do composto. O ciclopentano tem ângulos internos de 108°, ou seja, sua tensão angular é praticamente nenhuma, e ele poderia ser planar. No entanto, a planaridade levaria a um aumento na tensão de torção, uma vez que todos os hidrogênios da molécula estariam eclipsados. Para evitar esse aumento de energia, o pentano tem um de seus carbonos fora do plano, o que diminui a tensão de torção, uma vez que quase todos os hidrogênios estarão em conformação estrela com os demais (Figura 26).
Ciclo-hexano
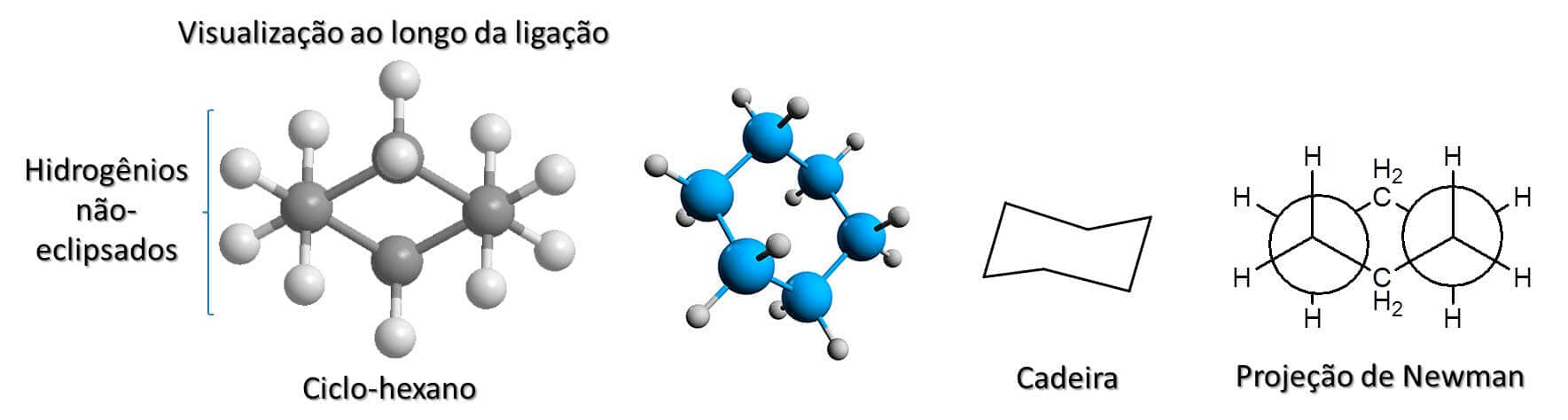
O ciclo-hexano é o mais estável entre todos os cicloalcanos que vimos até o momento. Seus ângulos internos têm 109,5°, ou seja, exatamente o mesmo ângulo presente na geometria tetraédrica, o que faz com que o ciclo-hexano não apresente tensão angular. Assim como já vimos nos outros cicloalcanos, com exceção do ciclopropano, o hexano não é plano e pode assumir diversas conformações. As três mais importantes são a conformação cadeira, a bote e a bote torcido.
Dentre essas três conformações, a mais estável é a cadeira, na qual, além de não haver tensão angular, também não há tensão de torção, uma vez que todos os hidrogênios estão em conformação estrela em relação a seus vizinhos. A Figura 27 ajuda a visualizar melhor essa conformação.
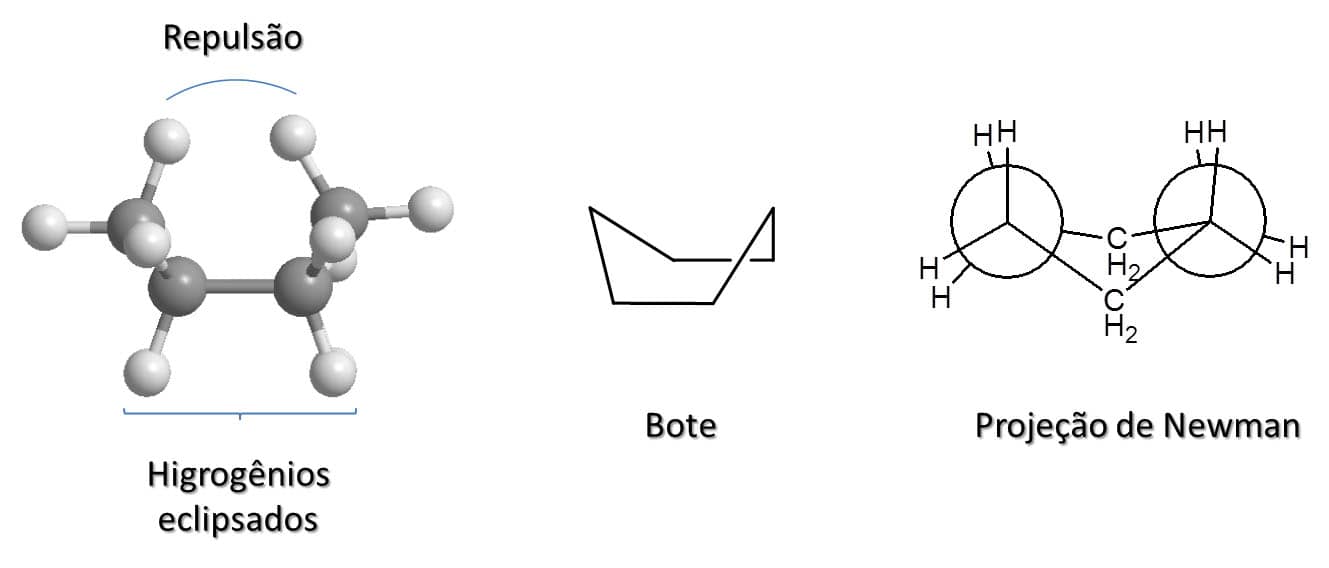
A outra possibilidade de conformação para o ciclo-hexano é a conformação bote, a menos estável das três que citamos anteriormente. Ela tem 30kJ/mol a mais de energia que a cadeira, e isso se deve à tensão de torção e a um impedimento estérico.
Comentário
Na conformação bote, os hidrogênios estão todos eclipsados, o que gera a tensão de torção, e, além disso, os hidrogênios no carbono um e no carbono quatro estão próximos o suficiente para que haja repulsão entre eles, ou seja, impedimento estérico.
A Figura 28 traz uma visualização 3D ao longo da ligação carbono-carbono para que possamos visualizar os hidrogênios eclipsados e a proximidade dos hidrogênios que leva à repulsão, além da estrutura de linhas e da projeção de Newman.
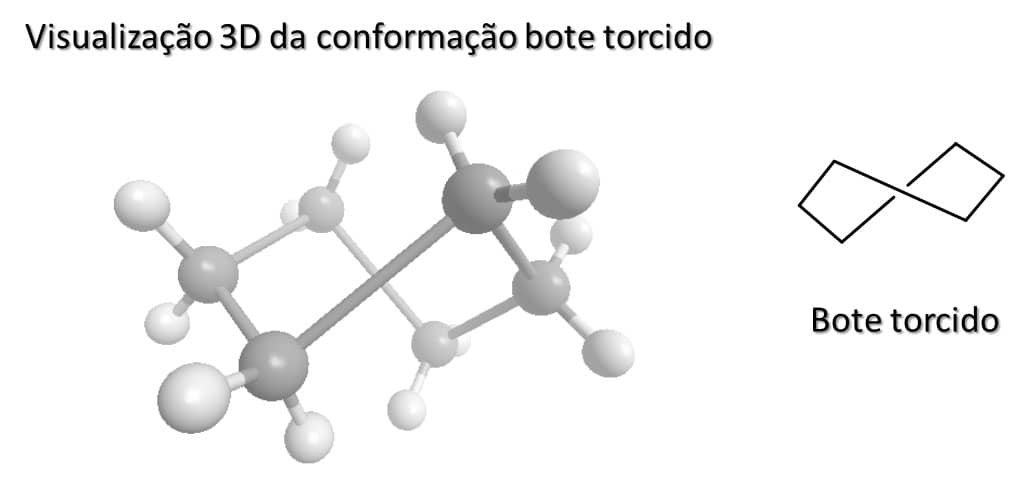
Embora seja menos estável, a conformação bote do ciclo-hexano apresenta maior mobilidade que a conformação cadeira e é capaz de se “dobrar” de forma a aliviar parte da tensão de torção que existe na molécula, bem como a repulsão entre os hidrogênios dos carbonos um e quatro.
A forma que surge é chamada de bote torcido e, embora seja mais estável que a conformação bote, ainda é menos estável que a conformação cadeira. Na Figura 29, temos a visualização 3D da estrutura do ciclo-hexano em conformação bote torcido.
Atenção
Nesta figura, as partes mais claras estão para longe do observador e as mais escuras, mais próximas. Isso mostra que, embora possa parecer uma estrutura pouco estável em termos de conformação, no espaço essa conformação permite o afastamento entre os átomos.
Falamos da maior ou menor estabilidade das diferentes conformações do ciclo-hexano, mas é importante notar que as barreiras de transição entre uma conformação e outra são baixas o suficiente para que essa interconversão ocorra à temperatura ambiente e haja um equilíbrio entre os diferentes confôrmeros. Ainda assim, a conformação cadeira estará presente em maior quantidade devido à sua maior estabilidade.
Ciclo-hexanos monossubstituídos
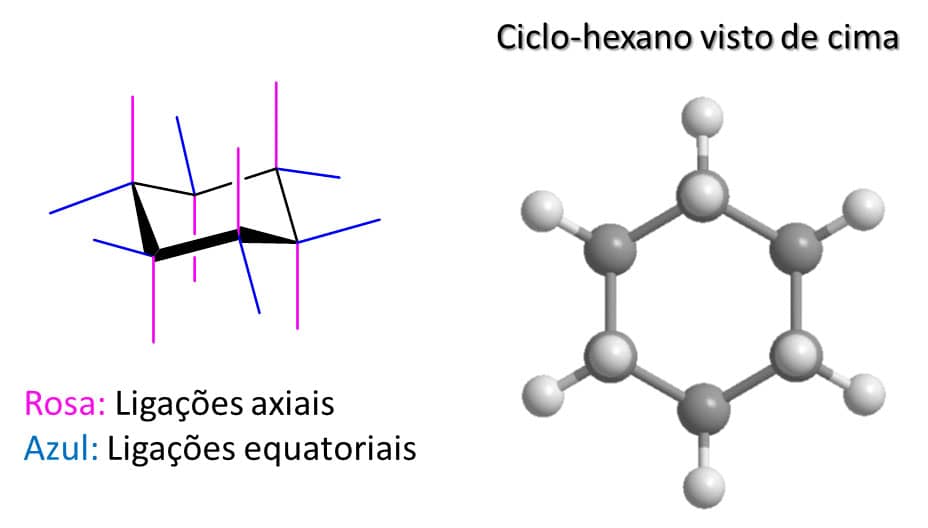
Antes de começarmos a falar das substituições em si, precisamos entender algumas características que provêm da conformação cadeira do ciclo-hexano, e a principal delas é o fato de que os substituintes do ciclo-hexano podem estar na posição axial, no plano do anel, ou na posição equatorial, fora do plano do anel.
Na Figura 30, podemos ver essas ligações na estrutura de linha do ciclo-hexano e ter uma visão de cima do composto. Podemos ver os hidrogênios equatoriais em volta do anel de carbonos e três hidrogênios axiais que estão acima do plano da estrutura (os outros três hidrogênios axiais ficam escondidos pelos carbonos).
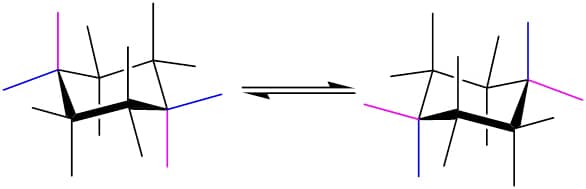
A possibilidade de ligações axiais e equatoriais gera a expectativa de vários isômeros para os ciclo-hexanos monossubstituídos, porém isso não acontece, uma vez que os anéis são móveis à temperatura ambiente e se interconvertem, fazendo com que ligações axiais passem a ser equatoriais, e vice-versa (Figura 31).
Apesar da interconversão, os dois confôrmeros não apresentam a mesma estabilidade. Um ciclo-hexano monossubstituído terá, em geral, o confôrmero com substituinte na posição equatorial como mais estável.
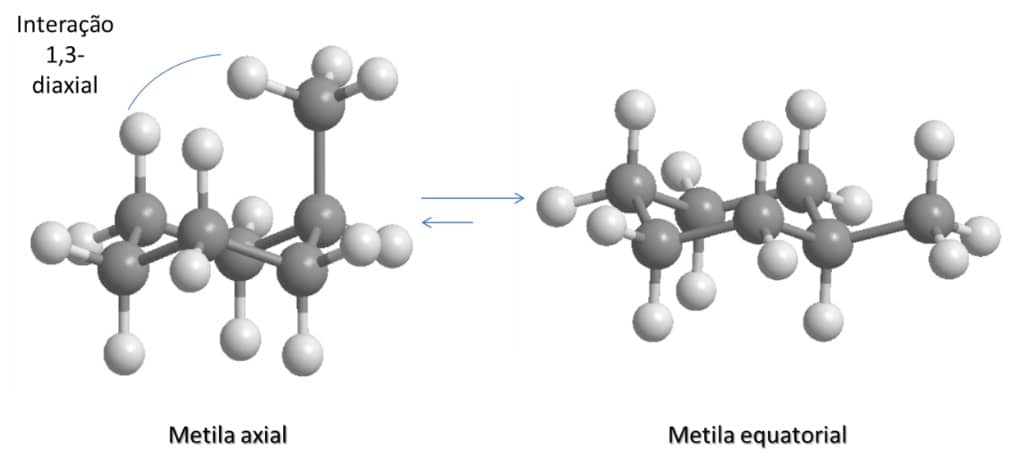
Isso acontece porque o substituinte na posição axial leva a um impedimento estérico, que é resultado das interações 1,3 di-axiais.
Ou seja, no caso do metilciclo-hexano, os hidrogênios da metila estão próximos dos hidrogênios dos carbonos três e cinco, o que leva à repulsão e ao aumento da energia. Na posição equatorial, esse impedimento estérico não ocorre (Figura 32).
Cicloalcanos dissubstituídos
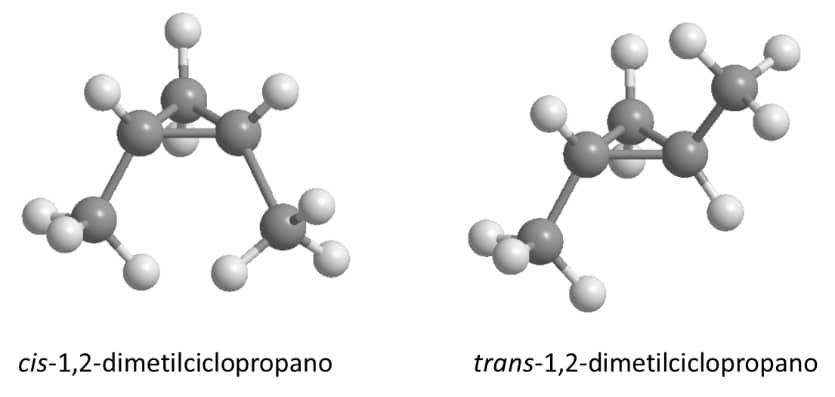
A presença de dois substituintes nos cicloalcanos abre a possibilidade de que haja isomeria cis e trans para esses compostos. É importante lembrar que na isomeria cis e trans, a interconversão só é possível com a quebra de ligações carbono-carbono, o que significa que esses compostos são diferentes, podem ser isolados e possuem características físico-químicas diferentes um do outro. O caso mais fácil de visualizar é o do ciclopropano, dada sua planaridade (Figura 33).
Para os ciclo-hexanos, a falta de planaridade pode prejudicar a visualização, porém basta observar se os substituintes estão em ligações que vão para cima ou para baixo. Caso os dois estejam na mesma face do anel, são considerados cis; caso estejam em faces diferentes, são trans. A Figura 34 exemplifica ambos os casos.
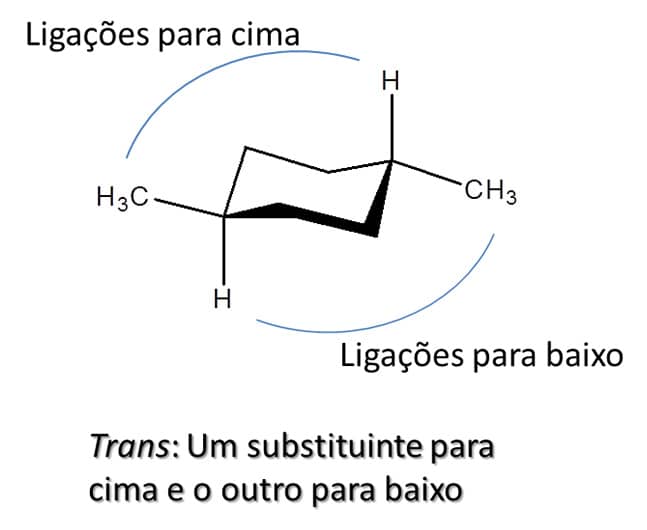
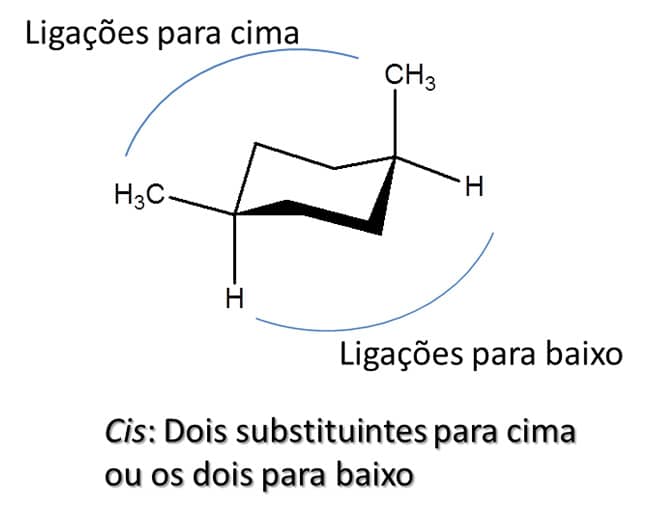
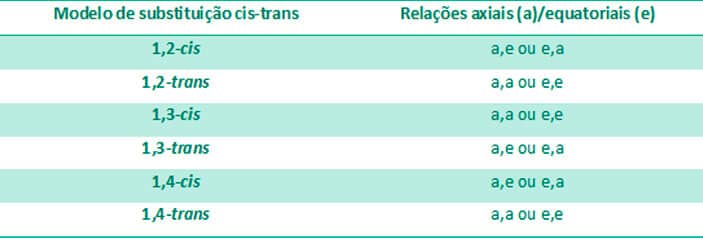
Existem três possibilidades de substituição nos ciclo-hexanos dissubstituídos: os 1,2-dissubstituídos, 1,3-dissubstituídos e 1,4-dissubstituídos. Todos podem apresentar isômeros trans e cis. Para entender a estabilidade de cada um, precisamos analisar se os substituintes estarão na posição axial ou equatorial no ciclo-hexano, uma vez que, como já vimos, a posição axial tende a gerar mais tensão devido ao impedimento estérico.
Para os ciclo-hexanos dissubstituídos, nos quais sempre haverá um substituinte na posição axial e um na posição equatorial, as duas formas são igualmente estáveis, desde que os substituintes sejam os mesmos. Caso sejam diferentes, a forma mais estável será aquela em que o substituinte mais volumoso esteja na posição equatorial, uma vez que nessa posição haverá menor impedimento estérico. Esse é o caso dos compostos 1,2-cis, 1,3-trans e 1,4-cis.
Para aqueles nos quais ambos os substituintes estarão em posição axial ou ambos em posição equatorial, a conformação cadeira mais estável será aquela na qual ambos os substituintes estejam em posição equatorial. Esse é o caso dos compostos 1,2-trans, 1,3-cis e 1,4-trans.
Entre as conformações cis e trans, deve-se avaliar qual dos dois isômeros permite que ambos os substituintes fiquem na posição equatorial, de maneira a termos a estrutura de menor energia. A Tabela 3 resume as possibilidades de posição dos substituintes em cada um dos isômeros.
Conformações de moléculas policíclicas
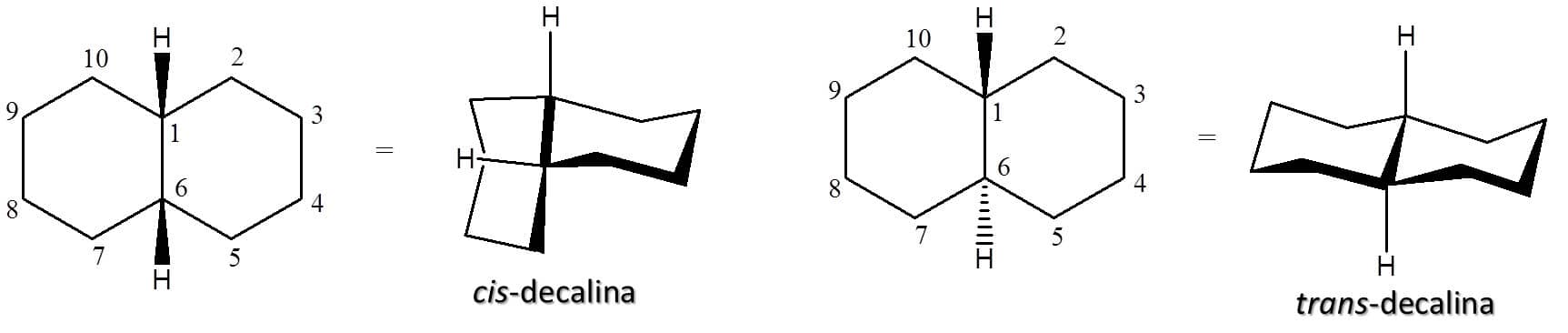
As moléculas policíclicas também apresentam isomeria cis e trans. Vamos usar como exemplo a decalina, um composto de dez carbonos formado pela união de dois anéis de ciclo-hexano. Neste composto, por exemplo, a determinação cis e trans é dada pela orientação dos hidrogênios dos carbonos da ponte (que unem os dois anéis) em relação ao plano do anel. A Figura 35 traz as diferentes possibilidades.
A cis-decalina e a trans-decalina não podem ser interconvertidas uma na outra sem que haja quebra das ligações carbono-carbono e, mais uma vez, apresentam propriedades distintas no que tange seus pontos de fusão e ebulição, por exemplo. A relação entre elas é a mesma que vimos para os ciclo-hexanos 1,2-dissubstituídos, ou seja, a forma trans é a mais estável porque não apresenta interações 1,3-diaxiais.
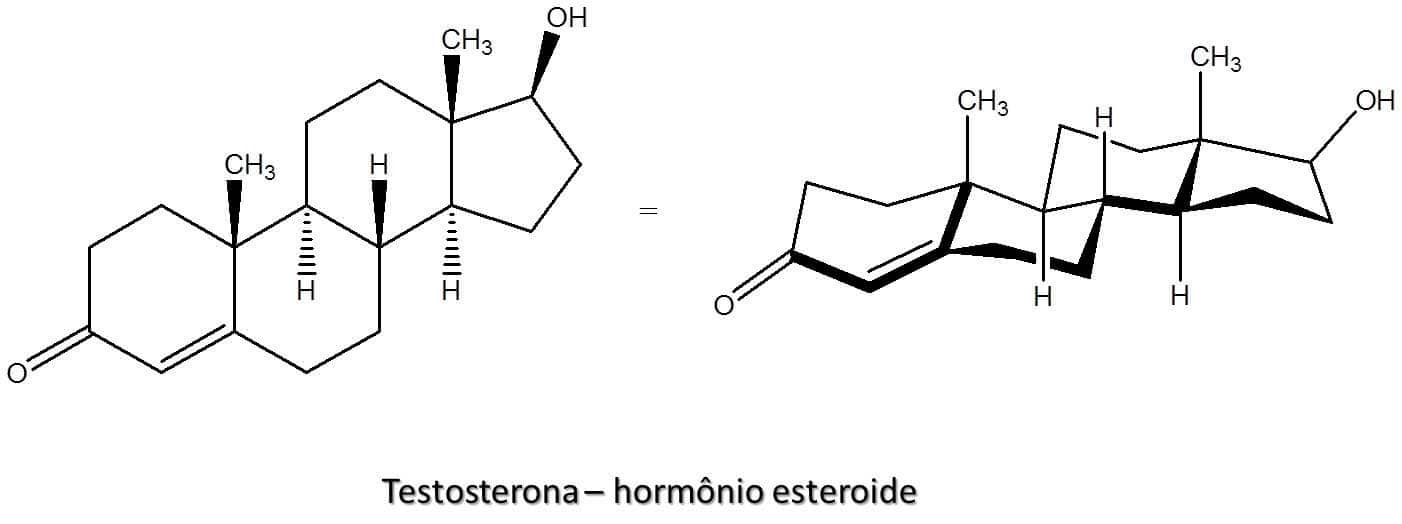
Você sabia
As estruturas cíclicas estão muito presentes na natureza e em nosso organismo, como é o caso dos hormônios esteroides, formados por quatro anéis fundidos (Figura 36).
É importante que sejamos capazes de reconhecer suas estruturas e entender suas diferenças, mas não se preocupe: a análise conformacional de compostos que apresentam vários anéis é a mesma feita para compostos ciclo-hexanos simples.
O especialista Luiz Américo Mota discute os fatores que influenciam a conformação e estabilidade de cicloalcanos.:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever as principais funções oxigenadas e nitrogenadas em química orgânica e suas principais características
Os compostos orgânicos oxigenados e nitrogenados
Existem diversas classes de compostos orgânicos, que são definidos por sua estrutura e pelos átomos contidos nos mesmos. Vamos agora conhecer os compostos oxigenados e nitrogenados, que compõem várias classes muito importantes dentro da química orgânica, aprender a dar nome a eles e conhecer suas propriedades.
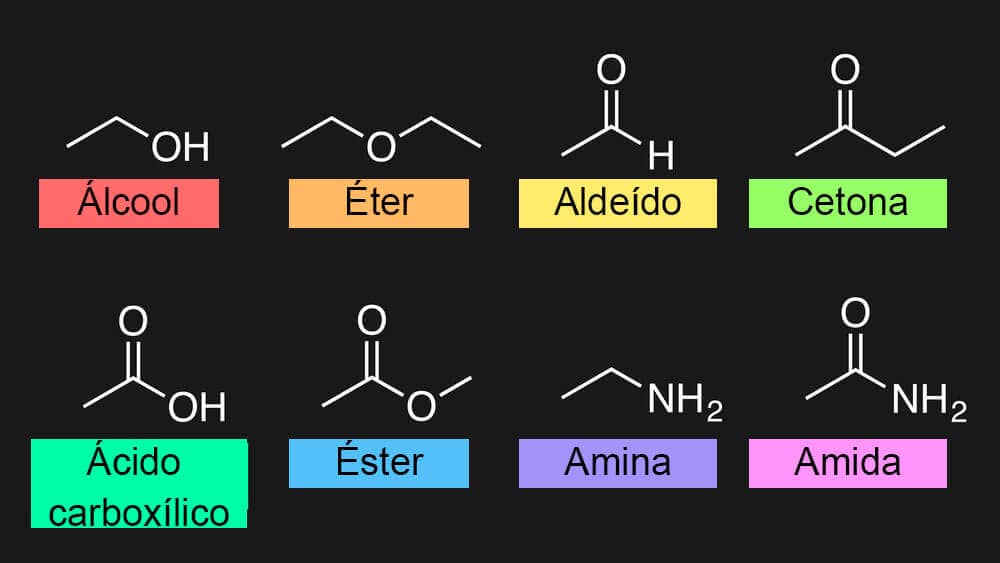
Álcoois
Os álcoois fazem parte das funções oxigenadas e talvez sejam a mais conhecida das classes de compostos orgânicos, devido a sua enorme participação no nosso cotidiano. O etanol, por exemplo, é o álcool comercial normalmente utilizado em casa, no álcool em gel e também nas bebidas alcoólicas.
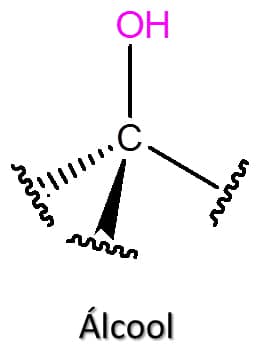
Nesta classe de compostos, um grupo hidroxila (-OH) está ligado a um carbono sp3, como podemos ver na Figura 37. Assim, os álcoois são frequentemente considerados como derivados alquílicos da água ou derivados hidroxilados dos alcanos.
Saiba mais
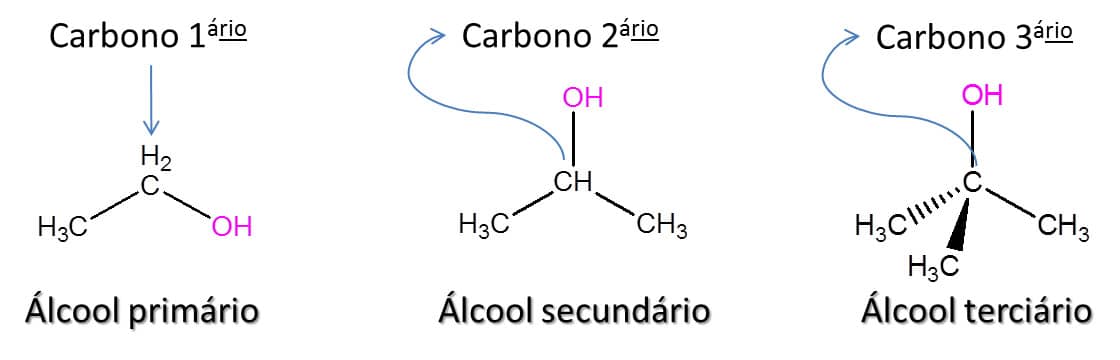
Esses compostos são ainda subdivididos entre primários, secundários e terciários, de acordo com o número de ligações carbono-carbono que o carbono ligado à hidroxila faz. Como assim? Se ele estiver ligado a apenas um outro carbono é considerado primário; se estiver ligado a dois outros carbonos, secundário; e se estiver ligado a três outros carbonos, é classificado como terciário.
A Figura 38 traz exemplos dos três tipos de álcoois.
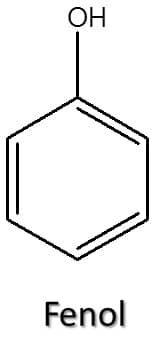
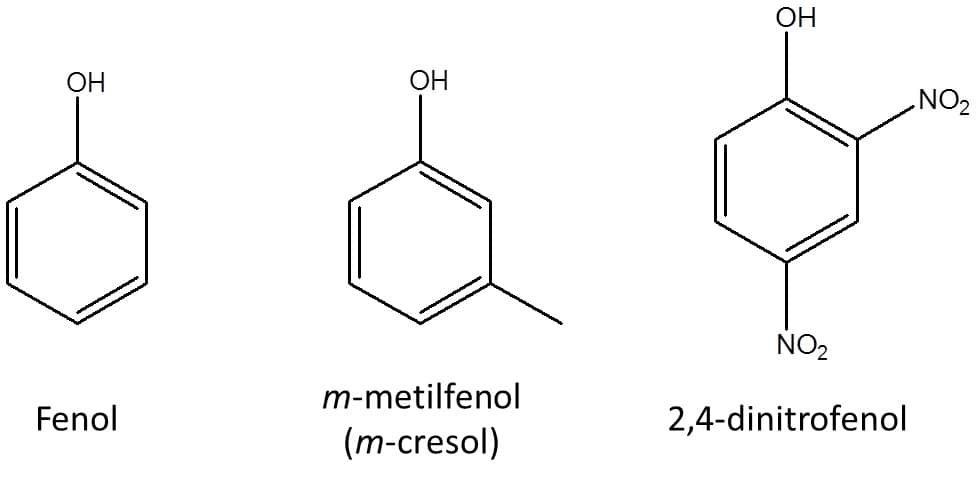
A hidroxila pode ainda estar ligada a um carbono de anel benzênico, dando origem a um fenol. Os fenóis têm propriedades ácidas diferentes dos álcoois citados anteriormente e sua nomenclatura também varia um pouco, então os trataremos sempre de forma separada dos demais álcoois. A Figura 39 traz a estrutura de um fenol simples.
Nomenclatura dos álcoois
Os álcoois seguem as mesmas regras de nomenclatura que vimos para os alcanos, porém a terminação desses compostos é –ol.
Como nomeá-los então? De maneira geral:
Encontre a cadeia principal de forma que ela seja a maior cadeia carbônica que contém a hidroxila.
Numere os carbonos começando pela extremidade mais próxima à hidroxila.
Escreva o nome dando aos substituintes a numeração do carbono ao qual estão conectados e obedecendo à ordem alfabética.
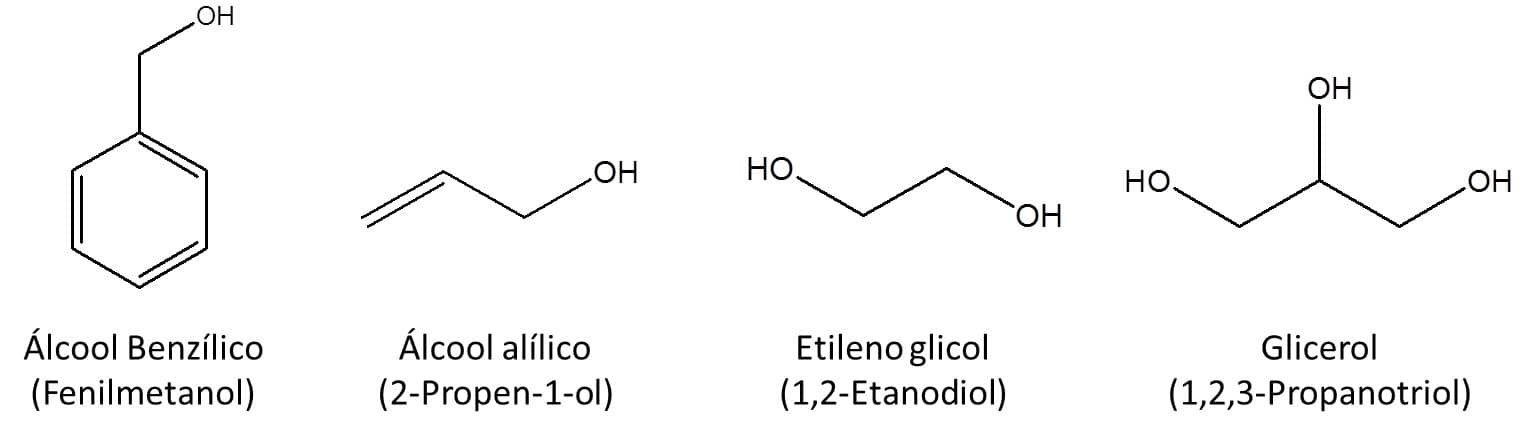
Alguns álcoois possuem nomes comuns que são tão difundidos que acabaram por serem aceitos pela IUPAC, como pode ser visto na Figura 40.
No caso dos fenóis, sua estrutura é tratada como um grupo funcional, e o nome da substância é formada pelos substituintes numerados + fenol. A Figura 41 traz alguns exemplos.
Características dos álcoois e fenóis
Em termos de estrutura, os álcoois e fenóis apresentam um ângulo de ligação de 109°, muito próximo ao que a água apresenta, por exemplo. Assim como a água, a polaridade existente na ligação O-H desses compostos permite que os mesmos façam ligações de hidrogênio entre suas moléculas, levando a pontos de ebulição consideravelmente mais elevados que suas contrapartes da classe de alcanos.
Atenção
Se compararmos o 1-propanol (MM=60) e o butano (MM=58), vemos que o álcool tem ponto de ebulição igual a 97°C, enquanto o do alcano é de -0,5°C. Outra característica que provém da capacidade dos álcoois apresentarem forças intermoleculares mais fortes que os alcanos é que, mesmo o álcool mais simples, o metanol, é um líquido à temperatura de 25°C.
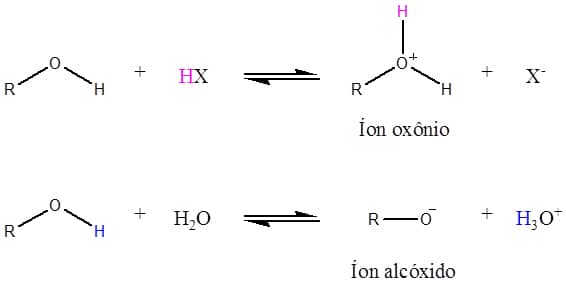
Uma segunda característica importante dos álcoois e fenóis é que esses compostos, assim como a água, podem reagir como ácidos ou bases, dependendo da condição do meio. Frente a ácidos fortes, os álcoois tem seu oxigênio da hidroxila protonado, dando origem ao íon oxônio, enquanto frente a bases ou até mesmo a água, eles se comportam como ácidos fracos, doando um próton e formando o íon alcóxido ou fenóxido (se for derivado de um fenol). Ambas as situações estão exemplificadas na Figura 42.
Éteres
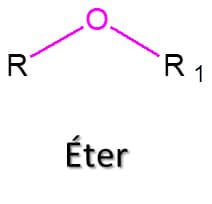
Éter é uma classe de compostos orgânicos na qual duas cadeias carbônicas estão ligadas a um único átomo de oxigênio, tendo como estrutura geral R‒O‒R’ (Figura 43). Esses compostos são razoavelmente estáveis, embora possam dar origem aos peróxidos, compostos com ligação O‒O, que são extremamente reativos, alguns sendo inclusive explosivos.
Nomenclatura de éteres
A nomenclatura desses compostos é extremamente simples e pode ser feita de duas formas, segundo a IUPAC:
1. Se o composto for simples, pode-se colocar o nome dos substituintes sem a terminação “a” (metil, etil, butil, por exemplo) em ordem alfabética, seguida da palavra “éter”. Assim, temos o etil metil éter, por exemplo.
2. A parte éter é considerada um substituinte do tipo alcóxido. Então, temos compostos como o etoxietano, por exemplo. Essa maneira é a preferível segundo as recomendações da IUPAC de 2013.
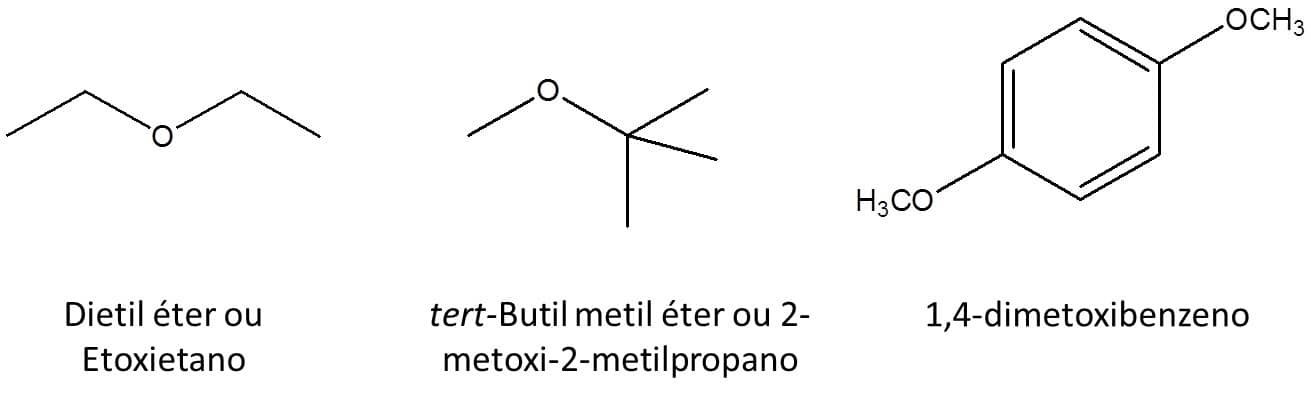
A Figura 44 traz alguns exemplos de ambas as situações:
Características dos éteres
Os éteres, assim como os álcoois, podem ser considerados derivados carbonílicos da água e, de fato, apresentam ângulo de ligação bastante próximo ao ângulo tetraédrico. O éter dimetílico, por exemplo, apresenta ângulo de ligação de 112°.
Essa classe de compostos apresenta pequenos dipolos em sua estrutura devido à presença do oxigênio, um átomo mais eletronegativo que carbono e hidrogênio. Isso torna suas forças intermoleculares ligeiramente mais fortes que as encontradas no alcanos, apresentando ponto de ebulição levemente mais alto. O éter dimetílico (MM=46), por exemplo, tem ponto de ebulição igual a -25°C, enquanto o propano (MM=44) tem ponto de ebulição a -45°C.
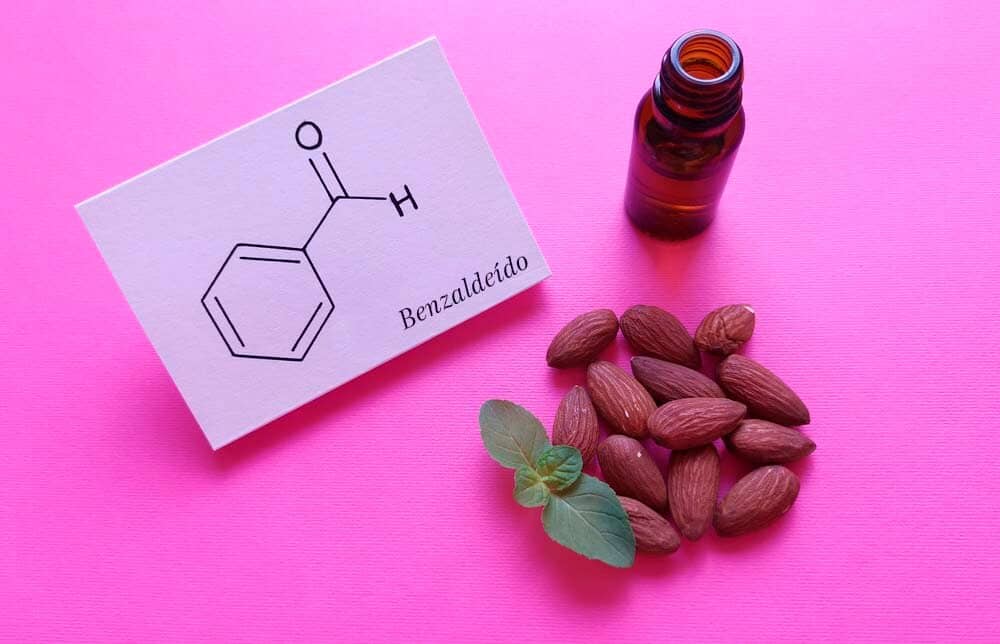
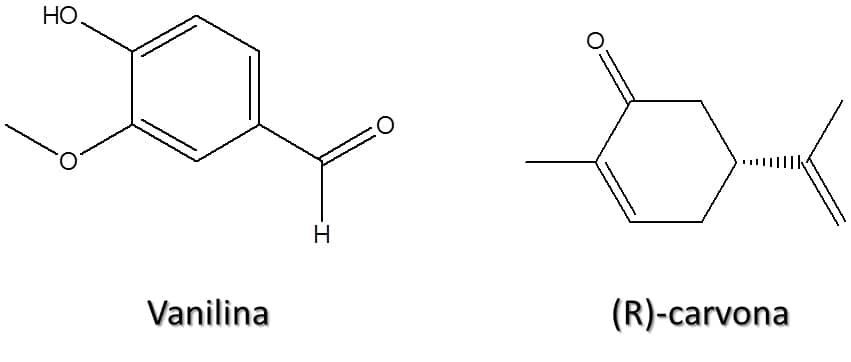
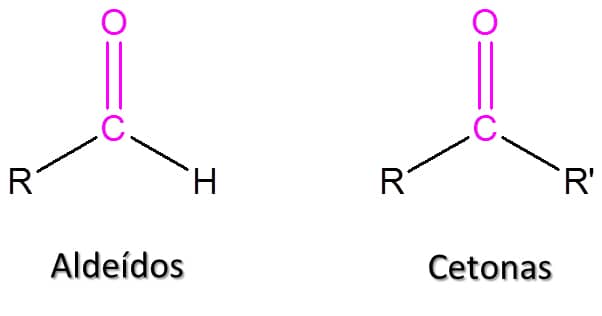
Aldeídos e cetonas
Os aldeídos e cetonas são muito abundantes na natureza e são as substâncias responsáveis pelo odor característico da baunilha e da hortelã, por exemplo, através da vanilina e da (R)-carvona, respectivamente (Figura 45).
Essas classes de compostos são caracterizadas pela presença do grupo carbonila (C=O) em sua estrutura. A diferença principal está na localização do grupo carbonila: enquanto aldeídos apresentam este grupo sempre no carbono terminal, as cetonas o apresentam no meio da cadeia carbônica, como podemos ver na Figura 46.
Nomenclatura de aldeídos
Uma vez que os aldeídos vão apresentar a carbonila sempre na posição terminal, não é necessário fazer a indicação por número. Se houver outros substituintes, no entanto, a numeração dos carbonos deverá ser feita de forma que o carbono da carbonila seja o carbono um. Como fazer:
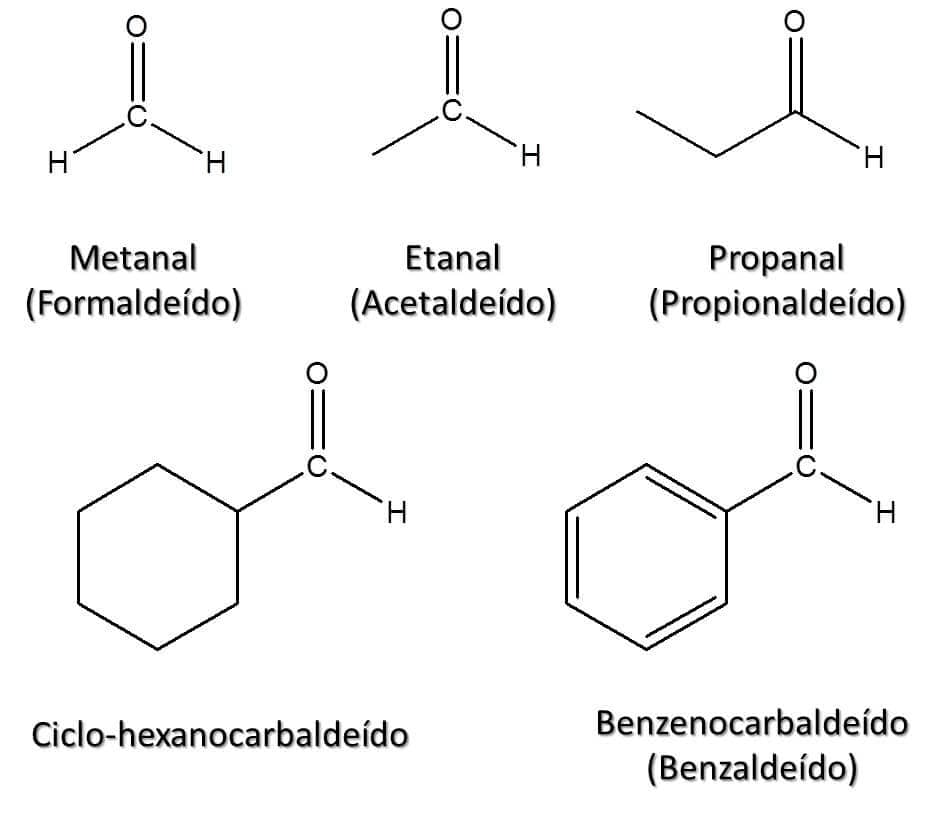
1. Para os aldeídos de cadeia aberta, basta trocar a terminação –o do alcano correspondente para a terminação –al, ou seja, um aldeído de três carbonos é o propanal, de quatro carbonos é o butanal e assim por diante.
2. Caso o grupo –CHO esteja ligado a um anel, aromático ou não, o composto receberá a terminação –carbaldeído.
A Figura 47 traz alguns exemplos nos quais os nomes comuns aceitos pela IUPAC estão entre parênteses.
Nomenclatura de cetonas
Para nomear uma cetona, precisamos retirar a terminação –o do alcano correspondente e substituí-la por –ona, como descrito nas etapas a seguir:
1. Encontre a maior cadeia carbônica que contém a carbonila (ela será a cadeia principal).
2. Comece a numerar os carbonos de maneira que o carbono carbonílico tenha o menor número possível.
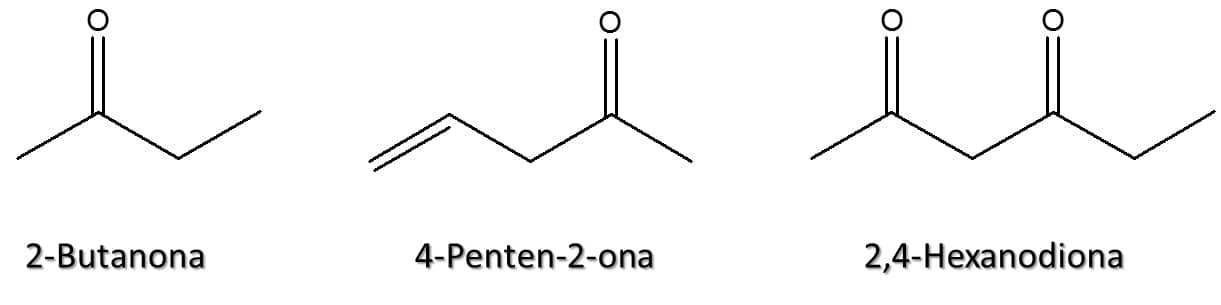
Veja alguns exemplos na Figura 48:
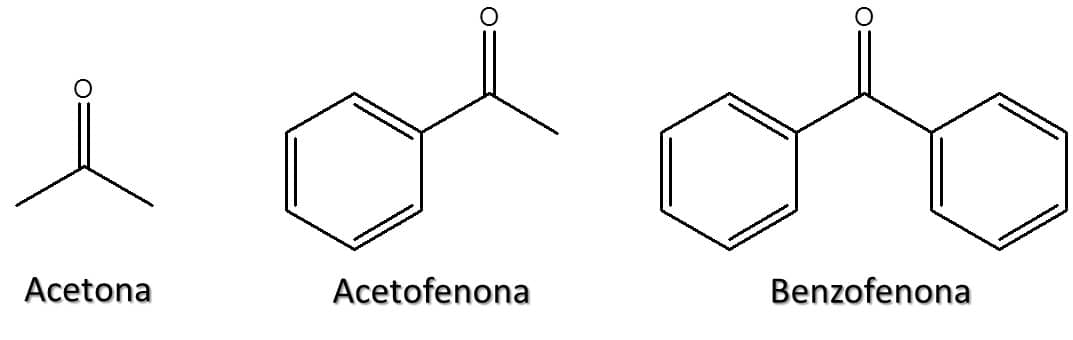
Algumas cetonas também podem ser denominadas por seus nomes comuns, segundo a IUPAC. Este é o caso das substâncias ilustradas na Figura 49:
Características de aldeídos e cetonas
A presença da carbonila na estrutura dessas classes de compostos é responsável por grande parte de suas propriedades químicas e físicas. Ambas as classes apresentam polaridade em suas estruturas devido à presença do átomo de oxigênio eletronegativo. Como não há hidrogênio ligado ao átomo de oxigênio, essas substâncias não são capazes de fazer ligações de hidrogênio entre si, porém podem fazê-lo com a água, e isso confere a aldeídos e cetonas de baixa massa molar uma boa solubilidade neste solvente.
A falta de ligações de hidrogênio entre as moléculas implica também em pontos de ebulição menores do que os vistos para os álcoois correspondentes. No entanto, aldeídos e cetonas têm dipolos contínuos em sua estrutura e, por isso, suas forças intermoleculares são mais fortes que as dos alcanos correspondentes. Se compararmos butano (MM=58), propanal (MM=58), acetona (MM=58) e 1-propanol (MM=60), veremos que os pontos de ebulição são respectivamente -0,5°C, 49°C, 56,1°C e 97,2°C.

Ácidos carboxílicos
Os ácidos carboxílicos são extremamente importantes na química orgânica e no cotidiano de maneira geral. O principal componente do vinagre é um ácido carboxílico, assim como a substância responsável pelo odor rançoso da manteiga.
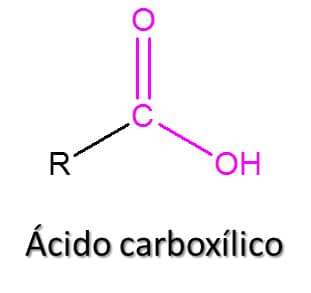
Os ácidos carboxílicos são substâncias do tipo RCO2H, como pode ser visto na Figura 50.
Nomenclatura dos ácidos carboxílicos
A nomenclatura dos ácidos carboxílicos depende da complexidade do ácido. O nome dos ácidos deve seguir as seguintes regras:
1. Encontre a maior cadeia que contém o grupo CO2H (essa será a cadeia principal).
2. O carbono da carbonila é sempre o carbono um, independentemente de ser um composto de cadeia aberta ou fechada.
3. Os ácidos de cadeia aberta perderão a terminação –o do alcano correspondente e ganharão a terminação –oico. A palavra “ácido” deve vir antes. Dessa forma, o ácido de três carbonos é chamado de ácido propanoico, e o de cinco carbonos, ácido pentanoico, por exemplo.
4. Os ácidos de cadeia fechada devem ser nomeados adicionando a palavra “ácido” antes, e o sufixo carboxílico.
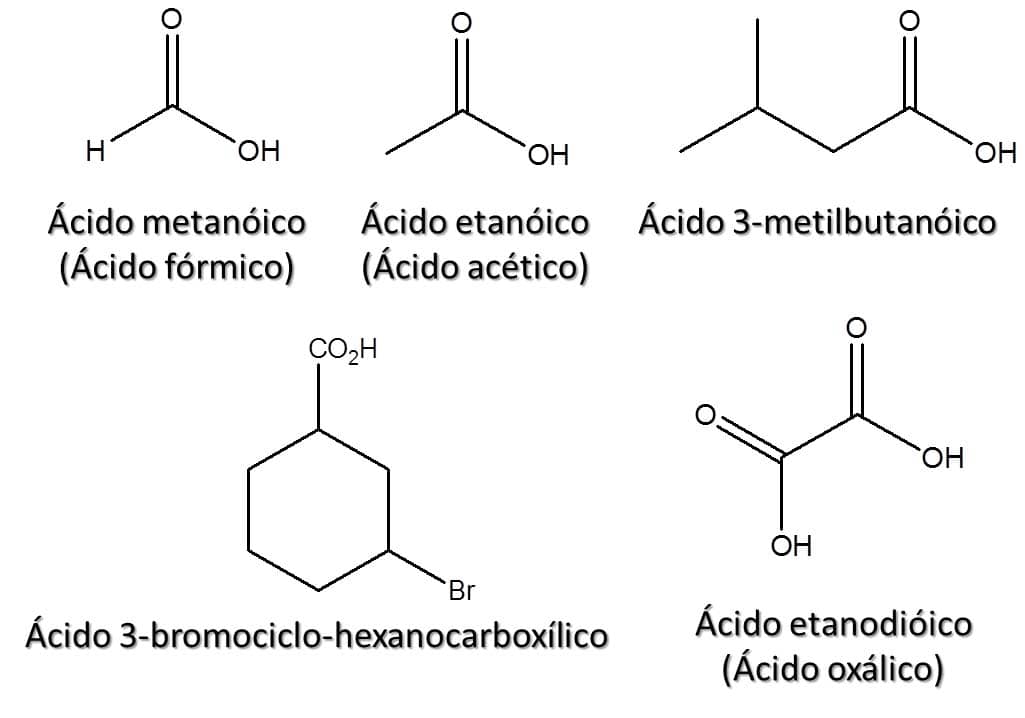
Assim como em outras classes, alguns ácidos têm seus nomes comuns aceitos pela IUPAC. A Figura 51 traz alguns exemplos de ácidos carboxílicos e suas respectivas nomenclaturas (os nomes comuns aparecem entre parênteses).
Características dos ácidos carboxílicos
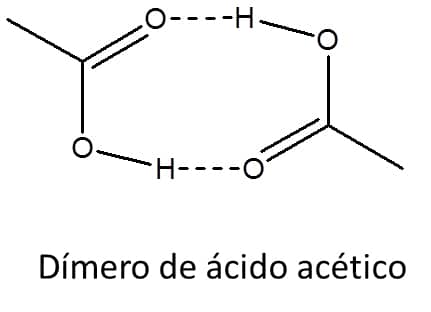
O carbono da carboxila tem hibridização sp2 e, portanto, o grupo carboxílico é planar, com ângulo de ligação de 120°. Esses compostos são capazes de fazer ligações de hidrogênio entre suas moléculas, assim como com a água, o que aumenta sua solubilidade e seu ponto de ebulição. Na verdade, a maioria dos ácidos carboxílicos é capaz de fazer duas ligações de hidrogênio com uma segunda molécula de ácido, formando um dímero (Figura 52), o que torna seus pontos de ebulição ainda mais altos do que os dos álcoois correspondentes. O ponto de ebulição do ácido acético (MM=60), por exemplo, é 117,9°C, enquanto o do 1-propanol (MM=60) é 97,2°C.
Outra característica importante é a acidez desses compostos, como evidenciado pelo nome da classe. Os ácidos carboxílicos são todos considerados ácidos fracos, e vários fatores influenciam em sua acidez, mas não os veremos aqui. Por ora, basta entendermos que todos terão característica ácida, por menor que ela seja.
Ésteres
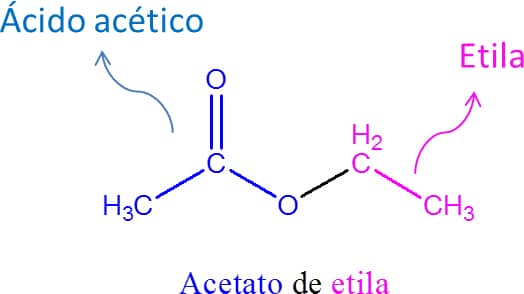
Os ésteres são uma classe derivada dos ácidos carboxílicos, na qual o hidrogênio ácido é substituído por uma cadeia carbônica, tendo RCO2R’ como fórmula geral (Figura 53). Esses compostos são muito comuns na natureza, sendo encontrados em óleos essenciais de frutas e também na gordura animal.
Nomenclatura de ésteres
A nomenclatura dessa classe é bastante simples e deve ser feita da seguinte forma:
- Identifique o grupo alquila ligado ao oxigênio.
- Identifique o ácido carboxílico de origem.
- Elimine a palavra “ácido” e substitua a terminação –ico por –ato.
- Após a palavra formada na etapa 3, adicione “de” e o nome do grupo alquila ligado ao oxigênio (Figura 54).
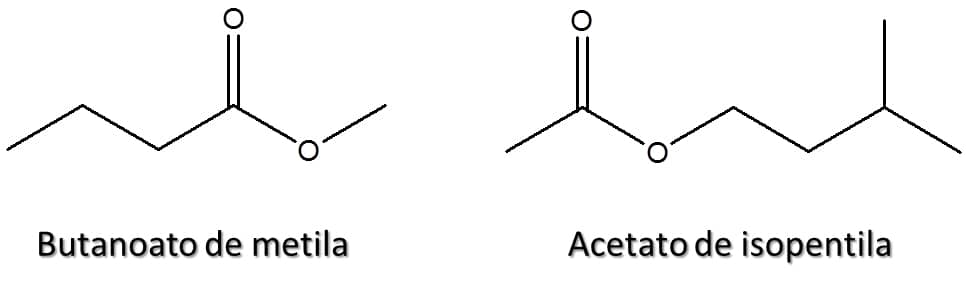
A Figura 55 traz alguns exemplos de ésteres e seus nomes.
Características dos ésteres
Os ésteres, diferentemente dos ácidos e dos álcoois, não são capazes de fazer ligações de hidrogênio. Por isso, seu ponto de ebulição, por exemplo, é menor que os dos ácidos e álcoois correspondentes, estando mais próximos dos aldeídos e cetonas, uma vez que têm o mesmo tipo de força intermolecular.
Quanto à reatividade, os ésteres são estáveis o suficiente para existir na natureza e serem usados como solvente. No entanto, esses compostos ainda podem sofrer diversos tipos de reações para fornecer álcoois, amidas e aldeídos, por exemplo.
Amidas
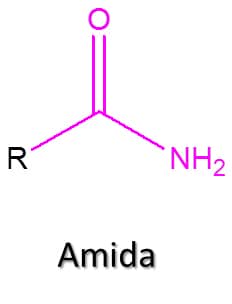
Essa classe de compostos também deriva dos ácidos carboxílicos e são compostos nos quais o –OH do ácido é substituído por –NH2, sendo sua fórmula geral RCONH2 (Figura 56). Você sabe por que esses compostos são de extrema importância? A ligação peptídica, formada quando dois aminoácidos reagem para gerar uma proteína, leva à formação de uma amida.
Nomenclatura de amidas
A nomenclatura dessa classe também pode ser comparada à nomenclatura que vimos para os ácidos, da seguinte forma:
1. Identifique o ácido carboxílico correspondente.
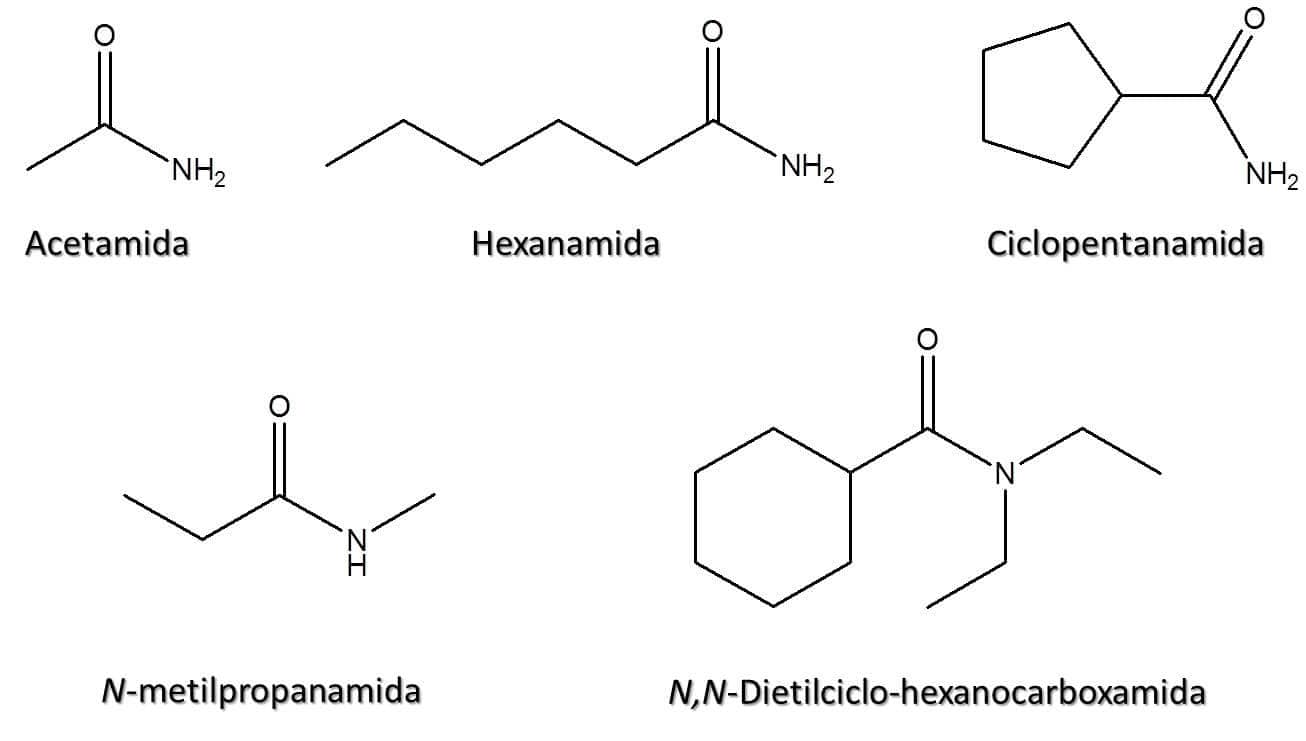
2. Em compostos de cadeia aberta, elimine a palavra “ácido” e substitua a terminação –oico ou –ico por –amida. Por exemplo: a amida derivada do ácido acético é a acetamida.
3. Em compostos de cadeia fechada, elimine a palavra “ácido” e substitua a terminação –carboxílico por –carboxamida. Por exemplo: a amida derivada do ácido ciclopentanocarboxílico é a ciclopentanocarboxamida.
4. Caso o átomo de nitrogênio seja substituído (-NHR ou -NR2), deve-se utilizar a letra N como se fosse o número de localização do substituinte.
A Figura 57 traz alguns exemplos.
Características das amidas
As amidas que apresentam ao menos um átomo de hidrogênio ligado ao átomo de nitrogênio são capazes de fazer ligações de hidrogênio e, por isso, apresentam pontos de fusão e ebulição elevados. Aquelas que apresentam dois substituintes no nitrogênio, por outro lado, não são capazes de fazê-lo e apresentam pontos de fusão e ebulição muito mais baixos. Por exemplo: a acetamida apresenta ponto de fusão de 82°C e ponto de ebulição de 221°C, enquanto os da N,N-dimetilacetamida são respectivamente -20°C e 166°C.
Comentário
Esses compostos são os derivados de ácidos carboxílicos menos reativos entre todos. Isso ocorre porque o átomo de nitrogênio em sua estrutura tem efeito doador de elétrons, tornando o composto mais estável e, consequentemente, menos reativo. Ainda assim, podem reagir para formar ácidos carboxílicos e aminas. Essa classe é ainda muito importante na indústria, pois as poliamidas constituem os náilons, polímeros de extrema importância em diversos setores, e são grupos funcionais presentes também em medicamentos, como o paracetamol.
Nitrilas
Essa classe tem muito em comum com os ácidos carboxílicos em termos de reações, embora não apresente nenhum átomo de oxigênio em sua estrutura. As nitrilas apresentam um átomo de carbono ligado a um átomo de nitrogênio através de uma tripla ligação (Figura 58).
Nomenclatura de nitrilas
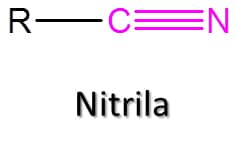
A nomenclatura das nitrilas deriva dos alcanos correspondentes, mas caso sejam complexas, saber o nome do ácido carboxílico correspondente pode ser útil. Vamos ver as regras:
1. A cadeia principal é maior cadeia que contém o grupo nitrila.
2. O carbono da nitrila deve ser numerado como carbono um.
3. Em compostos de cadeia aberta, deve-se adicionar o sufixo –nitrila ao nome do alcano correspondente.
4. Em compostos mais complexos, identifique o ácido carboxílico correspondente, elimine a palavra “ácido” e substitua a terminação –oico por –onitrila e a terminação –carboxílico por –carbonitrila. Por exemplo: a amida derivada do ácido benzoico é a benzonitrila.
A Figura 59 traz alguns exemplos.
Características das nitrilas
Essa classe de compostos apresenta um carbono ligado a um nitrogênio através de uma tripla ligação. Isso quer dizer que esse carbono é sp e a geometria do grupo funcional é linear. Além disso, o carbono está ligado a um átomo mais eletronegativo que ele, fazendo com que o mesmo tenha uma carga parcial positiva. A diferença de eletronegatividade leva também um caráter levemente ácido dos hidrogênios do carbono vizinho ao carbono da nitrila.
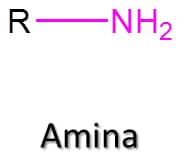
Aminas
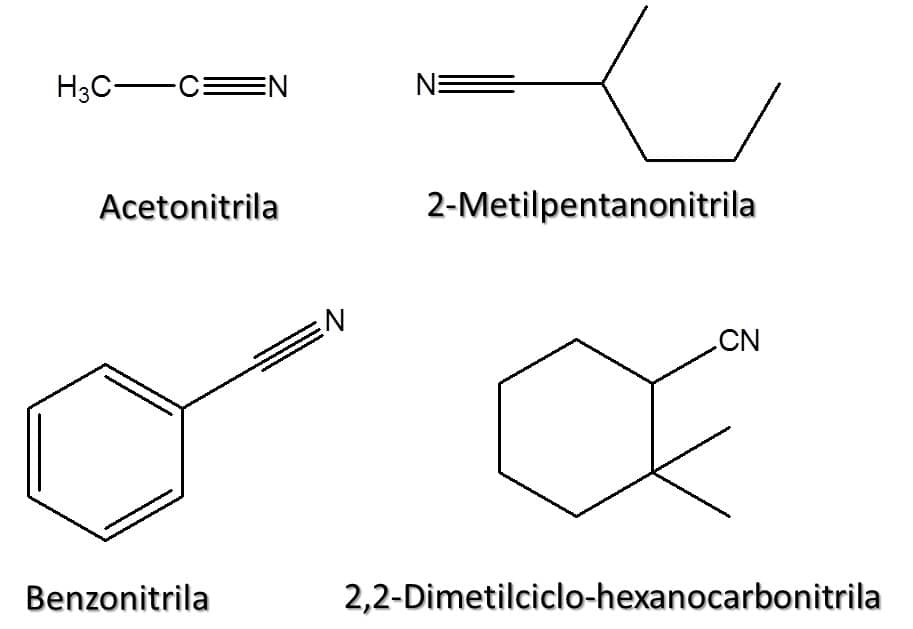
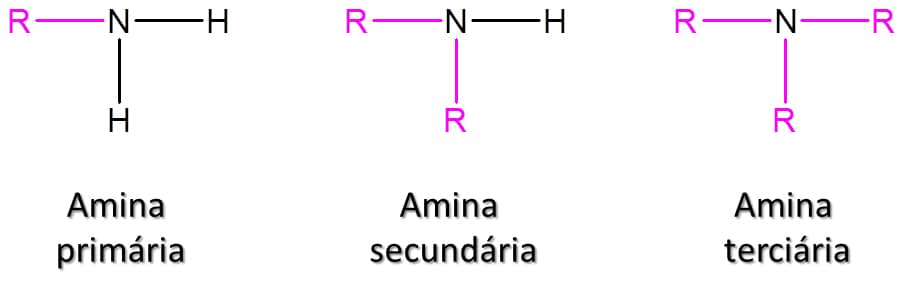
As aminas são, em essência, derivados orgânicos da amônia (NH3). São compostos de extrema importância, uma vez que estão presentes, por exemplo, em neurotransmissores, como a dopamina. Essa classe de compostos é definida pela presença de um grupo –NH2 em sua estrutura, tendo como fórmula geral RNH2 (Figura 60).
Assim como os álcoois, as aminas são divididas entre primárias, secundárias e terciárias, porém a classificação ocorre de maneira diferente do que vimos nos álcoois. Essa divisão é feita de acordo com o número de carbonos ligados ao átomo de nitrogênio. Se apenas um átomo de carbono estiver ligado ao nitrogênio da amina, ela é uma amina primária; se houver dois átomos de carbono, secundária; três átomos de carbono, terciária. A Figura 61 traz exemplos dos três tipos de aminas.
Nomenclatura de aminas
A nomenclatura das aminas vai variar ligeiramente de acordo com sua estrutura. Vamos ver a seguir as regras gerais:
|
Em aminas primárias: |
|---|
|
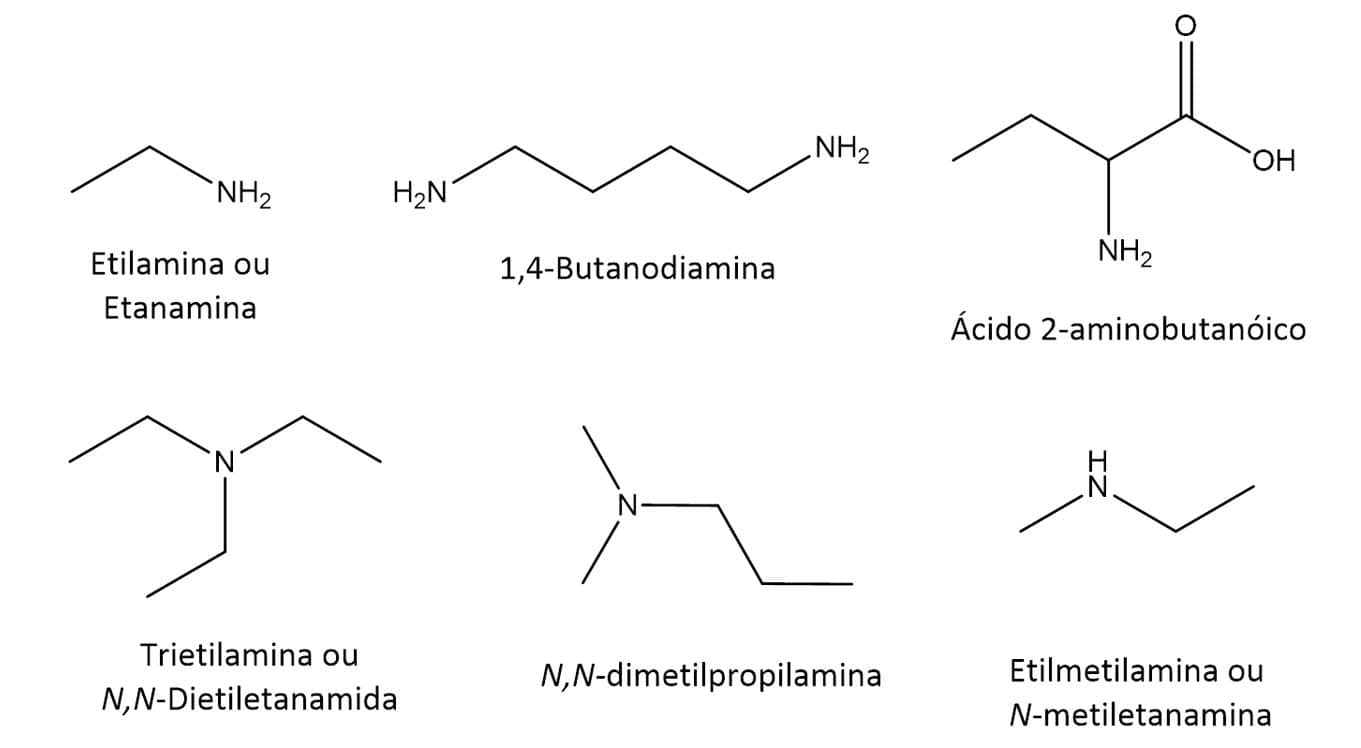
Em aminas primárias, adiciona-se a terminação –amina ao nome da cadeia alquílica principal. Se a cadeia principal tem um carbono, a substância será denominada metilamina; se tem dois carbonos, etilamina, e assim sucessivamente. Pode-se também eliminar a terminação –o do alcano correspondente e adicionar a terminação –amina, tendo-se então a etanamina quando a cadeia principal apresenta dois carbonos, por exemplo; |
|
Em aminas secundárias e terciárias: |
|
Em aminas secundárias e terciárias, os substituintes ligados ao nitrogênio devem ser nomeados utilizando os prefixos di e tri para compostos simétricos. Além disso, os substituintes ganham a designação N- para identificar que estão ligados ao átomo de nitrogênio. Temos a N,N-dimetilpropilamina, por exemplo; |
|
Outros grupos funcionais: |
|
Quando houver outros grupos funcionais, como –OH e –COOH, o grupo –NH2 é tratado como substituinte e é denominado grupo amino. Temos o ácido 2-aminobutanoico, por exemplo. |
A Figura 62 traz alguns exemplos.
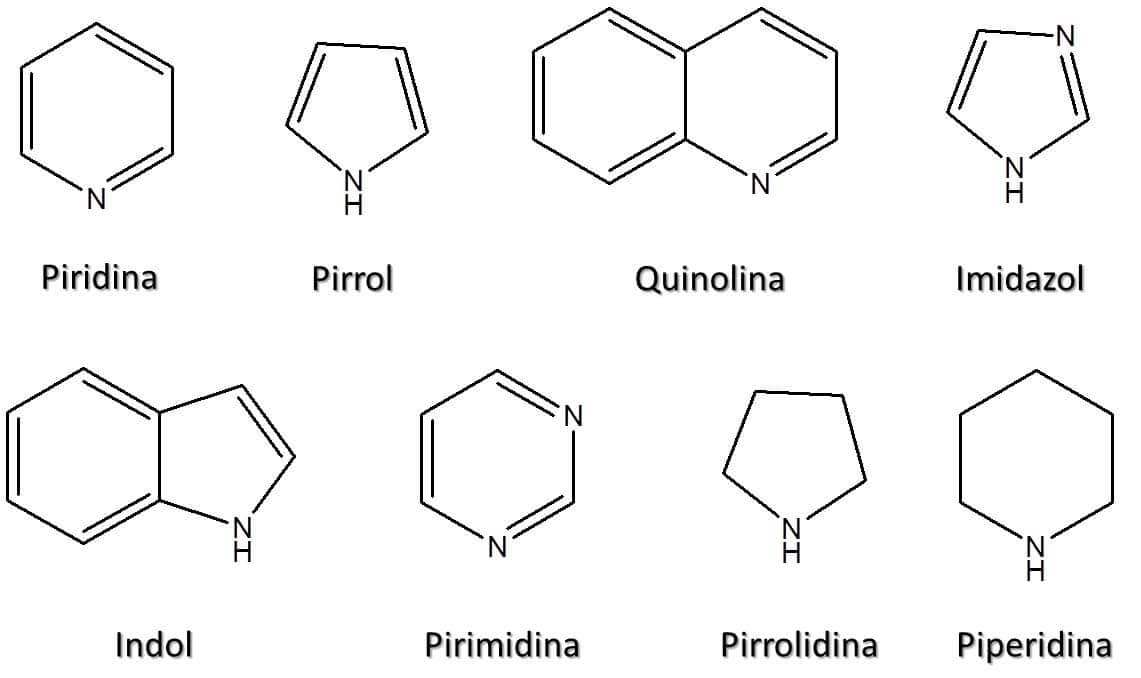
Existem ainda aminas heterocíclicas nas quais cada anel tem um nome próprio. Elas serão apresentadas na Figura 63.
Características das aminas
As aminas primárias e secundárias são capazes de estabelecer ligações de hidrogênio entre si, bem como com a água, o que garante uma boa solubilidade em água para moléculas pequenas. O ponto de ebulição para essas substâncias é maior que o dos alcanos correspondentes, porém costumam ser menores que os valores para álcoois. As aminas terciárias não são capazes de fazer ligação de hidrogênio entre suas moléculas e, por isso, apresentam ponto de ebulição mais baixo que as demais, porém são capazes de fazer esse tipo de ligação com a água, o que garante boa solubilidade para moléculas pequenas.
As aminas têm caráter básico em maior ou menor proporção, porém são consideradas bases razoavelmente fracas. Em sua maioria, serão mais básicas que a água, porém mais fracas que hidróxidos, por exemplo.
O especialista Luiz Américo Mota apresenta as regras de nomenclatura dos compostos oxigenados e nitrogenados, usando diferentes exemplos.:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Identificar as principais funções sulfuradas e halogenadas da química orgânica e suas características mais relevantes
A química dos compostos sulfurados e halogenados
Agora que conhecemos as principais funções oxigenadas e nitrogenadas, vamos ver aquelas que contêm enxofre e átomos de halogênio em sua estrutura e que também têm grande importância na química orgânica e na bioquímica.
Compostos sulfurados
O enxofre é um elemento do grupo 16 (ou 6A) da tabela periódica, vindo logo abaixo do oxigênio. Isso quer dizer que esses dois elementos compartilham uma série de similaridades em relação à sua química. Entretanto, propriedades como eletronegatividade e raio atômico, por exemplo, proporcionam características químicas significativamente diferentes daquelas observadas em relação ao átomo de oxigênio.
Vamos começar a estudar os compostos sulfurados e entender o que eles são, além de conhecer algumas de suas características químicas e físicas.
Tióis
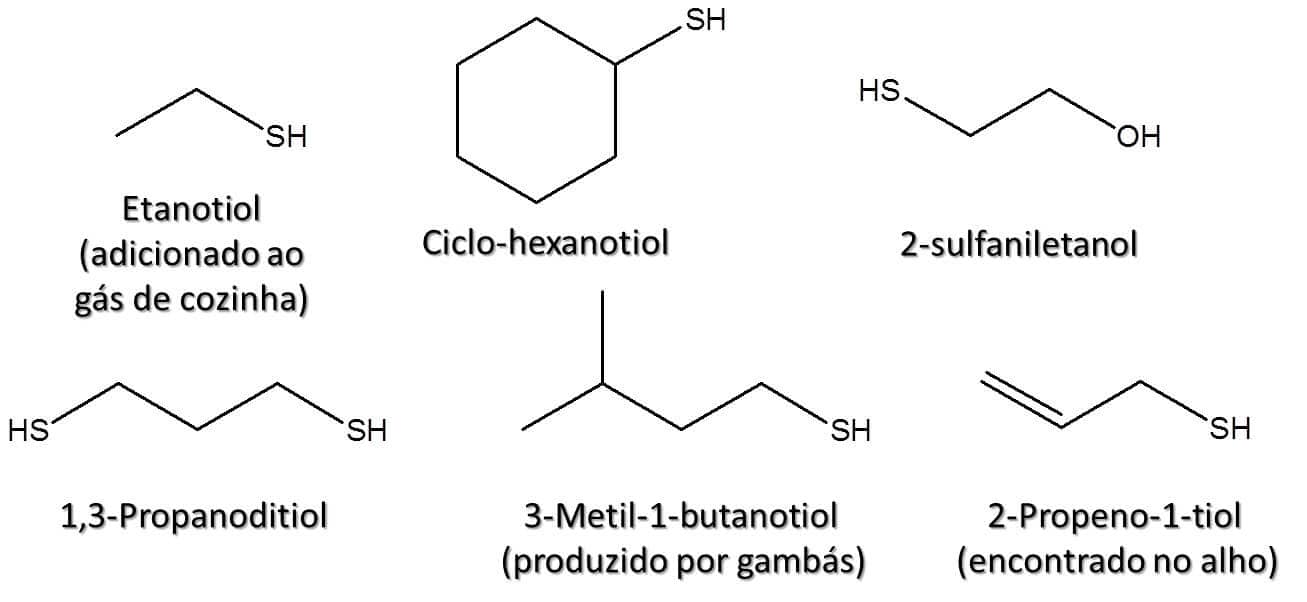
Os tióis, antigamente conhecidos como mercaptanos, estão mais presentes no cotidiano do que imaginamos. Os tióis de baixo peso molecular são voláteis e têm odor bastante característico, sendo responsáveis pelo odor desagradável liberado pelos gambás, por exemplo. Além disso, estas substâncias são adicionadas ao gás de cozinha para que seja possível identificar um vazamento, uma vez que os alcanos não apresentam cheiro.
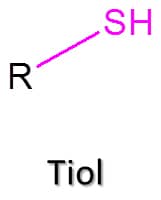
Esses compostos são análogos aos álcoois que vimos ao longo do módulo anterior, e sua fórmula geral é RSH (Figura 64). O grupo SH é chamado de grupo sulfidrila.
Nomenclatura de tióis
Os tióis seguem o mesmo padrão de nomenclatura que os álcoois, porém a terminação para os tióis é –tiol. Vamos ver as regras:
1. Encontre a cadeia principal de forma que ela seja a maior cadeia carbônica que contém o grupo sulfidrila.
2. Numere os carbonos começando pela extremidade mais próxima ao grupo funcional.
3. Escreva o nome dando aos substituintes a numeração do carbono ao qual estão conectados e obedecendo a ordem alfabética.
4. Caso o grupo –SH seja um substituinte, deve-se utilizar o prefixo sulfanil.
A Figura 65 traz alguns exemplos de estruturas e seus respectivos nomes.
Características dos tióis
Quanto às suas propriedades físicas, os tióis apresentam ponto de ebulição mais baixo que os álcoois correspondentes, pois suas ligações de hidrogênio, embora existam, são muito mais fracas que as encontradas em compostos oxigenados. Para fins de comparação, temos que o metanotiol tem ponto de ebulição de 6°C, sendo um gás a temperatura ambiente, enquanto o metanol, líquido a temperatura ambiente, tem ponto de ebulição igual a 65°C.
Atenção
Outra característica que precisamos pontuar é a acidez. Quando falamos de álcoois, discutimos sua leve acidez. Os tióis são ainda mais ácidos que os álcoois, graças ao maior raio atômico do enxofre e sua maior polarizabilidade. Por outro lado, as bases formadas a partir dos tióis, denominadas tiolatos, são mais fracas que os alcóxidos gerados na reação de álcoois com bases.
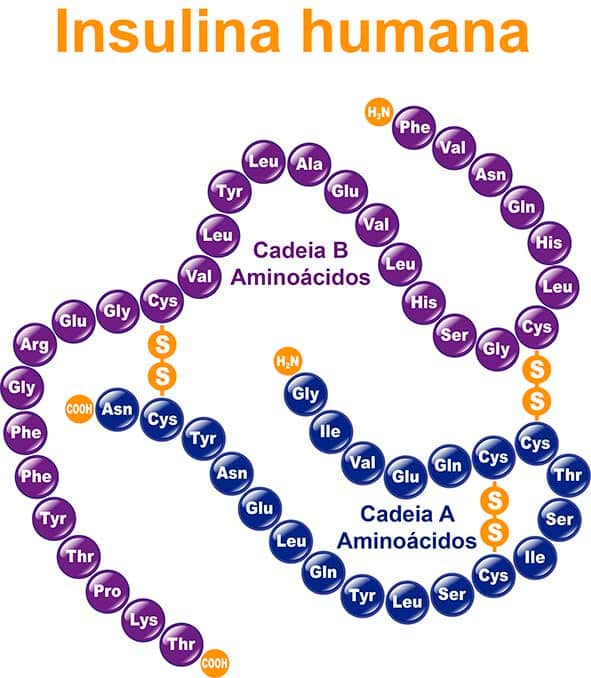
A terceira característica importante, especialmente para o organismo humano, é o fato de que a ligação S-H é fraca o suficiente para que os tióis sejam capazes de reagir com agentes oxidantes moderados e formar ligações dissulfeto, R-S-S-R. Essa característica é particularmente relevante, pois afeta a estrutura primária de proteínas e permite a ligação covalente entre cadeias polipeptídicas de maneira que sejam estabilizadas, como é o caso da insulina, por exemplo (Figura 66).
Sulfetos
Os sulfetos, também conhecidos como tioéteres, são os análogos sulfurados dos éteres, tendo como fórmula geral R-S-R’ (Figura 67).
Nomenclatura dos sulfetos
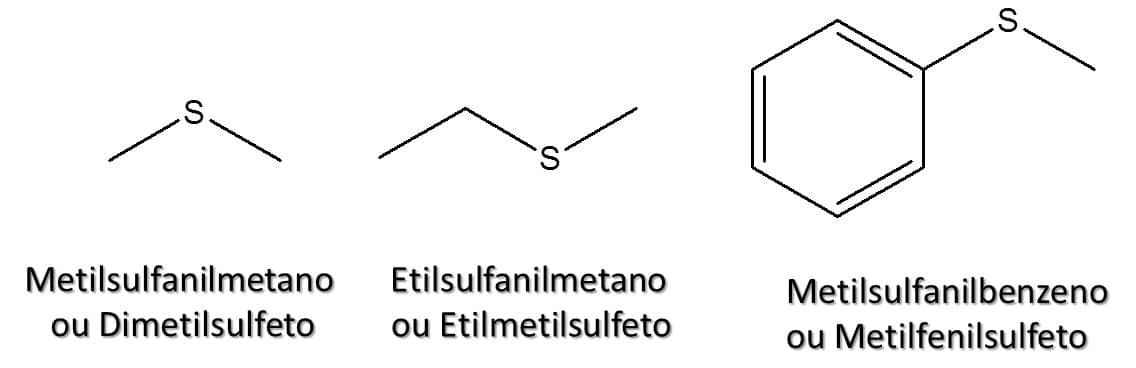
A nomenclatura dessa classe é bastante similar à dos éteres, como podemos ver nas regras a seguir:
- Trate a cadeia alquílica como um substituinte, ou seja, nome da cadeia alquílica sem a terminação “a” (metil, etil...) + sulfanil + nome do alcano principal. Assim, teremos metilsulfanilmetano, por exemplo.
Uma segunda opção também aceita pela IUPAC é seguindo o seguinte passo a passo:
- Identifique as cadeias alquílicas ligadas ao átomo de enxofre.
- Dê os nomes das cadeias alquílicas seguido da terminação –sulfeto. Duas metilas então formam o dimetilsulfeto, por exemplo.
A Figura 68 traz alguns exemplos.
Características dos sulfetos
Como dissemos anteriormente, embora oxigênio e enxofre compartilhem semelhanças, por estarem no mesmo grupo da tabela periódica, também apresentam diferenças. Uma dessas diferenças que afeta os sulfetos é a maior polarizabilidade do enxofre, o que quer dizer que o átomo de enxofre é capaz de estabilizar cargas negativas em um átomo vizinho. Isso faz com que, nos sulfetos, os átomos de hidrogênio ligados ao carbono vizinho ao átomo de enxofre sejam mais ácidos do que aqueles ligados ao grupo alcóxi.
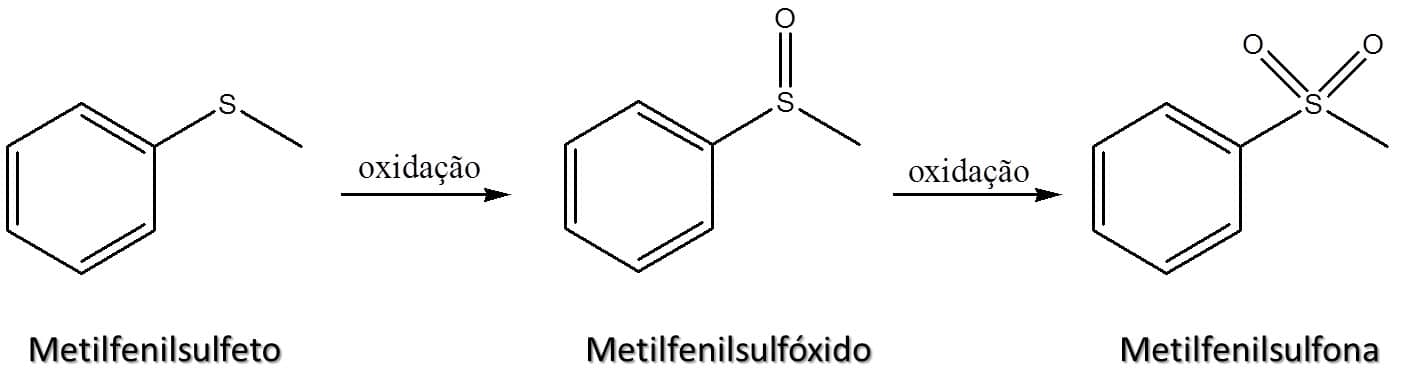
Um segundo ponto importante é que os sulfetos são passíveis de sofrer oxidação e, como membro do terceiro período da tabela periódica, o enxofre pode expandir sua camada de valência para além dos oito elétrons normalmente aceitos, fazendo ligações duplas adicionais com o oxigênio. Dessa forma, um sulfeto pode ser oxidado a sulfóxido e posteriormente a sulfona (Figura 69).
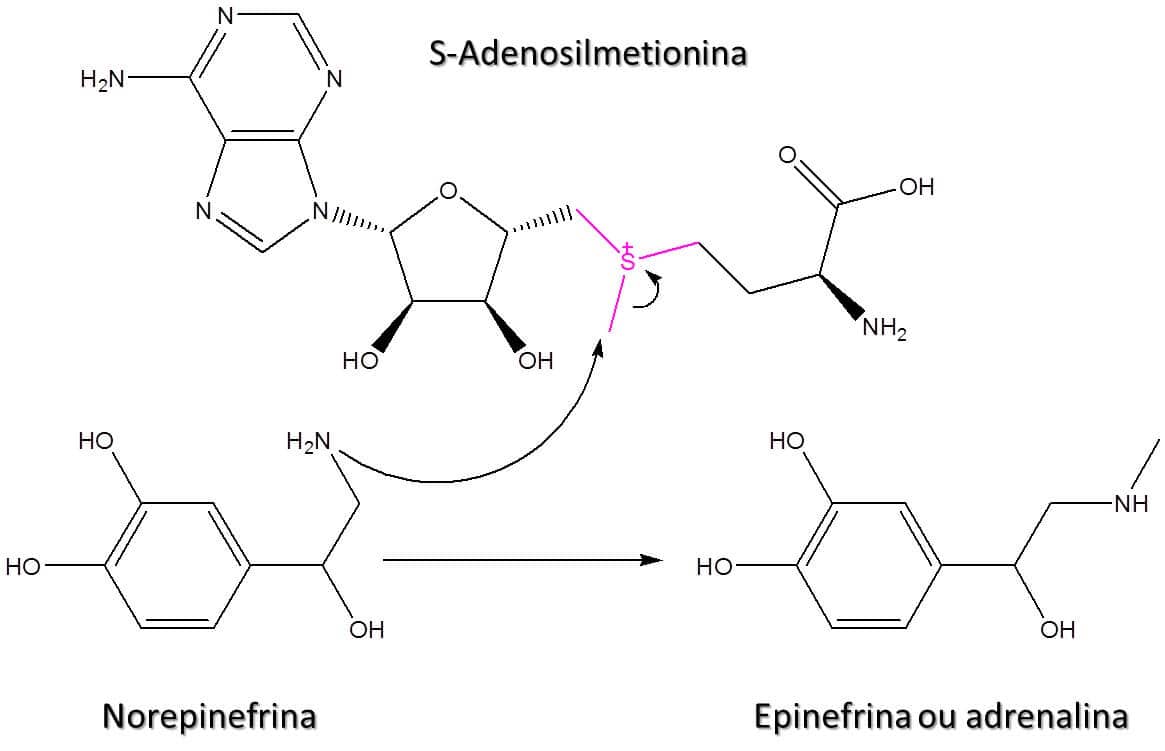
Os sulfetos podem ainda reagir com agentes alquilantes de maneira a formar sais de trialquilsulfônio. Um exemplo muito importante da aplicação da formação desse sal ocorre no organismo humano, no qual a S-adenosilmetionina funciona como um agente metilante na conversão da norepinefrina à epinefrina, mais conhecida como adrenalina (Figura 70).
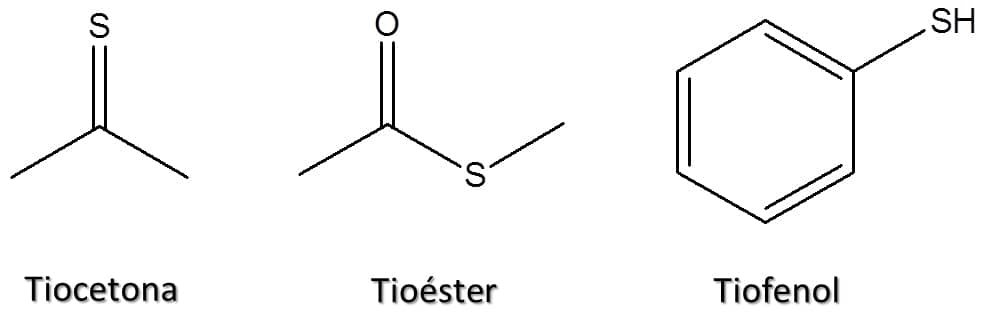
Existem ainda outros compostos sulfurados parecidos com os que vimos quando estudamos os compostos oxigenados. Alguns exemplos estão mostrados na Figura 71.
Compostos halogenados
Diferentemente dos compostos sulfurados, os compostos halogenados são mais comuns no cotidiano dos laboratórios de química orgânica. Isso porque essas substâncias sofrem reações importantes, além de serem utilizadas como solventes.
Haletos de alquila
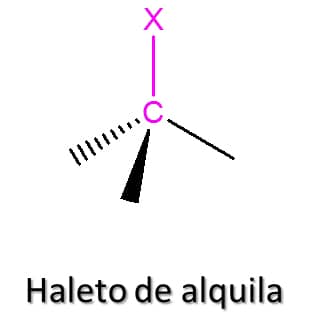
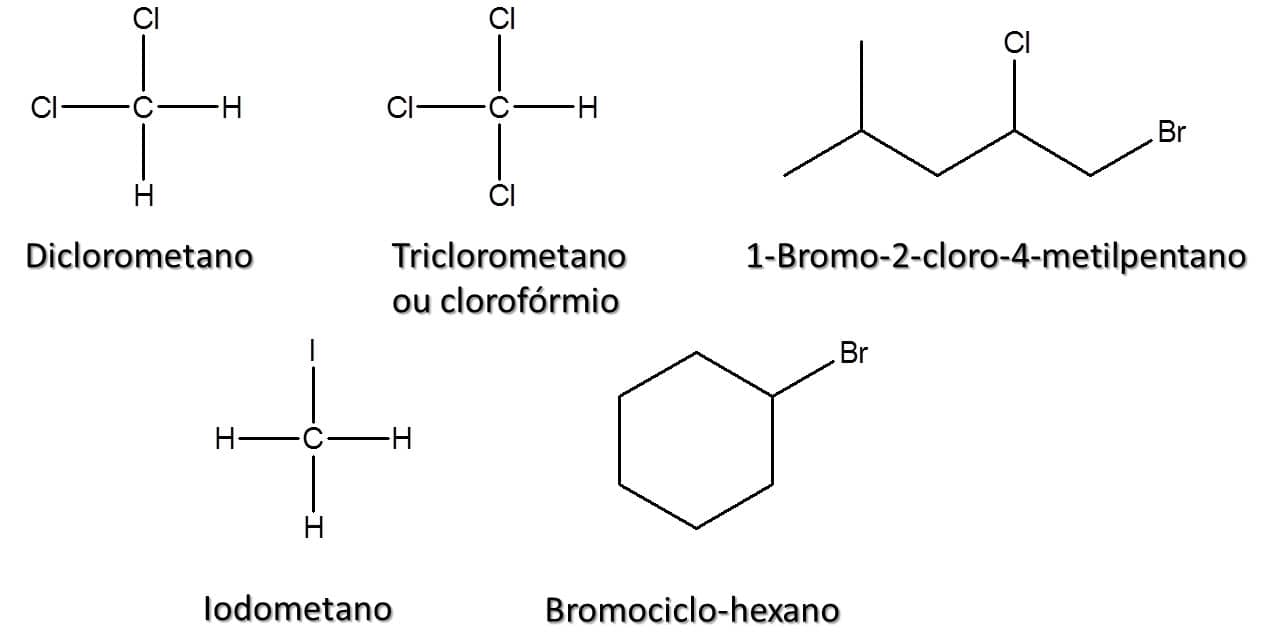
Na natureza, os haletos de alquila podem ser encontrados em algas, em queimadas e em vulcões. Apesar da relevância desses compostos na indústria química, sua utilização deve ser feita com muita cautela, pois muitos dos compostos clorados, por exemplo, apresentam efeito carcinogênico cumulativo importante. Esses compostos têm fórmula geral RX, em que X pode ser flúor, cloro, bromo ou iodo (Figura 72).
Assim como os álcoois que vimos anteriormente, os haletos de alquila são divididos entre primário, secundário e terciário. Nos haletos primários, o átomo de halogênio está ligado a um átomo de carbono que só faz uma ligação do tipo carbono-carbono; em haletos secundários e terciários, o halogênio está ligado a um átomo de carbono que faz duas ou três ligações carbono-carbono respectivamente (Figura 73).
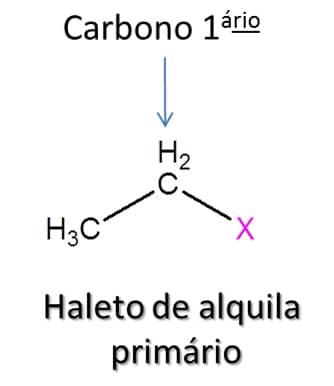
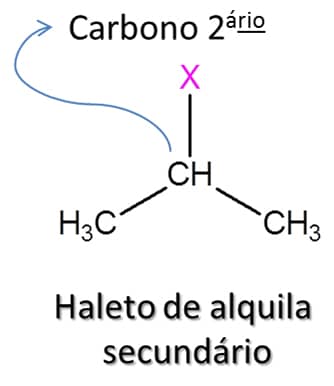
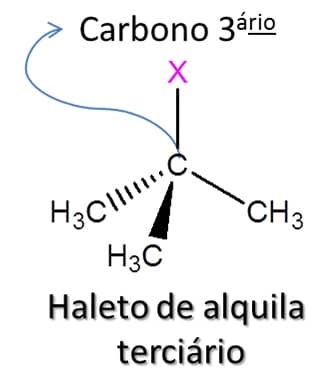
Antes de falarmos das características desses compostos, vamos aprender a nomeá-los, da mesma forma como fizemos com os outros compostos:
Identifique a cadeia principal, que deve ser a cadeia carbônica mais longa possível dentro do composto.
Numere os carbonos de maneira que o carbono um seja o mais próximo possível de um substituinte, seja ele um halogênio ou não. Lembre-se de usar os prefixos di-, tri, tetra-, por exemplo, quando houver mais de uma substituinte do mesmo tipo.
Se a cadeia puder ser nomeada por ambas as extremidades, deve-se seguir a ordem alfabética.
4. Se houver mais de um halogênio na cadeia, eles devem entrar no nome principal seguindo a ordem alfabética.
A Figura 74 traz alguns exemplos de haletos de alquila e seus respectivos nomes.
Características do haletos de alquila
Os halogênios são mais eletronegativos que o carbono, ainda que em maior ou menor grau, o que quer dizer que a ligação C-X é uma ligação polarizada, o que afeta imensamente a química desses compostos e faz com que tenham dipolos constantes na molécula, conforme veremos adiante.
Saiba mais
As forças intermoleculares entre as moléculas de haletos de alquila são forças do tipo dipolo-dipolo e são afetadas ainda pelo halogênio presente na estrutura das moléculas. Esse tipo de força intermolecular é favorecido quanto maior for a distorção da nuvem eletrônica do átomo, ou seja, quanto mais polarizável ele é.
No caso dos halogênios, o elemento mais polarizável é o iodo, que apresenta o maior raio atômico e a menor eletronegatividade, e o menos polarizável é o flúor, que apresenta menor raio atômico e maior eletronegatividade.
A implicação dessa diferença na polarização dos halogênios é que o ponto de ebulição dos diferentes compostos halogenados varia muito.
|
PONTO DE EBULIÇÃO |
|---|
|
O fluorometano tem ponto de ebulição igual a -78°C, enquanto o iodometano tem ponto de ebulição igual a 42°C. |
Outra característica importante que provém do aumento do raio atômico é a força da ligação entre os halogênios e o átomo de carbono.
|
FORÇA DE LIGAÇÃO |
|---|
|
O flúor é o átomo mais eletronegativo, e o comprimento da ligação com o carbono é o menor dentre os halogênios. Por outro lado, o iodo é o menos eletronegativo e é o que tem o maior raio atômico, ou seja, é aquele no qual a ligação carbono-halogênio é mais longa e fraca. |
Esses compostos são ainda muito importantes, pois reagem para formar reagentes de Grignard e outros compostos organometálicos que são altamente reativos e têm extrema relevância na síntese de compostos orgânicos em laboratório.
Reagentes de Grignard
São compostos organometálicos que apresentam em sua estrutura uma átomo de magnésio ligado a um radical orgânico e um halogênio.
Haletos de ácidos
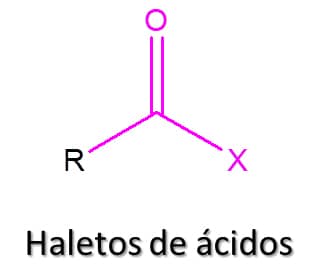
Os haletos de ácidos são uma classe de compostos que deriva dos ácidos carboxílicos, que vimos anteriormente. Nessa classe, o grupo –OH do ácido é substituído por um halogênio, dando origem a um composto de fórmula geral RCOX (Figura 75). Embora existam fluoretos, brometos e iodetos de alquila, os haletos de ácidos mais comuns são os cloretos de alquila.
Nomenclatura de haletos de ácidos
Para nomear os haletos de ácidos, vamos usar como base a nomenclatura que aprendemos para os ácidos carboxílicos. Como?
Identifique o ácido carboxílico de origem.
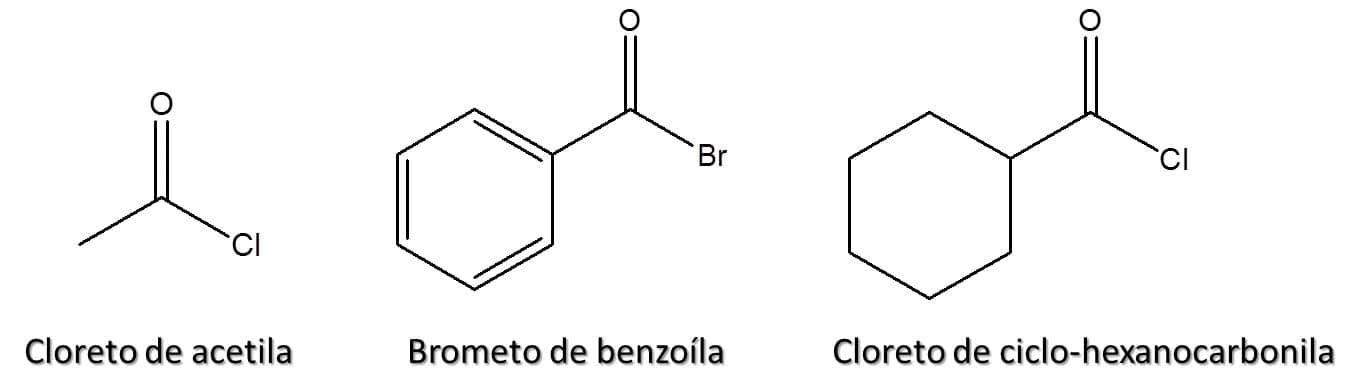
Elimine a palavra “ácido” e substitua a terminação –oico do seu nome pela terminação –ila. Caso seja um composto cíclico, a terminação –carboxílico será substituída pela terminação –carbonila.
A palavra originada na etapa 2 deverá ser precedida de “cloreto”, “brometo”, “iodeto” ou “fluoreto”, dependendo do halogênio em questão, e do termo “de”.
A Figura 76 traz alguns exemplos deste tipo de composto.
Características dos haletos de ácidos
Os haletos de ácidos são os mais reativos dentre os compostos derivados de ácidos. Essa classe é, de fato, tão reativa que não existe na natureza, pois reage muito rapidamente com a água, se decompondo e voltando ao ácido carboxílico de origem. Vamos utilizar os cloretos de ácidos como exemplo, pois são os mais usados na prática.
Atenção
A alta reatividade desses compostos acontece porque o átomo de cloro não é capaz de doar seus pares de elétrons livres de maneira a estabilizar a carbonila; ao contrário, ele tem efeito retirador de elétrons na estrutura, deixando o carbono ainda mais positivo e susceptível a ataques nucleofílicos. Isso significa que, apesar de não existirem na natureza, esses compostos são extremamente importantes na síntese de compostos orgânicos em laboratórios, pois através deles podem-se obter anidridos, ésteres e amidas, por exemplo.
O especialista Luiz Américo Mota apresenta as regras de nomenclatura e nitrogenados, usando diferentes exemplos.:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Ao longo do tema, pudemos aprender a reconhecer diversas funções orgânicas, desde as mais simples, como os hidrocarbonetos, até aquelas que contêm elementos não tão corriqueiros, como o enxofre. Vimos também como nomear esses compostos de modo uniforme para que seja possível a reprodução por qualquer pessoa com conhecimento em química.
Vimos ainda as diferenças de estabilidade nas distintas conformações tridimensionais dos compostos orgânicos. Além disso, aprendemos sobre as principais características das diferentes funções orgânicas que influenciam as propriedades físicas, como ponto de ebulição, e que afetam as reações que cada uma sofre. Esse conhecimento permite melhor entendimento do uso dessas substâncias no cotidiano, como é o caso dos hidrocarbonetos da gasolina ou das pontes de dissulfeto da insulina, e conhecê-los é o primeiro passo para que se possa fazer o melhor uso possível dos compostos.
Podcast
Agora, o especialista Luiz Américo Avelar encerra o tema fazendo um resumo sobre os principais tópicos de cada módulo.
CONQUISTAS
Você atingiu os seguintes objetivos:
Reconheceu os hidrocarbonetos e suas propriedades
Identificou os confôrmeros dos diversos alcanos e cicloalcanos e suas estabilidades
Descreveu as principais funções oxigenadas e nitrogenadas em química orgânica e suas principais características
Identificou as principais funções sulfuradas e halogenadas da química orgânica e suas principais características