Descrição
As estratégias de modificação estrutural para o desenvolvimento de novos fármacos.
PROPÓSITO
Conhecer as principais estratégias de modificação estrutural dos compostos considerados protótipos para o planejamento e desenvolvimento de moléculas mais ativas e menos tóxicas. Isso é importante para que o profissional farmacêutico compreenda como se obtém um novo fármaco. Esse conhecimento está intimamente relacionado à farmacologia e à química orgânica.
OBJETIVOS
Módulo 1
Definir bioisosterismo e hibridação molecular como estratégias de modificação molecular
Módulo 2
Identificar as estratégias de simplificação, homologação e rigidificação moleculares
Módulo 3
Conceituar pró-fármacos e a importância do processo de latenciação de fármacos
Introdução
Neste conteúdo, você irá entender o que é bioisosterismo e como ele é usado para modificar a estrutura de um composto protótipo com o objetivo de se obter uma molécula mais ativa e/ou com menos efeitos indesejáveis e tóxicos. Além do bioisosterismo, você conhecerá várias outras estratégias que apresentam os mesmos objetivos citados, como:
- A hibridação molecular
- A simplificação molecular
- A homologação
- A rigidificação molecular
Abordaremos, além disso, diversos exemplos das aplicações dessas estratégias.
Você entenderá, ainda, como funciona o método de otimização molecular chamado de latenciação, que ajuda a resolver principalmente problemas relacionados à farmacocinética indesejada em um composto protótipo.
MÓDULO 1
Definir bioisosterismo e hibridação molecular como estratégias de modificação molecular
Neste módulo, você estudará importantes estratégias de planejamento de novas moléculas bioativas a partir de compostos protótipos, sendo o bioisosterismo uma das mais importantes. A hibridação molecular, aliada ao bioisosterismo e a outras estratégias que veremos no próximo módulo, também constitui ferramenta valiosa nesse planejamento.
ESTRATÉGIAS DE MODIFICAÇÃO MOLECULAR E OTIMIZAÇÃO DO COMPOSTO PROTÓTIPO
O composto protótipo é obtido no processo de desenvolvimento de fármacos e, a partir dele, é necessário otimizar sua estrutura, objetivando, por exemplo, melhorar:
Seu perfil farmacocinético
Sua atividade biológica ou seletividade
A obtenção de compostos menos tóxicos
Essas modificações estruturais, com o intuito de otimização descritas, são necessárias para o planejamento e síntese de uma série congênere, ou seja, análoga ao composto protótipo. Para isso, a química medicinal utiliza diferentes ferramentas e métodos que veremos em maiores detalhes em nosso conteúdo.
O estudo das modificações estruturais feitas no protótipo é conhecido como relação estrutura-atividade (SAR, do inglês, Structure Activity Relationship).
BIOISOSTERISMO
O bioisosterismo é uma das estratégias mais utilizadas na química medicinal e busca tanto a otimização das propriedades farmacocinéticas como farmacodinâmicas de um composto. Ele surgiu a partir do isosterismo aplicado a substâncias bioativas.
A Regra do Hidreto de Grimm (em 1925) ajudou muito o bioisosterismo a se estabelecer como uma estratégia de modificação molecular. Segundo essa regra teórica, a adição de um hidreto (H-) a um átomo dá origem a um “pseudoátomo” com as mesmas propriedades físicas daqueles átomos que estão presentes na coluna seguinte da tabela periódica. Vamos entender melhor esse conceito observando a figura a seguir:
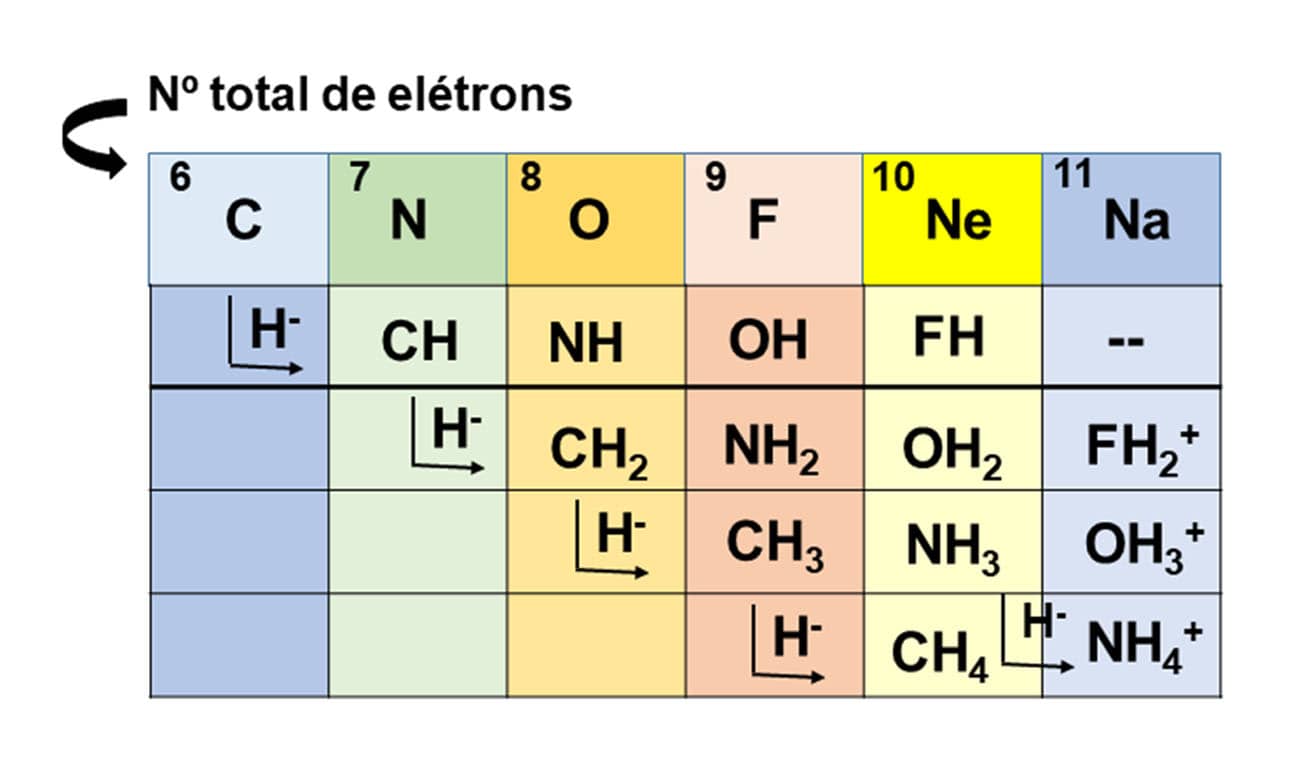
O bioisosterismo é divido em clássico e não clássico.
Bioisosterismo clássico
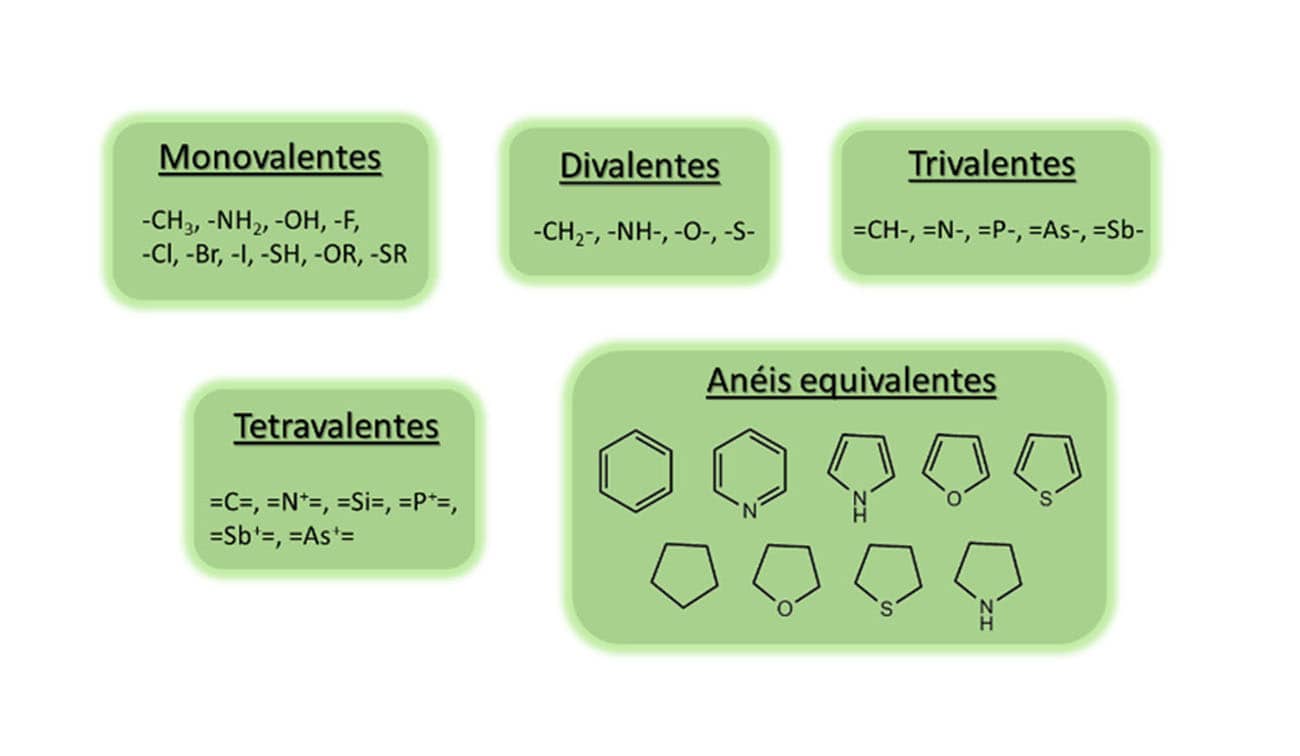
Engloba os átomos, grupos ou radicais monovalentes, divalentes, trivalentes, tetravalentes e a equivalência de anéis, aromáticos ou não.
Bioisosterismo não clássico
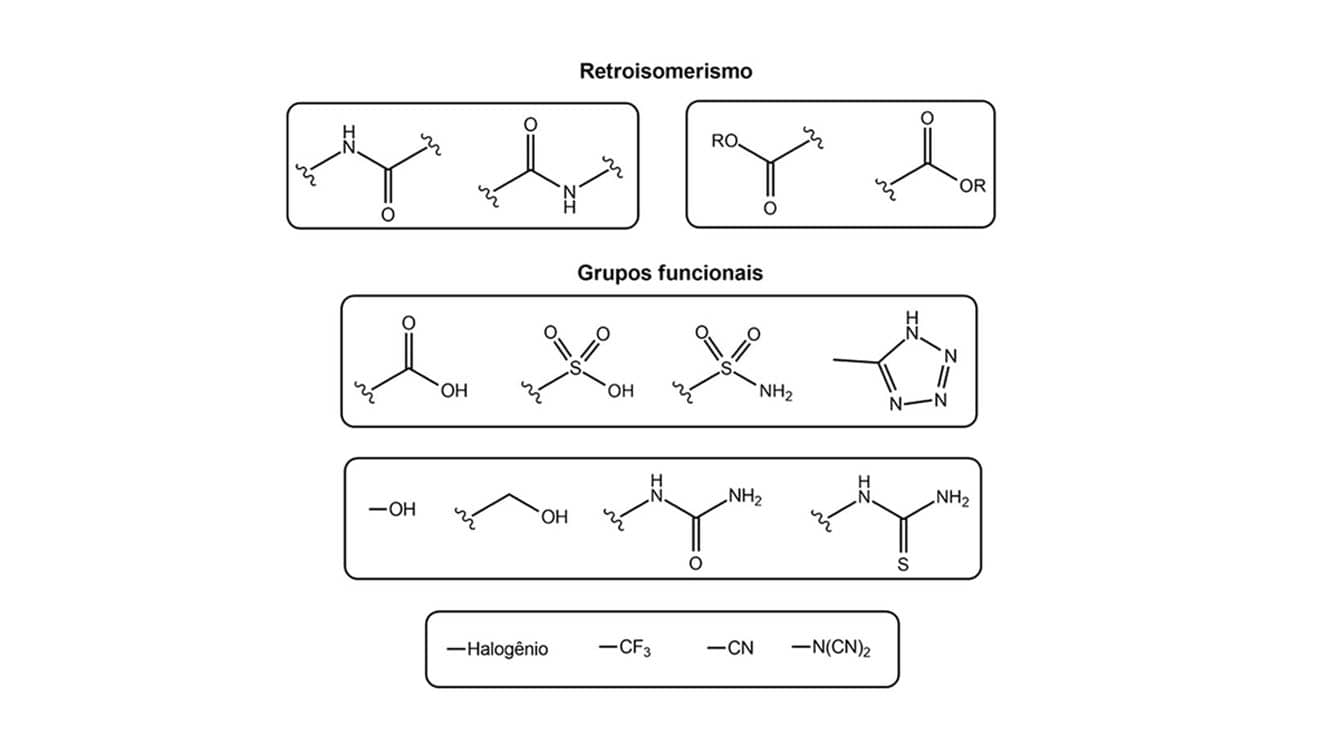
Envolve os casos não classificados como clássico, além de retroisomerismo, introdução e abertura de anéis, grupos funcionais equivalentes.
As figuras a seguir nos mostram bem essa classificação.
Há diversos exemplos do uso do bioisosterismo que mostram a sua versatilidade na modificação molecular de um composto protótipo ou ligante com intuitos variados, como:
- Aumento da potência e seletividade
- Alteração das propriedades físico-químicas
- Redução do metabolismo
- Eliminação ou redução dos grupos toxicofóricos
O bioisosterismo também é amplamente empregado para o desenvolvimento de fármacos me-too e para superar barreiras impostas por proteção de patentes.
Quando o químico medicinal for propor o planejamento de substâncias análogas ao protótipo, ele deverá estar atento às substituições bioisostéricas que irá realizar. Além dos objetivos já citados anteriormente, o “ideal” é que a substituição não altere de maneira significativa a interação da nova molécula com seu alvo.
Além disso, alguns fatores devem ser levados em conta na tentativa de se prever, ao menos teoricamente, como se comportará a nova estrutura após a modificação bioisostérica. Deve-se considerar, dentre outros fatores:
- O volume e o tamanho molecular.
- O grau de hibridização e polarizabilidade dos átomos.
- Os efeitos de indução e ressonância.
- Como a substituição vai alterar o pKa e log P.
- A reatividade dos grupos funcionais em relação ao metabolismo.
Me-too
Em português, essa expressão significa “eu também”, e engloba os fármacos que apresentam uma estrutura química muito parecida com algum fármaco já conhecido no mercado. Os fármacos me-too são considerados “cópias terapêuticas” e atuam pelo mesmo mecanismo de ação do fármaco conhecido que lhe deu origem.
Substituições bioisostéricas clássicas
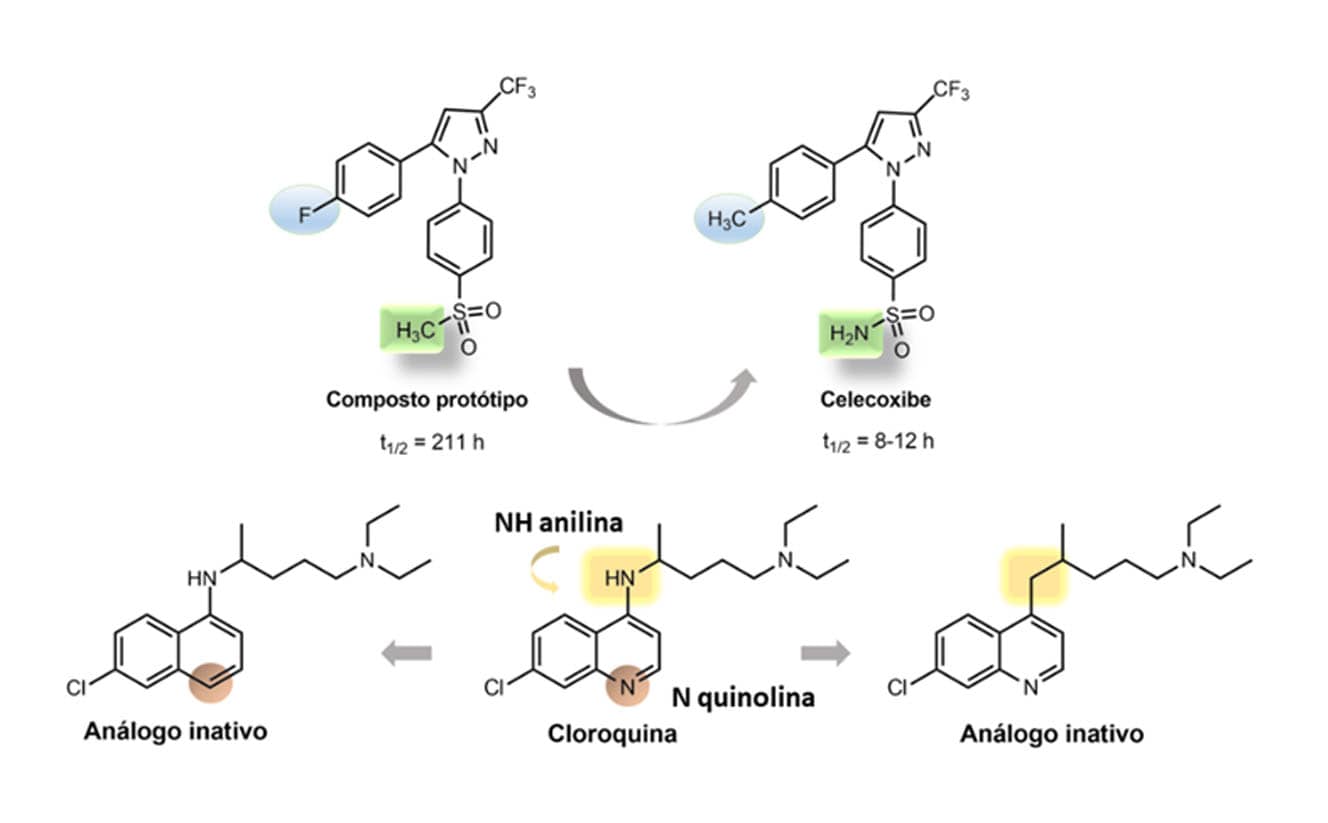
A descoberta do fármaco celecoxibe é um exemplo da utilização do bioisosterismo clássico de átomos monovalentes. O celecoxibe foi o primeiro da classe dos anti-inflamatórios não esteroidais (AINEs) que não provocava os efeitos adversos de irritação gástrica dos primeiros AINEs, devido à inibição seletiva da isoforma induzida da enzima prostaglandina endoperóxido sintase-2.
O fármaco foi desenhado a partir de duas substituições bioisostéricas no composto protótipo: o grupo metila (-CH3) foi trocado por um grupo amino (-NH2); e o flúor (-F), pela metila.
Podemos observar na figura a seguir que o protótipo apresentava um tempo de meia-vida maior que 200h, provavelmente, devido a sua baixa metabolização hepática, e que as substituições realizadas introduziram grupos sensíveis ao metabolismo, reduzindo assim seu tempo de meia-vida.
As substituições bioisostéricas nos mostram também a importância de não se alterar aqueles grupamentos essenciais à atividade farmacológica de uma molécula, ou seja, seus grupamentos farmacofóricos.
200h
O conteúdo on-line é produzido para que você possa acessá-lo como desejar, pelo computador, pelo smartphone, por suportes de diferentes tamanhos. Assim, usamos uma tecnologia para atender a todos. Em nosso material, unidades de medida e números são escritos juntos (ex.: 25km). No entanto, o Inmetro estabelece que deve existir um espaço entre o número e a unidade (ex.: 25 km). Logo, os relatórios técnicos e demais materiais escritos por você devem seguir o padrão internacional de separação dos números e das unidades.
Exemplo
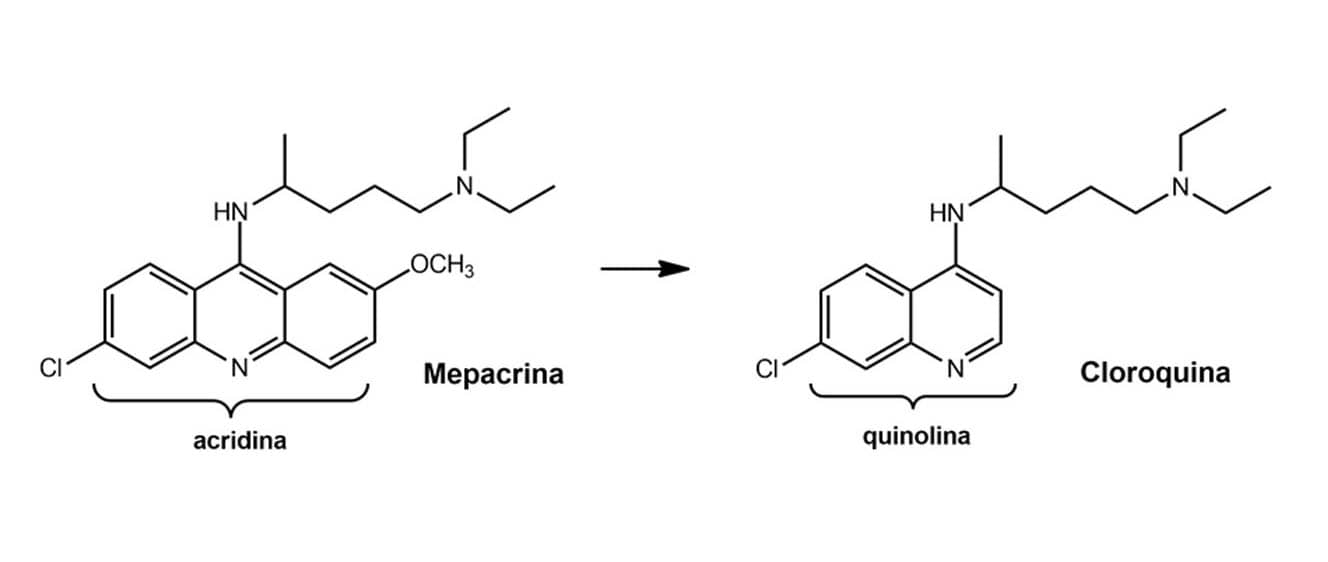
Vamos ver o caso do antimalárico de primeira geração ― cloroquina. Duas trocas bioisostéricas foram feitas em sua estrutura: uma de átomos divalentes e outra de átomos trivalentes, obtendo-se dois compostos, respectivamente, sem atividade antimalárica. As trocas realizadas foram: -NH- da anilina pelo –CH2- e =N- da quinolina pelo =CH-. Os resultados indicam a importância de se manter esses grupamentos na estrutura da cloroquina.
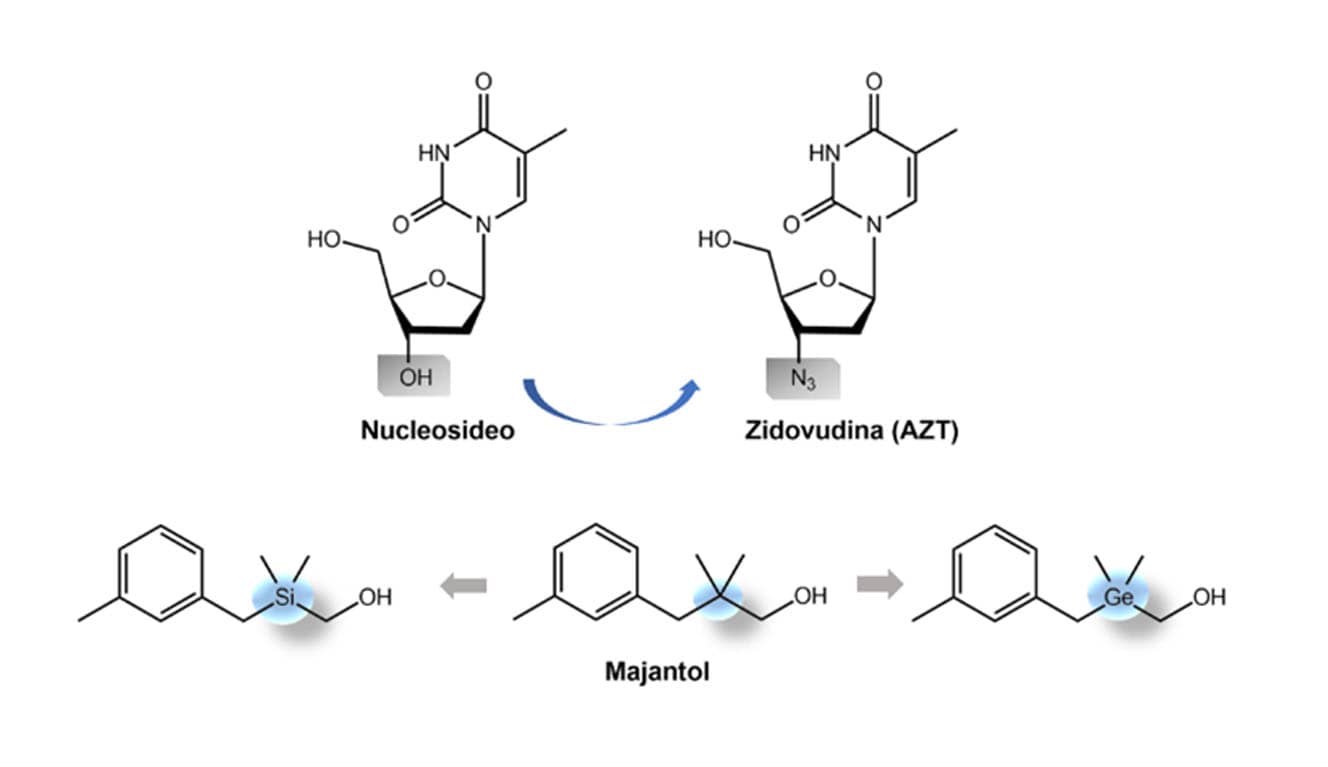
Outro importante exemplo é a zidovudina (AZT), um inibidor da transcriptase reversa do HIV, que teve como fonte de inspiração protótipos nucleosídeos de origem marinha. Podemos observar a troca bioisostérica entre os grupos monovalentes hidroxila (-OH), presente na estrutura do nucleosídeo, e azida (-N3) presente no AZT. O bioisosterismo pode ser utilizado não só na área farmacêutica, mas também em outras áreas.
O majantol é um composto usado na indústria dos perfumes para a obtenção de uma fragrância floral. Ele teve suas propriedades organolépticas modificadas pelo uso do bioisosterismo de átomos tetravalentes, por meio das trocas do carbono pelo silício e germânio, chegando-se a compostos com outros tipos de fragrâncias.
A troca isostérica de um átomo de carbono pelo silício não é muito comum na indústria farmacêutica porque esses dois átomos apresentam diferenças consideráveis em tamanho, eletronegatividade e lipofilicidade, além da instabilidade das ligações Si-hidrogênio no organismo.
A figura a seguir apresenta as modificações por bioisosterismo que deram origem à zidovudina e as que ocorreram no majantol.
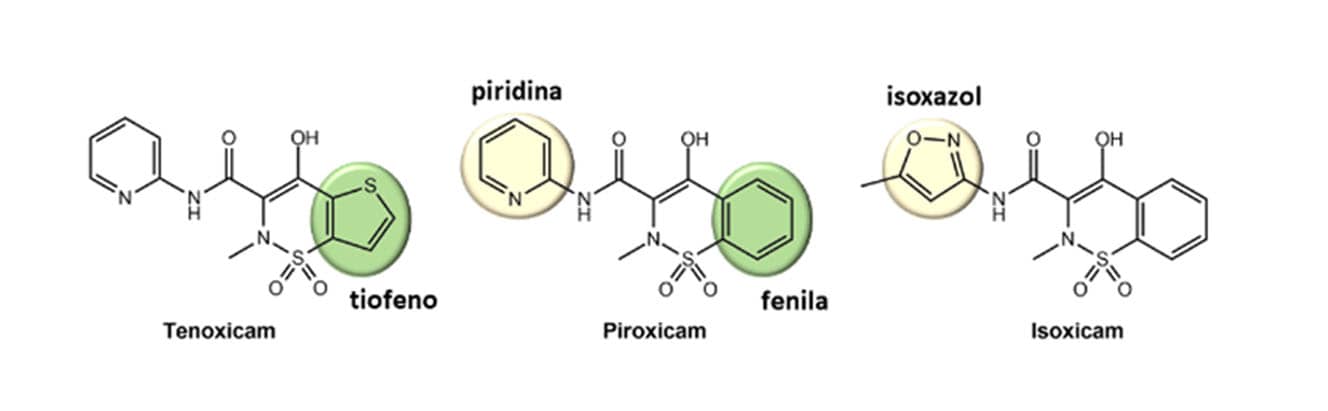
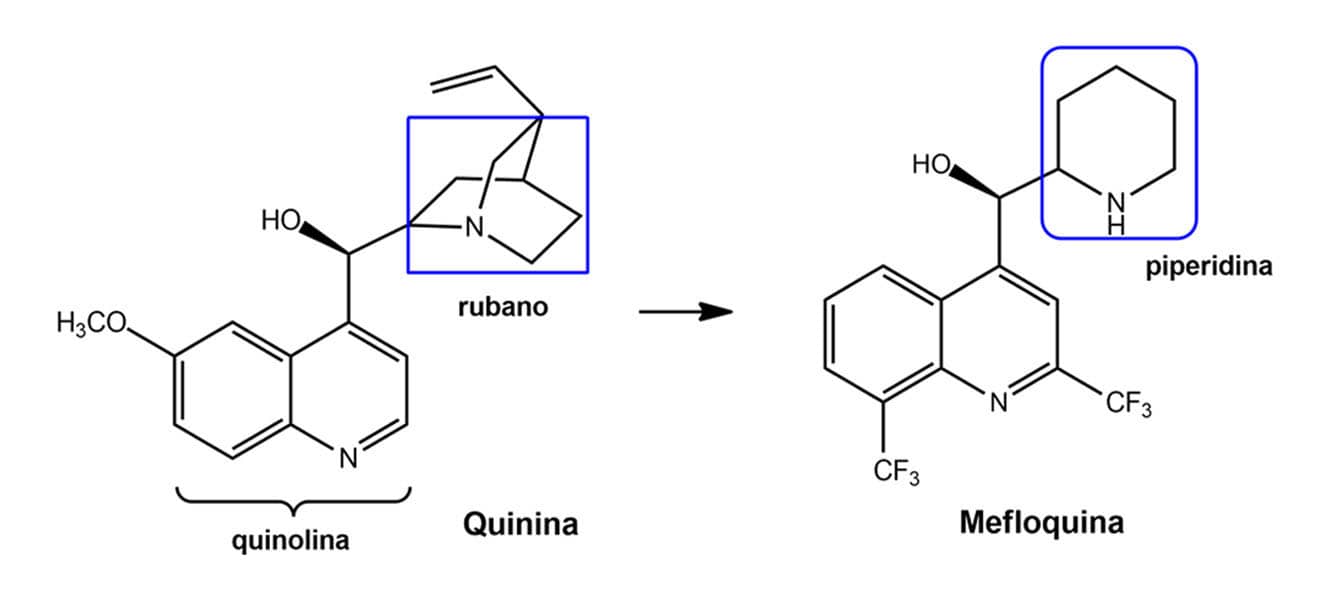
O bioisosterismo clássico de anéis é usado com bastante frequência para o planejamento de novas estruturas bioativas. Assim foi o caso dos fármacos tenoxicam e isoxicam planejados como bioisósteros do piroxicam, um anti-inflamatório não esteroidal da classe dos oxicans que age pela inibição da enzima cicloxigenase (COX).
Observamos na figura a seguir a troca bioisostérica do anel fenila presente no piroxicam pelo heterociclo tiofeno do tenoxicam, bem como a substituição da piridina pelo metilisoxazol. A atividade farmacológica do tenoxicam se manteve similar à do piroxicam, bem como sua grande meia-vida plasmática, desejável para esse tipo de fármaco. Em relação ao isoxicam, apesar da sua atividade biológica adequada, ele foi retirado do mercado devido a reações adversas dermatológicas graves.
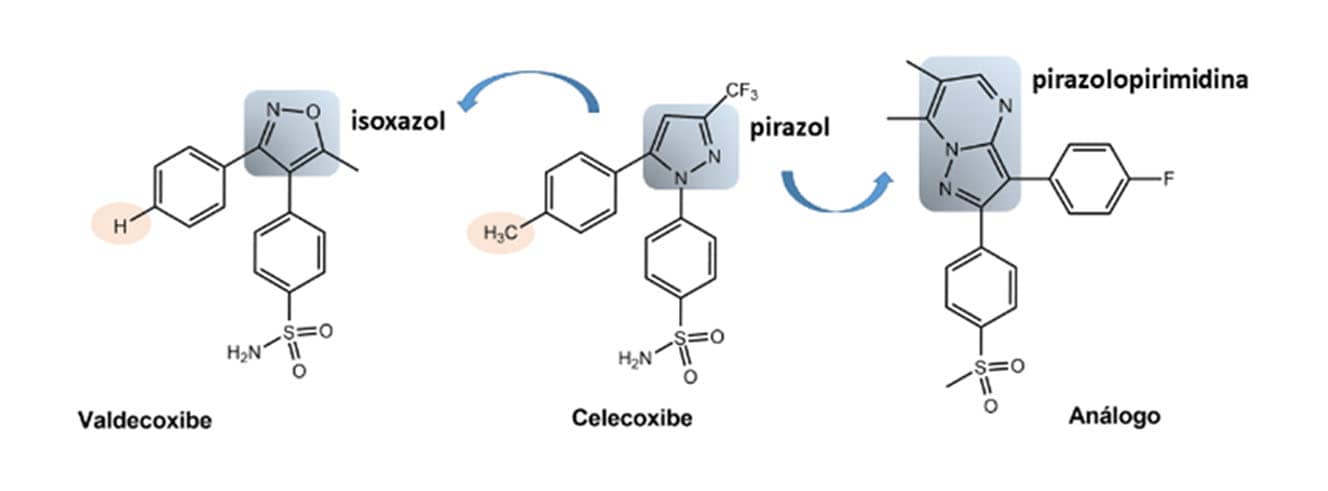
Ainda dentro da classe dos AINEs, o celecoxibe serviu de composto protótipo para substituições estruturais, como a troca bioisostérica do anel pirazol presente nesse fármaco e o anel biciclo pirazolopirimidina presente na estrutura do seu análogo. Nesse caso, houve uma melhora do valor de IC50 para a inibição da enzima COX-2 (IC50 = 0,08µM para o análogo/ IC50 = 0,6µM celecoxibe), ou seja, o análogo foi mais ativo que o celecoxibe e mais seletivo em relação à enzima COX-1, porém, não apresentou biodisponibilidade oral adequada.
Após a descoberta do celecoxibe, outros fármacos dessa mesma classe foram introduzidos no mercado ― e alguns já retirados ― tendo o mesmo padrão estrutural. Como exemplo, podemos citar o valdecoxibe, o rofecoxibe, o etoricoxibe e o lumiracoxibe. Observamos relações bioisostéricas clássicas entre essas estruturas, como, por exemplo, o bioisosterismo de anéis por meio da troca do anel pirazol do celecoxibe pelo isoxazol do valdecoxibe; e o bioisosterismo de grupos monovalentes, pela troca da metila (celecoxibe) pelo átomo de hidrogênio (valdecoxibe).
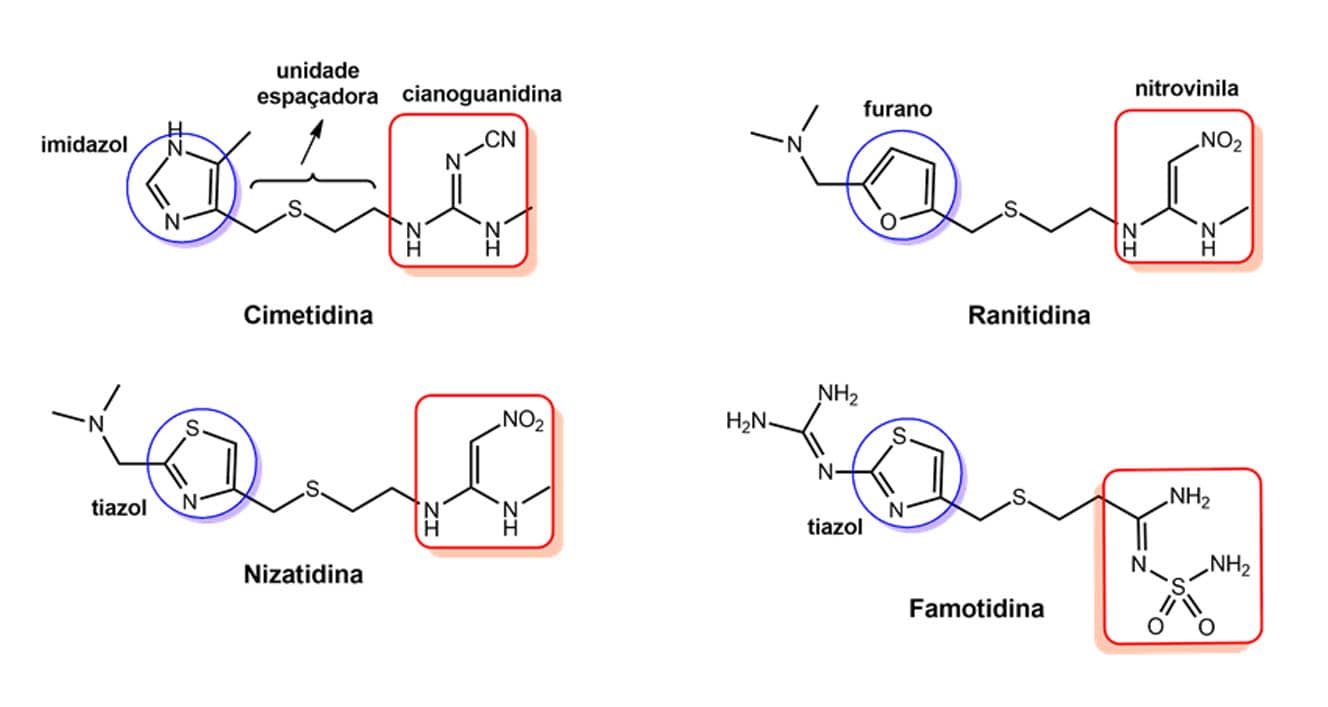
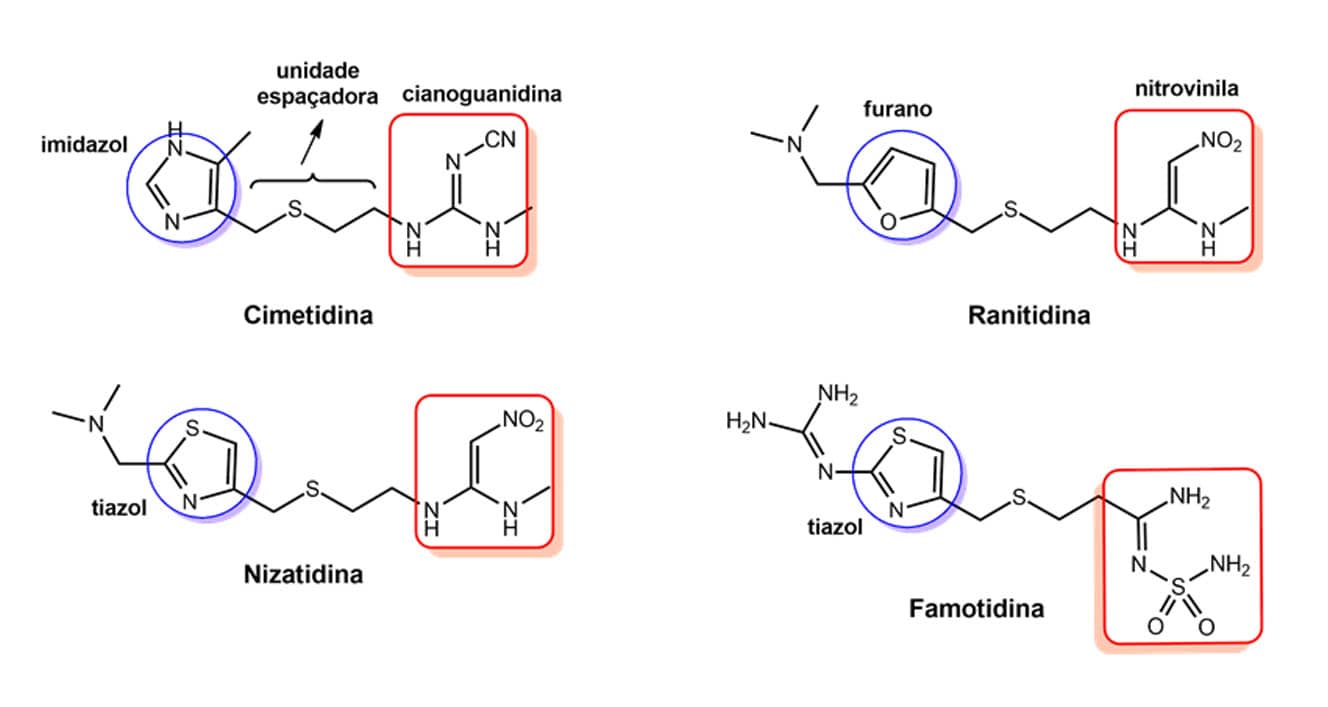
Agora, você irá entender como o bioisosterismo tem grande utilidade na descoberta desses fármacos me-too, também conhecidos como cópias terapêuticas. Para isso, vamos abordar alguns exemplos, iniciando pela cimetidina e pelos fármacos me-too que foram desenvolvidos a partir dela.
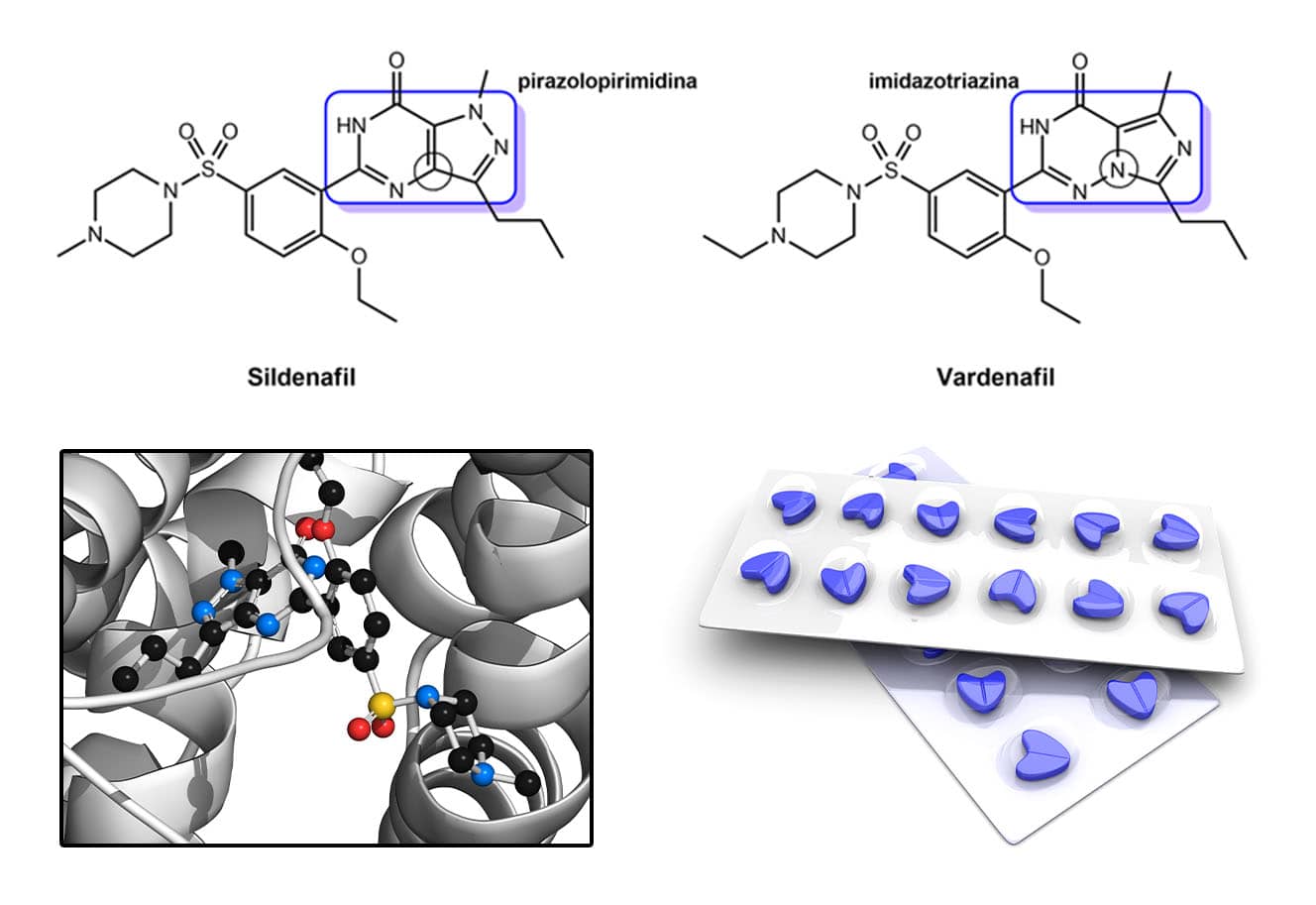
Outro exemplo da aplicação de sucesso do bioisosterismo no planejamento de fármacos me-too foi a descoberta do vardenafil, bioisóstero do protótipo sildenafil. Esses compostos são usados para tratar a disfunção erétil e agem pelo mecanismo de inibição seletiva da enzima fosfodiesterase 5 (PDE-5), sendo o sildenafil (Viagra) o primeiro fármaco atuando por esse mecanismo e para essa indicação.
Observando a figura a seguir, vemos a grande similaridade estrutural entre eles, porém, a principal diferença foi a troca isostérica de um carbono sp2 heterocíclico por um nitrogênio. Dessa forma, o anel pirazolopirimidina do sildenafil passa a ser um isóstero clássico imidazotriazina no vardenafil. Apesar da pequena diferença entre essas estruturas e da potência similar, o vardenafil foi 160 vezes mais seletivo para a PDE-5 em relação à PDE-6, enquanto o sildenafil foi somente 7 vezes mais seletivo nessa relação.
Substituições bioisostéricas não clássicas
O bioisosterismo não clássico também é muito empregado no planejamento de novas moléculas e suas principais estratégias são anelação ou fechamento de anel, bioisosterismo não clássico de grupos funcionais e retroisomerismo. Vamos ver do que trata cada uma dessas abordagens.
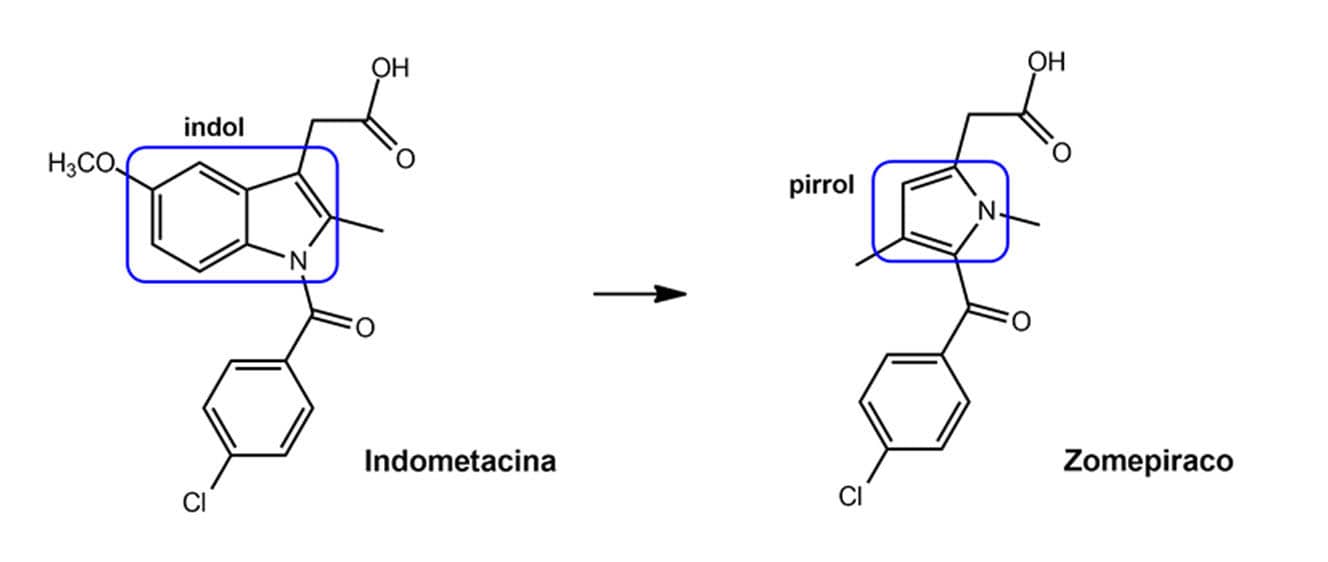
Podemos observar um exemplo de anelação como estratégia bioisostérica de planejamento de novos compostos na figura a seguir, que mostra a obtenção de derivados da classe dos AINEs. O anti-inflamatório cetroplac foi desenhado explorando o fechamento de anel a partir do protótipo tolmetina, que também é um conhecido AINE.
Observem que, se fecharmos um anel entre a cadeia lateral ácido acético e a porção N-metilada da tolmetina, teremos a estrutura cíclica presente no cetroplac. A tolmetina também foi planejada a partir da indometacina, que é um representante da classe dos ácidos 3-indolilacéticos, mediante a substituição do heterociclo indol pelo pirrol, além da substituição clássica de grupos monovalentes entre o cloro e a metila da função benzoíla.
A indometacina também deu origem ao zomepiraco, que é análogo à tolmetina e que, assim como esta, pode dar origem ao cetroplac pelo fechamento de anel.
O bioisosterismo não clássico de grupos funcionais também é muito utilizado no planejamento estrutural de moléculas e pode ser representado pelos exemplos mostrados na figura a seguir.
A sulfanilamida é um antibiótico da classe das sulfonamidas usado como antibacteriano e que, devido a sua semelhança estrutural com o ácido para-aminobenzoico (PABA), age competindo com ele pela enzima di-hidropteroato sintetase, inibindo o crescimento e multiplicação das bactérias.
Podemos observar a relação bioisostérica entre os grupos funcionais sulfonamida, presente na sulfanilamida, e ácido carboxílico, do PABA. Essas moléculas apresentam aspectos muito similares como propriedades físico-químicas, pKa e log P, e parâmetros eletrônicos e conformacionais.
A função ácido carboxílico tem vários grupamentos considerados bioisósteros, e um dos mais conhecidos é o anel tetrazol. Esses dois grupamentos apresentam características semelhantes, como a acidez, pois ambos apresentam um hidrogênio ácido, porém o tetrazol é mais lipofílico, característica importante para uma molécula conseguir atravessar membranas. Podemos ver essa troca bioisostérica no planejamento da losartana, fármaco anti-hipertensivo, a partir do seu composto protótipo.
O retroisomerismo consiste na inversão da posição de um grupo funcional, ou seja, os bioisósteros apresentam a mesma função com os mesmos pontos de interação com o receptor, só que em posições invertidas.
Assim como as outras estratégias, o retroisomerismo visa à otimização das características farmacoterapêuticas de um composto protótipo.
Temos como exemplo de retroisomerismo apresentado na figura a seguir o planejamento da lidocaína, um antiarrítmico com propriedades anestésicas. Ela se originou a partir de modificações estruturais da cocaína, chegando-se à procainamida, cuja inversão da posição dos grupos carbonila (C=O) e amina (N-H) da amida resultou no retroisóstero.
HIBRIDAÇÃO MOLECULAR
Assim como o bioisosterismo, a hibridação molecular tem sido bastante usada como estratégia de planejamento e modificação estrutural para a obtenção de novos compostos.
Você sabe do que se trata essa estratégia? Pelo nome, podemos imaginar algo do tipo híbrido?
Sim
Isso mesmo! A hibridação molecular consiste na junção em uma mesma molécula de partes estruturais de moléculas distintas, formando um híbrido de dois compostos.
Não
Não é bem assim! A hibridação molecular consiste na junção em uma mesma molécula de partes estruturais de moléculas distintas, formando um híbrido de dois compostos.
Esse híbrido poderá apresentar um sinergismo ou incremento da atividade farmacológica das moléculas precursoras, caso elas tenham a mesma atividade, ou ele poderá ter duas atividades farmacológicas distintas, porém, combater causas ou sintomas da mesma doença. Ainda, o híbrido poderá ter um efeito modulador se ele resultar da união de partes de uma molécula que apresente um determinado efeito indesejado, com outra molécula que poderá anular ou minimizar esse efeito da primeira molécula.
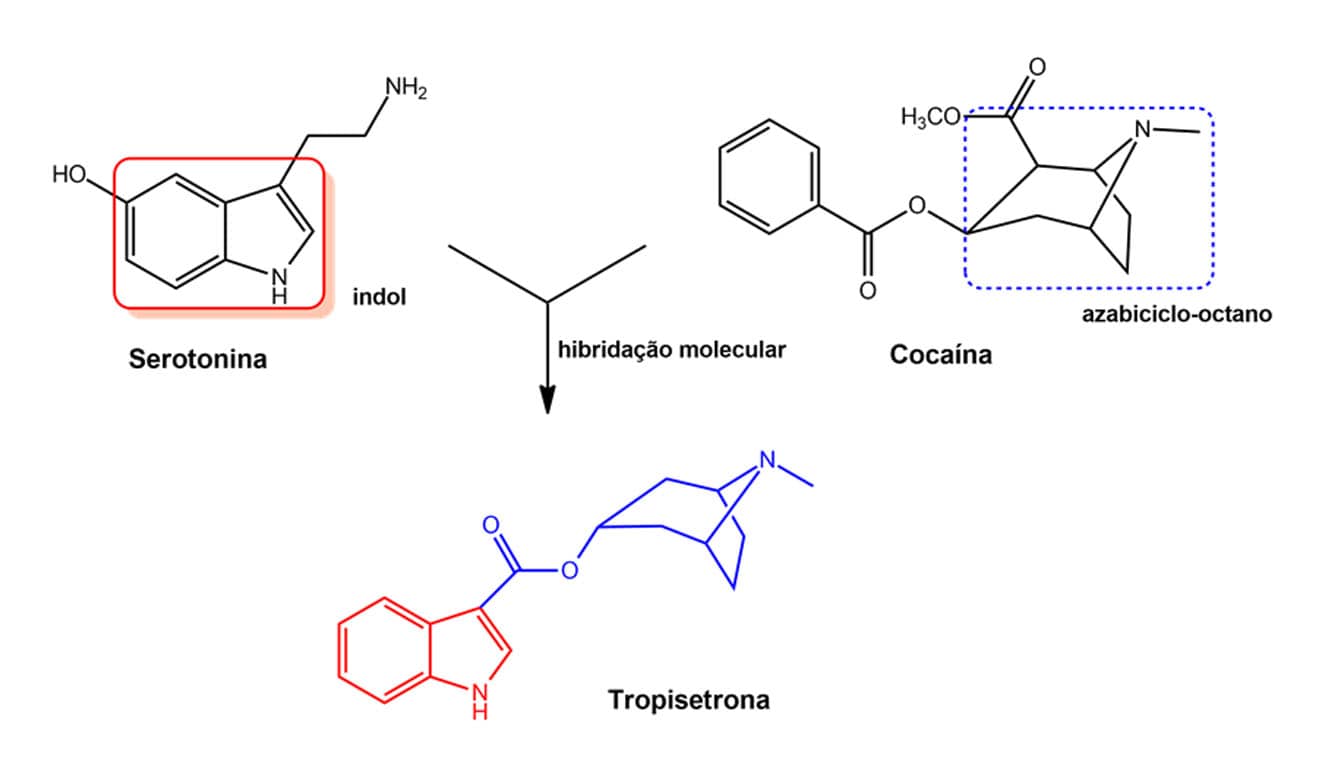
Veja na figura a seguir uma utilização da estratégia de hibridação molecular no desenho do fármaco tropisetrona. Esse fármaco é usado como antiemético na prevenção de vômitos induzidos por quimioterapia, e atua pelo antagonismo seletivo dos receptores serotoninérgicos 5-HT3. Observe que a tropisetrona foi desenhada a partir da hibridação da serotonina, usando seu núcleo indol, e da cocaína pelo sistema bicíclico azaoctano, mantendo a função éster dessa última.

APLICAÇÃO DE BIOISOSTERISMO NA OBTENÇÃO DE NOVAS MOLÉCULAS
Agora, o especialista Emerson Peçanha explicará o conceito de bioisosterismo e apresentará exemplos de sua aplicação, através de exemplos diversos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar as estratégias de simplificação, homologação e rigidificação moleculares
OUTRAS ESTRATÉGIAS DE MODIFICAÇÃO MOLECULAR E OTIMIZAÇÃO DO COMPOSTO PROTÓTIPO
Vimos que um composto protótipo ainda não é uma estrutura que podemos chamar de fármaco, pois ela não apresenta todas as características aprimoradas de um. Essas características, na maioria dos casos, precisam ser otimizadas.
Podemos citar como exemplo
- Perfil farmacocinético adequado.
- Melhor atividade biológica e/ou seletividade.
- Toxicidade reduzida.
Relembrando
E é aí que entram as estratégias estudadas no módulo 1. Você já estudou como funciona o bioisosterismo, uma das principais ferramentas usadas pelos químicos medicinais, e a hibridação molecular.
Neste módulo, você entenderá como funcionam outras estratégias não menos importantes que as já descritas e que, juntamente com elas, podem ser de grande utilidade na descoberta de novos padrões estruturais bioativos.
SIMPLIFICAÇÃO MOLECULAR
A estratégia de simplificação molecular consiste na modificação da estrutura do composto protótipo simplificando o seu padrão estrutural, ou seja, desenhando moléculas mais simples, porém, mantendo os grupamentos farmacofóricos.
Os produtos naturais foram e ainda são importantes fontes de compostos bioativos e protótipos que, ao sofrerem modificações em suas estruturas, deram origem a novos fármacos. Dentro desse contexto, existem diversos exemplos da utilização da estratégia de simplificação molecular de produtos naturais para obtenção de compostos sintéticos ativos.
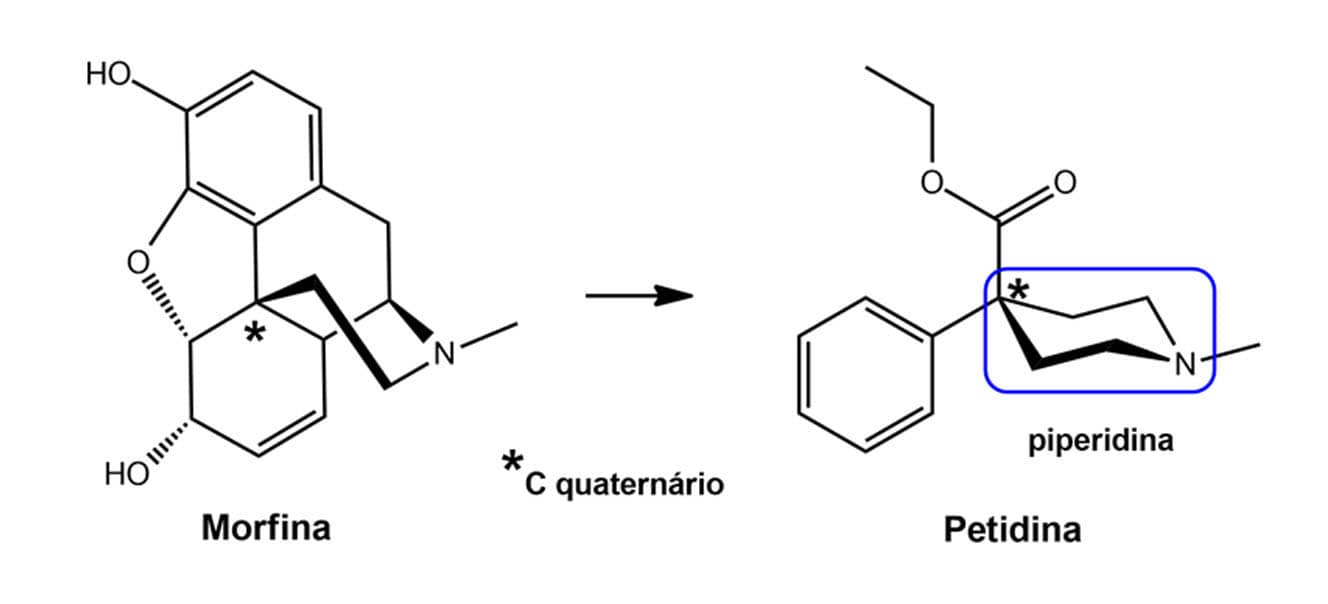
A petidina, usada como analgésico para dores de intensidade média e alta, é um exemplo clássico de simplificação molecular, e foi obtida tendo como protótipo a morfina, um alcaloide isolado de Papaver somniferum.
Saiba mais sobre a petidina:
Exemplos de fármacos desenvolvidos por simplificação molecular:
Um exemplo do planejamento de um fármaco baseado na estrutura do substrato natural da enzima foi o aciclovir (Zovirax). O nucleosídeo substrato das enzimas quinases usadas no ciclo reprodutivo do vírus teve sua estrutura modificada por meio da estratégia de simplificação molecular. Os carbonos estereogênicos presentes no heterociclo do tipo tetraidrofurano do nucleosídeo foram eliminados mediante a simplificação da estrutura da molécula, dando origem ao aciclovir.
É um fármaco anti-hipertensivo inibidor da enzima conversora de angiotensina (ECA) também desenvolvido por simplificação molecular. A história desse fármaco conta com a participação de um pesquisador brasileiro, o professor Sérgio Henrique Ferreira, do Departamento de Farmacologia da Faculdade de Medicina de Ribeirão Preto (SP). O professor Sérgio descobriu que, na peçonha da jararaca (Bothrops jararaca), havia substâncias que causavam diminuição rápida da pressão arterial e, dentre elas, o nonapetídeo chamado teprotido.
Essa substância serviu de protótipo para o desenho do captopril que foi sintetizado e comercializado pela farmacêutica Squibb. Os pesquisadores buscavam uma molécula tão ativa como o teprotido, mas que não fosse um peptídeo, devido aos problemas farmacocinéticos relacionados a essa classe de substâncias quando administradas por via oral. Inicialmente, eles identificaram a succinil prolina e, posteriormente, o captopril pela introdução de uma metila e substituição da carboxila por um tiol.
A estratégia de simplificação molecular foi aplicada não somente a produtos naturais como exemplificamos anteriormente, mas também a fármacos sintéticos, como veremos a seguir.
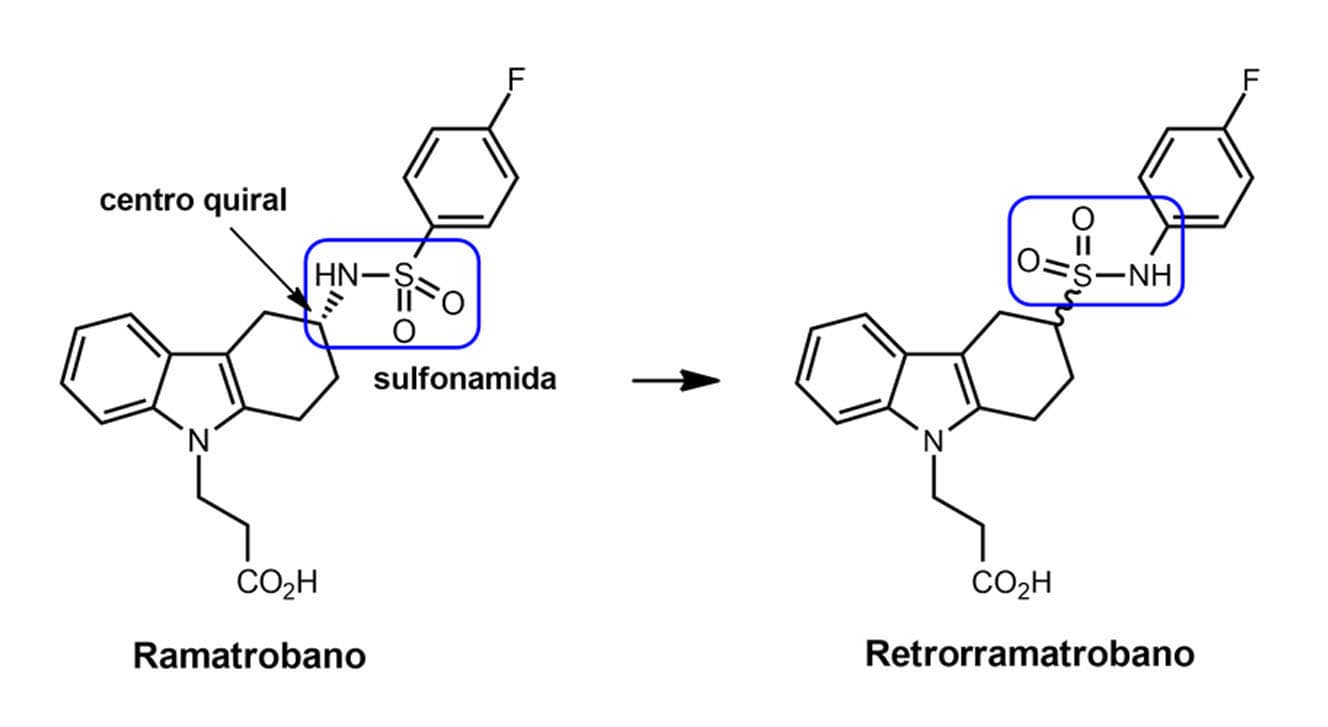
Você pode observar na figura a seguir mais um exemplo da simplificação molecular no planejamento de novos compostos, como no caso do ramatrobano, um fármaco antiasmático e antialérgico que age pelo mecanismo de antagonismo dual dos receptores de tromboxana A2 (TXA2) e prostaglandina D2 (PGD2). Para o desenho do retrorramatrobano foram aplicadas duas técnicas, a simplificação molecular pela eliminação do único centro quiral presente no ramatrobano, e o retroisomerismo da função sulfonamida, tipo de bioisosterismo não clássico estudado do módulo anterior.
HOMOLOGAÇÃO MOLECULAR
Os estudos da relação estrutura-atividade (SAR) envolvem diversas estratégias de modificação/otimização molecular, conforme você está estudando neste conteúdo. Os estudos da SAR são de fundamental importância, pois permitem desenvolver compostos com maior potência e índice terapêutico.
A estratégia de homologação consiste na introdução de grupos metileno (-CH2) em cadeias lineares ou em anéis, formando homólogos lineares ou homólogos cíclicos, respectivamente. Pode-se também introduzir grupos metila (-CH3) na estrutura do composto protótipo, formando um homólogo ramificado. Além disso, há os homólogos chamados vinílogo e fenílogo, que são resultados da introdução de uma ligação dupla (insaturação) e de um grupo fenila, respectivamente.
Você estudará agora diversos exemplos interessantes da aplicação dessa estratégia e como ela pode alterar de forma significativa questões como:
- Propriedades farmacocinéticas
- Tamanho e conformação da molécula
- Alteração no perfil de interação com o sítio receptor
Em geral, a introdução de grupos metileno (-CH2) em cadeias lineares ou em anéis leva a um aumento no tamanho e lipofilicidade das moléculas, e sabemos que substâncias lipofílicas atravessam mais facilmente membranas biológicas. Portanto, a obtenção de homólogos lineares ou cíclicos pode vir a aumentar a potência deles.
Esse tipo de modificação estrutural pode levar também à modificação na atividade farmacológica de um composto protótipo, resultando em um análogo com propriedades bem diferentes em alguns casos.
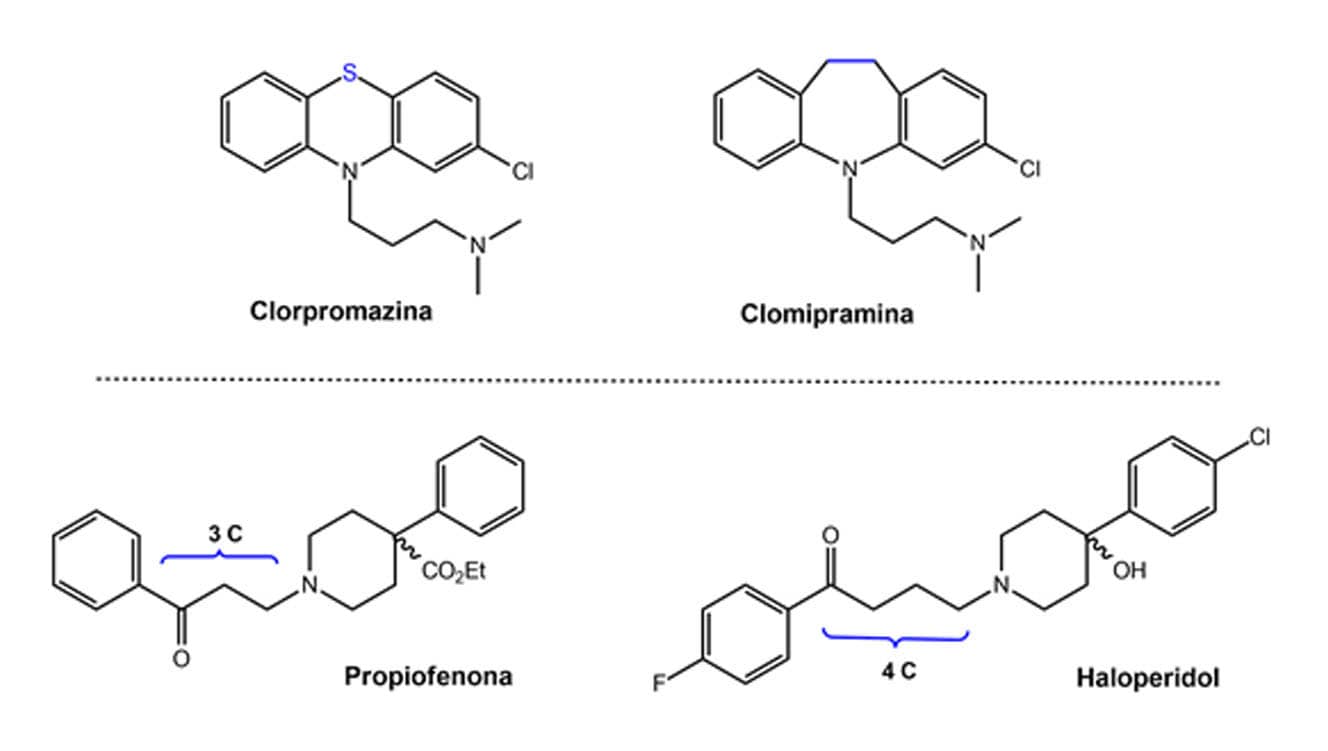
Observando as estruturas da figura a seguir vemos que a clomipramina, um homólogo da clorpromazina resultante da substituição do enxofre por 2 metilenos (-CH2-CH2-), apresenta uma ação antidepressiva, diferente da clorpromazina, que é um antipsicótico.
O haloperidol revolucionou o tratamento das psicoses, como a esquizofrenia, após a sua descoberta, pois substituiu o tratamento por eletrochoque em diversos distúrbios psiquiátricos. Esse fármaco pertence à classe das butirofenonas (4 carbonos) e foi desenhado por homologação da propiofenona (3 carbonos), e serviu de protótipo para a descoberta da risperidona, representante de uma nova geração de neurolépticos.
Exemplos da estratégia de homologação molecular
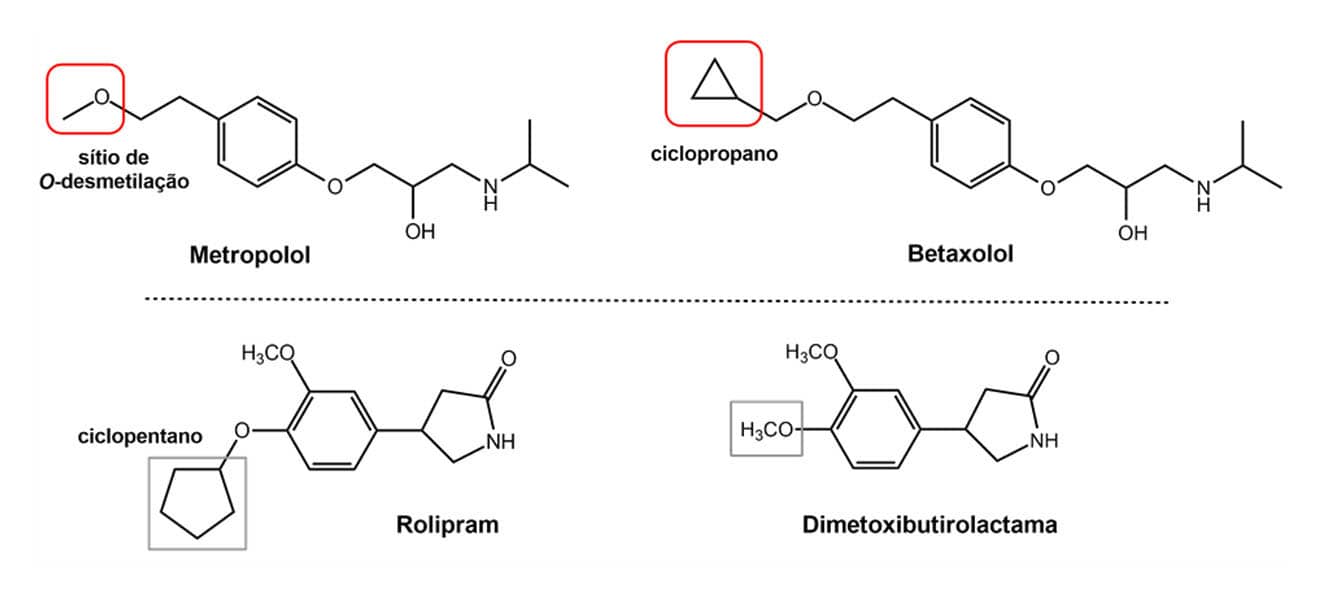
A introdução ou a retirada de anéis na estrutura de um protótipo também pode levar a modificações bastante interessantes em propriedades relevantes de uma molécula. O metoprolol é um anti-hipertensivo instável metabolicamente que sofre ação de enzimas que executam uma reação de O-desmetilação rapidamente, apresentando um t1/2 relativamente curto, de 3-6 h. A homologação do metoprolol, com a introdução de um anel ciclopropano, resultou no betaxolol que apresentou maior t1/2 (16-22 h) devido ao impedimento estérico do sítio de O-desmetilação.
Além de reduzir o metabolismo de um composto, a inserção de um anel pode melhorar a interação do homólogo com o sítio receptor por meio do preenchimento de uma cavidade hidrofóbica, por exemplo. É o caso do antidepressivo rolipram, que se apresentou mais potente que seu protótipo, a dimetoxibutirolactama, porque o anel ciclopentano foi capaz de preencher determinada cavidade hidrofóbica do sítio ativo da enzima fosfodiesterase-4 (PDE4).
Exemplos da introdução de anéis como estratégia de modificação molecular
Relembrando
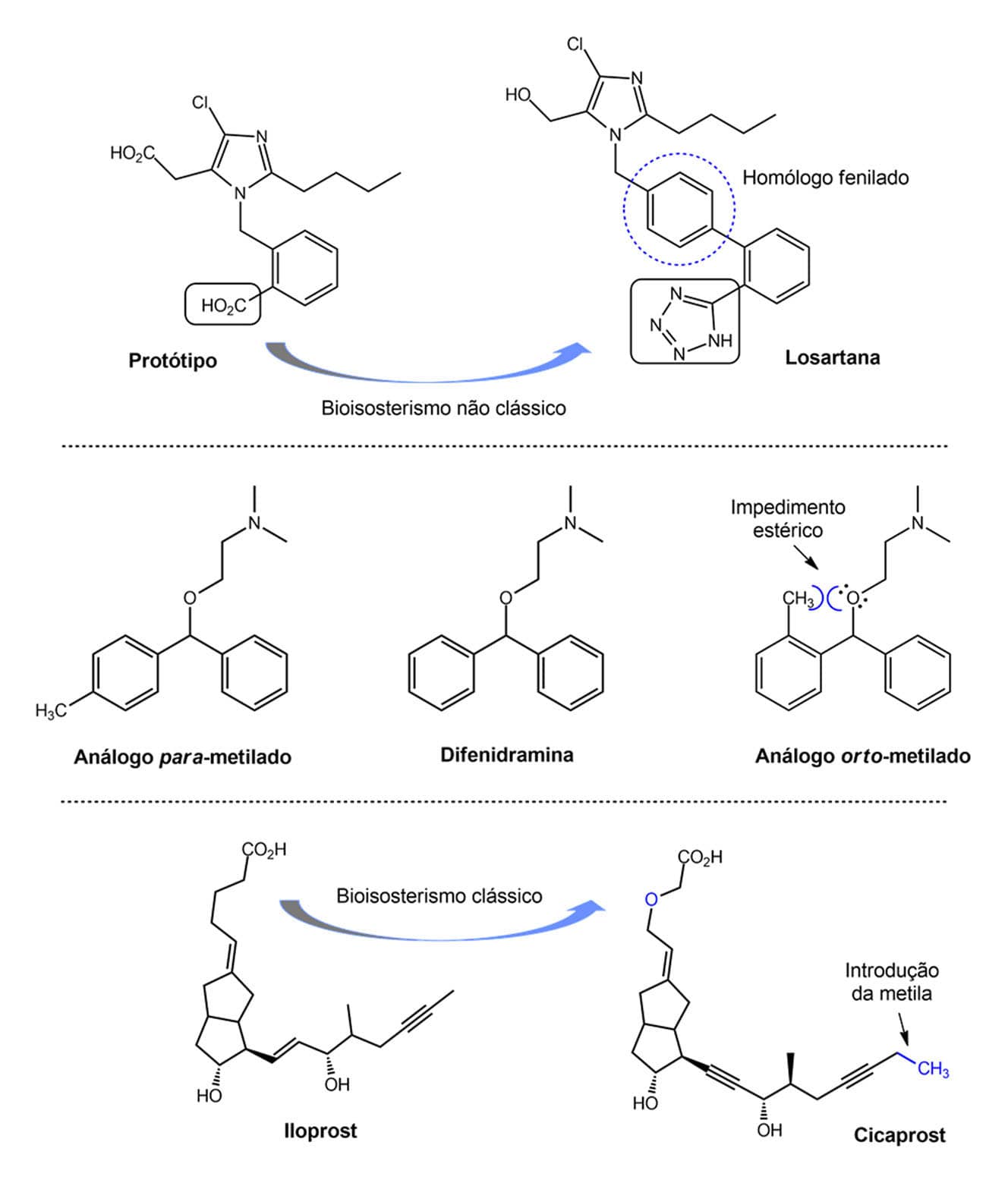
Você viu no módulo 1 que o anti-hipertensivo losartana foi o primeiro fármaco a ter em sua estrutura o anel tetrazol, que é bioisóstero não clássico da função ácido carboxílico.
Comparando sua estrutura com a de um protótipo anterior, observamos que:
A losartana é considerada um fenílogo devido à introdução de um anel fenila naquele protótipo.
Losartana foi o primeiro composto dessa classe e serviu de protótipo para outros fármacos me-too, como a valsartana, telmisartana e olmesartana, os quais apresentaram propriedades farmacocinéticas otimizadas para uma melhor biodisponibilidade oral.
A homologação também pode ser feita pela introdução de grupos metila como substituintes, o que geralmente leva à obtenção de homólogos mais lipofílicos e com menor solubilidade em água. Essa modificação melhora a absorção do composto análogo, porém, dificulta sua passagem para a biofase.
Outros parâmetros estruturais também devem ser levados em conta para avaliar a validade da introdução do grupo metila.
Biofase
Local que o fármaco precisa alcançar para exercer sua função biológica.
Por exemplo:
O análogo metilado na posição orto do anel fenil presente no anti-histamínico difenidramina não apresenta atividade biológica.
Já o homólogo para-substituído é 3,7 vezes mais potente que a difenidramina.
A perda da atividade do análogo orto-metilado, provavelmente, deve-se ao impedimento estérico causado pela metila ao par de elétrons livre do oxigênio, levando a uma restrição da rotação da ligação carbono-oxigênio.
Um exemplo do sucesso da introdução de um grupo metila foi o desenho do cicaprost, um composto agonista dos receptores de prostaciclina (PGI2) com atividade antiagregante plaquetária e vasodilatadora usado no tratamento da hipertensão arterial. Esse fármaco resultou na homologação da cadeia lateral que contém dois acetilenos do iloprost, além do bioisosterismo clássico de átomos divalentes pela troca do –CH2- pelo –O- para impedir a β-oxidação.
Exemplos de fenílogo e homólogos metilados
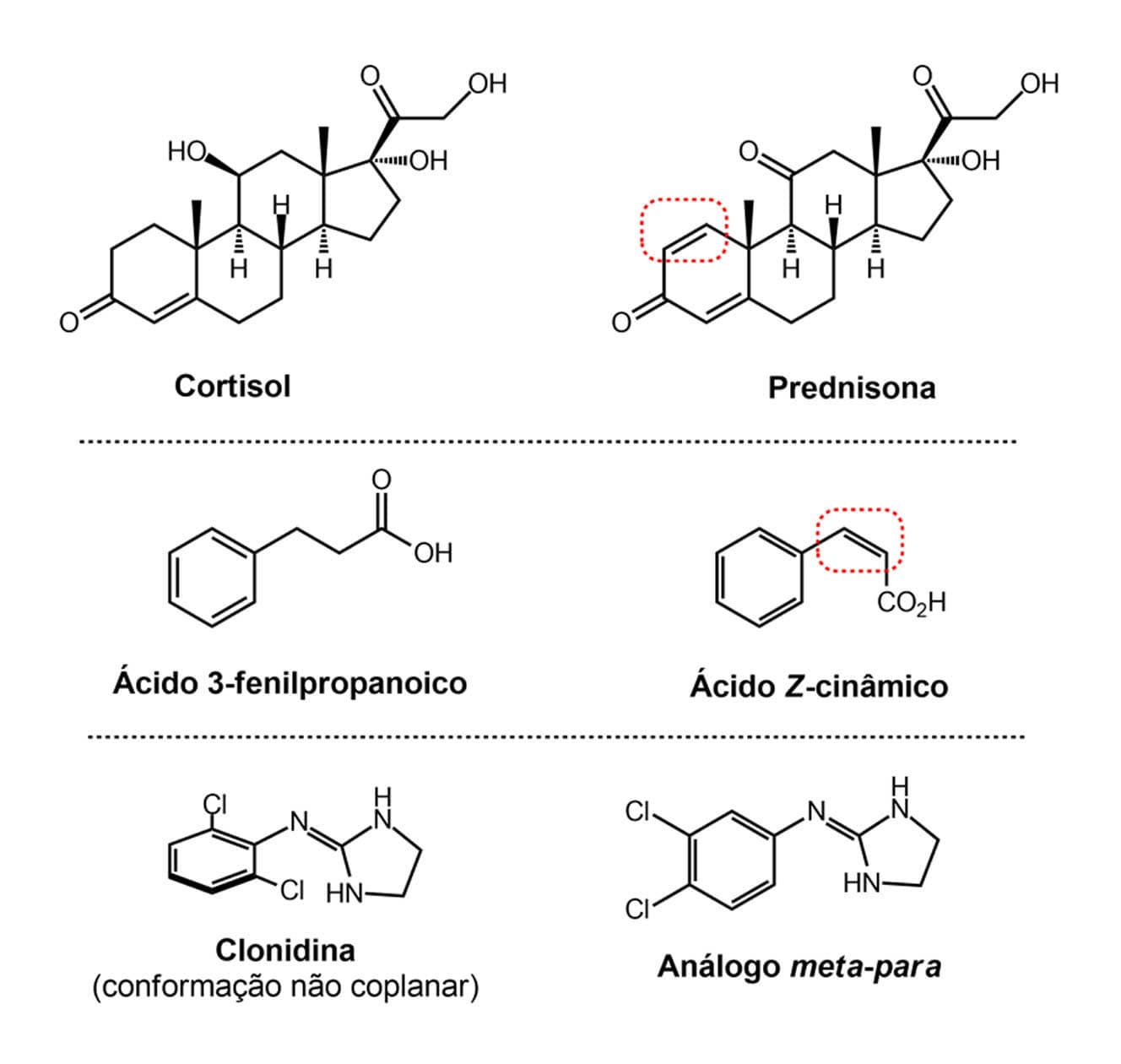
A introdução de ligações duplas ou triplas em uma estrutura pode modificar a flexibilidade de uma molécula alterando a forma de encaixe com o sítio receptor e, consequentemente, sua atividade biológica. É o exemplo da prednisona, um corticoide sintético 30 vezes mais potente que o análogo natural cortisol (a forma sintética é chamada de hidrocortisona), provavelmente devido à introdução da ligação dupla.
Já a remoção de insaturações, ou seja, hidrogenação de ligações duplas, pode levar à perda da atividade caso a insaturação esteja envolvida em alguma interação com o receptor. É o caso do ácido Z-cinâmico, um hormônio vegetal responsável pela regulação do crescimento de plantas, cujo ácido 3-fenilpropanoico, seu derivado hidrogenado, é inativo.
A introdução de outros substituintes como halogênios, hidroxila, grupos ácidos e básicos também podem levar a mudanças no tamanho e/ou conformação das moléculas, podendo alterar tanto algumas propriedades físico-químicas como a potência e atividade farmacológica. Em geral, a inserção de halogênios torna o análogo mais lipofílico e menos solúvel em água.
A mudança da posição de halogênios em uma molécula também pode alterar sua potência, como é o caso da clonidina que apresenta dois átomos de cloro em posições orto e é cerca de 300 vezes mais ativa que o seu análogo com os halogênios nas posições meta e para. A maior potência desse composto é explicada pela diferença conformacional entre a clonidina e o análogo. A presença dos halogênios em orto na clonidina força a predominância de uma conformação do tipo “torcida” que é não coplanar.
Exemplos de introdução e remoção de insaturações e halogênios
Diferente da introdução de grupos metila e halogênios, a presença de grupos hidroxila (-OH) leva a análogos mais hidrossolúveis e menos lipofílicos. Além disso, esse grupo pode interagir com o receptor por ligação hidrogênio, sendo mais um ponto de interação do análogo.
A presença de grupamentos ácidos (carboxílico, -CO2H; sulfônico, -SO3H) e básicos (aminas, amidinas e guanidinas) faz com que os compostos em geral encontrem-se nas suas formas ionizadas (em forma de sal) in vivo, sendo assim, mais solúveis em água e menos lipofílicos. É claro que as concentrações das formas ionizadas e não ionizadas vão depender da força da acidez e basicidade e do pH do meio. Por outro lado, a formação de sais pode ser benéfica, uma vez que pode permitir uma interação com o sítio receptor por ligação iônica.
RIGIDIFICAÇÃO MOLECULAR
Para entendermos a estratégia de rigidificação, precisamos saber que muitas moléculas, endógenas ou fármacos, são estruturas flexíveis que apresentam ligações que podem sofrer rotações adotando diferentes conformações.
Há a conformação ativa, que é aquela que é reconhecida por determinado receptor desencadeando uma resposta biológica.
A(s) inativa(s), que não tem uma boa interação (ou nenhuma) com esse mesmo receptor.
Porém, há outros tipos de receptores que podem reconhecer essas “conformações inativas”, que passam a ser ativas para eles, e que levam a respostas biológicas distintas, muitas vezes, indesejáveis.
A estratégia de rigidificação molecular, portanto, vem contribuir para o desenvolvimento de compostos mais rígidos com o intuito de reduzir o número de conformações e, se possível, tentar manter a molécula em sua conformação ativa. Como consequência, haverá aumento na atividade biológica e melhora na seletividade, uma vez que a molécula não irá mais interagir com diversos receptores, reduzindo assim os efeitos indesejáveis.
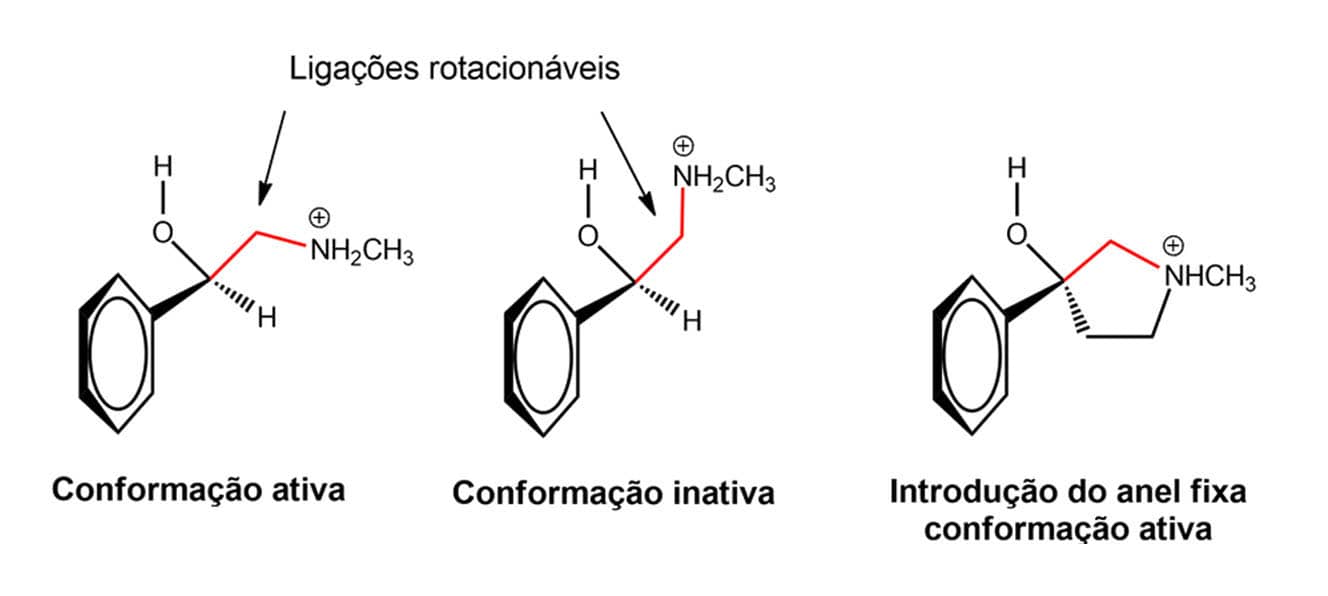
Existem diversas formas de introduzir rigidez em uma estrutura e uma delas é pela formação de um anel, como podemos entender melhor pela figura a seguir. A molécula apresentada é flexível e tem ligações rotacionáveis, podendo adotar diferentes conformações, uma ativa e pelo menos uma inativa. A introdução de um anel nessa estrutura ajuda a fixar a conformação ativa da molécula.
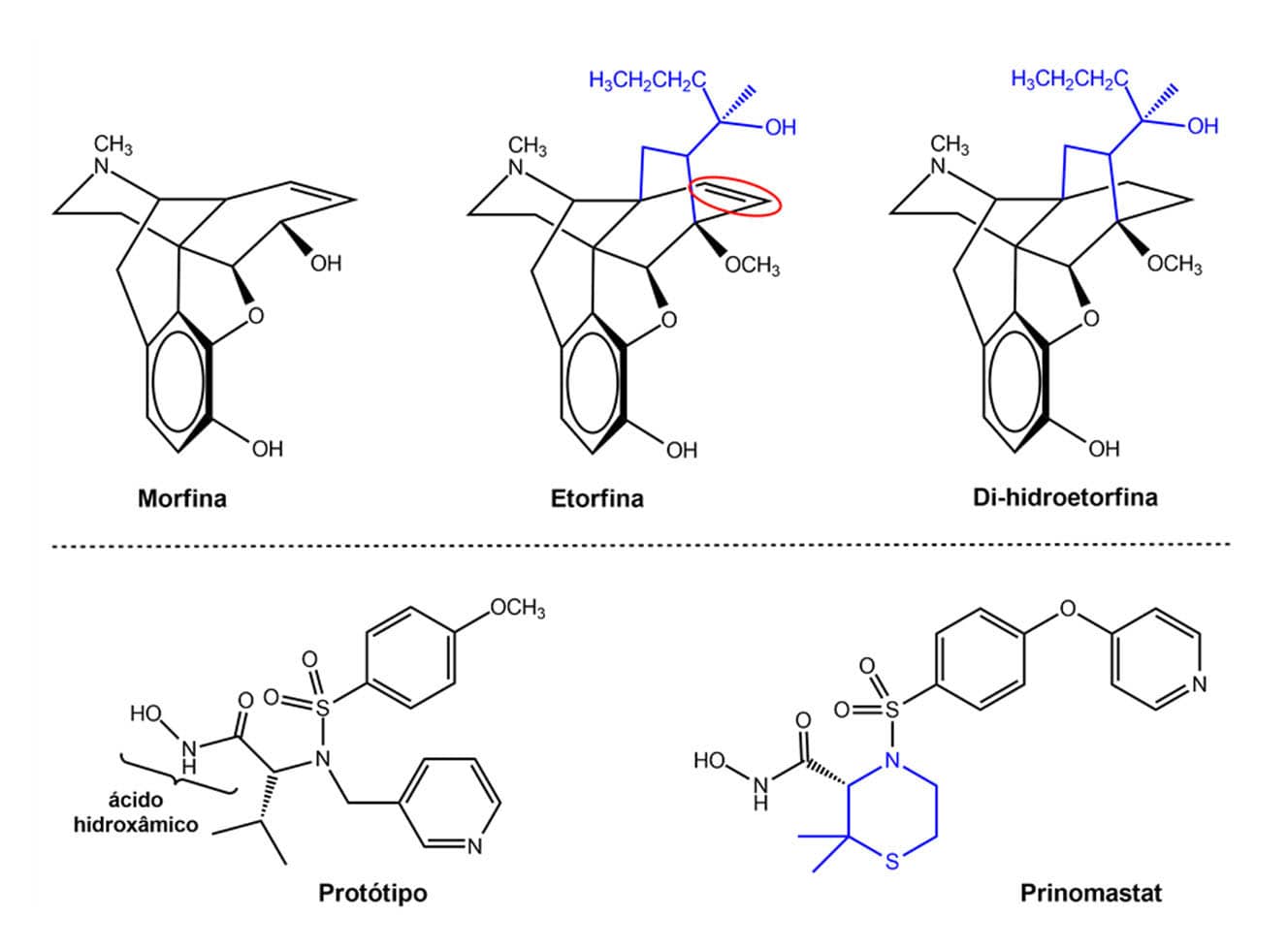
Existem diversos exemplos da aplicação da rigidificação molecular para obtenção de compostos farmacologicamente ativos. Como é o caso da etorfina, da classe dos analgésicos opioides, que é 10 mil vezes mais potente que a morfina por ser mais lipofílica e ter muito mais afinidade pelos receptores analgésicos. A etorfina é tão potente como sedativo que não é usada em humanos, mas sim como tranquilizante para animais de grande porte.
Podemos observar que a estrutura da etorfina apresenta um anel a mais em comparação com a morfina. A di-hidroetorfina, obtida da redução de uma ligação dupla da etorfina, é 10 vezes mais potente do que esta e é considerada um dos analgésicos mais potentes, além de ser usada no tratamento da adição a opioides. Esses compostos, por apresentarem estruturas bastante rígidas, são altamente seletivos para os receptores analgésicos.
O prinomastat é um derivado de ácido hidroxâmico com atividade antineoplásica que age pela inibição das enzimas metaloproteinases dos tipos 2, 9, 13 e 14. Esse composto foi planejado a partir da rigidificação do seu protótipo que apresenta um grupo isopropil responsável pelo bloqueio estérico da função ácido hidroxâmico relacionada ao metabolismo. O prinomastat apresentou melhor atividade biológica quando a função isopropil do protótipo foi transformada em um ciclo rígido, restringindo assim o número de conformações possíveis.
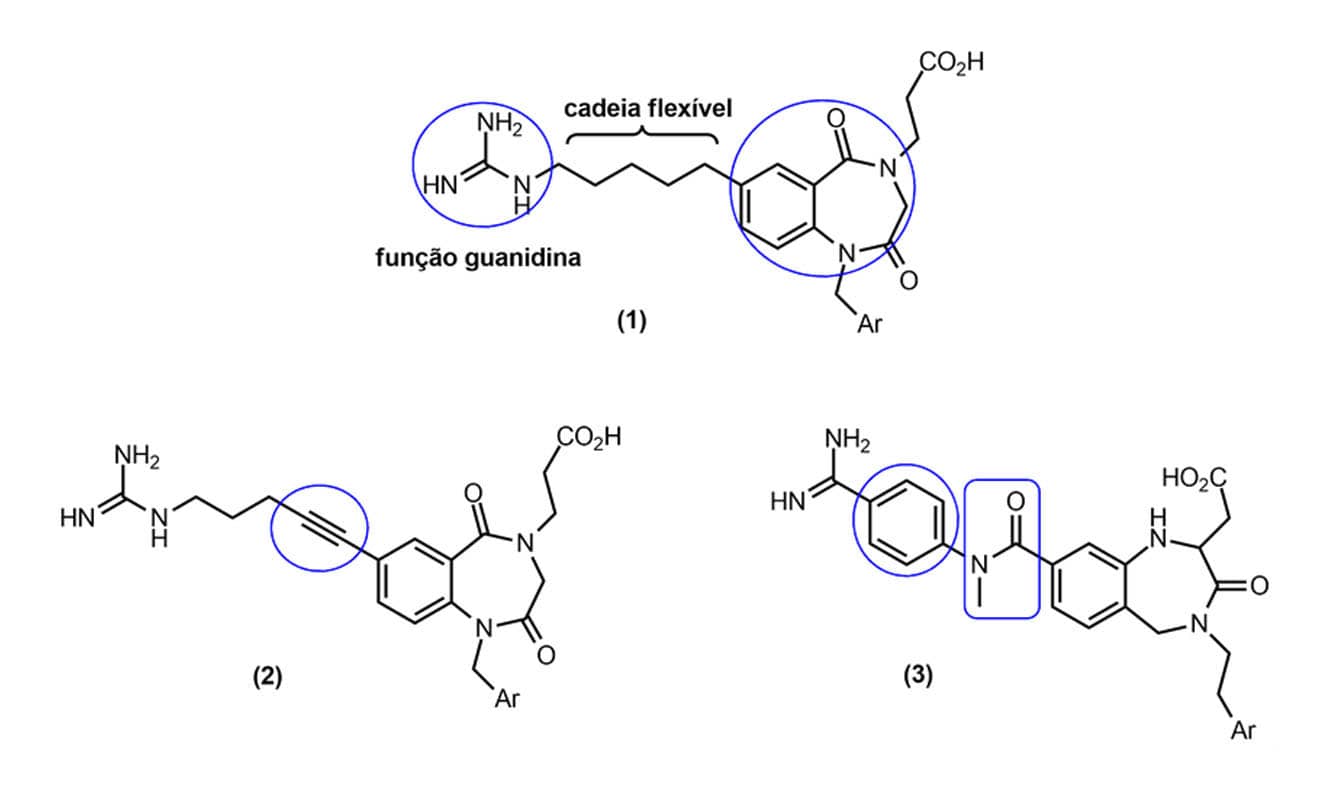
Outros métodos para introduzir rigidez em uma molécula consistem na inserção de grupos funcionais rígidos, tais como insaturações, anéis aromáticos ou grupos amida. No exemplo mostrado na figura a estrutura geral dos benzodiazepínicos (1) sofreu rigidificação, originando novos compostos. A cadeia lateral flexível que liga os grupamentos farmacofóricos guanidina e o sistema de anéis condensados foi modificada pela introdução de uma função alcino (uma ligação tripla), formando o derivado (2), um anel aromático e uma função amida, rigidificando o derivado (3).

APLICAÇÕES DA SIMPLIFICAÇÃO, HOMOLOGAÇÃO E RIGIDIFICAÇÃO MOLECULARES NA OBTENÇÃO DE NOVOS FÁRMACOS
O especialista Emerson Peçanha ilustrará mais detalhes sobre as estratégias de simplificação, homologação e rigidificação moleculares, através de exemplos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Conceituar pró-fármacos e a importância do processo de latenciação de fármacos
A LATENCIAÇÃO COMO ESTRATÉGIA DE MODIFICAÇÃO MOLECULAR
Relembrando
Nos módulos anteriores, você viu a importância das modificações moleculares para a introdução de novos fármacos na terapia, tais como o bioisosterismo, a hibridação molecular, a simplificação e homologação moleculares.
Aqui, você estudará mais um desses métodos que merece destaque ― a latenciação.
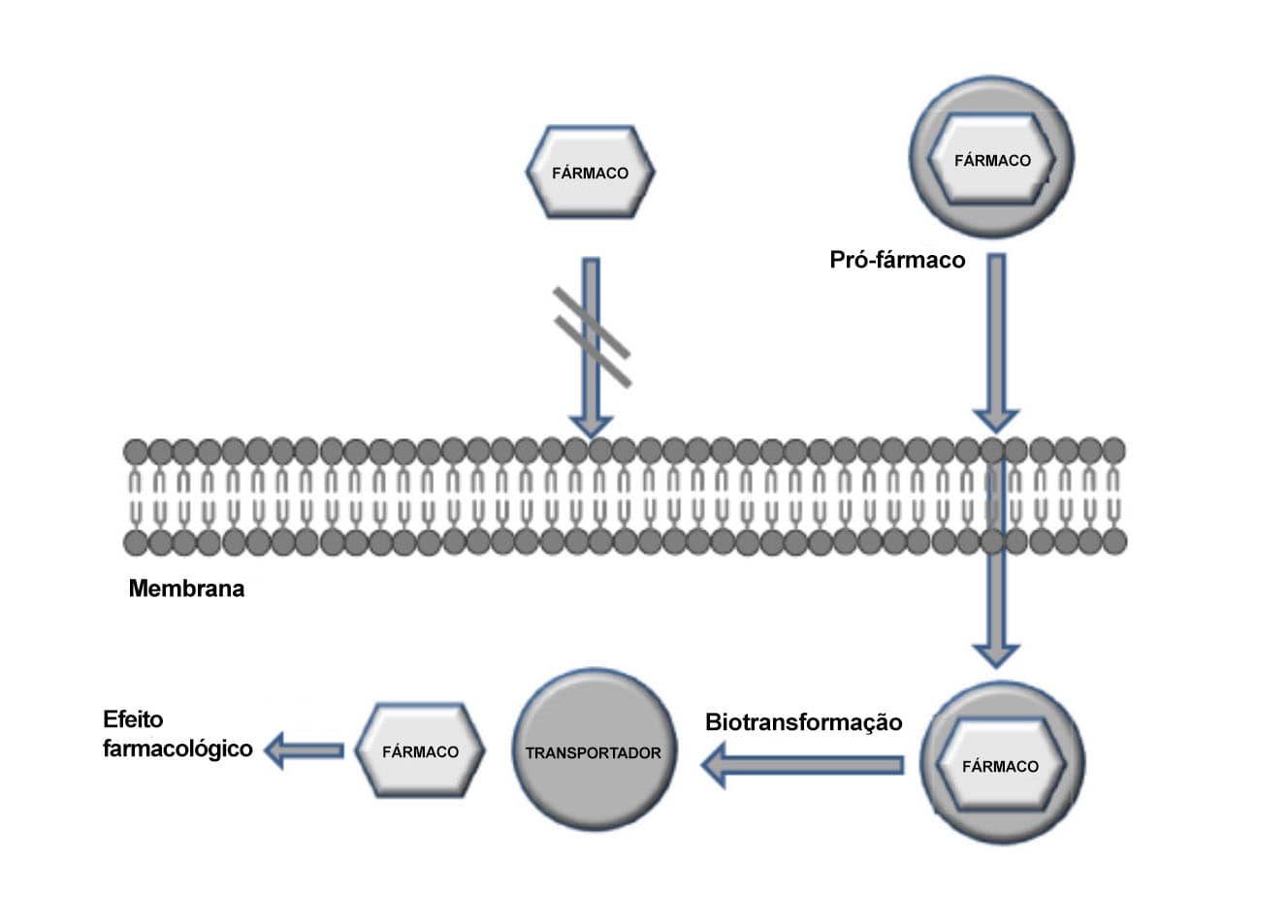
Trata-se de uma estratégia para obtenção de moléculas na forma inativa no organismo, ou seja, in vivo, que é transformada na sua forma ativa por meio de reações químicas ou enzimáticas. Uma das formas mais comuns de latenciação é a obtenção de pró-fármacos. Uma definição de pró-fármaco é que este é um derivado químico e farmacologicamente inativo da molécula matriz, que requer transformação no organismo para liberar o fármaco ativo.
Assim como as outras estratégias de modificação estrutural, a latenciação também visa superar algumas limitações relacionadas às fases farmacêutica e farmacocinética que as moléculas possam apresentar.
Algumas moléculas apresentam problemas de falta de solubilidade adequada na fase farmacêutica, além de instabilidade e propriedades organolépticas não desejáveis. Já a fase farmacocinética de um fármaco pode estar prejudicada por problemas de baixa absorção e biodisponibilidade inadequada devido ao metabolismo.
A figura a seguir esquematiza o exemplo de alguns pró-fármacos cuja modificação da molécula matriz possibilita a sua passagem através da membrana.
Saiba mais
Há também moléculas que são absorvidas e eliminadas muito rápido quando isso não é desejado, além de tantas outras que apresentam toxicidade.
Para que o processo de latenciação ocorra com sucesso, uma molécula adequada para ser um pró-fármaco precisa apresentar algumas características necessárias, tais como:
- Ser inativa ou ter atividade menor que a molécula matriz.
- A matriz deve apresentar grupos funcionais para a derivatização.
- Ter uma síntese e purificação mais fáceis que as da molécula matriz.
- O organismo deve ter sistemas de bioativação do pró-fármaco.
- O pró-fármaco e o transportador não devem apresentar toxicidade.
Para a obtenção de um pró-fármaco, as moléculas-matriz devem ter grupamentos funcionais capazes de fazer ligação com o transportador, dessa forma, a esterificação é um dos métodos mais empregados partindo de um grupo ácido carboxílico (-CO2H) ou hidroxila (-OH). Existem outros métodos comuns como a formação de ligação amida, imida e carbamato.
Na tabela a seguir, você pode observar melhor os tipos de pró-fármacos que podem ser formados a partir dos diferentes grupos funcionais presentes nas moléculas.
|
Grupo funcional |
Ligação fármaco-transportador |
Tipos de pró-fármacos |
|
-CO2H |
-COOR -COOCH(R)OOCR -CONHR |
ésteres ésteres α-aciloxialquílicos amidas amidas |
|
-OH |
-OOCR -OOOCR -OPO3H2 -OR -OCH(R)OOCR |
ésteres ésteres carbonatos ésteres fosfatos éteres éteres α-aciloxialquílicos |
|
-SH |
-S-R -SCH(R)OOCR -SCOR -S-S-R |
tioéteres tioésteres dissulfetos |
|
-C=O |
RRC(OR’)2 -HC=N-R -C=C-OOCR |
cetais iminas ésteres enólicos |
|
-NH2 |
-NHCOOR -N=CRR NHCH=CRR -NH-CH2N(R)COR -NHCOOCH(R)OCOR |
carbamatos iminas enaminas N -bases de Mannich derivados N-aciloxialcoxicarbonílicos |
|
-N terciária |
-+NC(R)CHOCOR |
derivados N-aciloxialquílicos |
|
-SO2NH2 ou - SO2NH - |
-SO2N=C(OR)R -SO2NHCH2OR |
imidatos N-sulfonílicos derivados N-alcoximetílicos |
|
-NH ácido |
-CON(R)CH2-NR1R2 -CONRCH2OH -CONH-COR -CONRCH(R1)OCOR2 |
N-bases de Mannich derivados N-aciloxialquílicos |
Elaborado por: Estela Muri.
CLASSIFICAÇÃO DOS PRÓ-FÁRMACOS
Os pró-fármacos podem ser subdivididos e classificados em:
Veja como funciona cada uma dessas classificações.
Pró-fármacos clássicos
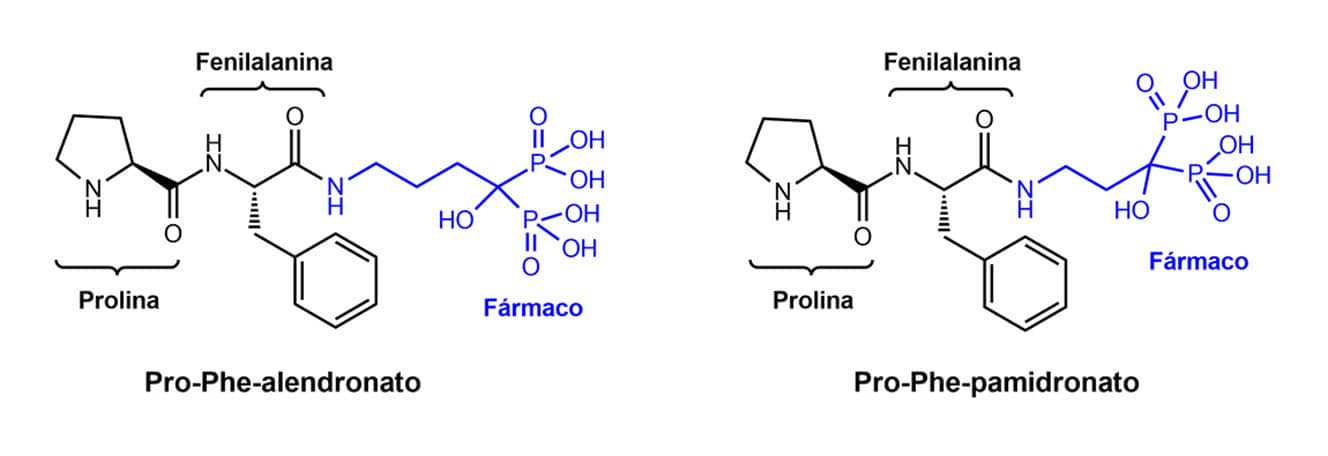
São em geral menos ativos que a molécula matriz ou são inativos e devem sofrer reação de hidrólise, seja química, seja enzimática, para se tornarem ativos. Eles são formados pela ligação da molécula matriz com o transportador com os principais objetivos de otimização das propriedades físico-químicas visando a uma melhoria na biodisponibilidade, seletividade e toxicidade.
Moléculas de aminoácidos, peptídeos e açúcares são usadas como transportadores, como no exemplo dos fármacos alendronato e pamidronato usados no tratamento da osteoporose em mulheres. Nesses casos, a utilização de transportadores dipeptídicos resultou em pró-fármacos com uma biodisponibilidade oral cerca de 3 vezes maior que o fármaco matriz.
Exemplos de pró-fármacos clássicos
Bioprecursores
Esse tipo de pró-fármaco não apresenta um transportador propriamente dito e sofre ativação in vivo, geralmente, pelo sistema redox da célula, dando origem a um novo composto ativo. Você pode observar alguns exemplos na figura a seguir.
Exemplos de pró-fármacos bioprecursores
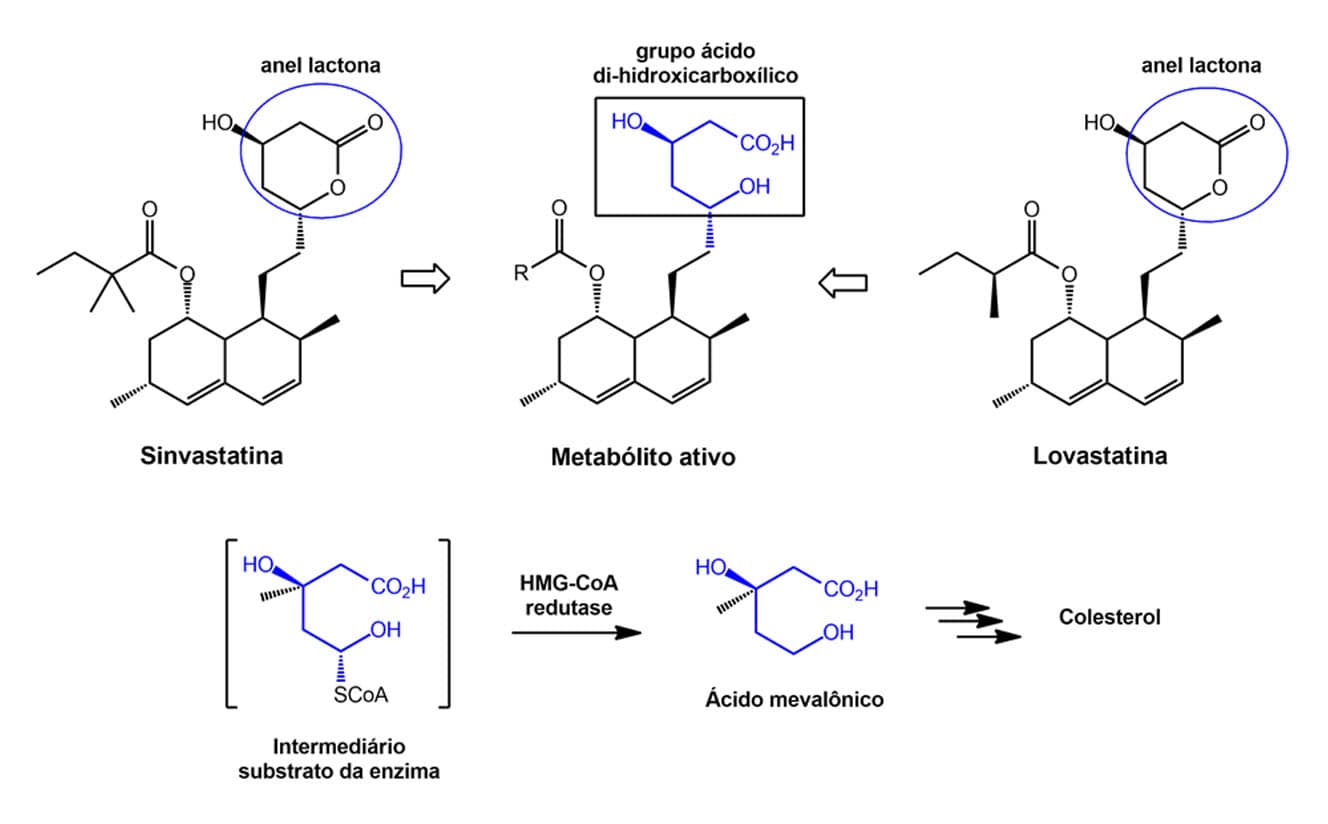
A sinvastatina e a lovastatina, conhecidas como estatinas, são fármacos inibidores da enzima 3-hidroxi-3-metilglutaril-coenzima-A redutase (HMG-CoA) usadas para reduzir os níveis de colesterol. Elas apresentam em suas estruturas um anel lactona (éster cíclico) e são consideradas pró-fármacos, pois esse anel sofre hidrólise enzimática in vivo, dando origem ao metabólito ativo que apresenta um grupo ácido di-hidroxicarboxílico.
Esse grupo ácido se assemelha ao estado de transição do substrato da enzima HMG-CoA na síntese do colesterol e, por isso, os metabólitos ativos dos fármacos citados podem inibir essa enzima. Você pode observar também que, se os metabólitos ativos contendo o grupo ácido di-hidroxicarboxílico fossem administrados, eles teriam elevada hidrossolubilidade e baixa lipofilicidade, ao passo que os pró-fármacos contendo o anel lactona são mais lipofílicos e apresentam elevada biodisponibilidade.
Dentre os pró-fármacos desenvolvidos para melhorar a solubilidade, podemos citar a vitamina E (o constituinte mais importante é o α-tocoferol), que é quase insolúvel em meio aquoso e é oxidada muito rapidamente pelo O2 atmosférico. Reações de esterificação levam à obtenção de ésteres do α-tocoferol (do tipo acetato, succinato ou linoleato), que são os pró-fármacos. Esses ésteres são muito usados em formulações tópicas e são ativados na pele por hidrólise enzimática por ação de esterases, liberando o α-tocoferol ativo, usando no tratamento de tumores cutâneos e redução de rugas.
Saiba mais
O grupo funcional ácido carboxílico, presente em várias moléculas, em muitos casos são importantes grupos farmacofóricos, pois se ligam aos sítios receptores por ligação iônica ou ligação hidrogênio. Porém, é um grupo facilmente ionizável e na forma ionizada não atravessa membranas biológicas com facilidade. Portanto, a sua “proteção” na forma de éster, que é menos polar e pode atravessar membranas lipídicas, é uma opção.
Após a absorção do éster, ele é hidrolisado por enzimas esterases presentes na corrente sanguínea, liberando ácido livre, que é a forma ativa. Temos como exemplo mostrado na figura a seguir o fármaco anti-hipertensivo enalaprilato e seu pró-fármaco, o éster enalapril.
Exemplos de fármacos e seus pró-fármacos correspondentes
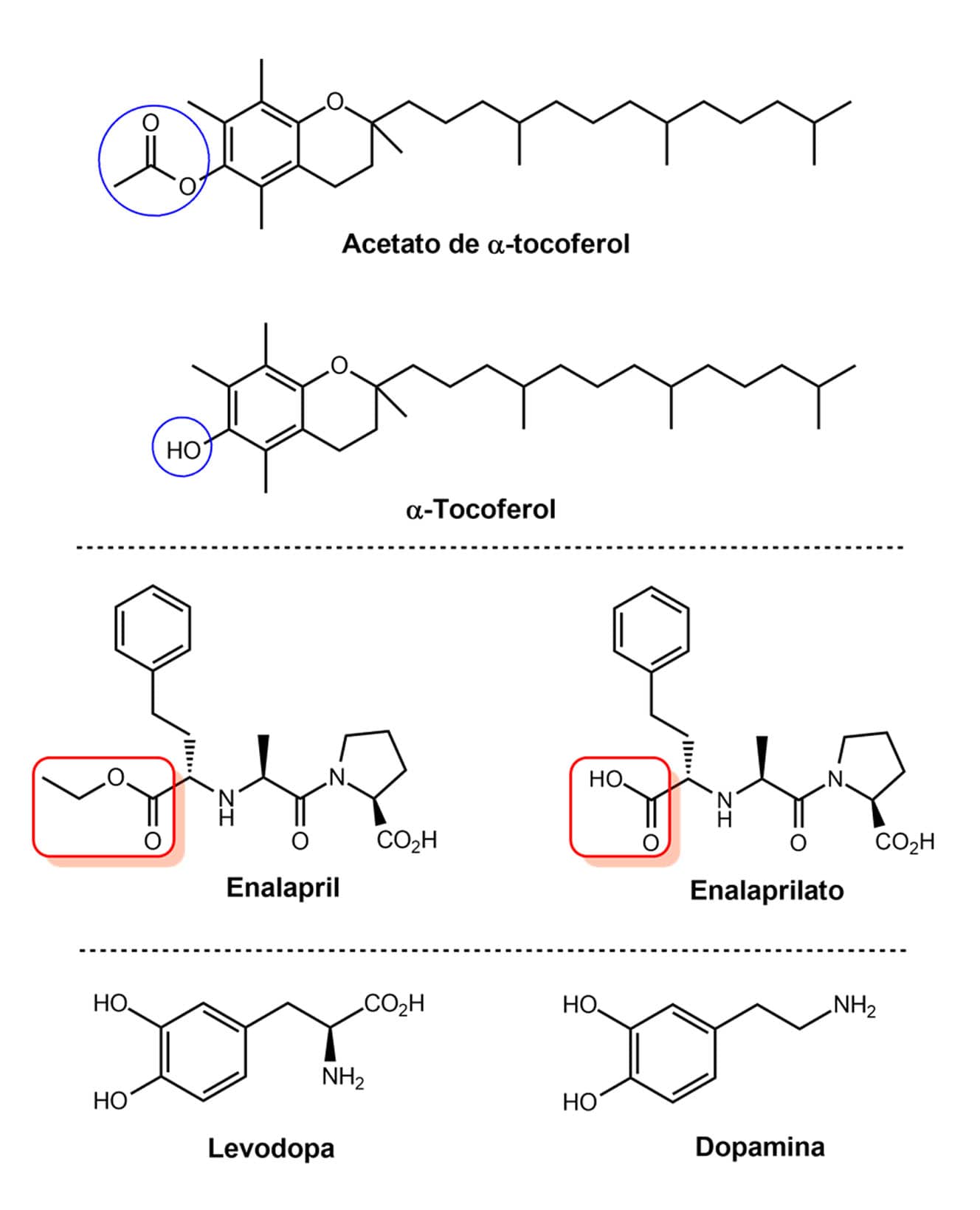
Outro exemplo de pró-fármaco usado para melhorar a permeabilidade através de membranas é o caso da levodopa usada no tratamento da doença de Parkinson. Essa síndrome é caracterizada pela deficiência do neurotransmissor dopamina, porém esta não pode ser administrada devido a sua alta polaridade sendo, consequentemente, incapaz de atravessar a barreira hematoencefálica.
A levodopa, apesar de ser mais polar que a dopamina, consegue atravessar a barreira por ser um aminoácido e, por isso, é reconhecida pela proteína transportadora de aminoácidos. Após atravessar a barreira hematoencefálica, a levodopa é descarboxilada por ação de enzimas, formando a dopamina.
Pró-fármacos mistos
Os pró-fármacos mistos apresentam tanto características de pró-fármacos clássicos como de bioprecursores, ou seja, necessitam de transportadores e também devem ser metabolizados para tornarem-se ativos. Temos como exemplo o sistema de liberação de fármacos chamado CDS (Chemical Delivery System – em português, Sistema de Liberação de Químicos), no qual o conjugado fármaco-transportador atravessa a barreira hematoencefálica, no caso de fármacos de ação central, e depois o transportador sofre oxidação e fica carregado positivamente, ficando retido no Sistema Nervoso Central (SNC). Após isso é que o conjugado sofre biotransformação, liberando o fármaco na forma ativa.
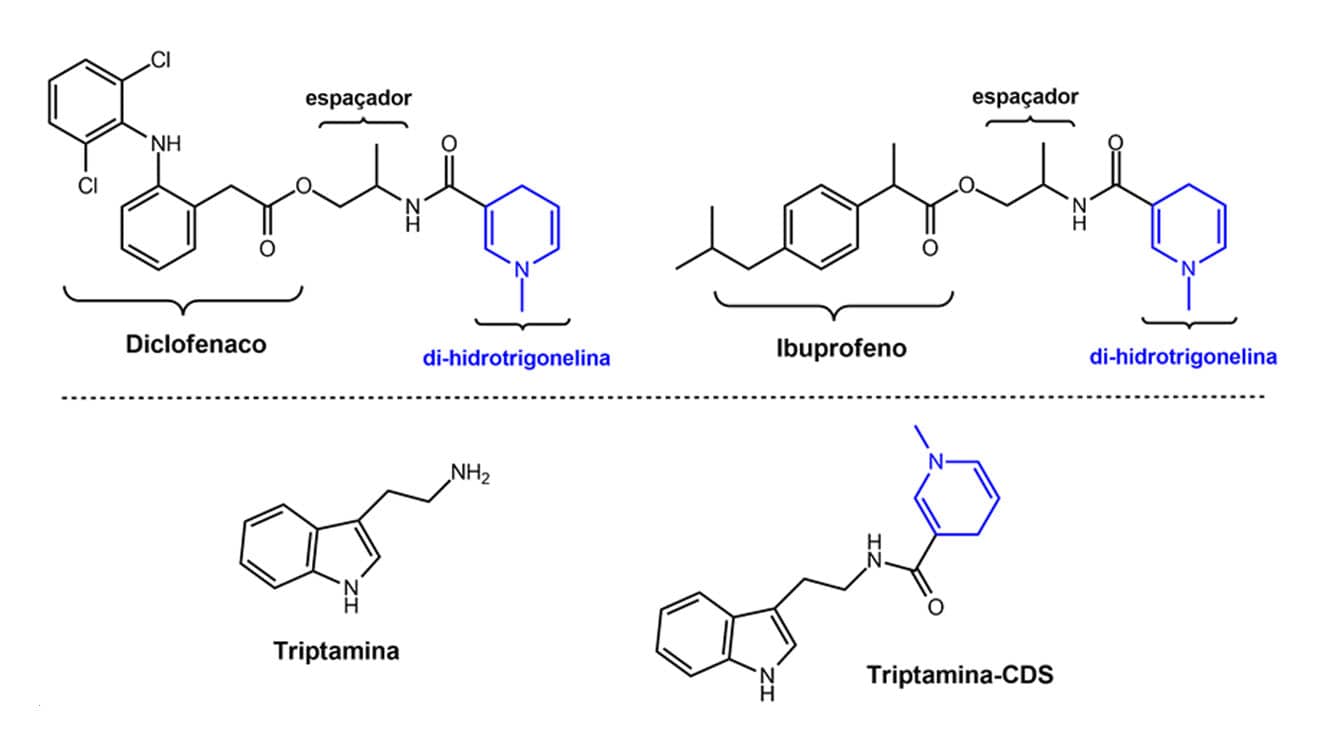
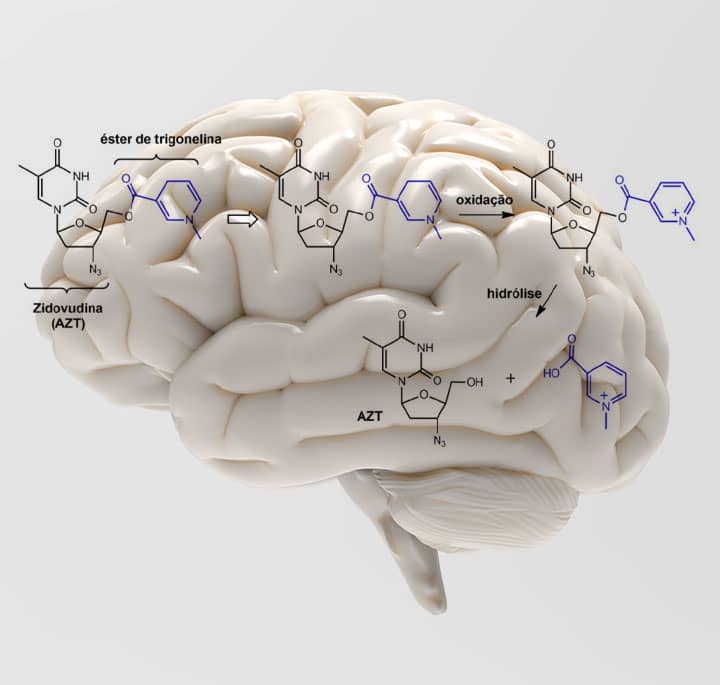
Podemos entender melhor como funciona esse sistema no exemplo mostrado na figura a seguir, no qual o CDS foi usado para o fármaco antiviral zidovudina (AZT) no tratamento de encefalopatias relacionadas ao HIV, juntamente com ésteres de trigonelina como transportador. Nesse exemplo a zidovudina é ligada ao transportador 1,4-di-hidrotrigonelina (derivado de di-hidropiridina) por uma ligação éster, e este conjugado atravessa a barreira hematoencefálica e entra no SNC, pois a di-hidropiridina aumenta a lipofilicidade do fármaco. Nesse compartimento, o transportador sofre oxidação formando um sal de trigonelinato, que aí se acumula. Depois, ocorre uma hidrólise que libera o fármaco.
Esse sistema CDS foi usado para o transporte de diversos fármacos, seja de ação no SNC, seja de ação em outros órgãos.
Outros exemplos podem ser mostrados na figura a seguir para o diclofenaco e o ibuprofeno, fármacos anti-inflamatórios usados na doença de Alzheimer. Assim como no exemplo anterior, esse sistema permitiu melhorar a lipofilicidade dos fármacos ajudando a atravessar a barreira hematoencefálica.
Pró-fármacos do betaxolol para o tratamento do glaucoma e da triptamina para arritmias também foram obtidos usando o sistema CDS e o transportador do tipo di-hidrotrigonelina.
Exemplos de pró-fármacos mistos
Fármacos dirigidos
Essa classe inclui os fármacos que utilizam transportadores específicos que os conduzem diretamente até seu local de ação, seja um receptor, seja uma enzima, sendo reduzidas suas ações inespecíficas em outros órgãos. Dessa forma, a toxicidade e os efeitos adversos podem ser minorados, além de a potência do fármaco ser melhorada.
Existem diversos tipos de transportadores que são utilizados nessa forma latente de fármacos, dentre eles estão:
Macromoléculas naturais (como os polissacarídeos quitina e quitosana) e proteínas (albumina, globulina)
Anticorpos monoclonais
Hormônios peptídicos e glicoproteínas
Macromoléculas sintéticas (como os polímeros sintéticos de polietilenoglicol - PEG) ou álcool polivinílico (PVA)
Saiba mais
As micelas, as lipossomas e os dendrímeros também são usados como moléculas transportadoras de fármacos.
O uso de macromoléculas como transportadores é muito útil e bastante aplicado na quimioterapia, uma vez que os antineoplásicos, em geral, apresentam alta toxicidade e são pouco seletivos. Um exemplo é o conjugado micela-doxorrubicina, um fármaco antitumoral que se mostrou mais potente contra leucemia e tumores sólidos que o fármaco livre.
As ciclodextrinas, naturais ou sintéticas, também são muito usadas como sistema de transporte de fármacos em diversas formulações farmacêuticas com objetivos diversos, como melhorar a solubilidade, reduzir a toxicidade e trazer estabilidade, dentre outros. Dependendo do tipo de ciclodextrina utilizada, ela pode melhorar a hidrossolubilidade de moléculas pouco solúveis em água e também trazer estabilidade contra decomposição química, fotoquímica e enzimática. Além disso, a formação de complexos de inclusão com ciclodextrinas podem reduzir efeitos adversos pela diminuição do contato do fármaco diretamente com membranas biológicas, pele ou mucosas, por exemplo. Também servem para modificar características organolépticas indesejadas, como odor e sabor.
Existem diversas formulações farmacêuticas comercializadas que utilizam as ciclodextrinas, como, por exemplo, omebeta tabletes, que contém o fármaco omeprazol, e voltarem oftálmico, que apresenta o anti-inflamatório não esteroidal diclofenaco como princípio ativo. Nesse último, a ciclodextrina reduz a toxicidade ocular do fármaco, além de melhorar sua hidrossolubilidade.
Alguns sistemas de direcionamento de fármacos foram e estão sendo desenvolvidos sempre objetivando melhorar características indesejáveis ou obter formas latentes mais seletivas. Como exemplo temos o sistema ADEPT (do inglês, Antibody-Directed Enzyme Produg Therapy), cuja tradução seria “Terapia dirigida por anticorpo-enzima-pró-fármaco”.
Esse sistema terapêutico ocorre em duas etapas, sendo que na primeira um conjugado enzima-anticorpo monoclonal é administrado. Após isso, o anticorpo no organismo reconhece e se liga ao antígeno; por exemplo, uma célula antineoplásica, no caso do tratamento de tumores. Na segunda etapa o pró-fármaco é administrado. Após contato com a enzima ligada ao anticorpo, o pró-fármaco é clivado por ela e libera o fármaco ativo, que irá combater a célula tumoral.
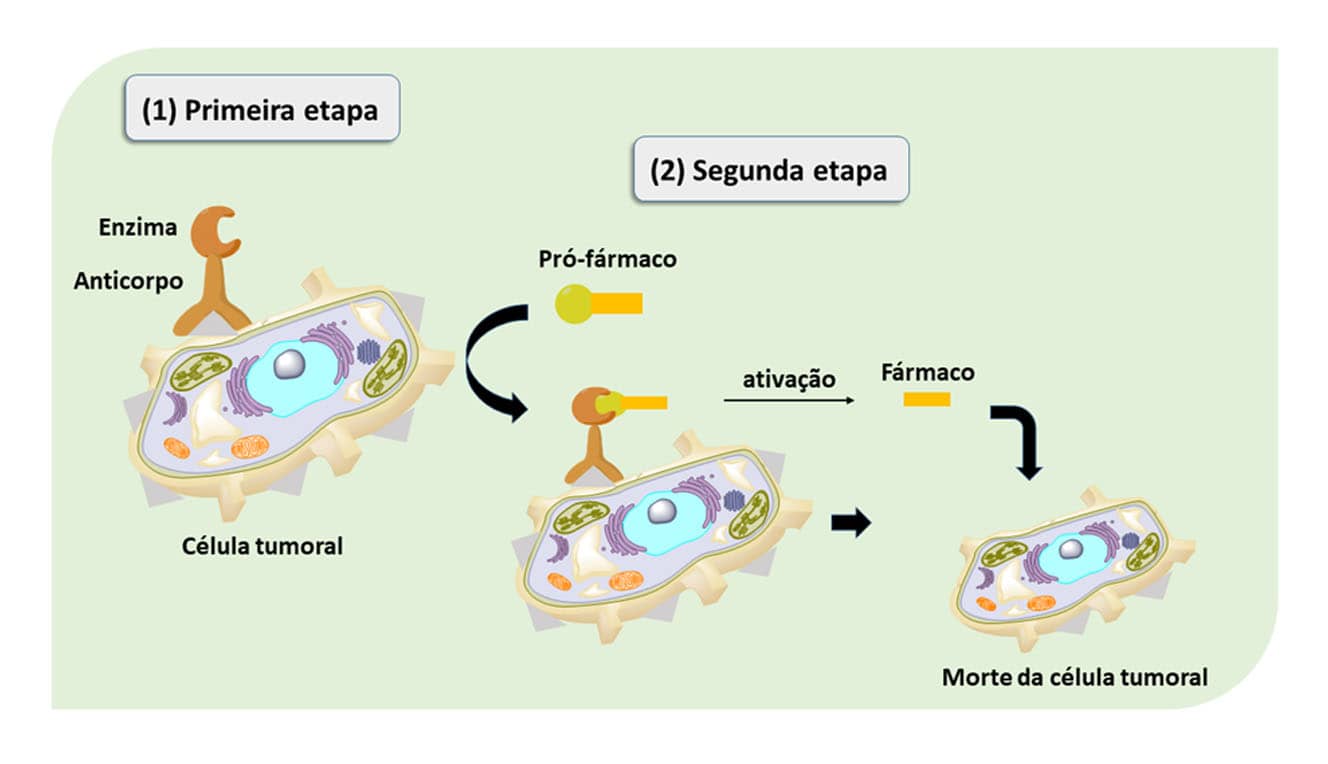
Existem diversos pró-fármacos que utilizam esse sistema, como por exemplo cefalosporina-mostarda de fenilenodiamina, cefalosporina-desacetilvimblastina e cefalosporina-doxorrubicina. Nesses exemplos, a enzima β-lactamase ligada a um anticorpo ataca a cefalosporina que libera o fármaco ativo que irá atacar o alvo cancerígeno.
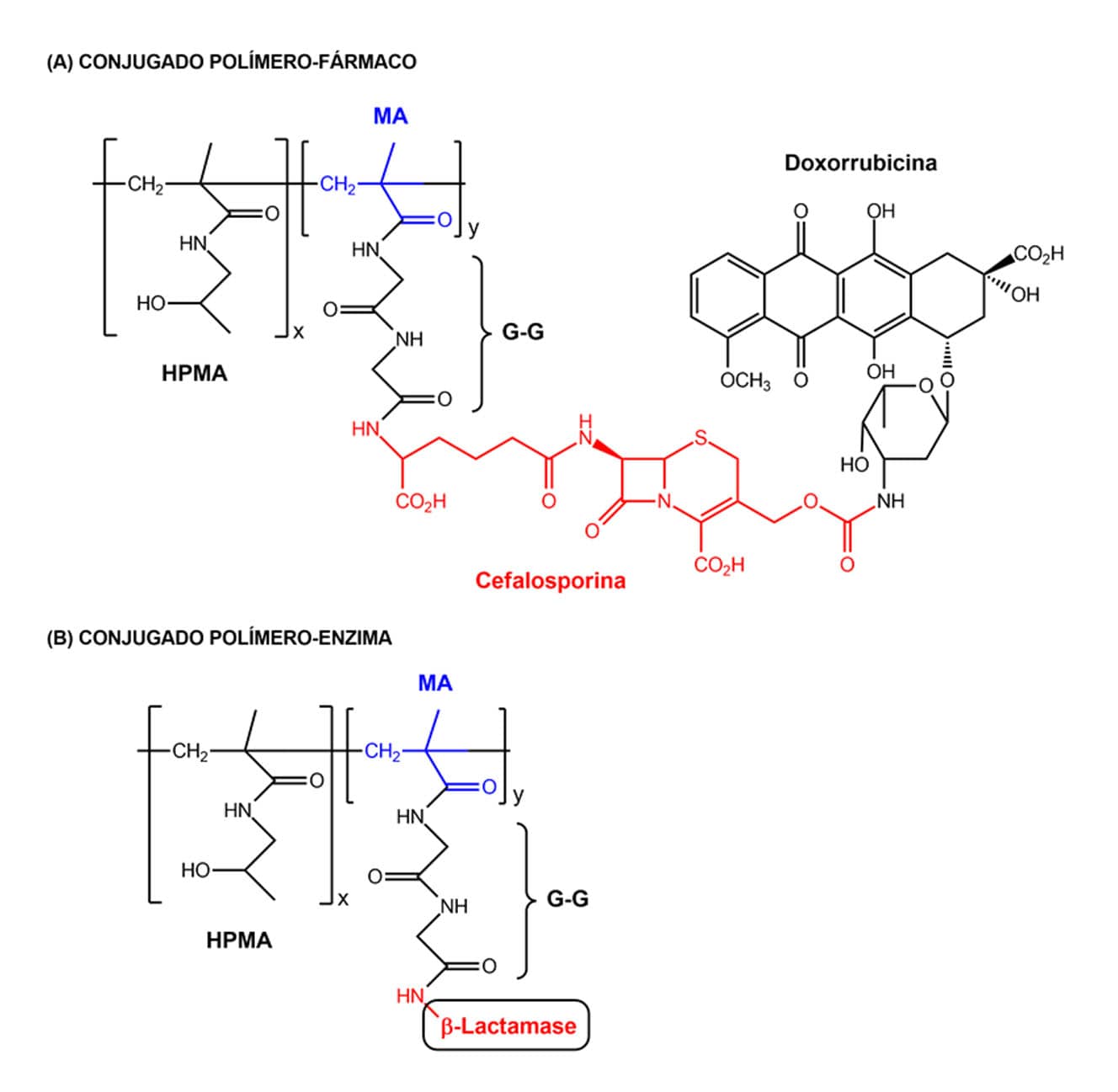
Outro sistema semelhante é o PDEPT (do inglês, Polymer-Directed Enzyme Produg Therapy), e difere do ADEPT pela utilização de um conjugado polímero-enzima e pró-fármaco-polímero para gerar o fármaco ativo. Um exemplo desse sistema pode ser visto na figura, e consiste na utilização de um copolímero de N-(2-Hidroxipropil) metacrilamida (HPMA) e metacriloil (MA) como transportador do fármaco.
Esse copolímero ainda está ligado a duas moléculas de glicina (G-G) e cefalosporina (C), portanto esse conjugado HPMA-MA-G-G-C conduz o fármaco antitumoral doxorrubicina (Dox). O mesmo copolímero é usado no componente polímero-enzima, usando a β-lactamase (β-L) para ativar o pró-fármaco. Esse sistema PDEPT apresentou significativa redução de tumores quando comparado à administração da doxorrubicina livre, além de não apresentar toxicidade.
Pró-fármacos recíprocos
Os pró-fármacos recíprocos utilizam transportadores que também apresentam atividade. Dessa forma, o pró-fármaco recíproco pode apresentar duas atividades diferentes, a dele e a do transportador (atividade mista) ou o dois podem ter a mesma atividade por mecanismos diferentes.
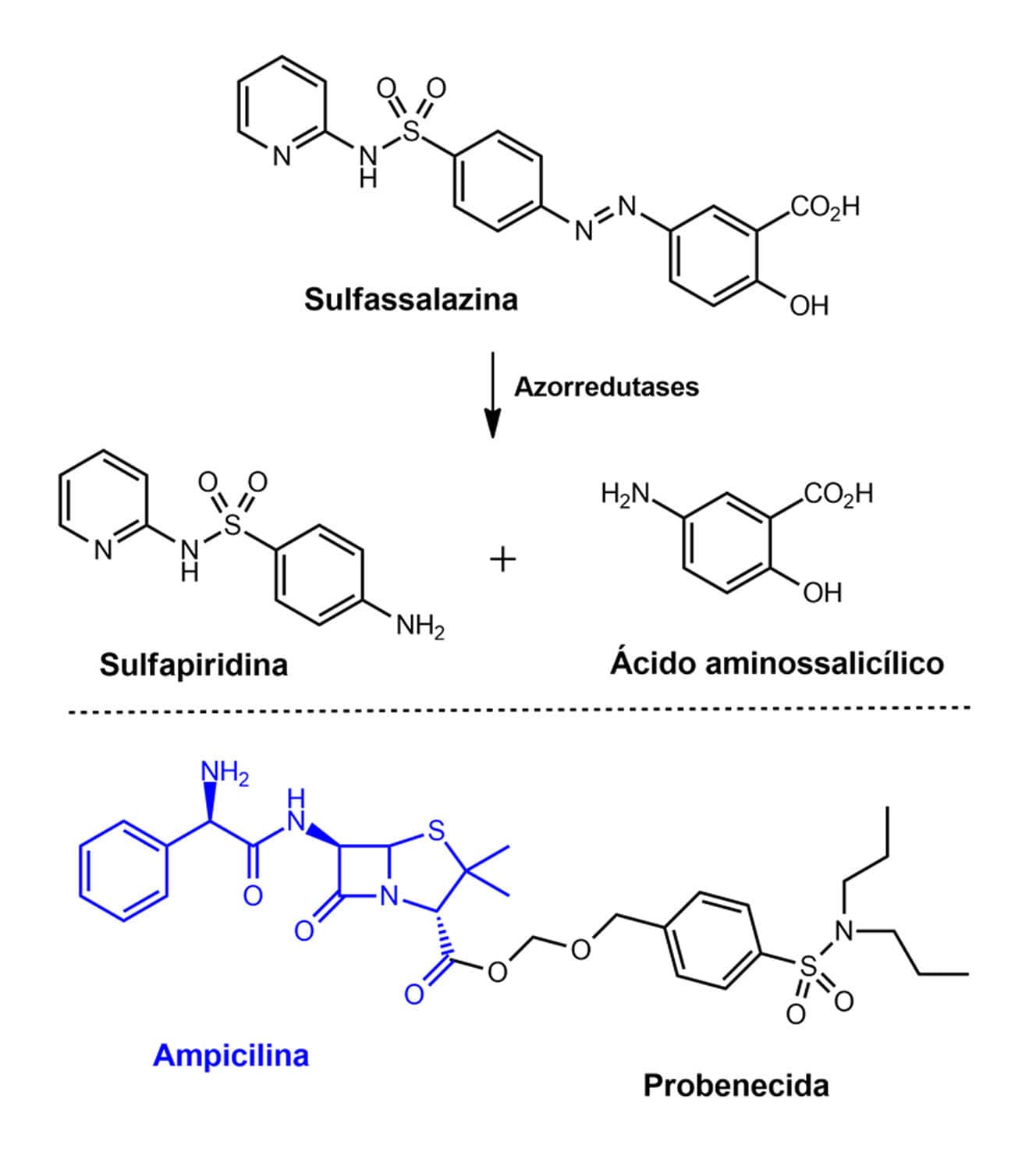
Temos como exemplo a sulfassalazina usada no tratamento da artrite reumatoide e colite ulcerativa que, in vivo, sofre ação das enzimas azorredutases liberando as moléculas de sulfapiridina e ácido aminossalicílico, dois compostos ativos farmacologicamente.
Outro exemplo é a utilização do éster da probenecida de antibióticos, como a ampicilina. A probenecida é um agente uricosúrico que inibe a reabsorção de sais e ésteres do ácido úrico, aumentando assim a sua eliminação, porém em associação com antibióticos tem efeito oposto. No caso do pró-fármaco o objetivo é prolongar a ação da ampicilina pelo bloqueio da sua eliminação nos túbulos renais.
Exemplos de pró-fármacos recíprocos

APLICAÇÃO DA LATENCIAÇÃO NO PLANEJAMENTO DE FÁRMACOS
O especialista Emerson Peçanha abordará o conceito de pró-farmacos, bem como a aplicação da latenciação para a obtenção de fármacos conhecidos, através de exemplos.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste conteúdo, você:
1
Viu as principais estratégias de modificação e otimização molecular de um composto protótipo. A aplicação dessas estratégias busca melhorar o perfil farmacocinético ou farmacodinâmico, além de alguma característica indesejável da fase farmacêutica, ou ainda, obter compostos mais seletivos e menos tóxicos.
Verificou que o bioisosterismo é uma das ferramentas de otimização mais utilizadas e que é dividido em bioisosterismo clássico e não clássico, dependendo do tipo de modificação estrutural que ocorra.
2
3
Estudou a hibridação molecular que consiste na construção de uma molécula híbrida a partir de outras moléculas. O composto híbrido formado pode ter uma atividade biológica aumentada em relação às moléculas precursoras ou apresentar duas atividades farmacológicas distintas, porém combater causas ou sintomas da mesma doença.
As estratégias de simplificação, homologação e rigidificação molecular não são menos importantes e são também muito utilizadas, por isso você estudou vários exemplos de fármacos descobertos por simplificação de estruturas de produtos naturais, que foram e continuam sendo fontes de moléculas bioativas.
4
5
Por último, viu o processo de latenciação na obtenção de pró-fármacos, estratégia que consegue superar inúmeras características indesejáveis em uma molécula, utilizando diversas ferramentas, e vetorizar o fármaco ao seu local de ação usando estratégias modernas como a utilização de nanopartículas.

PODCAST
Agora, o especialista Emerson Peçanha encerra fazendo um resumo sobre o conteúdo estudado.
CONQUISTAS
Você atingiu os seguintes objetivos:
Definiu bioisosterismo e hibridação molecular como estratégias de modificação molecular.
Identificou as estratégias de simplificação, homologação e rigidificação moleculares.
Conceituou pró-fármacos e a importância do processo de latenciação de fármacos.

Conforme Irving Langmuir definiu em 1919 em seu célebre artigo O acordo de elétrons nos átomos e moléculas, é a substituição de um átomo ou grupo de átomos por outros similares eletrônica e estericamente.
Langmuir estudava os átomos ou grupamentos que tinham o mesmo número de elétrons na camada de valência e o comportamento químico das substâncias que os continham, chamando-os de isósteros. A partir daí surgiu o termo bioisosterismo, que relaciona estruturas semelhantes e suas atividades farmacológicas similares ou opostas em um mesmo sítio alvo.