Descrição
Apresentação de características, nomenclatura e reações de formação de compostos de coordenação. Identificação dos conceitos gerais relacionados aos princípios de eletroquímica e dos cálculos relativos ao equilíbrio de oxidação-redução.
PROPÓSITO
Compreender as definições de compostos de coordenação, formação de complexos, conceitos de eletroquímica e reações de oxidação-redução para o conhecimento mais aprofundado de elementos presentes em nosso cotidiano.
Preparação
Antes de iniciarmos, tenha à mão uma calculadora científica. Você também pode usar a calculadora do smartphone ou do computador configurada na função científica.
OBJETIVOS
Módulo 1
Descrever os fundamentos conceituais sobre os compostos de coordenação
Módulo 2
Identificar as reações de formação dos complexos e os cálculos relacionados ao equilíbrio de complexação
Módulo 3
Reconhecer os princípios da eletroquímica e a equação de Nernst
Módulo 4
Descrever a constante de equilíbrio de oxidação-redução e os cálculos relativos à determinação da constante de equilíbrio e à equação de Nernst
Introdução
Neste tema, estudaremos os compostos de coordenação também conhecidos como complexos. Eles são de extrema importância para a sociedade atual, tendo em vista que podem ser aplicados nas mais diversas áreas da ciência e da tecnologia. Além disso, apresentaremos os princípios da eletroquímica.
MÓDULO 1
Descrever os fundamentos conceituais sobre os compostos de coordenação
Compostos de coordenação
Conceitos fundamentais
Também conhecidos como compostos de coordenação, os complexos são compostos suficientemente estáveis formados por:
- Um átomo ou íon central geralmente metálico (M). Ele está ligado por meio de ligações covalentes coordenadas com um número definido de ligantes arranjados ao redor dele.
- Um ou mais grupos de átomos, moléculas ou íons chamados de ligantes (L).
Para compreender melhor a formação desses complexos, é importante lembrar que as ligações covalentes coordenadas são aquelas em que um átomo compartilha completamente seus elétrons com outros átomos, moléculas ou íons.
Outros conceitos fundamentais a serem relembrados são as definições de ácido e base de Lewis:
- Ácidos: Espécies aceptoras de pares de elétrons.
- Bases: Doadores de pares de elétrons.
Atenção
Podemos dizer que, na formação dos compostos de coordenação, a espécie central (M) será um ácido de Lewis e o ligante (L), a base de Lewis.
O ligante pode ser uma molécula neutra (NH3, H2O), um ânion (SO4-2, Cl-, CN-) ou um composto orgânico normalmente formado por grupos doadores de elétrons (HO, N, COOH). A espécie central é um cátion metálico – geralmente de um metal de transição.
De maneira genérica e simplificada, podemos descrever a formação de um complexo com a reação a seguir:
Em que:
- M = Metal;
- L = Ligante;
- ML = Complexo;
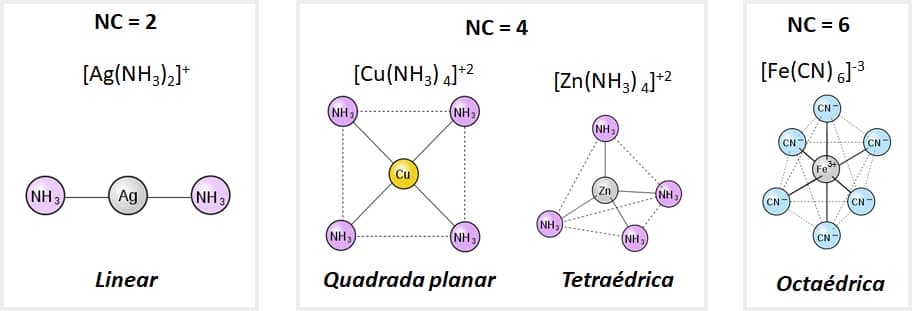
O número de ligações existentes entre o metal e o ligante, ou seja, o número de pares de elétrons compartilhados entre eles, é chamado de número de coordenação (NC).
Em geral, de acordo com a localização da espécie central na tabela periódica, é determinado o NC máximo. Afinal, os raios atômicos grandes favorecem a formação de complexos com números de coordenação mais altos.
Outros fatores que contribuem para determinar o NC de um complexo são as interações estéricas e eletrônicas entre o átomo central e os ligantes. Contudo, os complexos geralmente apresentam um número inferior ao máximo.
Exemplo
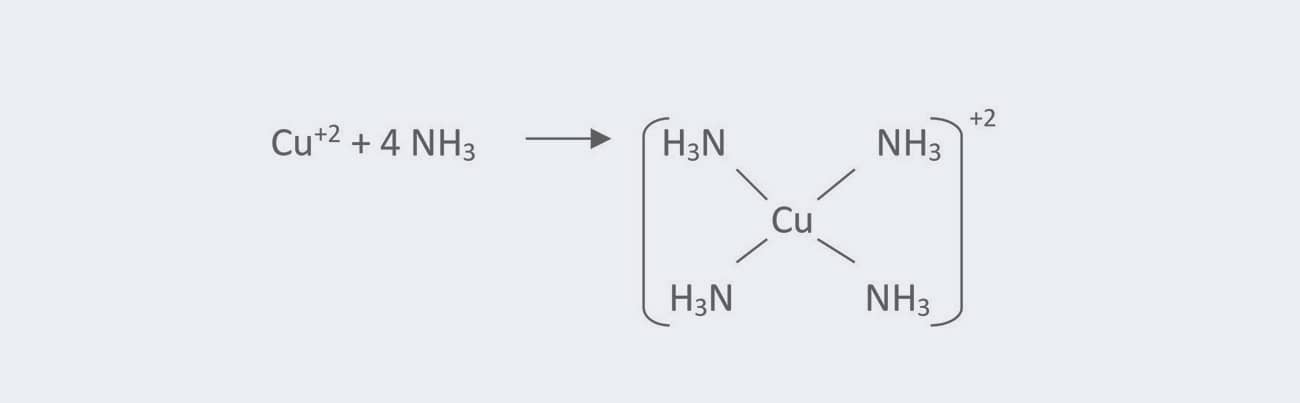
Isso acontece com os complexos de cobre (Cu), que tem o NC máximo igual a seis. No entanto, em geral, esse número é igual a quatro, como ocorre no complexo [Cu(NH3)4]+2.
Na maioria dos casos, o NC é equivalente ao dobro do número de eletrovalência da espécie central, o que pode ser observado nos complexos [Ag(NH3)2]+ e [Co(NO2)6]-3.
Devemos destacar que, dependendo do NC, o composto assumirá formas geométricas distintas:
Geometria dos compostos de coordenação
O especialista Luiz Américo de Avellar Mota explicará o que são compostos de coordenação, e apresentará o conceito de número de coordenação e sua relação com a geometria desses compostos. Assista!
Os ligantes são classificados de acordo com o número de átomos ligados ao metal. Dessa forma, eles podem ser:
Fazem apenas uma ligação com o metal através de um par de elétrons compartilhados.
O ligante é capaz de formar mais de uma ligação, ou seja, possui mais de dois átomos com pares de elétrons disponíveis capazes de formar ligações com o metal.
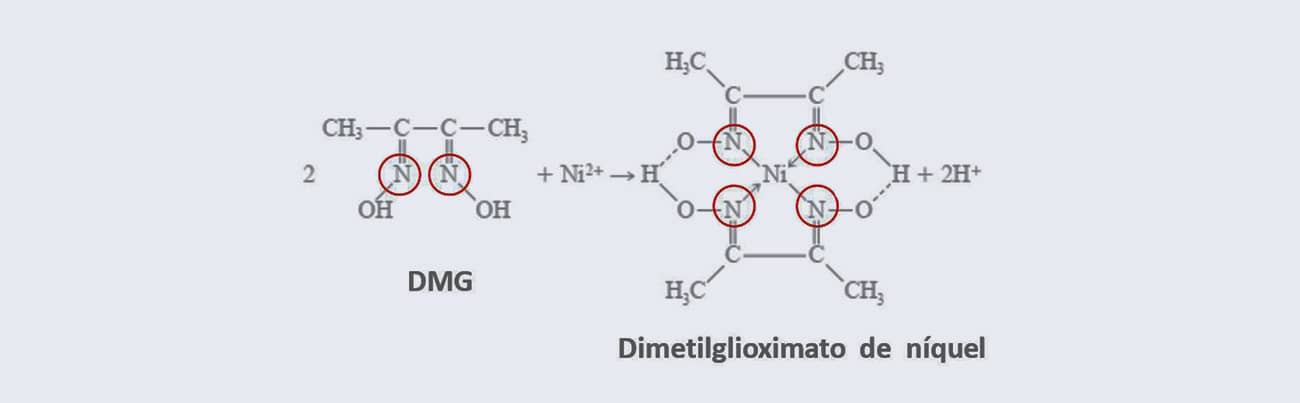
Os ligantes polidentados podem ser chamados de bidentados, tridentados, hexadentados etc. Essa variação se dá conforme o número de átomos ligados ao metal.
Veja outro exemplo:
A dimetilglioxima (DMG) e o ácido etilenodiaminotetracético (EDTA), dois agentes complexantes bastante conhecidos, são ligantes polidentados. Já a amônia é um exemplo de ligante monodentado, assim como H2O, CN- e HO-.
As duas imagens a seguir ilustram respectivamente exemplos de ligantes monodentado e polidentado:
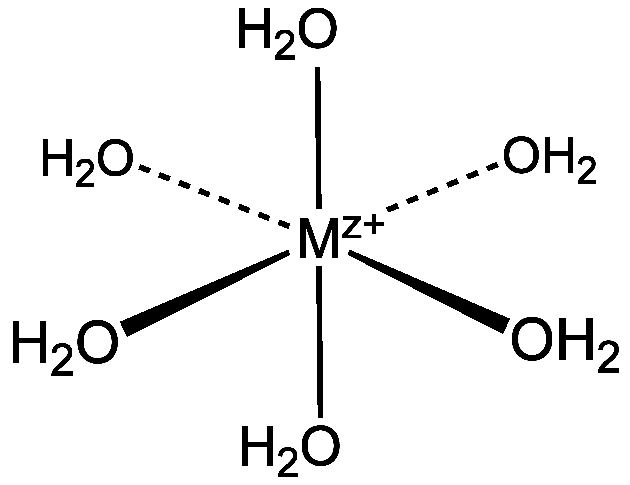
Em meio aquoso, a maioria dos íons metálicos se encontra sob a forma de aquocomplexos, ainda que frequentemente a formação dos aquocomplexos seja simplificada e que se represente apenas a dos demais complexos com outros ligantes.
No caso dos aquocomplexos, o H2O é o ligante, compartilhando o par de elétrons do oxigênio em ligação com o metal:
Para que ocorra a formação de outros complexos, é necessário que o novo ligante desloque as moléculas de H2O no sentido de substituí-las. E, para que isso aconteça, o ligante substituto deve formar um complexo mais estável do que aquele formado com a água.
Essas reações de substituição ocorrem em etapas como demonstram as duas equações a seguir:
Em que:
- M = Metal;
- n = NC do metal;
- L = Ligante diferente de H2O.
Nomenclatura
Os compostos de coordenação, apesar de já serem conhecidos, ganharam mais importância a partir do início do século XX. Em 1913, eles foram o tema central de um estudo que deu o prêmio Nobel de Química a Alfred Werner (1866-1919).
Saiba mais
O sistema de nomenclatura para os compostos de coordenação proposto por Werner continua sendo empregado atualmente apesar de ter sofrido algumas adaptações para se adequar à evolução da química de coordenação. Desde 1957, a International Union of Pure and Applied Chemistry (IUPAC) ou, em português, União Internacional de Química Pura e Aplicada, formaliza as regras de nomenclatura desses compostos a nível internacional. Aquela utilizada atualmente — e que será abordada neste tópico — segue as recomendações descritas pela IUPAC em 2005 em sua publicação intitulada Nomenclature of inorganic chemistry: IUPAC recommendations 2005.
É importante que saibamos como são estruturadas as fórmulas dos complexos. Pela fórmula de um composto de coordenação, é possível designar sua composição e detalhes estruturais.
As regras para a formulação dos compostos de coordenação podem ser descritas conforme a ordem listada a seguir:
Primeiramente, escreve-se o símbolo correspondente à espécie central (metal).
Em seguida, adicionam-se as fórmulas ou as abreviações dos ligantes iônicos e, depois, dos ligantes neutros.
A fórmula do complexo precisa estar dentro de colchetes (caso a espécie seja iônica, deve-se adicionar como expoente a sua carga).
Os ligantes são adicionados seguindo a ordem alfabética dos símbolos que correspondem a cada ligante, desconsiderando-se os prefixos referentes à quantidade.
Parênteses, chaves e colchetes têm de ser empregados nesta ordem para englobar um conjunto de grupos idênticos: [ { ( ) } ]. Quando houver ligantes com mais de um átomo, parênteses ou chaves devem ser usados.
Vamos treinar?
Em relação à nomenclatura dos compostos de coordenação, as regras gerais utilizadas podem ser resumidas conforme esta descrição:
- Os nomes dos ligantes devem ser escritos antes do nome da espécie central. Ainda sobre os ligantes, o ânion precisa preceder o cátion.
- Não deve ser inserido um espaço entre as partes do nome que se refiram à mesma entidade de coordenação.
- Os nomes dos ligantes têm de ser listados em ordem alfabética, desconsiderando-se os prefixos relacionados ao número de ligantes.
- Quando houver mais de um ligante igual, é necessário usar os prefixos di (2), tri (3), tetra (4), penta (5), hexa (6) – e, assim, sucessivamente – para se identificar o número de ligantes.
- Se o nome do ligante já possuir prefixo numérico, o número de ligantes deverá ser identificado pelos prefixos bis (2), tris (3), tetraquis (4), pentaquis (5), hexaquis (6) etc.
- Algumas abreviações são utilizadas na fórmula dos complexos para designar alguns ligantes. As mais conhecidas são: en (etilenodiamina), dien (dietilenotriamina), py (piridina), ur (ureia), gly (glicinato), entre outros exemplos.
- A espécie central, que deve ser escrita após o nome dos ligantes, precisa ter seu nome, seguido do seu estado de oxidação, escrito em algarismo romano entre parênteses.
- O uso de abreviações no nome dos complexos tem de ser evitado.
Os ligantes aniônicos têm os nomes terminados em “o”:
|
Fórmula |
Nome do ânion |
Nome do ligante |
|---|---|---|
|
Br- |
Brometo |
Bromo |
|
CO3-2 |
Carbonato |
Carbonato |
|
CN- |
Cianeto |
Ciano |
|
Cl- |
Cloreto |
Cloro |
|
F- |
Fluoreto |
Fluoro |
|
HS- |
Hidrogenossulfeto |
Mercapto |
|
OH- |
Hidróxido |
Hidroxo |
|
H3CO- |
Metóxido |
Metoxo |
|
C2O4-2 |
Oxalato |
Oxalato |
|
O-2 |
Óxido |
Oxo |
|
SO4-2 |
Sulfato |
Sulfato |
|
S-2 |
Sulfeto |
Tio |
Elaborado por Renata Jorge da Silva Bravim adaptada por Flávio Borges.
Os ligantes neutros geralmente utilizam o mesmo nome da molécula. Algumas exceções importantes estão listadas a seguir:
|
Fórmula |
Nome da espécie neutra |
Nome do ligante |
|---|---|---|
|
H2O |
Água |
Aquo |
|
CO |
Monóxido de carbono |
Carbonil |
|
NH3 |
Amônia |
Amin ou amino |
|
NO |
Monóxido de nitrogênio |
Nitrosil |
|
O2 |
Oxigênio |
Dioxigênio |
|
N2 |
Nitrogênio |
Dinitrogênio |
|
H2 |
Hidrogênio |
Hidro |
Elaborado por Renata Jorge da Silva Bravim adaptada por Flávio Borges.
Quando o complexo for neutro ou catiônico, a identificação do nome da espécie central (Metal) é dada pelo nome do átomo do metal. No entanto, quando o complexo for aniônico deve-se usar o nome do átomo do metal acrescido da terminação “ato”. Algumas exceções estão listadas a seguir:
|
Nome e Fórmula |
Nome em latim |
Nome do ânion |
|---|---|---|
|
Chumbo (Pb) |
Plumbum |
Plumbato |
|
Cobre (Cu) |
Cuprum |
Cuprato |
|
Estanho (Sn) |
Stannum |
Estanato |
|
Ferro (Fe) |
Ferrum |
Ferrato |
|
Ouro (Au) |
Aurum |
Aurato |
|
Prata (Ag) |
Argentum |
Argentato |
Elaborado por Renata Jorge da Silva Bravim adaptada por Flávio Borges.
No próximo quadro, podemos verificar alguns exemplos de aplicação das regras de nomenclatura dos compostos de coordenação. Contudo, antes de clicar, tente construir por conta própria a nomenclatura.
|
Fórmula |
|---|
Elaborado por Renata Jorge da Silva Bravim adaptada por Flávio Borges.
K3[Fe(CN)6]
Hexacianoferrato (III) de potássio
[Co(NH3)6]Cl3
Cloreto de hexa-amincobalto (III)
[Fe(CO)5]
Pentacarbonilferro
[Pt(NH3)4]+2
Tetra-aminplatina (II)
[Cr(CO)6]
Hexacarbonilcromo
[Ag(NH3)2]+
Diaminprata(I)
[Cr(H2O)6]+3
Hexa-aquacromo (III)
[Ni(CN)4]-2
Tetracianoniquelato (II)
[Fe(CN)6]-3
Hexacianoferrato (III)
[HgCl4]-2
Tetracloromercurato (II)
[Ag(CN)2]-
Dicianoargentato (I)
[AuCl2]-
Dicloroaurato (I)
Na3[Ag(S2O3)2]
Bis(tiossulfato)argentato (I) de sódio
[Co(en)3]Cl3
Cloreto de tris(etilenodiamino)cobalto (III)
Aplicações dos complexos
Os complexos constituídos de metais de transição geralmente apresentam uma grande variedade de cores devido às suas propriedades de estruturas eletrônica e geométrica. O fato de serem compostos coloridos e a facilidade de precipitação e de separação do meio, além de outras propriedades particulares, os tornam materiais muito versáteis em inúmeros campos da ciência.
Os métodos titulométricos baseados na formação de complexos (métodos complexométricos) são bastante conhecidos e aplicados em uma grande variedade de estudos quantitativos. A partir de 1940, esses métodos complexométricos ganharam mais notoriedade na aplicação analítica devido à utilização de uma classe específica dos compostos de coordenação: os quelatos.
Saiba mais
Derivando de uma palavra grega que significa “garra”, o termo “quelato” é utilizado para designar compostos organometálicos cíclicos (complexos) nos quais o metal (espécie central) é parte de um ou mais anéis com cinco ou seis membros. Em outras palavras, um quelato é formado quando um íon metálico se coordena com dois ou mais grupos doadores de um único ligante para formar um anel heterocíclico de cinco ou seis membros.
Para que haja a formação de um quelato, é necessária a atuação de um agente quelante, o qual, por sua vez, é um ligante multidentado com múltiplos sítios capazes de coordenar ligações com o íon metálico.
Exemplo
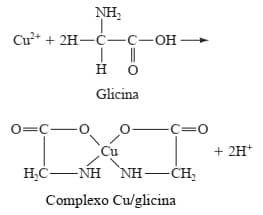
Ao se coordenar com o cobre (Cu) por ligações com o oxigênio do grupo carboxila e o nitrogênio do grupo amina, a glicina (C₂H₅NO₂) forma um complexo quelato Cu/glicina:
Estes agentes quelantes são ácidos aminocarboxílicos que, sempre na proporção 1:1, formam complexos estáveis com a maioria dos íons metálicos:
- EDTA (ácido etilenodiaminotetracético)
- DCTA (ácido trans-1,2-diaminocicloexanotetracético)
- DTPA (ácido dietilenotriaminopentacético)
- EGTA (ácido bis-(2-aminoetil)etilenoglicol- N,N,N',N'-tetracético)
- NTA (ácido nitrilotriacético)
Ethylenediaminetetraacetic acid
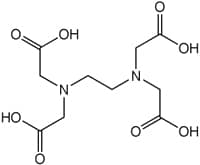
O EDTA, que costuma ser representado por H4Y, é um importante agente quelante e um dos reagentes mais versáteis utilizados nas titulações complexométricas. Esse quelante é hexadentado, ou seja, possui seis sítios potencialmente disponíveis para ligação com íon metálico: quatro grupos carboxílicos e dois grupos amino, cada um com um par de elétrons desemparelhado.
Estas imagens ilustram a estrutura do quelante EDTA e sua forma complexada com o metal, formando um quelato:
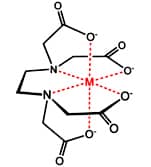
Listaremos a seguir cinco aplicações que podem exemplificar a grande importância dos complexos em diversas áreas comerciais e científicas:
a) EDTA
Ele é um excelente conservante e ingrediente comum de produtos alimentícios comerciais, pois, quando é adicionado aos alimentos, ele se liga tão fortemente à maioria dos íons metálicos que eles se tornam incapazes de catalisar a reação de oxidação pelo ar, conservando os alimentos (vide a figura a seguir).
Assim como o EDTA, outros agentes quelantes semelhantes a ele são frequentemente chamados de agentes sequestrantes devido à sua habilidade em remover ou desativar íons metálicos. Eles podem proteger as cadeias insaturadas de triglicerídeos e outros componentes da oxidação causada pelo ar.
Exemplo
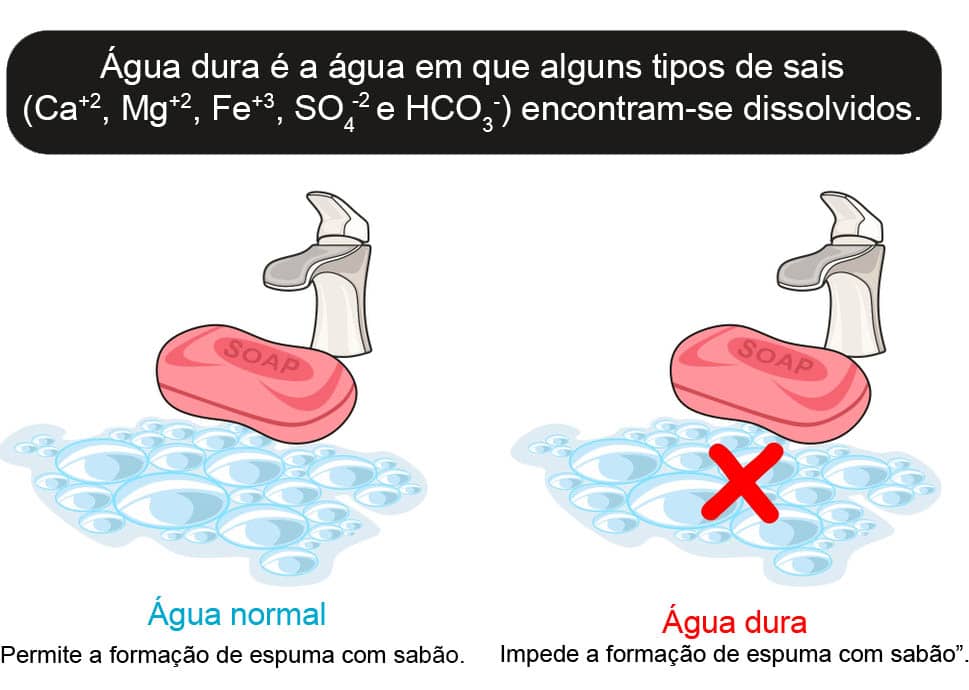
A dureza da água pode ser determinada com a utilização de EDTA. Essa determinação é a medida da concentração total ou parcial dos cátions presentes em uma amostra de água que, ao reagirem com os ânions dos sabões, formam compostos insolúveis que precipitarão.
Dessa forma, o termo “água dura” é utilizado para definir uma amostra de água com um alto teor de minerais, não formando, por isso, bolhas de sabão. Os cátions mais comumente encontrados em águas são o cálcio e magnésio.
A medida convencional de dureza é expressa como ppm ou mg/L de CaCO3. O EDTA é o agente complexante utilizado para a formação dos complexos com os metais presentes nas amostras de água, formando um precipitado que pode ser posteriormente quantificado.
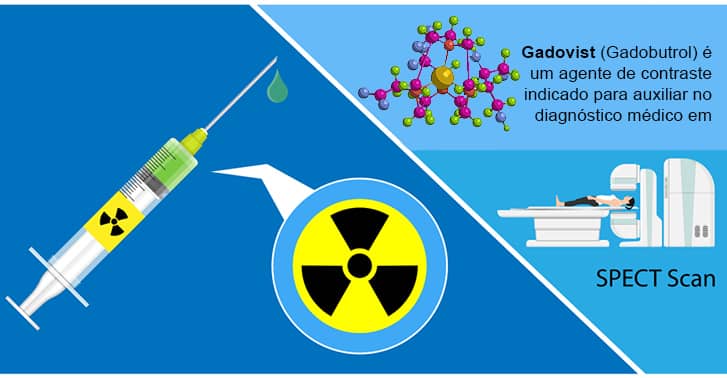
b) Radiofármacos
Eles são substâncias emissoras de radiação utilizadas na medicina para radioterapia e exames de diagnóstico por imagem.
Veja esse exemplo:
Um complexo específico de gadolínio (Gd) é um radiofármaco de grande importância para os exames de ressonância magnética nuclear (RMN). Ele atua realçando a qualidade de imagem obtida nos exames na comparação com outros tipos de radiofármacos utilizados como contraste.
A maioria dos agentes de contraste utilizados para exames de ressonância opera à base de quelatos do íon paramagnético Gd, que vêm sendo utilizado desde o final da década de 1980.
A vantagem do Gd em relação a outros metais está em:
- Necessidade de um volume menor de material a ser injetado no paciente.
- Baixa toxicidade ao organismo humano quando quelado a uma molécula.
- Estabilidade na circulação.
O íon Gd, quando fica livre na circulação, é bastante tóxico; porém, quando ele está quelado a uma molécula, tem sua farmacocinética alterada, acelerando sua depuração e, portanto, reduzindo acentuadamente a toxicidade relativa dele. O agente quelante é o que diferencia os diversos meios de contraste à base de Gd encontrados no mercado.
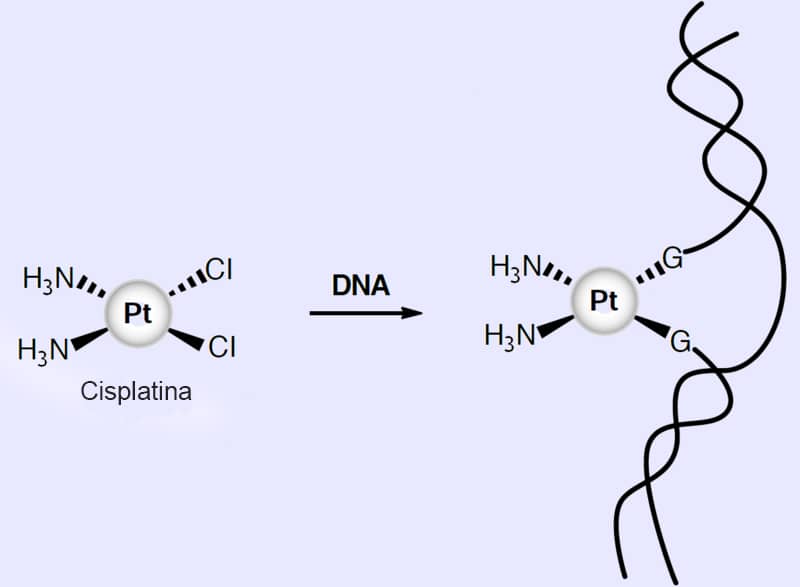
c) Metalofármacos antitumorais
São complexos que atuam na deformação da dupla hélice do DNA, gerando uma morte celular programada das células tumorais (observável na figura abaixo).
Exemplo
Entre os vários complexos utilizados como antitumorais, a cisplatina é uma das mais conhecidas. A descoberta de suas propriedades antitumorais e o uso clínico de complexos de platina (Pt) no tratamento do câncer constituem um dos maiores sucessos da química inorgânica medicinal.
Os diversos estudos sobre esses complexos possibilitaram o entendimento de seu mecanismo de ação e de seu comportamento dentro do organismo. Atualmente, existem várias linhas de pesquisa interessadas no desenvolvimento e na aplicação de novos complexos, sobretudo daqueles baseados no uso de metais essenciais, ou seja, metais encontrados na composição do corpo humano.
Exemplos de metais essenciais: Cobre (Cu) e zinco (Zn).
A produção de complexos baseados em metais essenciais é interessante, tendo em vista que o corpo humano sabe armazená-los, transportá-los e excretá-los, diferentemente do que acontece com a Pt. Isso pode promover um efeito menos tóxico e mais eficiente ao organismo do paciente.
Comentário
Alguns laboratórios brasileiros possuem pesquisas bastante promissoras nessa vertente. Espera-se que futuramente outros compostos metálicos possam vir a ser utilizados no tratamento contra o câncer.
d) Complexos de prata (Ag)
Eles são formados durante o processo de determinação de cianeto de hidrogênio (HCN) em efluentes de fábricas de acrilonitrila (C3H3N). Monômero da poliacrilonitrila, a acrilonitrila é muito aplicada na indústria têxtil e na produção de plásticos.
O HCN é a principal impureza encontrada nos efluentes das fábricas de acrilonitrila. A determinação quantitativa de CN- é realizada por meio de titulação com nitrato de prata (AgNO3).
O final da titulação é determinado com a adição de uma solução básica de iodeto de potássio (KI), a qual, por sua vez, determina o fim da complexação dos íons de Ag+ com todo CN- presente no efluente (formando [Ag(CN)2]-) por meio da formação de um precipitado de AgI, que, por fim, é responsável pela turbidez permanente no material avaliado:

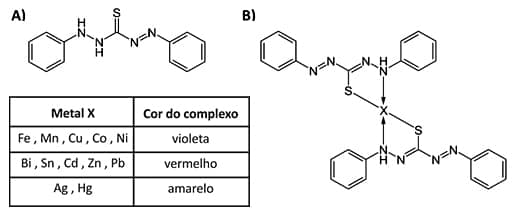
e) Agentes complexantes orgânicos
Eles têm sido utilizados na precipitação de metais ao se ligarem a outros, formando precipitados e eliminando interferências, em processos de extração e na formação de complexos que absorvem luz em determinações espectrofotométricas (o complexo M-ligante é colorido ou absorve a radiação ultravioleta).
Os compostos orgânicos de maior importância são aqueles capazes de formar complexos quelatos com metais (observe a figura abaixo). Os quelatos metálicos são relativamente apolares e, portanto, têm solubilidades relativamente baixas em água, embora elas sejam elevadas em líquidos orgânicos.
Atenção
Essa característica é fundamental para processos de extração de metais de interesse de meios reacionais contendo possíveis interferentes, favorecendo, assim, o efeito de pré-concentração do material extraído para uma fase de menor volume.
Outra aplicação para eles é seu emprego como agentes mascarantes, ou seja, agentes complexantes que reagem seletivamente com um componente da solução, formando complexos estáveis com o metal para impedir que ele interfira em determinação específica – caso, aliás, da difeniltiocarbazona (Ditizona).
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar as reações de formação dos complexos e os cálculos relacionados ao equilíbrio de complexação
Reações de complexação
Constantes de formação e global
As reações de complexação ocorrem em etapas. Cada etapa da coordenação possui uma constante de formação (também chamada de constante de estabilidade). Com isso, a reação inversa possui uma constante de dissociação ou de instabilidade do complexo.
Descreveremos de maneira genérica as reações de complexação entre metal e ligante, assim como suas correspondentes constantes de formação (equações 4 e 5). Serão formados tantos complexos até que o NC mais alto seja MLn:
Em que:
- M = Metal;
- L = Ligante;
- n = NC do metal;
- ML = Complexo;
- Kf = Constante de formação do complexo.
Cada etapa de reação dos complexos possui uma constante de formação (Kf). O conjunto dessas reações progressivas dá origem a uma reação global que possui uma constante global correspondente designada pelo símbolo β.
À exceção da primeira etapa, as constantes de formação globais são obtidas a partir do produto das constantes de formação progressivas para as etapas individuais que levam à formação do complexo. É o que as equações 6, 7 e 8 ilustram:
Já nas equações 9 a 11, podemos acompanhar a formação do complexo [Ag(NH3)2]+ por intermédio de reações de formação progressivas que dão origem à reação global de obtenção do complexo:
Reações de formação progressivas:
Reação global:
Distribuição das espécies
Como já mencionamos, as reações de complexação envolvendo ligantes monodentados ocorrem em etapas, havendo tantas etapas quantos ligantes forem adicionados, o que é determinado pelo NC do íon metálico (espécie central).
No entanto, por se tratar de ligantes polidentados (quelantes), as reações ocorrem em uma única etapa independentemente do NC do íon metálico, que, na proporção de 1:1, forma quelatos de grande estabilidade.
Durante a reação de complexação, a variação da concentração do ligante presente fará com que haja uma modificação na distribuição das espécies, predominando uma ou outra entre os vários possíveis complexos formados. Dessa forma, é essencial conhecer a concentração de cada espécie envolvida no equilíbrio de complexação.
Considere um modelo genérico constituído por um íon metálico M de concentração analítica CM reagindo com um ligante monodentado L de concentração analítica CL. Já temos os equilíbrios descritos anteriormente nas equações 6, 7 e 8 (repetidas a seguir para facilitar o acompanhamento dos cálculos):
Encontramos o seguinte balanço de massa para o sistema:
Substituindo as concentrações dos “n” complexos que foram tiradas das expressões das respectivas constantes de formação na equação 12, verificamos que:
Das constantes de formação global, as concentrações dessas espécies podem ser expressas em termos da concentração de metal livre [M]:
A fração da espécie M, denominada como αM, pode ser, portanto, descrita por:
De maneira análoga, podemos descrever a fração da espécie ML, αML, como:
Por meio dessas expressões, é possível calcular os valores das diferentes espécies em função de:
- Concentração do ligante livre.
- Constantes de formação ou constantes globais.
Quanto aos ligantes quelantes, podemos usar como exemplo a equação genérica para a reação de complexação entre o EDTA (H4Y) e um íon metálico (M):
Já as reações de equilíbrio do EDTA estão descritas a seguir:
Lembre-se de que a relação EDTA:M será sempre 1:1 e que Y-4 representa o EDTA na forma completamente ionizada.
Seguimos para o balanço de massas total das espécies do EDTA (CT):
De maneira análoga, os demais valores podem ser obtidos. Fazendo as substituições na equação de constante de equilíbrio de MY (M-EDTA) da equação 19, temos a equação 27:
Faremos agora uma atividade cuja aplicação envolve os cálculos para a determinação da fração de determinada espécie em solução:

Teoria na prática
Considerando que a fração de todo EDTA livre na forma Y-4 é denominada como αy-4, em pH
6, numa concentração formal de
- [H6Y+2] = 8,9.10-20 M; [H5Y+] = 8,9.10-14 M
- [H4Y] = 2,8.10-7 M; [H3Y-] = 2,8.10-5 M; [H2Y-2] = 0,057 M
- [HY-3] = 0,043 M; [Y-4] = 1,8.10-6 M
Como podemos determinar a fração de EDTA livre em solução nessas condições?
Podemos determinar o valor de αy-4 utilizando as fórmulas genéricas das equações 24 e 25:
αy-4 é a fração de EDTA na forma Y-4
Constante de formação condicional
Ela é uma constante de equilíbrio para a reação entre um íon metálico e um agente complexante, sendo aplicada somente quando a formação do complexo depende das condições do meio.
Complexos cujo ligante é o EDTA.
Por ser um ácido, o pH do meio determina o grau de protonação da sua molécula, e, consequentemente, a concentração das espécies aniônicas.
Outra situação na qual a constante de formação condicional se aplica é quando o meio conta com mais de um metal que pode formar complexos com o mesmo ligante. Dessa forma, a variação da concentração do ligante interfere nos dois equilíbrios, sendo favorecido sempre aquele que apresenta a maior constante de formação.
Exemplo
Nas reações de titulação de complexação, é comum aplicar agentes mascarantes para se evitar que os metais que não sejam de interesse (metais interferentes) reajam com o titulante, o qual, por sua vez, geralmente é um ligante polidentado. Para que o mascaramento seja efetivo, o metal interferente precisa formar um complexo mais estável com o agente mascarante do que com o titulante.
As constantes condicionais são diretamente calculadas e fornecem uma forma simples pela qual as concentrações de equilíbrio do íon metálico e do complexo podem ser calculadas no ponto de equivalência de uma titulação e quando existe um excesso de reagente.
Para descrever a obtenção da expressão correspondente à constante de formação condicional designada como K’f, daremos continuidade aos cálculos apresentados quando falamos da distribuição das espécies no tópico anterior.
Basta, portanto, combinar as duas constantes, α4 e KMY (na equação 27), para se obter a constante de formação condicional K’MY. Temos, assim, a equação 28 descrita como:
Em que:
K’MY = constante de formação condicional (α4 é controlado em função do pH).
Faremos agora uma atividade de cálculo na qual se utiliza a relação entre as constantes α4 e Kf para a obtenção da constante de formação condicional em determinado pH:

Teoria na prática
Em 50,00 mL de solução de Ca+2 0,00500 mol.L-1 titulado com EDTA (Y) 0,0100 mol.L-1 em uma solução tamponada com um pH constante igual a 10, há uma constante de formação do complexo KCaY = 5,0.1010 e um valor de α4 para o EDTA em pH 10 de 0,35.
Como poderemos obter a constante de formação condicional para o complexo CaY nessas condições mencionadas?
Em casos como esse, em que são fornecidos dados tabelados de uma constante de formação (Kf) e α4 em pH específico, basta aplicar os valores fornecidos na fórmula genérica da equação 28 para obter o valor da constante de formação condicional (K’f) no pH de interesse.
Desse modo, temos:
Reações de complexão
Neste vídeo, o especialista Luiz Américo de Avellar Mota realiza resolução de exercícios que envolvam cálculos de equilíbrio de complexação de baixa, média e alta complexidade. Assista!
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer os princípios da eletroquímica e a equação de Nernst
Eletroquímica
Neste módulo, estudaremos a eletroquímica. As reações de oxirredução, afinal, se tornaram presentes em diversos aspectos do cotidiano.
Listaremos a aplicação de algumas delas a seguir:
- Indústrias siderúrgicas.
- Processos bioquímicos, como, por exemplo, a respiração e a fotossíntese.
- Pilhas e baterias usadas nos equipamentos elétricos.
- Agentes de prevenção a corrosão (processo fruto de reações do tipo).
Buscando uma melhor compreensão desses sistemas reacionais, definiremos os aspectos básicos de uma reação de oxirredução. Além disso, explicaremos o funcionamento de uma célula eletroquímica e de seus eletrodos.
Entenderemos, por fim, quando uma espécie recebe ou doa elétrons para outra. Para isso, por meio da aplicação da equação de Nernst, aplicaremos a nomenclatura correta para tais espécies, sendo capazes de determinar a concentração delas em uma solução ao sabermos o potencial da reação – e vice-versa.
Definições das reações de oxidação-redução
Reações de oxidação-redução (ou reações redox) abrangem a transferência de elétrons entre espécies. Elas são caracterizadas pela ocorrência simultânea de dois processos:
Oxidação
Ocorre quando uma espécie química perde um ou mais elétrons. Como consequência, o seu número de oxidação (Nox) aumenta.
Redução
Processo inverso da oxidação, ele acontece quando uma espécie ganha um ou mais elétrons, fazendo com que seu número de oxidação (Nox) diminua.
Observe que a oxidação e a redução são processos opostos, embora eles se complementem. O motivo: os elétrons “perdidos” na oxidação são, na verdade, transferidos para outra espécie capaz de recebê-los, sendo consequentemente reduzida nesse processo.
A espécie que sofre oxidação provoca a redução em outra espécie, sendo denominada, assim, agente redutor (ou redutor). Já a que passa pela redução também provoca a oxidação em outra substância ou elemento, sendo chamada, por conta disso, de agente oxidante (oxidante).
Dica
Agente oxidante ou oxidante: Substância que se reduz, promovendo a oxidação da outra espécie durante o processo. É um bom aceptor de elétrons.
Agente redutor ou redutor: Substância que se oxida ao doar elétrons para outra substância, que, por sua vez, se reduz no processo. É um bom doador de elétrons.
Para exemplificarmos o sistema redox, podemos utilizar os elementos ferro e vanádio:
A transferência dos elétrons pode ocorrer sem que haja o contato entre o redutor e o oxidante; desse modo, as reações parciais (denominadas semirreações) ocorrem separadamente:
Por receber um elétron, o Fe3+ é o agente oxidante (se reduz e faz com que o V2+ sofra oxidação). Já o V2+ é o redutor (se oxida e faz com que o Fe3+ sofra redução) por doar um elétron. Assim, considerando que a equação 29 avança da esquerda para a direita, temos o ferro sendo reduzido de Fe3+ para Fe2+, enquanto o vanádio é oxidado de V2+ para V3+.
Outro exemplo que podemos utilizar para exemplificar uma reação de oxidação-redução é o sistema formado por ferro e cério:
Para tal reação, teremos as seguintes semirreações (equações 33 e 34):
Neste caso, podemos ver que o ferro está doando o elétron, passando a agir como um agente redutor; com isso, esse agente oxida, indo de Fe2+ para Fe3+ (conforme a demonstra a equação 34). Já o Cério, ao receber o elétron doado, reduzirá, passando de Ce4+ para Ce3+ e agindo como agente oxidante.
O estudo de equilíbrio redox tem como objetivo fundamentar quais espécies reagem como aceptoras ou doadoras de elétrons. Para compreendermos a reatividade das espécies envolvidas em uma reação de oxidação-redução, precisamos entender o conceito de energia de ionização.
Dica
A energia de ionização se refere à quantidade mínima de energia necessária para a retirada de um elétron de um átomo ou de um íon em seu estado gasoso.
O átomo de metal que apresentar a maior tendência a doar elétrons, ou seja, aquele que tiver a menor energia de ionização, será o mais reativo no que concerne à sua capacidade para se oxidar.
Com base nas energias de ionização, foi elaborada uma sequência que visa a organizar os metais em razão da reatividade a fim de que possamos identificar mais rapidamente qual espécie oxidaria e qual reduziria.
Essa sequência é denominada fila de reatividade dos metais ou fila das tensões eletrolíticas:
A sequência nos mostra que metais situados à esquerda são mais reativos (mais susceptíveis à oxidação) e tendem a reagir com cátions dos metais à direita, os quais, aliás, são menos reativos (menos suscetíveis à oxidação). Já o contrário não acontece.
Exemplo
O entendimento dos fundamentos da transferência de elétrons no sistema redox possibilita o desenvolvimento de baterias, prevenção à corrosão e produção industrial de cloro (Cl2), Al, Cu e NaOH.
Células eletroquímicas
Uma característica peculiar das reações redox é a possibilidade de que os agentes oxidante e redutor possam estar separados por meio do uso de uma célula eletroquímica.
a) Conceitos e funções
A célula eletroquímica é um sistema formado por dois condutores denominados eletrodos, em que cada um está inserido em uma solução eletrolítica. As duas soluções, na maioria dos casos, são separadas e diferentes entre si.
A separação das soluções eletrolíticas se deve à prevenção da ocorrência de uma reação direta e rápida entre os reagentes, acarretando uma interrupção precoce no funcionamento da célula.
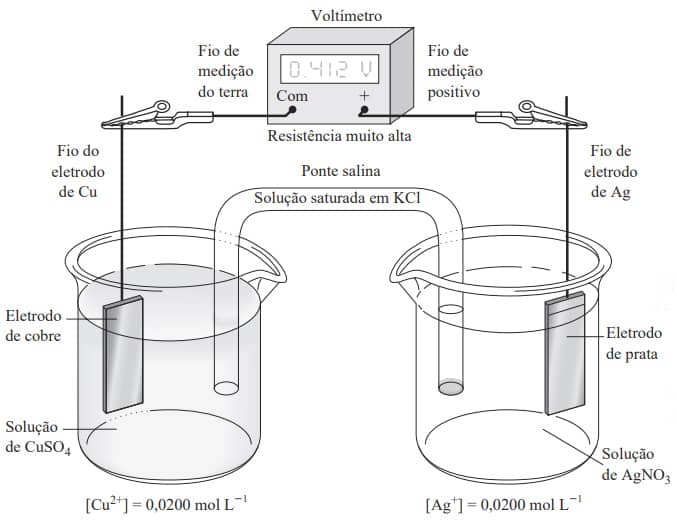
Conforme pode ser visualizado na imagem a seguir, a ponte salina é uma forma das mais usadas para separar e evitar a mistura das soluções eletrolíticas:
Eletrodos
São constituídos de um material condutor (geralmente, um metal) que possibilita a troca de elétrons em sua superfície.
A ponte salina é constituída geralmente por uma solução saturada de KCl. Neste caso, por meio do deslocamento dos cátions K+ em um sentido e dos ânions Cl- no contrário, ocorre a condução elétrica entre as soluções eletrolíticas, evitando o contato direto entre as distintas soluções da célula eletroquímica.
Levando em consideração os eletrodos metálicos da célula representada na figura acima, ocorre uma oxidação do cobre metálico na equação 35, enquanto o íon Ag+ é reduzido na 36:
Nesse processo, os elétrons, a partir do eletrodo de cobre, deslocam-se através de um condutor metálico externo em direção ao eletrodo de prata. A redução da prata se deve a essa espécie ser menos reativa que o cobre (conforme visualizamos na fila de tensões eletrolíticas apresentada anteriormente).
Ao inserirmos um voltímetro entre os dois eletrodos metálicos, teremos a medida da diferença de potencial (ddp) entre eles. Essa medida nos permite ter a noção do andamento da reação na célula eletrolítica para alcançar o equilíbrio, visto que o potencial tende a zero ao aproximar-se do equilíbrio da reação global:
Uma vez alcançado o equilíbrio, ou seja, E = 0V, e o fluxo líquido de elétrons também sendo zero, teremos as concentrações de Cu2+ e Ag+ nas soluções que satisfaçam à expressão da constante de equilíbrio:
Desse modo, a ddp entre as duas semirreações de uma célula eletroquímica possibilita o estudo do equilíbrio redox.
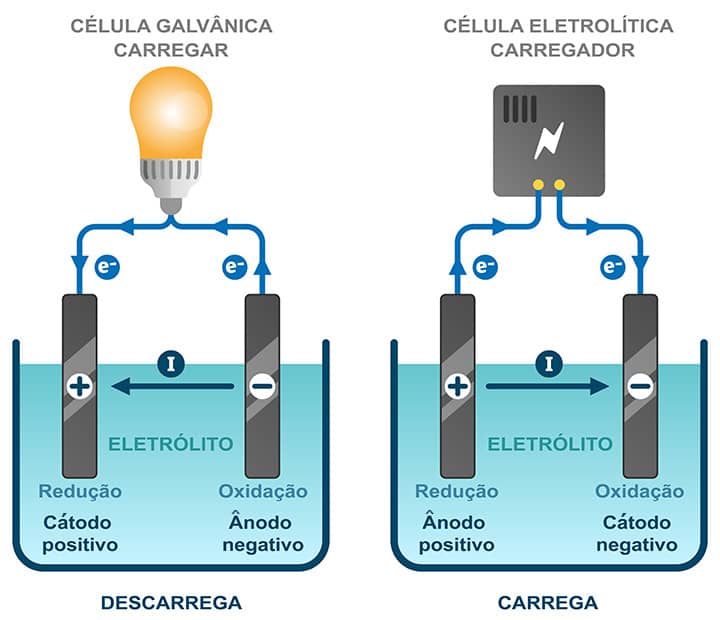
Nas células eletroquímicas, cada eletrodo recebe uma nomenclatura dependendo do tipo de reação que nele ocorre:
- Cátodo: Eletrodo onde ocorre a redução.
- Ânodo: onde acontece a oxidação.
Atenção
A designação do eletrodo não tem a ver com a sua carga, e sim com a semirreação que ali ocorre.
No caso da célula eletroquímica exemplificada na figura acima, há uma reação de redução da Ag+ (reação catódica) na equação 36 e a de oxidação do Cu(S) (reação anódica) na 35.
b) Tipos de células eletroquímicas
Células eletroquímicas são classificadas em dois grupos:
Células galvânicas (ou voltaicas)
São as células que armazenam eletricidade. Trata-se de reações de ocorrência espontânea que produzem um fluxo de elétrons do ânodo (Cu) para o catodo (Ag) via condutor externo (conforme o sistema representado na figura anterior).
Células eletrolíticas
Dependem de uma fonte de energia elétrica para o seu funcionamento.
Exemplo
Na introdução de uma fonte de corrente contínua de 0,5V em uma célula eletroquímica de modo que cada terminal da fonte está conectado a um eletrodo, há agora o fluxo de elétrons no sentido contrário daquele que é observado na célula galvânica (representada na figura a seguir).
Dessa forma, em uma mesma célula eletroquímica, o eletrodo que, em uma galvânica, é caracterizado como cátodo atua como um ânodo na eletrolítica. Da mesma maneira, o ânodo na célula galvânica se comporta como cátodo na eletrolítica.
Para simplificar a representação de uma célula, utiliza-se uma notação como a que foi exposta na equação 39. Está descrita nela a Pilha de Daniell (eletrodos de cobre e zinco), cujos eletrólitos apresentam uma atividade de 0,01M.
Atividade
A atividade está relacionada à concentração efetiva de uma espécie em solução, uma vez que os íons se encontram cercados por outros de cargas opostas. O valor dela é calculado por meio da multiplicação da concentração molar pelo coeficiente de atividade; no entanto, em concentrações baixas, o valor do coeficiente se aproxima da unidade. Assim, por conveniência, atribuiremos à atividade o valor da concentração molar.
Ânodo Cátodo
Nas representações, à esquerda se escreve o ânodo e a solução que se encontra em contato com ele. A seção onde ocorre o contato entre duas fases e a ddp são representadas por uma linha vertical simples, |, enquanto as duas barras verticais paralelas, ||, expressam a presença de ponte salina.
O potencial de uma célula eletroquímica é calculado pela diminuição do potencial do eletrodo do ânodo do potencial do catodo:
As células eletroquímicas
O especialista Luiz Américo de Avellar Mota vai conceituar células eletrolíticas e diferenciá-las, enfatizando as reações que acontecem nos eletrodos em cada uma delas. Assista!
Potencial de eletrodo
Antes de discutirmos o potencial de um eletrodo, precisamos compreender o que significa, nesse contexto, o termo potencial.
a) Conceitos
O potencial mede a capacidade das espécies químicas de sofrerem reações de oxidação e redução. Ou seja, quando um elemento ou uma substância química apresenta um alto potencial de redução, isso significa que ela se reduz com facilidade e que tem alta capacidade de provocar oxidação em outra espécie (caráter oxidante). De maneira análoga, se uma espécie química tem alto potencial de oxidação, ela se oxida facilmente, tendo um forte caráter redutor.
E o que seria, portanto, o potencial de eletrodo?
Consideramos o potencial de eletrodo como o potencial de redução. Com isso, o de oxidação é o potencial da semirreação. Apesar de ter o mesmo valor, ele conta com um sinal oposto:
Ao falarmos de potencial de eletrodo, estamos nos referindo à ddp de uma célula eletroquímica quando comparada a um eletrodo de referência. Esse potencial é usado para semirreações na forma de reduções.
Por determinação prévia, o sinal do potencial de eletrodo está diretamente relacionado ao da semicélula avaliada.
Desse modo, quando a semicélula estudada agir de maneira espontânea como catodo (o eletrodo positivo da célula galvânica), o sinal do seu potencial de eletrodo será positivo. O oposto se aplica nesse caso também: se ela tiver um comportamento de ânodo, o potencial do eletrodo será negativo.
b) Eletrodo padrão de hidrogênio
A fim de se determinar valores para os potenciais de um eletrodo, uma referência é necessária. Para isso, foi atribuída à semicélula de hidrogênio o valor de potencial de redução igual a zero:
Tal atribuição faz com que, em uma célula elaborada com um eletrodo de hidrogênio e outro eletrodo, o potencial observado seja totalmente o do segundo a ser empregado. Portanto, é possibilitada a elaboração de uma tabela de potenciais-padrão.
Na prática, o eletrodo de hidrogênio se trata de um fio com uma placa na ponta que é inserido em um tubo de vidro com gás hidrogênio a uma pressão de 1 atm. A placa de platina serve como suporte para o hidrogênio adsorvido em sua superfície, sendo ela inerte à reação. O sistema é submerso em uma solução de ácido sulfúrico de 1 M a 25°C.
c) Potencial de eletrodo padrão (E0)
A IUPAC define o potencial de eletrodo (ou, mais exatamente, o potencial de eletrodo relativo) como a força eletromotriz de uma célula eletroquímica constituída por um eletrodo de interesse e outro de hidrogênio.
Para ilustrarmos uma célula galvânica na determinação do potencial de eletrodo padrão, podemos utilizar a célula de prata e hidrogênio da equação 44:
Nessa célula eletroquímica, temos uma semicélula em que uma placa de prata pura está em contato com uma solução que contém Ag+ na concentração de 1,0 M (equação 5), enquanto o outro eletrodo é o de hidrogênio.
O potencial gerado por essa célula galvânica é de 0,779V, sendo o cátodo o eletrodo de prata. Na reação espontânea representada na equação 40, o potencial gerado era positivo, uma vez que os elétrons partiam do eletrodo de hidrogênio (ânodo) para o de prata (catodo). Logo, o sinal do potencial-padrão será positivo (+0,779V).
Para exemplificarmos novamente essa determinação de potencial-padrão, podemos utilizar uma semicélula de cádmio:
Em uma célula galvânica de reação espontânea entre cádmio e hidrogênio, o eletrodo de Cd age como ânodo; com isso, os elétrons migram do Cd para o eletrodo de hidrogênio. O sinal do potencial será, portanto, negativo: - 0,403V.
Quanto ao potencial de eletrodo, quanto maior (mais positivo) ele for, maior será também a capacidade de ação da forma oxidada como agente oxidante e mais fraca a possibilidade de a forma reduzida agir como agente redutor. Do mesmo modo, deduz-se que, quanto menor ou mais negativo for o potencial, mais forte será a forma reduzida como agente redutor.
A tabela a seguir contém alguns potenciais de eletrodo padrão (lembre-se de que eles são expostos na forma de potenciais de redução). O caráter oxidante aumenta, nessa tabela, de cima para baixo, sendo o flúor o agente oxidante mais forte.
|
Semirreações |
Potenciais de redução (E0red) em volt |
|---|---|
|
-3,04 |
|
|
-2,87 |
|
|
-2,71 |
|
|
-2,36 |
|
|
-1,66 |
|
|
-0,76 |
|
|
-0,44 |
|
|
-0,28 |
|
|
-0,25 |
|
|
-0,14 |
|
|
-0,13 |
|
|
0 |
|
|
+0,34 |
|
|
+0,80 |
|
|
+0,85 |
|
|
+1,07 |
|
|
+1,36 |
|
|
+1,50 |
|
|
+2,87 |
Elaborado por HARRIS, 2005, p. 800-808. Apêndice H., adaptada por Renata Jorge da Silva Bravim e Flávio Borges.
O potencial-padrão de uma célula E0tot pode ser utilizado para:
- Avaliar a espontaneidade de uma reação. Caso E0tot > 0, a reação será espontânea; se E0tot < 0, ela não o será.
- Determinar a energia livre padrão (ΔG0) e a constante de equilíbrio da reação (Keq) por meio da equação de Nernst.
Equação de Nernst
Como já falamos, o potencial de um eletrodo é diretamente afetado pela concentração dos eletrólitos, a qual, aliás, está relacionada à diferença entre as concentrações da semicélula e às de equilíbrio. Tal relação proporciona a possibilidade de sabermos o comportamento de um potencial quando ocorrer uma mudança nas concentrações.
Dica
Experimentalmente, observa-se um aumento do potencial quando ocorre um aumento na concentração de reagente ou uma diminuição da concentração de produtos, o que torna a reação mais espontânea. Do mesmo modo, o inverso será observado caso ocorra a diminuição do reagente ou o aumento da concentração de produtos o potencial diminuirá, enquanto a reação se tornará menos espontânea.
Medidas de potenciais são relacionadas à termodinâmica e à concentração do elemento eletroativo. Esses dois fatores, portanto, são considerados no cálculo do potencial por meio da equação de Nernst:
No próximo módulo, abordaremos os cálculos envolvidos na relação das concentrações e a determinação de potencial por meio da constante de equilíbrio. Além disso, falaremos mais sobre a equação de Nernst.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever a constante de equilíbrio de oxidação-redução e os cálculos relativos à determinação da constante de equilíbrio e à equação de Nernst
Balanceamento de equações de oxidação-redução
Antes de introduzirmos os cálculos da equação de Nernst, precisamos estar cientes da necessidade do balanceamento da reação para o bom desenvolvimento das equações. Estudaremos então como isso deve ser efetuado.
Dois métodos são empregados para se efetuar o balanceamento de equações redox:
Método íon-elétron
Vamos estruturar o procedimento em cinco etapas de organização das semirreações:
- Para balancearmos os átomos de oxigênio (O), usamos as moléculas de água (H2O);
- Para balancearmos os hidrogênios contidos nos compostos, utilizamos o íon H+;
- Para o balanceamento de cargas, empregamos elétrons (e-);
- Igualamos os números de elétrons nos processos de redução e oxidação;
- Somamos as semirreações para termos a equação global balanceada.
Para visualizarmos essa sequência na prática, empregaremos na reação do íon MnO4- com o ácido H2SO3, a qual, em meio ácido, produz ácido sulfúrico e o íon Mn2+. Antes de iniciarmos a aplicação dela, porém, precisamos entender a reação, já que devemos identificar quais espécies sofrem a oxidação e quais são reduzidas (equações 48 e 49):
Oxidação: H2SO3 → SO42-: o redutor H2SO3 está sendo oxidado a SO42-. Eq.48
Redução: MnO4- → Mn2+: o MnO4-, oxidante, se reduz a Mn2+. Eq.49
Definida essa etapa, balancearemos agora o oxigênio em cada semirreação por meio da inserção de H2O no lado em que for mais conveniente (equações 50 e 51):
Prosseguimos com o balanceamento do hidrogênio por intermédio da inserção de íons H+ onde for necessário (equações 52 e 53):
Conforme descrevemos, devemos realizar o balanceamento de cargas por adição de elétrons de modo que ele seja igual ao número de cargas positivas excedente (equações 54 e 55):
Em seguida, igualaremos os números de elétrons nas duas semirreações. Isso é efetuado graças à multiplicação de toda uma semirreação pela quantidade de elétrons presente na outra semirreação. Dessa forma, uma será multiplicada por 5 e a outra, por 2, conforme expressam as equações 56 e 57.
Finalizaremos isso com a soma das duas semirreações e a obtenção da reação balanceada:
Atenção
As espécies que aparecem tanto do lado dos reagentes quanto do lado dos produtos serão cortadas, podendo até não aparecer na reação balanceada (o que acontece com os elétrons no exemplo mostrado).
Método de balanceamento em meio alcalino
Nos casos das reações que ocorrem em meio alcalino, não é possível utilizar o íon H+ para equilibrar os lados de uma semirreação. Tal impedimento se deve à baixa concentração desses íons em meio básico. Para esse balanceamento, deve-se usar o hidrogênio na forma em que ele se encontra no meio (o íon OH-) ou pelo uso da molécula de água.
Para compreendermos esse procedimento, abordaremos a reação entre CN- e CrO42- (que ocorre em meio alcalino), formando CNO- e Cr(OH)4-:
Primeiramente, separamos as semirreações:
Em seguida, efetuamos o balanceamento dos átomos de oxigênio utilizando moléculas de água:
Devemos então igualar o número de hidrogênios nos dois lados de cada semirreação (equações 64 e 65) utilizando o íon hidroxila (OH-).
Realizamos então o balanceamento das cargas:
Para o balanceamento dos elétrons, devemos multiplicar a semirreação pelo número de elétrons presente na outra semirreação, ou seja, conforme procedemos no método anterior. Neste caso, multiplicamos uma semirreação por 3 e a outra por 2:
Novamente finalizamos isso com a soma das semirreações e a visualização da reação global balanceada. Devemos, contudo, estar atentos: não podemos deixar de cortar as espécies que apareçam no lado dos reagentes em uma semirreação e no dos produtos da outra:
Cálculos com a determinação da constante de equilíbrio e a equação de Nernst
Vimos que, para a existência de uma célula eletroquímica, são necessários dois eletrodos. Para tornarmos mais fácil o entendimento do sistema global da célula, avaliaremos o processo redox que ocorre separadamente em cada eletrodo para, em seguida, avaliarmos a combinação dos dois sistemas de eletrodos.
É estabelecido que o processo avaliado é sempre o de redução. Por isso, estudaremos a espécie oxidada enquanto ela for reduzida por uma quantidade “n” de elétrons até a formação da espécie reduzida:
A energia livre da semirreação (equação 71) é expressa conforme a 72:
Os termos da equação 72 se referem a:
- ΔG° = trabalho máximo gerado em temperatura e pressão constantes;
- -ΔG = indicativo da propensão de a reação se deslocar no sentido dos produtos, indo da esquerda para a direita;
- R = constante dos gases (8,317J/mol.K)
- T = Temperatura (K)
- [Red]/[Ox] = concentrações efetivas do par na superfície do eletrodo.
É possível relacionar a energia livre ao potencial por meio da equação 73:
Definindo os termos da equação 73, temos:
- ΔG° = trabalho máximo gerado em temperatura e pressão constantes;
- -ΔG = indicativo da propensão de a reação se deslocar no sentido dos produtos, indo da esquerda para a direita;
- n = número de mols de elétrons transferidos;
- F = carga elétrica de um mol de elétrons;
- E0 = força eletromotriz ou potencial normal da pilha.
Quando a relação [Red]/[Ox] for igual a um, o logaritmo será zero e todo o segundo termo da fórmula deixará de existir, tornando a energia livre da semirreação igual a ΔG0, a qual, por sua vez, equivale ao potencial-padrão da semicélula para a reação. Além disso, ela ainda constitui uma forma de se medir a constante de equilíbrio da semirreação (K), supondo a atividade unitária dos elétrons:
Ao substituirmos os termos da 73 na 72, obteremos uma equação que relaciona o potencial da semicélula e a concentração efetiva do par redox, sendo ela a equação de Nernst (equação 47 ou 75):
Substituindo os valores das constantes (R = 8,317 J/mol.K; F = 96485 C.mol-1) e da temperatura (T = 298 K) citados anteriormente e convertendo o logaritmo na base 10, obteremos a equação 76:
Os termos expressos dentro de colchetes ([Red] e [Ox]) se referem às atividades das espécies (aMa+). Elas são calculadas graças à multiplicação da concentração da espécie (CMa+) e ao coeficiente médio de atividade (f±):
Conheceremos agora cinco casos de aplicação da equação de Nernst:
Caso 1: semicélula de zinco
Caso 2: semicélula de ferro (III)
Caso 3: semicélula de hidrogênio
Em que PH2 é a pressão parcial de hidrogênio em atm.
Caso 4: semicélula de cromo
Neste caso, o potencial depende diretamente do pH da solução, além das concentrações dos íons dicromato e cromo (III), conforme é esperado.
Caso 5: semicélula de prata
A atividade de compostos sólidos é estabelecida como sendo igual a 1. Devido a isso, neste caso, as atividades da prata metálica e do cloreto de prata, que também é sólido, não aparecem no cálculo para a determinação do potencial do eletrodo de prata, o qual, por sua vez, depende apenas da concentração de íons cloreto.
Apresentação da constante de equilíbrio para o equilíbrio de oxidação-redução
Sabemos que uma célula eletroquímica é constituída de duas semicélulas que dependem uma da outra para oxidar e reduzir, formando, assim, os produtos.
Como já falamos, obtém-se, graças à soma das semirreações, a reação global da célula, a qual, por sua vez, se trata de uma equação química balanceada:
No entanto, será mais simples estudar as semirreações separadamente, sendo ambas escritas no sentido da redução. Essa escolha por separar as semirreações possibilita:
- Cálculos com valores mais adequados
- Cálculo de potencial para cada semicélula
Em uma célula galvânica, há, portanto, o potencial calculado pela subtração do potencial mais negativo pelo da semicélula mais positivo:
A expressão do potencial da célula será encontrada ao empregarmos as equações 75 e 88 na equação 89, a qual, por sua vez, é representada na 90.
Assim, pela diferença dos potenciais-padrão das semicélulas, encontramos o valor da constante de equilíbrio da equação 88 conforme está representado na 91:
Ou seja:
Para exemplificarmos o uso da equação 91, calcularemos o potencial da semirreação do chumbo, tendo Pb+2 = 0,001 M:
Dados:
- E0 = - 0,126V
- n = 2
- aPb = 1 (metal puro)
Eis o cálculo:
E = - 0,126 – 0,0296 . (3)
E = - 0,215V
Agora calcularemos o potencial da célula Zn/Cu conforme a equação 93:
Dados:
- E0 = 1,10V
- n = 2
Cálculo:
E = 1,10 – 0,0296 . (1,30)
E = 1,06V
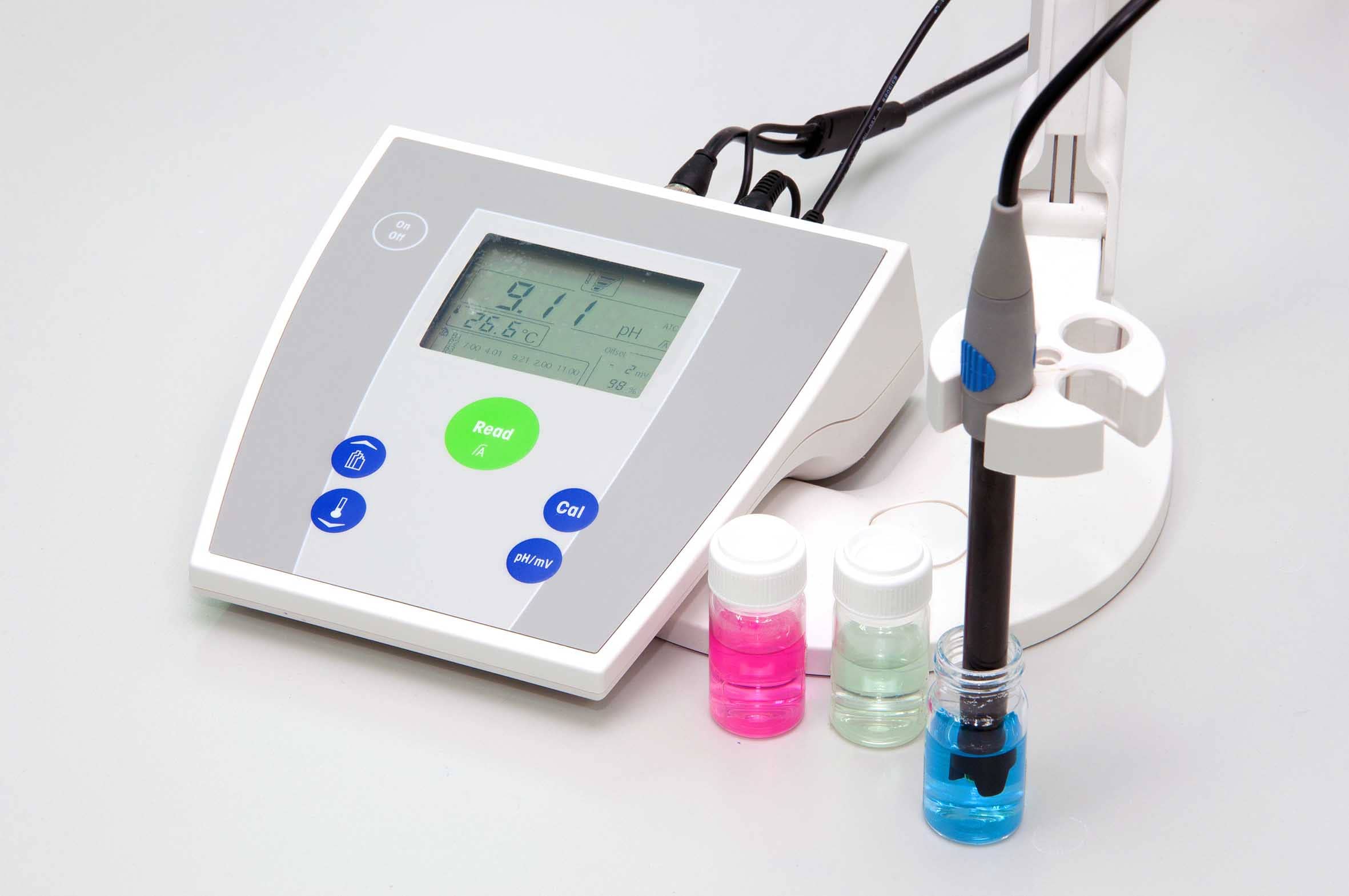
Um uso prático e de muita utilidade para a equação de Nernst, já que ele permite relacionar diretamente a concentração de uma espécie em solução, se dá pelo pHmetro (vide a figura abaixo).
O pHmetro é um medidor do potencial hidrogeniônico (o pH) formado resumidamente por um eletrodo e um potenciômetro. O aparelho funciona medindo a tensão (normalmente em milivolts) gerada pela imersão do eletrodo na amostra. O valor da tensão é convertido para a escala de pH, tendo em vista a necessidade de calibração do equipamento antes do uso.
Sua calibração usualmente é efetuada com o uso de duas soluções-padrão com valores 7 e 4, podendo ainda ser utilizada uma terceira na faixa alcalina. O emprego desse medidor é muito amplo.
Exemplo
Agricultura, tratamento e purificação de água, indústrias de papel, área petroquímica e farmacêutica, assim como no ramo alimentício.
As aplicações da equação de Nernst e do equilíbrio químico oxidação-redução
Veja a resolução de exercícios sobre o módulo, inclusive envolvendo balanceamento de reações, com o especialista Luiz Américo de Avellar Mota:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Aprendemos neste tema conceitos fundamentais e de nomenclatura relacionados à formação dos compostos de coordenação. Destacamos exemplos importantes dos complexos, além de demonstrarmos suas aplicações em diversas áreas da ciência e da tecnologia. Um deles foi um grupo de complexos de grande destaque: os quelatos.
Compreendemos também o desenvolvimento dos diversos cálculos que envolvem o equilíbrio de complexação, passando pela apresentação e aplicação das constantes de formação global e condicional. Abordamos em seguida os princípios básicos da eletroquímica, destacando a troca de elétrons entre as espécies e o que caracteriza uma reação de oxidação-redução. Definimos ainda quando um elemento ganha ou perde elétrons e o momento em que essa mudança tende a ocorrer.
Evidenciamos o significado de uma célula eletroquímica e mostramos sua constituição, além de determinarmos o potencial de uma célula e quando sua reação ocorre (seja ela de maneira espontânea ou não). Por fim, calculamos a constante de equilíbrio de uma reação de oxidação-redução a partir do potencial de redução das semirreações, assim como associamos de que forma as concentrações dos eletrólitos interferem nesse potencial.
Podcast
Para encerrar, o especialista Luiz Américo de Avellar Mota faz um resumo do principais pontos do tema.
CONQUISTAS
Você atingiu os seguintes objetivos:
Conheceu os fundamentos conceituais sobre os compostos de coordenação
Identificou as reações de formação dos complexos e os cálculos relacionados ao equilíbrio de complexação
Reconheceu os princípios da eletroquímica e a equação de Nernst
Compreendeu a constante de equilíbrio de oxidação-redução e os cálculos relativos à determinação da constante de equilíbrio e à equação de Nernst