Descrição
Apresentação dos mecanismos de ação sob a perspectiva química e farmacológica de importantes classes de fármacos.
PROPÓSITO
O conhecimento da relação estrutura-atividade dos fármacos se faz imensamente necessário para o profissional compreender de que forma cada estrutura química e os diferentes grupos funcionais presentes nos fármacos influenciam sua atividade farmacológica.
OBJETIVOS
Módulo 1
Descrever as propriedades químicas e farmacológicas do mecanismo de ação dos antibióticos beta-lactâmicos
Módulo 2
Descrever as propriedades químicas e farmacológicas do mecanismo de ação dos fármacos cardiovasculares
Módulo 3
Descrever as bases químicas e farmacológicas do mecanismo de ação dos anti-inflamatórios e anti-histamínicos
Módulo 4
Descrever as bases químicas e farmacológicas do mecanismo de ação das principais classes de fármacos neuroativos
Introdução
Para que a farmacologia relativa a cada fármaco seja compreendida, é de suma importância estudar as respectivas bases químicas, pois a estrutura do fármaco estará diretamente relacionada com sua farmacocinética e consequente farmacodinâmica. A compreensão da reatividade da molécula como um todo e de seus grupos funcionais frente ao organismo em que irão exercer sua atividade ajuda a entender de que forma o fármaco interage com o alvo, quais tipos de interação são importantes para a atividade e quais as regiões sujeitas a um possível processo de metabolização.
A relação entre a estrutura química de um fármaco e sua atividade farmacológica representa um dos principais objetos de estudo da farmacodinâmica e da química medicinal, compreendendo os efeitos que a estrutura e a composição química de um princípio ativo podem mediar durante sua interação com o receptor biológico, favorecendo, consequentemente, os principais fatores que governam essa interação.
Nesse contexto, os estudos de relação estrutura-atividade (REA) visam determinar que porções estruturais do fármaco (grupos farmacofóricos) estarão de fato relacionadas com sua atividade.
25mg/kg/dia
Em nosso material, unidades de medida e números são escritos juntos (ex.: 25km). No entanto, o Inmetro estabelece que deve existir um espaço entre o número e a unidade (ex.: 25 km). Logo, os relatórios técnicos e demais materiais escritos por você devem seguir o padrão internacional de separação dos números e das unidades.
MÓDULO 1
Descrever as propriedades químicas e farmacológicas do mecanismo de ação dos antibióticos beta-lactâmicos
Antibióticos β-lactâmicos
Em toda a história, diversos surtos de doenças foram responsáveis por altas taxas de mortalidade devido a seus níveis de gravidade, chegando a dizimar comunidades inteiras. Na antiguidade, esses surtos eram quase sempre associados a questões religiosas, que envolviam castigo divino à população. Graças a Pasteur e Robert Koch, o conhecimento sobre essas doenças mudou de paradigma, passando a considerar seres microscópicos — chamados de micróbios — como os responsáveis por tais mazelas. Apesar de esses conhecimentos serem datados do início do século XX, somente alguns anos após foram iniciadas pesquisas mais aprofundadas sobre substâncias antibacterianas — posteriormente chamadas de antibióticos — e a produção de medicamentos.

A descoberta de um dos primeiros antibióticos ocorreu ao acaso, por Alexander Fleming, em 1928. Ao realizar estudos com bactérias do gênero Staphylococcus, Fleming percebeu que algumas de suas amostras haviam sido contaminadas por algum tipo de fungo, posteriormente descoberto ser do gênero Penicillium. As amostras contaminadas apresentaram inibição do crescimento das colônias bacterianas, indicando a produção de algum possível produto natural de característica antibiótica, que, mais à frente, seria associado à penicilina. Tratava-se do primeiro antibiótico natural descoberto e que apresenta o núcleo de anel β-lactâmico, sendo o primeiro representante dessa importante classe de antibióticos.
Mecanismo de ação dos antibióticos β-lactâmicos
Analogamente aos demais fármacos que agem sobre o nosso organismo, os antibióticos também possuem mecanismos próprios de ação, variando de acordo com o tipo de mecanismo, o local de ação e a classe à qual pertencem. De forma resumida, os antibióticos podem ser divididos entre bacteriostáticos, que inibem o crescimento celular das bactérias, e bactericidas, que levam à morte desses microrganismos.
Os antibióticos β-lactâmicos trazem em comum, no seu núcleo estrutural, o anel β-lactâmico, que é considerado um grupamento farmacofórico importante para sua atividade bactericida.
As variações da cadeia lateral das estruturas dos antibióticos dessa classe serão responsáveis pelas variações do espectro de ação e de suas propriedades farmacológicas. Pertencem a esse grupo:
Penicilinas
Cefalosporinas
Carbapenêmicos
Monobactâmicos
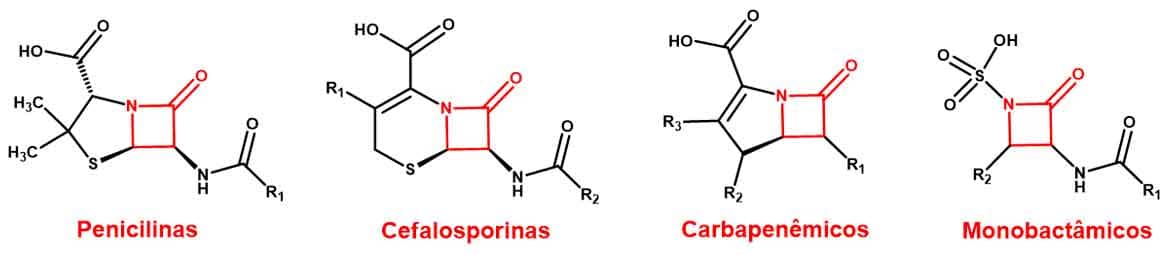
Apesar de todas as estruturas possuírem um anel β-lactâmico, a estrutura química de cada um é diferente e pode conter diversas cadeias laterais onde o anel β-lactâmico pode estar ou não fundido a outro anel presente na estrutura. Tais diferenças estruturais determinam as classes dessa família, diferenciando também suas características farmacológicas.
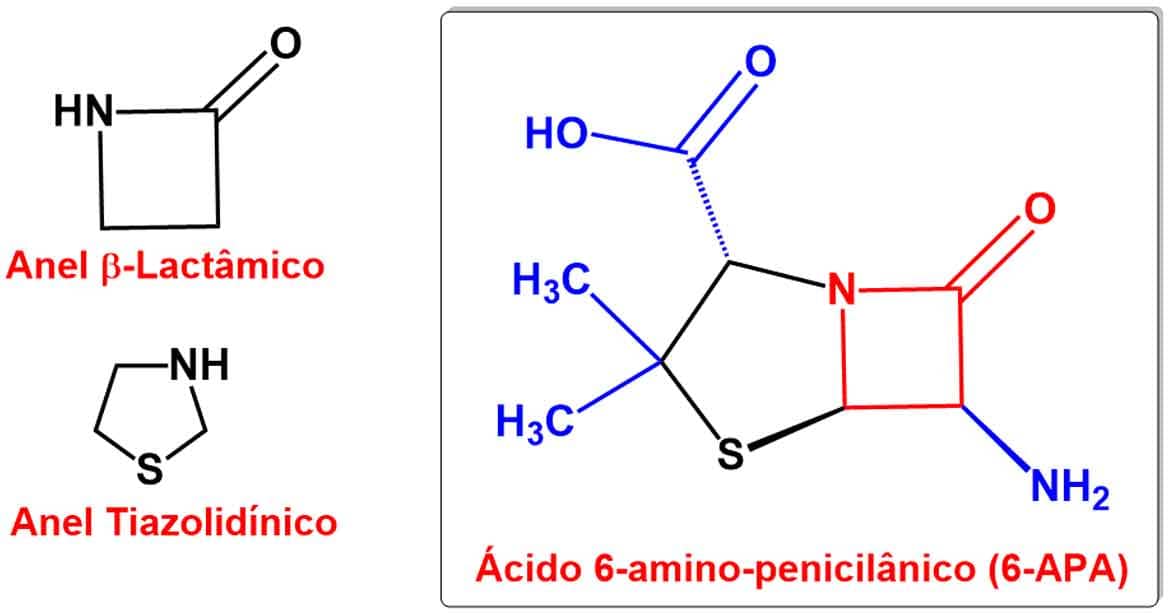
Nas penicilinas, o anel β-lactâmico se funde com o anel tiazolidina.
Nas cefalosporinas, o anel fundido é o dihidrotiazina.
Nos carbapenêmicos, é o anel pirrólico.
Os monobactâmicos não trazem outro anel em sua estrutura química, são monocíclicos e caracterizados por conter o grupo 2-oxoazetidina-1-sufônico.
Veja na imagem 2 as diferenças estruturais entre as classes de antibióticos β-lactâmicos.
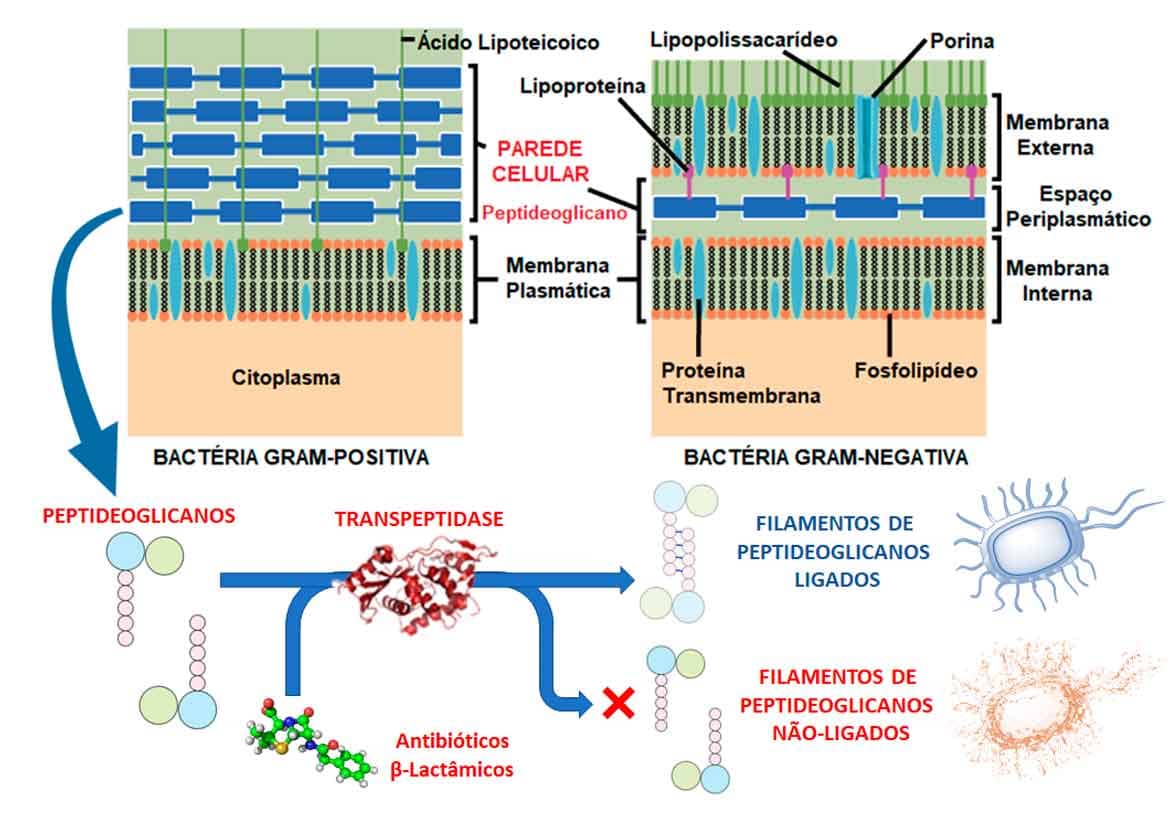
A ação bactericida dos β-lactâmicos ocorre devido à inibição da síntese da parede celular bacteriana. A parede celular das bactérias apresenta em sua estrutura diversas cadeias de peptideoglicanos — filamentos lineares de polissacarídeos (glicanos) que conferem resistência à bactéria contra o ambiente.
Em geral, os antibióticos inibidores da síntese da parede celular inibem a enzima intracelular do tipo transpeptidase — chamada de proteína ligadora de penicilina ou PLP, responsável pela união dos filamentos de glicanos — e, consequentemente, impedem a formação da parede celular, enfraquecendo a integridade da parede bacteriana e levando à sua morte.
Bactérias Gram-positivas apresentam maior teor de peptideoglicanos em sua parede celular, sendo em geral mais sensíveis aos antibióticos β-lactâmicos, entretanto, com o avanço e a descoberta de β-lactâmicos de novas gerações, estes também podem apresentar efeito bactericida sobre bactérias Gram-negativas (Imagem 3).
Para que os β-lactâmicos realizem sua ação, devem penetrar na bactéria através de porinas presentes na membrana externa da parede celular bacteriana, não devem ser destruídos pela ação das β-lactamases (penicilinases) produzidas pelas bactérias, e devem ligar-se às transpeptidases PLP, inibindo a etapa final de síntese da parede bacteriana.
Porinas
Proteínas transmembranares que permitem a passagem de pequenas moléculas, como açúcares, aminoácidos e íons.
Bases químicas e farmacológicas do mecanismo de ação dos antibióticos β-lactâmicos
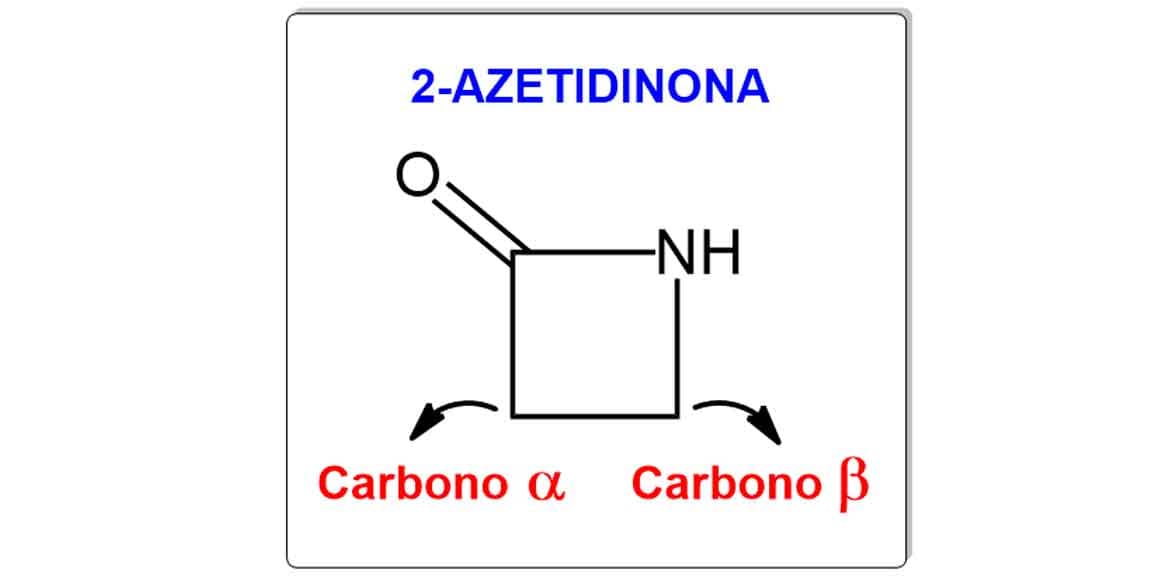
Os fármacos β-lactâmicos são classificados de acordo com sua estrutura química por conterem um anel β-lactâmico — também chamado de 2-azetidinona — formado pelo grupo funcional amida cíclica, que, por sua vez, contém um carbono α e um carbono β à carbonila (Imagem 4). As penicilinas e a cefalosporina representam os principais fármacos dessa classe de antibióticos, no entanto, para entender as bases químicas e farmacológicas do seu mecanismo de ação, o foco estará nas penicilinas.
Como característica química estrutural, as penicilinas apresentam, fundido ao anel β-lactâmico, um anel de cinco membros chamado de anel tiazolidínico, com duas metilas no carbono 5 e um ácido carboxílico exo (R) no carbono 4, e um grupo amina no carbono α do anel lactâmico, formando a estrutura básica das penicilinas (Imagem 5): o ácido 6-amino-penicilânico (6-APA).
Saiba mais
O ácido 6-amino-penicilâmico (6-APA) é essencial para a atividade antibiótica das penicilinas, porém a estrutura final das penicilinas apresenta algumas limitações, por exemplo, a microbiológica, a qual faz com que seu espectro de ação bactericida seja estreito, restrito a algumas bactérias apenas.
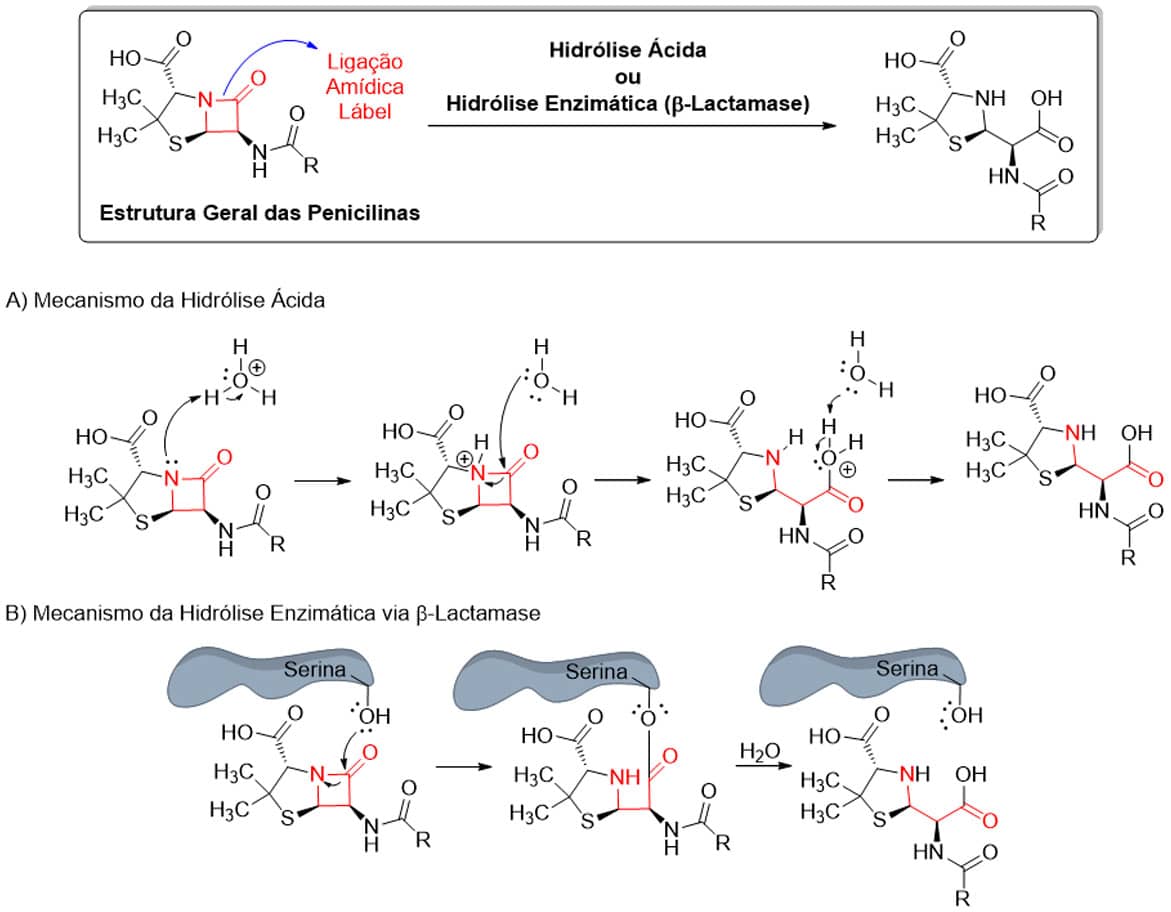
Outras limitações têm a ver com a susceptibilidade do anel β-lactâmico a reações de hidrólise (Imagem 6), quando se encontra em meio ácido (limitação química) ou promovida por enzimas produzidas por algumas bactérias, denominadas β-lactamases (limitação bioquímica). Em ambas as situações, o resultado da hidrólise é a abertura do anel β-lactâmico e a consequente perda da atividade antibiótica.
Veja como ocorre cada uma delas:
Abertura do anel por hidrólise ácida
A abertura do anel β-lactâmico por hidrólise direta ocorre pela protonação do nitrogênio do anel seguida do ataque de uma molécula de água à carbonila amídica, acarretando a quebra da ligação amídica (C-N) e a consequente abertura do anel (Imagem 6A).
Abertura do anel por hidrólise enzimática
A hidrólise enzimática é catalisada pela β-lactamase e ocorre pelo ataque da hidroxila da cadeia lateral do resíduo do aminoácido serina à carbonila amídica do anel β-lactâmico, formando um complexo bimolecular (substrato-enzima) com simultâneo rompimento do anel devido à quebra da ligação C-N.
Comentário
Como as penicilinas agem inibindo a formação da parede celular via bloqueio da ligação dos filamentos de peptideoglicanos e a parede celular de bactérias Gram-negativas tende a ser mais delgada, essas bactérias apresentam menor sensibilidade às penicilinas. Além disso, para alcançar as transpeptidades presentes no espaço periplasmático, a penicilina precisa permear a membrana externa de lipopolissacarídeo, o que dificulta ainda mais sua ação contra as bactérias Gram-negativas.
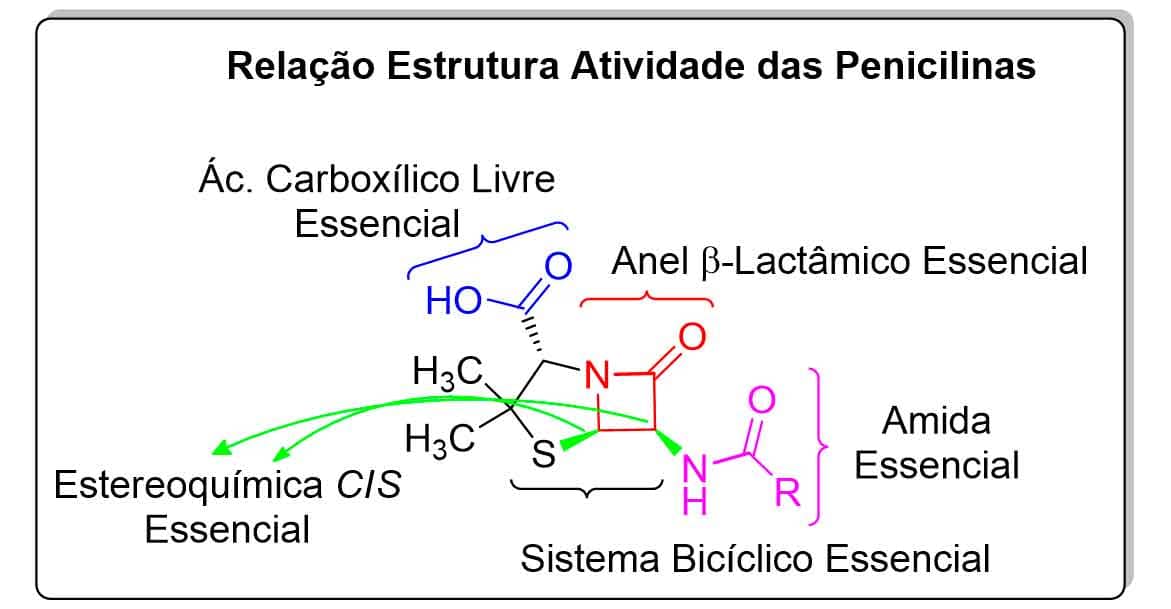
A presença das enzimas que degradam penicilinas, as β-lactamases, também constitui um grande obstáculo para seu uso na prática clínica. Visando driblar esse revés, diversos derivados penicilínicos foram desenvolvidos; após a inserção de modificações, foi possível então estabelecer uma relação entre a estrutura química e a atividade farmacológica (REA) das penicilinas, como os seguintes grupos farmacofóricos essenciais para sua atividade (Imagem 7):
Anel β-lactâmico.
Ácido carboxílico livre em exo.
Sistema bicíclico conferindo tensão ao anel β-lactâmico.
Amida da cadeia lateral.
Estereoquímica cis do anel bicíclico.
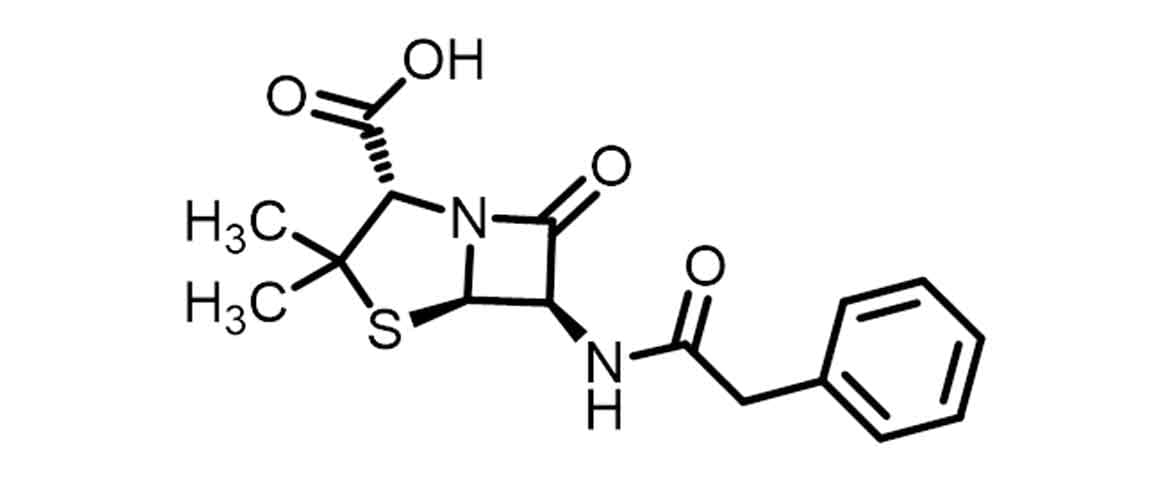
Na busca por minimizar as limitações relacionadas às penicilinas, diversos derivados penicilínicos foram planejados a partir do ácido 6-amino-penicilâmico. O 6-APA pode ser facilmente obtido a partir da biocatálise realizada entre a enzima penicilina G acilase produzida por Escherichia coli e Bacillus megaterium recombinantes. Essa enzima é responsável pela quebra da ligação amídica da cadeia lateral da penicilina G, formando o ácido fenilacético e o 6-APA, que poderá ser utilizado no planejamento de diversas outras penicilinas sintéticas.
Tomando a penicilina G (ou benzilpenicilina) como penicilina de primeira geração, pode-se verificar que sua estrutura (Imagem 8) é naturalmente favorável à degradação, devido a alguns motivos como a tensão do seu anel β-lactâmico, o que o torna sensível à hidrólise pelos ácidos gástricos, impedindo, por exemplo, sua administração por via oral. O sistema de anel bicíclico — constituído de um anel de quatro membros e outro de cinco membros — tem como resultado uma penicilina com grande ângulo de torção, favorecendo sua abertura por hidrólise ácida para tornar o sistema menos tensionado.
Diferentemente de amidas terciárias que são altamente resistentes a ataques nucleofílicos, a carbonila da amida do anel β-lactâmico é bastante reativa frente a nucleófilos, porque no anel β-lactâmico (devido à sua geometria estrutural e tensão angular) o par de elétrons do nitrogênio fica impossibilitado de estabilizar por ressonância o grupo carbonílico, o que não ocorre em aminas terciárias comuns (Imagem 9). A ausência dessa estabilização faz com que a carbonila tenha um caráter eletrofílico mais elevado.
Outro fator muito importante que favorece a hidrólise ácida do anel é o grupamento acil da cadeia lateral ao anel β-lactâmico, que pode auxiliar a abertura do anel por meio de interações intramoleculares (Imagem 10).

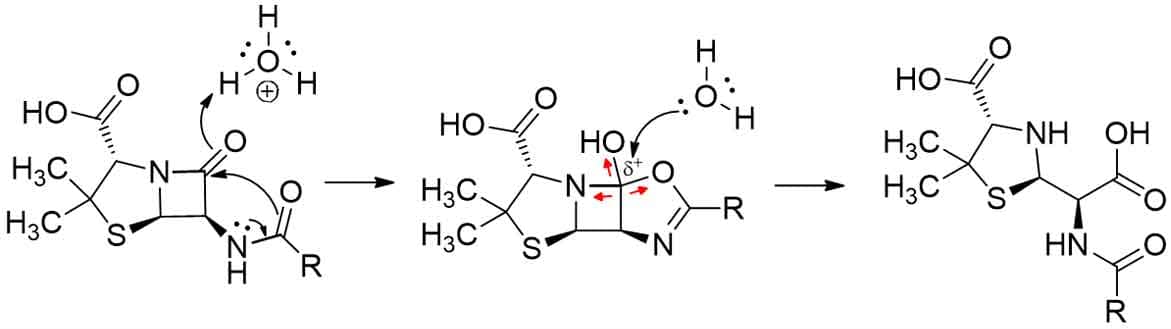
Em razão da essencialidade do sistema bicíclico para a atividade antibiótica das penicilinas, nada pode ser feito em relação à sensibilidade ácida do anel β-lactâmico. No entanto, modificações estruturais foram planejadas no intuito de dificultar a participação da cadeia lateral na hidrólise, como o aumento do efeito indutor retirador de elétrons sobre o oxigênio da carbonila, diminuindo sua nucleofilicidade e reduzindo sua tendência ao ataque à carbonila do anel.
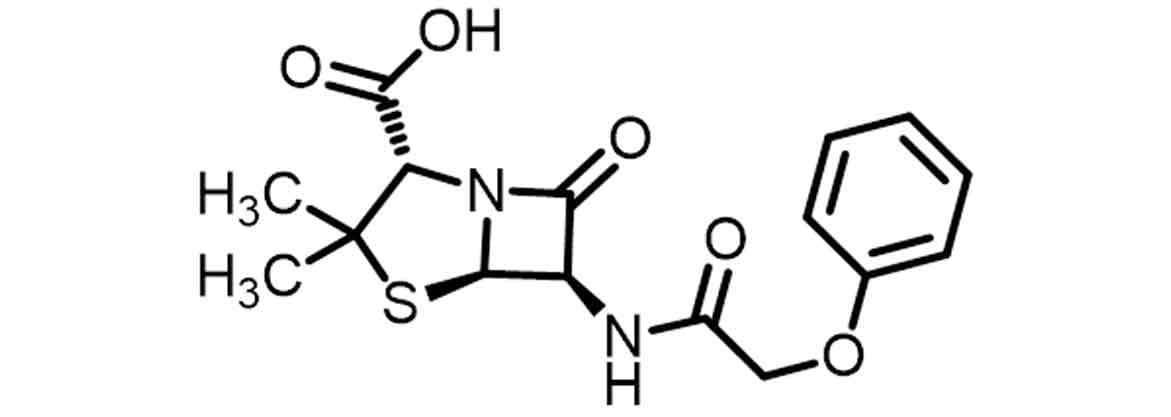
Dessa forma, surgiu a fenoximetilpenicilina — ou penicilina V (Imagem 11) —, a primeira penicilina ácido-resistente devido à modificação da cadeia lateral e que pode ser administrada por via oral. A modificação responsável pela resistência ao meio ácido se deu pela adição de grupo eletrofílico ligado à cadeia lateral aminada, diminuindo a densidade eletrônica da carbonila amídica e, consequentemente, aumentando a resistência do anel β-lactâmico ao meio ácido.
Visando impedir a ação das penicilinases sobre os antibióticos, grupos volumosos foram adicionados à cadeia lateral da penicilina, impossibilitando sua interação com o sítio ativo da β-lactamase.
Apesar dessa importante descoberta, esses substituintes não devem apresentar um volume exagerado, pois poderão resultar em um impedimento estérico também com a enzima alvo desses antibióticos — a proteína ligadora de penicilina ou PLP.
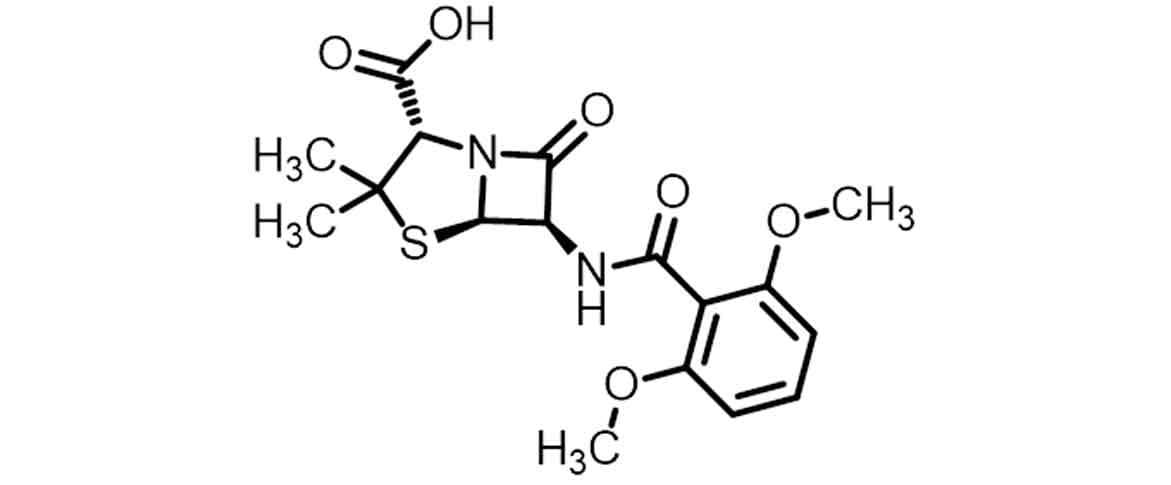
Surge assim a primeira penicilina de segunda geração e resistente à β-lactamases, a meticilina (Imagem 12), que apresenta um impedimento estérico gerado pela presença de dois grupos metóxi nas posições orto do anel aromático da cadeia lateral, impossibilitando a interação do sítio ativo da penicilinase sobre o anel lactâmico.
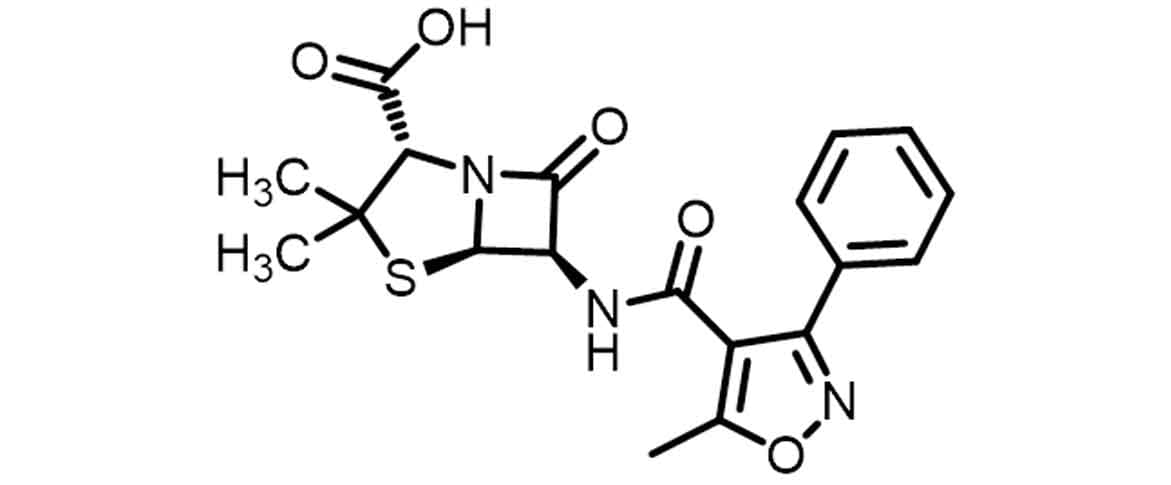
Outro antibiótico também de segunda geração, como a meticilina, é a oxacilina (Imagem 13), que, além de apresentar resistência à penicilinase devido ao impedimento estérico causado pelo anel oxazol com um anel aromático em C3, tem um grupamento metil em C5. Os substituintes da cadeia lateral não só geram proteção contra a abertura do anel pela lactamase como ainda conferem resistência à hidrólise ácida em consequência do efeito eletrolítico dos anéis aromáticos e seus átomos eletronegativos, sendo duplamente resistentes e podendo ser administrados por via oral (Imagem 14).
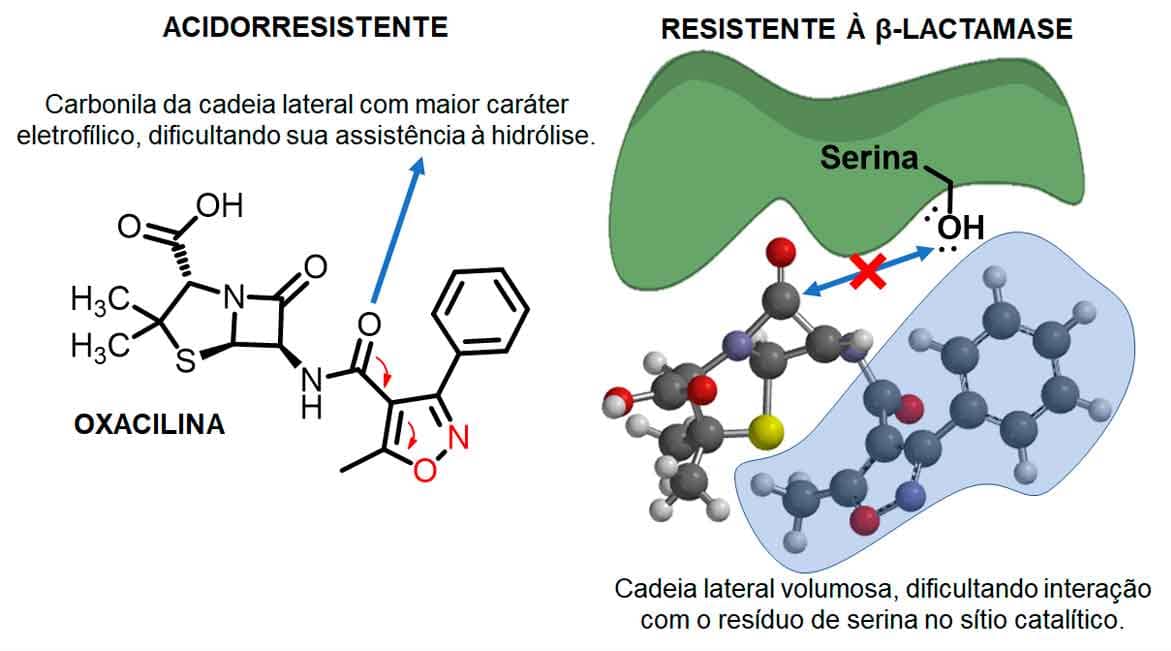
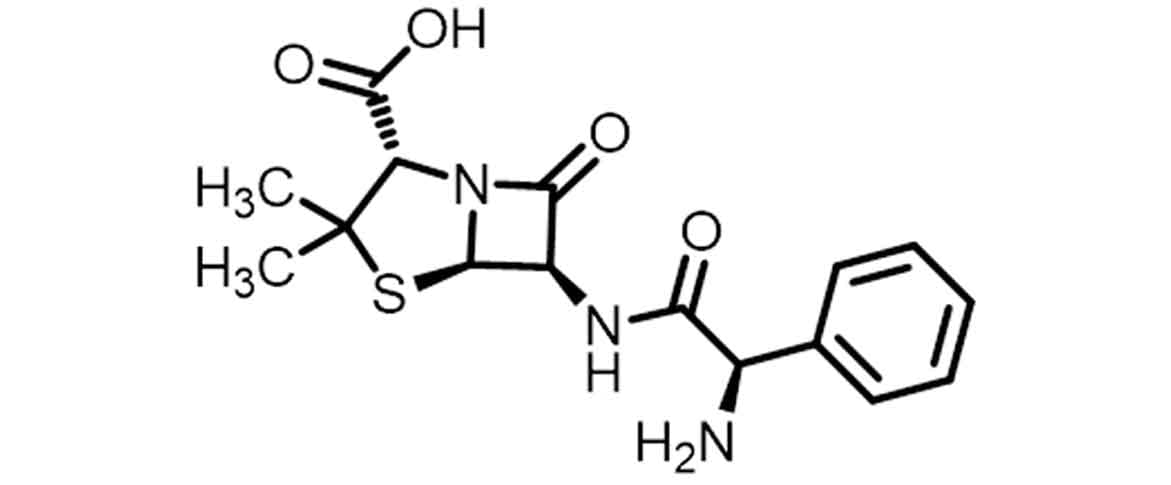
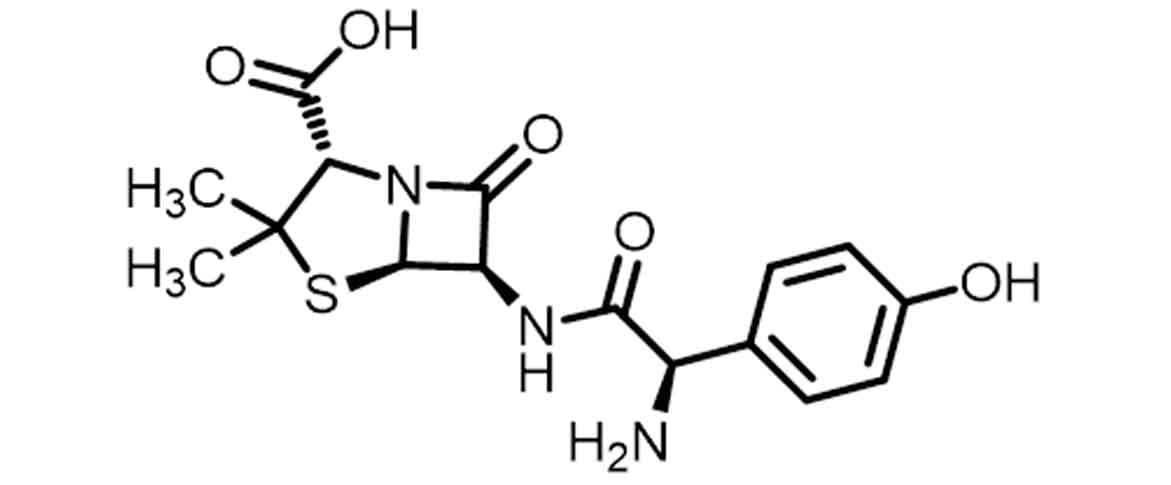
Posteriormente, percebeu-se que o grupamento aromático, graças ao efeito retirador de elétrons por ressonância, também poderia contribuir para a diminuição da densidade eletrônica da carbonila amídica da cadeia lateral, levando ao planejamento dos antibióticos β-lactâmicos de terceira geração, as aminopenicilinas acidorresistentes ampicilina (Imagem 15) e amoxicilina (Imagem 16).
Você sabia
Dentre as penicilinas mencionadas até o momento (primeira a terceira gerações), todas apresentam pouca atividade contra bactérias Gram-negativas, em geral justificada pela dificuldade dessas penicilinas em invadir as membranas das bactérias Gram-negativas. Visando resolver esse problema do espectro de ação reduzido, foram propostas diversas modificações moleculares; infelizmente, é impossível encontrar uma estratégia que resolva todos os problemas relacionados aos antibióticos β-lactâmicos. Assim foram produzidos vários análogos penicilínicos de quarta geração.
A principal modificação da cadeia lateral foi realizada pela adição de grupamentos hidrofílicos (NH2, OH, CO2H), que levam a um aumento da atividade contra bactérias Gram-negativas, principalmente quando anexados ao carbono alfa à carbonila da cadeia lateral. É preciso lembrar que as aminopenicilinas, a ampicilina e a amoxicilina, já apresentam em sua estrutura o grupamento amino alfa à carbonila da cadeia lateral e estes grupamentos já apresentam uma ampliação de seu espectro de ação para algumas bactérias Gram-negativas.
Exemplos de penicilinas semissintéticas de quarta geração e de espectro ampliado são as carboximetilpenicilina — como a ticarciclina (Imagem 17) — e as ureidopenicilinas — como a piperaciclina (Imagem 18) —, que apresentam seu espectro de ação ampliado para algumas bactérias Gram-negativas, como as Pseudomonas e as enterobactérias E. coli e Proteus.
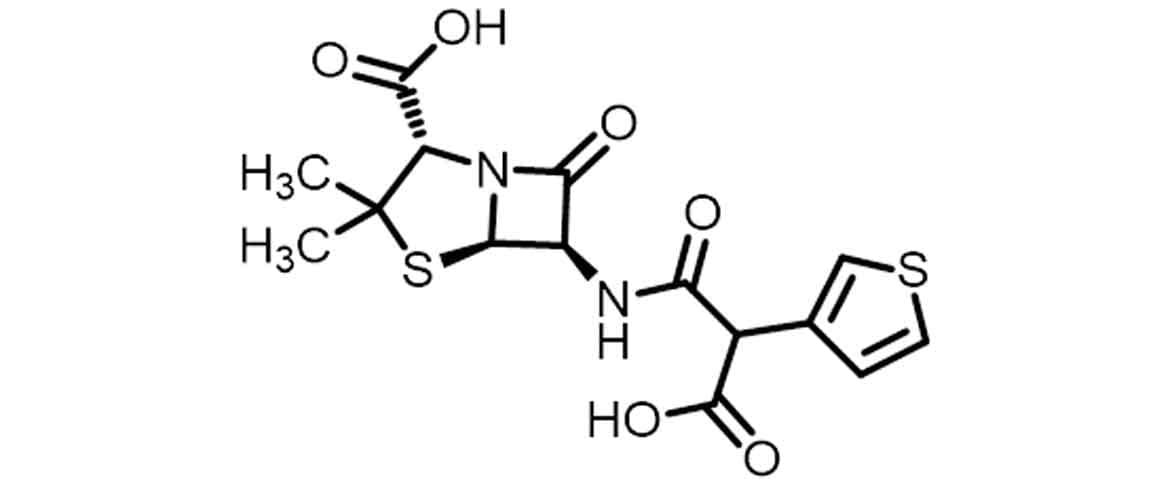
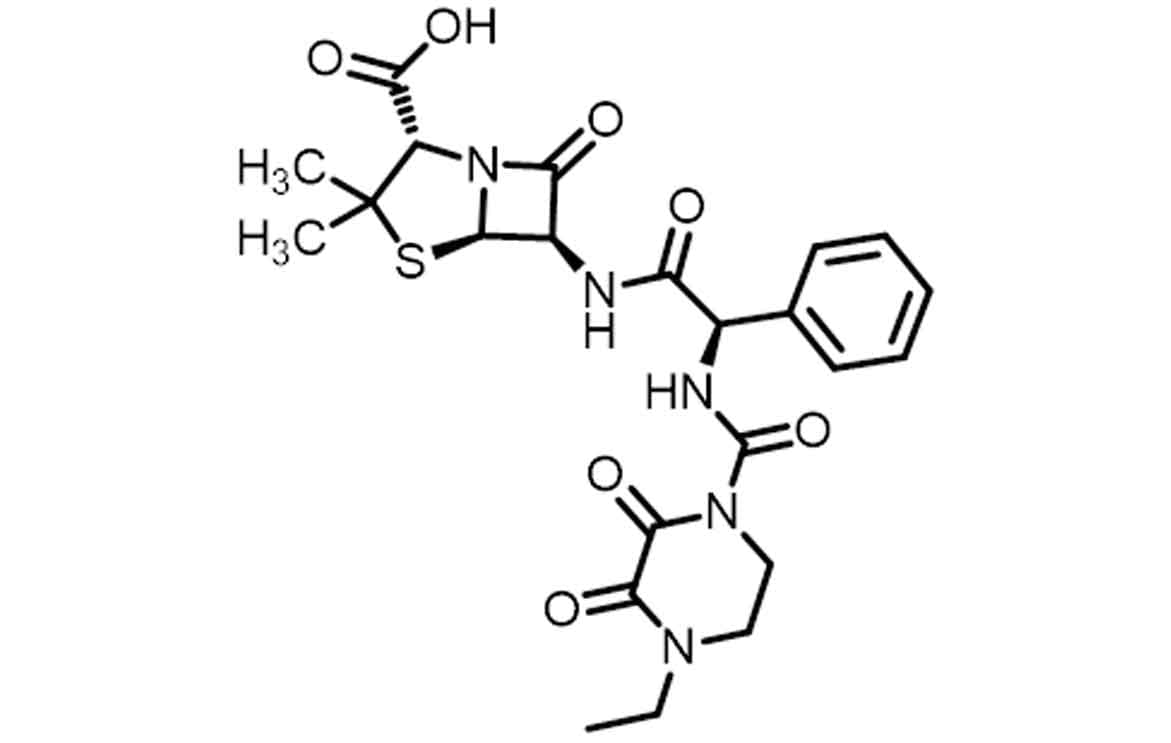
O espectro do antibiótico ticarciclina foi ampliado pela adição do grupamento hidrofílico com estereoquímica exo de ácido carboxílico no carbono alfa à carbonila da cadeia lateral. Já para o antibiótico piperaciclina, a hidrofilicidade pode ser aumentada pela adição do grupo 2,3-dioxopiperazina-1-ureia contendo múltiplos pontos polares que aumentam bastante a hidrofilicidade do fármaco, impactando o aumento do seu espectro de ação. Em ambos os casos, o aumento da hidrofilicidade auxilia na permeabilidade desses fármacos pela membrana externa das bactérias Gram-negativas, fazendo com que os antibióticos alcancem mais facilmente as transpeptidades (PLP) no espaço periplasmático.
A estratégia de defesa das bactérias frente à ação das penicilinas via produção das enzimas β-lactamases que hidrolisam o anel β-lactâmico, inibindo a ação bactericida, é bastante efetiva, considerando sua ação sobre grande parte das penicilinas.
Dessa forma, uma estratégia bastante útil e constantemente utilizada na terapêutica clínica para contornar essa desativação é a utilização da associação entre a penicilina e um inibidor de β-lactamase.
Exemplo
O ácido clavulânico, o sulbactam e o tazobactam são exemplos de inibidores de β-lactamases e possuem estruturas semelhante às dos antibióticos β-lactâmicos (Imagem 19). Assim, diferentes associações foram criadas, como a conhecida amoxicilina + clavulanato, a ampicilina + sulbactam e a piperaciclina + tazobactam.
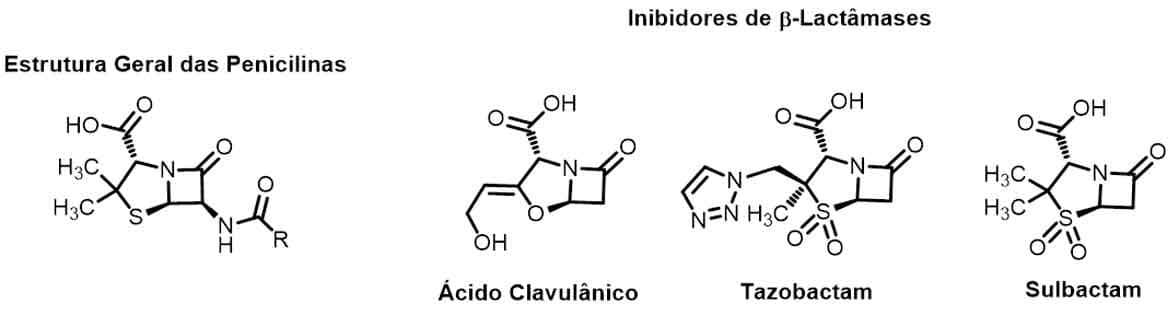
O ácido clavulânico é um derivado β-lactâmico natural, produzido pelo Streptomyces clavuligerus, que possui fraca atividade antibacteriana quando usado de forma isolada, mas consegue agir de forma sinérgica quando utilizado com outras penicilinas.
Seu mecanismo de ação ocorre por inibição irreversível das β-lactamases, inativando-as e tornando as bactérias produtoras dessas enzimas suscetíveis à ação das penicilinas.
Esses fármacos também são conhecidos como antibióticos suicidas, pois sua única função é a de se ligar às penicilinases, impedindo que estas venham a hidrolisar os anéis β-lactâmicos das penicilinas.
Antibióticos beta-lactâmicos: propriedades estruturais e o mecanismo de ação
O vídeo a seguir fala sobre a estrutura dos antibióticos beta-lactâmicos e sua relação com a atividade farmacológica desses fármacos. Também explora os fatores que interferem na sua atividade farmacológica:
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Descrever as propriedades químicas e farmacológicas do mecanismo de ação dos fármacos cardiovasculares
Doenças cardiovasculares

As doenças cardiovasculares são a causa de morte mais frequente no mundo ocidental e podem ser resultado de defeitos congênitos ou de doenças e hábitos adquiridos posteriormente. Como patologias cardiovasculares, podemos citar a insuficiência cardíaca, a hipertensão arterial sistêmica (HAS) e as arritmias. No tratamento da insuficiência cardíaca, são utilizados os fármacos chamados de glicosídeos cardiotônicos. Já para tratar a HAS, são utilizados os fármacos anti-hipertensivos, como os betabloqueadores e os inibidores da enzima conversora de angiotensina. Ainda, como terapia das arritmias, podem ser utilizados os bloqueadores de canais de cálcio.
Insuficiência cardíaca e glicosídeos cardiotônicos
A insuficiência cardíaca (IC) é uma síndrome clínica caracterizada por sintomas como fadiga e dispneia, podendo ser acompanhados por sinais clínicos como ruídos pulmonares e edemas periféricos. A IC pode ser causada por uma alteração cardíaca estrutural e/ou funcional, acarretando na diminuição do débito cardíaco.
Sua fisiopatologia é complexa e ainda pouco compreendida, estando associada a uma variedade de fenótipos em razão de:
- Vários mecanismos fisiopatológicos (disfunção diastólica e sistólica; disfunção vascular; miopatias; comprometimento pulmonar etc.).
- Comorbidades (hipertensão; diabetes; obesidade etc.).
- Características clínicas dominantes.
Esses aspectos tornam desafiadores tanto o diagnóstico quanto o tratamento.
Infelizmente, ainda não existe um tratamento efetivo para IC e as recomendações atuais estão baseadas no alívio dos sintomas e na diminuição da progressão da doença. A terapia tende a utilizar fármacos que diminuam a formação de edemas com diuréticos, a resistência vascular periférica com o uso de vasodilatadores e o aumento da força de contração do músculo cardíaco com o uso de glicosídeos cardiotônicos, melhorando o bombeamento de sangue. Como os cardiotônicos digoxina e digitoxina são os principais fármacos utilizados na IC, eles serão o foco das informações sobre a relação estrutura-atividade. Os demais fármacos que também são utilizados no tratamento da IC, como os β-bloqueadores e inibidores da enzima conversora de angiotensina, serão discutidos mais à frente.
Bases químicas e farmacológicas do mecanismo de ação dos glicosídeos cardiotônicos
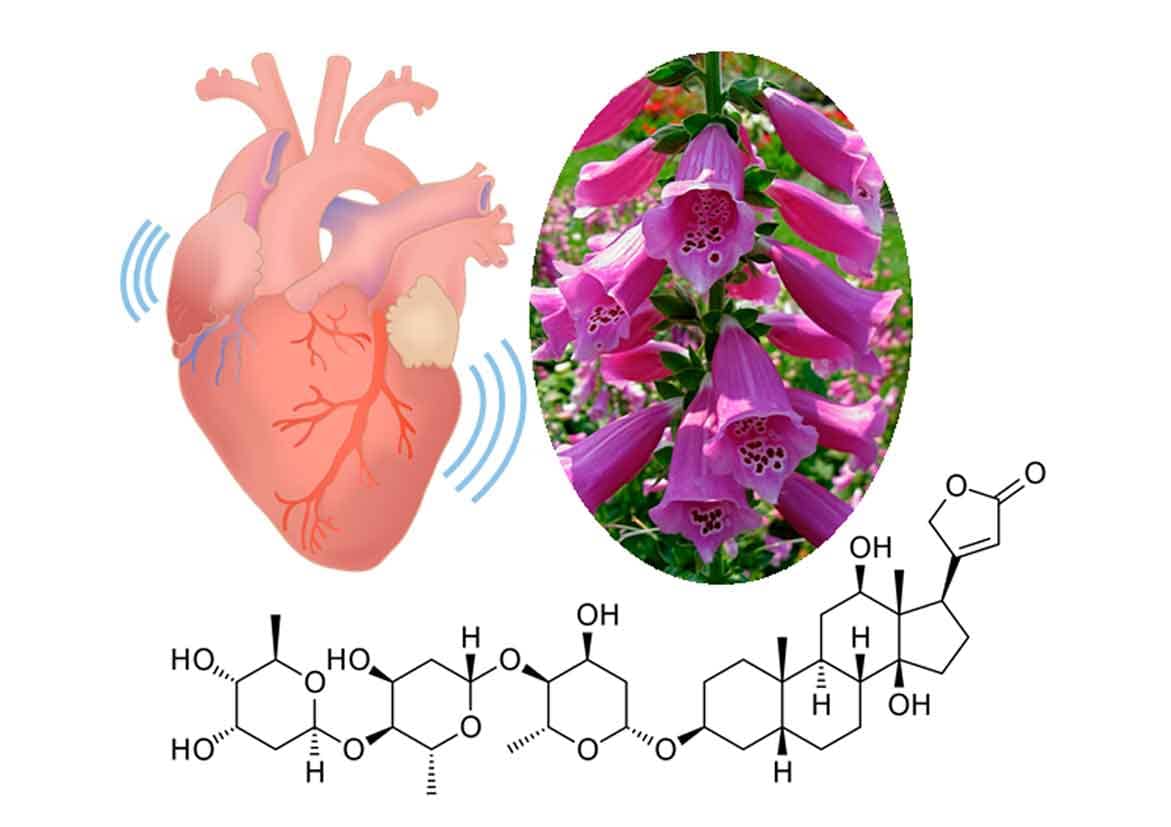
O uso de digitálicos em pacientes cardiopatas foi descrito por William Withering (1785), que obteve sucesso no tratamento deles utilizando a planta medicinal Digitalis purpurea (Imagem 22). Posteriormente a melhora desses pacientes foi justificada pela presença de glicosídeos cardiotônicos produzidos por plantas da espécie Digitalis, como a digoxina e a digitoxina. Esses fármacos são usados no tratamento da IC avançada, na fase em que já há remodelamento cardíaco, crescimento do coração e diminuição da força de contração.
William Withering
Botânico, geologista, químico e médico inglês que observou o potencial farmacológico da planta Digitalis purpurea.

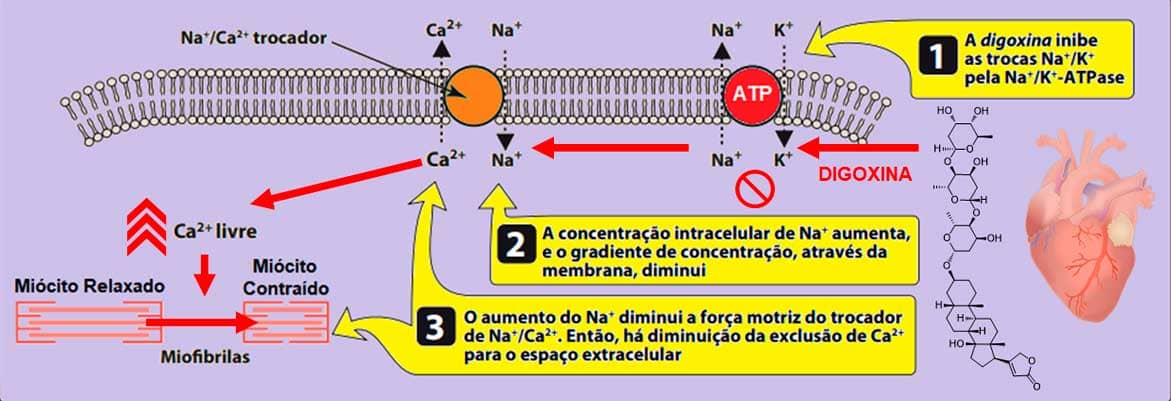
O mecanismo de ação primário dos digitálicos ocorre pela inibição reversível da enzima sódio-potássio-ATPase (Na-K-ATPase) nas células do músculo cardíaco, com a função de remover o sódio intracelular, permitindo a entrada de potássio na célula. A inibição da Na-K-ATPase eleva os níveis de sódio intracelular, evitando que o cálcio seja retirado do miócito, aumentando sua concentração dentro da célula e melhorando a contração dos miócitos (Imagem 23).
Os glicosídeos, também chamados de heterosídeos, são metabólitos secundários produzidos por plantas; apresentam em sua estrutura básica uma porção contendo um ou mais açúcares (glicona) e uma porção não glicídica, chamada de genina (aglicona). Os glicosídeos cardiotônicos citados apresentam, como sua estrutura básica de glicona, três unidades do açúcar digitoxose. A porção genina, por sua vez, é composta pelo núcleo cardenólido de 23 carbonos, contendo o esqueleto esteroidal tetracíclico ciclopentano-per-hidrofenantreno e o anel γ-lactônico (Imagem 24). É preciso salientar que o anel γ-lactônico é instável em meio básico, podendo ser hidrolisado, o que leva à abertura do anel e impacta sua atividade.
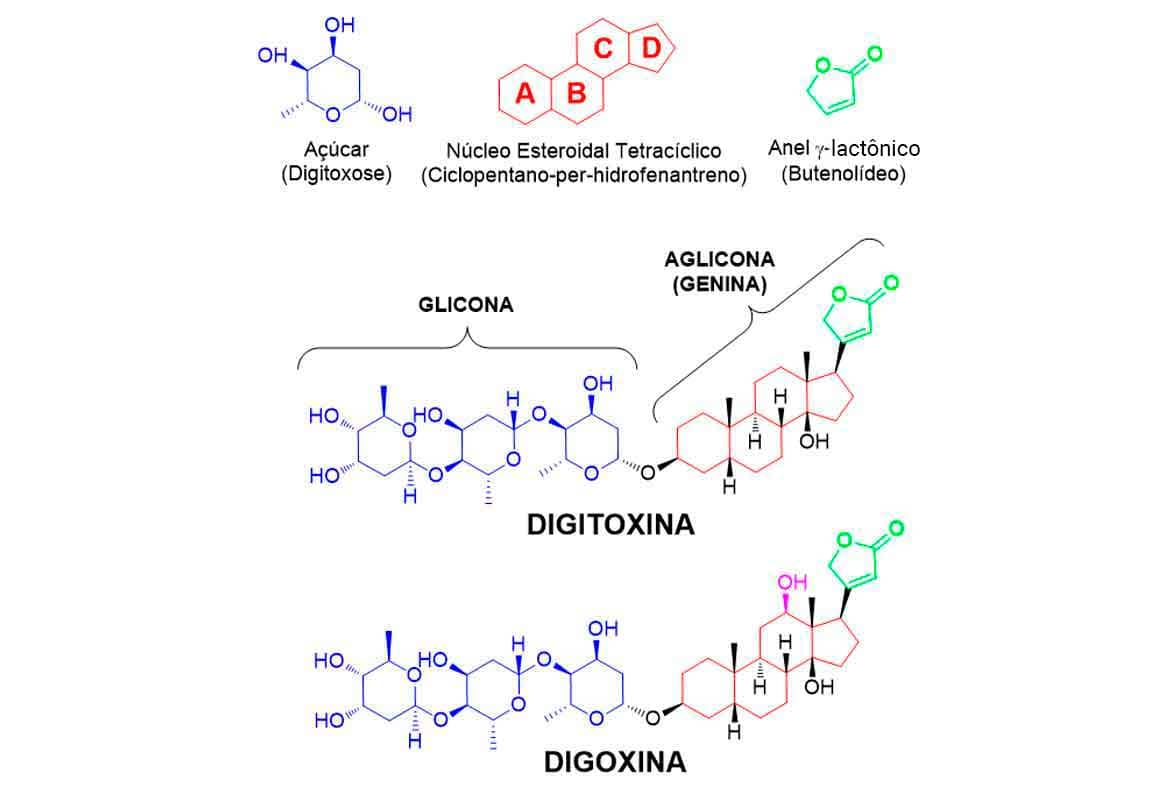
A digoxina e a digitoxina, apesar de suas estruturas bastante semelhantes, apresentam várias propriedades farmacológicas diferentes (diferença para uma hidroxila em C12). A digitoxina é absorvida mais prontamente e tem menor volume de distribuição, maior meia-vida e maior ligação de proteínas do que a digoxina. Além disso, a digitoxina é eliminada por via hepática, enquanto a digoxina é removida pelos rins. Apesar de ser menos prontamente absorvida que a digitoxina, a digoxina é o heterosídeo cardiotônico mais utilizado na clínica, por isso iremos focar sua relação estrutura-atividade.
Cada porção da digoxina tem uma função específica que contribui para a atividade global da molécula (Imagem 25).
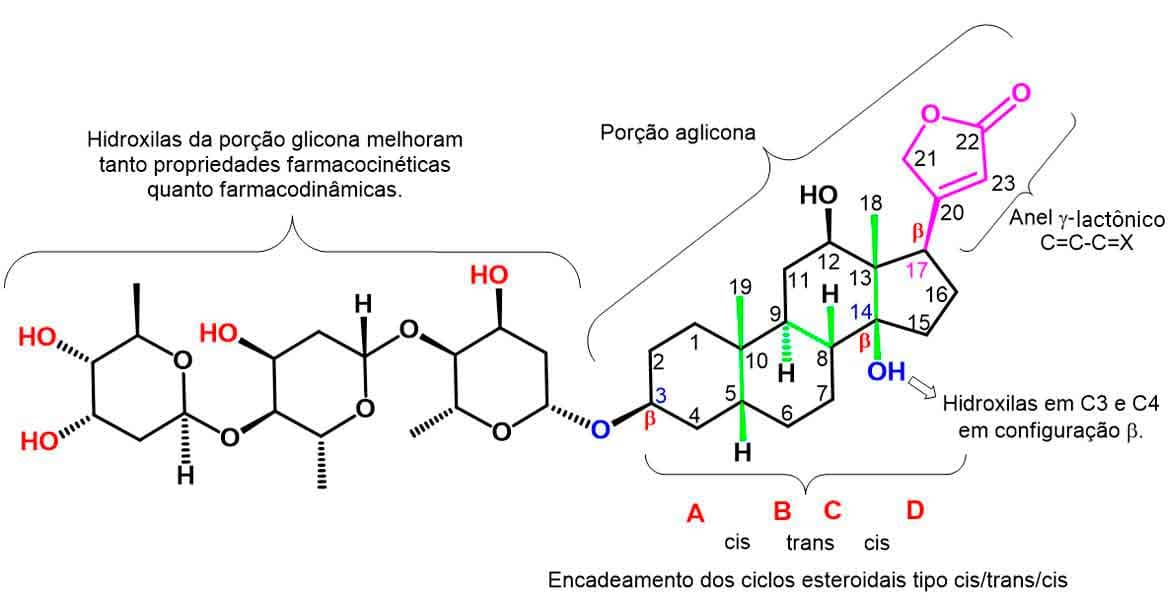
A porção glicona não atua diretamente na atividade farmacológica e sim modulando-a, pois essa ação implica fatores farmacocinéticos, como aumento da solubilidade do fármaco e da afinidade da ligação no sítio da enzima. Assim, sua atividade cardioativa ocorre devido à sua porção genina, chamada de digoxigenina.
A porção aglicona ou não glicídica, da molécula precisa ter grupos farmacofóricos específicos para apresentar atividade, como o anel lactona em C17β; a configuração cis/trans/cis dos ciclos do núcleo esteroidal e os substituintes de hidroxila em C3β e C14β.
O anel γ-lactônico é necessário para um encadeamento de átomos do tipo C=C–C=X, em que X deve ser um heteroátomo, e a substituição do carbono-17 deve ser orientada em β. Isso foi observado a partir da atividade de derivados apresentando orientação α que tiveram menor atividade em razão da maior facilidade de abertura do anel γ-lactônico para essa orientação.
Quanto ao anel esteroidal, a atividade máxima é observada quando seu encadeamento dos ciclos A/B/C/D ocorre na forma cis/trans/cis, e sua atividade é fortemente diminuída quando o ciclo A/B é trans. Foi observada também a obrigatoriedade da estereoquímica cis entre os ciclos C e D para sua atividade. Por fim, os substituintes do carbono 3 e 14, se em configuração α, apresentam perda de atividade, sendo necessária sua configuração em β.
Hipertensão arterial sistêmica e seu tratamento
A hipertensão pode ser definida como pressão arterial sistólica contínua maior que 140mmHg e/ou como pressão sanguínea diastólica contínua maior que 90mmHg e pode estar associada ao aumento do tônus do músculo liso arteriolar vascular periférico, que implica diretamente o aumento da resistência arteriolar. Muitas vezes, essa doença é silenciosa; porém, quando em um quadro crônico, pode levar a outros problemas, como o acidente vascular encefálico (AVE) e a insuficiência renal.

A queda da pressão arterial leva à ativação de fatores que culminarão no aumento da pressão arterial, visando normalizá-la. Quando estimulados, esses fatores levarão a alterações no sistema nervoso simpático via ativação de adrenoreceptores β1 no coração, que aumentam o débito cardíaco; via ativação de adrenoreceptores α1 nos vasos sanguíneos, aumentando o retorno venoso; ou junto à ativação de adrenoreceptores β1 nos rins, que ativa o sistema renina-angiotensina-aldosterona, aumentando a resistência vascular periférica e a retenção de sódio e água, com consequente aumento do volume sanguíneo e do débito cardíaco (Imagem 27).
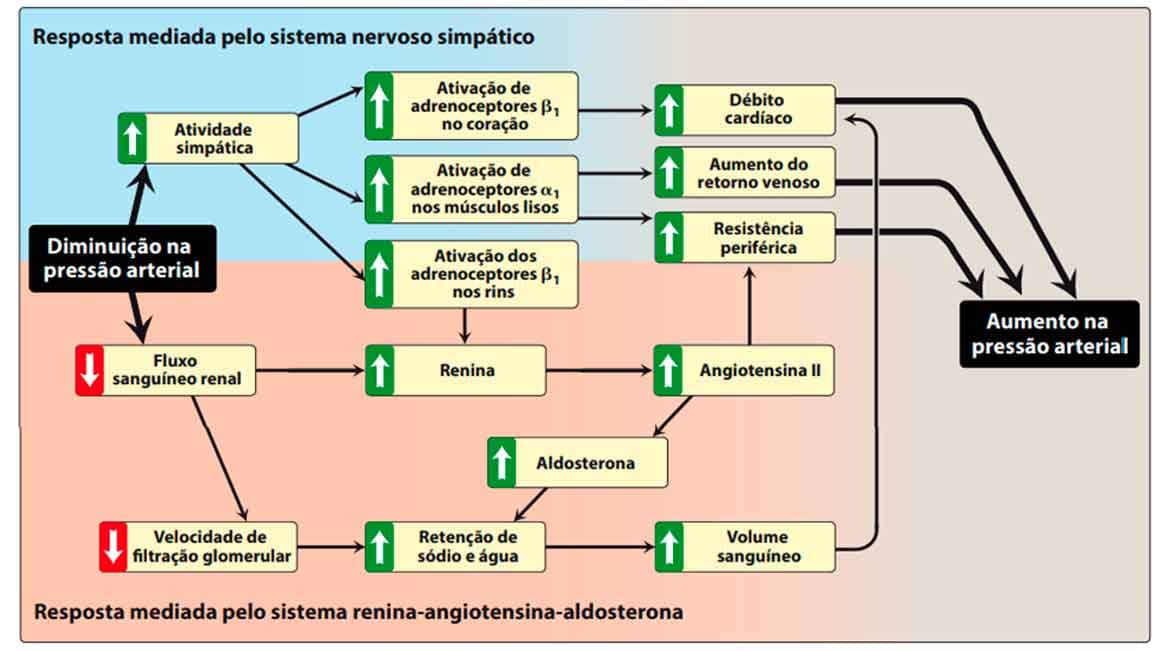
Conhecendo os processos fisiológicos relacionados ao aumento da pressão arterial, é possível compreender as possibilidades terapêuticas baseadas nos adrenoreceptores β1 do coração, nas enzimas conversoras de angiotensina no nível renal, e nos canais de cálcio encontrados na musculatura lisa dos vasos. Apesar de os fármacos diuréticos também serem utilizados no tratamento da hipertensão, este módulo focará as três classes de anti-hipertensivos citadas anteriormente.
β-bloqueadores
Os anti-hipertensivos da classe dos β-bloqueadores apresentam um mecanismo de ação complexo, uma vez que envolvem a diminuição do débito cardíaco, a redução da secreção de renina e a diminuição das catecolaminas nas sinapses nervosas. Basicamente, esses fármacos bloqueiam os receptores β-adrenérgicos, como o receptor β1, localizado principalmente no coração. Os receptores β2, devido à similaridade estrutural, podem também ser antagonizados e, por serem encontrados em outros órgãos, como o pulmão, implicam o aparecimento de efeitos colaterais.
Ao bloquear esses receptores, a resposta simpática via agonista (noradrenalina ou adrenalina) fica impedida, bloqueando os efeitos chamados de inotrópicos positivos (aumento da força de contração cardíaca). Como exemplos de anti-hipertensivos dessa classe temos o atenolol, o propranolol, o metoprolol, entre outros.
Bases químicas e farmacológicas do mecanismo de ação dos β-bloqueadores
Os receptores β-adrenérgicos são receptores transmembranares acoplados à proteína G, ativados por seus agonistas diretos. Com a descoberta do análogo isopropilamina da adrenalina (Isoproterenol), modificações sobre o anel catecol foram propostas, o que culminou no desenvolvimento do agonista parcial dicloroisoprenalina, em que as duas hidroxilas do anel catecol foram substituídas pelo halogênio cloro (Imagem 28). Dessa forma, foi observado que modificações no anel catecol poderiam diminuir a ação adrenérgica sobre o receptor, surgindo assim o primeiro β-bloqueador pronetalol, infelizmente nunca utilizado clinicamente devido à carcinogenicidade de seu metabólito.
Saiba mais
Estudos posteriores identificaram a necessidade de um grupamento espaçador entre o sistema aromático e o grupo etanolamina para melhora da atividade β-bloqueadora e para evitar a formação do metabólito carcinogênico. Surgiu, assim, o conhecido propranolol (Imagem 29), que apresenta como grupo espaçador a função metil éter e é de 10 a 20 vezes mais ativo que o pronetalol. Outro fator importante observado foi a atividade bloqueadora relacionada apenas ao seu enantiômero S (hidroxila endo), sendo o isômero R inativo.
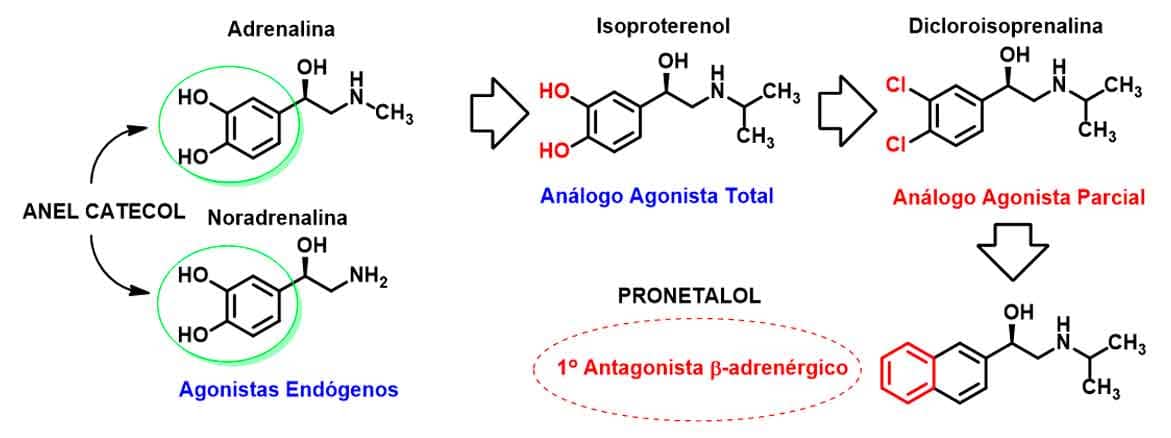
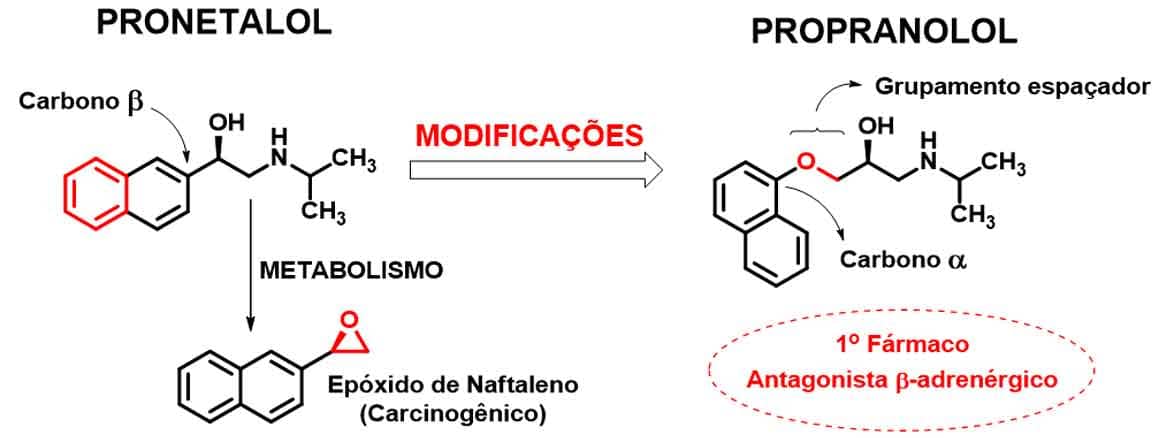
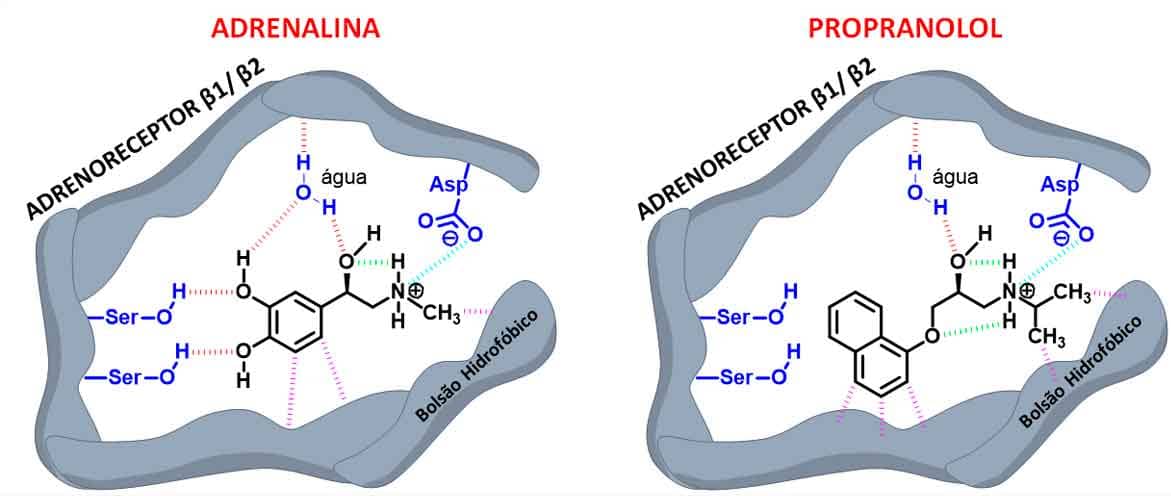
A partir do propranolol, foi possível compreender melhor a relação estrutura-atividade dos β-bloqueadores (Imagem 30). A estrutura dos β-bloqueadores adrenérgicos baseia-se principalmente na interrupção das interações relacionadas à atividade adrenérgica que ocorrem entre as hidroxilas do anel catecol e os resíduos de serina do receptor, pela adição de grupos aromáticos volumosos com interações hidrofóbicas.
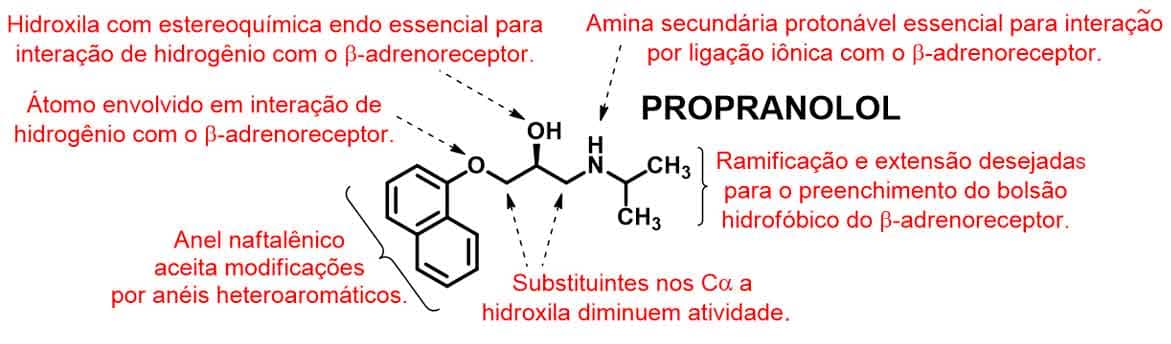
A estereoquímica da hidroxila deve ser mantida em endo para que haja interação de hidrogênio com outro resíduo de serina, o que não ocorre quando o OH está em exo.
A interação com a função ácido carboxílico do aspartato do receptor é importante na manutenção da interação molécula-receptor via ligação iônica desse grupamento com a função amina secundária do fármaco, que deve estar protonada.
Por fim, as porções alquílicas da amina realizam interação do tipo hidrofóbica com um bolsão hidrofóbico do receptor beta, sendo maior no receptor β2. Dessa forma, grupos volumosos que permitam interação hidrofóbica nessa região aumentam a seletividade do fármaco para o adrenoreceptor-β1 (Imagem 31).

Teoria na prática
É preciso lembrar que o propranolol não apresenta seletividade para o receptor β1, podendo antagonizar o receptor β2 encontrado, por exemplo, no tecido pulmonar, levando a efeitos adversos e sendo contraindicado para pacientes com doenças pulmonares.
Como solucionar essa situação?
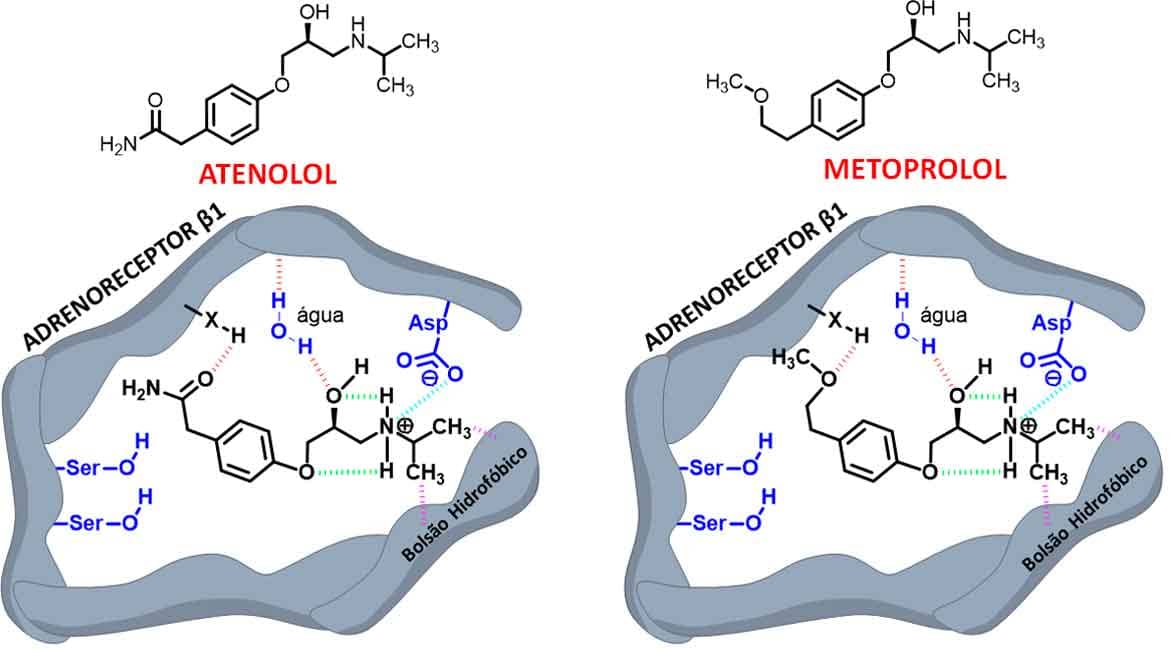
Diante desse problema, estudos conseguiram identificar a possibilidade de outra ligação de hidrogênio, que ocorreria somente para o receptor β1, por meio de substituintes no anel aromático na posição para, passíveis de realizar ligação de hidrogênio, aumentando a seletividade para o adrenoreceptor cardíaco.
Assim surgiram os bloqueadores cardiosseletivos atenolol e metoprolol (Imagem 32).
Inibidores da enzima conversora de angiotensina (IECA)
Os inibidores da enzima conversora da angiotensina, quando utilizados em monoterapia, dependem da inibição da enzima que converte a angiotensina I em angiotensina II no sangue e nos tecidos. Exemplos de fármacos dessa classe de anti-hipertensivos são os conhecidos captopril e enalapril, entre outros.
Os IECA agem sobre a diminuição da pressão arterial, reduzindo a resistência vascular periférica sem gerar reflexo de aumento no débito cardíaco, na frequência e na contratilidade cardíaca.
Esses fármacos inibem a enzima conversora de angiotensina (ECA), que hidrolisa a angiotensina I ao vasoconstritor angiotensina II. Além disso, as IECA agem sobre os vasos sanguíneos, pois inibem também a atividade da ECA sobre a degradação da bradicinina, um peptídeo que aumenta a produção de oxido nítrico e prostaciclinas, substâncias vasodilatadoras. Desse modo, a pressão arterial diminui devido aos níveis de angiotensina II reduzidos e de bradicinina aumentados, levando à vasodilatação de arteríolas e veias, resultado da menor vasoconstrição causada pela angiotensina II e da maior vasodilatação causada pelo aumento da bradicinina (Imagem 33).
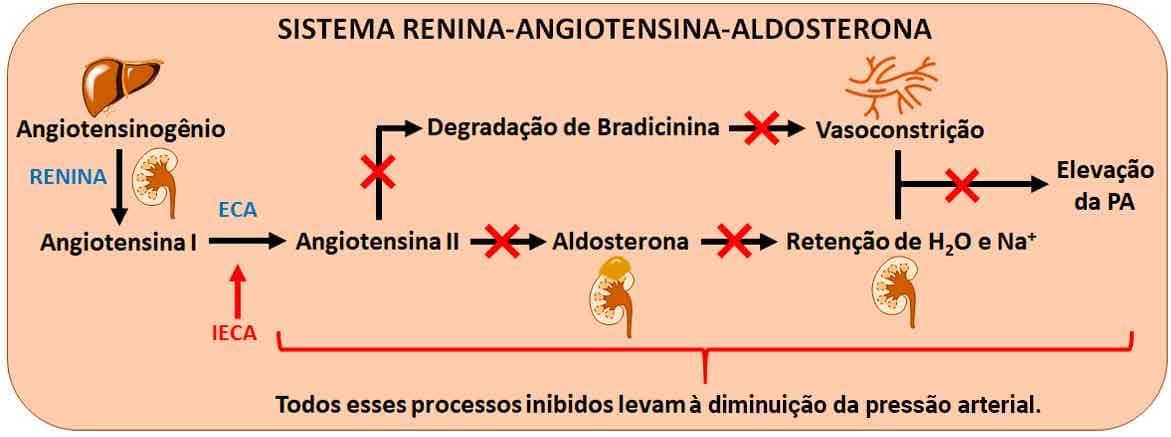
Bases químicas e farmacológicas do mecanismo de ação dos IECA
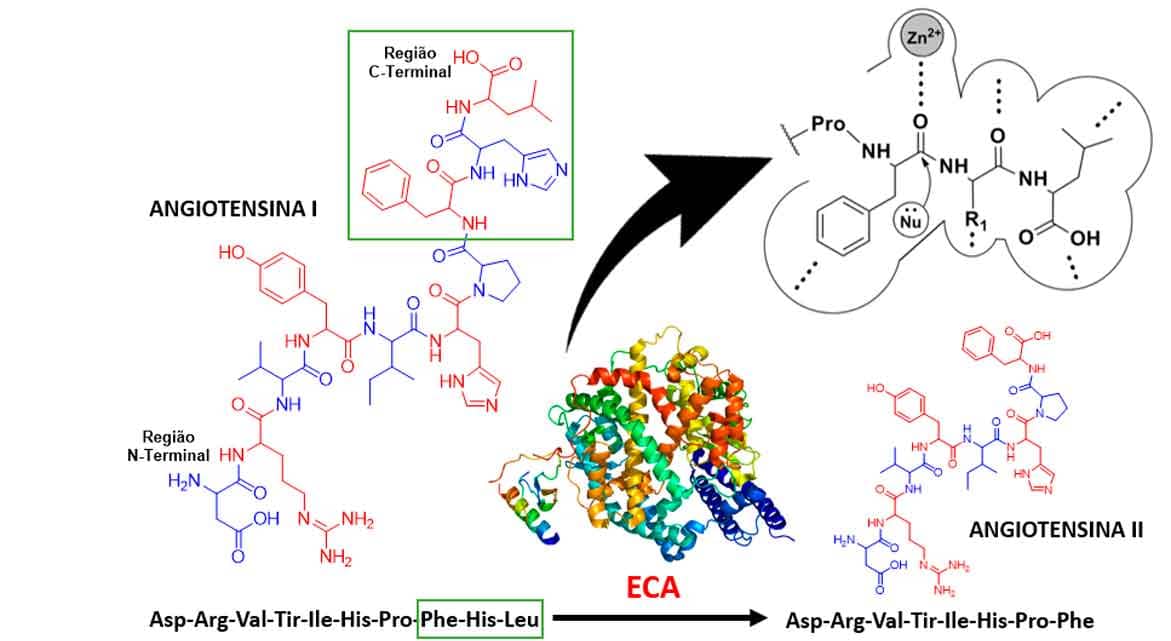
A atividade catalítica da ECA é dependente de Zn2+ e as bases químicas necessárias ao reconhecimento molecular de seu substrato estão associadas a uma sequência de três peptídeos presentes na estrutura da angiotensina I, que realiza coordenação com o íon de Zn2+ e sofre um ataque nucleofílico, resultando na clivagem da angiotensina I e na formação da angiotensina II.
A Imagem 34 ilustra as interações de complexação com zinco, as ligações de hidrogênio e as interações hidrofóbicas que ocorrem entre a angiotensina I e a ECA. Entendendo as interações do substrato endógeno da ECA, foram propostos os inibidores competitivos captopril e seus análogos, como o enalapril e ramipril.
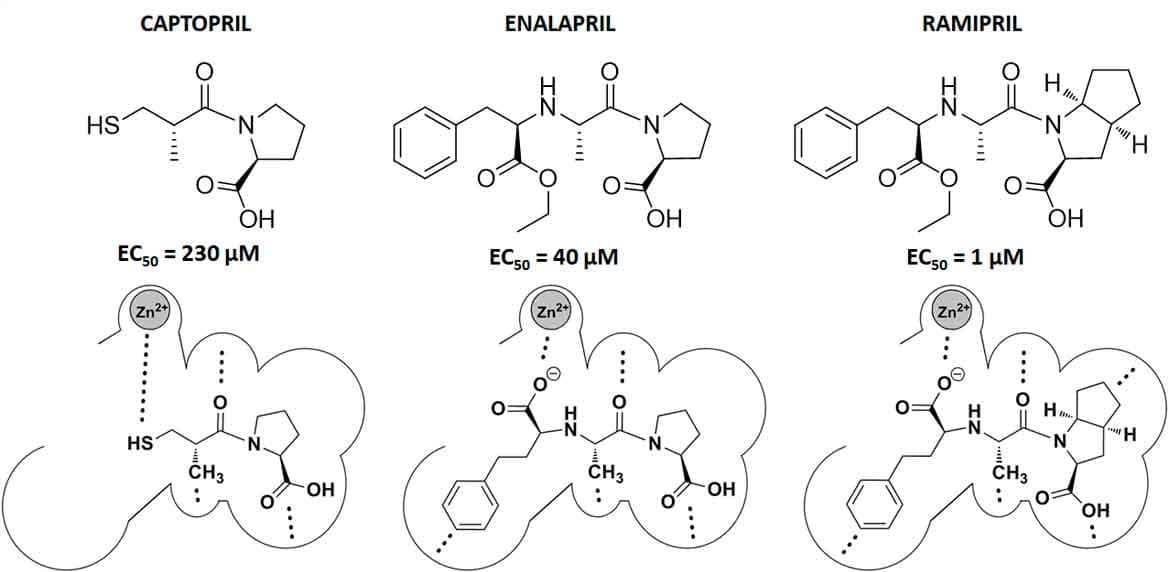
A interação principal de coordenação com o Zn2+ da metaloenzima foi mantida via grupamento sulfeto do captopril e grupamentos de ácido carboxílico desprotonados da forma ativa do enalapril e ramipril. Esses fármacos apresentam potência (EC50) mais elevada que o captopril, provavelmente em razão do aumento do número de interações com os bolsões da enzima via interação hidrofóbica, primeiramente pelo anel aromático e depois para o ramipril pelo anel bicíclico de pirrol (Imagem 35).
Bloqueadores de canal de cálcio
Os anti-hipertensivos da classe dos bloqueadores dos canais de cálcio (BCC) são uma opção efetiva de tratamento para hipertensos com diabetes ou angina. Esses fármacos promovem a redução da resistência vascular periférica por meio da redução da concentração de cálcio nas células musculares lisas vasculares, diminuindo o processo de vasoconstrição e favorecendo a vasodilatação. Os BCC são divididos em três classes químicas, cada qual com propriedades farmacocinéticas e indicações clínicas diferentes:
I
Difenilalquilaminas (verapamil).
II
Benzotiazepinas (diltiazem).
III
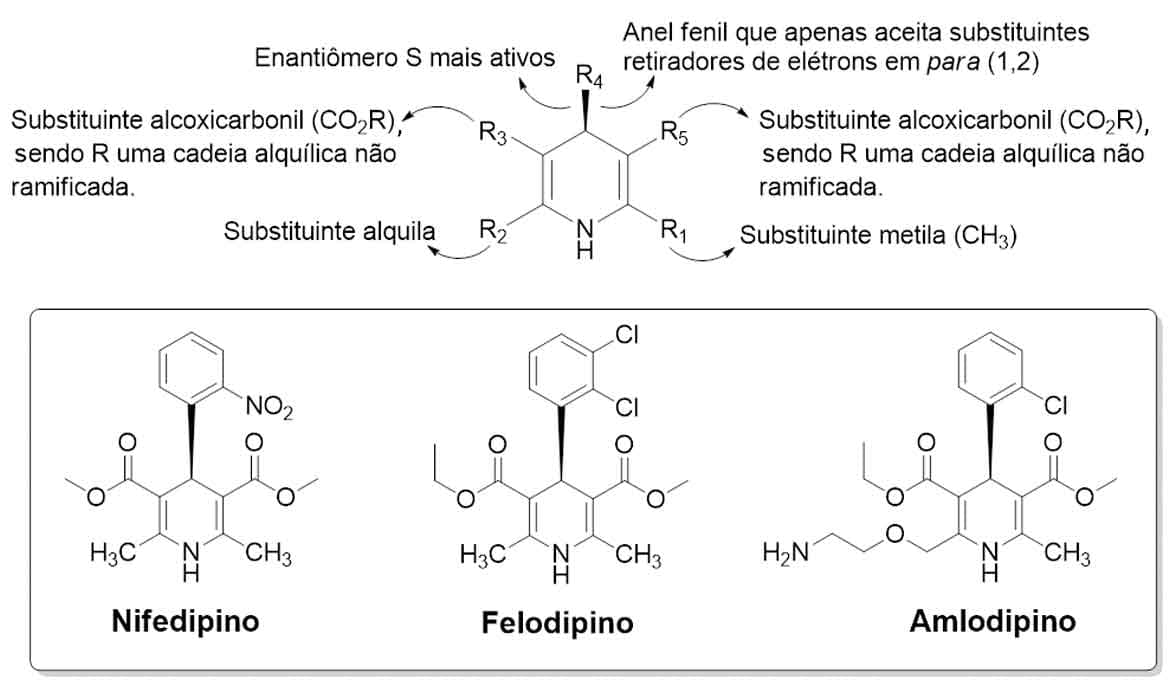
Dihidropiridinas (anlodipino, entre outros).
Dentre os BCC, o verapamil é o menos seletivo, apresentando efeitos significativos também sobre os canais de cálcio das células cardíacas (efeito inotrópico negativo). O diltiazem também afeta os miócitos, porém com efeito inotrópico negativo menos pronunciado, além de ter um perfil de efeitos adversos favorável. Por fim, as dihidropiridinas apresentam maior afinidade pelos canais de cálcio vasculares do que do coração, sendo a primeira escolha no tratamento da hipertensão, apesar de apresentarem maior frequência de efeitos adversos.
Bases químicas e farmacológicas do mecanismo de ação dos bloqueadores de canal de cálcio
Os canais de cálcio voltagem-dependentes do tipo L são constituídos por cinco subunidades (α1, α2, β, γ e δ), sendo os mais importantes clinicamente. Os BCC ligam-se sobre a subunidade α1, inibindo a ação dos mecanismos regulares de entrada de íons de Ca2+ nas células musculares lisa dos vasos, por bloqueio competitivo (Imagem 36).
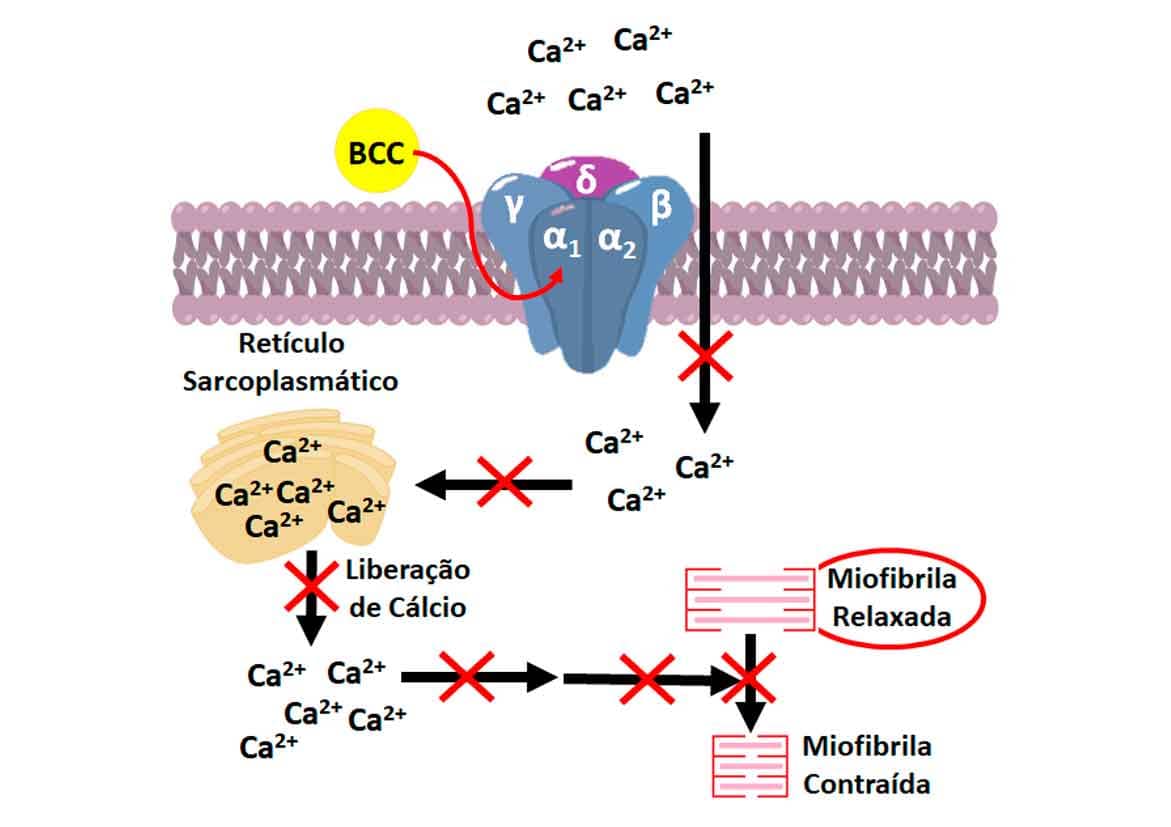
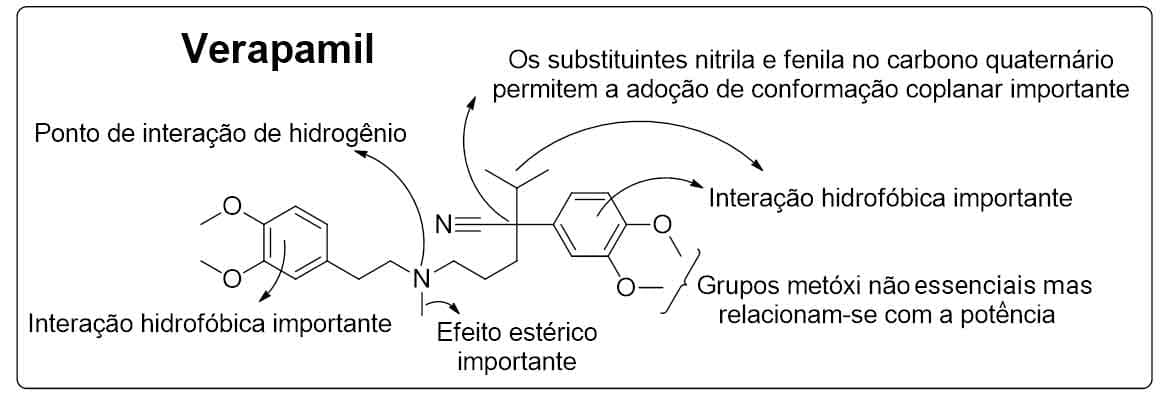
Quanto à relação estrutura-atividade do verapamil, estudos observaram que os substituintes metóxi do anel benzeno próximo ao carbono quiral não foram considerados essenciais, mas impactaram na potência. O nitrogênio da amina terciária e os dois anéis de benzeno demonstraram ser essenciais também para sua ação, devido à interação de hidrogênio e hidrofóbica, respectivamente. O grupo N-metil está envolvido com efeitos estéricos importantes, uma vez que existe menor atividade em análogos do verapamil, em que a amina é quaternária. O carbono benzílico quaternário ligado ao grupo ciano e ao grupo fenil permite a adoção de uma conformação coplanar importante para a afinidade com o alvo (Imagem 37).
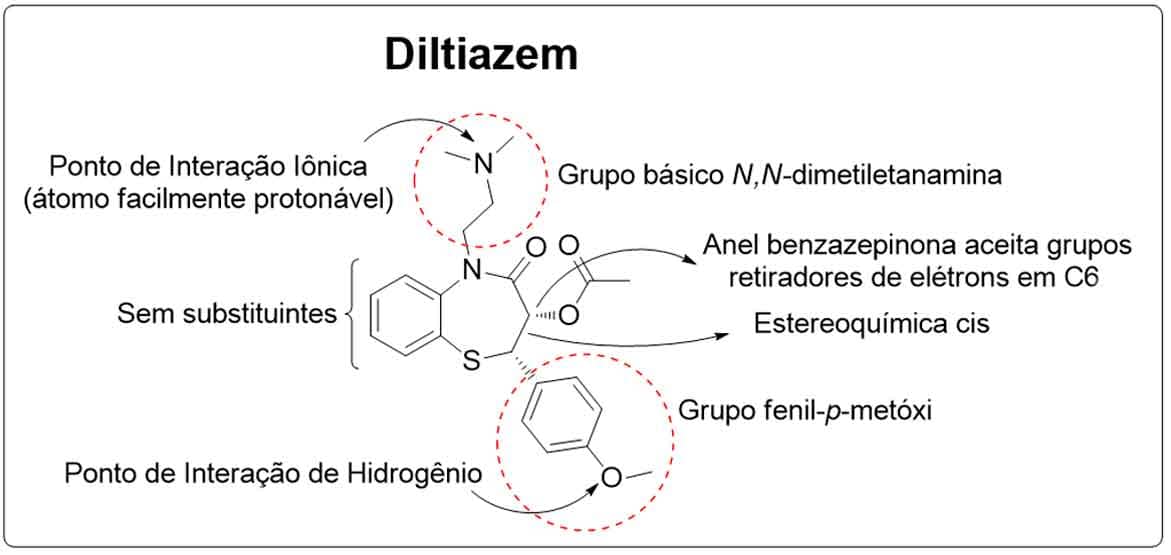
Sobre o BCC diltiazem, sua atividade é dependente de dois principais grupos farmacofóricos: o fenil-p-metóxi, responsável por uma interação do tipo hidrogênio, e o resíduo básico de N,N-dimetiletanamina, ligado ao nitrogênio da benzazepinona, facilmente protonado, gerando interação do tipo iônica.
Fármacos cardiovasculares: propriedades estruturais e o mecanismo de ação
O vídeo a seguir aborda a relação entre a estrutura e a atividade farmacológica dos diferentes grupos de fármacos que auxiliam no tratamento das doenças cardíaca.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever as bases químicas e farmacológicas do mecanismo de ação dos anti-inflamatórios e anti-histamínicos
Inflamação

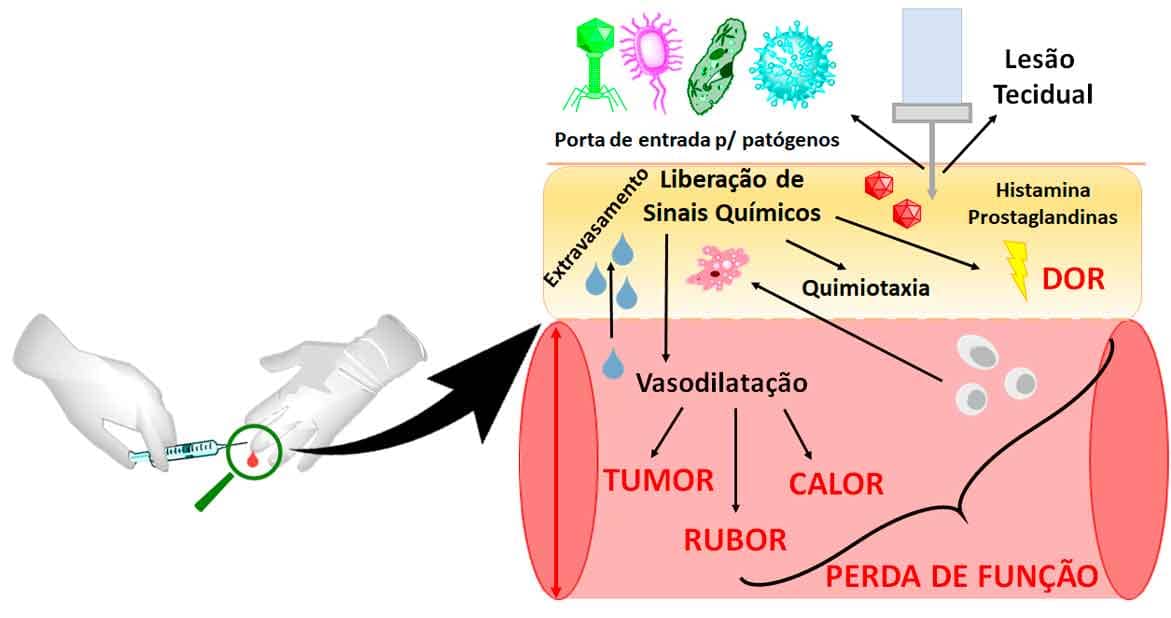
Por definição, a inflamação é uma resposta do organismo à lesão tecidual ou infecção que visa erradicar o agente lesivo e favorecer o reparo tecidual. O processo inflamatório relaciona-se com o sistema imune, levando a modificações celulares — chamadas de sinais cardinais da inflamação — como:
Calor (vasodilatação e aumento do metabolismo celular).
Rubor (vasodilatação e hiperemia).
Tumor (vasodilatação, aumento da permeabilidade celular, influxo celular e extravasamento de fluido).
Dor (liberação de mediadores que aumentam a dor).
Perda de função (lesão tecidual), principalmente quando a inflamação não é controlada.
Veja na imagem 41 um esquema ilustrativo que apresenta o processo de inflamação e os seus sinais cardinais.
Diversos mediadores químicos são liberados no processo inflamatório, como as importantes histamina e prostaglandinas, cujas ações estão associadas a processos pró-inflamatórios. Assim, resumidamente, fármacos anti-inflamatórios e anti-histamínicos terão seus mecanismos associados ao bloqueio da ação dessas substâncias e/ou de suas sínteses endógenas.
Fármacos anti-inflamatórios
Do ponto de vista do controle da inflamação, os anti-inflamatórios podem ser divididos em anti-inflamatórios não esteroidais (AINE) e anti-inflamatórios esteroidais (corticosteroides). Neste módulo, você terá um breve resumo sobre o mecanismo geral de ação de ambos e poderá avaliar a relação estrutura-atividade de alguns exemplos, em vista do amplo número de fármacos e classes existentes.
Anti-inflamatórios não esteroidais (AINE)
O mecanismo de ação de todos os AINE ocorre via inibição da síntese das prostaglandinas (PG), produzidas a partir de fosfolipídios da membrana, formando, em quase todos os tecidos, o precursor (ácido araquidônico) das PG pela via da cicloxigenase. As prostaglandinas apresentam papel importante na modulação da dor, da inflamação e da febre, controlando ainda outras funções fisiológicas, como secreção ácida estomacal; além disso, estão entre os mediadores químicos liberados nos processos alérgicos (Imagem 42).
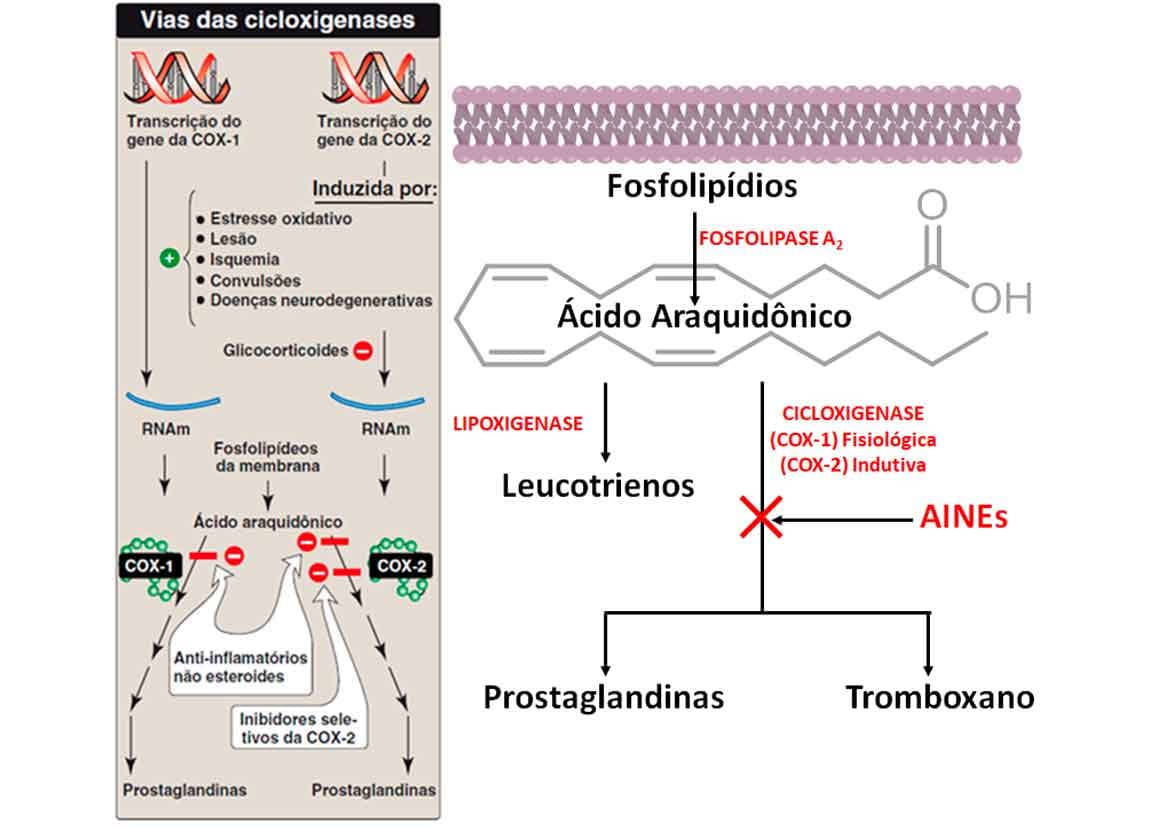
Os AINE são um grupo de fármacos quimicamente diferentes com atividades distintas quanto à ação antipirética, analgésica e anti-inflamatória. Suas classes químicas incluem derivados do:
Ácido salicílico (ácido acetilsalicílico – AAS).
Ácido propiônico (ibuprofeno e cetoprofeno).
Ácido acético (diclofenaco e cetorolaco).
Ácido enólico (meloxicam e piroxicam).
Fenamatos (ácido mefenâmico).
Coxibes inibidores seletivos da COX-2 (celecoxibe).
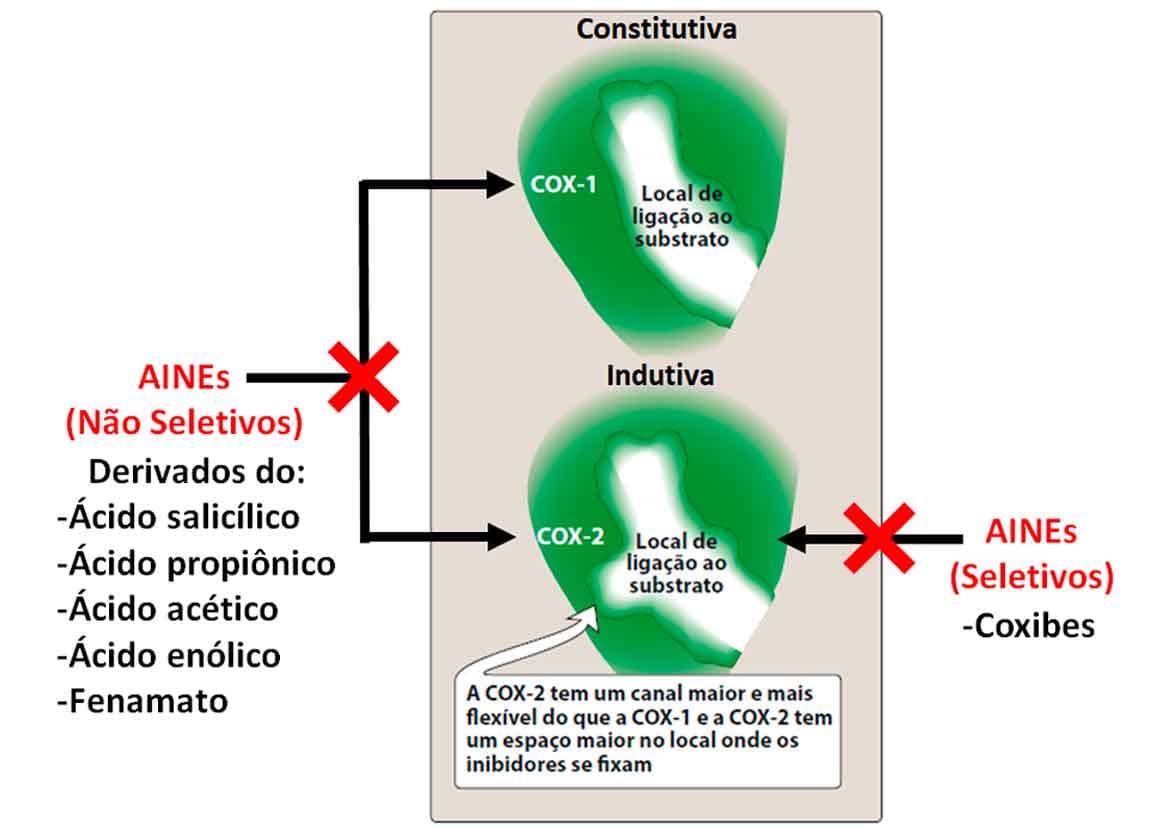
Todos os AINE inibem as cicloxigenases (COX-1 e/ou COX-2) que catalisam a primeira etapa da biossíntese das prostaglandinas. A COX-1 apresenta sua expressão constitutiva, ou seja, fisiológica, e está relacionada a processos naturais do corpo, enquanto a COX-2 é dita como indutiva, pois tem a expressão aumentada devido a estímulos inflamatórios. Assim, é interessante que apenas a COX-2 seja inibida para que não sejam bloqueados mecanismos fisiológicos associados à COX-1, levando a efeitos adversos, por exemplo (Imagem 43).
Bases químicas e farmacológicas do mecanismo de ação dos AINE
Diante da gama de AINE e de suas diferentes estruturas e classes químicas, o foco do estudo estará na relação estrutura-atividade para alguns dos principais, como ácido acetilsalicílico (AAS), paracetamol, dipirona, ibuprofeno e celecoxibe.
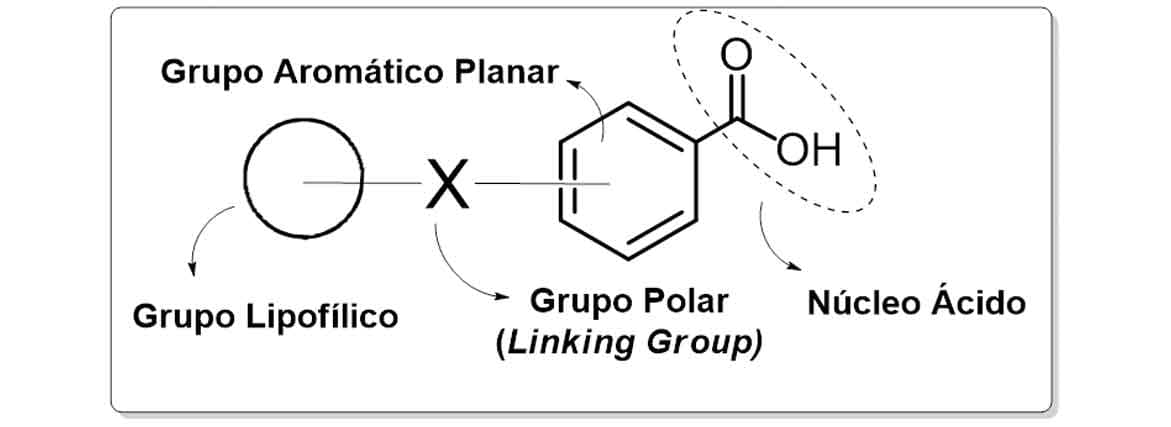
Estruturalmente, os AINE apresentam em sua estrutura química um núcleo ácido — com funções do tipo ácido carboxílico, sulfonamidas ou enol — acoplado a um grupamento aromático funcionalizado planar. Também apresentam um grupo polar que faz a ligação entre o núcleo planar e um grupo lipofílico adicional (Imagem 44).
Veja, a seguir, as características químicas e farmacológicas dos principais representantes dessa classe:
- Ácido acetilsalicílico (AAS)
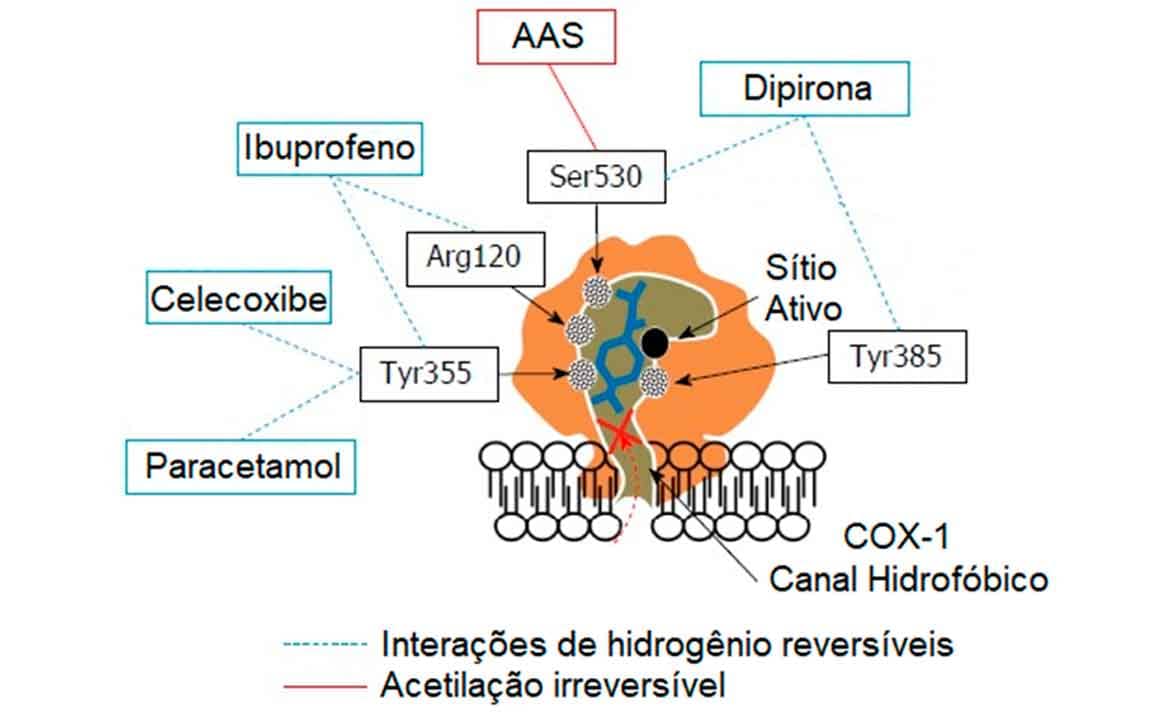
Dentre os AINE conhecidos, apenas o AAS inibe a COX-1 de maneira irreversível, devido à reação de acetilação da cadeia lateral do resíduo de serina no sítio catalítico. Os demais AINE interagem por meio de inibição reversível via ligação de hidrogênio com diferentes resíduos da enzima, como ilustrado na Imagem 45.
Em relação à estrutura-atividade, o AAS deriva da estrutura do ácido salicílico, anti-inflamatório mais simples.
Para que se tenha atividade, os derivados do ácido salicílico necessitam que o grupo carboxil e o grupo acetil estejam adjacentes (posição para); derivados halogenados apresentam maior atividade inibitória da COX, porém são tóxicos. O aumento da cadeia alquílica do grupo acetil, assim como a substituição da função ácida por éster, reduz a atividade inibitória. Para a manutenção da atividade do AAS, o anel não deve apresentar substituintes na posição 4. E, por fim, a remoção do grupo acetilado ou mesmo sua hidroxila também reduzem sua atividade (Imagem 46).
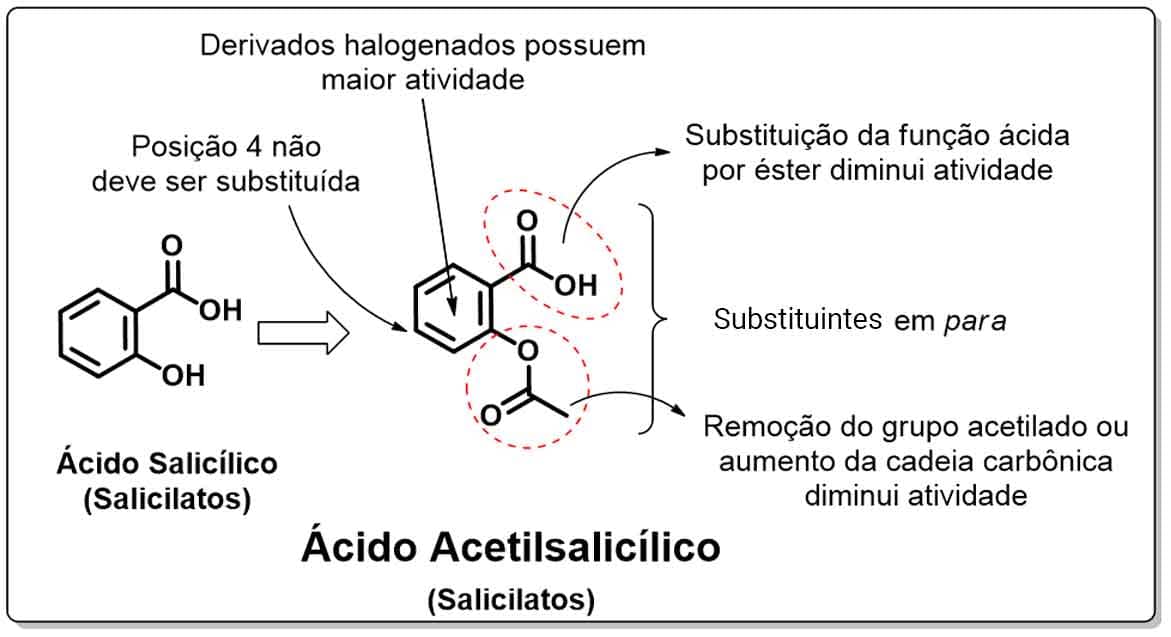
- Paracetamol e dipirona
Os fármacos paracetamol e dipirona são as primeiras escolhas no tratamento de febre e dor devido ao seu maior potencial antipirético e analgésico dentre os AINE.
Sugere-se que esses fármacos tenham mecanismo de ação um pouco diferente, inibindo também uma variante da COX-1 — a COX-3 (ou COX-1b) —, envolvida em processos de dor e febre.
Os dois ainda inibem fracamente COX-1 e COX-2 em tecidos periféricos, atuando provavelmente em cicloxigenases cerebrais, como a COX-3, o que justifica a baixa potência anti-inflamatória de ambos.
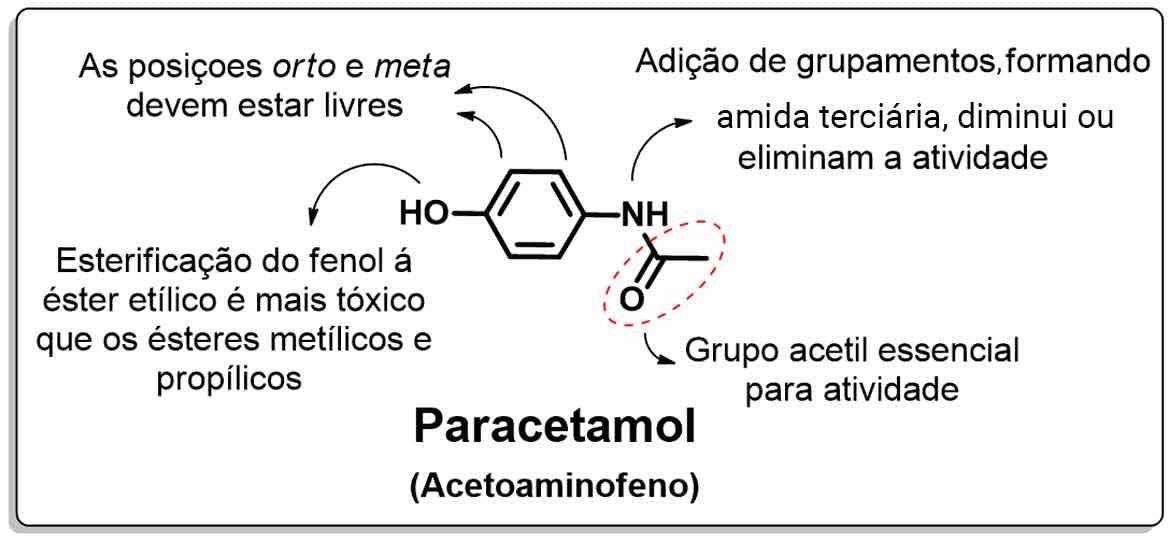
A relação estrutura-atividade do paracetamol indica que o grupo acetil é essencial para sua atividade e que substituições nas demais posições livres (2, 3, 5 e 6) inibem sua atividade. A esterificação da função fenólica com grupo etóxi forma derivado com mais efeitos adversos que derivados metóxi ou propóxi. O nitrogênio do grupamento amida, ao ser substituído por amida terciária, reduz a basicidade e diminui a atividade, a não ser que seja substituído por grupamentos metabolicamente lábeis. Grupos volumosos, como aromáticos, também provocam o mesmo efeito sobre a atividade, podendo até extingui-la (Imagem 47).
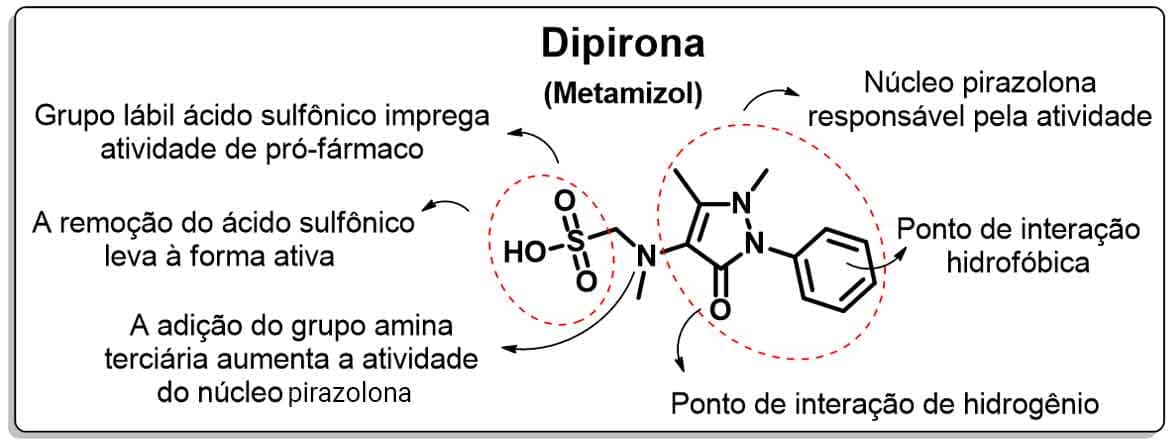
A dipirona tem sua atividade relacionada ao núcleo fenil-pirazolona, que apresenta interações hidrofóbicas devido ao fenila e interação de hidrogênio devido à carbonila do anel pirazolona. Em virtude do grupo lábil ácido sulfônico, a dipirona é considerada um pró-fármaco, que, após a remoção desse grupo, forma o derivado ativo, contendo a amina terciária, que tem maior atividade que a molécula contendo apenas o núcleo fenil-pirazolona.
Veja as características da estrutura atividade da dipirona na figura 48.
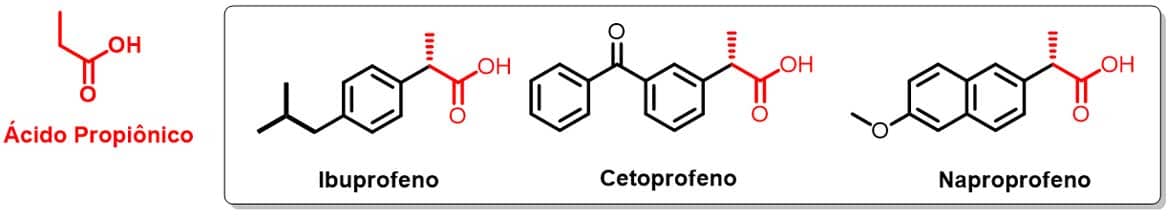
- Derivados do ácido propiônico
Os AINE derivados do ácido propiônico são caracterizados pela presença do anel aromático ligado ao carbono α do ácido propanoico e a uma segunda cadeia alquílica ou arílica nas posições meta ou para. O cetoprofeno e o naproxeno, devido à maior complexidade de suas cadeias laterais, apresentam maior atividade anti-inflamatória e pouca atividade analgésica e antipirética, diferentemente do ibuprofeno (Imagem 49).
Quanto à relação estrutura-atividade, o substituinte metílico no carbono α com estereoquímica S é essencial para a atividade inibitória das COX; outros substituintes de cadeia maior diminuem a atividade. Isômeros R não apresentam atividade, o que possibilita a comercialização desses fármacos como racematos, com exceção do naproxeno, comercializado apenas como isômero S. A substituição da função ácido carboxílico por grupos polares com ésteres, amidas ou álcoois forma análogos de menor atividade. A atividade parece estar relacionada também a interações hidrofóbicas do segundo substituinte do benzeno, sendo ótima para o isobutil (ibuprofeno), inferior para grupos alquil menores e grupos alquil maiores, mas com maior flexibilidade. Os grupos aromáticos, devido à possibilidade de interações hidrofóbicas, também contribuem para maior atividade dos AINE dessa classe (Imagem 50).
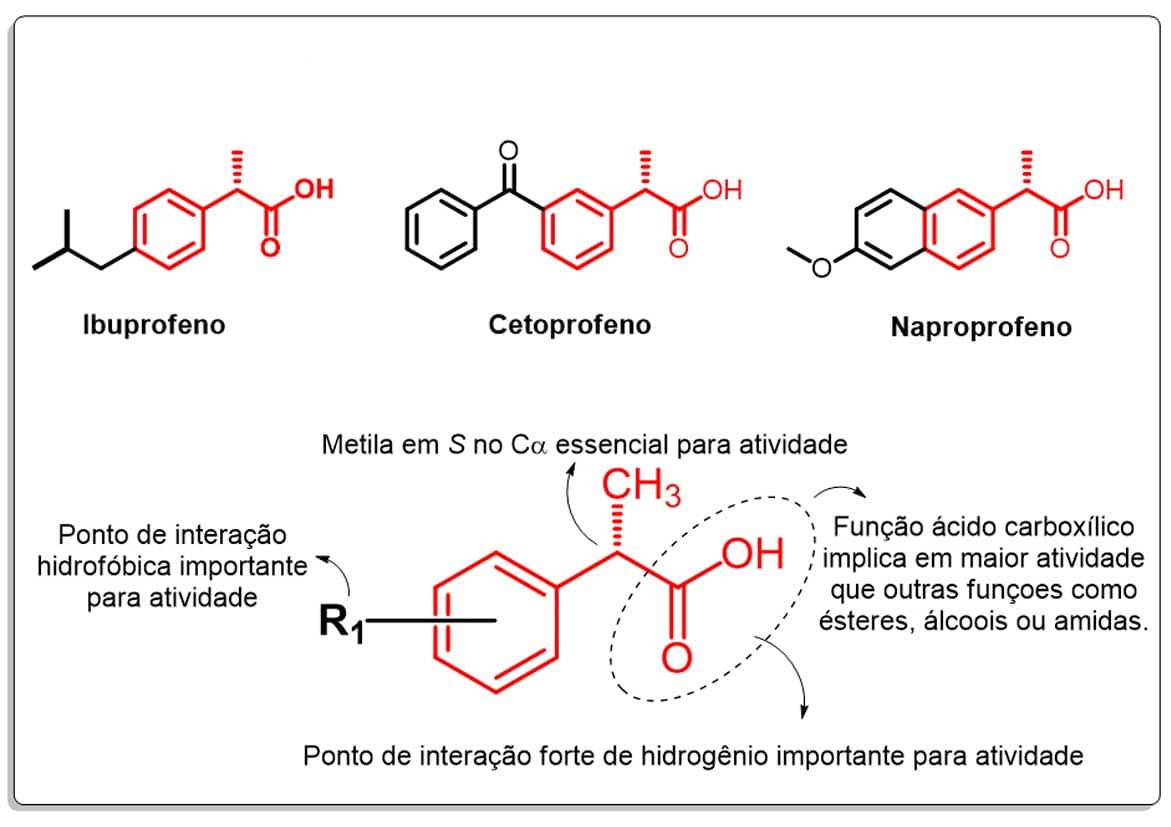
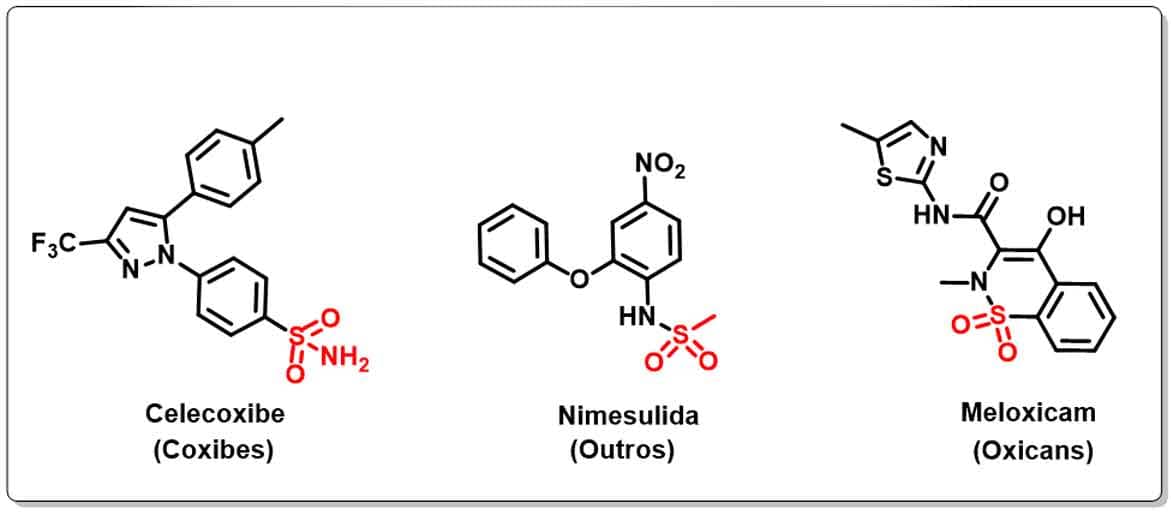
- Coxibes
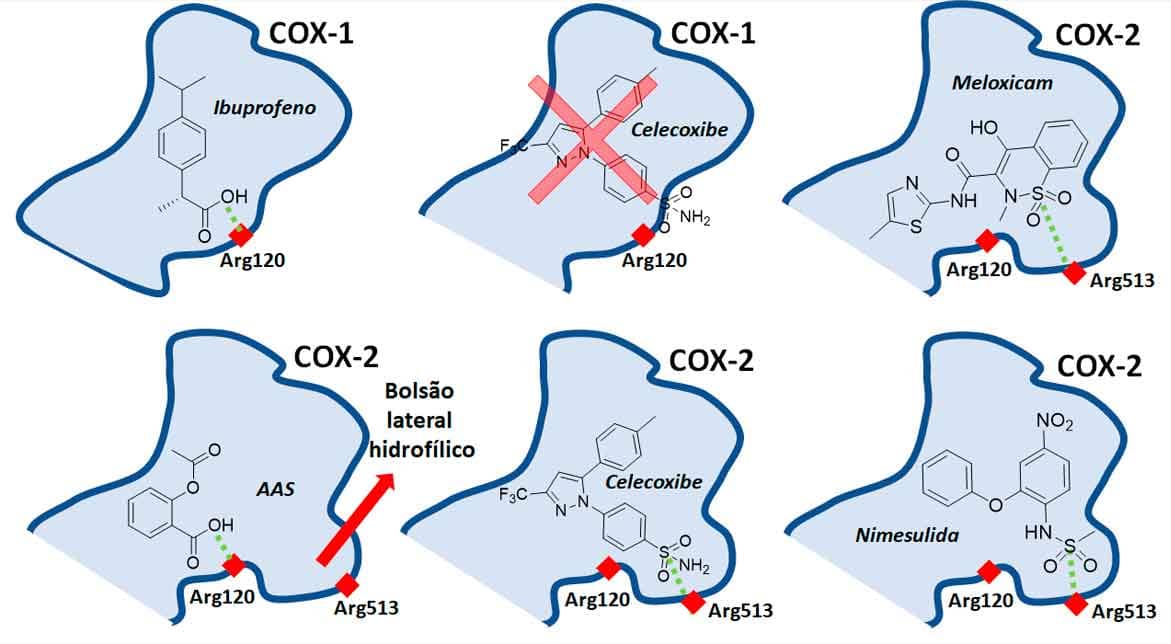
Essa é a única classe de anti-inflamatórios totalmente seletivos da COX-2. Estruturalmente, a principal diferença entre as enzimas COX-1 e 2 ocorre devido à troca entre um aminoácido no sítio ativo — para a COX-1 é uma serina; para COX-2, um aminoácido de cadeia lateral maior, a isoleucina.
Tal mudança impacta na estrutura final das enzimas, fazendo com que a COX-2 apresente um bolsão lateral hidrofílico maior, o que permite a interação com moléculas estruturalmente distintas e seletivas, como os coxibes e alguns fármacos de outras classes, como a nimesulida e o meloxicam, único oxicam COX-2 seletivo (Imagem 51).
A atividade desses fármacos parece estar ligada ao fato de sua estrutura permitir a interação de hidrogênio com o resíduo de arginina 513 do bolsão hidrofílico das COX-2 e à ausência de interação com o resíduo de arginina 120 (Imagem 52).
De maneira geral, os inibidores seletivos da COX-2 apresentam em sua estrutura um núcleo de heterociclo central acoplado a um sistema diaromático. A presença do grupamento sulfonamida ou sufonilmetil em um dos anéis aromáticos também desempenha papel importantíssimo de seletividade com a COX-2, como explicado anteriormente. Diante da ampla diversidade de tipos de compostos heterocícliclos e das possibilidades de substituintes associados, inúmeros análogos dos AINE seletivos da COX-2 vêm sendo estudados, sendo a principal relação estrutura-atividade aplicada a esses três aspectos (Imagem 53).
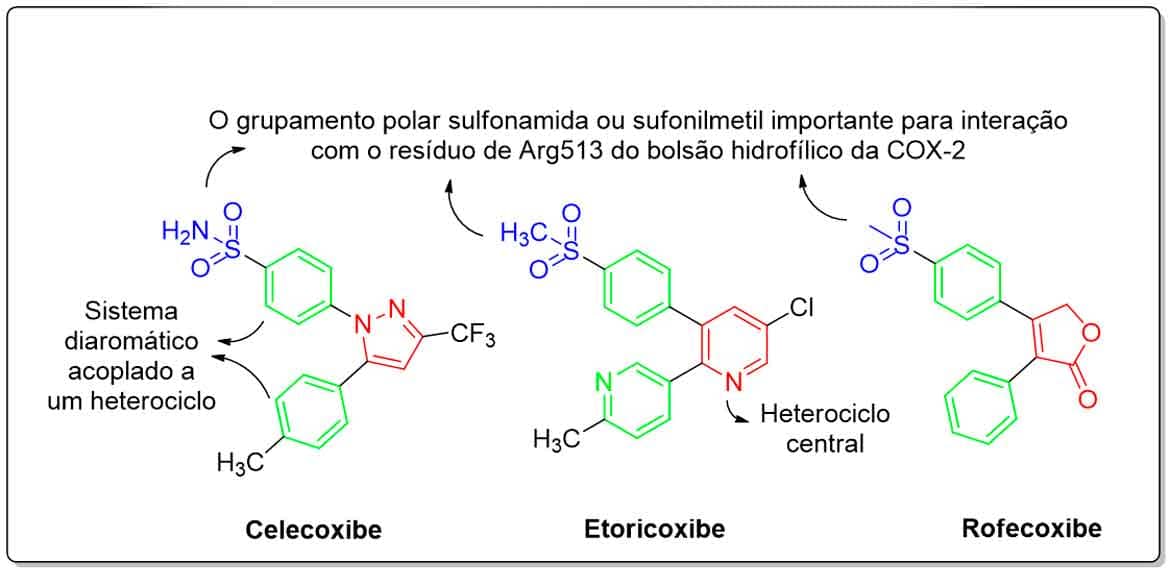
Anti-inflamatórios esteroidais
Um segundo grupo anti-inflamatório importante é o dos corticosteroides, também chamados de glicocorticoides ou anti-inflamatórios esteroidais. Os corticosteroides endógenos são sintetizados na glândula suprarrenal, na região da zona intermediária do córtex dessas glândulas.
Os glicocorticoides ligam-se a receptores intracelulares citoplasmáticos específicos em tecidos-alvos distribuídos pelo corpo.
Então, após dimerização, esses complexos formados por receptor-corticoide são transportados para o núcleo, onde modificarão a transcrição gênica de fatores relacionados a processos diversos.
Por fim, culminarão na ação anti-inflamatória.
Veja na imagem 54 o mecanismo de ação dos corticoides.
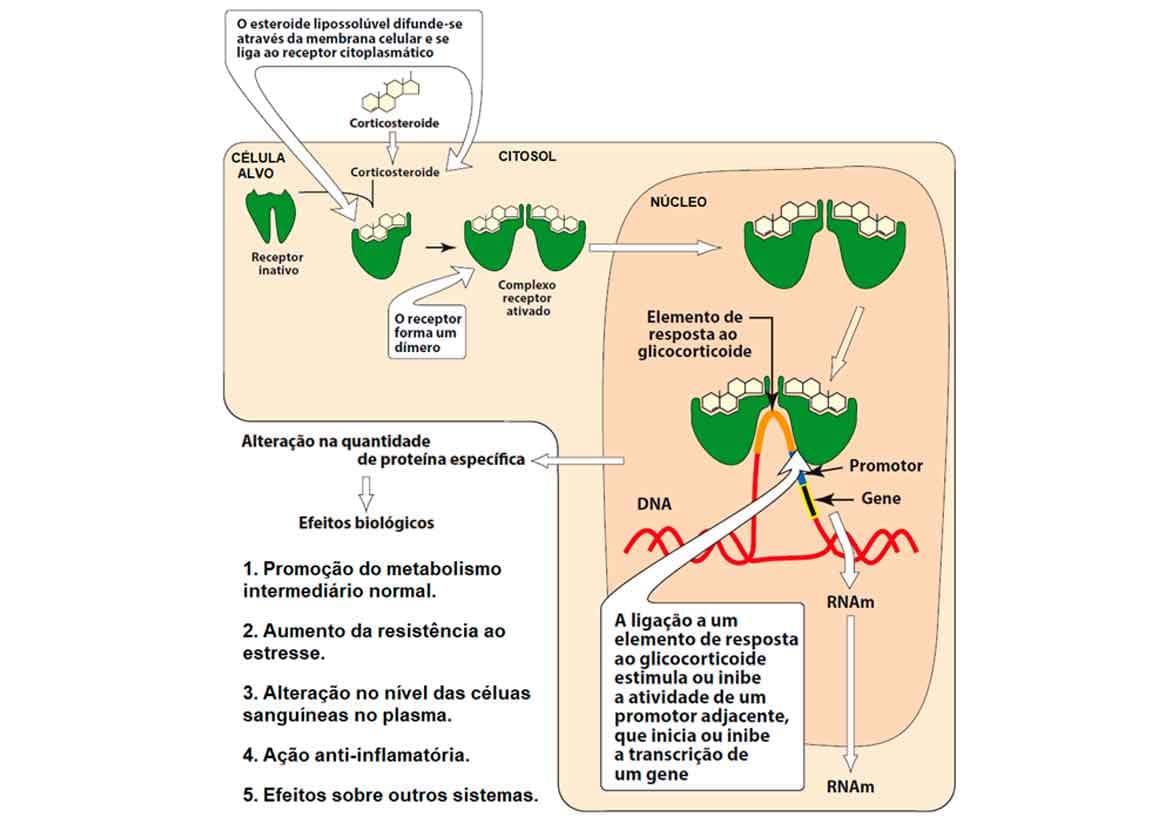
Você sabia
As propriedades terapêuticas mais importantes dos glicocorticoides são suas potentes atividades anti-inflamatórias e imunossupressivas. Além de diminuírem o número de linfócitos circulantes, essas substâncias inibem a habilidade dos leucócitos e macrófagos em responderem a antígenos.
Os glicocorticoides diminuem ainda a produção e liberação de citocinas pró-inflamatórias devido à inibição direta da fosfolipase A2, enzima que converte fosfolipídios ao ácido araquidônico, precursor das prostaglandinas e dos leucotrienos pró-inflamatórios (Imagem 55). Por fim, os corticoides estabilizam a membrana de mastócitos e basófilos, resultando em menor liberação de histamina.
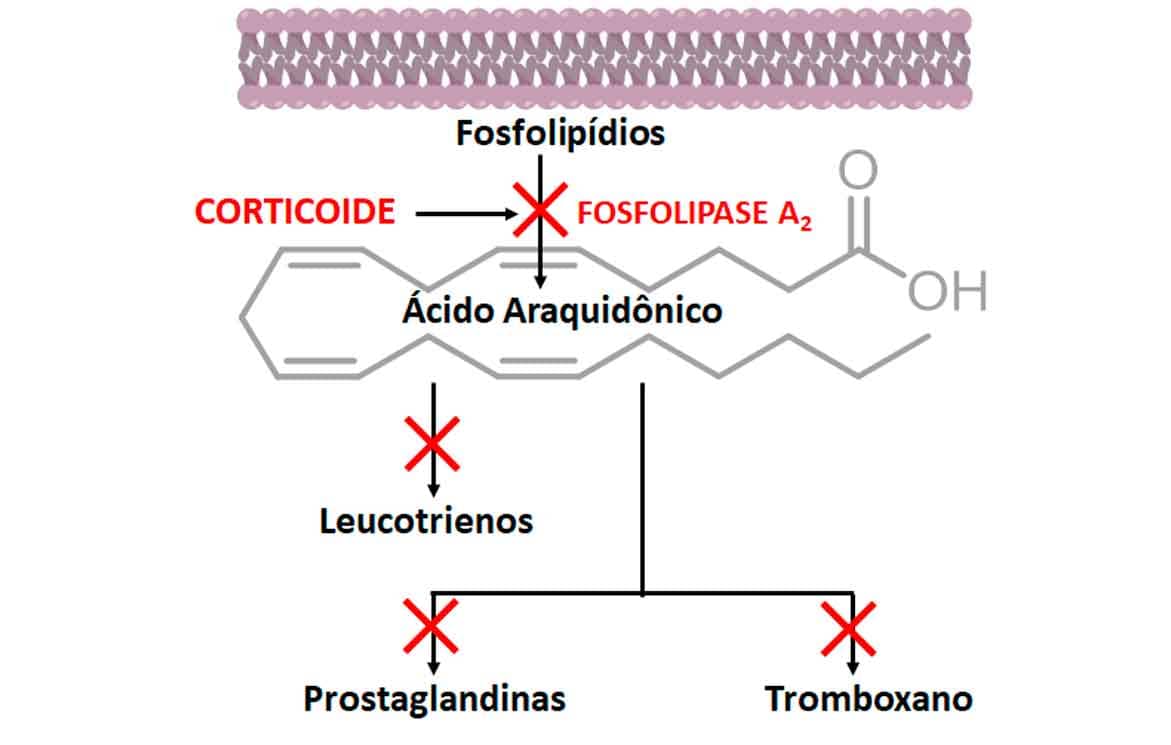
Bases químicas e farmacológicas do mecanismo de ação dos corticoides
Como exemplos de corticoides bastante utilizados na clínica, temos os análogos da cortisona – hidrocortisona, betametasona, dexametasona, prednisona, prednisolona e metilprednisolona. Suas estruturas são bastante semelhantes, mas as poucas variações que apresentam entre si impactam bastante na potência anti-inflamatória, no efeito colateral de retenção de sódio e no tempo de duração de cada fármaco (Imagem 56).
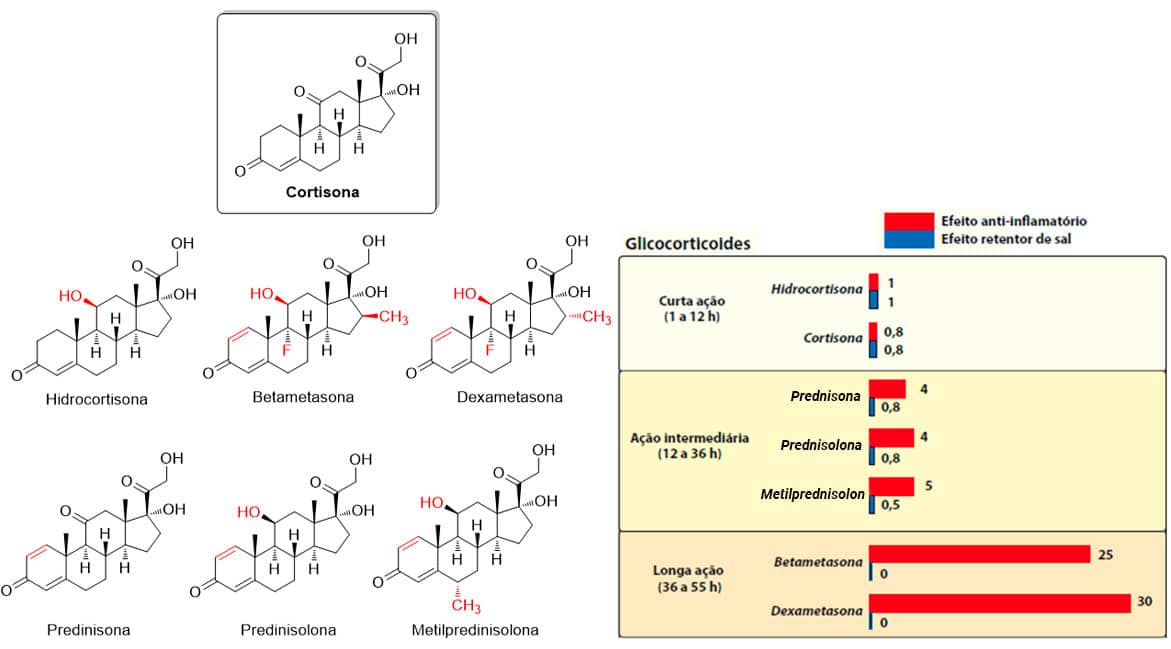
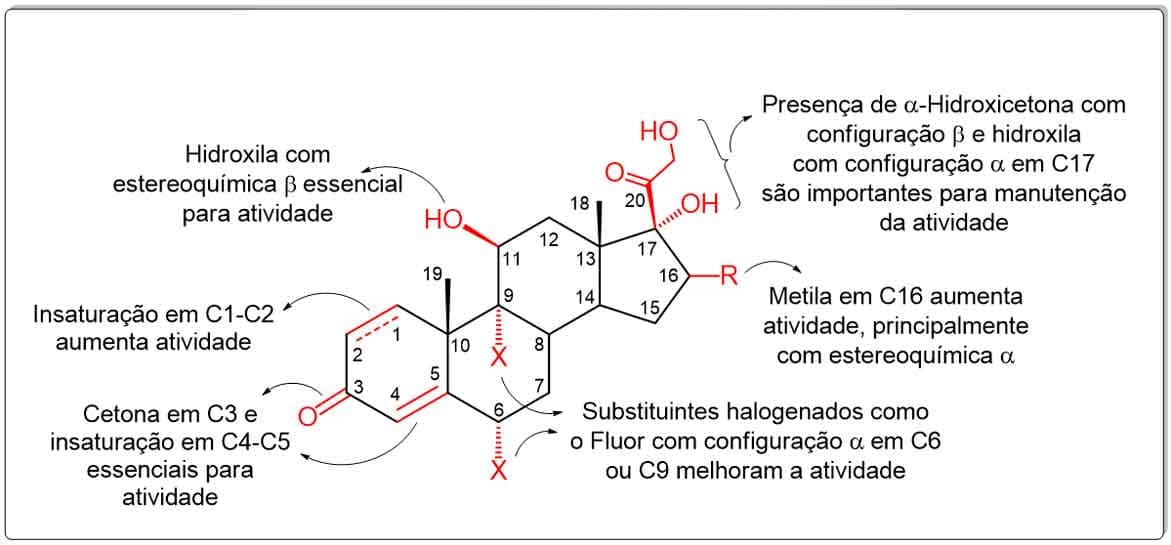
Como os corticoides utilizados na clínica apresentam pequenas variações estruturais, podemos avaliar a relação estrutura-atividade da estrutura geral dos glicocorticoides da seguinte forma:
- A cetona em C3 e a presença da insaturação entre os carbonos 4 e 5 são essenciais para a atividade.
- A dupla ligação entre C1 e C2 melhora a atividade dos glicocorticoides.
- Substituintes com estereoquímica α do tipo halogênio em C6 e C9 e do tipo metila em C16 aumentam bastante a atividade anti-inflamatória.
- A presença de hidroxila em α e do substituinte α-hidroxicetona em β no carbono 17 são importantes para a manutenção da atividade dos corticoides.
- A hidroxila com estereoquímica β em C11 é extremamente essencial para que ocorra a atividade.
- A hidroxila com estereoquímica β em C11 é extremamente essencial para que ocorra a atividade.
Veja na Imagem 57.
Processos alérgicos
Os distúrbios alérgicos são considerados um tipo de hipersensibilidade; compreendem reações imunes inapropriadas ou exageradas em resposta a alérgenos — em geral substâncias exógenas como medicamentos, alimentos, ou produzidas por microrganismos. Na maior parte das vezes, essas respostas imunes exageradas são mediadas por anticorpos do tipo IgE e de histamina, e compreendem inúmeras doenças alérgicas, como dermatite atópica, asma alérgica, rinite, conjuntivite, anafilaxia, alergias alimentares e a outras substâncias etc.
Reação alérgica
A reação alérgica se inicia pela ligação do alérgeno aos mastócitos e basófilos sensibilizados pela IgG. Então ocorre:
- Liberação de histamina de seus grânulos intracelulares, agindo de forma pró-inflamatória e gerando vasodilatação local (eritema e rubor).
- Aumento da permeabilidade capilar (edema e pápulas).
- Estimulação de nervos sensitivos (prurido).
- Contração do músculo liso das vias respiratórias (broncoespasmo) e do trato gastrointestinal (aumentando a motilidade).
- Aumento das secreções nasais, salivares e brônquicas.
A histamina tem seu efeito mediado por uma interação com quatro tipos de receptores (H1, H2, H3 e H4); porém, o principal receptor envolvido nos processos alérgicos é o receptor do tipo H1.
A histamina é sintetizada pela enzima descarboxilase a partir do aminoácido histidina e, diante do envolvimento dela nos principais processos alérgicos, o bloqueio de sua ação sobre seus respectivos receptores H1 é uma estratégia importante de tratamento. Assim, o uso de anti-histamínicos é bastante efetivo no controle desses distúrbios (Imagem 58).
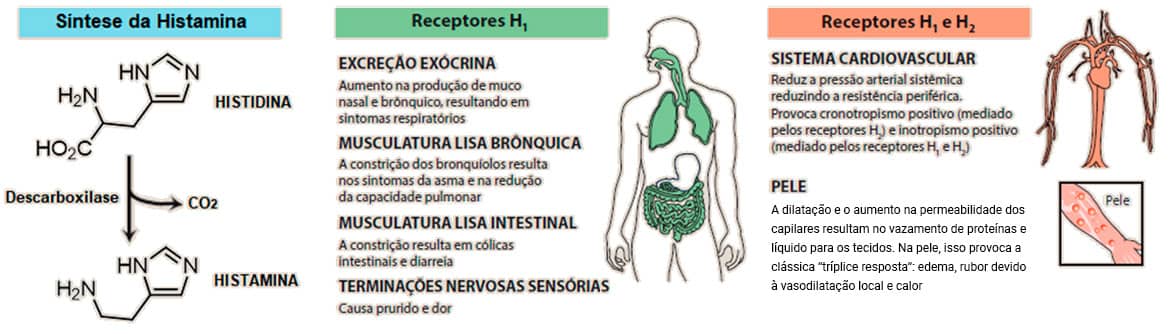
Fármacos anti-histamínicos
Os anti-histamínicos que agem sobre os receptores do tipo H1 podem apresentar ações distintas que variam desde o controle de enjoo e náuseas do movimento (cinetose), ação sedativa, até propriamente o controle de condições alérgicas.
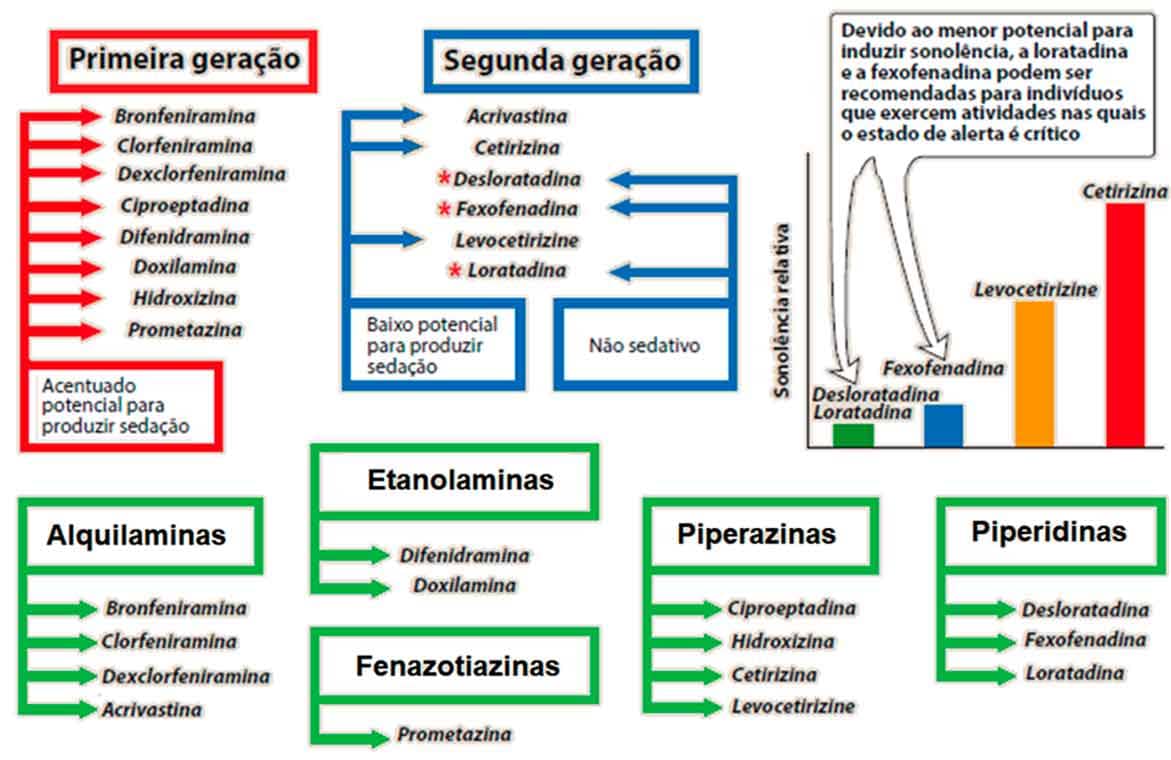
Os fármacos anti-histamínicos são divididos em diferentes classes químicas:
- Os de primeira geração – derivados alquilaminas, etanolamina e fenazotiazinas.
- Ou de primeira e segunda gerações – derivados piperazinas e piperidinas.
Em geral, fármacos de segunda geração apresentam baixo ou nenhum potencial de sedação, sendo esse o grande diferencial em relação aos de primeira (Imagem 59).
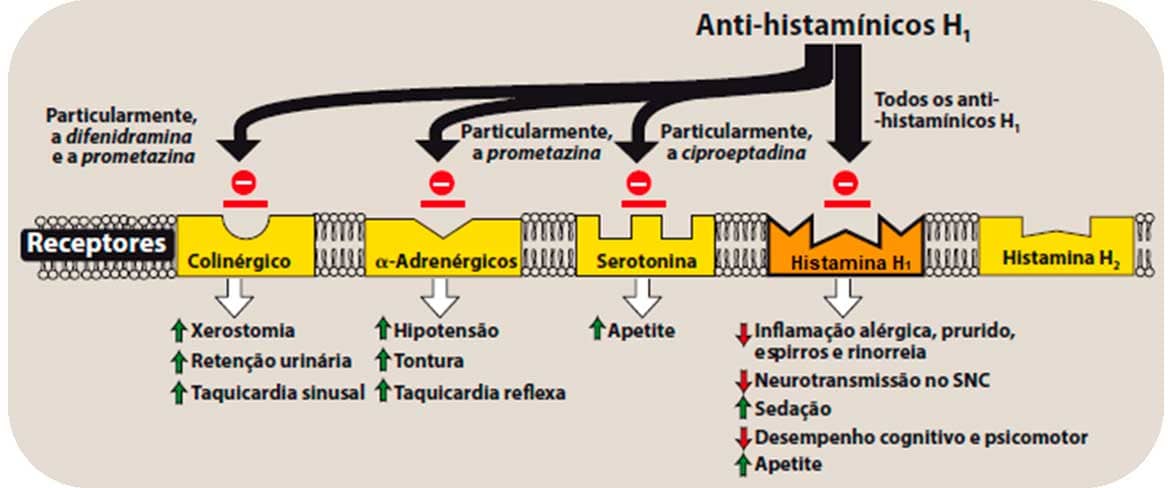
Sobre a relação estrutura-atividade dos anti-histamínicos, a estrutura geral desses fármacos apresenta um sistema diaromático: admite heterociclos aromáticos em um dos anéis, conectados por um átomo de carbono ou nitrogênio, seguido de um segundo átomo de carbono, oxigênio ou nitrogênio — ou sem nenhum deles — e então um grupo etil espaçador entre a porção anterior e uma amina terciária.
Saiba mais
O sistema diaromático espaçado por um átomo faz com que ele adquira coplanaridade, sendo essencial para a atividade. Substituintes em um dos aromáticos aumentam a potência anti-histamínica. O grupo espaçador Y e Z auxilia no reconhecimento do grupo farmacofórico dos anéis coplanares e da amina terciária. A cadeia alquílica de dois carbonos cria a distância (5-6 Å), necessária entre os dois pontos farmacofóricos externos da molécula. Substituintes nesses carbonos, no geral, diminuem a atividade do fármaco. Por fim, a amina terminal deve ser terciária (admitindo aminas terciárias cíclicas), com uma basicidade de pKa 8,5-10,0 para permitir sua protonação ao interagir com o receptor histaminérgico e alcançar máxima atividade (Imagem 61).
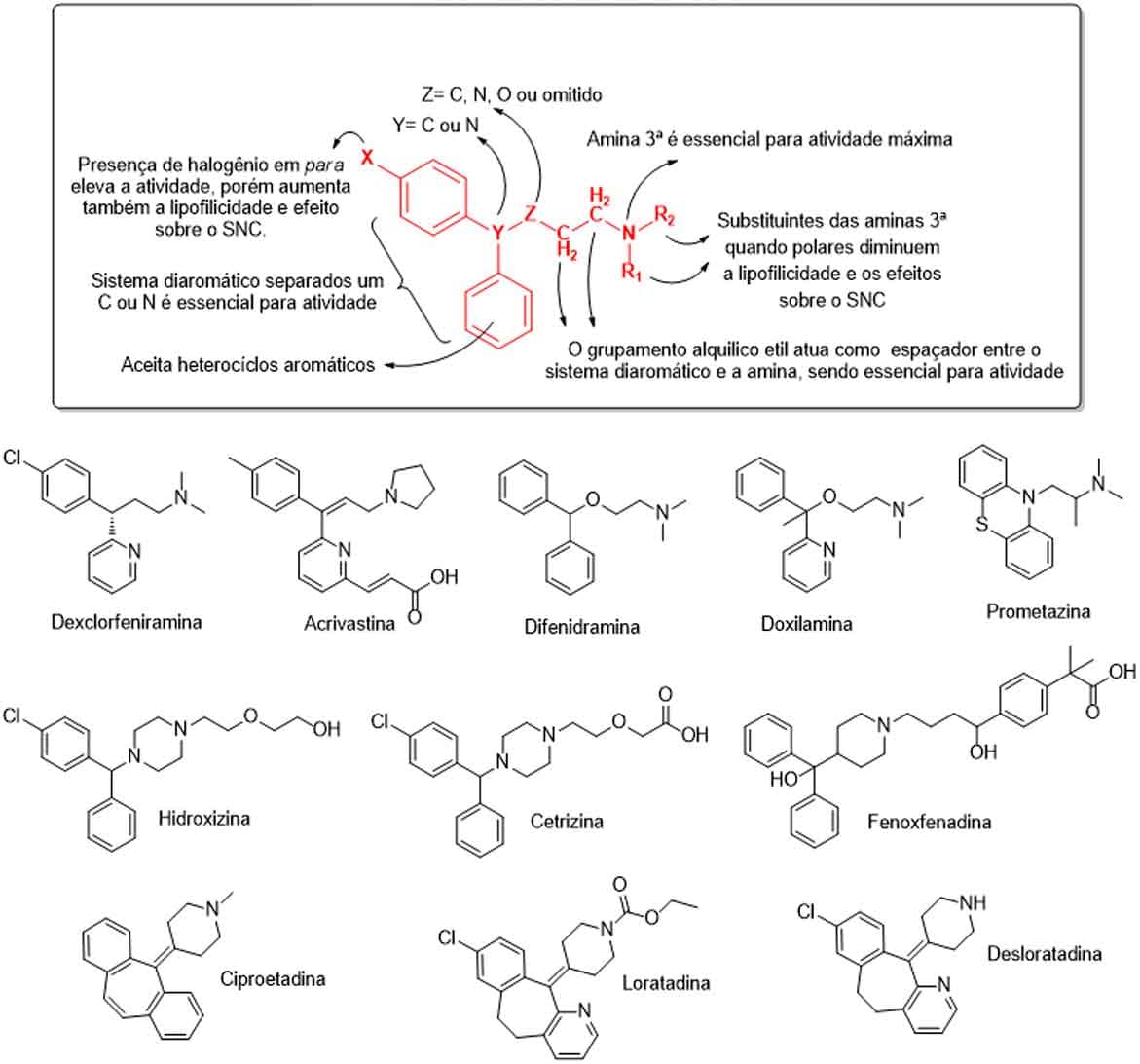
Fármacos anti-inflamatórios: propriedades estruturais e o mecanismo de ação
O vídeo a seguir fala sobre a estrutura e sua relação com a atividade dos diferentes grupos de fármacos de anti-inflamatório. Também explora os fatores que interferem na atividade farmacológica.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever as bases químicas e farmacológicas do mecanismo de ação das principais classes de fármacos neuroativos
Desordens neurológicas e fármacos neuroativos
O acelerado avanço tecnológico e dos meios de comunicação provocou transformações radicais na sociedade, nas últimas décadas, ocasionando uma série de problemas comportamentais, físicos e emocionais, sendo considerados por muitos como doenças do século 21. Aliados a esses avanços, outros aspectos, como rotinas de trabalho exaustivas e estressantes, violência urbana e o excesso de expectativas sociais, parecem elevar os índices de aparecimento de desordens neurológicas, por exemplo, ansiedade, insônia, depressão e até mesmo síndromes psicóticas.
Dependendo do mecanismo de ação, os fármacos que agem sobre o sistema nervoso central podem ser assim diferenciados: fármacos depressores do SNC — por exemplo, analgésicos opioides de ação central, antipsicóticos, ansiolíticos — e fármacos estimulantes do SNC — por exemplo, antidepressivos.
Fisiopatologia da dor
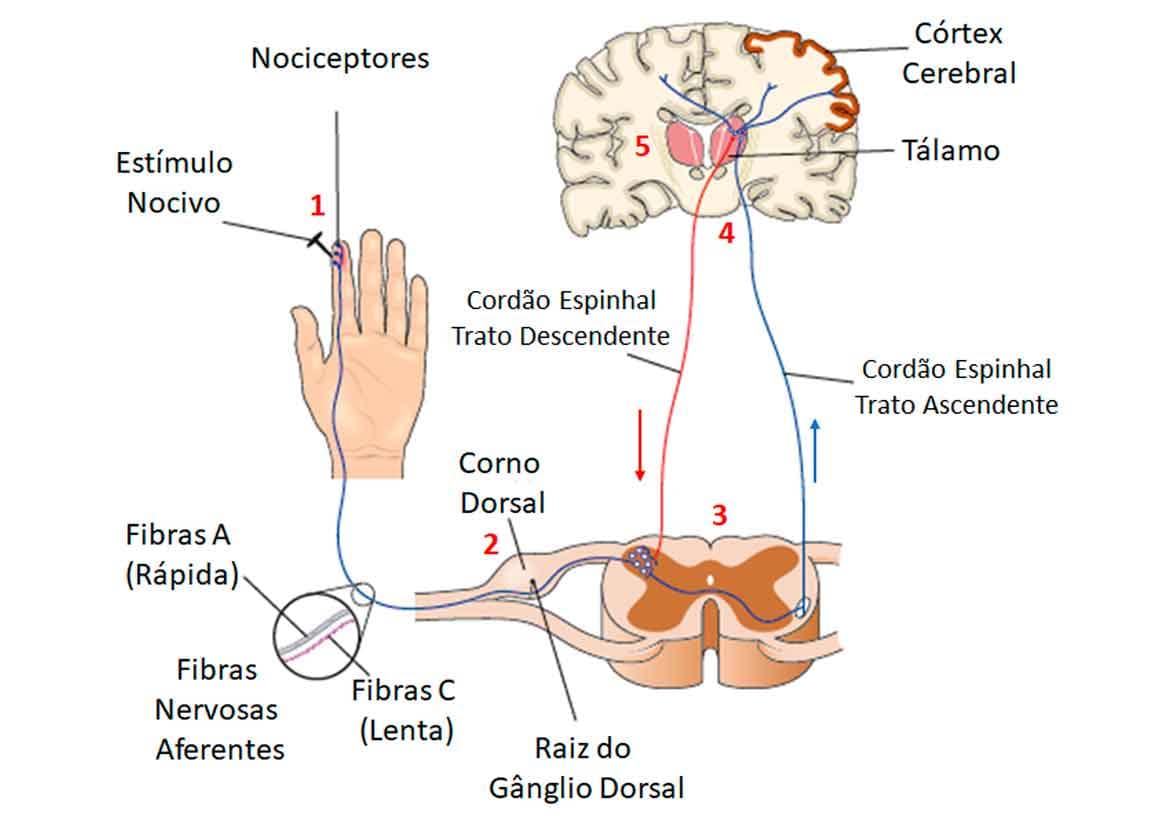
A dor é definida como uma sensação desagradável (aguda ou crônica), consequência de processos neuroquímicos complexos que envolvem o sistema nervoso central e periférico. Para compreender a fisiologia da dor é necessário entender os mecanismos envolvidos e o percurso realizado desde o momento do estímulo nocivo até sua percepção, a qual irá permitir que a dor seja efetivamente sentida e percebida na sua localização específica.
O mecanismo fisiológico da dor inicia-se pela sensibilização periférica de nociceptores em função da liberação de substâncias como bradicinina, prostaglandinas e substância P, e termina com sua percepção no córtex cerebral por meio de cinco fases:
- Transdução.
- Condução.
- Transmissão.
- Modulação
- Percepção.
TRANSDUÇÃO
Na transdução, nociceptores periféricos são estimulados por um estímulo nocivo e convertidos a um potencial elétrico despolarizante que será propagado centralmente.
CONDUÇÃO
Na condução, esse impulso elétrico é levado por fibras aferentes até a raiz dorsal da medula, podendo variar quanto à velocidade e ao tipo de fibra envolvida.
TRANSMISSÃO
A transmissão do impulso à raiz dorsal libera neurotransmissores que se encontram presentes no corno posterior à medula espinal. Através dos receptores específico da medula, fortes estímulos são gerados por esses neurotransmissores ou por mediadores bioquímicos excitatórios (glutamato, substância P, fatores de crescimento) e inibitórios (opioides, GABA e glicina), provenientes de três fontes principais: fibra aferente primária, interneurônios e fibra descendente.
PERCEPÇÃO E MODULAÇÃO
A percepção da dor que ocorrerá em seguida no cérebro sofre ação direta de modulação, a qual pode ser suprimida em situações de lesão ou ameaça, em uma reação de luta ou fuga, ou de modulações motivacionais, como crenças e sentimentos de afetividade e confiança. Então, a percepção da dor ocorre via integração entre os estímulos nocivos com áreas corticais e via o sistema límbico (Imagem 63).
Exemplo
O alívio da dor depende do seu tipo específico. Por exemplo, na dor articular leve ou moderada (dor nociceptiva) os analgésicos do tipo AINE em geral são eficazes; já na dor neuropática às vezes é necessário o uso de opioides ou mesmo sua combinação com outros fármacos, como anticonvulsivantes e até antidepressivos. A dor moderada a grave, quando crônica, em geral tem como tratamento de escolha os opioides.
Bases químicas e farmacológicas do mecanismo de ação dos opioides de ação central
Os opioides são fármacos de diferentes potências podendo ter origem natural, semissintética ou sintética. Eles produzem efeitos de modulação negativa da dor no nível central e podem ser divididos de acordo com sua estrutura química (Imagem 64). Todos os opioides agem ligando-se a receptores opioides específicos no SNC e produzindo efeitos similares aos dos neuropeptídeos endógenos (endorfinas, encefalinas e dinorfinas).
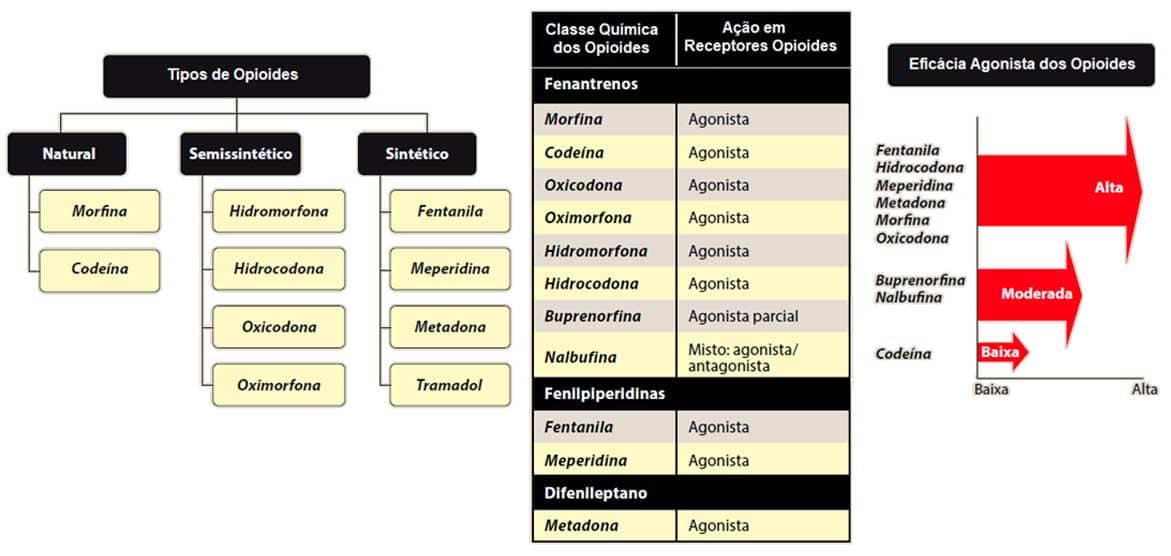
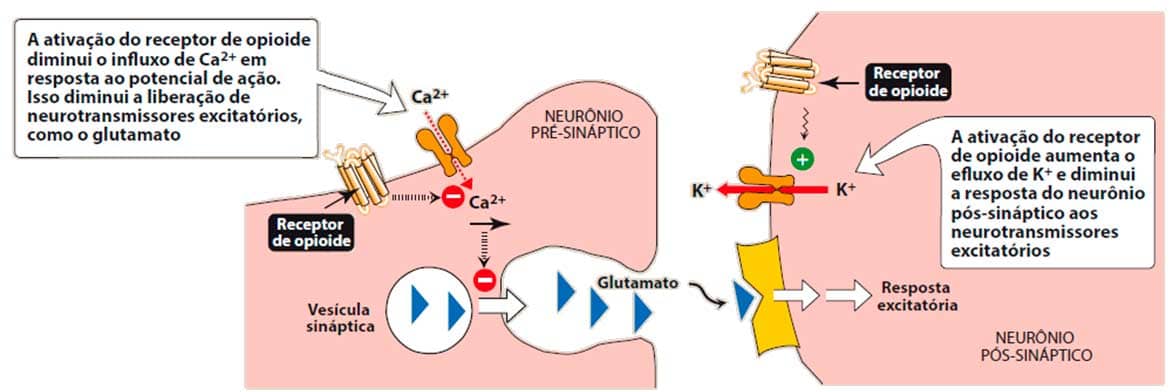
A ação dos opioides ocorre sobre três diferentes tipos de receptores. A propriedade analgésica é medida principalmente pela interação com os receptores μ, que modulam respostas nociceptivas térmicas, mecânicas e químicas. Já os receptores , no corno dorsal, geram analgesia pela modulação à resposta nociceptiva química e térmica. Por fim, os receptores estão relacionados à modulação da dor na região da periferia. Os três receptores são do tipo acoplado à proteína G e, ao serem ativados, inibem a adenililciclase, aumentando o efluxo pós-sináptico de potássio (hiperpolarização) ou reduzindo o influxo pré-sináptico de cálcio, impedindo assim o disparo neuronal e a liberação de neurotransmissores nociceptivos (Imagem 65).
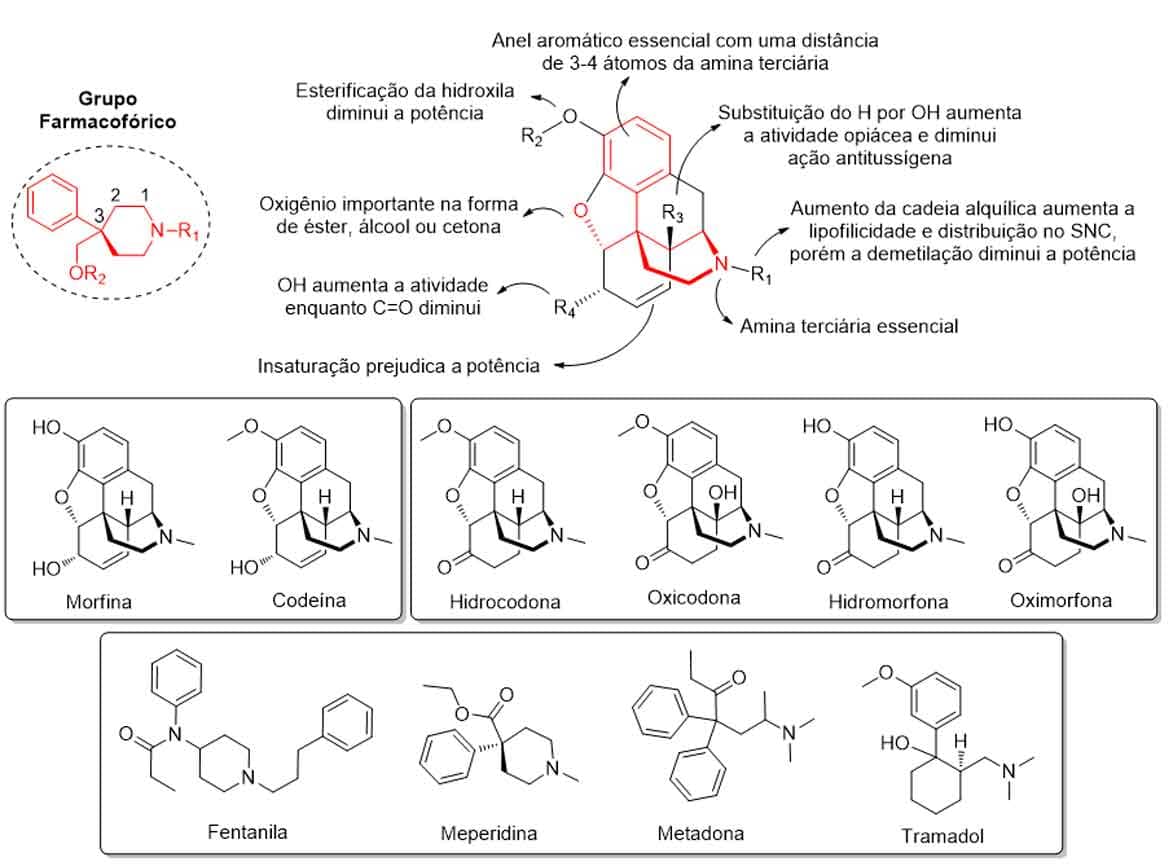
A estrutura geral dos opioides naturais e semissintéticos baseia-se na presença de cinco ciclos (A-E), sendo um anel aromático, dois ciclos hexanos, um anel de piperidina e um anel de tetra hidrofurano. A distância de 3 a 4 átomos entre o nitrogênio da piperidina e o anel aromático, assim como a presença de um grupo oxigenado ligado ao 3º ou 4º átomos, formam o grupo farmacofórico responsável pela atividade dos opioides.
Em relação à estrutura-atividade dos opioides, além da presença do grupo farmacofórico, a alquilação da hidroxila do anel aromático pode levar à formação de pro-fármacos, como é o caso da codeína, em vista da importância dessa hidroxila para a atividade.
As funções oxigenadas de álcool ou cetona no oxigênio do grupo farmacofórico melhoram a atividade da molécula, enquanto a oxidação da cetona do álcool em R4 e a presença da insaturação no carbono vizinho diminuem a potência. O substituinte R3 hidroxilado é mais ativo que o hidrogênio e a cadeia alquílica da amina terciária, contendo menos que 3 carbonos, implica atividade agonista, entre 3-5 carbonos na atividade antagonista do receptor opioide. Por fim, quando maior que 5 carbonos, a atividade agonista é retornada e com maior potência, devido a maior lipofilicidade e acesso ao SNC (Imagem 66).
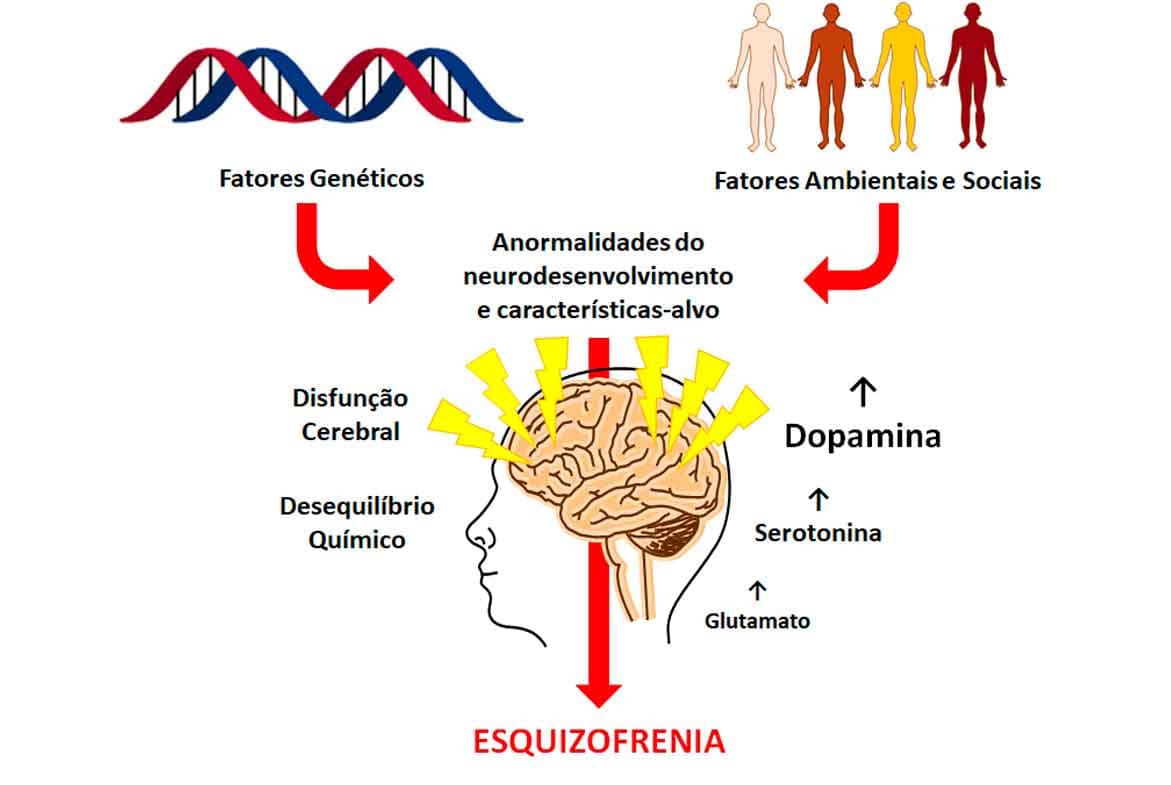
Fisiopatologia dos distúrbios psicóticos
A esquizofrenia é uma forma de psicose crônica caracterizada por ilusões, alucinações e transtornos de fala ou pensamento. Esse distúrbio envolve forte componente genético e reflete uma possível anormalidade bioquímica relacionada à disfunção das vias neuronais dopaminérgicas, serotoninérgicas e/ou glutamatérgicas (Imagem 67).
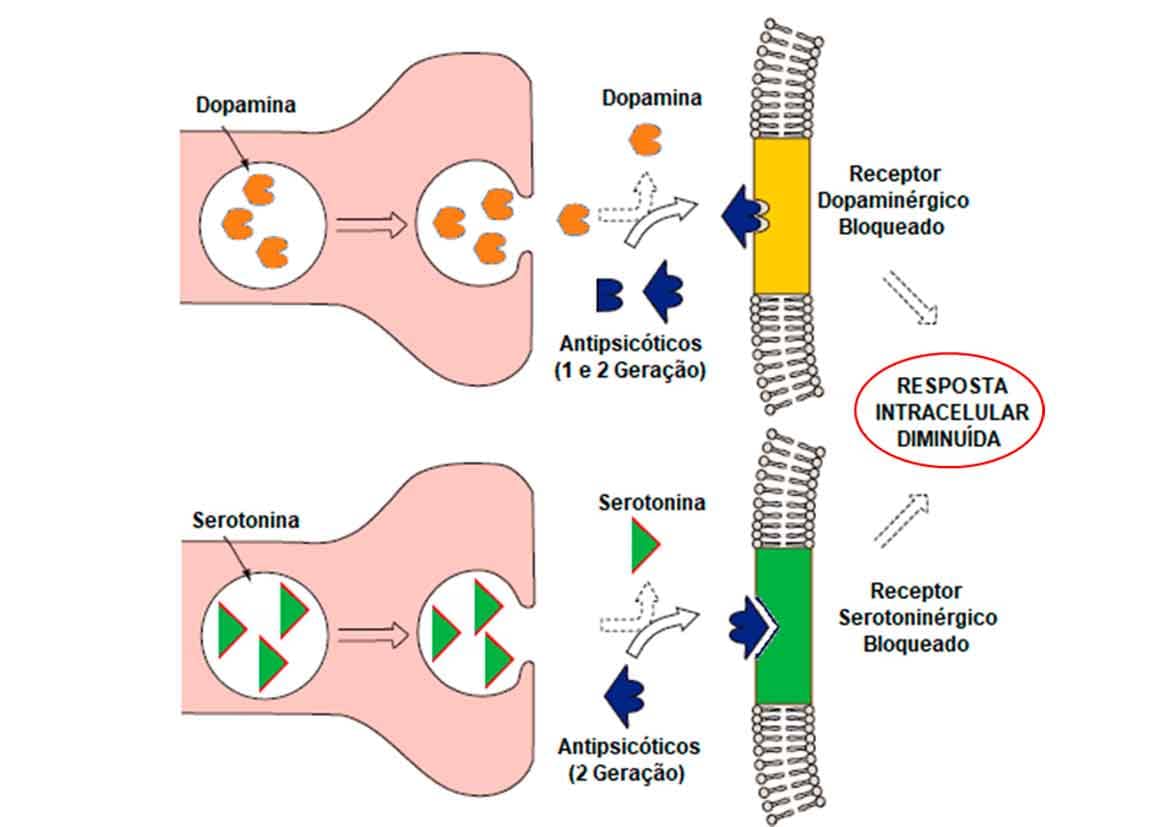
Bases químicas e farmacológicas do mecanismo de ação dos antipsicóticos
Os medicamentos antipsicóticos são utilizados principalmente para tratar esquizofrenia, mas também são eficazes para o tratamento de outros estados psicóticos e distúrbios de mania. Na maior parte dos casos, esses fármacos infelizmente envolvem muitos efeitos adversos graves de difícil manejo, o que merece uma análise criteriosa do risco comparado ao benefício de seu uso.
Os antipsicóticos não curam os distúrbios psicóticos, mas auxiliam na diminuição da intensidade e da frequência das alucinações e ilusões, permitindo que a pessoa conviva minimamente dentro da sociedade.
Os fármacos antipsicóticos são divididos em primeira (típicos) e segunda (atípicos) gerações, sendo a primeira geração subdividida em potência baixa e potência alta. Essa classificação não se relaciona à indicação clínica, mas sim à afinidade pelo receptor dopaminérgico D2, que, por sua vez, influencia os possíveis efeitos adversos relacionados (Imagem 68).

ANTIPSICÓTICOS TÍPICOS
Os antipsicóticos típicos são inibidores competitivos dos receptores dopaminérgicos D2 e, devido à seletividade pelo receptor D2 e ao efeito sobre outros receptores, podem ocasionar transtornos conhecidos como sintomas extrapiramidais (SEP).
ANTIPSICÓTICOS ATÍPICOS
Já os antipsicóticos atípicos antagonizam tanto os receptores dopaminérgicos como os serotoninérgicos e apresentam menor incidência de SEP, entretanto, possuem maiores riscos de eventos adversos metabólicos, como diabetes e hipercolesterolemia.
Como mecanismo de ação, todos os antipsicóticos antagonizam os receptores dopaminérgicos D2, impedindo assim a interação do neurotransmissor dopamina, que se encontra elevado, com o seu receptor, minimizando assim os efeitos de sua ativação. Já a atividade antagônica dos receptores de serotonina, em particular 5-HT2A, exercida pelos antipsicóticos atípicos, minimiza os efeitos psicóticos associados ao neurotransmissor serotonina. Como a atividade desses fármacos ocorre via antagonismo dos dois receptores, isso pode justificar a minimização da síndrome extrapiramidal relacionada ao antagonismo dopaminérgico (Imagem 69).
A relação estrutura-atividade dos antipsicóticos típicos (Imagem 70), contendo o núcleo fenazotiazina, apresenta uma amina terciária protonável passível de interação iônica com o receptor e um anel fenil, que interage com a área plana hidrofóbica do receptor. A distância de dois carbonos é alcançada pela flexão molecular da cadeia lateral, que contém uma ponte de três carbonos (α, β, γ), em direção a um dos anéis de fenil, para aproximar uma distância de dois carbonos. A geometria do anel de fenazotiazina de ângulo alfa próximo a 50° também é importante para a interação com o receptor.
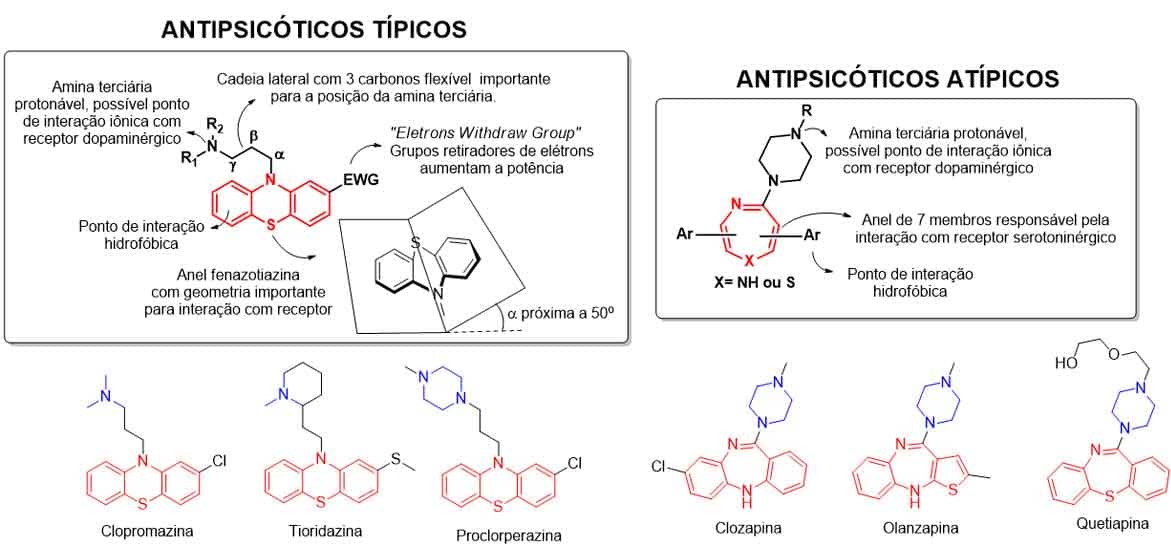
A adição de um grupo retirador de elétrons da posição C2 de um dos anéis aromáticos favorece a interação de hidrogênio, colocando a molécula em uma conformação semelhante à dopamina. O substituinte em C1 é deletério ao efeito antipsicótico e, em C4, diminui a potência, pois interfere na interação do átomo de enxofre do anel fenazotiazina com o receptor. Mais de um substituinte parece reduzir a potência desses fármacos, assim como a oxidação do átomo de enxofre. A cadeia alquílica lateral maior que dois carbonos diminui a potência, assim como substituintes no carbono α.
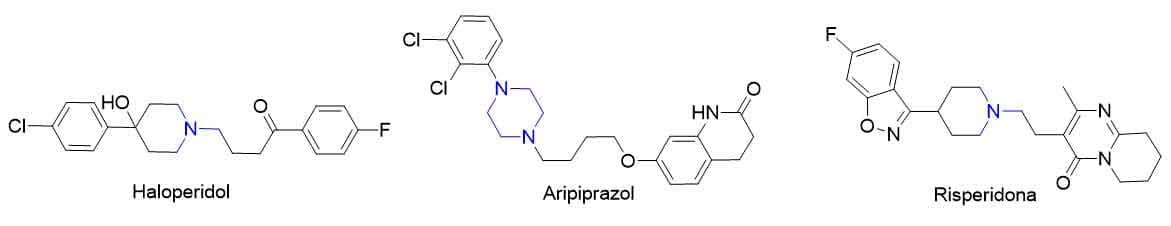
A amina terciária da cadeia lateral apresenta maior potência antagônica dos receptores D2 para o núcleo, piperazina seguida da amina alifática e o núcleo piperidina menos potente. Além disso, o núcleo piperidina da cadeia lateral, como nos antipsicóticos atípicos, parece estar associado a menores efeitos extrapiramidais devido a uma menor potência anticolinérgica desse núcleo, já que tem potência antagônica alta ao receptor D2. Os antipsicóticos contendo anel de 7 membros parecem ter essa estrutura associada ao potencial inibitório dos receptores serotoninérgicos (Imagem 70). As estruturas dos antipsicóticos haloperidol, aripiprazol e risperidona (Imagem 71) apresentam REA específicas, não tendo grandes semelhanças com os fármacos anteriores.
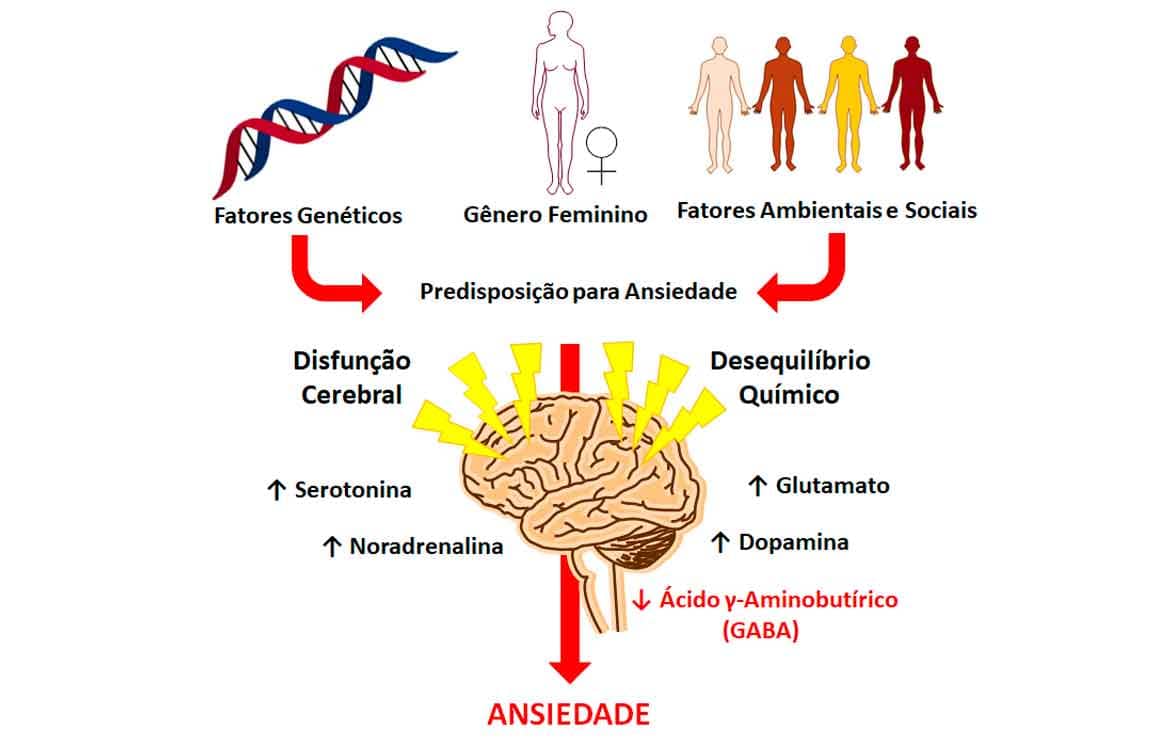
Fisiopatologia da ansiedade e da depressão
Em geral, as desordens neurológicas de ansiedade e depressão estão associadas, isso porque o indivíduo acometido por esses distúrbios tende a oscilar entre crises de ansiedade e crises depressivas.
A patogênese dos transtornos de ansiedade tem como base a resposta ao sistema “luta e fuga” via ativação do sistema nervoso simpático, embora também envolva respostas autonômicas, neuroendócrinas, cognitivas e motoras. O núcleo central da tonsila capta o estímulo excitatório do neurotransmissor glutamato de diversas áreas corticais e do tálamo e, em resposta, a tonsila projeta para muitas áreas cerebrais dos sistemas monoaminérgicos (dopamina, serotonina e noradrenalina), o que provoca as manifestações clínicas comuns da ansiedade, como palpitação, dispneia, náusea, sudorese, tremores, cefaleia, entre outros. Além disso, desequilíbrios químicos associados à diminuição do ácido gama-aminobutírico (GABA), um neurotransmissor depressor do SNC, também está associado ao quadro de ansiedade (Imagem 72).
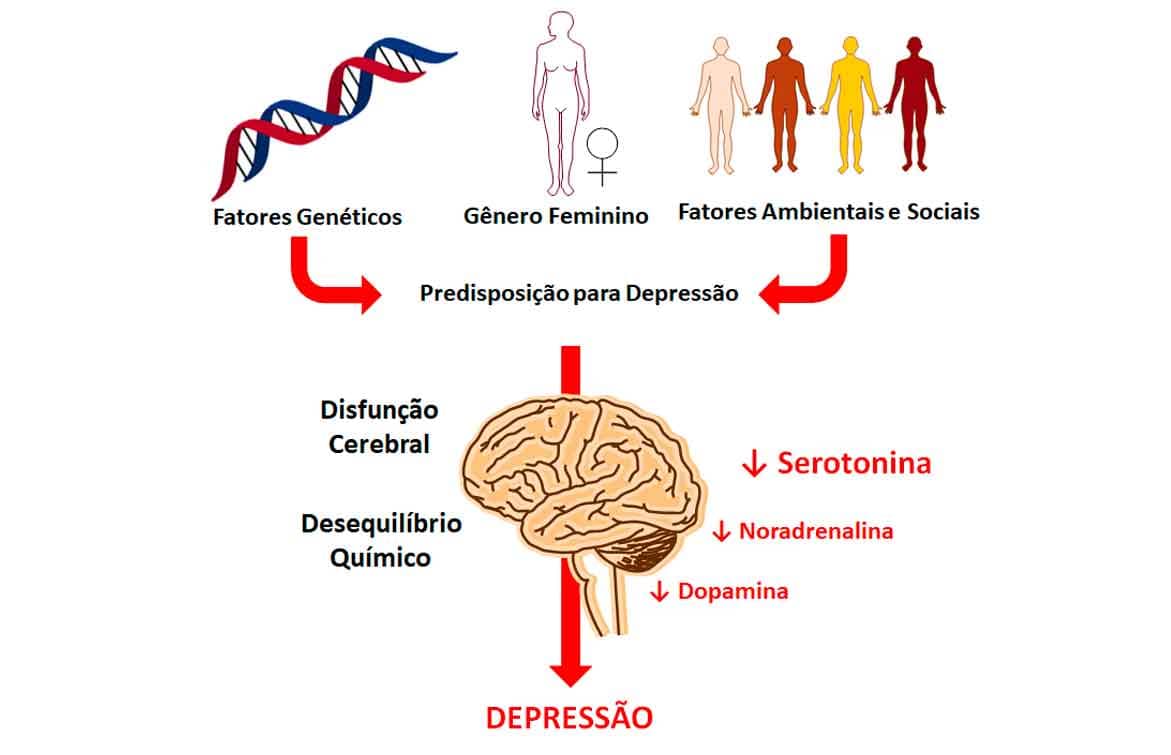
Já a depressão responde por uma fisiopatologia multifuncional, abrangendo fatores biológicos, genéticos e psicossociais.
A hipótese mais aceita envolve os neurotransmissores monoaminérgicos, principalmente as aminas biogênicas serotonina e noradrenalina. Os receptores adrenérgicos β2, nos botões pré-sinápticos, parecem apresentar alterações que resultam na liberação de quantidades reduzidas desses dois neurotransmissores, levando a quadros de alterações de humor, apatia, ganho ou perda de peso, insônia, fadiga, falta de concentração, tristeza e até mesmo ansiedade (Imagem 73).
Em vista da associação entre essas duas desordens, o tratamento farmacológico tende a ser combinado, utilizando tanto medicamentos conhecidos como ansiolíticos quanto antidepressivos.
Bases químicas e farmacológicas do mecanismo de ação dos ansiolíticos
Os benzodiazepínicos (BDZ) são os fármacos de primeira escolha no tratamento dos transtornos de ansiedade. Os BDZ são moduladores de alta afinidade e altamente seletivos aos receptores GABA (do tipo canais de cloreto); ligam-se a um sítio alostérico do receptor, aumentando a afinidade dos receptores pelo GABA e potencializando a neurotransmissão gabaérgica depressora do SNC. Em geral, condições de ansiedade estão associadas a menores concentrações de GABA; dessa forma, os benzodiazepínicos aumentam a frequência de abertura dos canais de cloreto, hiperpolarizando e reduzindo a excitabilidade neuronal, o que leva a efeitos sedativos, hipnóticos, ansiolíticos e até anestésicos (Imagem 74).
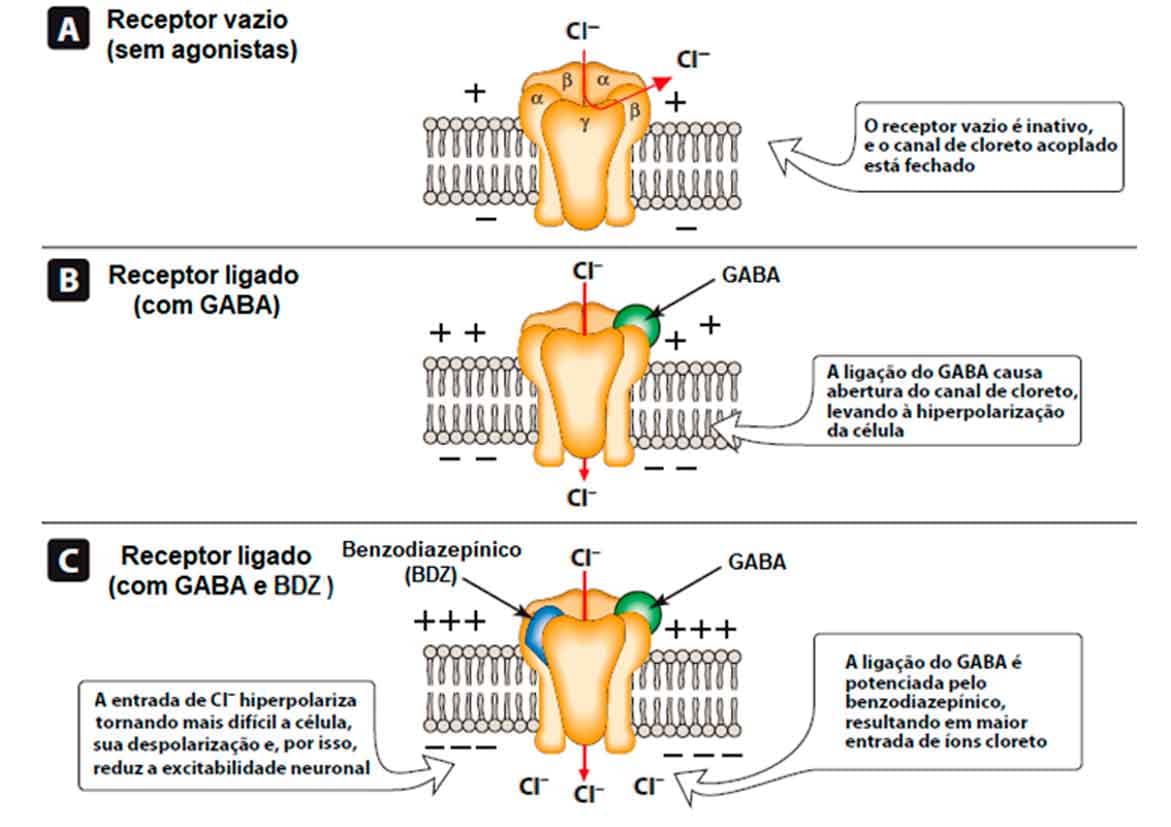
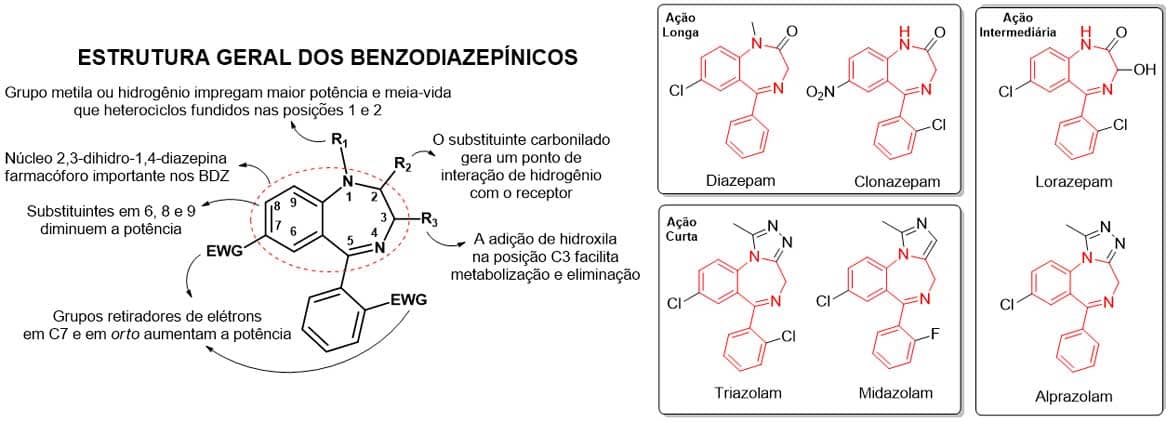
Bases químicas e farmacológicas do mecanismo de ação dos antidepressivos
Graças ao avanço da química medicinal, diversas classes de fármacos podem ser utilizadas como tratamento da depressão. Em geral, variam entre efeitos na degradação das monoaminas endógenas serotonina e noradrenalina (inibidores da monoaminoxidase – IMAO) e inibidores da recaptação de serotonina e noradrenalina (IRSN e antidepressivos tricíclicos) ou inibidores seletivos da receptação de serotonina (ISRS).
O mecanismo de ação geral dos ISRS ocorre sobre a inibição das proteínas de recaptação de serotonina no botão sináptico do neurônio pré-sináptico; isso faz com que moléculas de serotonina permaneçam mais tempo na fenda sináptica, interagindo com seus respectivos receptores pós-sinápticos e gerando seus efeitos antidepressivos (Imagem 76).
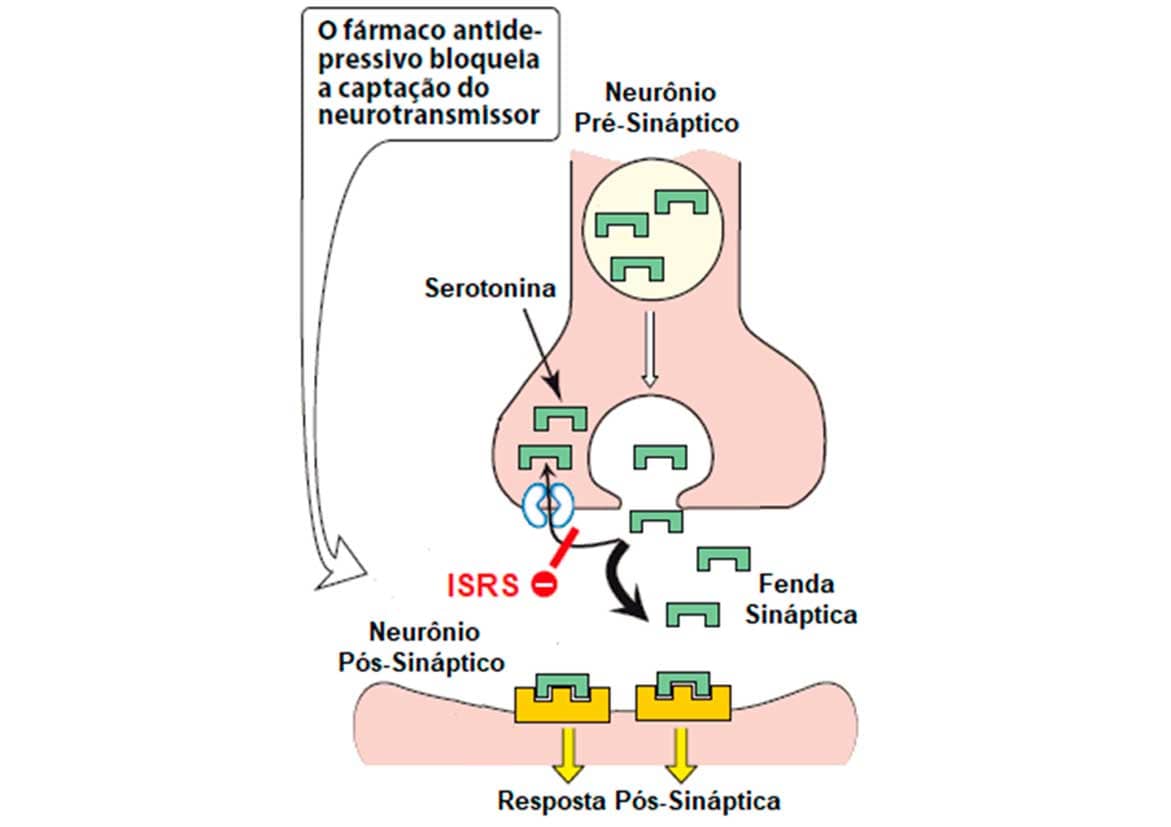
Como a base do tratamento está relacionada à ação do neurotransmissor serotonina, o foco dos estudos de relação estrutura-atividade será os ISRS, considerando o fato de serem bastante utilizados na clínica.
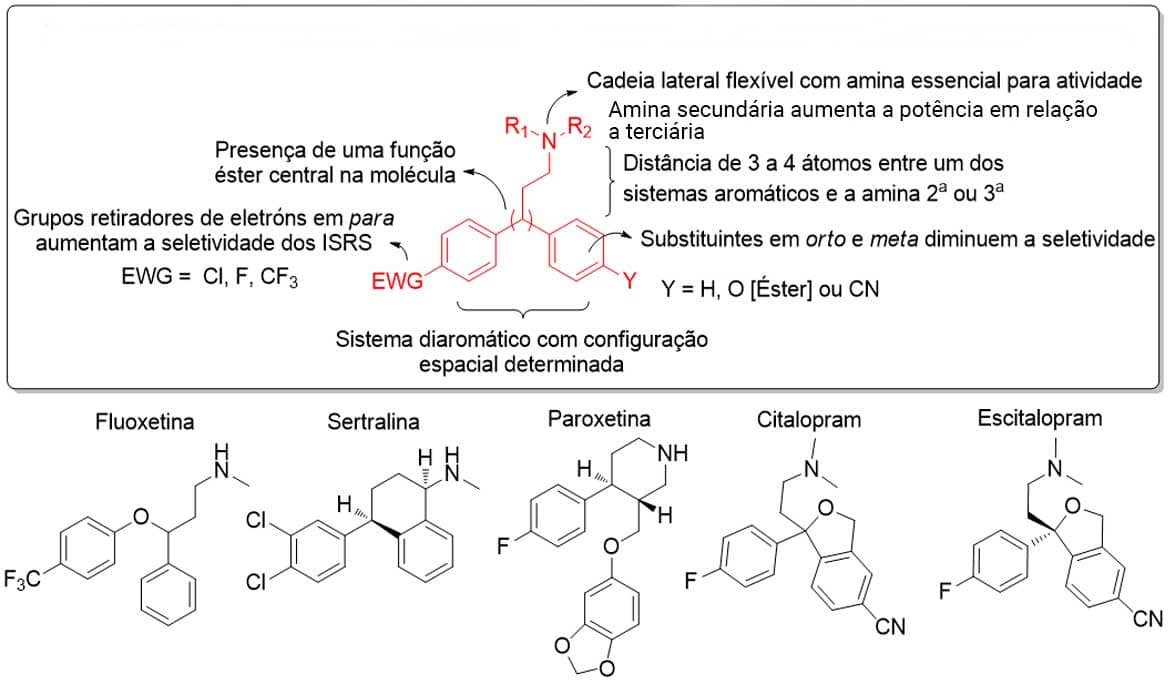
Fármacos neuroativos
O vídeo a seguir fala sobre a estrutura de importantes fármacos neuroativos e sua relação com a atividade farmacológica.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste estudo, foi possível integrar diversos conhecimentos relacionados à Química Medicinal e à Farmacologia, mostrando como o efeito de modificações simples ou complexas sobre uma molécula pode impactar sua relação estrutura-atividade. Isso influencia nas formas de interação com o alvo molecular, aumentando ou diminuindo sua potência e seletividade, e provocando efeitos adversos por meio de interações com outras macromoléculas biológicas e até mesmo com parâmetros farmacocinéticos, como tempo de meia-vida e absorção do fármaco.
Conclui-se que a reatividade química da estrutura do fármaco, dos resíduos de aminoácidos do alvo molecular e suas interações entre si exercem influência direta sobre os efeitos biológicos farmacocinéticos e farmacodinâmicos envolvidos no uso dos fármacos, justificando seu uso para o tratamento de diversas patologias.
Podcast
Agora, a(o) especialista Luiz Augusto Pinheiro Flores Junior encerra o tema fazendo um resumo sobre os tópicos abordados.
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu as propriedades químicas e farmacológicas do mecanismo de ação dos antibióticos beta-lactâmicos
Descreveu as propriedades químicas e farmacológicas do mecanismo de ação dos fármacos cardiovasculares
Descreveu as bases químicas e farmacológicas do mecanismo de ação dos anti-inflamatórios e anti-histamínicos
Descreveu as bases químicas e farmacológicas do mecanismo de ação das principais classes de fármacos neuroativos