Descrição
A Química Orgânica e sua estruturação por meio das ligações químicas, ressonância, polaridade, representação e geometria de suas moléculas; e o átomo de carbono como elemento determinante para a sua identidade como um ramo da ciência Química.
PROPÓSITO
Compreender as características, representações e aplicações das estruturas moleculares baseadas no átomo de carbono — estudo comumente conhecido como Química Orgânica — e reconhecer sua importância para as áreas relacionadas à saúde e engenharia, tendo em vista as múltiplas utilizações de seus compostos.
Preparação
Antes de iniciar o conteúdo, tenha em mãos uma tabela periódica atualizada.
OBJETIVOS
Módulo 1
Reconhecer as diferenças entre Química Orgânica e Inorgânica, o histórico e a importância das moléculas orgânicas
Módulo 2
Identificar a configuração eletrônica das espécies químicas com a dos elétrons presentes na camada de valência
Módulo 3
Reconhecer moléculas orgânicas em suas diferentes representações e o uso adequado das ligações químicas envolvidas em sua construção
Módulo 4
Identificar as diferentes geometrias e o caráter polar ou apolar das moléculas orgânicas de acordo com as configurações de suas estruturas
Introdução
Neste conteúdo, vamos aprender a reconhecer a Química Orgânica, suas aplicações, estruturas e geometria de suas moléculas — conhecimentos fundamentais para a construção e manutenção da vida e para inúmeras áreas, desde a indústria até a geração de energia.
Os campos de aplicação da Química Orgânica, por sua amplitude, tornam os compostos orgânicos uma das classes químicas mais importantes tanto do ponto de vista biológico como econômico e industrial.
Assim, iremos explorar as possibilidades de formação de ligações químicas e demais propriedades que permitem a construção de moléculas orgânicas, visualizando suas geometrias, estruturas, aplicações gerais e representações gráficas necessárias para a sua identificação como entidade química.
MÓDULO 1
Reconhecer as diferenças entre Química Orgânica e Inorgânica, o histórico e a importância das moléculas orgânicas
QUÍMICA E TRANSFORMAÇÃO DA MATÉRIA
A Química é a ciência que busca estudar e entender a transformação da matéria, suas leis, o modo como os átomos se ligam e como essas ligações são desconstruídas para formar novos compostos por meio das reações químicas.
Estamos cercados de transformações químicas por todos os lados. O ato de respirar, as trocas gasosas que ocorrem em nossos pulmões, as reações metabólicas em nosso organismo, a formação e a quebra de proteínas em nosso corpo, a quebra das moléculas que compõem os alimentos no processo digestivo, são todas modificações da matéria que envolvem necessariamente reações químicas.
Mas as transformações químicas que cercam o nosso mundo podem ocorrer tanto em meios biológicos quanto em ambientes não biológicos, ou seja, em ambientes industriais e externos que não estão diretamente ligados aos organismos vivos. Há uma série de transformações cotidianas que não estão envolvidas diretamente com a manutenção da vida, como a queima de combustíveis fósseis, a cura e a secagem do concreto, os processos de refino de metais e a sua oxidação, a produção de polímeros e plásticos industriais, entre inúmeros outros processos.
A Química, como ciência, estabelece leis gerais aplicáveis em todos os casos de transformações químicas, sejam as que envolvem a manutenção da vida, sejam as que não estão relacionadas com essa finalidade.
As regras da Química são válidas para quaisquer tipos de reação.
VITALISMO E ORIGENS HISTÓRICAS DA QUÍMICA ORGÂNICA
Se as leis gerais da Química podem ser aplicadas à toda matéria e suas transformações, por que existe uma chamada de “Química Orgânica”?
Resposta
Por razões históricas, no desenvolvimento da Química como ciência, os primeiros estudiosos da área, em meados do século XVIII, perceberam que compostos provenientes de organismos vivos apresentavam características, propriedades e comportamentos diferentes de substâncias originárias de meios minerais ou meios não orgânicos.
De uma forma geral, os compostos extraídos de animais e plantas apresentam maior dificuldade de isolamento e de purificação e possibilidade de degradação mais acentuada, se comparamos com os compostos de origem não biológica.

No final do século XVIII, mas especificamente em 1770, o químico sueco Torbern Bergman (1735-1784) estudou as diferenças entre os compostos provenientes de seres vivos (compostos orgânicos) e compostos de origem não orgânica (compostos inorgânicos).
De forma errônea, Bergman e outros estudiosos da época acreditavam que os compostos orgânicos não poderiam ser sintetizados em laboratórios por possuírem uma força vital, que impedia a sua reprodução em meios artificiais (desprovidos de vida). A ideia da existência de uma força vital nos compostos de origem em seres vivos foi chamada de vitalismo.
O vitalismo foi abandonado ao longo do século XIX, quando alguns estudiosos começaram a obter moléculas orgânicas utilizando fontes inorgânicas como reagentes. Em 1828, Friedrich Wöhler (1800-1882) sintetizou ureia (composto orgânico presente na urina) utilizando um reagente inorgânico, o cianato de amônio. Essa rota reacional, representada a seguir, ficou conhecida como síntese de Wöhler.

Representação reacional da síntese de Wöhler
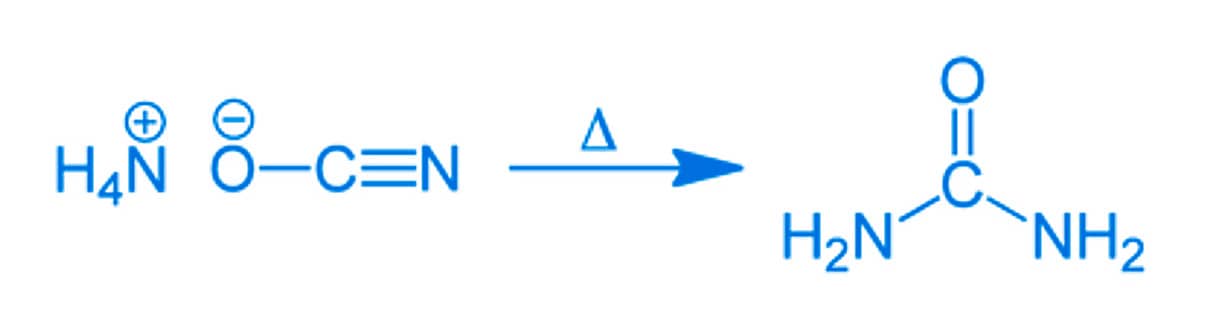
(cianato de amônio) + calor (ureia)
A importância dos compostos baseados no carbono, sua versatilidade e aplicações fizeram surgir uma abordagem científica diferenciada, que recebeu a denominação geral de Química Orgânica. Assim, podemos definir a Química Orgânica como o ramo da Química que estuda os compostos cuja estrutura é formada, principalmente, por átomos de carbono.
Atenção
Muito embora o carbono seja o principal elemento dos compostos orgânicos, a maioria também contém hidrogênio e muitos contêm nitrogênio, oxigênio, fósforo, enxofre, cloro e outros elementos.
Por que motivo o átomo de carbono se configura como peça-chave na Química Orgânica?
Resposta
Porque o carbono é o principal elemento para a formação de moléculas orgânicas. É tão primordial que encontrar compostos de carbono em exoplanetas pode ser um indicativo de vida.
A posição do carbono na família 14 e no segundo período da tabela periódica dos elementos químicos nos ajuda a entender a sua versatilidade e importância.
O carbono possui 6 prótons em seu núcleo e, consequentemente, este é o seu número atômico (Z=6). Além disso, tem massa atômica igual à 12,0107 u. No seu estado fundamental, o carbono possui 4 elétrons em sua camada de valência. É sua organização eletrônica que permite a ocorrência do fenômeno chamado de hibridização de orbitais, o que aumenta a sua capacidade de formar diferentes tipos de ligações: simples, duplas e triplas.
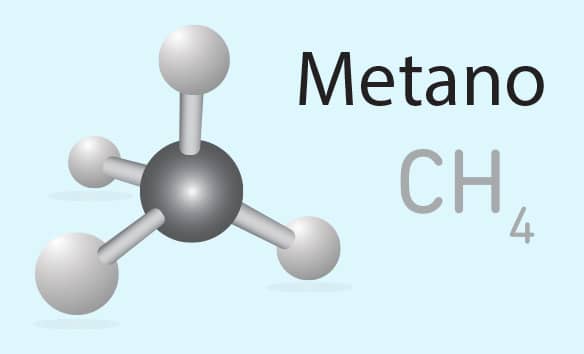
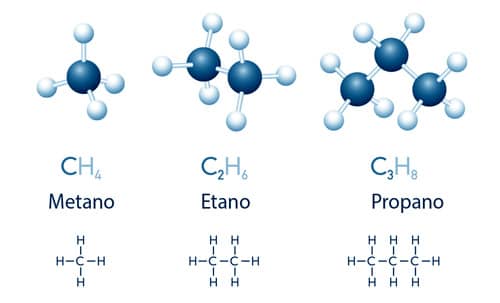
Desde compostos bastante simples que possuem 1 ou 2 átomos de carbono em sua estrutura, como o metano (CH4) e o etano (C2H6), até moléculas complexas como o DNA e o RNA, vitaminas, proteínas, plásticos e seus polímeros, combustíveis fósseis, tintas, vernizes e compostos industriais dos mais diversos possuem em sua composição moléculas orgânicas.
APLICAÇÕES E IMPORTÂNCIA DA QUÍMICA ORGÂNICA
Moléculas orgânicas e seres vivos
Embora a ideia do vitalismo tenha sido abandonada a partir do século XIX, a Química Orgânica é inequivocamente a química da vida. Isso porque encontramos compostos baseados em átomos de carbono em todas as formas de vida, seja como função estrutural (os tecidos que compõem os organismos são constituídos por moléculas orgânicas), seja como função não estrutural (moléculas orgânicas participam dos processos metabólicos dos seres vivos).
Uma teoria bastante aceita para a origem da vida pressupõe que a presença de amônia (NH3), dióxido de carbono (CO2), água, hidrogênio (H2) e gás metano (CH4) na atmosfera primitiva da Terra tenha dado origem às primeiras proteínas através de reações entre esses componentes, quando a atmosfera primitiva era bombardeada por descargas elétricas provenientes de raios.
Experimentos em laboratórios, que buscam reproduzir essa atmosfera embrionária da Terra, tiveram sucesso em obter fragmentos de compostos orgânicos extremamente reativos capazes de se recombinar formando moléculas orgânicas mais complexas, como aminoácidos e proteínas, essenciais para a vida.
O composto metano, presente na atmosfera primordial, é uma das moléculas orgânicas mais simples: possui 1 átomo de carbono central ligado a 4 hidrogênios. Esse composto é utilizado na indústria petroquímica e é o principal componente do gás natural.

Diferentemente da simplicidade apresentada pela molécula do metano, o DNA (ácido desoxirribonucleico), responsável por comandar todas as características genéticas dos seres vivos, apresenta uma estrutura muito mais complexa. O DNA é composto por:
Um carboidrato com cinco átomos de carbono em sua estrutura (pentose, um tipo de açúcar).
Uma base nitrogenada que em sua estrutura comporta tanto átomos de carbono quanto de nitrogênio.
Grupos fosfatos (grupo inorgânico).
Nesse ponto, você já deve ter percebido a importância de algumas moléculas orgânicas para a vida e a diferença de complexidade entre elas. Mas outras moléculas orgânicas estão presentes no nosso dia a dia, como a cafeína (C8H10N4O2) e a teobromina (C7H8N4O2), contidas no chocolate. Os compostos orgânicos também constituem as drogas legalizadas, como o etanol (C2H5OH) e a nicotina (C10H14N2), e as drogas ilícitas, como a cocaína (C17H21NO4) e o LSD-dietilamina de ácido lisérgico (C20H25N3O).
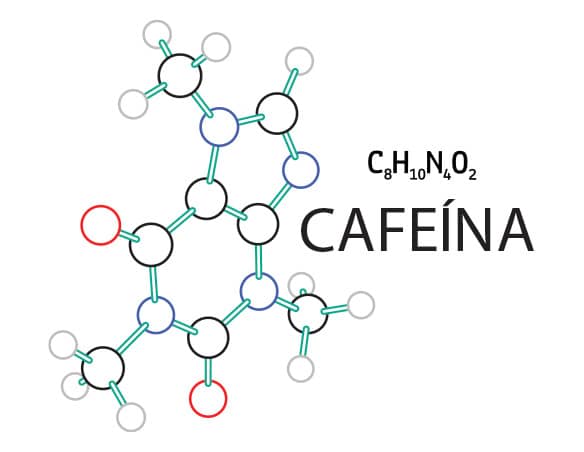
Molécula orgânica da cafeína, estimulante presente no café.
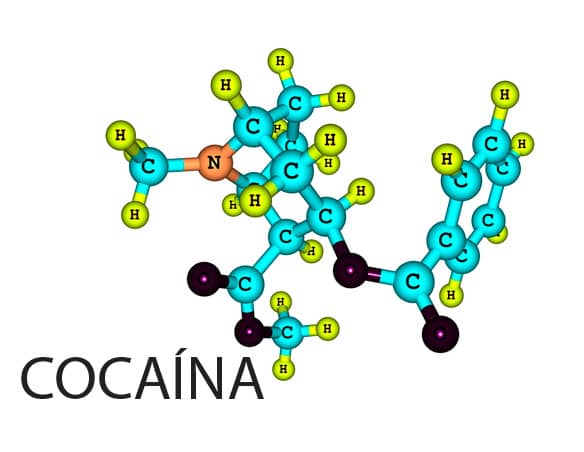
Molécula orgânica da droga ilícita cocaína.
Moléculas orgânicas derivadas do petróleo
Além das moléculas orgânicas diretamente ligadas à vida ou à sua manutenção, existem as moléculas presentes em “compostos artificiais”, como os combustíveis derivados do petróleo, e em produtos da indústria petroquímica, como os plásticos, que são polímeros industriais com longa cadeia molecular baseada em carbono.
Saiba mais
Esses compostos, normalmente de baixo custo, ao mesmo tempo apresentam versatilidade de usos para a vida moderna, mas também lançam desafios para a sua reciclagem e reaproveitamento.
Vejamos o petróleo, por exemplo. Ele é uma mistura complexa de compostos orgânicos. Nessa grande mistura de moléculas orgânicas, existem desde compostos com apenas 1 carbono, como o metano, até compostos de cadeias mais longas com 20, 30 ou mais carbonos em sua estrutura. O processo de destilação do petróleo dá origem aos combustíveis fósseis como a gasolina, o diesel e o querosene. Esses combustíveis, por sua vez, também são misturas mais leves e menos complexas de moléculas orgânicas, adequadas ao processo de combustão. As transformações das moléculas orgânicas presentes no petróleo dão origem a uma série de produtos da indústria petroquímica que vão além dos combustíveis fósseis.

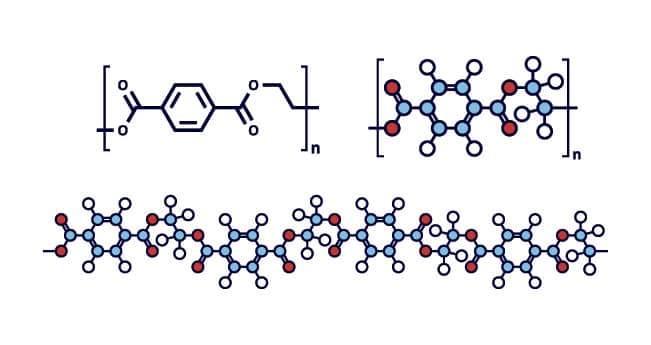
Também originários do petróleo, os diferentes plásticos são materiais classificados como orgânicos, tendo em vista que têm a sua estrutura molecular baseada no átomo de carbono. Esses materiais orgânicos, provenientes dos processos industriais de produção de polímeros não biodegradáveis, provocam enormes problemas de poluição, sobretudo nos mares.
Saiba mais
Polímero é uma molécula com uma cadeia praticamente “infinita”, onde determinados grupamentos químicos se repetem “n” vezes. Por esse motivo, a massa molecular de um polímero é bastante elevada. O PET, por exemplo, tem a fórmula molecular representada por (C10H8O4)n, ou seja, uma cadeia orgânica com 10 carbonos apresenta um número “n” de repetições, estruturando dessa forma o composto polimérico. Os segmentos com 10 carbonos do PET são chamados de “monômeros”.

Um dos materiais plásticos mais utilizados pelo homem atualmente é o polímero orgânico polietileno tereftalato (PET), principalmente na produção de recipientes para o armazenamento de alimentos, sobretudo garrafas plásticas para bebidas. Embora apresente as vantagens de baixo custo, baixo peso das embalagens, facilidade no transporte e resistência mecânica adequada ao seu propósito, o PET representa atualmente um sério problema ambiental em razão de seus baixos índices de reciclagem. As garrafas e embalagens PET não recicladas são descartadas inadequadamente e levadas pelos fluxos de água, acumulando-se em praias, ilhas e oceanos.
QUÍMICA ORGÂNICA: A QUÍMICA DA VIDA
Agora, o especialista apresentará a importância da Química Orgânica, bem como exemplos de moléculas importantes para a vida tanto no desenvolvimento no campo das ciências da saúde, como no ramo industrial e da engenharia química.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar a configuração eletrônica das espécies químicas com a dos elétrons presentes na camada de valência
ESTRUTURA DO ÁTOMO E FORMAÇÃO DE ÍONS
Tudo o que existe ao nosso redor é formado por matéria. A matéria, por sua vez, compreende um número enorme de átomos que se conjugam através de ligações chamadas de ligações químicas.
Mas por que os átomos se ligam? Qual a justificativa para que a matéria não passe de um grande volume de átomos dispersos e flutuando no universo?
Resposta
Para começarmos a responder a essas perguntas, devemos compreender como é a estrutura do átomo. Existem partículas subatômicas com cargas positivas, negativas e neutras que dão a identidade aos diferentes átomos. A maioria dos átomos, quando tratados isoladamente, não possuem estabilidade como entidade química e, então, busca se conjugar a outros átomos através de ligações para formar compostos estáveis.
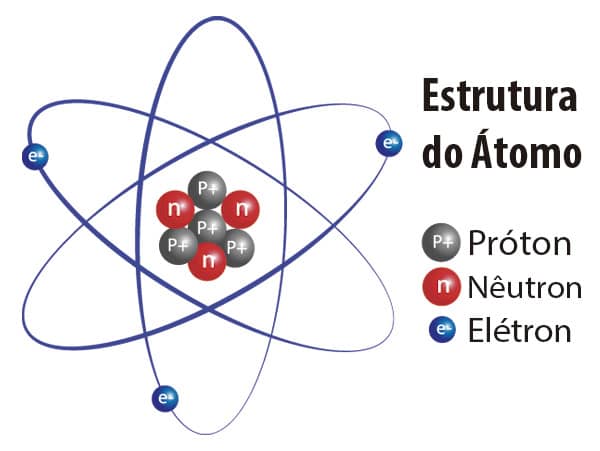
O modelo atômico simplificado, adotado atualmente, descreve o átomo em duas regiões principais: no núcleo e na região extranuclear.
Núcleo
Toda a carga positiva e praticamente toda a massa do átomo. Possui duas partículas: os nêutrons (sem carga) e os prótons (carga positiva).
Região extranuclear
O restante do átomo. Composta de elétrons que são partículas com carga negativa.

O número atômico (Z) de um determinado elemento químico configura a identidade do elemento, tendo em vista que representa a quantidade de prótons em seu núcleo. Em um átomo neutro, o número de elétrons na região extranuclear é igual ao número de prótons presentes no núcleo.
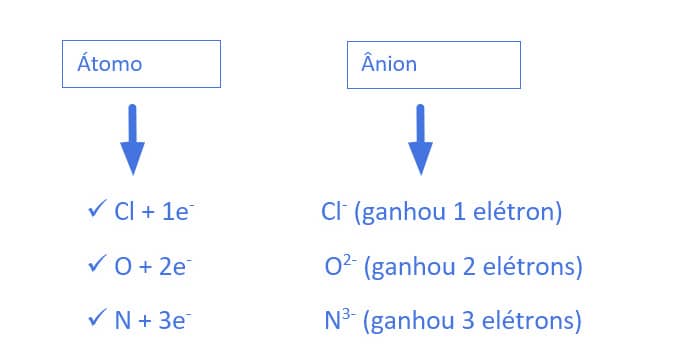
Um átomo, no entanto, pode adquirir carga geral positiva ou negativa. O aparecimento de uma carga se dá pelo ganho ou pela perda de elétrons na região extranuclear.
Os íons são partículas carregadas positivamente ou negativamente.
Escolha um dos ítens a seguir.
Ocorre pela perda de elétrons. É chamado de cátion.

Ocorre pelo ganho de elétrons. É chamado de ânion.
ORGANIZAÇÃO ELETRÔNICA DOS ELÉTRONS NA REGIÃO EXTRANUCLEAR
Neste ponto, é importante salientar que os elétrons que se encontram na região extranuclear são distribuídos de acordo com regras bem estabelecidas e não de forma aleatória.
Para começarmos a entender os mecanismos de ligação química e, mais adiante, as ligações envolvidas nas moléculas orgânicas, precisamos entender como os elétrons se encontram em um átomo.
Embora haja a limitação imposta pelo Princípio de Incerteza de Heinsenberg, podemos descrever, em termos práticos, como se encontram os elétrons na camada extranuclear. Essa descrição é dada por um conjunto de informações relacionadas aos números quânticos dos elétrons.
Saiba mais
Em 1927, o físico alemão Werner Heisenberg desenvolveu uma relação importante que mostra a existência de uma limitação rígida e natural em nossa capacidade de aprender e descrever o movimento de partículas extremamente pequenas. O Princípio de Incerteza de Heinsenberg estabelece que é impossível conhecer simultaneamente e com certeza a posição e o momento de uma pequena partícula como um elétron.
Existem quatro números quânticos e cada um está relacionado a uma informação referente aos elétrons presentes no átomo. Vamos aos números quânticos!
Números quânticos
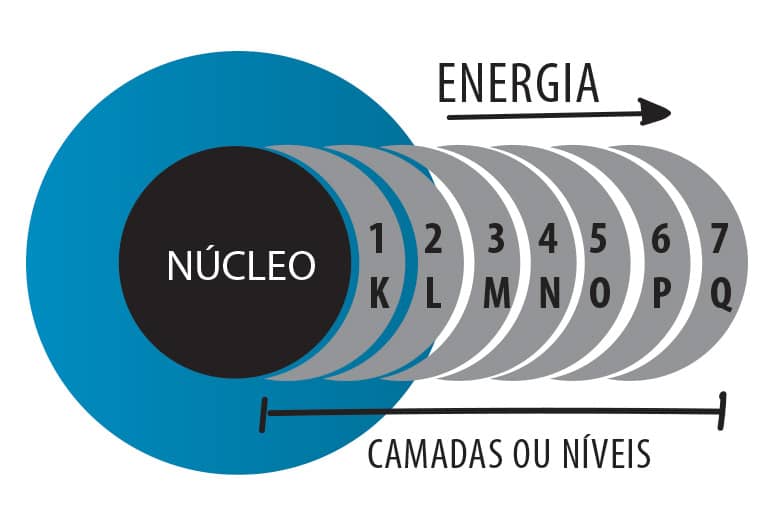
Número quântico principal (n) — Camadas ou níveis
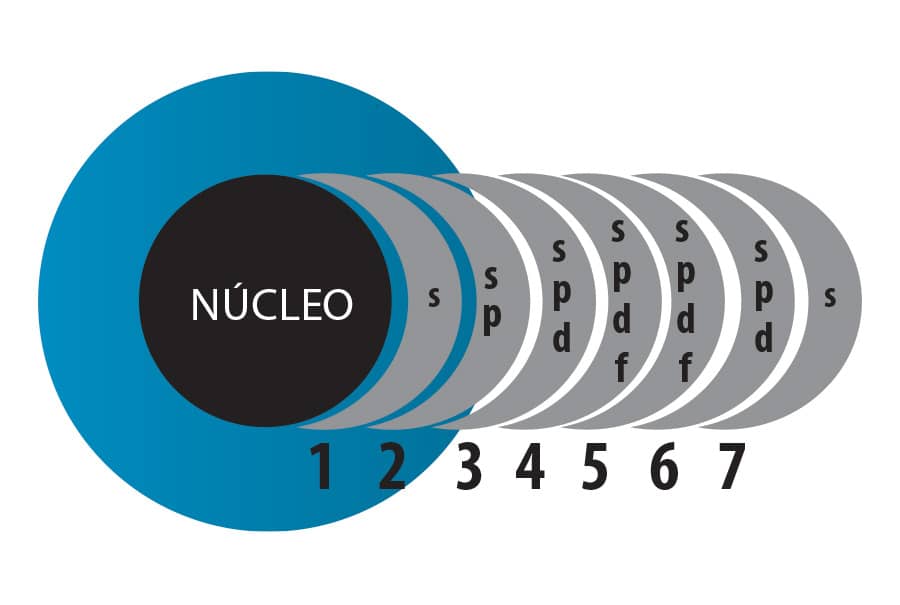
As camadas eletrônicas de um átomo representam o número quântico principal, n. Existem sete camadas eletrônicas, dentro das quais se acomodam os elétrons ao redor do núcleo. Estas camadas são representadas por letras e possuem um número quântico correspondente: K (n=1), L (n=2), M (n=3), N (n=4), O (n=5), P (n=6) e Q (n=7), sendo K a camada mais próxima do núcleo e Q a camada mais distante.
Número quântico secundário ou azimutal (ℓ) — As subcamadas
As subcamadas são agrupamentos dos orbitais dentro dos quais se encontram os elétrons. Cada camada eletrônica contém uma ou mais subcamadas.
As subcamadas necessárias para agrupar os orbitais nos átomos em seus estados fundamentais são descritas pelas letras s, p, d e f. Nas camadas “n”, há subcamadas, como mostra a imagem a seguir:
|
Camada energética (“n”) |
Subcamadas presentes nas camadas eletrônicas dos átomos em seus estados fundamentais (“ℓ”) |
|||
|
1 |
s |
|
||
|
2 |
s |
p |
|
|
|
3 |
s |
p |
d |
|
|
4 |
s |
p |
d |
f |
|
5 |
s |
p |
d |
f |
|
6 |
s |
p |
d |
|
|
7 |
s |
|||
Cada subcamada corresponde a um número quântico secundário específico (“ℓ”) e acomoda um número máximo de elétrons. Assim, temos:
|
Número quântico secundário (“ℓ”) |
Subcamada correspondente |
Número máximo de elétrons |
|
0 |
s |
2 |
|
1 |
p |
6 |
|
2 |
d |
10 |
|
3 |
f |
14 |
Neste ponto, devemos abordar um conceito importante para a distribuição dos elétrons: o subnível. Ele é identificado pela subcamada e pelo nível em que se encontra um determinado elétron, por exemplo:
Subnível 1s → camada 1 (K), subcamada s
Subnível 2p → camada 2 (L), subcamada p
Subnível 4d → camada 4 (N), subcamada d
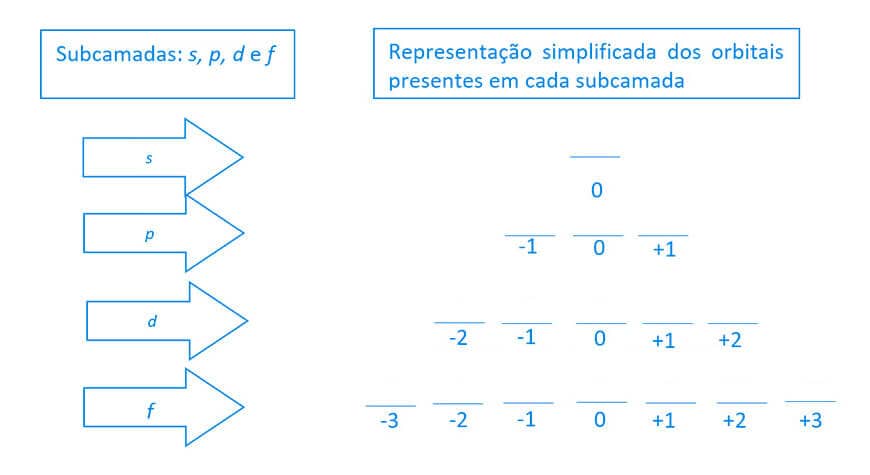
Número quântico magnético (mℓ) — Os orbitais
Os orbitais correspondem aos estados individuais que podem ser ocupados pelo elétron em um átomo. O número quântico magnético que representa esses orbitais varia de - ℓ à +ℓ.
Para fins de simplificação e compreensão inicial, os orbitais presentes em cada subcamada serão representados graficamente conforme a figura a seguir. Observe que na parte inferior dos orbitais estão descritos os seus respectivos números quânticos magnéticos (mℓ):
Número quântico spin (ms)
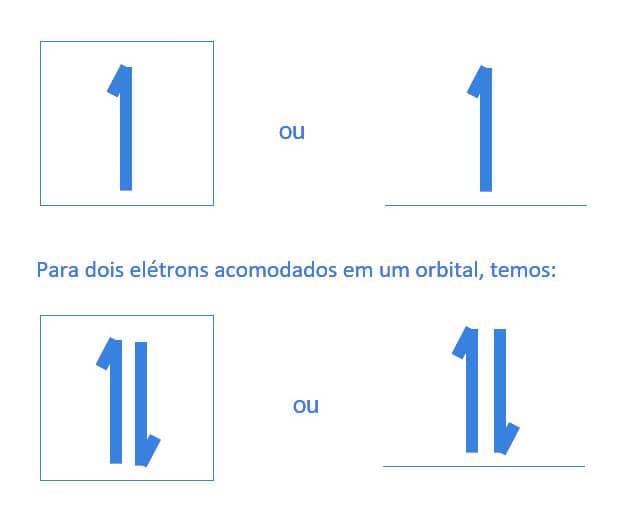
Refere-se à rotação de um elétron em um orbital. Um elétron pode ter uma rotação anti-horária ou horária. Ao se acomodar dois elétrons em um único orbital, estes devem ter spins opostos, para minimizar a repulsão, tendo em vista que ambos possuem carga negativa.
O elétron em um orbital é representado de forma simplificada por uma “meia seta” orientada para cima (ms = +1/2) ou para baixo (ms = -1/2).
Considerando um elétron no orbital e o seu spin, temos a seguinte representação:
Agora que já vimos como a região extranuclear é organizada, vamos entender como os elétrons estão ali distribuídos.
Distribuição eletrônica
Os elétrons são acomodados nos subníveis por ordem crescente de energia. O Diagrama de Pauling mostra a ordem de preenchimento, conforme a figura a seguir.
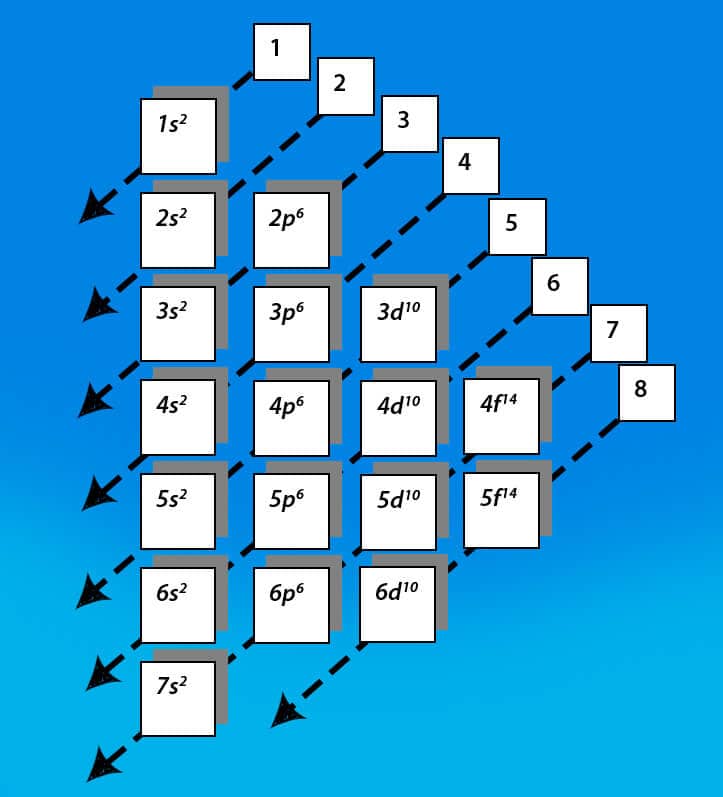
Utilizando o Diagrama de Pauling, é fácil estabelecer um ordenamento dos elétrons na região extranuclear. Observe que há oito diagonais, ordenadas de 1 até 8. Essas diagonais, representadas por setas, “cortam” os subníveis (representados pela camada, pela subcamada e por seu número máximo de elétrons). Cada uma das oito diagonais representa um nível crescente de energia. Obedecendo a sequência crescente das diagonais de 1 até 8, temos a seguinte ordem de preenchimento eletrônico na região extranuclear:

Vamos verificar agora como fica a distribuição eletrônica na região extranuclear para átomos neutros e a representação dos elétrons nos orbitais com os seus spins. Veja os exemplos a seguir.
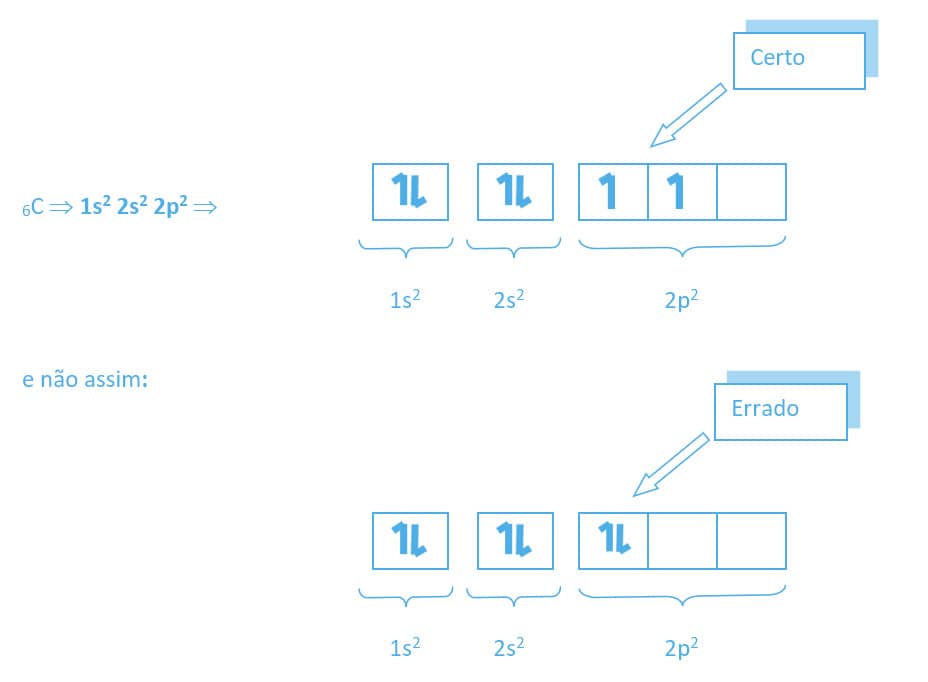
Para um átomo neutro, deve-se contabilizar seus elétrons e distribuí-los de acordo com a ordem de preenchimento do diagrama energético. O preenchimento nos orbitais eletrônicos deve observar a Regra de Hund.
Regra de Hund
Segundo a Regra de Hund, os elétrons numa mesma subcamada tendem a permanecer desemparelhados (em orbitais separados) com spins paralelos.
A distribuição do átomo de carbono deve ser assim:
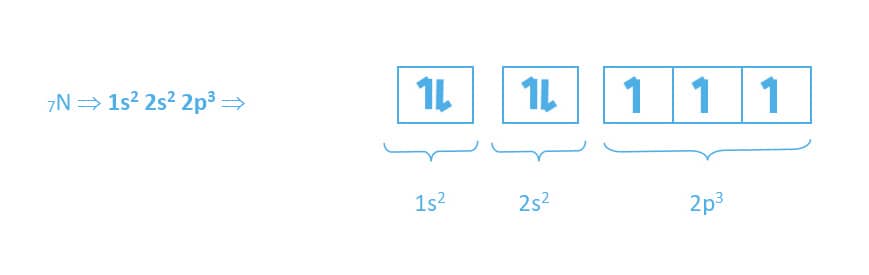
O elemento nitrogênio possui sete elétrons em sua região extranuclear que serão distribuídos da seguinte forma:
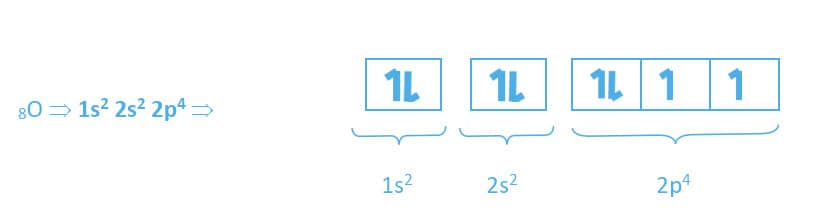
Para o elemento oxigênio, considerando um átomo neutro, há oito elétrons em sua região extranuclear que serão distribuídos da seguinte forma:
Modelos de ligação química
A partir do entendimento da distribuição eletrônica em seus subníveis, devemos nos deter nos elétrons da camada de valência e ter em vista que as ligações químicas ocorrem envolvendo os elétrons que se localizam na camada de valência.
Existem três modelos atualmente aceitos para a ligação química: a ligação iônica, a ligação metálica e a ligação covalente.
Resumidamente, cada modelo de ligação química tem as seguintes características:
Clique nos cards a seguir.
Ocorre entre íons e é explicada, de uma forma simplificada, pela atração eletrostática entre as espécies de cargas opostas, isto é, cátions e ânions. Este modelo é aplicado aos elementos metálicos que se ionizam formando cátions e aos ametais que, quando se ionizam, formam ânions.
Ocorre entre os elementos metálicos. Por este modelo, os núcleos metálicos dos participantes da ligação, carregados positivamente, encontram-se “mergulhados” na região extranuclear coletiva dos átomos presentes, carregados negativamente com seus elétrons. Assim, há uma estabilização mútua dos núcleos com os elétrons envolvendo todos os átomos participantes.
Ocorre quando um ou mais átomos participantes compartilham pares de elétrons, de forma que passam a integrar simultaneamente as camadas de valência dos átomos presentes na ligação até que haja estabilidade eletrônica. Esse tipo de ligação envolve os átomos dos ametais. As ligações covalentes são as responsáveis por estruturar as moléculas orgânicas.
Para fins de entendimento das ligações envolvidas nas moléculas orgânicas, no próximo módulo exploraremos com maiores detalhes as características das ligações covalentes.
DISTRIBUIÇÃO ELETRÔNICA, LIGAÇÕES QUÍMICAS E A REGRA DO OCTETO
Mas, antes, o especialista apresentará a relação entre a configuração dos elementos e sua estabilidade, relacionando-a com a formação de ligações químicas.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer moléculas orgânicas em suas diferentes representações e o uso adequado das ligações químicas envolvidas em sua construção
LIGAÇÃO COVALENTE NAS MOLÉCULAS ORGÂNICAS E REPRESENTAÇÕES DE LEWIS E KEKULÉ
Para compreendermos como a ligação química covalente se estabelece, precisamos visualizar os elétrons de valência dos átomos que participarão da ligação. Para isso, utilizaremos uma representação denominada “estrutura de Lewis”.
A estrutura de Lewis de um átomo utiliza o símbolo químico desse átomo cercado de seus elétrons de valência representados por “·”
Vejamos as estruturas de Lewis para o hidrogênio (H), carbono (C), nitrogênio (N), oxigênio (O) e cloro (Cl):
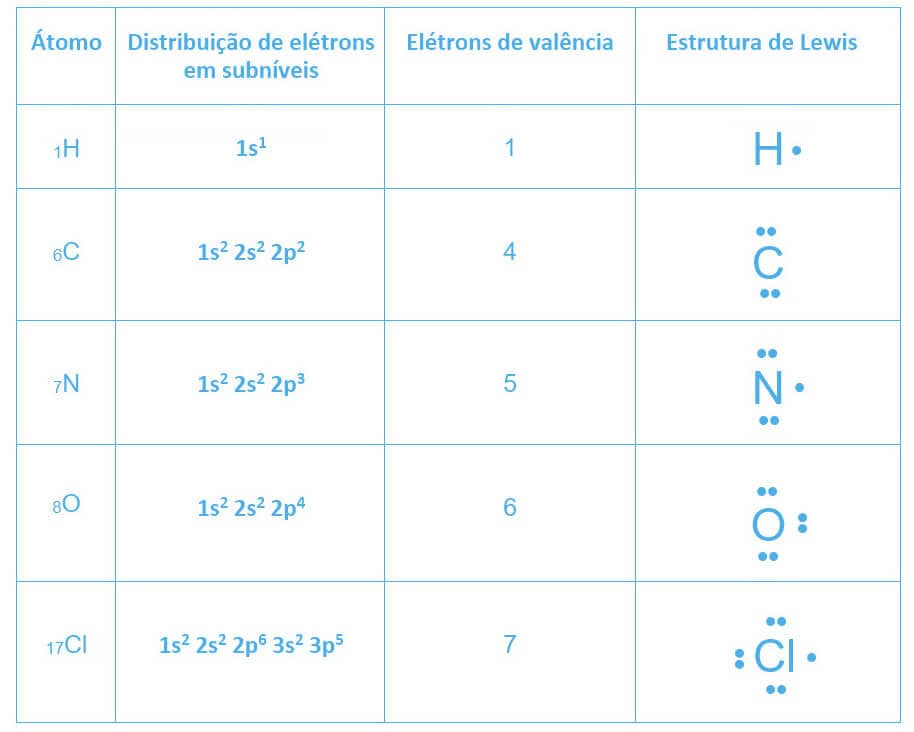
Esses elétrons, representados nas estruturas de Lewis, serão compartilhados com outros átomos, formando pares eletrônicos até que as camadas de valência de cada participante alcancem 8 elétrons (Regra do Octeto).
As estruturas de Lewis representam átomos e seus elétrons, além dos compostos formados pela ligação entre esses átomos. Assim, podemos representar alguns compostos covalentes utilizando estruturas de Lewis. Vejamos alguns exemplos:
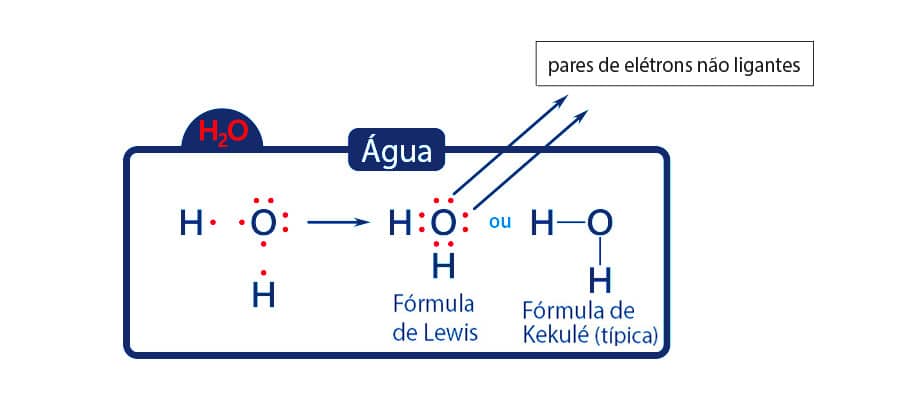
Na molécula da água, o oxigênio apresenta 6 elétrons de valência, necessitando de 2 elétrons para a estabilização eletrônica. Cada hidrogênio ligado ao oxigênio fica estabilizado compartilhando seu único elétron.
Observe que na molécula de água, há 2 pares de elétrons que participam da ligação entre o oxigênio e o hidrogênio e há também 2 pares de elétrons na camada de valência do oxigênio que não estão ligados a nenhum átomo. Esses pares que não participam da ligação são chamados de pares de elétrons não ligantes.
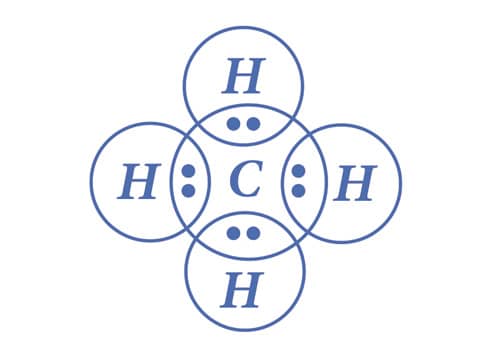
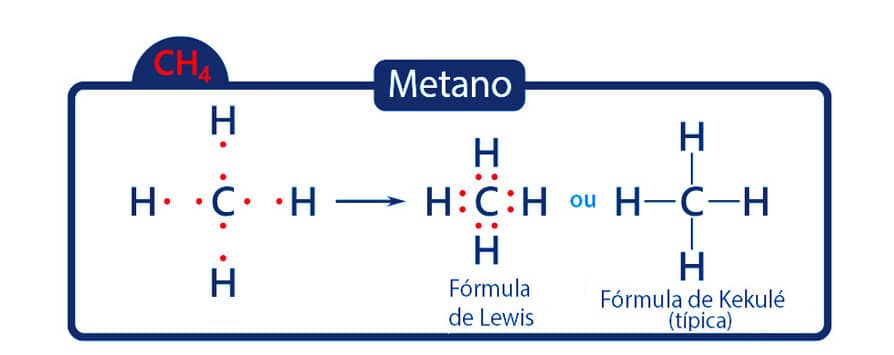
Na molécula de metano, temos o carbono como o átomo central. E como o carbono apresenta 4 elétrons em sua camada de valência, para alcançar o octeto, compartilha cada um deles com 1 elétron de átomos de hidrogênio, formando 4 ligações covalentes.
No caso do metano, todos os pares de elétrons participam das ligações.
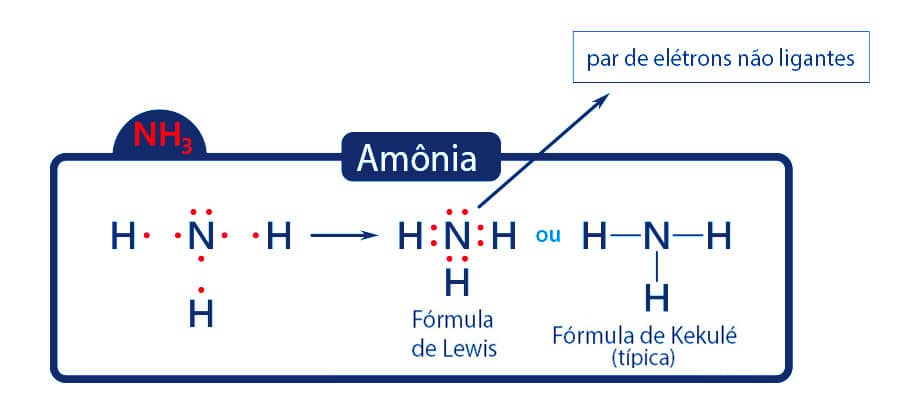
O nitrogênio apresenta 5 elétrons em sua camada de valência, necessitando de 3 ligações covalentes para alcançar o octeto.
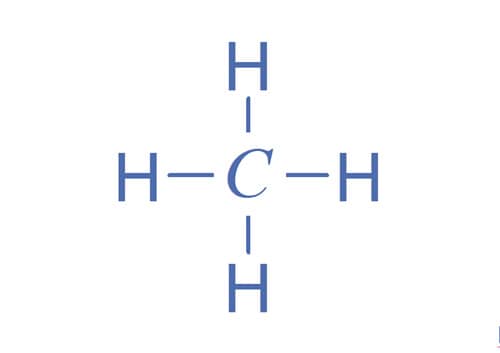
As ligações covalentes podem ser representadas por traços e levam a uma fórmula típica e plana de um composto. A representação por traços também é chamada de fórmula de Kekulé.
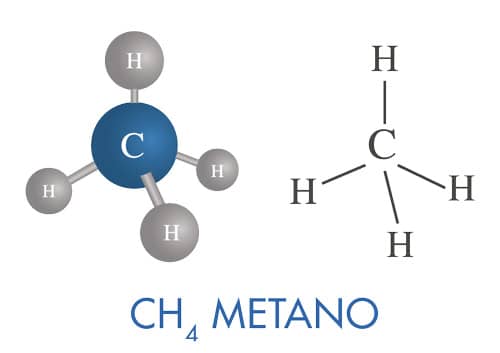
As representações de Lewis e de Kekulé mostram as moléculas de forma plana. Entretanto, as moléculas têm uma geometria tridimensional, como apresentado na figura.
Agora que vimos como as ligações covalentes são representadas, vamos estudar mais profundamente como são formadas.
TEORIA DA LIGAÇÃO DE VALÊNCIA (LV)
Com base no entendimento de que os orbitais são regiões do espaço que os elétrons ocupam, a teoria de ligação de valência (LV) prevê que uma ligação química covalente é decorrente da sobreposição de densidades eletrônicas de dois átomos, e esta sobreposição é o resultado da interferência construtiva dos seus orbitais. Vejamos como isso ocorre, especialmente com os orbitais s e p.
Espacialmente, a maior probabilidade de se encontrar um elétron num orbital s é em uma “nuvem eletrônica” descrita como uma esfera.
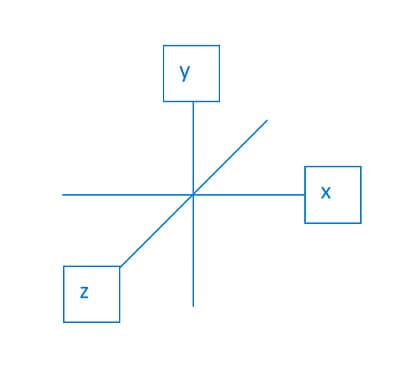
Os orbitais p, por sua vez, apresentam a região mais provável para encontrar os elétrons distribuída em “lóbulos” localizados nos três eixos geométricos. Os elétrons da subcamada p estão distribuídos nessa região. Cada lóbulo que se encontra nos eixos x, y e z são denominados, respectivamente, px py e pz.
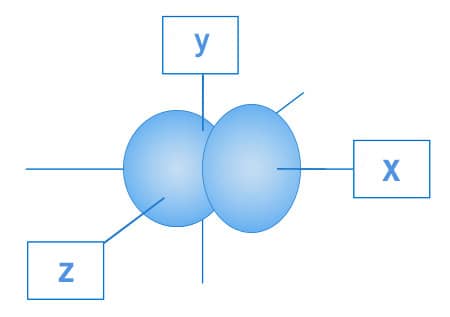
Representação espacial do orbital px.
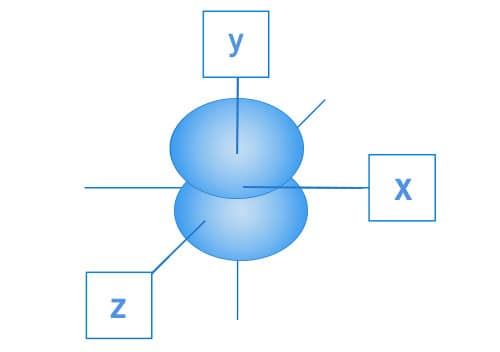
Representação espacial do orbital py
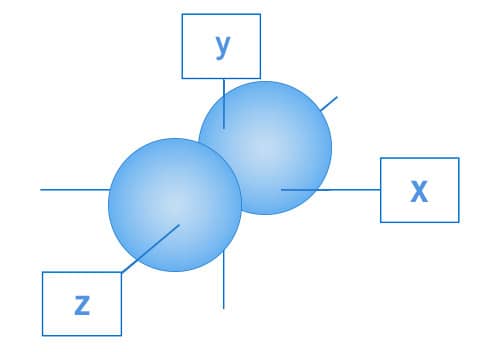
Representação espacial do orbital pz
De acordo com a teoria LV, os elétrons p que participarão da ligação covalente se encontram nos orbitais descritos geometricamente nos eixos x, y e z nos seus respectivos átomos. Para realizar uma ligação covalente, esses orbitais dos átomos participantes devem se sobrepor, compartilhando os elétrons numa região comum aos dois átomos. Isso também é válido para elétrons que se encontram nos orbitais s.
Assim, a ligação covalente ocorre entre os pares de elétrons que se encontrarão na região de sobreposição dos orbitais dos átomos participantes.
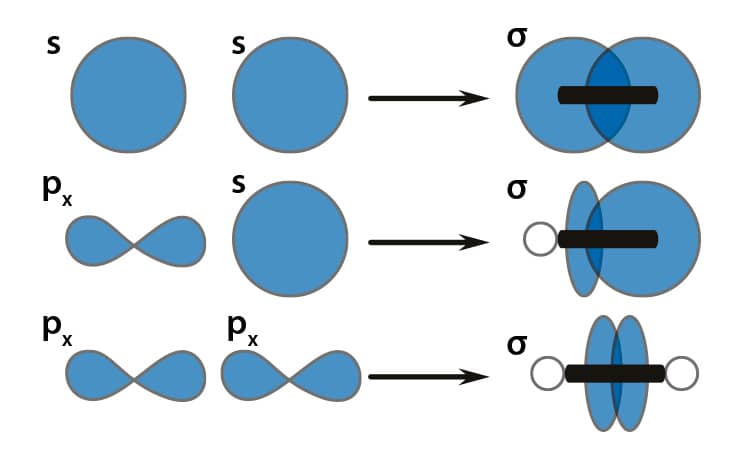
Uma ligação simples é realizada por apenas 1 compartilhamento do par de elétrons na região sobreposta dos orbitais dos átomos participantes. A ligação simples apresenta uma sobreposição de orbitais axial e é denominada ligação sigma, σ.
Veja o exemplo para uma molécula de gás hidrogênio, H2, com a formação de uma ligação σ.
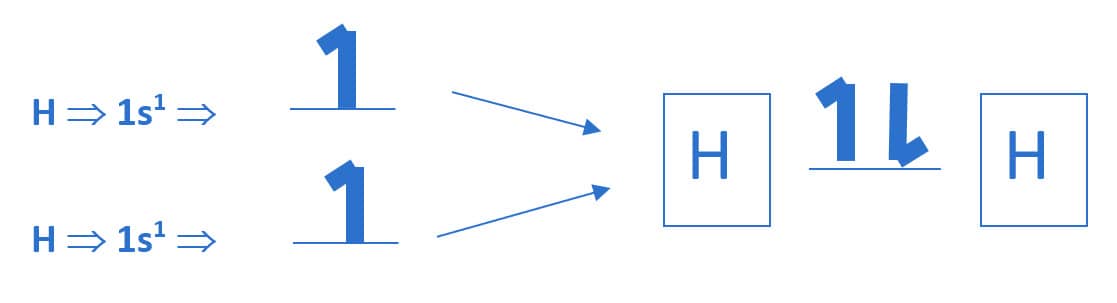
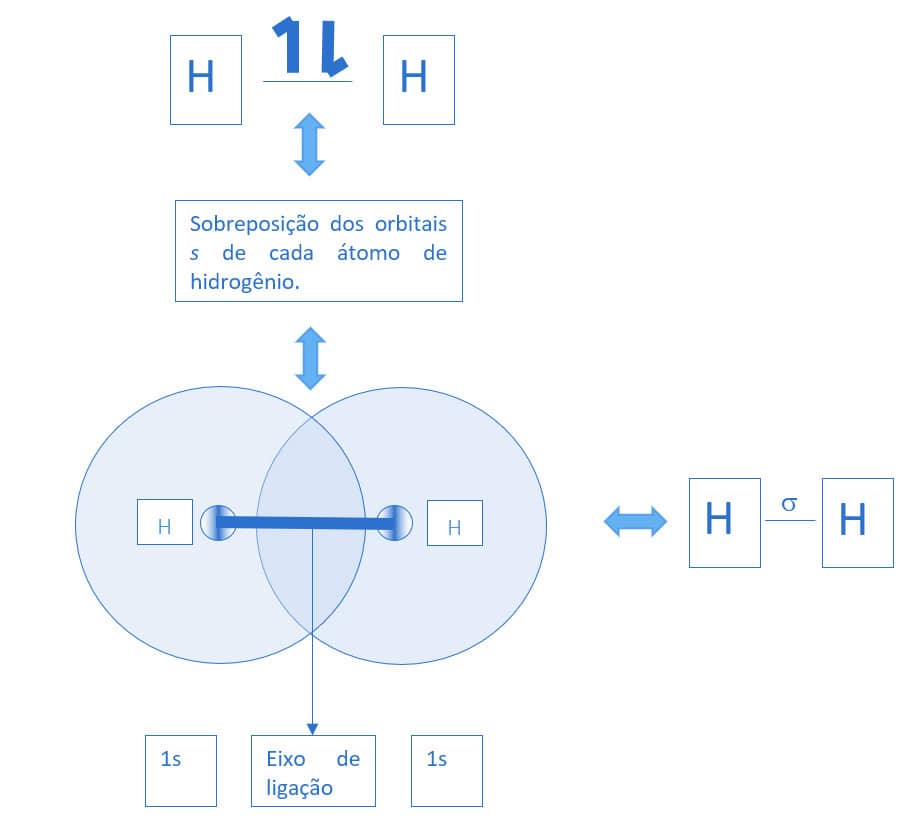
Havendo sobreposição significativa dos orbitais de cada um dos átomos, os elétrons irão se emparelhar no espaço tridimensional. Assim, espacialmente, os elétrons dos orbitais s de ambos os átomos são compartilhados em uma região comum, alinhando-se de forma axial (eixo de ligação), conforme a figura a seguir.
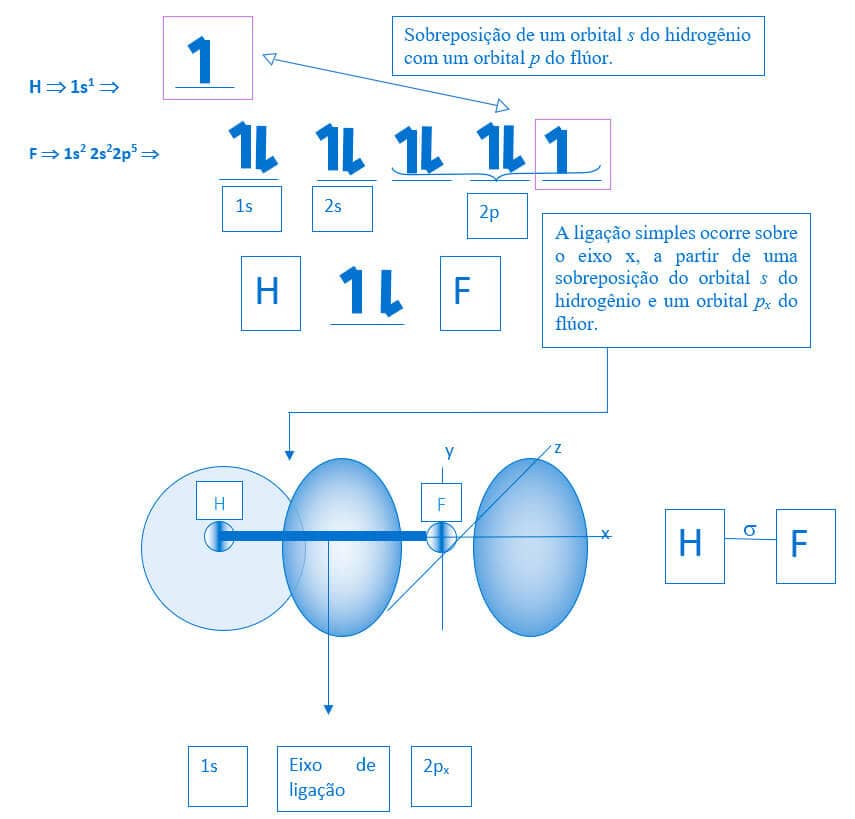
As ligações sigma também são formadas pela sobreposição de orbitais s com orbitais p. Assim, compostos como HF apresentam ligação sigma com esse tipo de sobreposição.
Para o composto HF, teremos:
A sobreposição de orbitais p de dois átomos para formar uma ligação covalente simples tem simetria axial e leva a uma ligação sigma, como no caso de moléculas de gás flúor (F2).
Observe que as ligações simples formadas quando há sobreposição de dois orbitais s, orbitais s e p ou de orbitais p e p dos átomos participantes são denominadas ligações sigma. As ligações sigma têm orientação axial em relação aos orbitais envolvidos.
Essas ligações σ se desenvolvem, por convenção, no eixo geométrico “x” entre os átomos participantes.
As ligações que se formam além da primeira ligação sigma são denominadas ligações “pi” (π). As ligações π estão presentes nas ligações múltiplas e elas são o resultado da sobreposição lateral de orbitais p. Veja na figura a seguir a representação da sobreposição de orbitais que acontecem entre orbitais do tipo p.
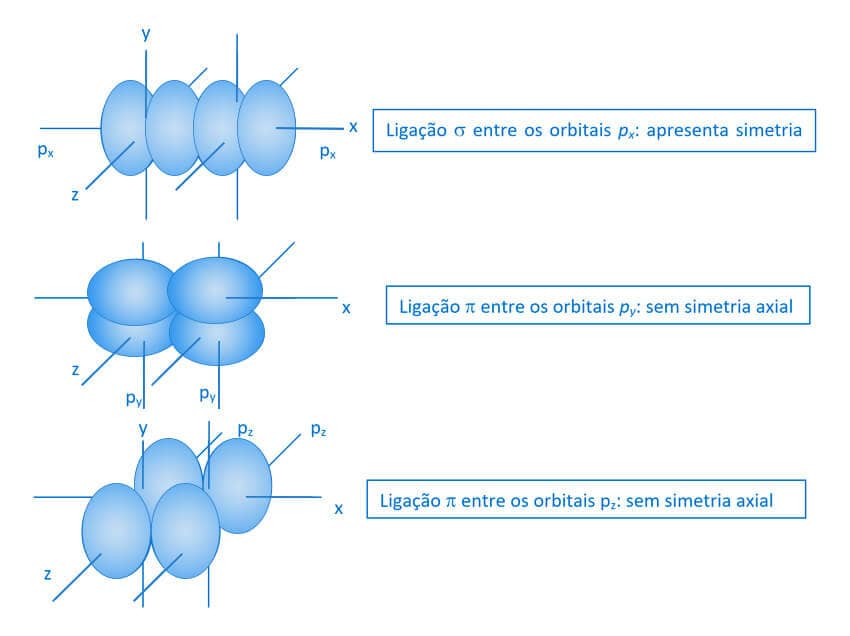
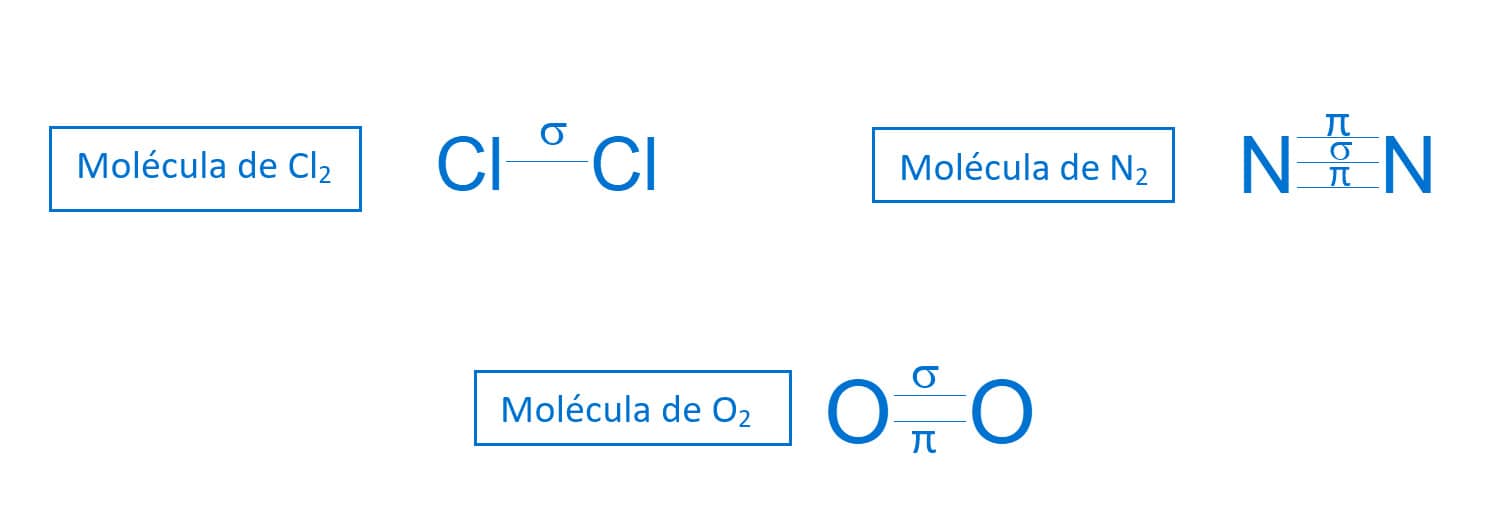
Além dos compostos orgânicos, outras moléculas que apresentam ligações duplas e triplas covalentes terão necessariamente a presença da ligação π.
Exemplos de ligações em moléculas inorgânicas:
HIBRIDIZAÇÃO DE ORBITAIS NOS ÁTOMOS DE CARBONO
Em alguns compostos, observa-se a existência de orbitais mistos ou hibridizados, que são a conjunção de diferentes tipos de orbitais. Para a química do carbono, veremos a descrição de três hibridizações importantes que influenciam diretamente a estrutura e a geometria de diferentes moléculas orgânicas.
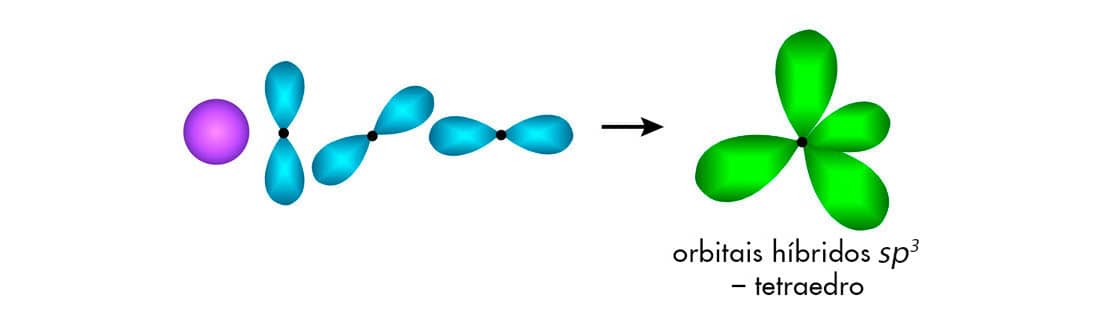
Hibridização sp3
Os orbitais hibridizados sp3 são formados a partir de um orbital 2s e três orbitais 2p de um mesmo átomo. Este tipo de hibridização ocorre no átomo de carbono durante a formação de seus compostos que apresentam somente ligações σ, como o CH4.
O carbono no estado fundamental tem a seguinte configuração:
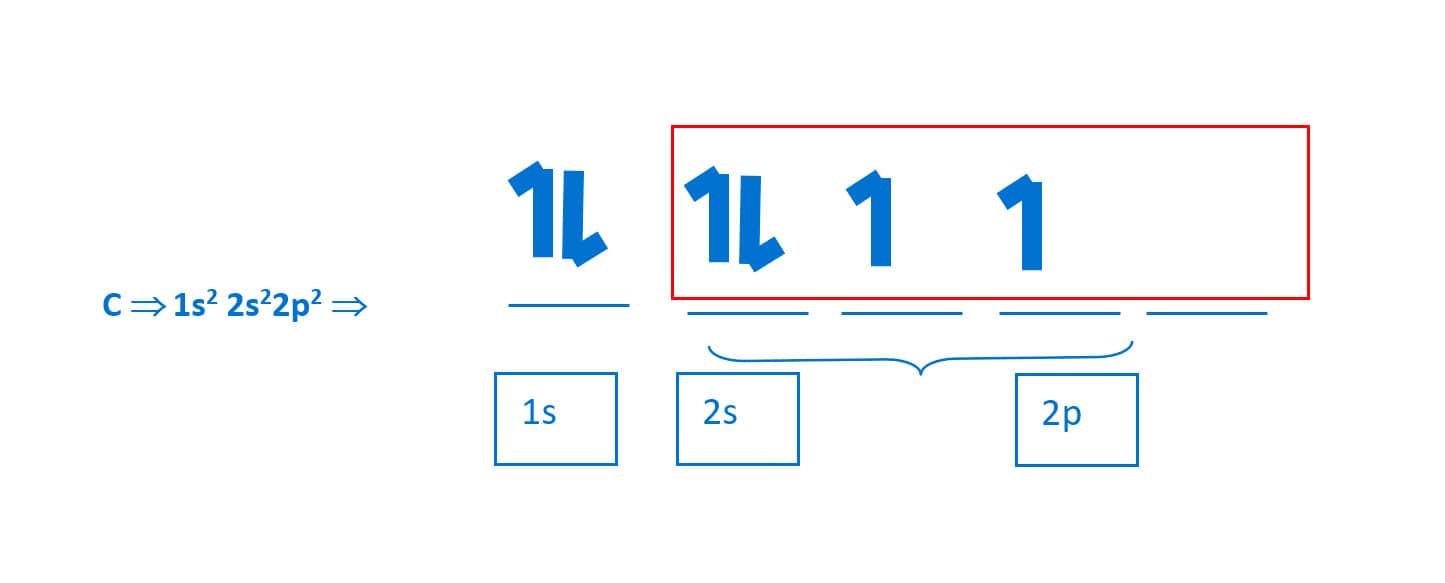
Essa configuração não satisfaz a estrutura do CH4, pois apresenta apenas dois orbitais moleculares capazes de fazer ligações covalentes, além de não justificar a sua geometria tridimensional. Como, então, podemos justificar a tetravalência (capacidade de fazer quatro ligações) e a geometria tetraédrica do carbono sp3?
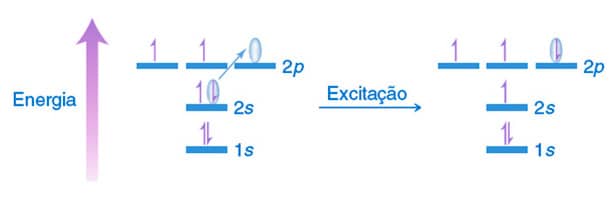
Esse questionamento pode ser resolvido se pensarmos no carbono em estado excitado, onde um elétron presente no orbital 2s do carbono é promovido para o orbital 2p vazio. Desta forma, na camada de valência o carbono passa a ter quatro elétrons desemparelhados, como mostra a figura ao lado. Cada um desses elétrons está envolvido na formação de ligações covalentes.
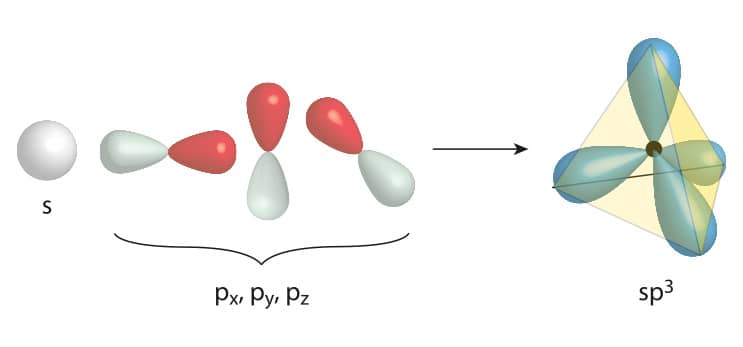
O fenômeno da excitação eletrônica explica o motivo pelo qual o carbono faz quatro ligações covalentes. Mas a justificativa para a geometria do carbono sp3 foi proposta por Linus Pauling no início da década de 1930. Matematicamente, Pauling calculou a média do orbital 2s e dos três orbitais 2p. O resultado deste cálculo sugere a formação de quatro novos orbitais atômicos hibridizados degenerados, em que seu formato possui 25% das características do orbital s e 75% são características oriundas dos orbitais p. Veja o esquema a seguir.
hibridizados degenerados
Em Química, o termo “orbitais degenerados” significa orbitais com energias equivalentes.
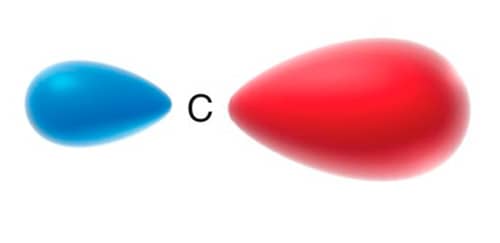
Orbital sp3.
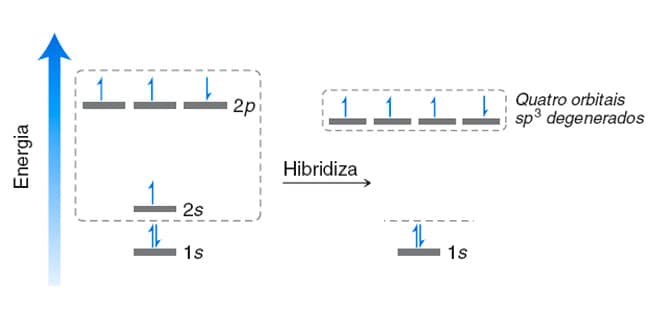
Formação dos quatro orbitais sp3 degenerados.
Atenção
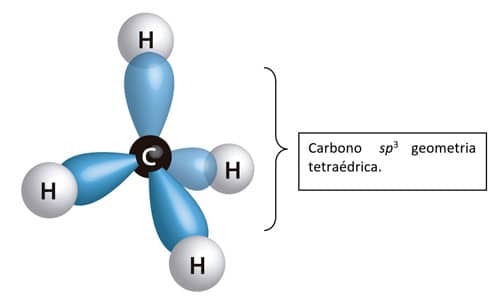
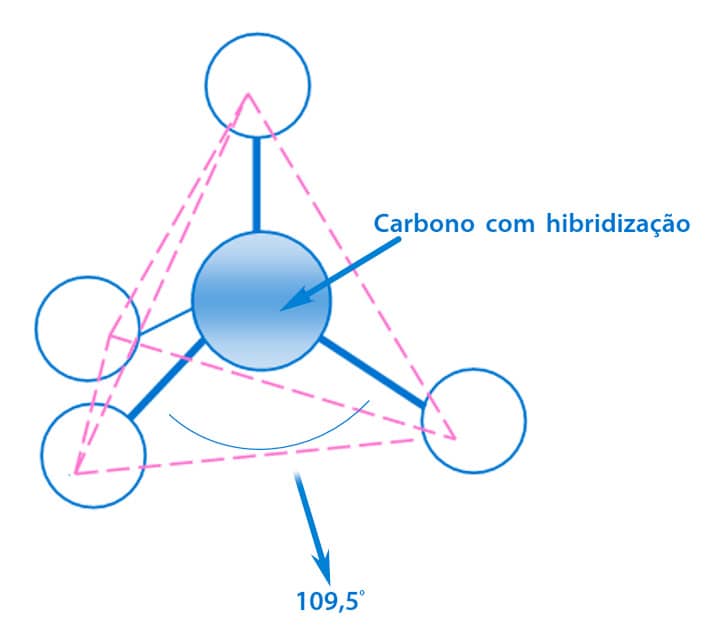
A hibridização não é um fenômeno fisicamente representado. É uma previsão matemática que descreve satisfatoriamente a ligação observada. Por serem energeticamente equivalentes, os orbitais sp3 se distanciam o máximo possível um do outro, alcançando uma configuração tetraédrica, com ângulos de 109,5 °.
Assim, um carbono ligado a quatro átomos de hidrogênio, na molécula de CH4, apresenta a seguinte configuração:
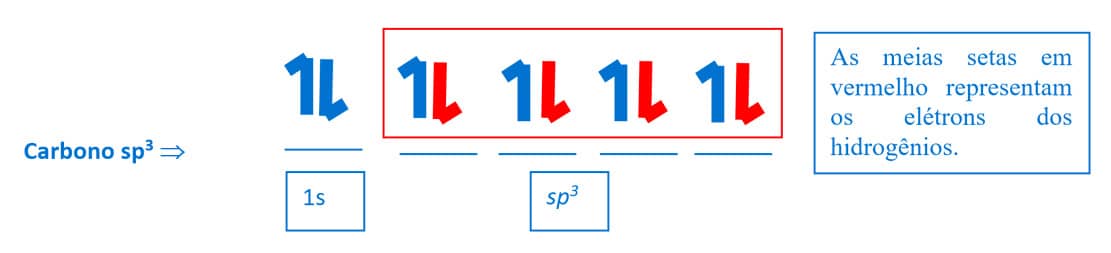
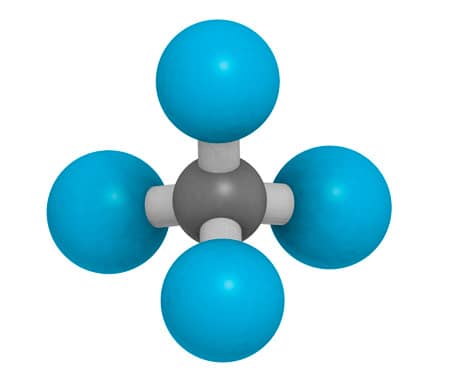
Uma vez que, na molécula do metano, cada orbital sp3 forma uma ligação do tipo σ com orbitais s do hidrogênio, a sua configuração espacial será tetraédrica, com o átomo de carbono como elemento central e os átomos de hidrogênio localizando-se nos vértices. Na figura ao lado, você pode observar a representação da geometria tridimensional tetraédrica do metano.
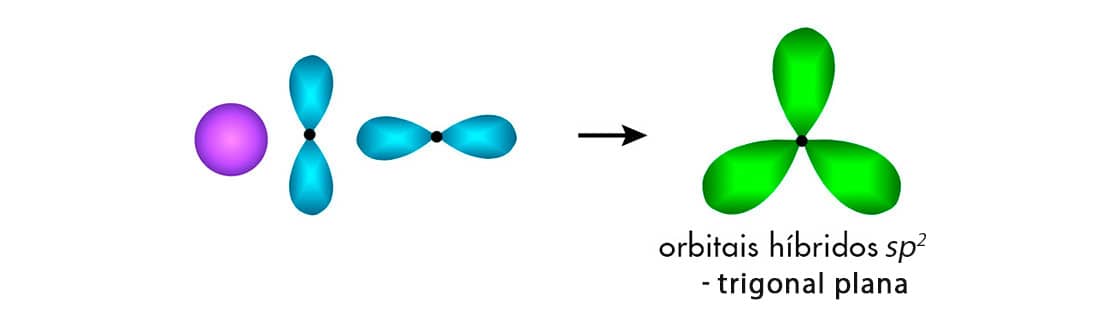
Hibridização sp2
Outro tipo de hibridização do carbono é denominado hibridização sp2. Ocorre a conjunção entre um orbital 2s e dois orbitais 2p. Neste processo, são formados três orbitais sp2 degenerados e um orbital p não é afetado, conforme exemplificado a seguir:
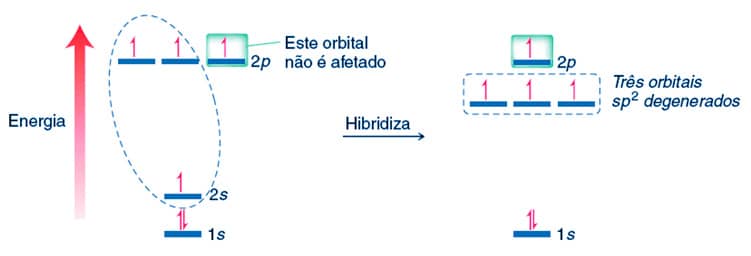
O formato de um orbital sp2 apresenta 33% da característica do orbital s e 67% da característica do orbital p.
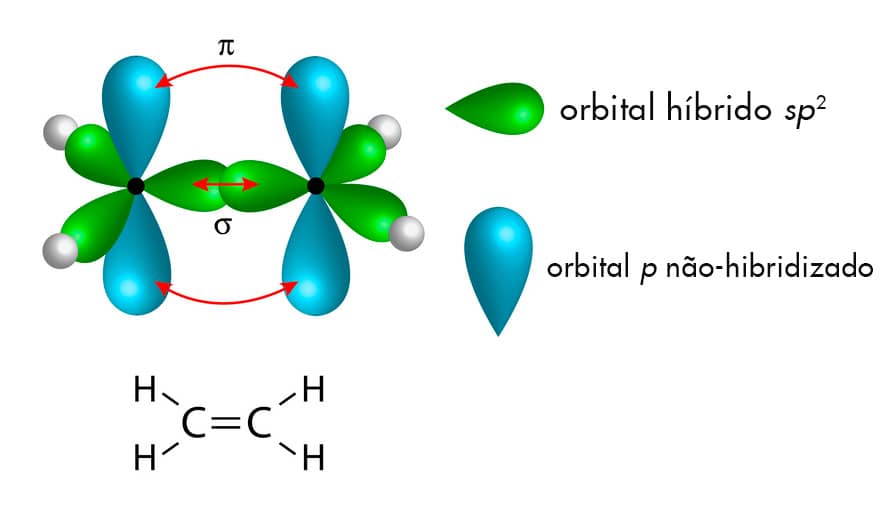
O carbono sp2 é capaz de realizar três ligações do tipo por meio dos orbitais sp2. O orbital p não hibridizado será responsável pela formação de uma ligação π.
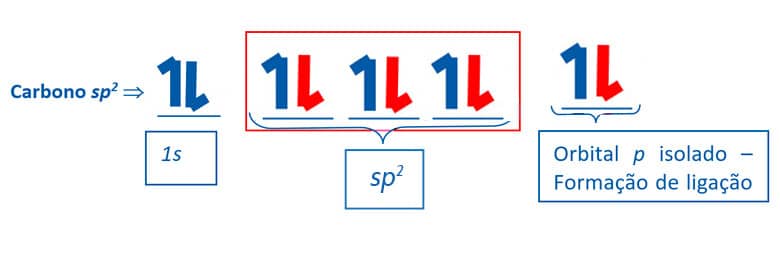
Assim, a partir da hibridização sp2 o átomo de carbono poderá realizar uma ligação dupla mais duas ligações simples. A geometria em torno do carbono em hibridização sp2 é trigonal plana, com ângulo entre as ligações de aproximadamente 120o, como podemos observar na estrutura do eteno.
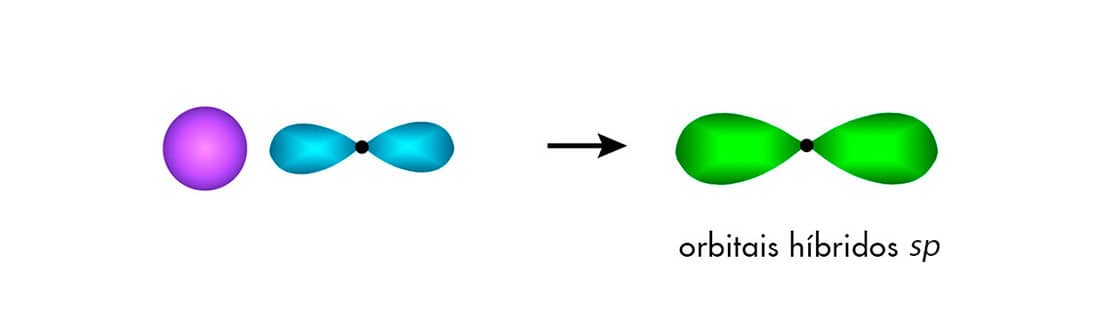
Orbitais hibridizados sp
O carbono pode apresentar mais um tipo de hibridização de seus orbitais denominado sp. Na hibridização sp, ocorre a conjunção entre um orbital 2s e um orbital 2p. O formato do orbital sp apresenta 50% de suas características oriundas do orbital 2s e 50% provenientes do orbital 2p.
Como apenas um orbital do tipo 2s e um 2p sofrem hibridização, dois orbitais 2p ficam inalterados. Assim, o carbono sp é capaz de fazer duas ligações do tipo e duas ligações do tipo π:
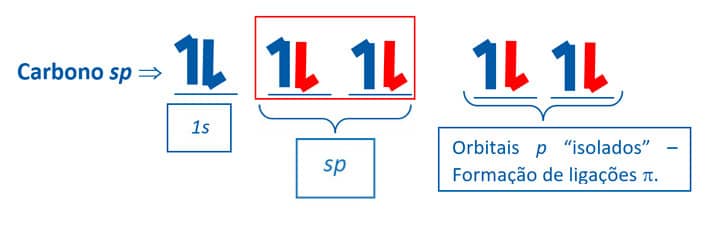
Vejamos o exemplo da molécula orgânica do etino, C2H2. Nela, ambos os carbonos possuem hibridização do tipo sp. Eles estão ligados entre si em um ângulo de 180° por uma ligação tripla, que é constituída por uma ligação σ e duas ligações π (resultantes da sobreposição dos orbitais py – py e pz – pz que não sofreram hibridização). Observe que cada um desses carbonos faz também uma ligação σ com um átomo de hidrogênio por meio de sobreposições sp-s.

Molécula de etino.
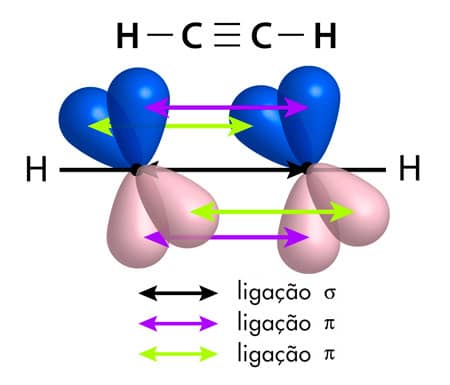
Sobreposição dos orbitais p, formando as ligações σ e π do etino.
Em cada tipo de hibridização, os orbitais têm disposições espaciais diferentes que vão determinar a forma geométrica tridimensional do átomo. Os ângulos formados entre os orbitais hibridizados e, consequentemente, entre as ligações do tipo são os seguintes:
sp3
– ângulo entre as ligações de 109,5° – geometria tetraédrica.
sp2
– ângulo entre as ligações de 120°
– geometria trigonal plana.
sp
– ângulo entre as ligações de 180°
– geometria linear.
Observe a forma geométrica tridimensional para cada uma das hibridizações.
TEORIA DO ORBITAL MOLECULAR (OM)
Uma outra abordagem para a formação de ligações covalentes é a teoria do orbital molecular (OM). Essa teoria assume que os orbitais atômicos são substituídos por um novo conjunto de níveis energéticos na molécula chamados de orbitais moleculares.
A teoria OM utiliza a ordem da ligação para estabelecer a probabilidade de existência de uma molécula. De acordo com essa teoria, os elétrons de dois átomos são distribuídos em orbitais moleculares ligantes e antiligantes.
Atenção
- Orbitais ligantes, com níveis energéticos menores, são favoráveis para estabelecer uma ligação.
- Orbitais antiligantes, com níveis energéticos mais altos, são desfavoráveis para estabelecer uma ligação.
Os orbitais ligantes possuem menos energia do que os orbitais atômicos, isto é, os orbitais originais dos átomos participantes. Por isso, os elétrons da ligação covalente se localizam preferencialmente nestes orbitais moleculares ligantes.
Há uma diferença conceitual importante entre a teoria OM e a teoria LV:
Teoria OM
Na teoria OM, são formados orbitais novos, chamados de orbitais moleculares, com um comportamento diferente dos orbitais atômicos e com seus próprios níveis de energia.
Teoria LV
Pela teoria LV, os orbitais atômicos são sobrepostos e a ligação covalente ocorre na sobreposição desses orbitais.
De acordo com a teoria OM, a ordem de uma ligação é uma contabilização entre o número de elétrons localizados nos orbitais ligantes e o número de elétrons nos orbitais antiligantes.
Para que uma reação química covalente se estabeleça, é necessário que a ordem da ligação seja diferente de zero, isto é, o total de elétrons ligantes deve ser maior que o total de elétrons antiligantes.
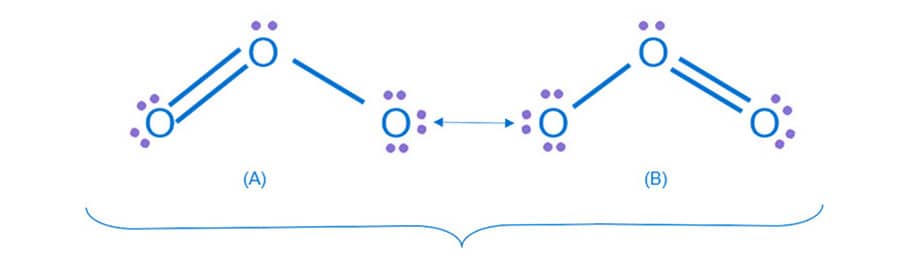
A ordem da ligação estabelece o número de pares de elétrons presentes numa ligação covalente. As moléculas de Cl2, O2 e N2 são formadas por ligações simples, dupla e tripla, respectivamente.
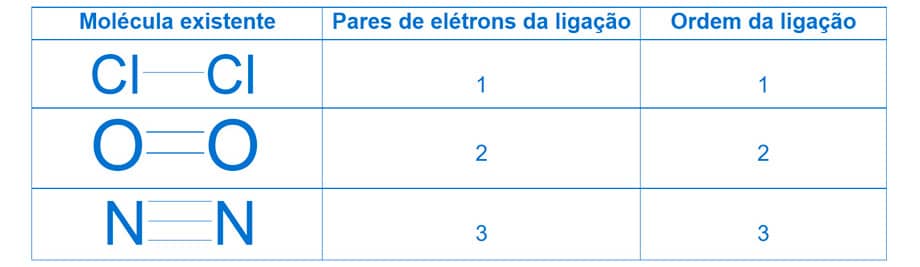
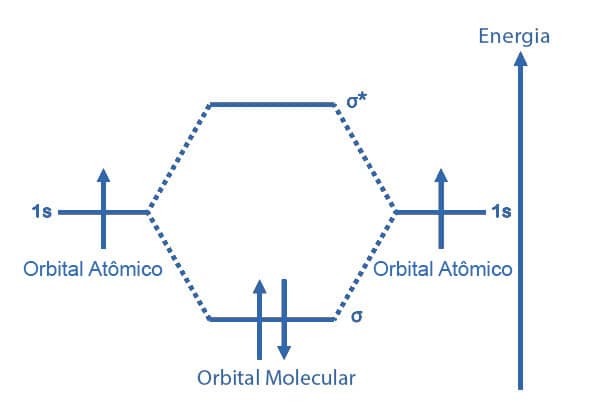
O diagrama de energia para o orbital molecular, em uma ligação simples, mostra os orbitais ligantes σ e antiligantes σ*. Para uma molécula de H2, cada átomo de H possui um orbital atômico 1s, cada um com apenas 1 elétron.
O par de elétrons da ligação covalente se localiza preferencialmente no orbital molecular σ (ligante). Não há nenhum elétron em σ*. A ordem da ligação para essa molécula será 1.
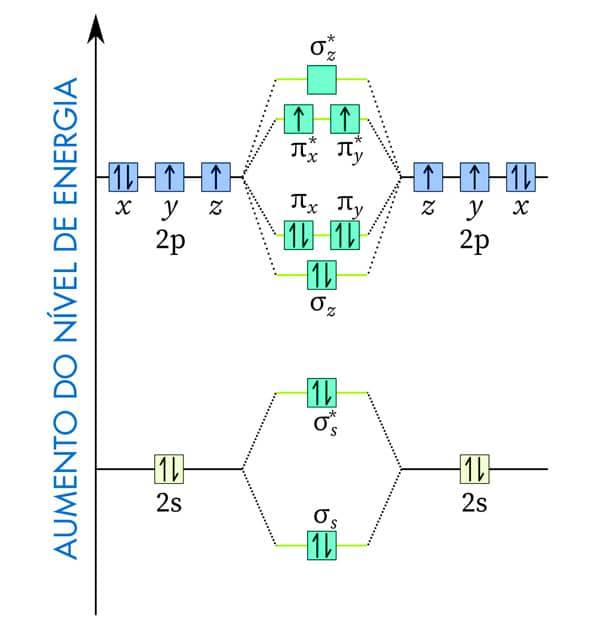
Para uma molécula de O2, o diagrama de energia do orbital molecular mostra a formação de pares de ligação entre os orbitais ligantes e antiligantes. Nesse caso, em virtude do número de elétrons na camada de valência, há orbitais sigma ligante (σ) e antiligante (σ*), além de orbitais “pi” ligante (π) e antiligante (π*).
Observe que cada átomo de oxigênio, antes da ligação, tem a seguinte configuração eletrônica, com os orbitais atômicos p nos eixos x, y e z (px, py e pz):
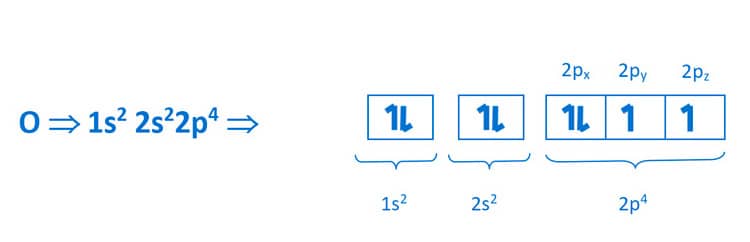
A análise de energia do orbital molecular para a ligação entre dois átomos de oxigênio mostra os orbitais ligantes e antiligantes.
No diagrama para a molécula do O2, temos um total de 8 elétrons em orbitais ligantes (σs, σz, πx e πz) e 4 elétrons nos orbitais antiligantes. Assim, a ordem de ligação para o O2 será dada por:
Pela teoria OM, as ligações covalentes presentes nos compostos orgânicos se dariam nos orbitais moleculares formados entre os orbitais atômicos do carbono e os orbitais atômicos dos átomos que se ligam ao carbono.
A determinação da ordem de ligação entre os participantes origina as ligações simples, dupla e tripla, conforme já mencionado. É importante ressaltar que tanto a teoria OM quanto a teoria LV chegam aos mesmos resultados para as estruturas das moléculas orgânicas.
HIBRIDIZAÇÃO DO CARBONO E SUAS RELAÇÕES COM O COMPRIMENTO E A FORÇA DAS LIGAÇÕES
Para concluir o módulo, o especialista apresentará o fenômeno de hibridização e como este se relaciona com a estrutura do composto, a forma e o comprimento de ligações.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Identificar as diferentes geometrias e o caráter polar ou apolar das moléculas orgânicas de acordo com as configurações de suas estruturas
POLARIDADE DAS LIGAÇÕES QUÍMICAS
As ligações químicas iônicas e covalentes apresentam dois extremos de modelos de ligação.
Ligação iônica
Na ligação iônica, os átomos participantes conseguem se ionizar com um dos átomos transferindo elétrons para o outro átomo .
Ligação covalente
Na ligação covalente há o compartilhamento de elétrons sem a formação efetiva de íons.
um dos átomos
Normalmente, um metal, que se transforma em um cátion.
outro átomo
Normalmente, não metal que se transforma em um ânion.
Ligação covalente polar e apolar
Para as moléculas orgânicas, o modelo mais importante é o da ligação covalente, tendo em vista que suas moléculas são estruturadas pelo compartilhamento de pares de elétrons, formando as ligações σ e as ligações π.
Cabe ressaltar, entretanto, que os elétrons compartilhados, na maioria das vezes, não se encontram na distância média exata entre os átomos participantes. Quando são elementos diferentes, esses pares de elétrons ficam deslocados e mais próximos do átomo cujo núcleo tem maior capacidade de atraí-los para si.
Mas como podemos identificar qual átomo atrairá para sua proximidade o par de elétrons da ligação? Primeiramente, devemos ficar atentos à eletronegatividade dos átomos envolvidos na ligação covalente.
De forma geral, elementos com menos camadas eletrônicas e com maior número atômico tendem a atrair mais os elétrons, em virtude da proximidade entre o núcleo (carregado positivamente) e a camada de valência (carregada negativamente). Esses fatores justificam o maior valor de eletronegatividade dos elementos situados na parte superior e à direita da tabela periódica.
eletronegatividade
A eletronegatividade (EN) é uma propriedade periódica que mede a tendência de atração de elétrons da ligação por um elemento químico.
Como se vê na figura a seguir, o flúor (EN = 4,0), o oxigênio (EN = 3,5) e o nitrogênio (EN = 3,0) são os elementos com as maiores eletronegatividades, enquanto o Césio (Cs) é o elemento menos eletronegativo (EN = 0,7).
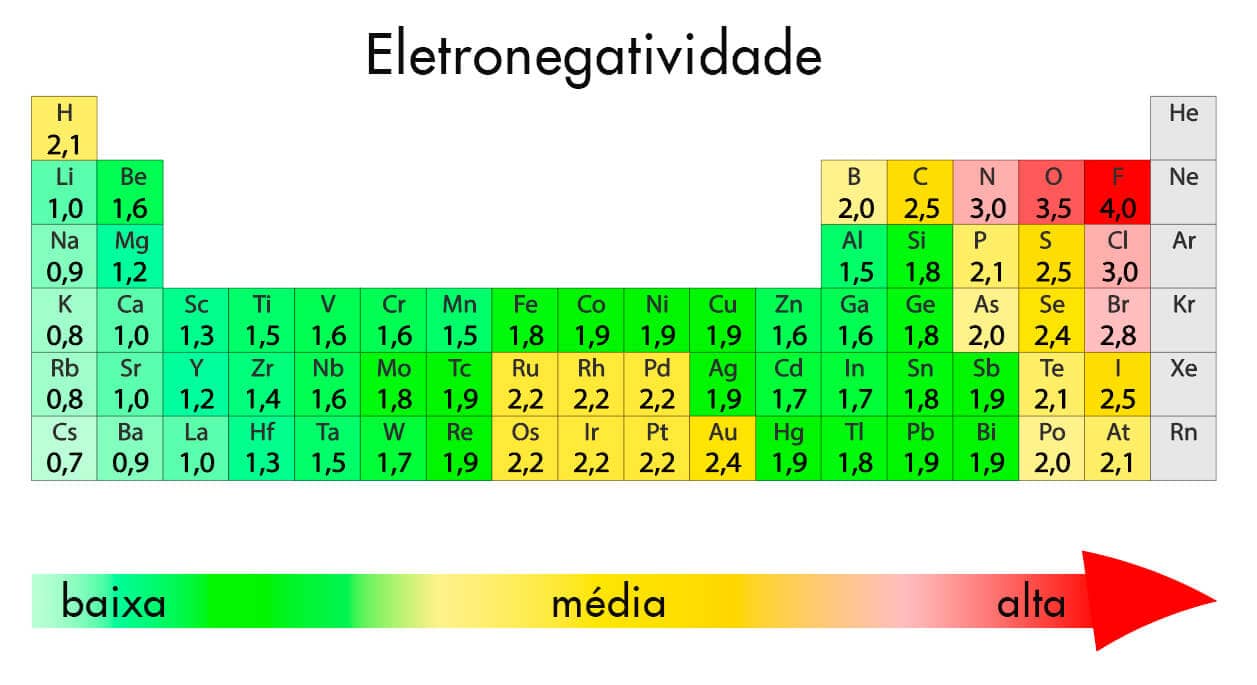
Em relação à polaridade, as ligações covalentes podem ser classificadas como apolar e polar, de acordo com a diferença de eletronegatividade entre os participantes. Para diferenças de eletronegatividade mais altas (normalmente para valores superiores a 1,8), teremos uma ligação iônica.
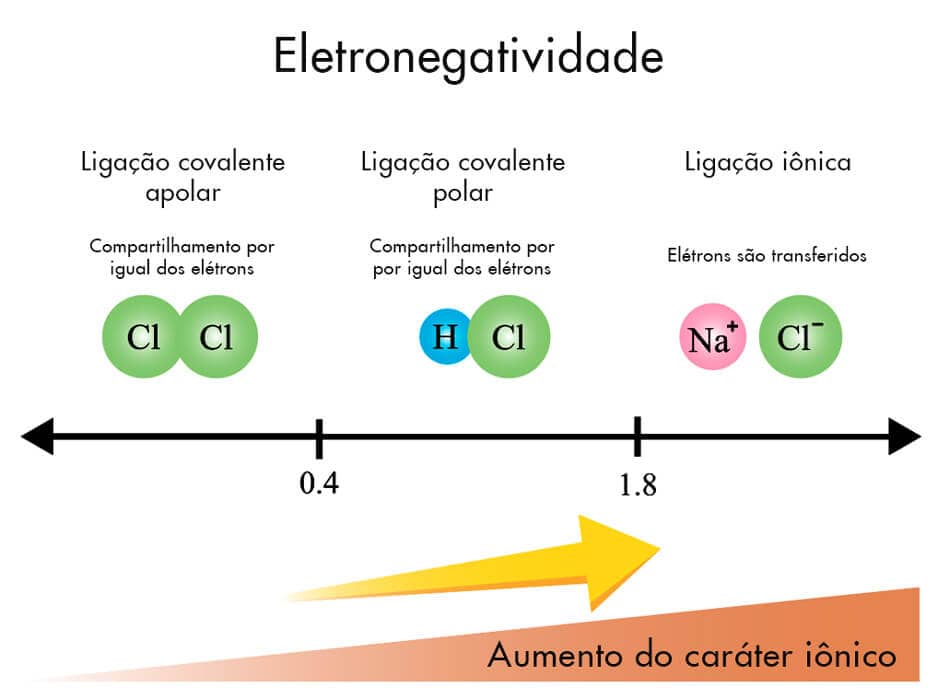
Ligação apolar
A diferença entre a eletronegatividade dos átomos participantes é muito baixa (menor que 0,4) ou nula. Os pares de elétrons encontram-se compartilhados de forma igualitária entre os átomos participantes. Por exemplo, a ligação entre carbono (EN = 2,5) e hidrogênio (EN = 2,1) terá uma diferença de 2,5 -2,1 = 0,4. Ou seja, não há formação efetiva de dipolo e, portanto, a ligação C–H é classificada como uma ligação covalente apolar.
Ligação polar
A diferença entre a eletronegatividade dos átomos participantes da ligação covalente é maior 0,4 até um valor por volta de 1,8, formando nesse caso um dipolo, isto é, uma região mais adensada em elétrons (polo negativo, , no átomo mais eletronegativo) e uma região com menos adensamento de elétrons (polo positivo, , no átomo menos eletronegativo). Como exemplo, uma ligação entre oxigênio (EN = 3,5) e hidrogênio (EN = 2,1) terá uma diferença de eletronegatividade igual a 3,5 – 2,1 = 1,4. Isso confere a esta ligação um caráter polar significativo. Logo, podemos classificar a ligação O–H como uma ligação covalente polar.
Diferenças entre as ligações covalentes apolares e polares
Clique nas figuras abaixo para ver as informações.
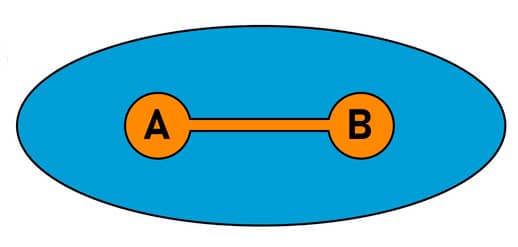
Os átomos A e B têm a mesma eletronegatividade, por isso têm um compartilhamento igual dos pares de elétrons (região azul).
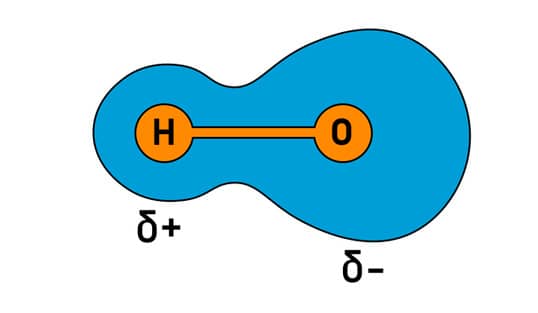
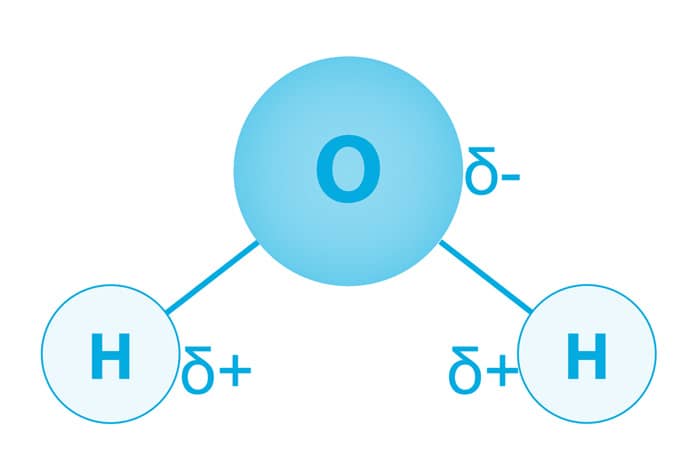
Átomos com eletronegatividades diferentes têm um compartilhamento desigual dos pares de elétrons da ligação covalente. O átomo de oxigênio (O) tem maior eletronegatividade do que o átomo de hidrogênio (H) e assim tem a maior proximidade com os pares de elétrons da ligação. Um dipolo é formado, porque uma extremidade da ligação é ligeiramente positiva (delta positiva, δ+ ) e a outra extremidade é ligeiramente negativa (delta negativo, δ-).
RESSONÂNCIA E AS ESTRUTURAS DE RESSONÂNCIA
Já vimos que as estruturas de Lewis de uma molécula mostram os elétrons presentes, tanto na forma de pares ligados quanto na forma de pares de elétrons não ligantes. Esse conjunto de elétrons é responsável pela estabilidade eletrônica da molécula. Ao organizarmos todos os elétrons envolvidos, podemos observar em algumas moléculas a possibilidade de mais de um arranjo eletrônico, ou seja, a possibilidade de mais de uma estrutura eletrônica numa mesma molécula. Esse fenômeno é chamado de ressonância.
Cargas formais e as possíveis estruturas de uma espécie química
Ao compartilhar elétrons para formar as ligações covalentes, são possíveis diferentes arranjos desses pares eletrônicos para estruturar uma determinada espécie química. Entre as possibilidades, entretanto, existem as estruturas mais estáveis eletronicamente. Um dos critérios para avaliar qual a estrutura eletrônica mais estável — e, portanto, com maior possibilidade de representar adequadamente o composto — é a análise da carga formal de seus átomos presentes.
O critério é bastante simples: a estrutura mais adequada é aquela que tiver o maior conjunto de cargas formais iguais a zero ou próximas de zero.
Mas, afinal, como se calcula a carga formal (CF)? Primeiramente, devemos analisar as estruturas de Lewis possíveis para uma determinada espécie química.
A seguir, temos como exemplo a molécula de ácido clorídrico, HCl, formada por apenas uma ligação covalente.
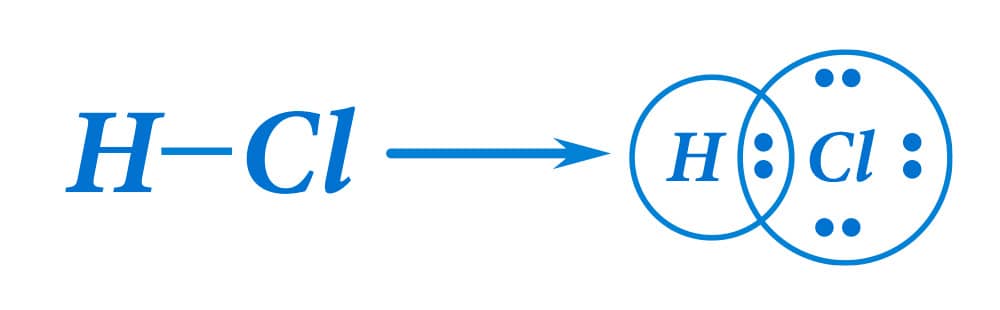
Atenção
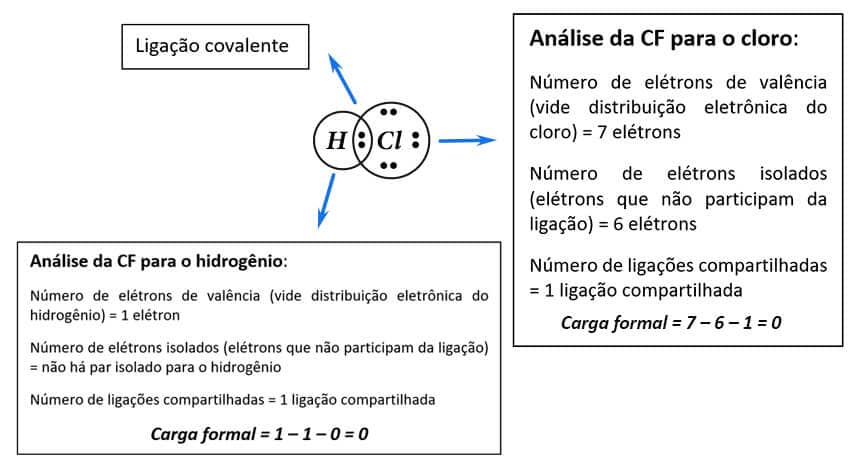
Carga formal (CF) = (número de elétrons de valência – número de elétrons isolados) – número de ligações compartilhadas
Assim:
A molécula de HCl somente apresenta uma estrutura provável. No próximo exemplo, veremos a análise do íon sulfato, SO42-, que pode apresentar mais de uma estrutura de Lewis possível. Neste caso, a carga formal dos participantes determinará a estrutura mais adequada para esse íon. Cabe ressaltar que o enxofre (S) é um elemento que aceita a estabilização com 10 elétrons em sua camada de valência, em virtude do fenômeno da expansão da camada de valência para elementos do terceiro período da Tabela Periódica.
Expansão da camada de valência
A expansão da camada de valência é a capacidade de um elemento adquirir estabilidade com mais de 8 elétrons na camada de valência. Isso ocorre com elementos não metálicos que possuem mais de três níveis e é justificado pelo fato desses elementos possuírem orbitais do tipo d vazios em sua camada de valência que podem acomodar 10 ou 12 elétrons.
Estruturas possíveis para o íon sulfato
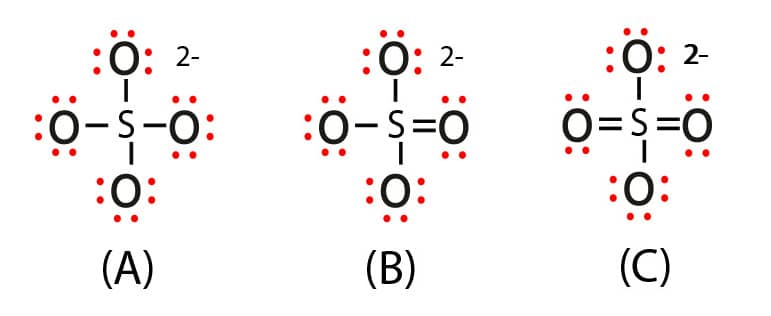
Nas três estruturas mostradas, temos:
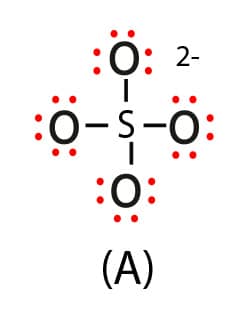
Enxofre com quatro ligações simples, ligado a 4 oxigênios com 3 pares não ligantes.
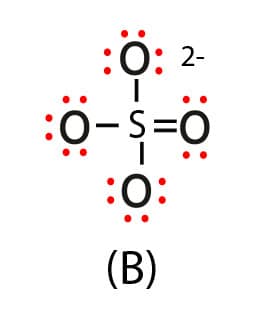
Enxofre com três ligações simples e uma ligação dupla, ligado a 3 oxigênios com 3 pares não ligantes e a 1 oxigênio com 2 pares não ligantes.
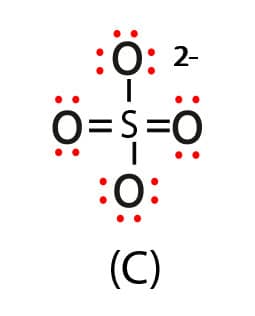
Enxofre com duas ligações duplas e duas ligações simples, ligado a 2 oxigênios com 3 pares não ligantes e a 2 oxigênios com 2 pares não ligantes.
Para estabelecer o arranjo eletrônico mais adequado para o íon sulfato, temos que analisar as cargas formais de todos os átomos presentes em cada uma das três estruturas. A tabela a seguir apresenta as CF dos átomos presentes nas três estruturas do íon sulfato (SO42-).
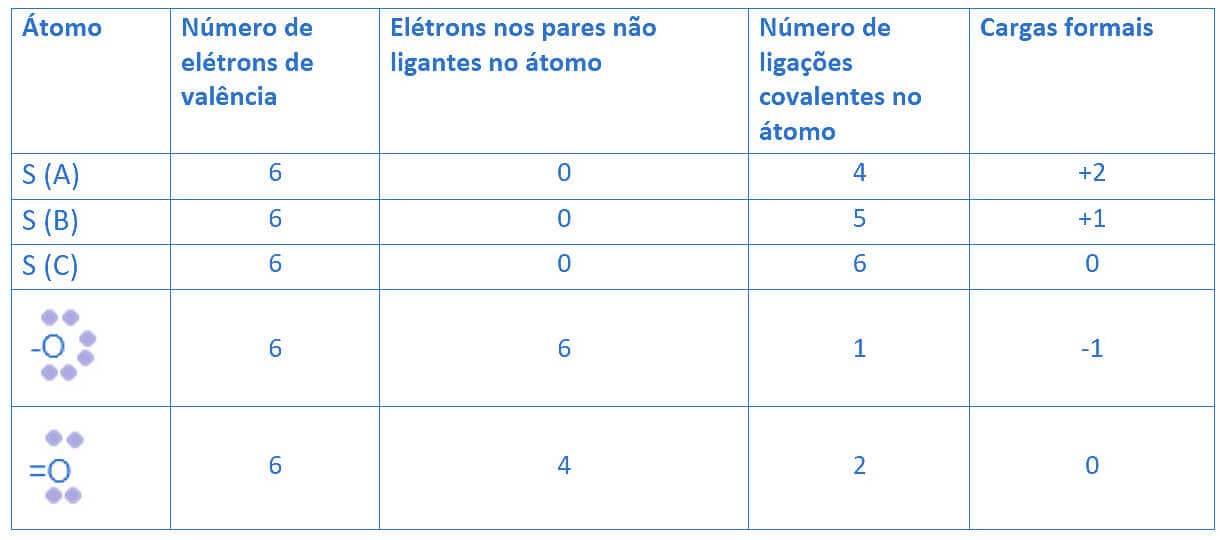
Como se vê na tabela, a estrutura que apresenta o maior número de átomos com CF igual a zero é a estrutura “C”. Nessa estrutura, temos o enxofre (S) com CF igual a zero e temos 2 oxigênios, que possuem a dupla ligação também com CF igual a zero. Todas as outras estruturas apresentam um número maior de átomos com CF diferente de zero. Assim, a estrutura “C” para o íon sulfato é a mais adequada e favorável.
Saiba mais
Embora o íon sulfato não seja um composto orgânico, o exemplo de análise de cargas formais demonstrado para identificar uma estrutura eletrônica mais estável é válido para qualquer composto, seja orgânico ou inorgânico.
Ressonância e híbridos de ressonância
Vimos que a análise das cargas formais de possíveis estruturas eletrônicas permite identificar o arranjo das ligações mais provável para uma espécie química. Ocorre que, em algumas moléculas e íons que possuem ligações covalentes, teremos duas ou mais estruturas que apresentam o mesmo resultado na análise das cargas formais. Essas estruturas serão totalmente equivalentes do ponto de vista de arranjo eletrônico.
É importante destacar dois aspectos das estruturas de ressonância. Primeiramente, cada um dos átomos cumpre com a regra do octeto, apresentando configuração de gás nobre. O outro aspecto refere-se à capacidade de cada uma delas se transformar em qualquer outra mudando a posição dos elétrons não ligados e daqueles envolvidos nas ligações do tipo π.
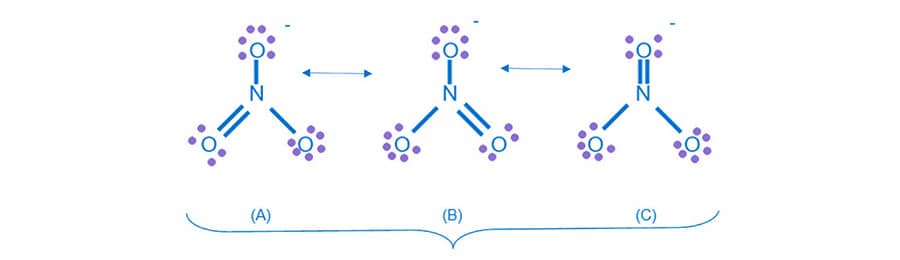
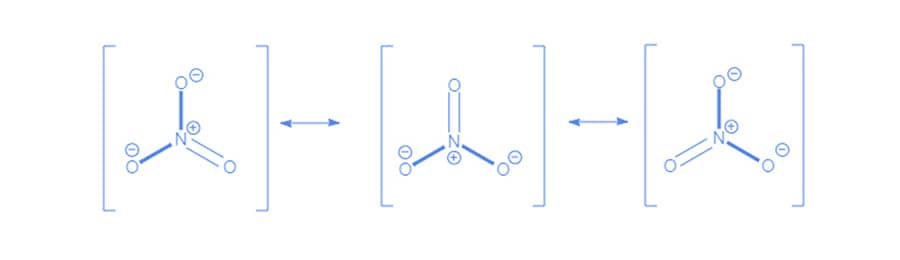
Essa movimentação pode ser indicada por setas curvas, como mostra o exemplo a seguir que apresenta as estruturas de ressonância do íon carbonato (CO32-):
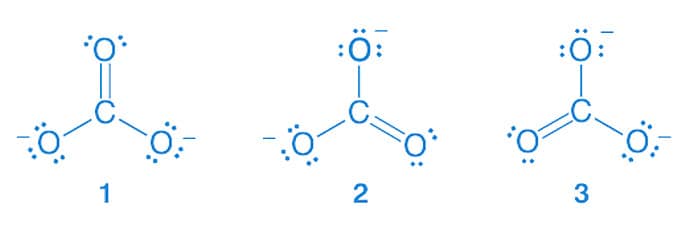
O deslocamento de elétrons demonstrado ao lado faz com que a estrutura 1 se transforme na 2.
De maneira semelhante, a movimentação dos elétrons na estrutura 2 leva à formação da estrutura 3 como representado a lado.
Ainda sobre o íon carbonato, apesar de a ligação simples entre o átomo de carbono e o oxigênio ser maior que a ligação dupla entre esses dois átomos, no íon carbonato todas as ligações apresentam o mesmo tamanho, indicando que nenhuma dessas estruturas estão exatamente corretas. A teoria da ressonância explica esse fenômeno, pois declara que, quando um composto pode ser representado por mais de uma estrutura de Lewis que são distintas apenas pela posição de elétrons, nenhuma delas será a representação correta da espécie química. Esta molécula será, então, mais bem representada por uma média de cada uma das estruturas equivalentes, chamada de híbrido de ressonância.
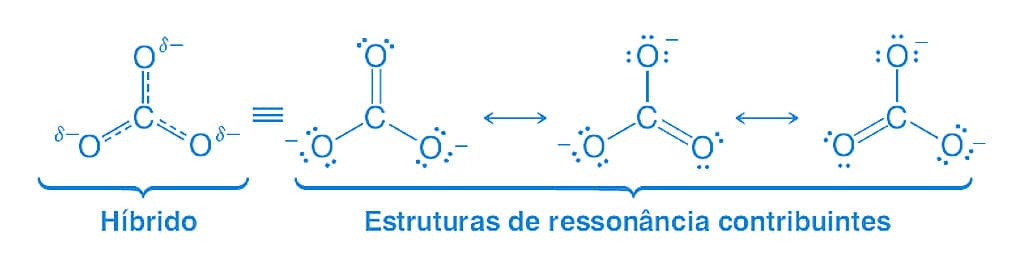
Atenção
As estruturas de ressonâncias são hipotéticas e não podem ser isoladas.
Vejamos o fenômeno de ressonância aplicado a algumas moléculas orgânicas.
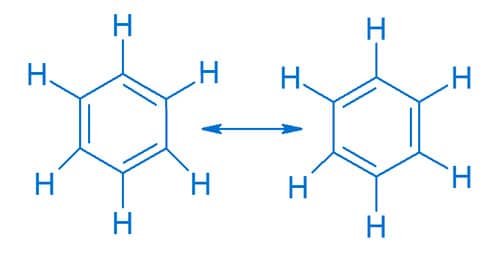
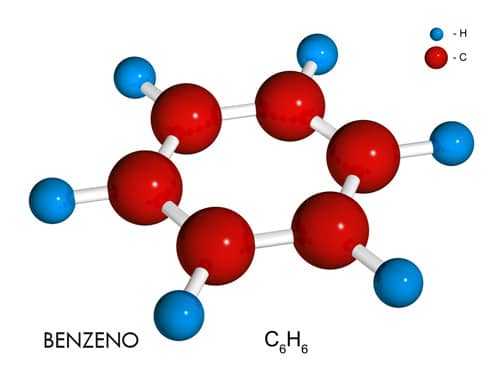
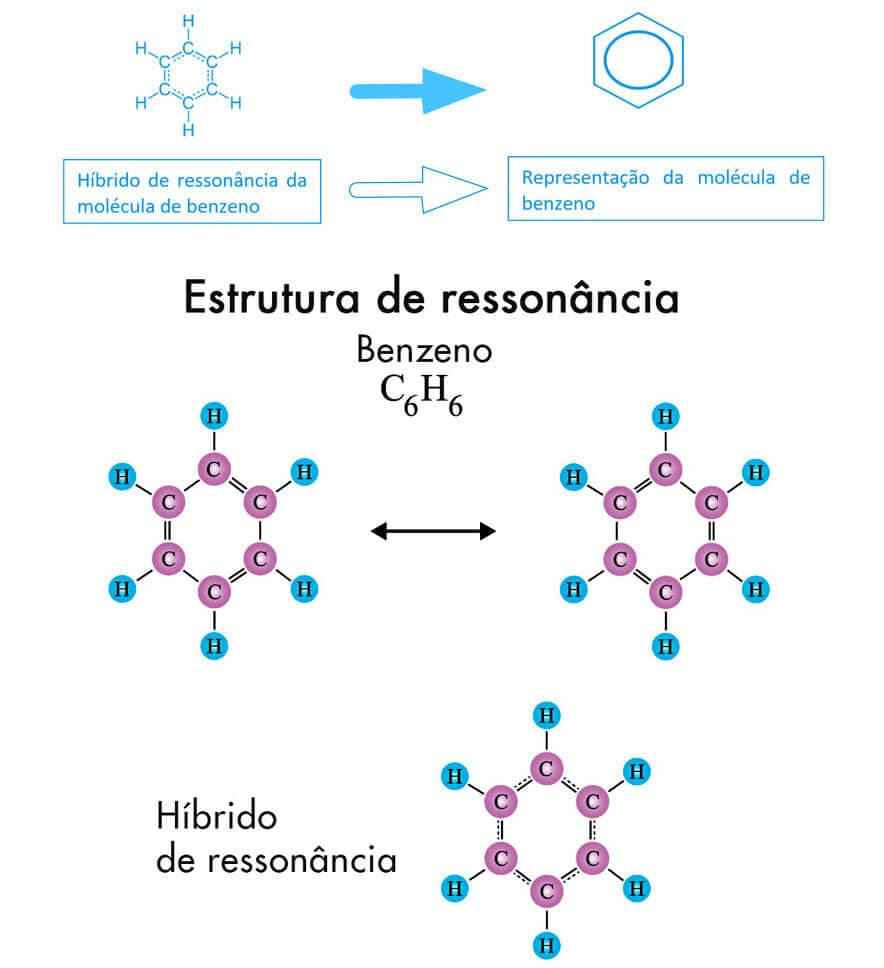
A molécula orgânica de benzeno, C6H6, é um exemplo clássico de um hidrocarboneto cíclico que apresenta dois possíveis arranjos eletrônicos de suas ligações, ou seja, duas estruturas de ressonância.
A posição intercalada dessas ligações simples e duplas possibilita a existência de duas estruturas diferentes, porém eletronicamente equivalentes. Observe que a molécula apresenta ligações duplas e simples intercaladas em torno do anel benzênico. O híbrido de ressonância, bem como uma das mais conhecidas representações da molécula do benzeno são representados a seguir.
Um outro exemplo é o íon orgânico acetato, CH3COO-, que também apresenta ressonância, tendo em vista a possibilidade de duas estruturas eletronicamente equivalentes.
Atenção
A carga localizada no oxigênio da ligação simples é a sua carga formal.
DESENHANDO ESTRUTURAS DE RESSONÂNCIA
A seguir, o especialista explicará como escrever estruturas de ressonância para estruturas orgânicas, destacando o movimento de setas, e como decidir se uma estrutura de ressonância contribui mais para o híbrido do que outra.
GEOMETRIA DAS MOLÉCULAS ORGÂNICAS
As moléculas, sejam inorgânicas ou orgânicas, apresentam uma representação geométrica de acordo com as ligações presentes, tipo de hibridização dos átomos centrais, presença de elétrons não ligantes, entre outros fatores. Entretanto, podemos prever de maneira simples a geometria de um composto aplicando o que diz o modelo de repulsão dos pares de elétrons na camada de valência (RPECV). Para esta previsão, o modelo leva em consideração:
Moléculas cujo átomo central está ligado a, no mínimo, 2 outros átomos ou grupos.
Todos os elétrons de valência do átomo central (pares de elétrons envolvidos em ligações covalentes e pares de elétrons não ligantes).
A repulsão entres os pares de elétrons, fazendo com que os elétrons de valência fiquem o mais afastados possível uns dos outros, sabendo-se que a repulsão entre elétrons envolvidos em ligação covalente é menor do que entre pares de elétrons isolados.
Moléculas cujo átomo central está ligado a, no mínimo, 2 outros átomos ou grupos.
Sendo assim, de acordo com o modelo RPECV, podemos afirmar que a geometria assumida por uma molécula é aquela que possibilita maior distância possível entre os pares de elétrons da camada de valência.
Veja o exemplo de uma molécula do composto orgânico metano, CH4, em relação às diferentes representações de sua molécula.
Escolha um dos itens a seguir.
As propriedades das moléculas estão relacionadas com sua estrutura espacial real. O metano apresenta o carbono como átomo central de sua molécula, com seus orbitais permitindo a realização de quatro ligações σ, em virtude de sua hibridização sp3. Assim, os 4 átomos de hidrogênio irão se alinhar com um ângulo de 109,5° em torno do átomo de carbono, formando uma estrutura tridimensional tetraédrica. Para o metano, esta é a única orientação que permitirá maior e igual distância entre os pares de elétrons envolvidos em suas ligações covalentes.
Já vimos que, além da hibridização sp3, o carbono pode ter a hibridização sp2 e a hibridização sp. Essas diferentes hibridizações irão refletir na organização geométrica da molécula em torno do átomo de carbono.
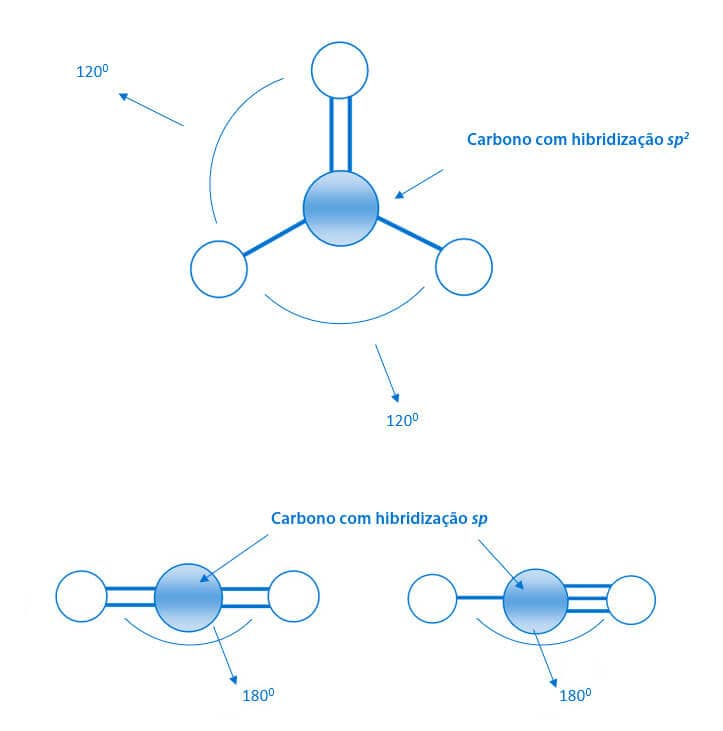
Assim, os tipos de hibridizações presentes em uma molécula orgânica irão determinar os ângulos de ligações em torno do átomo de carbono.
Como vimos, para as hibridizações sp3, sp2 e sp, considerando que o carbono se ligue a átomos ou grupos químicos iguais, teremos, respectivamente, os ângulos de 109,5°, 120° e 180°. Esses ângulos sofrerão ligeiras alterações, se os ligantes aos átomos de carbono forem diferentes. Essas alterações ocorrem em virtude do tamanho dos átomos ou grupos químicos, da repulsão entre as nuvens eletrônicas ou da presença de pares de elétrons não compartilhados.
Além das geometrias mostradas para as hibridizações sp3, sp2 e sp, importantes para as moléculas orgânicas, existem outros tipos de estruturas moleculares.
O conjunto completo de estruturas moleculares pode ser visto no quadro a seguir.
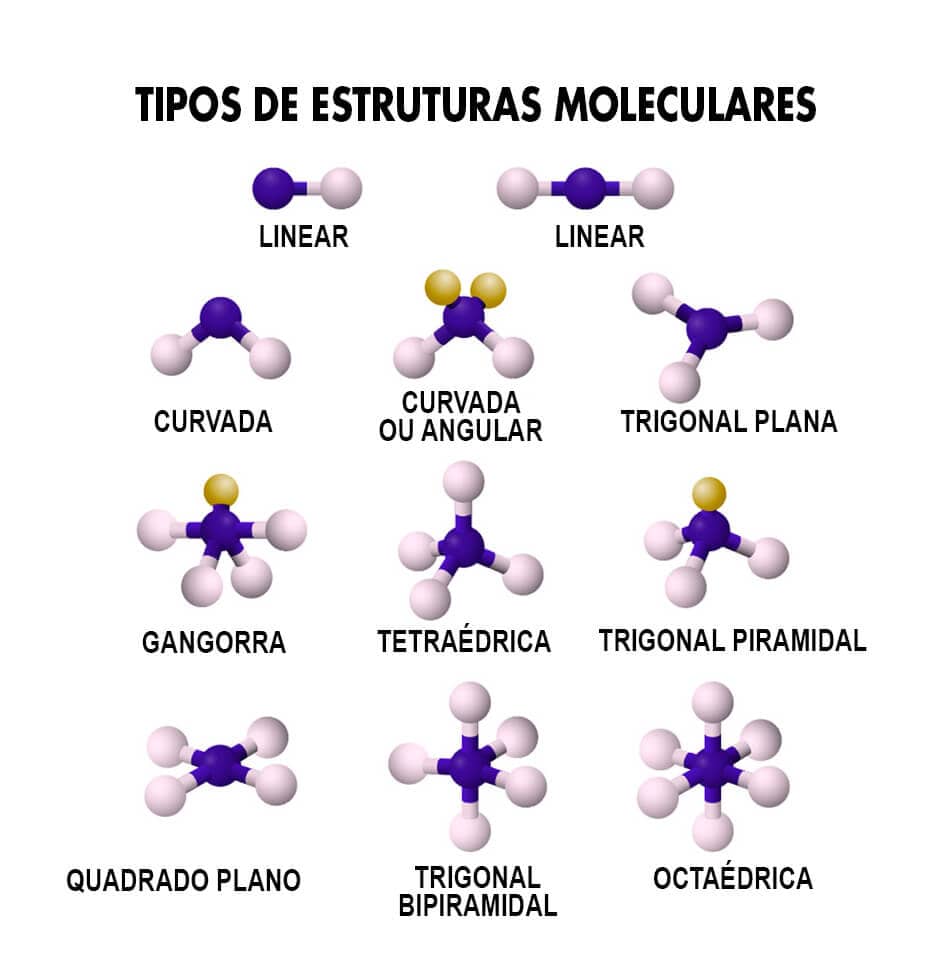
Observe que uma mesma molécula pode conter carbonos com diferentes hibridizações, levando a uma mistura de geometrias e de posicionamentos dos ligantes em sua estrutura.
POLARIDADE DAS MOLÉCULAS
Já vimos que ligações covalentes entre átomos com diferentes eletronegatividades levam à formação de ligações químicas polares. Embora existam moléculas bastante simples (sobretudo alguns gases inorgânicos) que têm apenas uma ligação, a maior parte das moléculas apresenta várias ligações químicas em sua estrutura.
O balanço das cargas deslocalizadas por ligações covalentes polares em uma molécula pode resultar em moléculas polares ou apolares. A existência ou não de polaridade numa molécula dependerá também de sua geometria.
Uma geometria molecular capaz de equilibrar todos os dipolos das ligações presentes, de forma que o balanço resulte num momento dipolar, μ, igual a zero, resultará em uma molécula apolar. Por outro lado, uma molécula com momento dipolar diferente de zero é classificada como uma molécula polar.
A polaridade de moléculas pode ser medida experimentalmente colocando-se amostras de moléculas entre placas carregadas eletricamente com cargas opostas. Se as moléculas forem polares, observa-se um alinhamento com o campo elétrico formado. A medida desse alinhamento é chamada de momento dipolo, μ, e é expresso numa unidade denominada debye (D).
Moléculas polares: momento dipolo, μ ≠ 0
Moléculas apolares: momento dipolo, μ = 0
Um exemplo importante de molécula polar é a água, tendo em vista que a sua estrutura geométrica, angular, não consegue anular os dipolos das ligações entre o oxigênio e o hidrogênio. O polo negativo se localiza no oxigênio por ser o elemento mais eletronegativo.
Por sua vez, o gás carbônico, CO2, é uma molécula apolar tendo em vista que os dipolos formados pelas ligações do carbono com o oxigênio têm um resultante de momento dipolar igual a zero. A molécula de CO2 apresenta uma geometria linear, com 1 átomo de carbono com hibridização sp ligado a 2 oxigênios em extremidades opostas. Essa regularidade estrutural equilibra os dipolos, resultando num momento dipolar nulo.
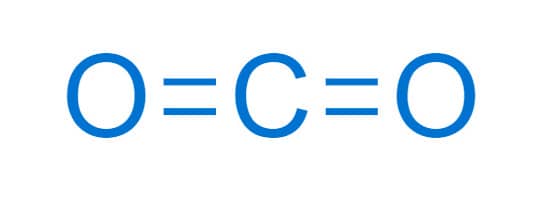
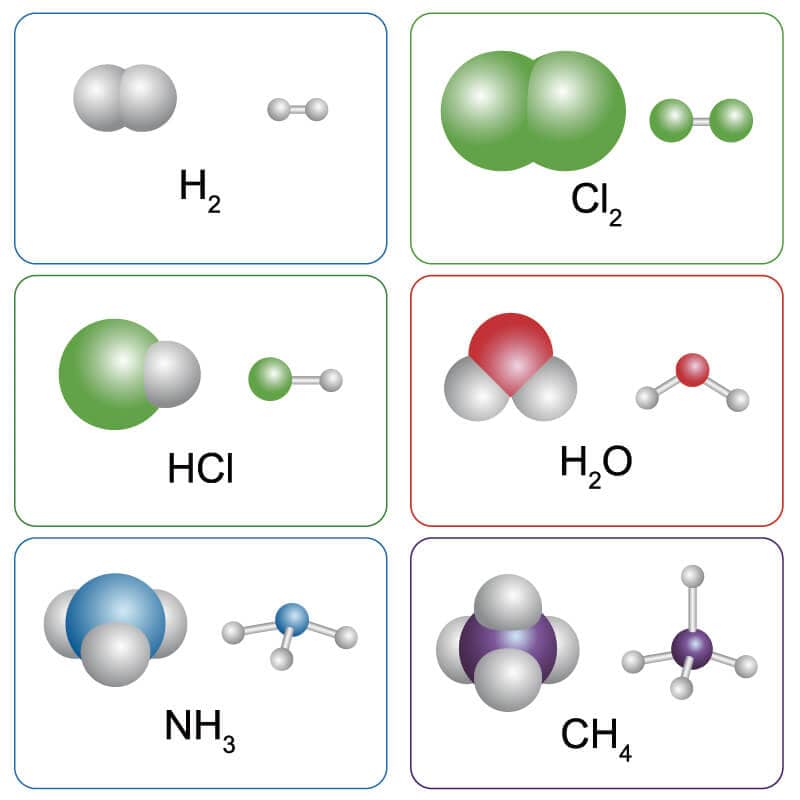
A ideia de regularidade geométrica das moléculas como forma de equilibrar os dipolos levando a uma molécula apolar é válida desde os compostos mais simples até às estruturas mais complexas. Assim, moléculas como H2, Cl2 e CH4 são apolares, enquanto moléculas HCl, H2O e NH3 são polares.
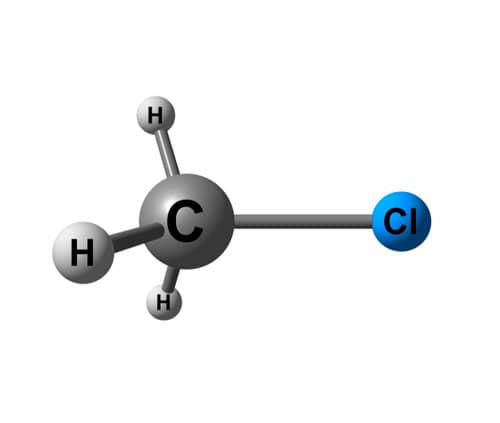
Observe que enquanto a molécula de metano, CH4 é apolar, um derivado do metano, o clorometano, CH3Cl, é polar. Ambas as moléculas têm geometria tetraédrica, entretanto o metano é totalmente regular, tendo em vista que o carbono está ligado a 4 hidrogênios.
A molécula de etano, C2H6, é outro exemplo de molécula apolar que apresenta simetria na geometria molecular. Nesta molécula, 2 carbonos estão ligados entre si e cada carbono se liga a 3 átomos de hidrogênio. Entretanto, a substituição de 1 átomo de hidrogênio por 1 átomo de cloro gera uma molécula de cloroetano (C2H5Cl), que é uma molécula sem simetria e, portanto, polar.
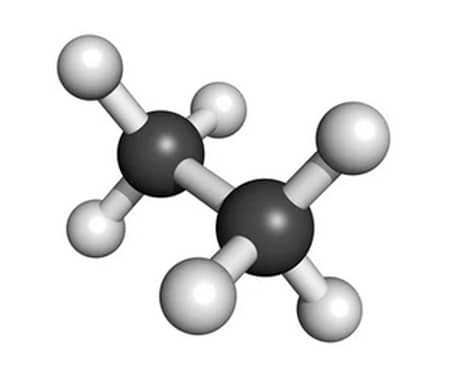
Molécula apolar de etano, μ = 0
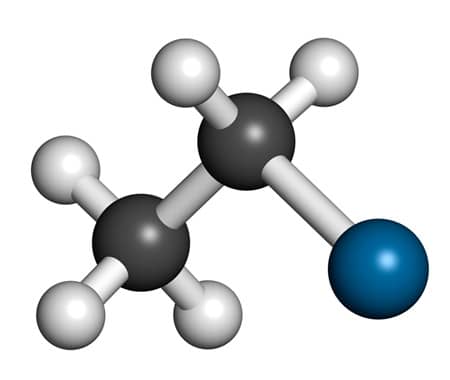
Molécula polar de cloroetano, μ = 2,06 D
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
A Química Orgânica continua como um ramo diferenciado da grande ciência Química. Verificamos em nosso estudo a importância de uma classe específica de compostos caracterizados pela presença de carbono na estruturação de suas moléculas.
A ligação química covalente e seu modelo por compartilhamento de elétrons são responsáveis por conectar o átomo de carbono aos demais elementos que compõem as moléculas orgânicas. Vimos que há diferentes teorias para explicar como os elétrons participam da ligação covalente, mas as duas mais importantes são a teoria da ligação de valência (LV) e a teoria do orbital molecular (OM).
O carbono é a peça-chave da Química Orgânica e sua versatilidade está na capacidade de formar quatro ligações e apresentar diferentes hibridizações em seus orbitais, levando à múltiplos arranjos de estrutura, geometria e polaridade em suas moléculas.
Podcast
Para encerrar o tema, o especialista Bruno Cavalcante Di Lello fará um breve resumo de todo conteúdo.
CONQUISTAS
Você atingiu os seguintes objetivos:
Reconheceu as diferenças entre Química Orgânica e Inorgânica, o histórico e a importância das moléculas orgânicas.
Identificou a configuração eletrônica das espécies químicas com a dos elétrons presentes na camada de valência.
Reconheceu moléculas orgânicas em suas diferentes representações e o uso adequado das ligações químicas envolvidas em sua construção.
Identificou as diferentes geometrias e o caráter polar ou apolar das moléculas orgânicas de acordo com as configurações de suas estruturas.