Descrição
Introdução ao estudo da Enzimologia: principais condições, fatores patológicos e métodos de dosagem. Marcadores do infarto agudo do miocárdio: principais achados laboratoriais e metabolismo mineral e ósseo.
PROPÓSITO
Compreender os principais conceitos em Enzimologia, os marcadores séricos do infarto agudo do miocárdio e a avaliação do metabolismo mineral e ósseo em seus estados basais e alterações em condições patológicas, assim como os métodos usados para o diagnóstico, é importante para o profissional priorizar as atividades que exerce no laboratório clínico, sendo capaz de realizá-las com caução e qualidade.
Preparação
Tenha acesso a um dicionário médico on-line para consultar as doenças relatadas no conteúdo.
OBJETIVOS
Módulo 1
Descrever as principais enzimas, as condições patológicas que alteram sua concentração e os métodos de diagnóstico laboratorial
Módulo 2
Identificar os marcadores cardíacos laboratoriais do infarto agudo do miocárdio
Módulo 3
Reconhecer os marcadores séricos que permitem a identificação das doenças relacionadas ao metabolismo mineral e ósseo
Introdução
Neste conteúdo, você vai identificar os principais conceitos em Enzimologia, aprender a interpretar os resultados séricos de enzimas relacionadas ao infarto agudo do miocárdio (IAM) e monitorar os marcadores do metabolismo mineral e ósseo em condições basais e patológicas, e aplicando corretamente o método de detecção dos metabólitos associados a cada condição proposta.
Você vai também relacionar as alterações detectadas pelos testes bioquímicos no soro com as condições patológicas, estudando o comportamento fisiológico e as correlações com a doença clínica. Vamos juntos?
MÓDULO 1
Descrever as principais enzimas, as condições patológicas que alteram sua concentração e os métodos de diagnóstico laboratorial
Enzimologia e níveis de enzimas no plasma
Enzimologia é a ciência que estuda as enzimas e sua natureza química, as funções biológicas e as alterações, bem como o seu significado como biomarcador. Enzimas são proteínas que atuam acelerando reações químicas, agindo como catalisadores; portanto, sob determinadas condições.
Esses compostos proteicos globulares têm alto poder catalítico, grau elevado de especificidade ao seu substrato, não sendo consumidos após as reações químicas nas quais estão envolvidos. É parte da sua atividade não influenciar ou alterar o equilíbrio químico das reações, sendo reguladas por via genética ou pelas condições metabólicas. A atuação como enzima não é função exclusiva de proteínas, pois já foram descritas moléculas de RNA, denominadas ribozimas, que também executam a mesma função.
A especificidade de cada enzima é determinada por características de uma cavidade ou sítio de ligação ao substrato, alocado na sua superfície. Essa denomina-se sítio ativo, uma ordenação de grupos presentes em cadeias laterais de alguns aminoácidos que se acoplam ao substrato a partir de ligações não covalentes. A ligação enzima-substrato ocorre pela complementaridade, em um modelo chave e fechadura ou sítio-específica.
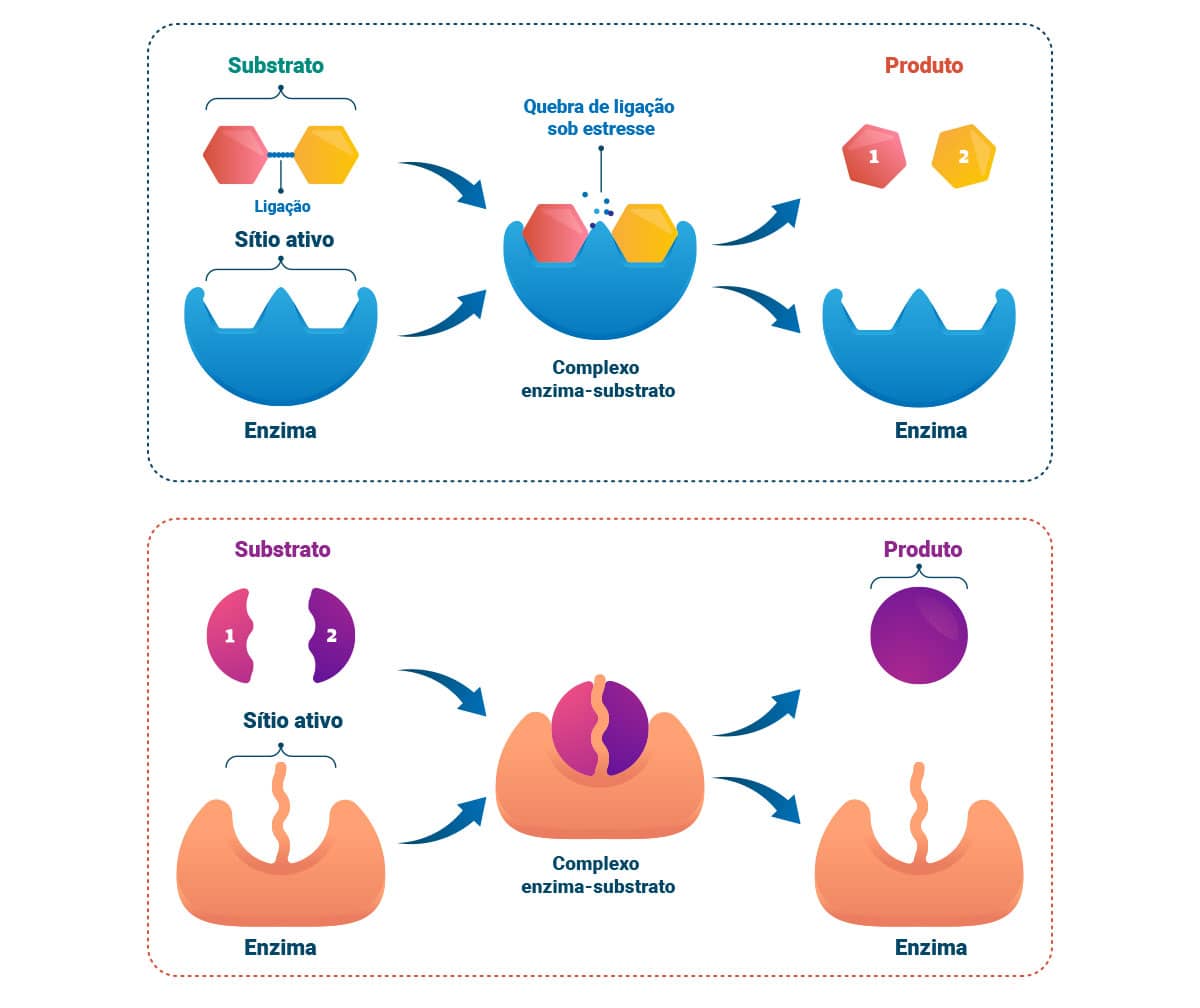
É bastante comum que as enzimas demandem a ação conjunta de moléculas orgânicas ou inorgânicas de tamanho diminuto, essenciais à sua atividade, são elas:
COENZIMAS
Moléculas orgânicas, frequentemente, derivadas de vitaminas, a exemplo do FAD e do NAD.
COFATORES
Íons metálicos de transição, já que os metais são essenciais à catálise, como Fe2+, Zn2+ e Cu2+.
Um sistema de nomenclatura e categorização enzimática foi acatado pela União Internacional de Bioquímica e Biologia Molecular (IUBMB) e nos permite identificá-las em seis classes, combinadas com a natureza da reação química que catalisam:
Certos fatores podem perturbar a atividade enzimática, dentre os principais, temos: temperatura, pH, concentração do substrato, tempo e produto da reação. Além dos já citados, vale ressaltar a importância da integração das enzimas nas vias metabólicas e a interrelação dos produtos de uma via com outras. As vias metabólicas não operam em capacidade máxima o tempo todo. Diversos processos celulares podem ser interrompidos, inibidos ou ativados, durante certas fases do ciclo vital, por influência enzimática; entre eles estão aqueles que permitem um crescimento celular controlado e econômico.
Em se tratando das concentrações e atividades de certas enzimas, podemos observar que o mecanismo de controle é mediado por:
- Controle genético - Controla indução ou repressão enzimáticas.
- Modificação enzimática covalente - São reações químicas reversíveis, catalisadas por outras enzimas, o que resulta na ativação ou inibição.
- Regulação alostérica - Quando as enzimas são reguladas por moduladores ligados a outro(s) sítio(s), sofrendo modificações conformacionais não covalentes.
- Compartimentalização - A síntese de algumas enzimas como moléculas precursoras, denominadas zimogênios/proenzimas, de início inativas, e que são ativadas em seguida pela clivagem de ligações peptídicas específicas.
Peptídicas específicas
Por exemplo:
Pepsinogênio ⇒ pepsina
Tripsinogênio ⇒ tripsina
Proelastase ⇒ elastase
Entre outras.
As enzimas podem ser plasma-específicas, secretadas e celulares. Durante algumas situações, já bem estabelecidas, ocorre o aumento na liberação plasmática de enzimas, como, por exemplo:
- Lesão celular extensa (por isquemia ou toxinas).
- Proliferação e aumento da multiplicação/renovação celular (elevação da fosfatase alcalina por restauração óssea pós-fraturas).
- Índices elevados de produção enzimática (aumento da gama-glutamil transferase em etilistas).
- Obstrução dos ductos pancreáticos, o que pode resultar no extravasamento de enzimas digestivas (amilase e lipase pancreática) para as ilhotas de Langerhans (ou Ilhotas pancreáticas), causando inflamação pancreática.
A redução nos níveis enzimáticos pode ser devido a: síntese reduzida da enzima, deficiência congênita ou variantes anormais com atividade metabólica ínfima.
As enzimas presentes nos fluidos biológicos são derivadas, sobretudo, do processo normal de aniquilamento, do metabolismo e da reposição celular. Contudo, algumas delas são detectadas em índices superiores após lesão tecidual ocasionada por processos patológicos, decorrentes da permeabilidade celular aumentada ou da morte precoce da célula. Quanto mais elevada a concentração entre os níveis intra e extracelular da enzima, mais rapidamente ela difunde para fora e pode ser detectada por diferentes métodos de diagnóstico em Bioquímica Clínica.
Plasma-específicas, secretadas e celulares
Plasma-específicas - Enzimas que atuam no plasma e agem nos processos de coagulação e fibrinólise, como os fatores X e XII da cascata de coagulação.
Secretadas - Enzimas que geralmente são secretadas inativas e, após a ocorrência da ativação, são direcionadas a agir em pontos extracelulares, como a lipase, tripsinogênio e o antígeno prostático específico.
Celulares - Enzimas cujos níveis normais são baixos no soro e se elevam após a doença que causa algum tipo de lesão tecidual, a exemplo das transaminases e lactato desidrogenases
Atenção
A dosagem das enzimas séricas é de suma importância, pois elas são marcadores sensíveis de lesão ou proliferação celular, permitindo em alguns casos localizar o local lesionado, bem como o acompanhamento do tratamento e o prognóstico da doença.
Veja, a seguir, as formas variantes, ou isoformas, de algumas enzimas, e suas características fisiológicas.
Isoenzimas e isoformas
Isoenzimas são formas múltiplas de uma enzima que catalisam uma mesma reação bioquímica, mas com estruturas moleculares um pouco diferentes que possibilitam a separação por eletroforese. Em geral as isoenzimas estão em diferentes órgãos em concentrações caraterísticas.
Exemplo
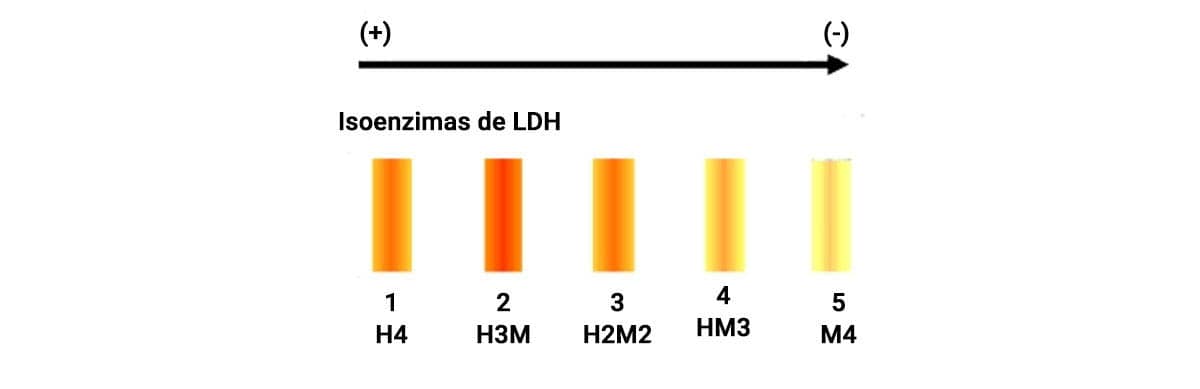
A enzima lactato desidrogenase (LDH) é um exemplo bastante conhecido. Quimicamente, sua estrutura proteica se apresenta como um tetrâmero, com dois tipos de cadeias polipeptídicas: a cadeia M (músculo) e a cadeia H (coração). Sua combinação gera cinco isoenzimas: LDH1 (formado por quatro subunidades H - H4), LDH2 (formado por três subunidades H e uma M -H3M); LDH3 (formado por duas subunidades H e duas M – H2M2); LDH4 (formado por 3 subunidades M e uma subunidade H – HM3) e LDH5 (formado por 4 subunidades M-M4), distribuídas em localizações diferentes, sendo detectadas no miocárdio, hemácias, cérebro, fígado e musculatura esquelética. Essas formas variantes da mesma enzima são as isoenzimas, produzidas a partir de genes diferentes ou por processo alternativo, como a recombinação gênica entre alelos.
Segundo a IUBMB, as isoenzimas modificadas após a tradução, são chamadas de isoformas. Por exemplo, após uma lesão cardíaca, como uma necrose, as isoenzimas tissulares CK-MM (isoenzimas da creatinoquinase) caem na circulação sanguínea e podem sofrer alterações enzimáticas, originando as isoformas CK-MM1, CK-MM2. No entanto, em bioquímica, isoformas e isoenzimas são utilizadas como sinônimos.
Além dessa enzima, é válido citar outras que possuem isoenzimas. Vamos conhecê-las?
Creatinoquinase
Sua função ocorre nas células musculares (esqueléticas e cardíacas), no armazenamento de creatina fosfato; é altamente energética. Está associada aos sistemas de geração de adenosina trifosfato (ATP) nas contrações ou transporte celular. A CK catalisa a reação de fosforilação reversível da creatinina, às custas de ATP, formando creatina fosfato.
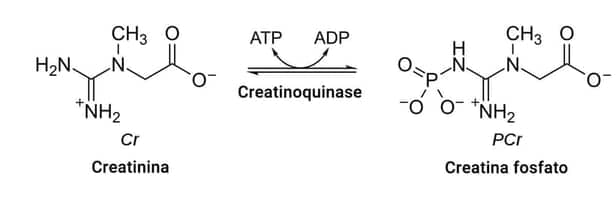
A creatinoquinase está distribuída amplamente nos tecidos e órgãos, e é bastante elevada no músculo esquelético, cérebro e coração. É um dímero composto sempre por subunidades M (muscular) e/ou B (cerebral), com as suas isoformas: CK-BB ou CK-1, CK-MB ou CK-2 e CK-MM ou CK-3. Duas isoenzimas macromoleculares têm sido consideradas como causa de falso positivo para a CK-MB:
CK-BB ou CK-1, CK-MB ou CK-2 e CK-MM ou CK-3
CK-BB ou CK-1 - mais comum no cérebro, raramente no sangue.
CK-MB ou CK-2 - mais comum no coração/miocárdio.
CK-MM ou CK-3 - músculo esquelético.
A macro tipo 1 é um complexo de CK-BB ou CK-MM ligado a IgG ou IgA
A macro CK tipo 2 é um complexo oligomérico de origem mitocondrial e está associada a neoplasias.
De grande importância, a CK pode variar de acordo com sexo, idade, massa muscular, atividade física e etnia. Seus níveis séricos podem estar elevados na: distrofia muscular progressiva (de Duchene), miosite viral e polimiosite, hipertermia maligna, polimiopatia necrosante, uso de drogas de abuso e estados psicóticos agudos. Além dessas, no IAM, em procedimentos cardíacos, angina pectoris, choque cardiogênico e miocardite. Os níveis séricos podem estar elevados também nas lesões no Sistema Nervoso Central (SNC), como craniais com dano cerebral, neurocirurgia, isquemia cerebral, hemorragia subaracnoidea, síndrome de Reye e hipertireoidismo.
Lactato desidrogenase (LDH)
Essas enzimas e suas isoenzimas têm função de oxidorredutases, catalisadoras da reação reversível do lactato ao piruvato, por ação da coenzima NAD, que irá doar ou receber os hidrogênios.
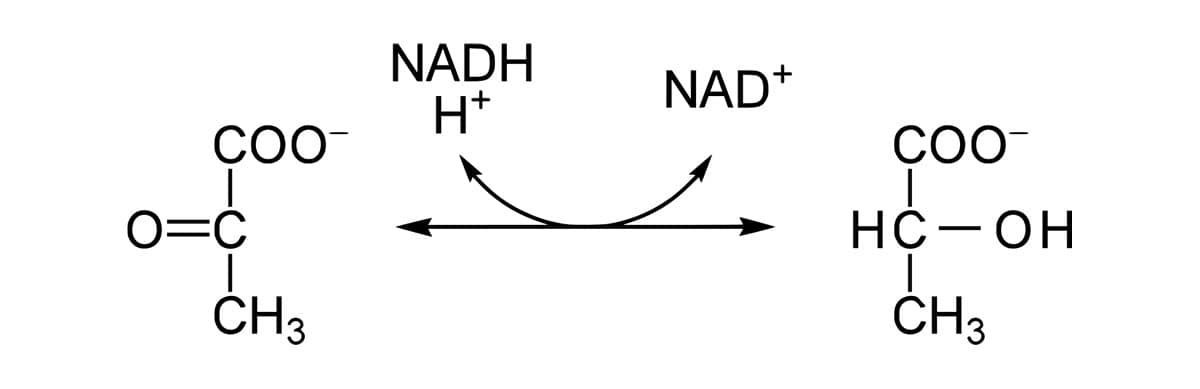
Como você viu, a LDH possui cinco isoenzimas, presentes em todas as células, porém, com abundância variada em alguns tecidos, tais como:

Ou HHHH, miocárdio e hemácias.

Ou HHHM, miocárdio e hemácias.

Ou HHMM, pulmão, linfócitos, baço, pâncreas.

Ou HMMM, fígado e músculo esquelético.

Ou MMMM, fígado e músculo esquelético.
A atividade da LDH encontra-se elevada no: IAM, insuficiência cardíaca congestiva (ICC), miocardite, choque ou insuficiência circulatória, anemia megaloblástica, implantação de válvula cardíaca artificial, doenças hepáticas com icterícia, mononucleose infecciosa, enfermidade renal (necrose tubular e pielonefrite), doenças malignas (Hodgkin, câncer pulmonar e na região do abdômen), distrofia e trauma muscular, exercícios muito intensos, embolia pulmonar e pneumocistose.
Na urina, dosagens elevadas podem indicar glomerulonefrite crônica, lúpus eritematoso sistêmico (LES), nefrosclerose diabética e câncer de rins e bexiga. No líquor (LCR), valores muito elevados podem ser decorrentes de hemorragias ou lesões na barreira hematoencefálica, meningite bacteriana ou viral, tumores cerebrais, convulsões e hidrocefalia.
Fosfatase ácida (FA)
Consiste em um grupo de fosfatases que exibem pH ótimo de ação entre 4,5 e 7,0; catalisam a hidrólise de um monoéster fosfórico, produzindo álcool e um grupamento fosfato. A FA está bem distribuída pelos tecidos do corpo, aparecendo bastante concentrada na próstata, nos osteoblastos, fígado, baço, rins, hemácias e plaquetas.
Nos homens, a fração da FA prostática atinge cerca de 50% do total, tendo alta importância na detecção de câncer de próstata pela análise da fração prostática da fosfatase (FACP). A hiperfosfatasemia pode ocorrer no carcinoma prostático, após cirurgia/terapia anti-androgênica, palpação retal, doença de Paget, hiperparatireoidismo, câncer de mama metastático, anemia megaloblástica, mononucleose, prostatite, policitemia vera, leucemia mielocítica e mieloma múltiplo.
Saiba mais
Como a FA prostática está em alta concentração no sêmen e no tecido prostático, ela é utilizada em medicina legal como marcador para investigação de estupro e outras ofensas.
Amilase e lipase – pancreatite e seus achados laboratoriais
A amilase é uma enzima fundamental ao metabolismo digestivo; age como hidrolase, catalisa a conversão do amido e do glicogênio que adentram o sistema digestivo pela alimentação.
Amido e do glicogênio
Amido: Polissacarídeo formado pela união de moléculas de α-glicose da amilose e da amilopectina, sendo armazenado em diferentes órgãos vegetais.
Glicogênio - Principal reserva de glicose nas células animais e bactérias, encontrado, principalmente, no fígado e nos músculos. Na alimentação é obtido a partir de alimentos de origem animal.
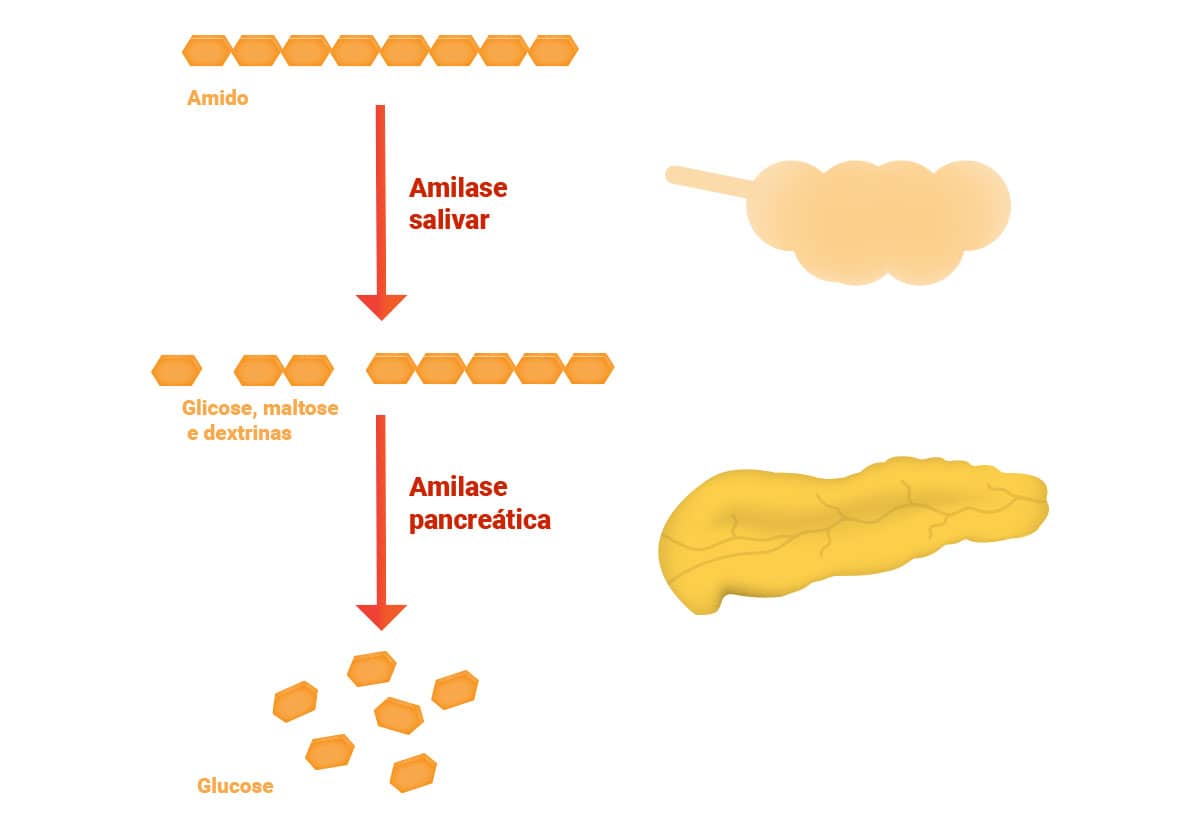
A amilase secretada pelas glândulas salivares (S) hidrolisam o amido ainda no processo de mastigação e salivação, e células acinares pancreáticas (P) secretam parte da amilase sérica no trato gastrointestinal, via ducto pancreático, agindo no duodeno.
Há também atividade dessa enzima no líquido seminal, nas tubas uterinas, nos pulmões, músculo esquelético estriado e tecido adiposo corpóreo.
O aumento dos níveis séricos da amilase pode decorrer de pancreatite aguda, além de trauma, carcinoma ou abscesso pancreático, parotidite, doenças do trato biliar, trauma cerebral, cetoacidose diabética, alcoolismo agudo e uso de drogas. Essa situação é terminologicamente tratada por hiperamilasemia.
No caso de hipoamilasemia, seus valores decrescidos têm correlação com doença renal, câncer de pulmão, síndrome de Meigs (ascite e fibroma de ovário) e lesões nas glândulas salivares.
Parotidite
Infecção viral que afeta as glândulas salivares e glândulas parótidas.
Na pancreatite aguda (PA), os achados laboratoriais apontam para a hiperamilasemia, processo inflamatório do pâncreas, que se apresenta edemaciado, hemorrágico e com necrose, estando os níveis de amilase sérica aumentados entre 2 e 12 horas após a epigastralgia constante; a proporção do aumento não tem ligação direta com a gravidade de cada caso.
Aproximadamente 20% dos indivíduos com PA apresentam índices dentro da normalidade desse analito. Junto com a hiperamilasemia, é fundamental avaliar os demais marcadores que auxiliam no fechamento do diagnóstico, são eles: amilase urinária, depuração da amilase, isoformas da amilase e lipase. Esse quadro também é acompanhado de leucocitose, hiperglicemia, aumento da concentração sérica de LDH e da enzima alanina aminotransferases (ALT), além da elevação do hematócrito, redução do cálcio sérico e hipotensão arterial.
A lipase é uma enzima produzida exclusivamente pelo pâncreas; hidrolisa os triglicerídeos, pelo rompimento das ligações éster nos átomos de carbono 1 e 3 dos triglicerídeos em 2-monoacil-glicerol. Trata-se de uma enzima muito específica, atuando em ambiente que contém os sais biliares e necessitando de um cofator enzimático, a colipase.
Tanto as enzimas como o seu cofator são produzidos nas células acinares pancreáticas, podendo ser detectadas no intestino, nos glóbulos brancos, língua, leite materno e tecido adiposo. A condição de hiperlipasemia, que pode ser dosada no soro, líquido ascético e líquido pleural, é unicamente empregada no diagnóstico de doenças pancreáticas, especialmente, em casos agudos.
Na pancreatite aguda, há aumento entre 4 e 8 horas após o início do quadro, e pode perdurar por até 24 horas. Pode acompanhar a hiperamilasemia, mas cerca de 20% dos pacientes apresentam amilase normal e lipase aumentada. Ainda pode-se observar esse marcador com taxas aumentadas em: pancreatite crônica, úlceras duodenais gástricas, colecistite aguda, doença renal aguda ou crônica e obstrução do ducto pancreático.
Saiba mais
Alguns fatores podem deflagrar a gravidade da pancreatite aguda. São eles: idade maior que 55 anos, leucocitose superior a 16.000/µL, hiperglicemia menor que 200 mg/dL, LDH sérica > 400 UI/L e AST > 250 UI/L. Quando três ou mais critérios estão presentes no momento da admissão do paciente, é indicativo da gravidade do quadro. Além disso, é importante observar alguns parâmetros nas primeiras 48 horas, indicando mau prognóstico, como queda no hematócrito > 10%, deficit de líquido > 4 L, hipoxemia (PaO2 < 60 mmHg), hipocalcemia < 3,2 mg/dL, hipoalbuminemia < 3,2 mg/dL, entre outros.
Dosagem de enzimas no soro
Aqui, você vai conhecer abordagens analíticas para a medida da atividade enzimática e tipos de métodos empregados em um laboratório clínico.
Os métodos de análise e diagnóstico em Bioquímica Clínica, para a avaliação das enzimas, têm evoluído bastante ao longo do tempo. O laboratório clínico atualmente emprega técnicas automatizadas para seus ensaios e dosagens enzimáticas no soro, urina, ou líquido cefalorraquidiano, por exemplo, mas há diversos ensaios disponíveis quando se almeja identificar e/ou quantificar as enzimas nos principais fluidos biológicos.
Ainda que haja métodos diversificados, note que alguns serão comumente empregados na maioria dos laboratórios clínicos. As análises de biomoléculas podem ser executadas de modo a alcançar resultados qualitativos, de presença ou ausência em uma amostra, ou quali-quantitativos, pela determinação da presença e quantidade em um determinado material biológico.
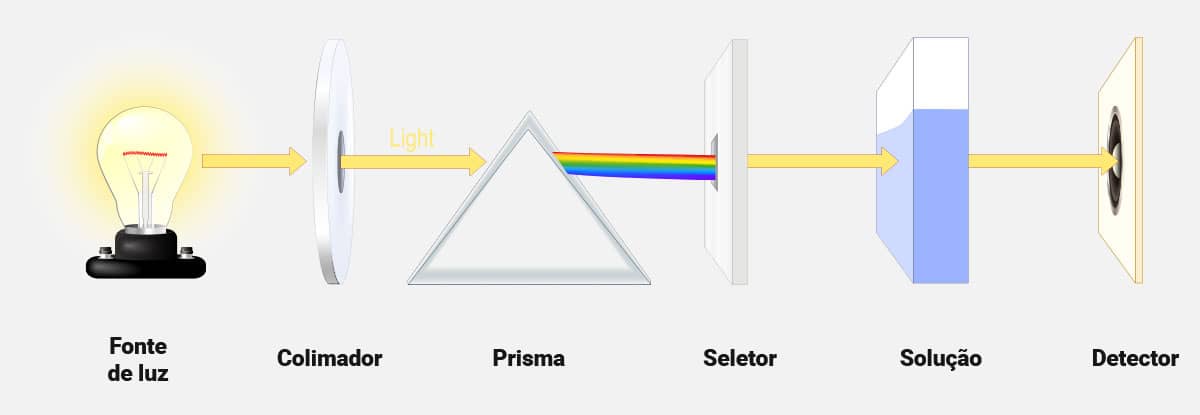
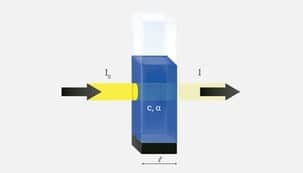
Os métodos ópticos, como a colorimetria e a espectrofotometria, baseiam-se na capacidade de algumas soluções absorverem/transmitirem a luz que incide sobre uma solução, a partir de fonte luminosa.
Essas medidas caracterizam índices de absorbância e transmitância, postulados pela Lei de Lambert-Beer. Repare, a cubeta com líquido azul que é uma solução de amostra. A diferença entre a luz incidida (amarelo escuro) e luz que atravessa (amarelo claro) se traduz na forma de absorbância e indica a concentração, maior ou menor, da solução.
Considerando que a luz é uma radiação eletromagnética composta de comprimentos de ondas, as análises colorimétricas são baseadas no princípio da absorção da luz visível pela substância a ser dosada; na espectrofotometria, o espectro de luz absorvido apresenta comprimentos de onda entre o ultravioleta e o infravermelho. Portanto, quanto mais elevada a concentração do analito pesquisado, maior a absorção de luz pela solução (absorbância), sendo grandezas diretamente proporcionais.
Impotância laboratorial da enzimologia no diagnóstico de sindromes metabólicas
A especialista Jéssica Ribeiro Lima fala sobre a importância das dosagens enzimáticas para o diganóstico das síndromes metabólicas.
A automação em laboratório clínico, recentemente, passou a adotar essas metodologias, que vêm inseridas em equipamentos de grande porte, com medidas bastante precisas e rapidamente realizadas. Isso favorece a liberação de resultados precisos, com alta sensibilidade e reprodutibilidade, respeitando as regras mais estritas de controle de qualidade da análise.
Inicialmente, você vai ver como essas metodologias são empregadas de forma diferencial aos analitos e, adiante, os métodos mais avançados de diagnóstico empregados na atualidade para os demais. Nos próximos módulos, você conhecerá outras enzimas e perceberá que cada enzima pode ser detectada por métodos diferentes. Veja a seguir.
Métodos para determinar a amilase
Amiloclástico (Iodométrico)
Método que se baseia na capacidade do iodo em se combinar com o amido e gerar uma coloração azul intensa na reação; após a amilase agir num substrato por certo tempo, a cor azul em sua intensidade é medida, e assim sabe-se o teor de amido restante. Essa é a técnica de Van Loon modificada por Caraway.
Cromolítico
Método que emprega amido complexado a um corante, compondo um substrato complexo insolúvel. Ao interagir com a amilase, forma pequenas porções de corante-substrato solúveis em água medidos por fotometria, e pode ser automatizado.
Turbidimetria, nefelometria e de polarização fluorescente
Métodos que também podem ser utilizados nas dosagens de amilase. Oferecem rapidez e simplicidade em sua execução, monitorando a turvação/turbidez de uma mistura.
Métodos para determinar a lipase
Titulometria
Usando-se uma emulsão tamponada de azeite de oliva (substrato), é feita uma incubação com o soro teste por 24 horas, e a titulação dos ácidos graxos liberados é feita com hidróxido de sódio, empregando-se a fenolftaleína como agente indicador.
Turbidimetria ou nefelometria
Oferecem rapidez e simplicidade em sua execução, monitorando a turvação/turbidez de uma mistura/emulsão de azeite de oliva resultante da ação da enzima lipase sobre um substrato.
Enzimático
A lipase hidrolisa triglicerídeos como seu substrato, gerando glicerol livre que pode ser quantificado.
Métodos para determinar a fosfatase alcalina (FAL)
Beta-glicerofosfato
Método que quantifica a liberação do Pi (fosfato inorgânico) do beta-glicerofosfato, após a ação da FAL.
p-nitrofenilfosfato
Neste método, a atividade da FAL é medida pelo quantitativo de fenol liberado do p-nitrofenilfosfato, após sua incubação com o soro.
4-nitrofenilfosfato
Método proposto por Bowers e McComb, é o mais usado presentemente. Nesse método, a fosfatase alcalina, em meio alcalino, catalisa a transferência do grupo fosfato do 4- nitrofenilfosfato ao 2-amino-2metil-1-propanol (AMP), liberando 4-nitrofenol. A concentração é determinada pela velocidade de formação do 4-nitrofenol, medido em 405 nm, sendo diretamente proporcional à atividade enzimática da amostra.
Métodos para determinar a fosfatase ácida (FA)
Timolftaleína monofosfato
Método bastante empregado, trata-se de um substrato (timolftaleína monofosfato) que age como indicador, altamente específico para a FA, formando cor após a reação final. Esse ensaio é especificado para a fosfataste ácida prostática.
Enzima imunoensaio
Método sorológico no qual é feita a detecção de um anticorpo monoclonal ligado à FA, em suporte sólido.
Radioimunoensaio e cinética fluorométrica
Também são métodos que servem para detectar a fosfatase ácida.
Métodos para determinar aminotransferases (transaminases)
Formação de cor
Ocorre por causa da interação entre o piruvato ou oxalacetato e a dinitrofenilhidrazina, que forma as hidrazonas correspondentes. Trata-se de um método já obsoleto.
Química seca (automação)
O piruvato ou o oxalacetato, formados por causa das aminotransferases presentes – sejam a ALT ou a AST, respectivamente –, são reduzidos pela NADH após reagirem, devido à presença da LDH e à adição de piridoxal-5-fosfato ao soro.
Método para determinar creatinoquinases e suas frações (CK, CK-MM, CK-MB e CK-BB)
Imunoinibição (técnica sorológica que emprega anticorpos anti-CK-M para inibir a fração CK-MM e detectar a fração CK-MB).
Ensaios imunoenzimáticos e de massa.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Identificar os marcadores cardíacos laboratoriais do infarto agudo do miocárdio
Fisiopatologia do infarto agudo do miocárdio (IAM)
As doenças cardiovasculares podem afetar o coração e os vasos sanguíneos; grande destaque para a doença arterial coronariana, que envolve dor no peito e infarto agudo do miocárdio, sendo a maior causa de morbimortalidade no mundo. Segundo o Ministério da Saúde (2019), no Brasil, por ano, 300 mil pessoas sofrem IAM, ocorrendo óbito em 30% dos casos.
Miocárdio
O miocárdio é um tecido muscular cardíaco, formado por fibras musculares estriadas cardíacas, anastomosadas, compondo a parte contráctil do coração.
A região mais interna chama-se endocárdio e a mais externa, epicárdio. O músculo é envolto por um saco fibroso, o pericárdio, e por um líquido que forma uma barreira contra choques mecânicos, o líquido pericárdico. Pode ocorrer a morte do tecido de parte do músculo cardíaco por carência de oxigênio, quando a artéria coronária fica obstruída. Tal evento é conhecido informalmente como “ataque cardíaco”. Essa obstrução pode ocorrer especialmente pela formação de um coágulo em uma área previamente comprometida por aterosclerose, provocando estreitamentos do espaço interno dos vasos sanguíneos do coração.
Infarto agudo do miocárdio
Observando os processos patológicos, ocorre a necrose irreversível do músculo cardíaco, como resultado de isquemia (perda do suprimento do sangue). Esse processo é ocasionado pela aterosclerose, um processo inflamatório localizado dentro da parede arterial na forma de placas de ateroma, que diminui o lúmen arterial, em geral, nas artérias coronárias e, consequentemente, o suprimento sanguíneo de determinada região tecidual. O rompimento da placa, gera a trombose no local da lesão vascular e formação dos êmbolos com a oclusão total do vaso, levando ao infarto ou falência do miocárdio.
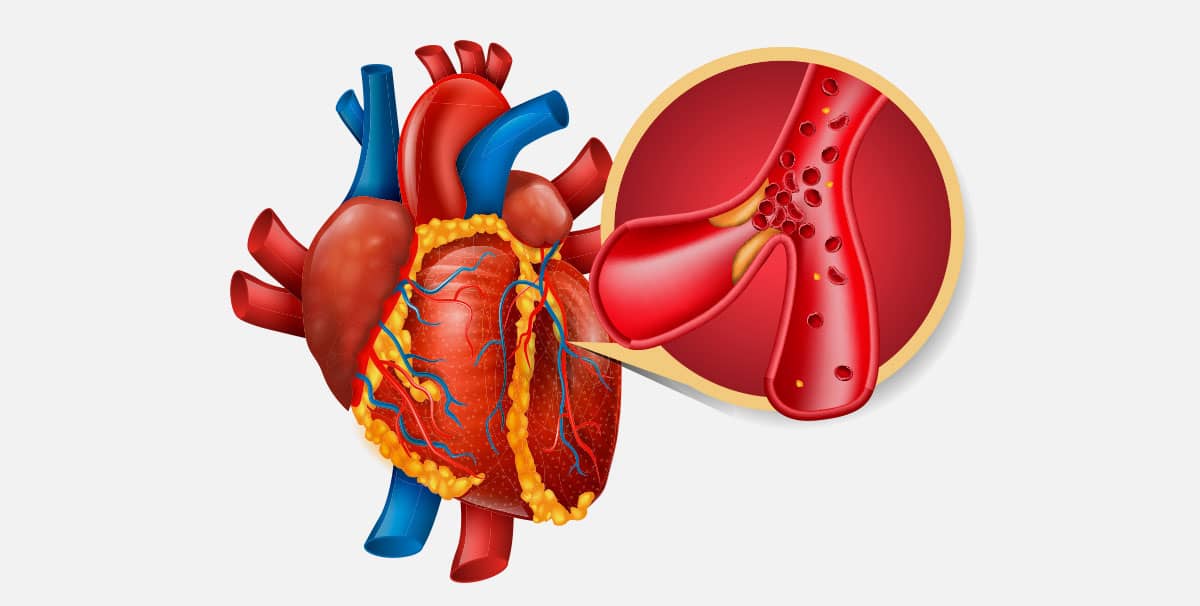
De início, o processo de isquemia é detectado e pode culminar no IAM. A extensão da lesão varia de acordo com a obstrução da coronária, o grau de circulação colateral do indivíduo e as demandas de oxigênio dos tecidos alimentados pela artéria.
Existe uma tríade sintomatológica marcadora do IAM, que se dá pela presença de dor precordial, alterações no eletrocardiograma (ECG) – elevações dos segmentos ST e da onda Q – e enzimas cárdio-específicas elevadas na dosagem quali-quantitativa, sendo estes marcadores verificados rotineiramente em casos suspeitos de IAM.
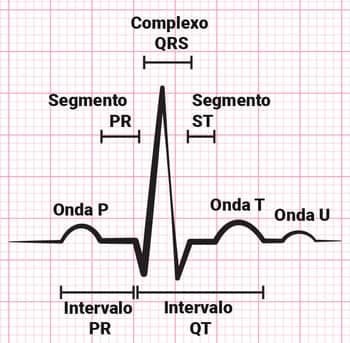
ECG normal.
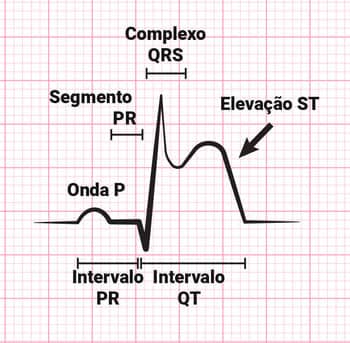
ECG de paciente com infarto do miocárdio com elevação do segmento ST.
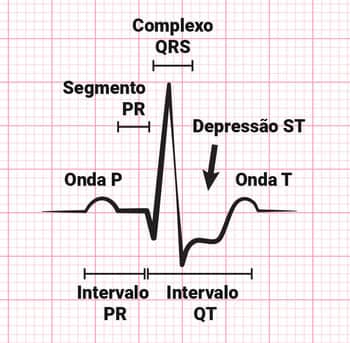
ECG de paciente com infarto do miocárdio sem elevação do segmento ST.
Nem todos os pacientes manifestam os mesmos sintomas e os graus de intensidade podem variar; diante disso, há necessidade de se esclarecer possíveis suspeitas clínicas relacionadas a quadros de angina pectoris, ICC e embolia pulmonar.
A síndrome coronariana aguda (SCA) engloba os denominados eventos isquêmicos do miocárdio, desdobrando-se desde angina, injúria tecidual reversível e angina instável até infarto do miocárdio e extensa necrose tissular miocárdica. O desafio diagnóstico naqueles pacientes que referem queixa de dor precordial tem sido, tradicionalmente, o de firmar ou excluir a existência de lesão miocárdica.
Para o diagnóstico de IAM, devem ser preenchidos, ao menos, dois dos seguintes requisitos:
Sintomas clínicos sugestivos de isquemia miocárdica superiores a 30 minutos de permanência.
Alterações no ECG correlacionáveis com lesão miocárdica.
Ascensão seriada na atividade de enzimas cardíacas séricas dosadas.
Cerca de 20% dos IAM não apresentam sintomas marcantes, além de ausência de ECG característico (sem elevação do segmento ST) em alguns pacientes. Na Enzimologia Clínica, são dosadas: a CK, LDH, e as isoenzimas de ambas, e menos frequentemente as transaminases (particularmente a AST, aspartato-aminotransferase). Há períodos específicos para os quais cada marcador enzimático se faz mais eficiente, após o surgimento dos primeiros sintomas do IAM. A relação tempo/detecção pode variar entre os pacientes, mas pode-se basear as análises em valores padrão.
Marcadores clássicos do IAM (enzimas)
Creatinoquinase total e CK-MB, lactato desidrogenase total e LDH-1 e aspartato-aminotransferase (AST) são marcadores clássicos do infarto agudo do miocárdio.
Como visto anteriormente, a enzima CK catalisa a reação de fosforilação, reversível, da creatinina pelo ATP, formando creatina fosfato. Ela é distribuída amplamente nos tecidos e órgãos, mas mostra-se bastante elevada no músculo esquelético, cérebro e coração, e seus valores séricos podem variar com o sexo, idade, massa muscular, atividade física e etnia, elevando-se em diversas situações. A sua fração CK-MB ou CK-2 é a mais comum no coração/miocárdio.
A CK-MB existe em grandes quantidades no miocárdio e pode ter seus níveis séricos aumentados de forma expressiva. Sua elevação média após o infarto é de 10 a 20 vezes o limite superior da normalidade e, devido à curta meia-vida, retorna rapidamente aos valores de normalidade. O CK-MB pode ser expresso por porcentagem do CK total – esses valores vão de 3 a 6. Apresenta alta especificidade, principalmente se há suspeita de IAM e se os valores começam a aumentar de 4 a 8 horas após a dor precordial, com pico máximo entre 12 e 24 horas.
Atenção
É relevante ressaltar que nos casos mais brandos, sem complicações, os valores de CK-MB retornam aos níveis basais de 48 a 72 horas após o infarto. Para tornar ainda maior a especificidade no IAM, analisam-se outros marcadores, como as isoenzimas da LDH (LDH-1), que deve ser dosada periodicamente nas 48 horas ou mais após o episódio, para observar aumentos e diminuições típicas desse analito.
Atenção
Nos casos de câncer de pulmão, além dos casos de desordem cerebral aguda, entre outras condições, a CK-BB pode ser convertida em CK-MB. A CK-MB também pode elevar-se nas seguintes situações: angina severa, fibrilação muscular crônica, pericardite, desfibrilação, angiografia coronária, reanimação cardiopulmonar e processos malignos, dentre outras.
A lactato desidrogenase total se encontra elevada de 8 a 12 horas após o IAM, considerando-se o início da dor precordial como marcador, podendo assim permanecer por uma semana, elevando-se de três a dez vezes mais do que os valores considerados normais/de referência. A fração LDH-1 é um excelente marcador por ser mais específica nesse caso; ela costuma exceder em 45% ou mais a atividade da LDH total.
Atenção
Em amostras hemolisadas e em casos de pacientes com válvula cardíaca prostética, a LDH-1 também pode estar aumentada.
Aproximadamente 80% dos casos de IAM têm uma correlação de LDH-1/LDH-2, pois a LDH-2 não aumenta após o IAM, já a LDH-1 que em condições normais tem uma menor concentração que LDH-2, aumenta sua concentração de forma expressiva, ultrapassando os valores de LDH-2, ficando assim uma razão com valores maiores que 1. Isso promove um percentual de especificidade diagnóstica próximo dos 99%. Em outras condições, essa relação também pode estar aumentada, a saber: infarto renal agudo, hemólise e processos malignos.
A aspartato-aminotransferase (AST), quando correlata ao IAM, aumenta seus níveis séricos de 6 a 8 horas após a dor precordial, retornando aos níveis basais em quatro a cinco dias. Essa enzima não é específica do miocárdio; encontra-se em altas concentrações plasmáticas em condições patológicas do fígado, pulmões e músculo esquelético. É cada vez menos adotada como critério diagnóstico do IAM.
Veja, a seguir, outros marcadores. Ainda que não enzimáticos, são essenciais e conferem maior velocidade e especificidade na detecção dessa condição clínica.
Marcadores modernos do IAM (enzimas e outras proteínas): mioglobinas e troponinas
Existem outros testes classificados como não enzimáticos para o IAM. A mioglobina, uma proteína do tipo heme, que se liga ao O2 nos músculos, compõe cerca de 2% das proteínas musculares e localiza-se no citoplasma dessas células. Logo, quando há lesão muscular durante o IAM, ocorre a liberação da mioglobina na circulação, cerca de 2 horas após a dor precordial. Seus picos máximos ocorrem de 6 a 9 horas após o evento, normalizando-se entre um e dois dias após o IAM.
Outras situações em que a mioglobina está elevada no plasma: cirurgia de coração aberto, atividade física intensa, lesão muscular, atrofia muscular progressiva genética, deficiência renal grave e aplicação de injeção pela via IM. A proteína deve ser dosada, para fins de diagnóstico do IAM, de 2 a 12 horas após o infarto, pois se difunde rapidamente pela circulação, devido o seu baixo peso molecular.
A troponina, uma proteína importante para a contração muscular, tem sido utilizada como um excelente marcador do IAM.
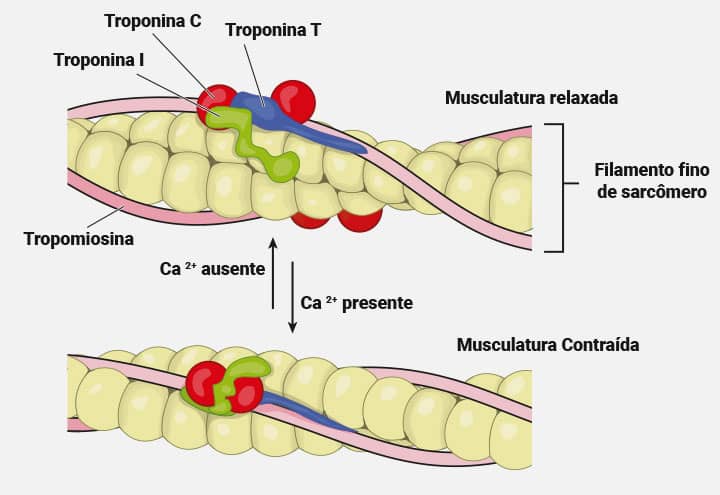
O aparelho miofibrilar das células musculares contráteis, o sarcômero, contém proteínas denominadas troponinas, com as seguintes subunidades:
- Troponina I, inibidora de actina, presente no músculo esquelético e coração.
- Troponina C, ligada ao cálcio e reguladora da contração.
- Troponina T, ligada à miosina, ou tropomiosina.
As isoformas da troponina mais usadas em diagnóstico do IAM são: troponina T (cTnT), que eleva-se por 4 a 6 horas, e fica aumentada de seis a dez dias após o infarto; e troponina I (cTnI), que aparece no plasma de 4 a 6 horas após o IAM, com pico de 10 a 12 horas, ficando elevada de quatro a sete dias. Elas são liberadas quase que simultaneamente à CK-MB.
Atenção
As dosagens de cTnT e cTnI são específicas ao músculo cardíaco, pois no músculo esquelético são encontradas as isoformas smTnT e smTnI. Além disso, o músculo liso não é regulado pelas troponinas T e I, assim as dosagens dessas isoformas são de grande utilidade, pela sua especificidade. A dosagem de TnC não é realizada na prática clínica, pois ela é encontrada tanto no músculo esquelético e cardíaco.
DOSAGEM DE ENZIMAS CARDÍACAS NO IAM
A especialista Jéssica Ribeiro Lima fala sobre os diferentes tempos de dosagens dos marcadores de IAM e sua correlação com a eficácia do atendimento clínico aos pacientes infartados.
No gráfico a seguir, conseguimos ver o perfil de alteração das enzimas estudadas até aqui após um infarto não resolvido.
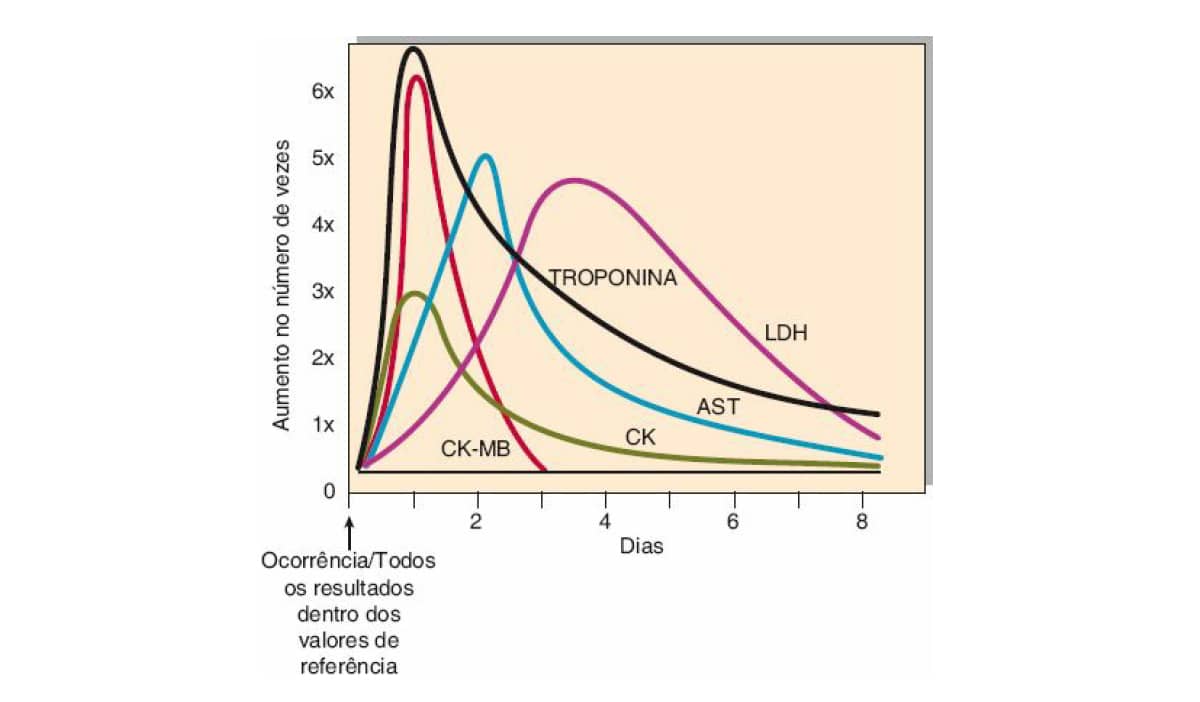
Veja, agora, a prática aplicada à teoria que você estudou.
Caso 1
Indivíduo do sexo masculino, 60 anos, apresentou-se no setor de emergência com forte dor precordial, presente há mais de uma hora. Previamente, foi atendido pela clínica cardiovascular. Tem histórico de quatro anos de angina durante o esforço. Que testes específicos deveriam ser solicitados ao laboratório de Bioquímica?
Após uma hora do início dos sintomas específicos, as isoenzimas (como a creatinoquinase e a lactato desidrogenase) utilizadas para o diagnóstico de IAM, ainda não apresentam seus níveis elevados, mesmo que o indivíduo esteja de fato sofrendo um infarto. Porém, muitas vezes, o paciente relata queixa de dor sem conseguir precisar quando foi exatamente o início dos sintomas.
Como a CK apresenta níveis altos com cerca de quatro horas após o início do evento miocárdico, este seria o teste mais preciso para se realizar nesse paciente, especialmente a investigação dos níveis da fração CK-MB, isoenzima específica do miocárdio. Se o exame for inconclusivo ou não se detectarem alterações, recomenda-se manter o paciente no hospital, repetir o exame após algumas horas e verificar novamente os níveis séricos dessa isoenzima. Atualmente, outros marcadores como a mioglobina e a troponina também são dosados, pois apresentam intervalos de tempo ainda menores e altamente específicos quando correlacionados com os demais marcadores do IAM.
Caso 2
A.L.T., 70 anos, mulher, parda, deu entrada no serviço hospitalar com queixa de dor no peito com duas horas de duração. Paciente hipertensa e diabética, descreve dor intensa e aguda, irradiando para o membro superior esquerdo; informa que vomitou e teve episódio de sudorese fria. Relata ainda que já vinha sentindo dor torácica aos esforços (angina pectoris), mas dessa vez ocorreu quando se levantou, ao acordar de manhã. Nega histórico de doenças cardiovasculares familiares. Informa uso irregular de losartana (50 mg), e metformina (850 mg). Seu estado geral é regular, anictérico, acianótico, afebril ao toque, hidratado e pálido, com ritmo cardíaco regular e taquicárdico em dois tempos e pulsos palpáveis. Extremidades quentes e sudoreicas.
Neste caso, a paciente exibe fatores de risco importantes, como diabetes e hipertensão, sendo de alto risco. Ela descreve a clássica dor torácica, uma dor ou desconforto ou queimação ou sensação opressiva localizada na região precordial, que irradia para o ombro e/ou braço esquerdo, braço direito, pescoço ou mandíbula, frequentemente com diaforese, náuseas, vômitos, ou dispneia, podendo durar alguns minutos (geralmente entre 10 e 20) e ceder, ou mais de 30 minutos, como nos casos de IAM.
O ECG exerce papel fundamental na avaliação de pacientes com dor torácica e deve ser prontamente realizado, junto com os marcadores enzimáticos séricos de necrose miocárdica, que têm um papel importante não só no diagnóstico, como também no prognóstico da Síndrome Coronariana Aguda (SAC).
A CK catalisa a formação de moléculas de alta energia e, por isso, é encontrada em tecidos que as consomem (músculos cardíaco e esquelético e tecido nervoso); a mais usada é a fração CK-MB, pois é a mais específica das CK para músculo cardíaco, devendo ser mensurada em laboratório o quanto antes. As troponinas cardíacas (cTnT e cTnI) são proteínas miofibrilares encontradas somente no músculo cardíaco. Há alta sensibilidade para esses analitos, e bastam discretas alterações para estabelecerem-se compatibilidades com pequenos infartos, ainda que não haja elevação da CK-MB.
Por esse motivo, as troponinas são hoje consideradas o marcador padrão-ouro para o diagnóstico de IAM e devem ser requeridas em intervalos de tempo predeterminados, de acordo como protocolo do serviço, para acompanhar a evolução e a gravidade. Quanto maior a elevação da troponina, mais grave é o infarto e pior é o prognóstico (avaliação quantitativa). Deve-se usar também como importante selo diagnóstico, a fim de aumentar a sensibilidade dos exames, a dosagem da mioglobina em conjunto.
O gráfico mostra a cinética da concentração plasmática das enzimas de mioglobina, CK, troponina e CK-MB, dias após o IAM.
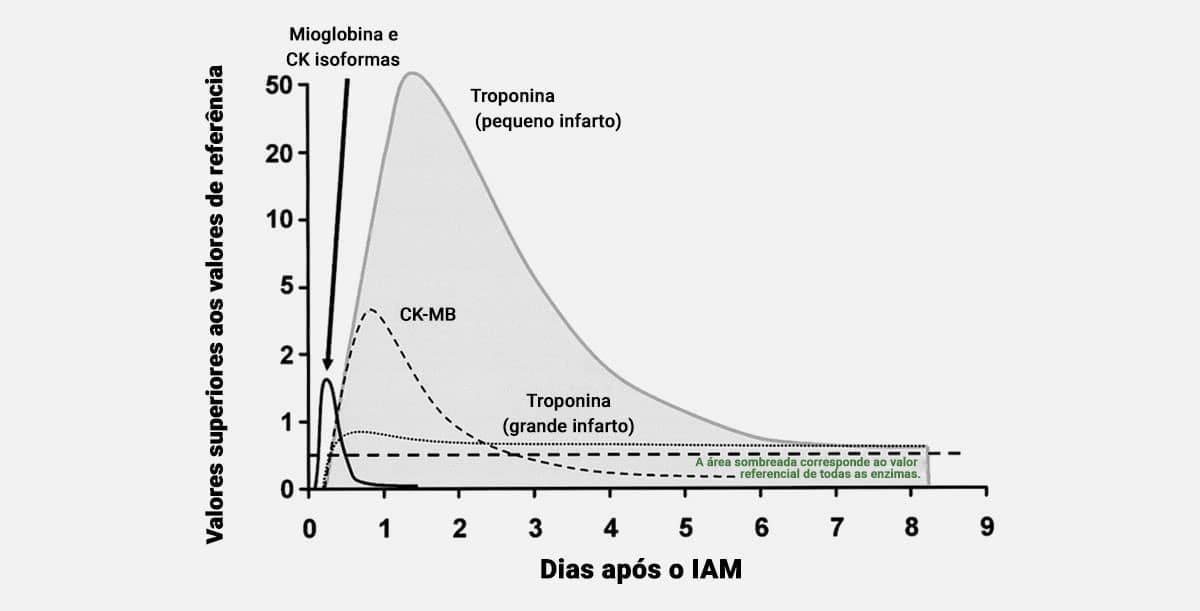
Saiba mais
Como mencionado anteriormente, a SCA engloba os eventos isquêmicos do miocárdio, compreendendo o infarto agudo do miocárdio com elevação do segmento ST (IAM-SST), sem elevação do segmento ST (IAM-SSST) e angina instável (AI). A realização do ECG é essencial para a distinção de pacientes com ou sem elevação do segmento ST. Nos pacientes com elevação do segmento ST, a isquemia é grave, causada normalmente por trombos e êmbolos derivados da placa de ateroma, que, ao ocluir o vaso, produz lesão miocárdica, com liberação para a corrente sanguínea dos marcadores bioquímicos de necrose miocárdica. Nesses pacientes, é essencial iniciar, durante as primeiras oito horas do início dos sintomas, a terapia de reperfusão (com agentes trombolíticos) ou a intervenção coronariana percutânea, para dissolução do trombo, reperfusão do fluxo sanguíneo da artéria obstruída, diminuindo o grau de necrose tecidual. Após a utilização do agente trombolítico, há um aumento de mais de duas vezes no valor de CK-MB após 90 minutos. No acompanhamento das troponinas durante a reperfusão, a diferença entre o tempo zero e 90 minutos é muito maior do que a CK-MB. No entanto, a concentração plasmática das enzimas cai rapidamente após o IAM, diferentemente do observado quando não é realizada a reperfusão, conforme mostra o gráfico a seguir:
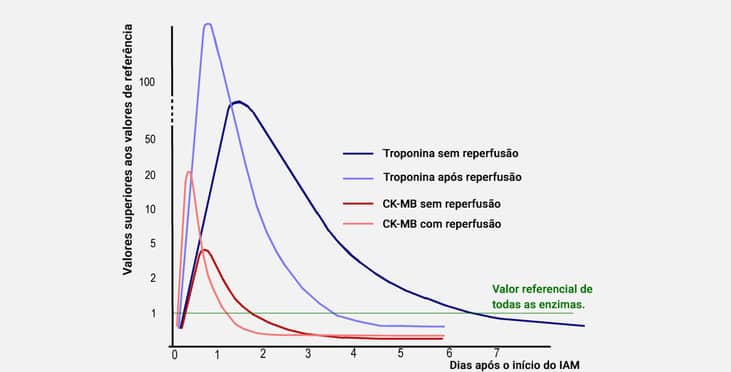
Atenção: O IAM-SSST e a AI são entidades relacionadas, porém, com diferentes graus de intensidade da isquemia. Caso seja demonstrada alteração no ECG sem a elevação dos níveis dos marcadores cardíacos, será estabelecido o diagnóstico de AI.
Saiba mais
Atualmente, é muito comum a solicitação pelos cardiologistas durante os exames de sangue de rotina a dosagem da PCR-ultrassensível (PCR-us), que é um exame capaz de detectar baixas concentrações da proteína no soro. A proteína C-reativa é uma proteína de fase aguda, produzida no fígado, que é conhecida como um importante marcador de processos inflamatórios e/ou infecciosos. Com a descoberta do componente inflamatório na etiologia da aterosclerose, a dosagem do PCR-us tornou-se uma importante ferramenta como marcador do risco cardiovascular. Níveis de PCR aumentados estão associados com aumento no risco de doença arterial periférica, infarto do miocárdio, AVC e morte súbita cardiovascular. Os resultados são classificados em graus de risco, conforme observamos a seguir:
- Baixo risco: <1,0 mg/L ou <0,1 mg<d.
- Médio risco: de 1,0 a 3,0 mg/L ou de 0,1 a 0,3 mg/dL.
- Alto risco: >3,0 mg/L ou >0,3 mg/dL.
- Muito alto risco: ≥10,0 mg/L ou ≥1,0 mg/dL.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Reconhecer os marcadores séricos que permitem a identificação das doenças relacionadas ao metabolismo mineral e ósseo
Metabolismo mineral e ósseo
O metabolismo mineral e ósseo e seus estudos correlatos permitiram, ao longo do tempo, melhor compreensão da fisiopatologia das doenças ósseas. Nota-se uma melhoria da sensibilidade e maior especificidade na detecção desses marcadores, por exemplo, do cálcio fosfato e magnésio. Neste módulo, cada um desses minerais será analisado, bem como seus índices discrepantes de referência e as enfermidades metabólicas ósseas mais relacionadas.
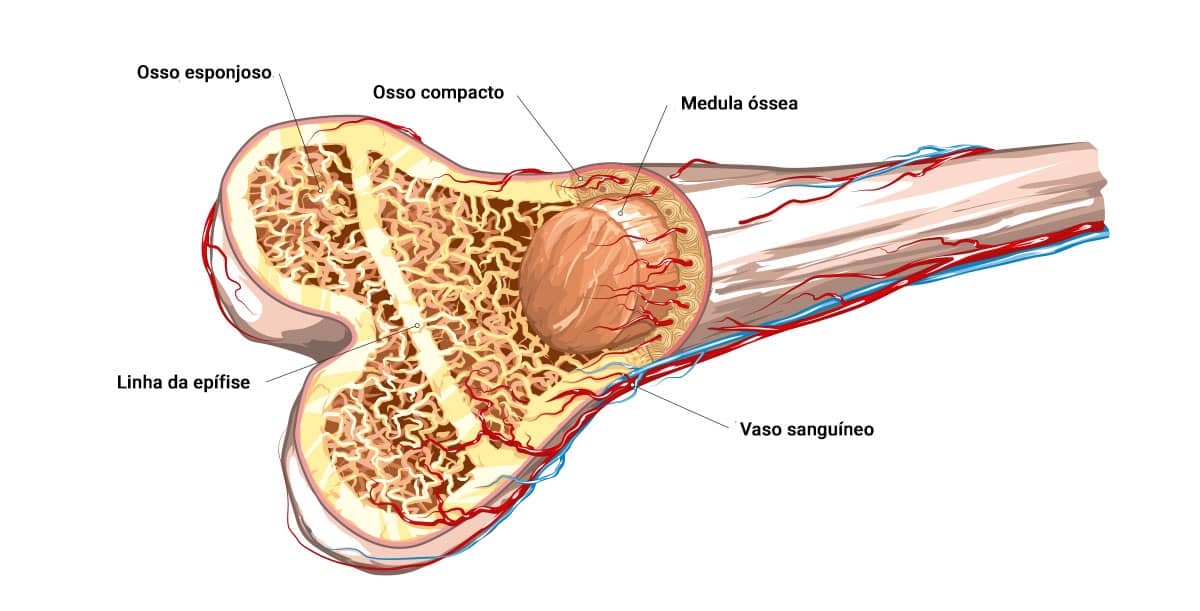
O osso é um tipo de tecido conjuntivo cujas funções são a sustentação do corpo, a proteção do sistema nervoso central e da medula óssea; desempenha também importante papel no metabolismo dos minerais.
Do peso seco dos ossos, 75% são representados por sais minerais inorgânicos, como o fosfato de cálcio e o carbonato de cálcio. Os minerais (fosfato de cálcio) estão combinados na forma de cristais de hidroxiapatita. Há ainda, em quantidades proporcionalmente menores, magnésio, sódio, potássio, estrôncio, zinco, fluoreto, cloreto e sulfato; esses fortalecem a estrutura esquelética dos ossos. A matriz orgânica, 25% do peso ósseo, é formada por fibras de colágeno (ricas em prolina e hidroxiprolina), albumina, mucoproteína, sulfato de condroitina, ácido hialurônico, osteocalcina e pequenos peptídeos.
Fisiologicamente, o osso encontra-se em contínuo remodelamento, ou seja, em processos de destruição e renovação que mantêm os níveis séricos de cálcio e fósforo constantes, retirando ou fornecendo esses elementos aos ossos. Todo esse processo é orquestrado por hormônios e ocorre dentro do osso trabecular, um importante reservatório de minerais.
Cálcio
O cálcio do organismo, em sua quase totalidade – 99% –, está armazenado nos ossos; o mínimo restante desempenha funções significativas não relacionadas à rigidez do esqueleto e sustentação do corpo. As diversas funções do cálcio na fisiologia humana têm destaque nos diversos meios celulares:
Condução neuromuscular de impulsos, manutenção do tônus muscular, regulação de glândulas endócrinas e exócrinas, metabolismo do glicogênio, interação com a calmodulina e integridade da membrana celular.
Mineralização óssea, coagulação sanguínea e potencial elétrico da membrana plasmática.
Armazenado e mobilizado, quando necessário, participando do remodelamento esquelético.
No organismo, o cálcio plasmático é encontrado em três estados físico-químicos: cálcio livre ou iônico (50%); cálcio ligado às proteínas plasmáticas (sendo 40% ligados à albumina); e cálcio ligado a ânions difusíveis (10%), como o HCO3-, H2PO4-, lactato, citrato e HPO42-, chamados de cálcio complexado. O cálcio fisiologicamente ativo é o cálcio iônico, regulado por hormônios e pela vitamina D, e que consegue ultrapassar as membranas plasmáticas.
É importante relatar que alguns fatores podem alterar a distribuição de cálcio nesses três estados plasmáticos. São eles:

O pH. No pH ácido, a alta concentração de íons H+ diminui a carga global negativa da albumina, reduzindo a ligação de cálcio à albumina, o que aumenta a concentração plasmática de cálcio iônico.

A concentração alterada de albumina. Os níveis menores de albumina inicialmente disponibilizam maior concentração de cálcio livre.

O aumento da concentração de substâncias que se ligam à albumina, como ácidos graxos, medicamentos e aumento de heparina ou outros ânions que se ligam ao cálcio iônico e diminuem a sua forma livre.
No laboratório, é possível medir a concentração plasmática de cálcio total e o livre (iônico); o cálcio livre é considerado o melhor indicador fisiológico.
Controle do metabolismo do cálcio
O controle é exercido homeostaticamente, seja pela ingestão na dieta, seja pela formação e desintegração óssea, além da absorção e excreção desse mineral.
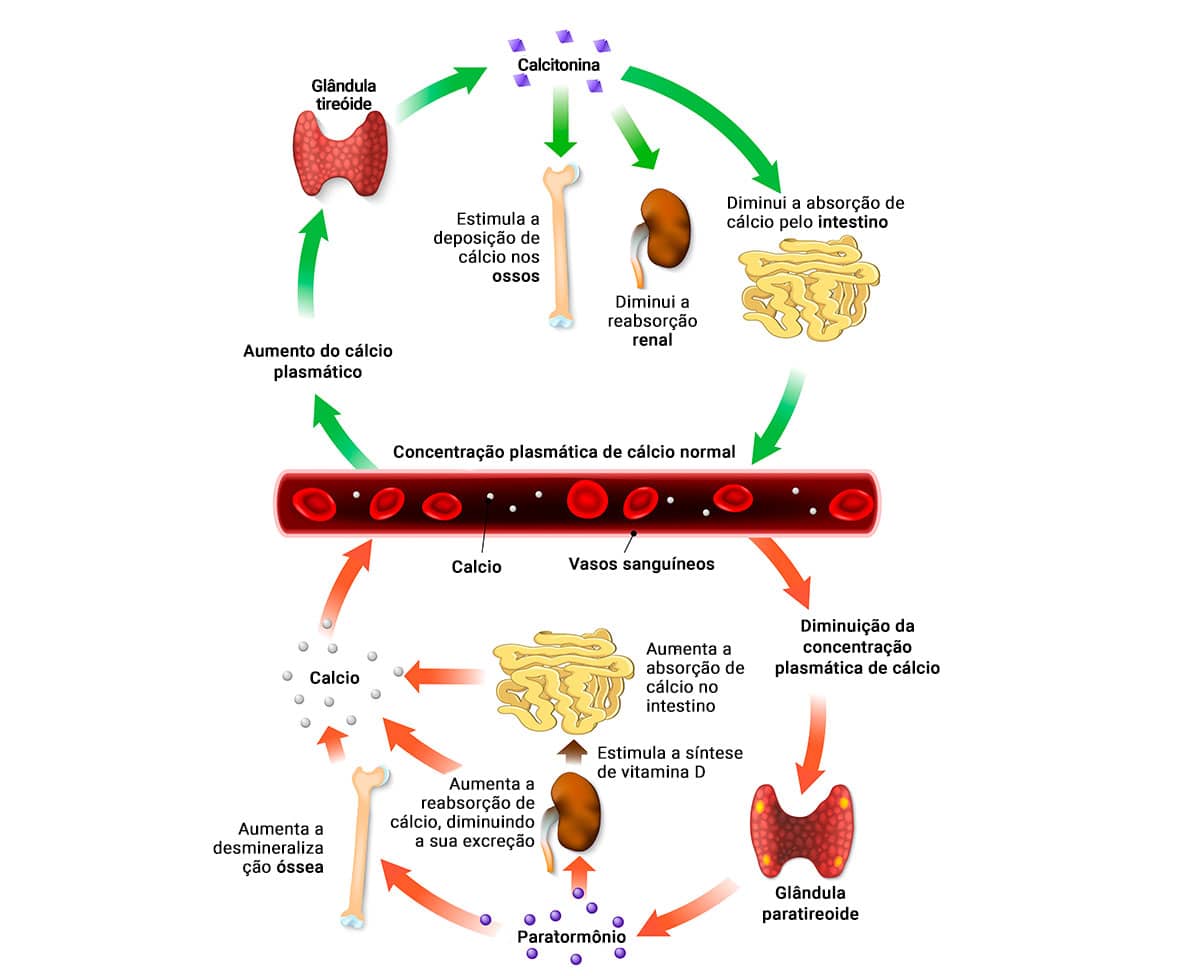
Os moduladores principais do cálcio no organismo são os paratormônios (PTH), secretados, principalmente, pela manhã, pelas glândulas paratireoides, responsáveis por controlar a hipo ou hipercalcemia. Os PTH atuam: regulando a absorção intestinal de cálcio e fosfato, pois ativam a transição da 25-hidroxivitamina D a 1,25-diidroxicolecalciferol, forma ativa biológica da vitamina D; nos rins, ao aumentar a reabsorção de cálcio e a excreção do fósforo; e nos ossos, mobilizando a atividade dos osteoclastos, bem como sua quantidade, deslocando o cálcio para fora das células.
O outro fator relevante que merece atenção é a vitamina D (1,25-diidroxicolecalciferol ou calcitriol ou DHCC), um grupo de esteróis sintetizado pela pele após a exposição à radiação solar ou absorvidos no intestino.
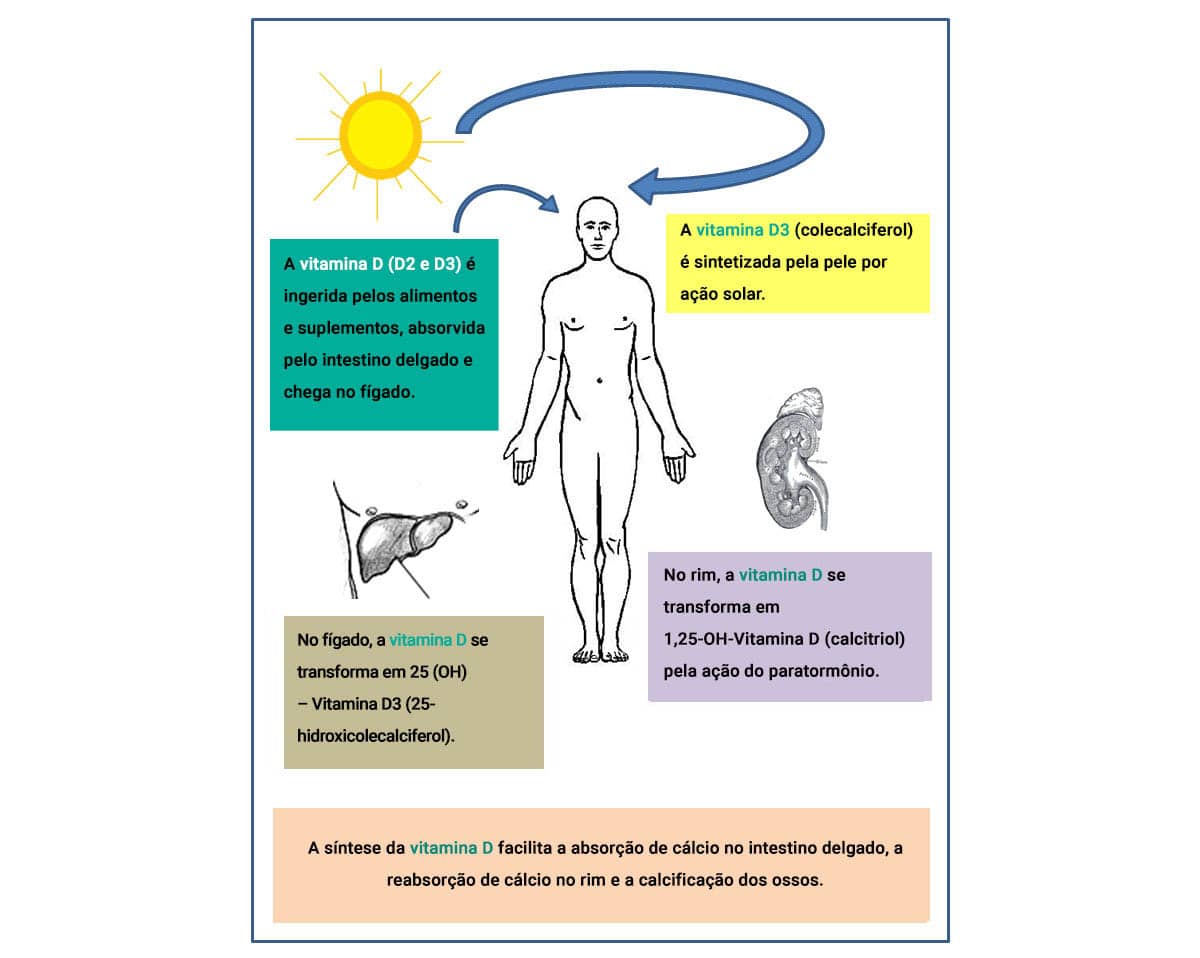
Clique a seguir e conheça outros hormônios que contribuem para a homeostase de cálcio:
Controla o nível sérico de cálcio ao inibir a reabsorção pelos osteoclastos e pode impedir a sua reabsorção renal.
Elevam a mobilização do cálcio dos ossos.
Alteram a excreção renal.
Na menopausa, colaboram para a reabsorção do cálcio e diminuição da densidade óssea, elevando as chances de fratura por osteopenia e osteoporose.
Hipercalcemia
Esse é o nome que se emprega quando o cálcio sérico total se encontra em níveis acima da referência, em geral, 10,5 mg/dL. Normalmente, essa condição decorre de hiperparatireoidismo primário ou câncer, com ou sem envolvimento ósseo e mieloma múltiplo. Pode também ocorrer taxas variáveis de fósforo sérico, hiper ou hipofosfatemia e níveis da FAL (fosfatase alcalina) elevados.
Além disso, a hipercalcemia está ligada a condições de hipervitaminose D, doenças endócrinas, imobilizações de membros inferiores ou superiores por tempo prolongado, insuficiência renal, terapia com lítio, uso de alguns diuréticos e aumento da concentração plasmática de proteínas. Há sintomas pouco específicos na maior parte dos pacientes, porém, pode-se perceber que alguns relatam fadiga, arritmias, fraqueza e mal-estar, com poliúria e polidipsia.
Hipocalcemia
A hipocalcemia pode ser acompanhada de hipoalbuminemia, insuficiência renal crônica (IRC), síndromes que causam deficiência da vitamina D, pancreatite aguda, baixos níveis de magnésio, hipoparatireoidismo, tetania, fase de cura de doenças ósseas e após fraturas. Raramente, há sintomas, mas pode ocorrer irritabilidade neuromuscular (tetania).
Atenção
Todas as variáveis que influenciam tanto a hiper quanto a hipocalcemia devem ser levadas em conta, quando avaliamos esses estados: idade, sexo, malignidade, dor óssea, medicamentos, litíase renal e histórico familiar. Essas variáveis afetam o cálcio ativo (iônico) no corpo e geram redução no teor do cálcio total, que está relacionado às proteínas plasmáticas e ao pH do tecido sanguíneo, como mencionado anteriormente.
Determinação do cálcio total
Antigamente, essa dosagem era determinada pela precipitação do cálcio pelo oxalato, com posterior titulação da amostra com permanganato ou EDTA, com indicador Cal-red, purpurato de amônio e negro de eriocromo T. Atualmente, as dosagens são pelo método da o-cresolftaleína, medida por espectrofotometria, na qual forma-se cor vermelha após a reação do cálcio e a o-cresolftaleína complexona. É possível também realizar-se por espectroscopia de absorção atômica ou diluição isotópica.

Determinação do cálcio livre ou ionizado
A dosagem de cálcio ionizado é feita por eletrodo íon seletivo em amostras de soro, método que não é sensível ao cálcio ligado a proteínas. Além do soro, pode-se utilizar sangue total com heparina em emergências, além do plasma, mas não são as amostras-padrão.
Essa metodologia emprega eletrodos de membrana que respondem seletivamente a alguns íons, medindo o potencial de um íon em solução. Esse eletrodo de membrana e um eletrodo externo de referência são imersos em uma solução de interesse. Como os potenciais de referência apresentam valor constante, qualquer modificação da concentração de um íon na célula é verificada.
Atenção
A partir da diferença entre os potenciais do eletrodo de referência e do eletrodo de medida, é calculada a “concentração” do íon na solução. Mas, fique atento: nessa metodologia, é a atividade do cálcio que é medida, e não seu teor.
Cálcio urinário
A dosagem de cálcio urinário, conhecida por calciúria, é determinada da mesma forma que a dosagem no soro e no plasma, mas como amostra utiliza-se a urina de 24h. Essa medida nos permite analisar alguns aspectos relativos ao cálcio total urinário: níveis de absorção intestinal desse mineral, reabsorção óssea e filtração/reabsorção tubular renal.
Diagnóstico clínico
Os esquemas abaixo mostram, de forma simplificada, os fluxogramas que auxiliam no diagnóstico clínico da hipercalcemia e da hipocalcemia, respectivamente.
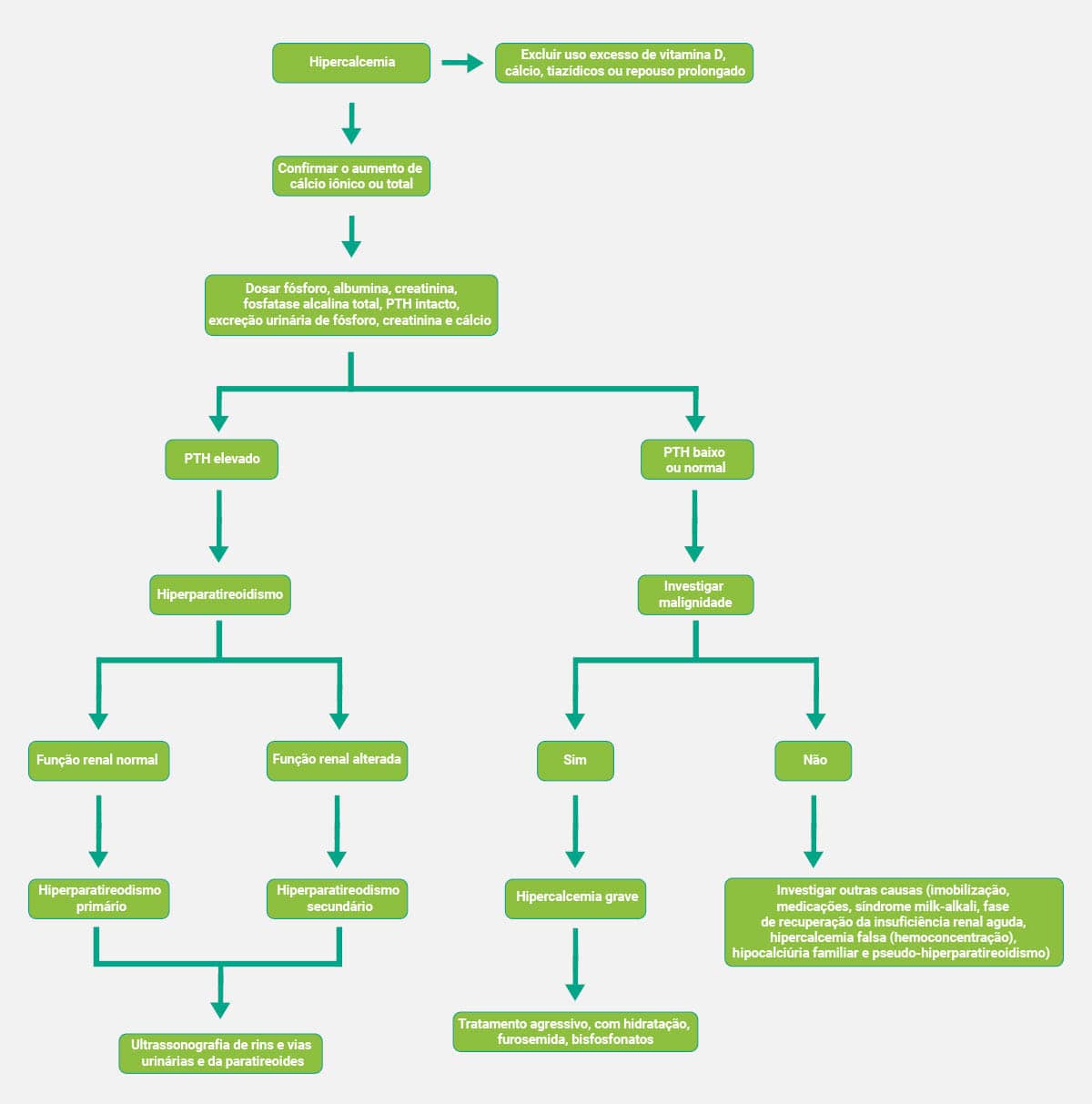
Valores elevados de cálcio podem indicar doença de Paget, hipercalciúria primária, carcinoma ósseo com metástase, acromegalia, intoxicações, excesso de vitamina D, mielomas, uso de estrogênios e corticoides.
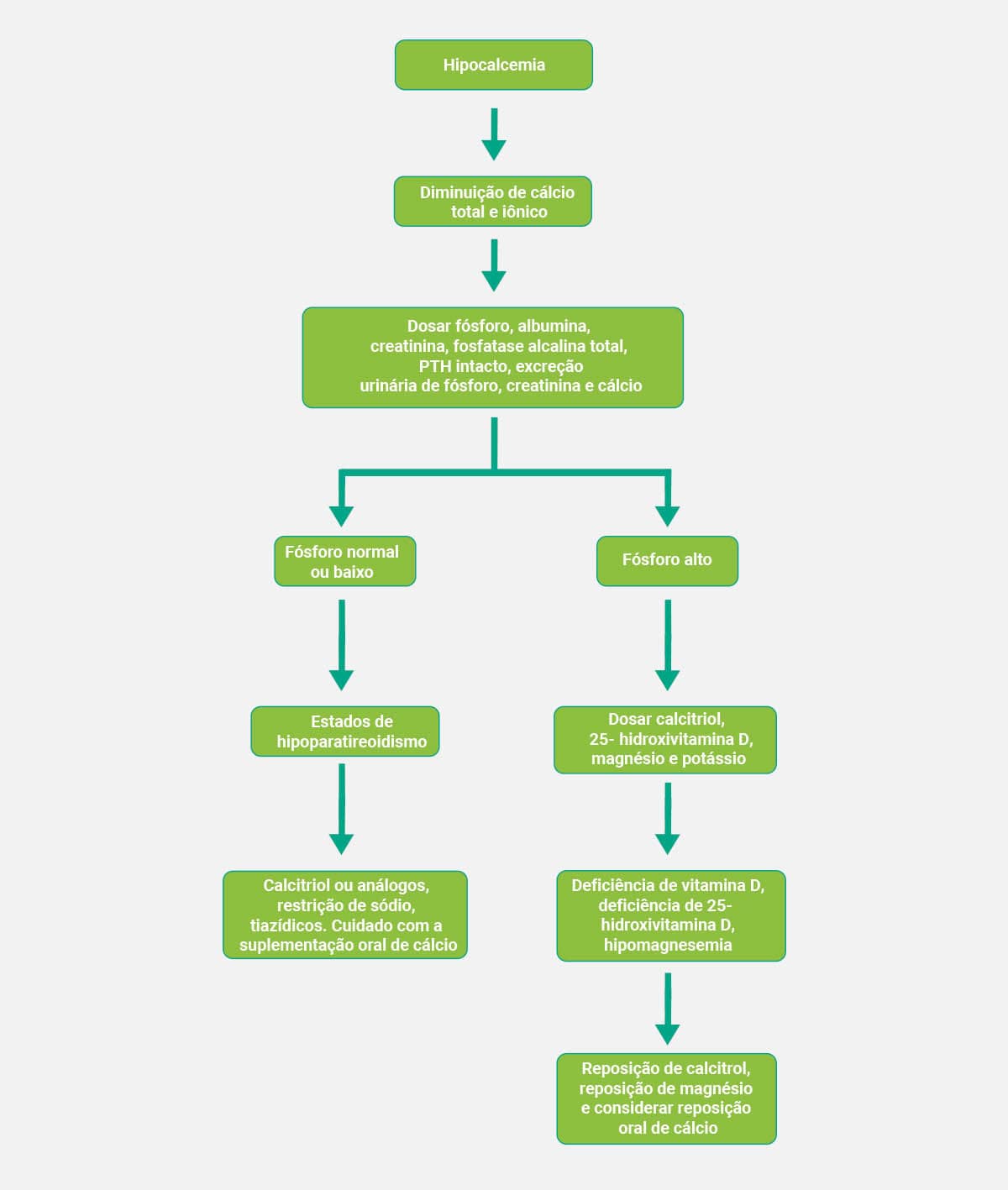
Valores de cálcio abaixo do esperado sugerem: déficit de vitamina D, hipocalciúria primária familiar, pré-eclâmpsia, hipoparatireoidismo, osteodistrofia renal e uso de tiazídicos.
Fosfato
No nosso organismo, o fósforo pode ser encontrado na forma inorgânica – forma de tampão fosfato sanguíneo e na cascata de fosforilação do crescimento celular – ou na forma orgânica –presente na composição dos ácidos nucleicos, fosfolipídios de membrana, fosfoproteínas, ATP e NADP.
No organismo, a maior parte do fósforo corporal (85-90%) encontra-se nos ossos, na forma de hidroxiapatita inorgânica. Além disso, uma pequena concentração (10-15%) encontra-se em tecidos moles, como músculos, hemácias e tecido nervoso. No plasma sanguíneo, encontramos apenas 1%, que estão ligados a proteínas (10-20%) ou nas formas iônicas (ânion livre e complexada com sódio, magnésio ou cálcio).
Homeostase do fósforo
Diversos mecanismos mantêm a homeostase do fósforo em nosso organismo, ocorrendo em órgãos como o intestino delgado, os rins e o esqueleto. Uma refeição abundante em fosfatos eleva a fosfatemia com facilidade, e o alumínio é o ligante metálico mais eficiente para o fósforo e sua absorção, formando complexos insolúveis.
Atenção
Os fatores que condicionam positiva ou negativamente os níveis séricos de fosfato são bastante similares àqueles do cálcio, como o controle exercido pelo PTH, a vitamina D e o hormônio do crescimento (GH).
O fosfato está envolvido no metabolismo energético, na resistência estrutural aos ossos, no tampão plasmático e urinário, na manutenção da integridade celular, além de regular a atividade enzimática e do transporte do O2 nas hemácias (2,3-difosfoglicerato).
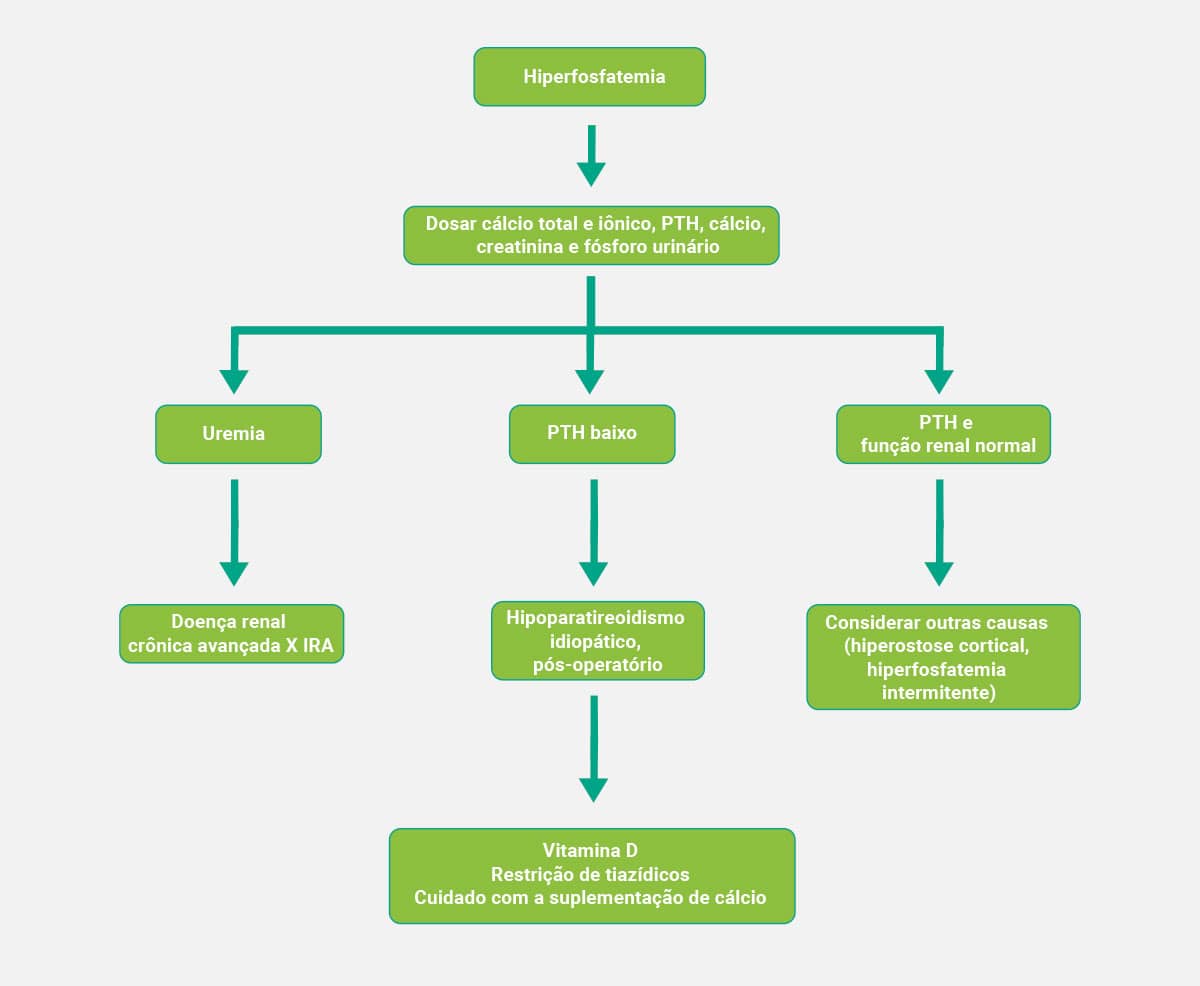
Hiperfosfatemia
Se, ao mensurarmos os níveis plasmáticos do fosfato, eles superarem o valor de 5 mg/dL, estaremos diante de um quadro de hiperfosfatemia. Esse achado pode ser correlacionado diretamente à hipercalcemia, uma vez que vai ocorrer aumento da concentração plasmática do cálcio, com redução da síntese da vitamina D, e a reabsorção óssea mediada pelo PTH ficará bloqueada.
Este fenômeno pode decorrer da redução na excreção do fosfato pelos rins; aumento da ingestão dessa substância, causada por medicamentos; doenças endócrinas; aumento das reações catabólicas ou dano às células; acidose. A hiperfosfatemia pode levar a um estado mental alterado, hipotensão, insuficiência cardíaca e até mesmo catarata.
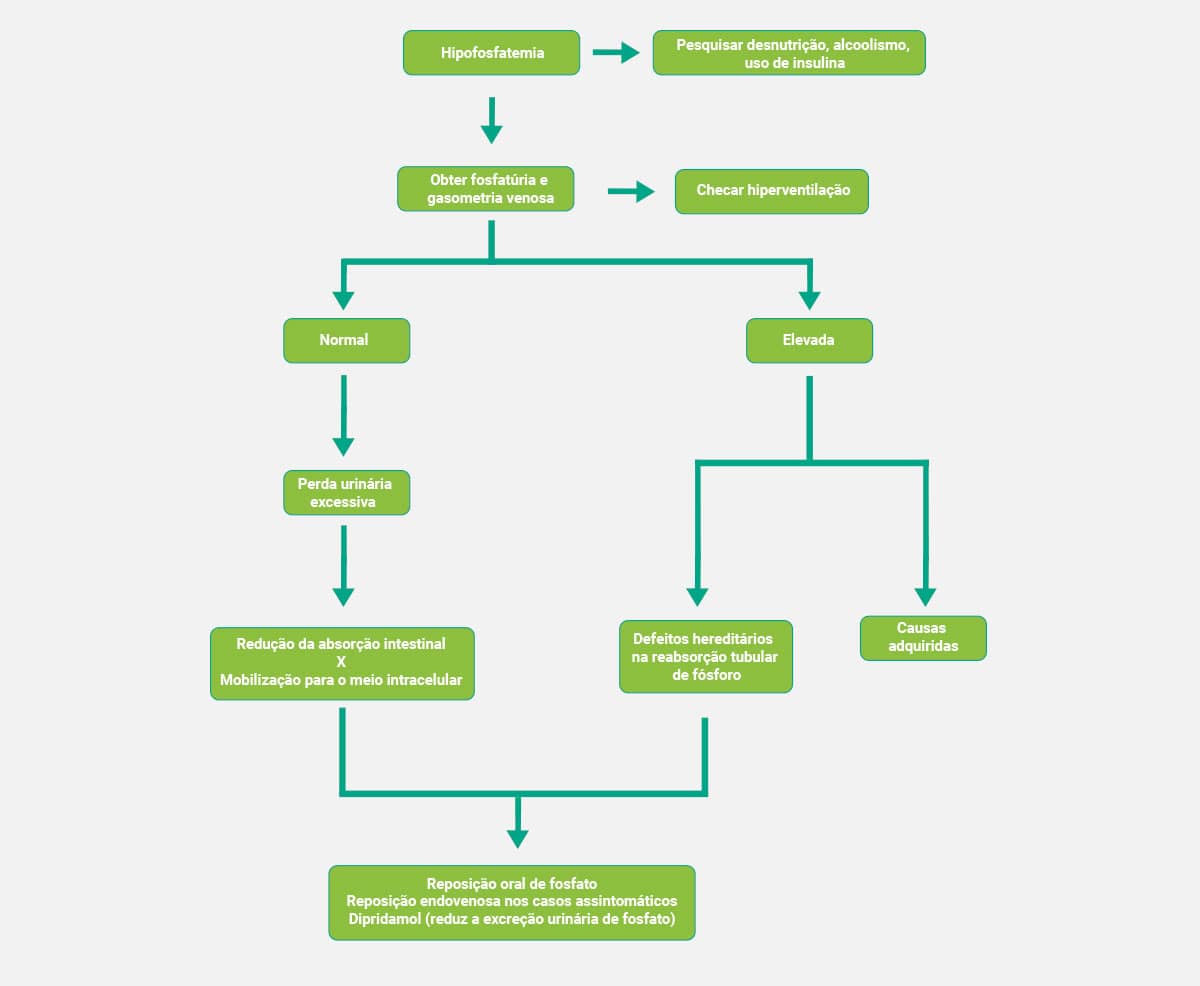
Hipofosfatemia
A redução nos níveis séricos de fosfato pode ser devido à abstinência de álcool e cetoacidose diabética. Caracteriza-se como leve, moderada ou grave, ao oscilar de 2 a <1 mg/dL. Esse estado pode ser resultante de alterações intracelulares, como maior fosfatação da glicose, hiperinsulinismo ou alcalose respiratória, além do aumento da excreção renal e baixa absorção nos intestinos. Geralmente, é assintomática. Em casos severos, está ligada à fraqueza e necrose muscular, dor óssea, acidose metabólica e hemólise, podendo ocorrer sintomas neurológicos diversos.
Determinação do fósforo
A dosagem de fósforo é tradicionalmente realizada pela combinação dos íons fosfato com o molibdato de amônio, sempre em pH baixo (ácido). Em seguida, pode-se medir o comprimento de onda (espectrometria) ou a coloração apresentada após o emprego de agentes redutores – no método conhecido como “azul de molibdênio” –, detectada por sistemas automatizados de química seca. Um importante método enzimático usa a purina nucleosídeo fosforilase e a xantina oxidase, a fim de reduzir o H2O2, a partir do fósforo e da inosina.
Fosfato urinário
Este analito, quando dosado na urina, pode apresentar uma diversidade de variações que acompanham características de cada indivíduo, como o sexo, a faixa etária, o funcionamento dos rins, PTH, momento da coleta e alimentação.
Atenção
Quando alcança níveis elevados na urina, pode ser por motivos como: insuficiência renal aguda (IRA), insuficiência renal crônica (IRC), hipoparatireoidismo, osteoporose, acromegalia, mieloma múltiplo, leucemia mieloide crônica (LMC), diabetes mellitus descompensada, atividade física intensa e hipovolemia. Quando os índices estão reduzidos nessa amostra, pode decorrer de reabsorção tubular comprometida, hiperparatireoidismo, hipovitaminose D, raquitismo, alimentação parenteral extensiva, diuréticos, etilismo, hemodiálise e enfermidades do fígado.
Diagnóstico clínico
Os esquemas a seguir mostram, de forma simplificada, os fluxogramas que auxiliam no diagnóstico clínico da hiperfosfatemia e da hipofosfatemia, respectivamente.
Magnésio
O magnésio é um íon fundamental em diferentes funções do organismo. Atua como cofator enzimático e na glicólise, fosforilação oxidativa, replicação e metabolismo celular, manutenção dos ácidos nucleicos e síntese de proteínas, estabilização dos axônios e liberação de neurotransmissores. Assim como o cálcio e o fósforo, ele é estocado nos ossos, mantendo seus níveis séricos a partir desse depósito natural (aproximadamente 53% do total). Além disso, 27% encontram-se no músculo, 19% nos tecidos moles, 0,5% nos eritrócitos e 0,3% no soro.
Balanço do magnésio
A concentração sérica do magnésio é o resultado de um balanço na ingestão/absorção do íon, excreção (trato urinário e intestinal) e biodistribuição no organismo. O influxo de magnésio para dentro da célula e o seu efluxo são ligados a sistemas de transporte dependentes de carboidratos. A estimulação de receptores beta-adrenérgicos favorece o efluxo de magnésio, enquanto a insulina, o calcitriol e a vitamina B6 favorecem a sua entrada nas células.
Ao mensurar seu nível sérico, não se pode usar como medida real o magnésio total, pois sua maior concentração está estocada nos ossos. Sua deficiência é mais bem caracterizada pelo histórico dos pacientes e pelo exame clínico físico.
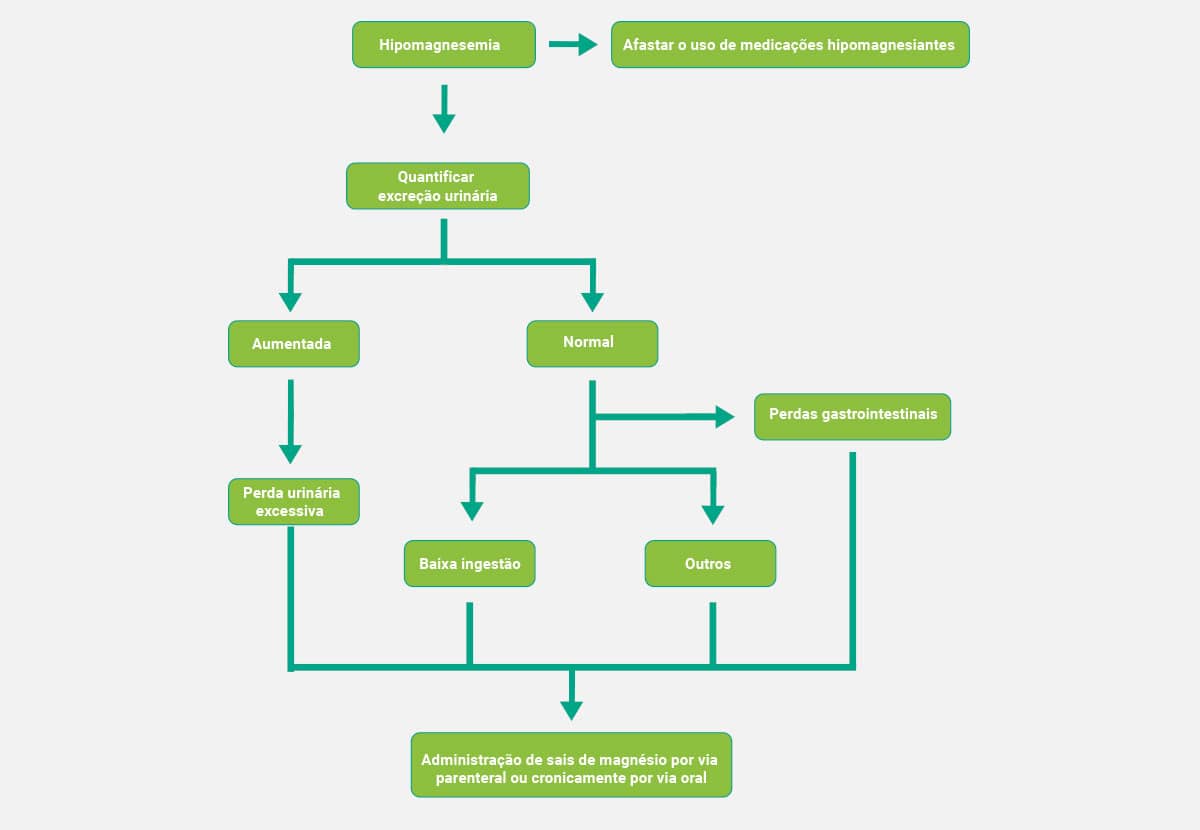
Hipomagnesemia
Raramente, poderemos verificar casos em que os níveis séricos desse analito diminuem de forma isolada. Em geral estão correlacionados a baixas taxas de potássio, cálcio e fósforo. Podem ocorrer devido a enfermidades ou condições do trato gastrointestinal (TGI), como fístulas, diarreia e pancreatite, além da excessiva perda pela filtração renal, acidose metabólica, doença renal grave, etilismo crônico e medicamentos, como aminoglicosídeos, anfotericina B, cisplatina, ciclosporina, pentamidina e tiazídicos. Quando sintomáticos, os pacientes podem apresentar tetania, depressão, debilidade e arritmias cardíacas.
Atenção
O principal exame laboratorial é a dosagem sérica de magnésio. A hipomagnesemia pode estar associada à hipocalcemia por diminuição do PTH ou da resposta a este; e à hipocalemia, nos casos de perda urinária aumentada. A partir de dosagens urinárias do íon, é possível calcular sua fração de excreção urinária. Investigações adicionais devem ser solicitadas, dependendo da suspeita clínica inicial, como a diminuição do potássio sérico,hiponatremia e alteração no eletrocardiograma.
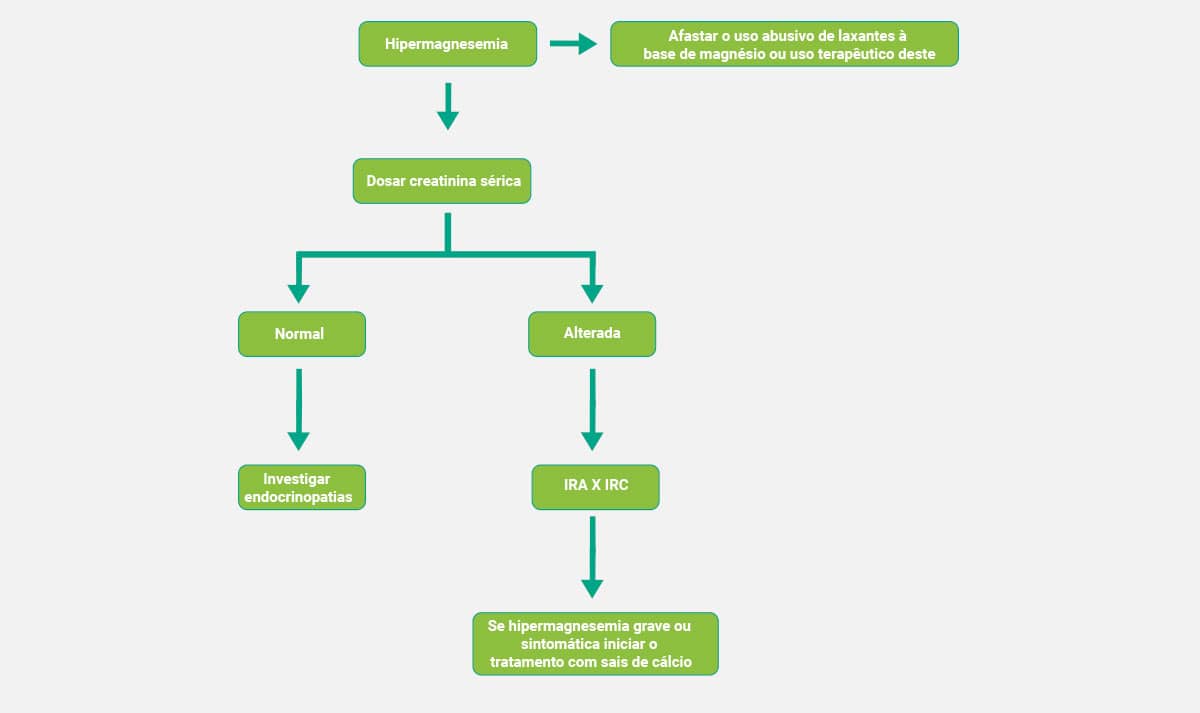
Hipermagnesemia
Trata-se de uma condição pouco comum, uma vez que a excreção renal é altamente eficaz quando há excesso desse analito. Os índices elevados de magnésio sérico são achados laboratoriais específicos em pacientes com insuficiência renal. As demais causas que também podem gerar hipermagnesemia são: aumento da ingestão, uso de lítio, cetoacidose diabética e doença de Addison; os sintomas mais comuns são perda de reflexos tendíneos, apneia, hipotensão, náusea e vômito.
Determinação do magnésio
Determina-se o magnésio pela espectrometria de massa atômica, método altamente sensível, automatizado e de simples execução. Outras técnicas empregadas são:
- O uso de um meio alcalino, onde se forma um composto colorido, o amarelo de titan.
- O azul de metiltimol, que reage com o magnésio formando complexos colorimétricos.
- O corante metalocrômico calmagita e o agente quelantes clorofosfonazo III, que também podem ser reagentes indicadores importantes na sua dosagem.
Diagnóstico clínico
Os esquemas a seguir mostram, de forma simplificada, os fluxogramas que auxiliam no diagnóstico clínico da hipermagnesemia e da hipomagnesemia, respectivamente.
Doenças osteometabólicas
As doenças osteometabólicas são um grupo de doenças relacionadas a distúrbios do metabolismo ósseo, como a osteoporose, a osteomalacia, o hiperparatireoidismo, o raquitismo e a doença de Paget, com destaque para a osteoporose. Essas doenças são caracterizadas pela perda de massa óssea e ruptura de sua microarquitetura, ocasionando a fragilidade desse tecido e, consequentemente, a incidência de fraturas.
Vamos agora entender mais sobre essas doenças osteometabólicas.
Osteoporose
Esta enfermidade é associada a índices reduzidos de minerais e da matriz óssea; necessariamente, à perda da estrutura microscópica do tecido ósseo e sua ultra-arquitetura. No entanto, a avaliação histoquímica é normal. De fato, o que fica comprometido no que tange à fisiologia é a rigidez dos ossos, aumentando o risco de fraturas no sistema de sustentação do corpo.
Trata-se da doença óssea metabólica mais frequente, ligada a diversos fatores clínicos, bioquímicos e epidemiológicos. Pode, portanto, ser de natureza primária, associada à deficiência de hormônios esteroides sexuais, ou secundária, como consequência de doenças endócrinas de natureza variada, causas gastrointestinais, disfunções da medula óssea e do tecido conjuntivo, uso de drogas, álcool, heparina, corticoides, anticonvulsivantes, ciclosporina e quimioterapia.
CORRELAÇÃO ENTRE A DENSITOMETRIA ÓSSEA E O DIAGNÓSTICO LABORATORIAL DO METABOLISMO MINERAL
A especialista Jéssica Ribeiro Lima fala sobre densitometria óssea e a sua correlação com as dosagens laboratoriais dos analitos indicadores do metabolismo mineral.
Osteomalácia/raquitismo
A enfermidade da osteomalácia, também denominada raquitismo, ocorre antes do estágio no qual se completaria o desenvolvimento ósseo de fato, com fechamento completo das epífises. Essa doença está ligada à ausência de mineralização completa dos ossos, por diversas condições, mas relacionada sempre ao metabolismo do cálcio e do fósforo.
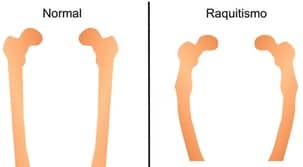
Ocorre formação óssea normalmente, mas os ossos não apresentam a dureza intrínseca – ficam moles. A doença decorre, principalmente, da carência da vitamina D e diminuição nos valores de fosfato (hipofosfatemia crônica), manifestando-se sob a forma de fraqueza muscular, andar cambaleante, dor óssea e tendência aumentada a fraturar os ossos.
Doença óssea de Paget
A doença de Paget – também conhecida como osteíte deformante – é uma doença crônica, de causa ainda pouco conhecida, com comprometimento ósseo local ou sistêmico. No início da doença, ocorre alta taxa de remodelação óssea com aumento da atividade de osteoclastos e aumento na velocidade da degradação e formação óssea. As áreas superativas aumentam de tamanho, mas, apesar de serem grandes, são estruturalmente anormais e fracas.
A doença acomete indivíduos geralmente acima de 40 anos de idade, atingindo em torno de 5% da população; atinge os ossos do crânio, pelve, vértebras e fêmur. São frequentes as queixas de dor muscular e óssea, deformidade, atrite, deficit neurológico, tumores ósseos e ICC. Laboratorialmente, nota-se aumento da FAL, da osteocalcina, do cálcio, fósforo, além da elevação da hidroxiprolina urinária.
Osteodistrofia renal
A osteodistrofia renal compõe um conjunto de anormalidades do esqueleto, comumente associadas a doenças renais, em função do comprometimento dos mecanismos fisiológicos que provocam a patologia, alterando a excreção dos íons cálcio, fósforo e magnésio. Em associação, pode-se verificar osteíte fibrosa, osteomalácia, osso aplástico e amiloide esquelética.
Atenção
PTH em níveis elevados, na IRC, pode resultar nesse tipo de enfermidade. Intoxicações por alumínio também já foram correlacionadas a essas condições fisiopatológicas. A sintomatologia mais comum é a dor óssea, podendo haver deformidades naqueles indivíduos em estágio de crescimento, além de calcificações em órgãos como pulmões e coração.
Observe a imagem radiográfica da região periosteal, mostrando uma reação periosteal fina e tunelamento cortical no fêmur. O paciente apresenta doença renal em estágio terminal e hiperparatireoidismo terciário.

Marcadores da formação óssea
Os principais marcadores da formação óssea são cálcio, fósforo, magnésio, PTH, vitamina D e FAL, devendo ser dosados frequentemente e seus índices alterados correlacionados às patologias anteriormente descritas, em associação às queixas e história clínica de cada paciente.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Neste estudo, você conheceu os principais conceitos em Enzimologia, que viabilizaram a compreensão das bases da Bioquímica Clínica, assim como as principais enzimas diagnosticadas no laboratório clínico, que culminaram na criação de importantes ferramentas auxiliares de diagnóstico médico de diversas enfermidades.
Atualmente, a maior parte das dosagens é realizada por métodos automatizados; no entanto, é válido conhecer as demais metodologias para a determinação dos índices séricos dos analitos estudados. Em casos como o IAM e a pancreatite aguda, assim como em enfermidades ósseas e metabólicas, a velocidade, a precisão e a sensibilidade na determinação desses marcadores clínicos são cada vez mais importantes no diagnóstico, e interferem diretamente na assistência dos pacientes.
Além de trazer elementos importantes para o entendimento da qualidade dos ensaios laboratoriais, este estudo buscou valorizar a Bioquímica Clínica como parte da estratégia de saúde que visa à manutenção do bem-estar de todos.
Podcast
Agora, a especialista Jéssica Ribeiro Lima encerra o conteúdo falando sobre a importância das dosagens enzimáticas no diagnóstico das síndromes metabólicas.
CONQUISTAS
Você atingiu os seguintes objetivos:
Descreveu as principais enzimas, as condições patológicas que alteram sua concentração e os métodos de diagnóstico laboratorial
Identificou os marcadores cardíacos laboratoriais do infarto agudo do miocárdio
Reconheceu os marcadores séricos que permitem a identificação das doenças relacionadas ao metabolismo mineral e ósseo