Descrição
Biossíntese, distribuição e papel fisiológico, estrutura, propriedades físico-químicas e métodos de extração de alcaloides, drogas vegetais clássicas com alcaloides.
PROPÓSITO
Compreender a Farmacognosia – um dos braços mais antigos da Farmácia – e o funcionamento das plantas medicinais como medicamentos fitoterápicos e preparações caseiras com droga vegetal, bem como sua constituição química, permite usar essas plantas para melhorar a qualidade de vida do paciente.
OBJETIVOS
Módulo 1
Definir a biossíntese, a distribuição e os principais métodos de extração e identificação dos alcaloides
Módulo 2
Descrever os alcaloides da via do Acetil-CoA
Módulo 3
Descrever os alcaloides da via do chiquimato
Módulo 4
Descrever os alcaloides de precursores não aminoácidos
Introdução
O termo alcaloide foi proposto pela primeira vez em 1819 pelo químico alemão Carl F. W. Meissner (1792-1853) e deriva do nome arábico al-qali.
Alcaloides são substâncias de baixo peso molecular e representam aproximadamente 20% dos metabólitos secundários em plantas. Até o momento, cerca de 12.000 alcaloides foram isolados de diversos gêneros vegetais no reino vegetal. São constituídos por carbono, hidrogênio e nitrogênio, contendo, em geral, um anel heterocíclico. Sua biossíntese normalmente ocorre a partir de aminoácidos, mas também há alcaloides derivados de terpenos e esteróis.
Vamos aprender aqui sobre os alcaloides, abordando sua biossíntese vegetal, suas atividades farmacológicas, características estruturais e propriedades físico-químicas. Além disso, vamos conhecer os métodos de extração mais utilizados para esses compostos e as principais drogas vegetais que contêm tais substâncias.
MÓDULO 1
Definir a biossíntese, a distribuição e os principais métodos de extração e identificação dos alcaloides
Aspectos gerais, estrutura e distribuição
Os alcaloides estão amplamente distribuídos no reino vegetal. São substâncias contendo pelo menos um átomo de nitrogênio em sua estrutura, principalmente na forma de aminas primárias, secundárias e terciárias, o que geralmente confere a eles uma característica básica.
O grau de basicidade dos alcaloides varia muito, pois depende das ligações e da posição do nitrogênio na molécula, e da presença e da localização de outros grupos funcionais.

Classificação
Os alcaloides se classificam de duas maneiras:
Origem biossintética
A classificação por meio de sua biossíntese se divide em: alcaloides verdadeiros, protoalcaloides e pseudoalcaloides. Alcaloides verdadeiros são aqueles que possuem o nitrogênio como parte do anel heterocíclico, e protoalcaloides são aqueles que possuem o nitrogênio na cadeira lateral. Ambos são produzidos a partir de aminoácidos. Já os pseudoalcaloides são aqueles que não são derivados dos aminoácidos.
Tipo de precursor
A classificação pelo tipo de precursor é baseada no aminoácido (ou outra substância) que origina a biossíntese, fornecendo parte do esqueleto e o nitrogênio do alcaloide. Os aminoácidos precursores dos alcaloides são: L-aspártico, L-histidina, L-lisina, L-ornitina, L-tirosina, L-triptofano, ácido antranílico e ácido nicotínico.
Características
Além dos aminoácidos, os alcaloides também recebem parte de sua estrutura por meio de moléculas oriundas das vias do acetato e do chiquimato e das bases púricas, por exemplo.
Saiba mais
São normalmente sólidos em temperatura ambiente e ocorrem, principalmente, em plantas superiores pertencentes às famílias Amaryllidaceae, Papaveraceae, Rubiaceae, Ranunculaceae, Solanaceae etc.
Os alcaloides podem ser encontrados em diversos seres vivos. As plantas são sua principal fonte. Algumas famílias são particularmente ricas em alcaloides.
Normalmente, determinada espécie de planta contém apenas alguns tipos de alcaloides característicos daquela espécie ou daquele gênero. A Papaver somniferum e o fungo Ergot, por exemplo, contêm cerca de 30 tipos diferentes de alcaloides cada um. Acredita-se que todas as plantas da família Papaveraceae contêm os mesmos alcaloides da Papaver somniferum.
Alcaloides regulam o crescimento do vegetal e têm função protetora frente a predadores.
Propriedades físico-químicas e métodos de extração e detecção
Os alcaloides são encontrados nos tecidos vegetais na forma de sais de ácidos orgânicos, ésteres ou combinados com taninos ou açúcares, e são isolados na forma de compostos cristalinos, amorfos, sem odor e não abundantes.
Alcaloides de baixo peso molecular, como pilocarpina, e aqueles sem átomo de oxigênio em sua estrutura, como a nicotina, ocorrem na forma líquida em temperatura ambiente. A maioria é caracterizada pelo gosto amargo e por ser incolor, mas alguns são coloridos, como a colchicina e betaína.
Muitos alcaloides são opticamente ativos, e seus esteroisômeros puros são farmacologicamente mais ativos do que suas misturas racêmicas.
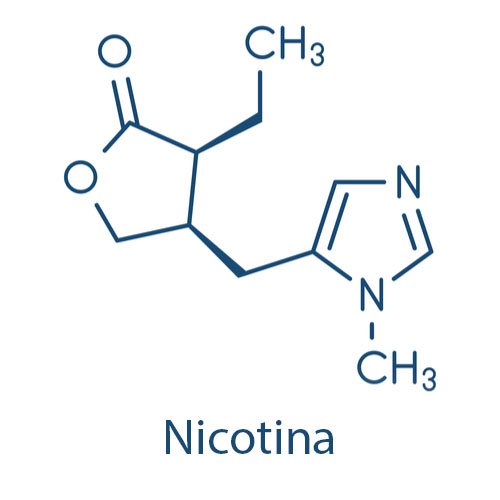
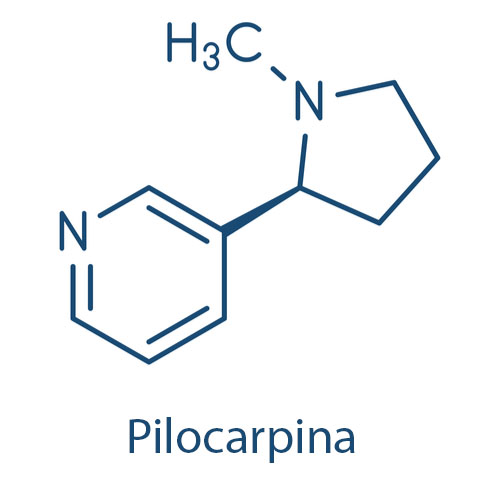
Alcaloides na forma de bases livres são solúveis em solventes orgânicos apolares (clorofórmio, cloreto de metileno e éter) e possuem, em geral, baixa solubilidade em água. Em contrapartida, seus sais são solúveis em água ou ácidos diluídos e são insolúveis ou pouco solúveis em solventes orgânicos.
Métodos de extração
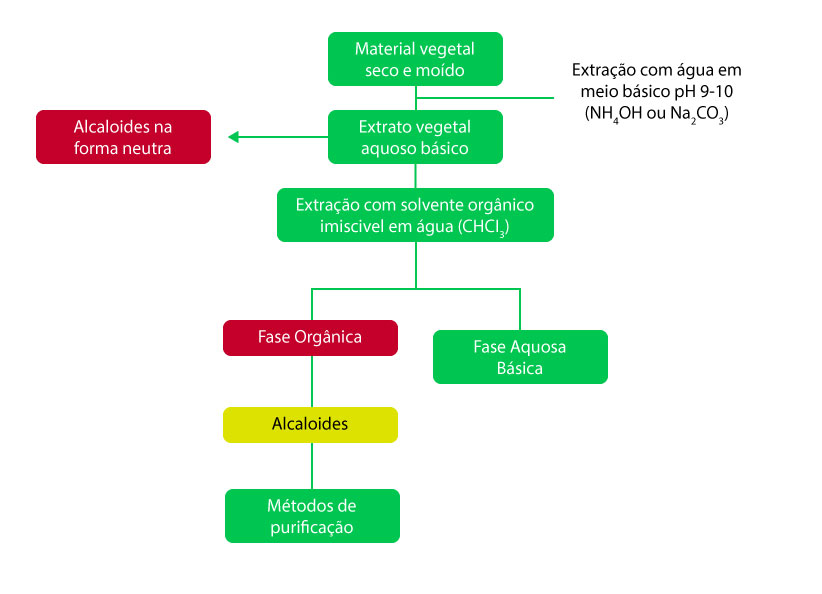
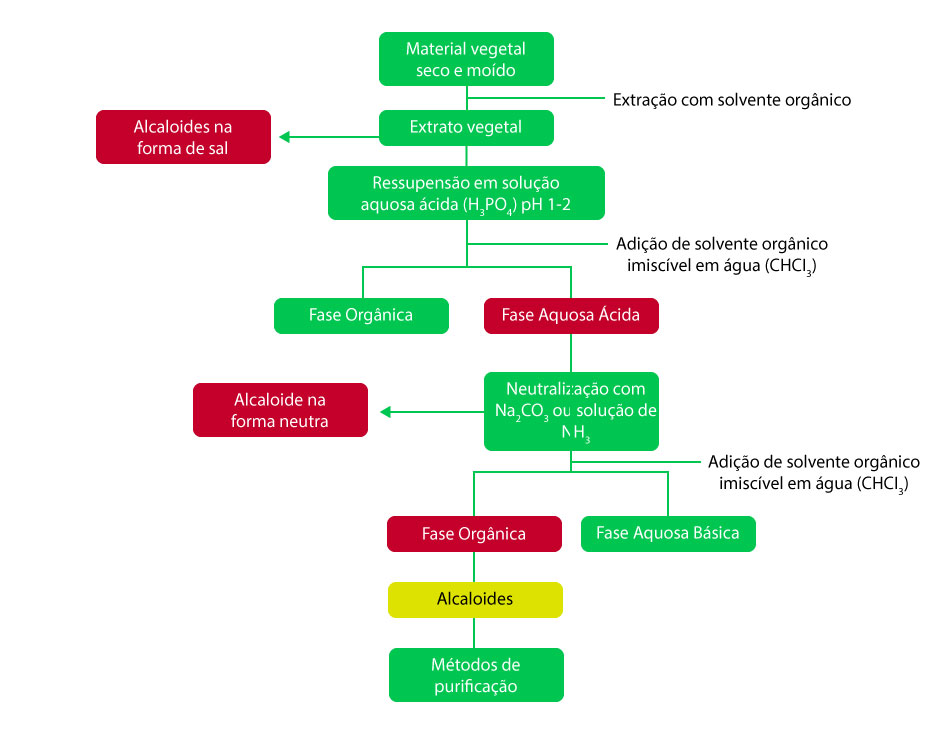
O processo de extração dos alcaloides se baseia em suas propriedades físico-químicas, e dois métodos gerais podem ser aplicados: um utilizando solventes em meio alcalino e outro em meio ácido.
Recomendação
É recomendado que, antes da extração dos alcaloides em si, seja feita uma extração com solventes apolares, como n-hexano ou éter de petróleo, para remoção das substâncias lipofílicas, que podem formar emulsões durante o processo extrativo dos alcaloides.
Os dois métodos de extração estão esquematizados nas figuras 1 e 2:
Métodos de detecção
Devido à presença do nitrogênio em sua estrutura, os alcaloides se complexam na forma de sais com metais (como mercúrio, ouro e platina) e precipitam. Por causa disso, muitos reagentes contendo metais são usados para a detecção de alcaloides por precipitação.
Os testes de detecção utilizam soluções neutras ou levemente ácidas e reagentes específicos. Esses reagentes estão listados no quadro a seguir:
| Nome do teste | Composição do reagente | Resultado positivo |
|---|---|---|
|
Reagente de Mayer |
Solução de iodeto de potássio e cloreto de mercúrio |
Precipitado branco |
|
Reagente de Dragendorff |
Solução de iodeto de potássio e subnitrato de bismuto |
Precipitado laranja ou laranja avermelhado |
|
Reagente de Wagner ou Bouchardat |
Solução de iodo e iodeto de potássio |
Precipitado marrom |
|
Reagente de Hager |
Solução saturada de ácido pícrico |
Precipitado amarelo |
|
Reagente de Bertrand |
Solução de ácido silicotungstico |
Precipitado branco |
|
Reagente de Urk |
Solução de p-dimetilaminobenzaldeído em ácido sulfúrico |
Positivo para alcaloides indólicos (coloração azul) |
|
Sulfato Cérico |
Solução de sulfato cérico amoniacal |
Positivo para: indólicos (amarelos), deidroindólicos (vermelho) e acrilatos (azuis) |
|
Reagente de Vitali-Morin |
HNO3 fumegante + solução etanólica de KOH |
Positivo para alcaloides tropânicos (rosa a violeta) |
|
Reagente para presença de hidroxilas |
Solução de Cloreto férrico ou sais de arildiazônio |
Positivo para alcaloides com hidroxilas fenólicas |
|
Teste de Scott |
2% tiocianato de cobalto (Co(SCN)2) em glicerina ou água |
Positivo como teste presuntivo para cocaína (coloração azul) |
|
Ácido tânico |
Solução de ácido tânico |
Precipitado branco leitoso |
Elaborado por: Henriques et al., 2004 apud Simões, 2004.
Muitos desses precipitados também ocorrem na presença de proteínas ou substâncias fenólicas. Por isso, um resultado negativo com esses reagentes indica a ausência de alcaloides, enquanto um positivo pode ser considerado apenas a provável presença de alcaloides, necessitando de mais análises para confirmação.
Biossíntese dos alcaloides
Os alcaloides possuem uma imensa variabilidade estrutural, porque não há apenas uma via de biossíntese que dá origem a eles. De modo geral, eles são compostos principalmente a partir de precursores formados na via do acetato e na via do chiquimato, mas também existem diversos tipos de alcaloides criados por precursores provenientes de outras vias do metabolismo secundário das plantas. Vamos conhecê-los.
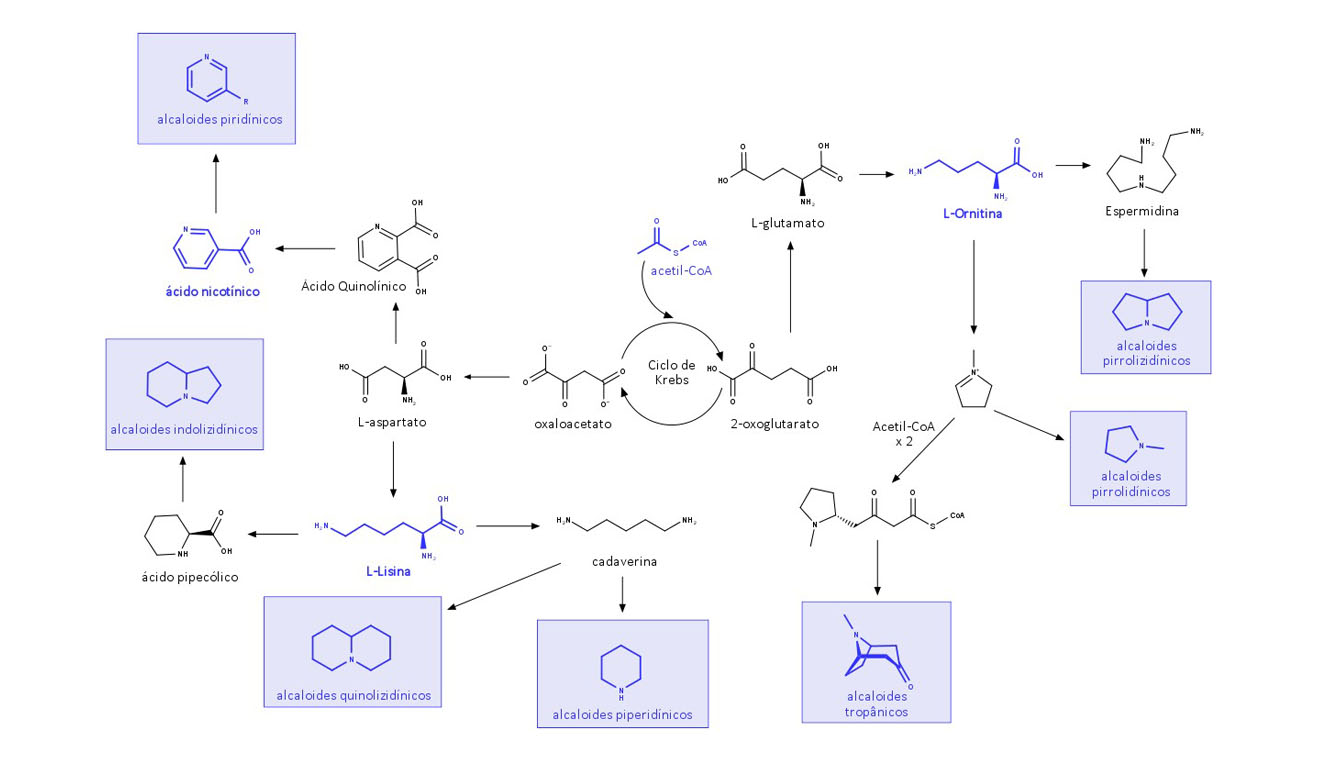
Via do acetato ou do Acetil-CoA
A via do acetato, também chamada de via do Acetil-CoA, produz os aminoácidos L-ornitina e L-lisina e o ácido nicotínico.
A L-ornitina é composta por 2-oxoglutarato – um dos intermediários do Ciclo de Krebs – e origina, baseado no cátion N-metil-Δ1-pirrolínio, os alcaloides tropânicos e pirrolizidínicos e, por meio da espermidina, os alcaloides pirrolidínicos.
O L-aspartato tem como base o oxaloacetato – outro intermediário do ciclo de Krebs –, e, a partir dele, temos a L-lisina e o ácido nicotínico. A L-lisina cria os alcaloides piperidínicos e os quinolizidínicos devido à formação da cadaverina, e os alcaloides indolizidínicos por conta do ácido pipecólico. O ácido nicotínico compõe alcaloides piridínicos.
Um esquema da biossíntese dos alcaloides pela via do acetato é descrito na figura 3:
Via do chiquimato
A via do chiquimato produz alcaloides por meio da formação do ácido antranílico e dos aminoácidos L-tirosina, L-fenilalanina e L-triptofano.
Saiba mais
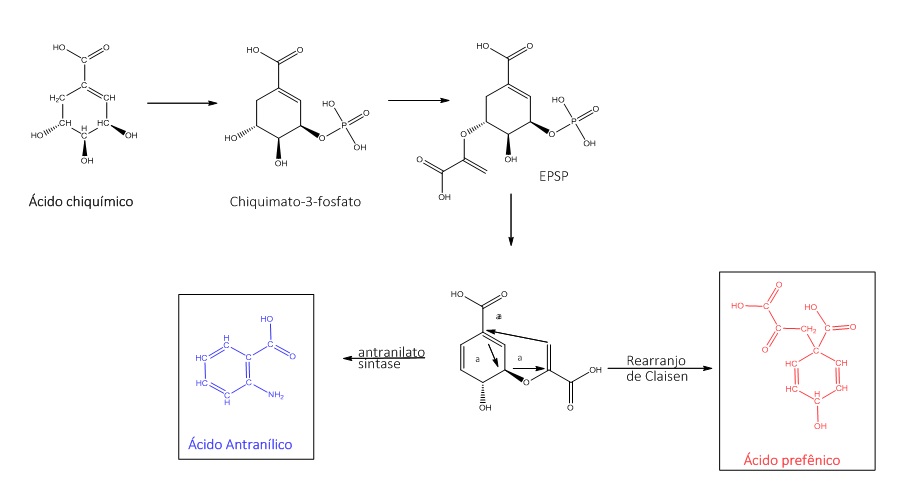
O ácido chiquímico compõe o ácido corísmico, e este forma dois importantes intermediários: ácido antranílico, por reação enzimática, e ácido prefênico, mediante um rearranjo de Claisen.
A figura 4 apresenta esse processo:
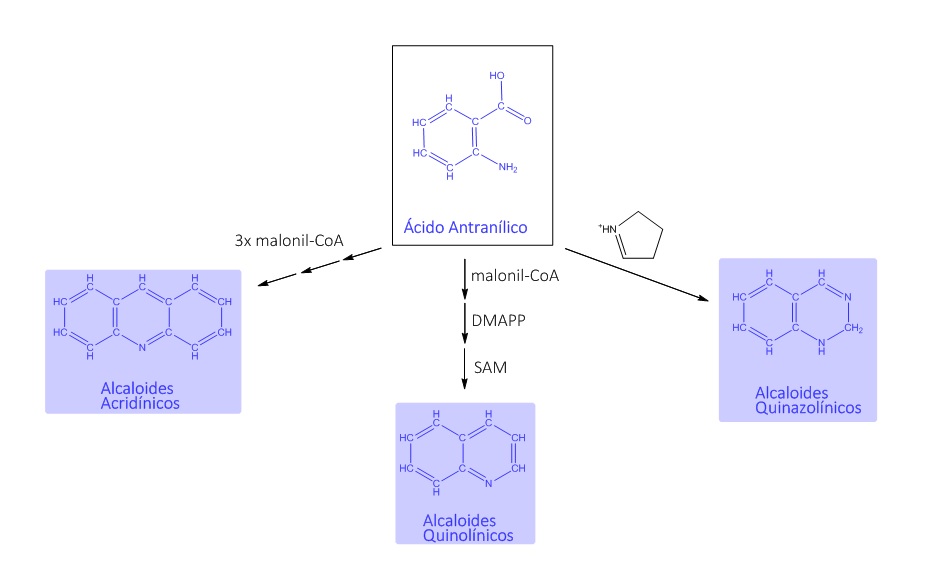
É a partir do ácido antranílico que os alcaloides quinolínicos, quinazolínicos e acridínicos são formados, conforme mostra a figura 5:
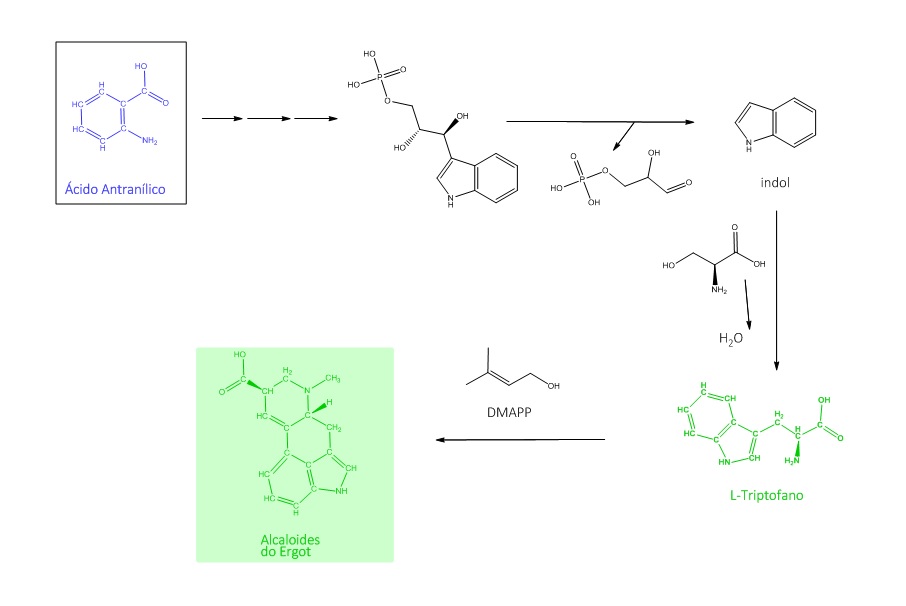
O ácido antranílico também compõe, depois de reações sequenciais, o Indol-3-glicerol-fosfato. Esse, após saída do 3-fosfogliceraldeído, forma o Indol, e, em seguida, o L-triptofano, por meio de reação enzimática e adição de uma serina.
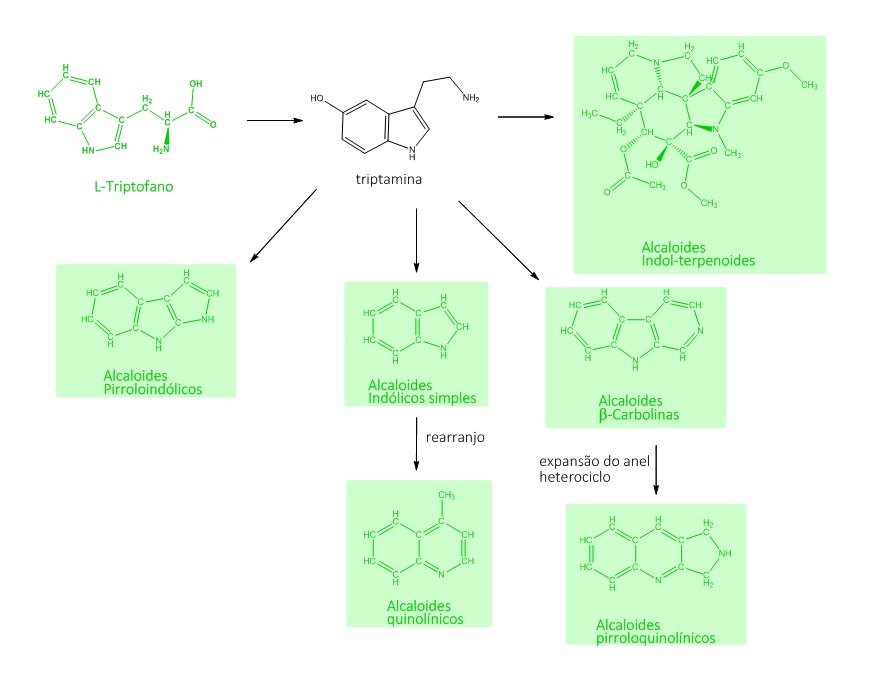
O L-triptofano dá origem a diversos alcaloides. Os alcaloides do tipo indólicos simples, as β-carbolinas, os pirroloindólicos e indolterpenoides são formados por meio da composição tendo a triptamina como intermediário. A adição de 5 carbonos, a partir do DMAPP, à estrutura do L-triptofano dá origem à biossíntese dos alcaloides do Ergot, conforme mostra a figura 6:
O núcleo indólico de alguns intermediários pode sofrer um rearranjo e formar os alcaloides quinolínicos, assim como as β-carbolinas, que, originalmente, apresentam um sistema de anel 6-5-6 carbonos, que vira um sistema de 6-6 carbonos por meio da expansão do anel heterociclo, compondo os alcaloides do tipo pirroloquinolínicos, conforme pode ser visto na figura 7:
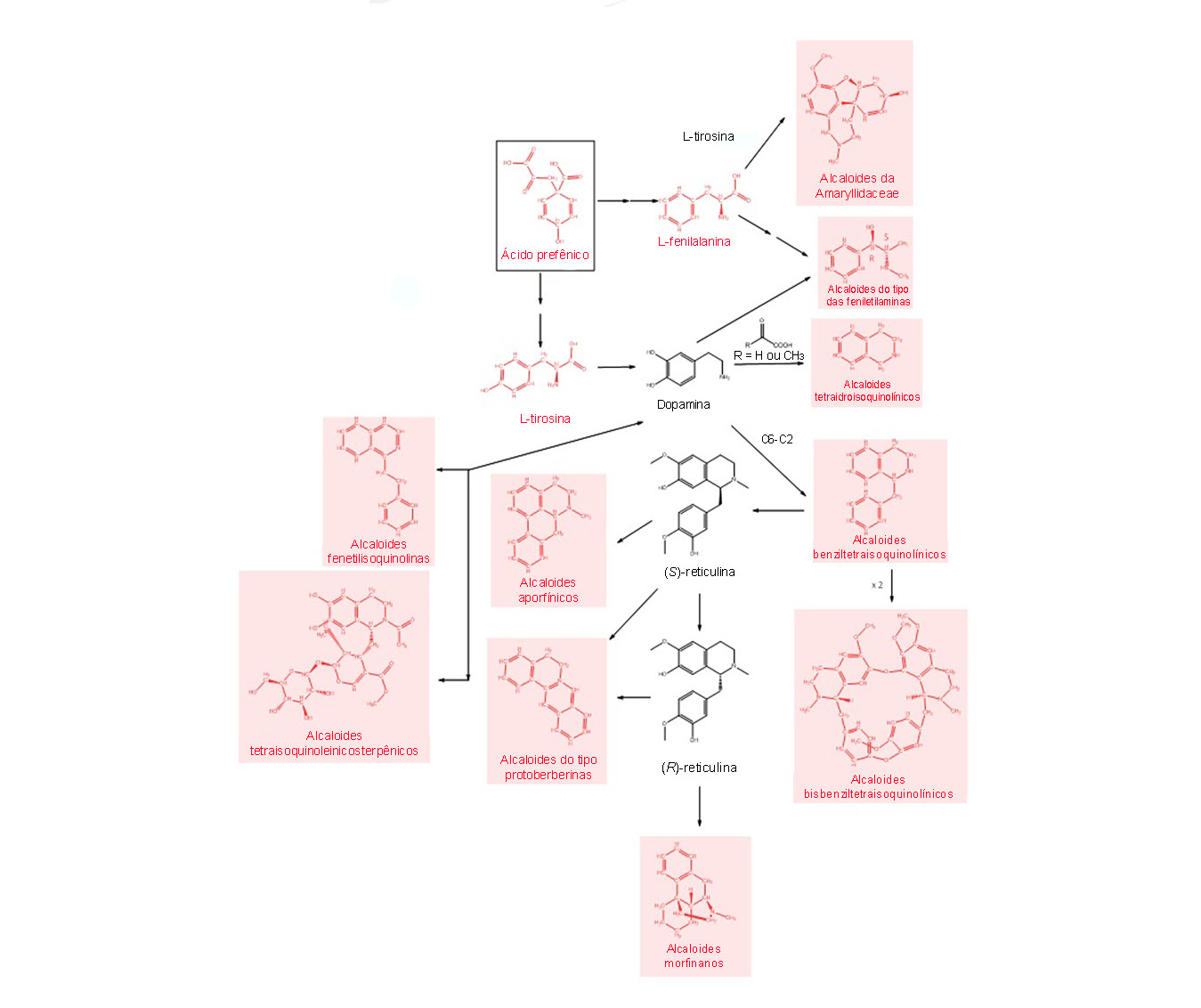
O ácido prefênico cria os aminoácidos L-fenilalanina e L-tirosina. Enquanto a L-fenilalanina dá origem apenas aos alcaloides do tipo das feniletilaminas, a L-tirosina forma uma grande variedade de classes de alcaloides.
A formação da dopamina com base na L-tirosina permite a síntese dos alcaloides do tipo das feniletilaminas e dos tetraidroisoquinolínicos com a entrada de 2 ou 3 carbonos na estrutura. A dopamina também é o intermediário para a composição dos alcaloides benziltetraidroisoquinolínicos, a partir da adição de C6-C2 carbonos, que podem sofrer acoplamento radicalar e formar os alcaloides bisbenziltetraisoquinolínicos.
O rearranjo em sua estrutura cria os alcaloides benziltetrahidroisoquinolínicos modificados. A formação do intermediário (S)-reticulina é o caminho da biossíntese desses alcaloides.
Adição de C6-C2 carbonos
Adição de uma estrutura de 6 carbonos, como um ciclohexano, substituído com mais 2 carbonos. Ou seja, no total há adição de 8 carbonos.
Os alcaloides aporfínicos são uma das classes formadas, a partir de, principalmente, reações de acoplamento oxidativo.
A (R)-reticulina, baseada na (S)-reticulina, é o precursor dos alcaloides morfinanos.
Os alcaloides do tipo protoberberinas são criados por meio da reticulina em um processo de ciclização oxidativa.
Os alcaloides fenetilisoquinolinas têm origem na ligação entre a dopamina e um derivado da L-fenilalanina e compõem diversos outros alcaloides.
Por fim, os alcaloides da família Amaryllidaceae são formados pela união de um derivado da L-fenilalanina e um da L-tirosina.
A figura 8 apresenta os processos que levam aos alcaloides derivados do ácido prefênico:
Alcaloides de precursores não aminoácidos
Podemos destacar, também, os alcaloides compostos pela histidina, os alcaloides que não são formados com base em aminoácidos e os alcaloides purínicos.
Você sabia
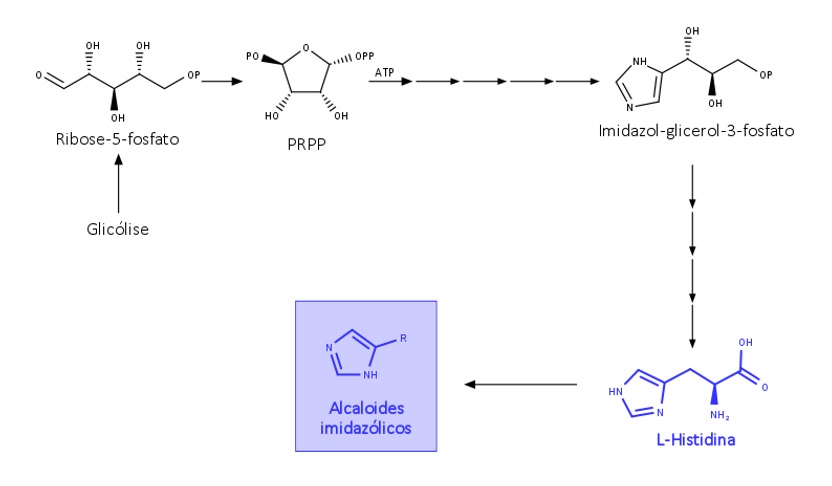
A biossíntese da L-histidina em plantas foi desconhecida por muitos anos, mas, com o aumento dos estudos genéticos, foi possível sugerir uma via de biossíntese, que se inicia a partir da Ribose-5-fosfato da glicólise.
A L-histidina dá origem aos alcaloides imidazólicos, conforme mostra a figura 9:
Muitos alcaloides não são formados a partir de aminoácidos, e sim por meio de esqueletos carbônicos que sofrem reações de transaminação.
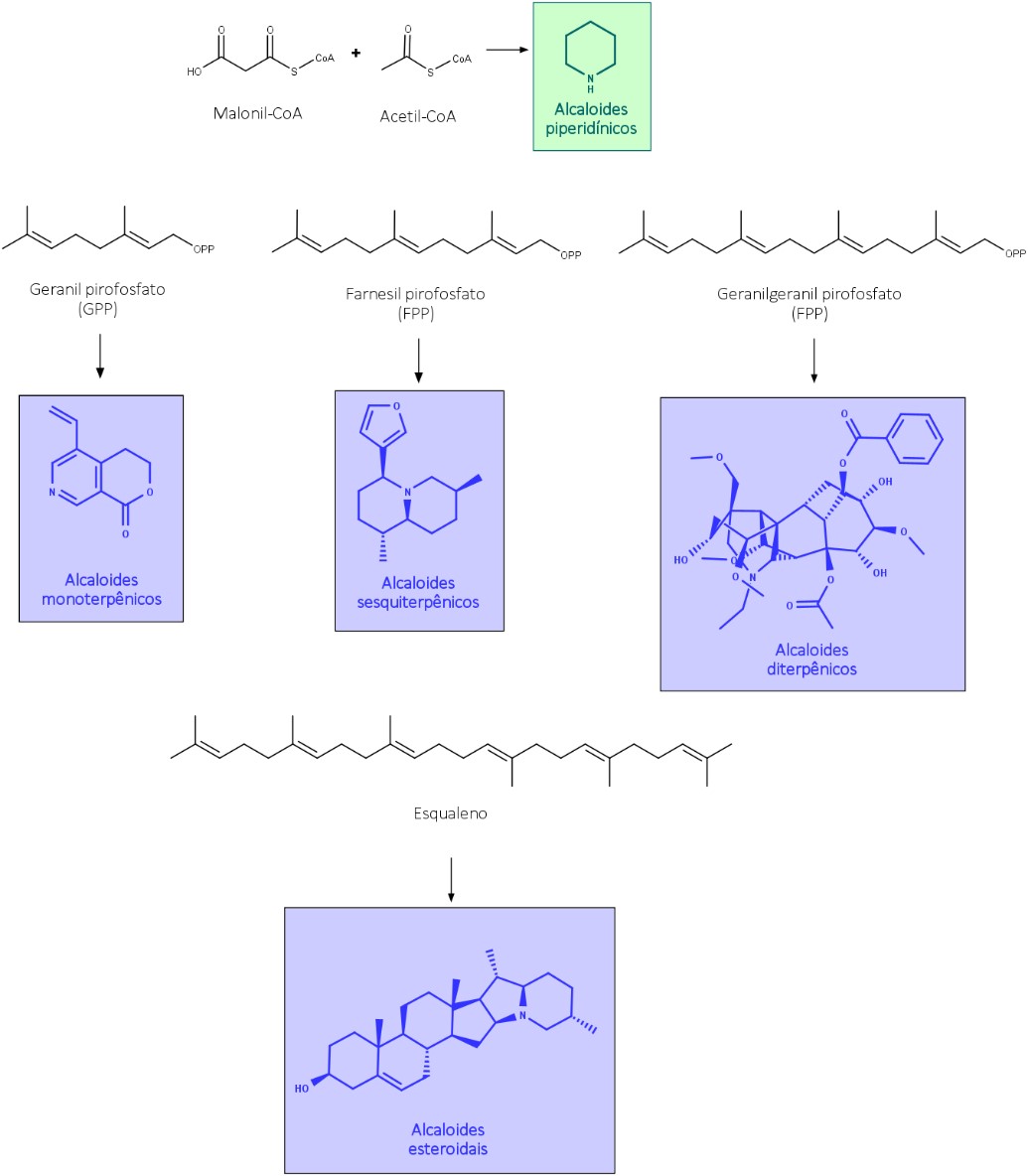
Os alcaloides piperidínicos são compostos por meio de reações entre o Acetil-CoA e o Malonil-CoA. Já os alcaloides terpenoides pela transaminação de esqueletos mono-, sesqui-, di-, e esteroidais.
Os alcaloides terpenoides podem ter uma grande variedade estrutural, assim como ocorre com os terpenos em geral, mas alguns esqueletos de alcaloides terpenoides são bem conhecidos, como mostra a figura 10:
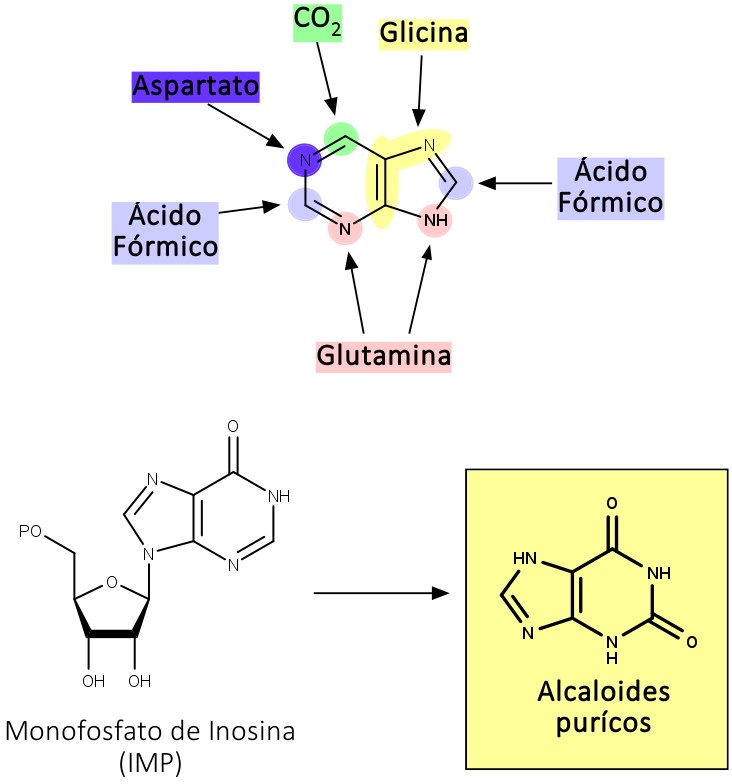
Os alcaloides púricos são aqueles derivados da xantina, que possuem sua origem biossintética nas bases púricas. Por isso, sua estrutura é formada por “pedaços” de outras estruturas, como ilustra a figura 11:
Agora que definimos a biossíntese, a distribuição e os principais métodos de extração e detecção dos alcaloides, vamos descrever cada um deles nos próximos módulos.
O especialista Marco Rocha fala sobre importância dos alcaloides, suas vias de biossíntese, características químicas e métodos de extração.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 2
Descrever os alcaloides da via do Acetil-CoA
Características gerais e origem biossintética dos alcaloides da via do Acetil-CoA
Os alcaloides provenientes da via do Acetil-CoA são aqueles formados a partir dos aminoácidos L-ornitina e L-lisina e pelo ácido nicotínico. A L-ornitina é precursora dos alcaloides tropânicos, pirrolizidínicos e pirrolidínicos. A L-lisina é precursora dos alcaloides piperidínicos, quinolizidínicos e indolizidínicos. O ácido nicotínico dá origem aos alcaloides piridínicos.
Vamos conhecer, a seguir, algumas dessas classes.
Alcaloides pirrolidínicos e tropânicos
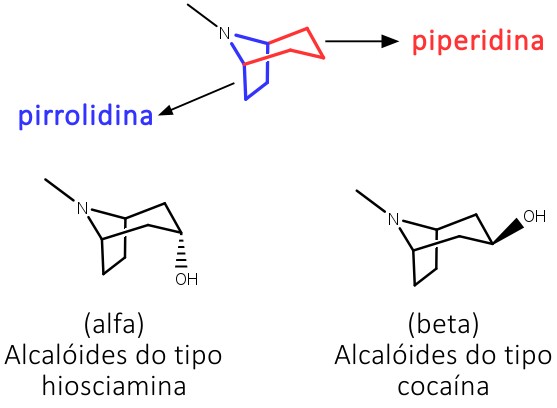
Os alcaloides tropânicos são derivados da L-ornitina e Acetil-CoA e apresentam em comum uma estrutura bicíclica, composta pelos anéis pirrolidina e piperidina, que possuem orientações α e β, existindo na forma de 2 isômeros geométricos (figura 12) e podem ser encontrados como ésteres de álcoois tropânicos e ácidos orgânicos diversos.
Comentário
Estão presentes em diversos gêneros da família Solanacea e em menor número nas famílias Erythroxylaceae, Convolvulaceae e Dioscoreaceae. Dentre as diversas espécies contendo alcaloides tropânicos, destacam-se a Atropa belladonna, Datura stramonium e Hyoscyamus niger, da família Solanaceae, e Erythroxylum coca, da família Erythroxylaceae.
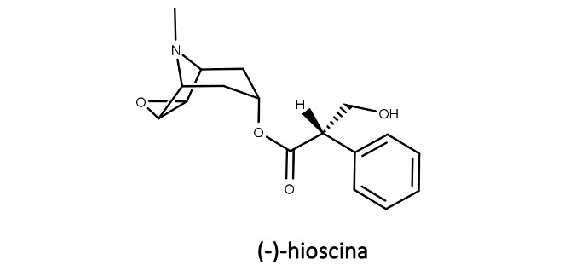
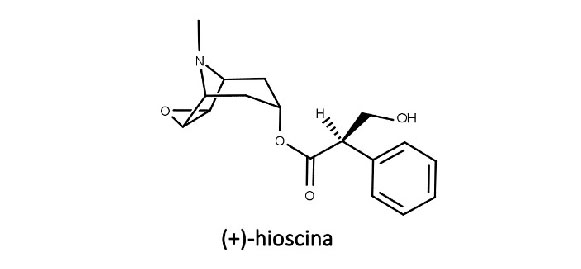
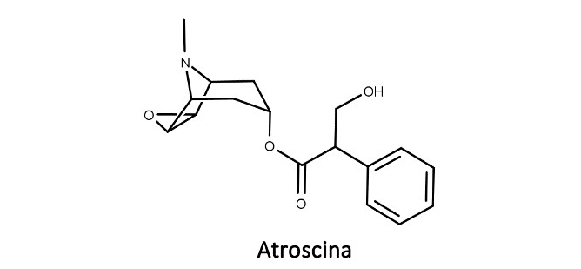
Os alcaloides (-)-hiosciamina, (-)-hioscina e cocaína são exemplos de alcaloides tropânicos com grande importância farmacológica. Sua biossíntese está descrita na figura 13:
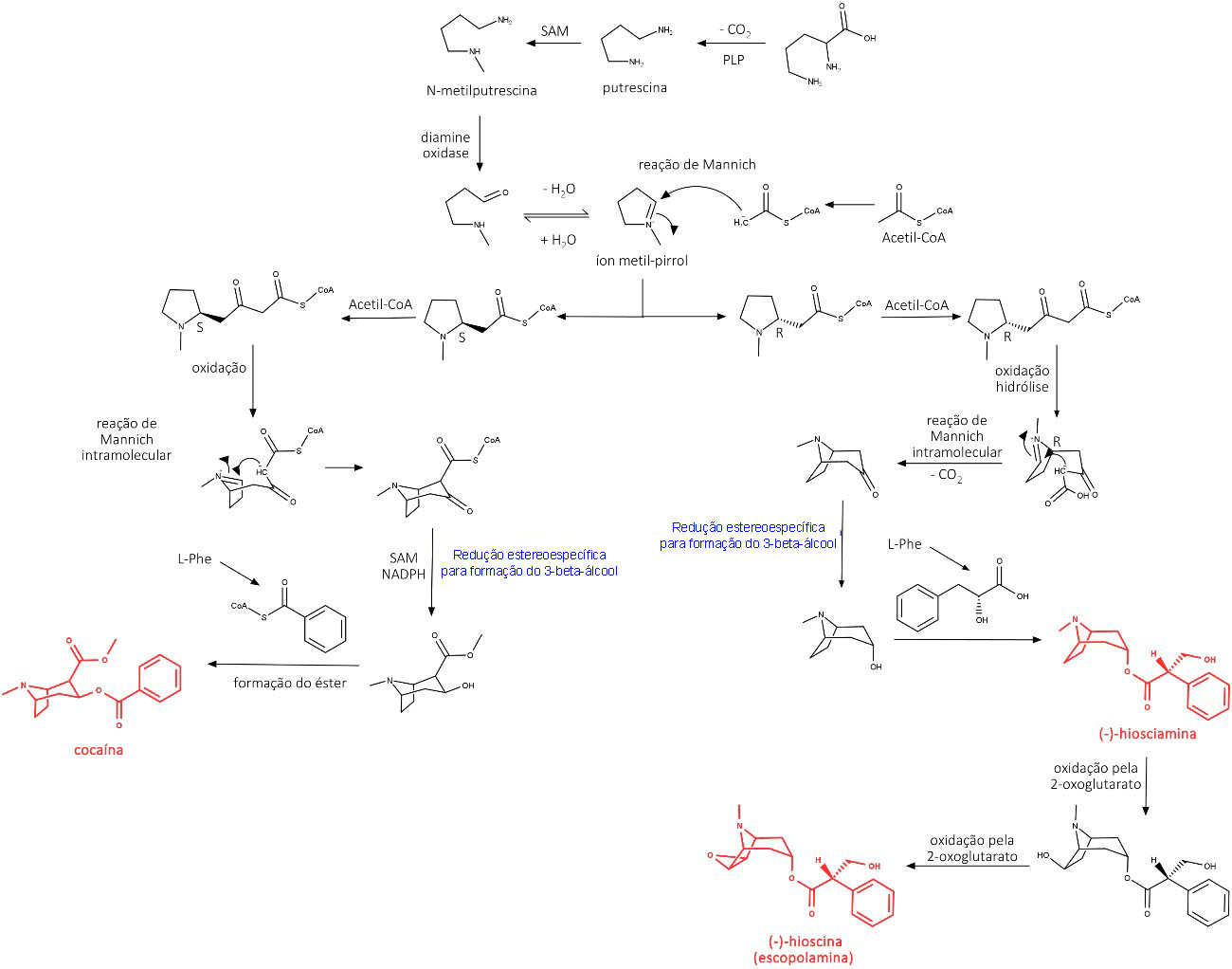
(-)-hiosciamina, atropina, (-)-hioscina (escopolamina) e atroscina
Encontrada nas plantas normalmente na forma enantiomericamente pura, a (-)-hiosciamina é racemizada durante a extração vegetal e o fracionamento do extrato vegetal, compondo a mistura racêmica chamada de atropina (figura 14).
Isso se dá porque o centro quiral é adjacente a uma carbonila e ao anel aromático.
A racemização ocorre em condições suaves, como aquecimento ou tratamento com base, contendo um enol intermediário.
A atividade biológica do (+)-enantiômero é cerca de 20-30 vezes menor do que a da forma natural (-)-.
Assim como ocorre com a hiosciamina, a hioscina, também conhecida como escopolamina (Figura 15), é racemizada durante o processo de extração vegetal e o fracionamento, porém com menos facilidade. A forma racêmica da hioscina é chamada de atroscina, e seu enantiômero (-) também possui maior atividade biológica do que o enantiômero (+).
Esses alcaloides são substâncias anticolinérgicas, ou seja, são antagonistas dos receptores muscarínicos e evitam os efeitos da acetilcolina ao bloquear sua ligação com os receptores muscarínicos. Seus efeitos farmacológicos costumam ser dose-dependentes e variam conforme o local (tecido/órgão). O quadro a seguir descreve esses efeitos:
| Local | Atropina | Escopolamina | Observações |
|---|---|---|---|
|
Sistema Nervoso Central (SNC) |
Em doses terapêuticas, provoca leve estimulação de centros parassimpáticos bulbares. Doses tóxicas promovem excitação mais evidente, irritabilidade, intranquilidade, desorientação, alucinação e delírios. Doses maiores podem causar depressão, colapso circulatório, insuficiência respiratória, coma e morte. |
Provoca sonolência, amnésia, fadiga e sono. É mais sedante que a atropina. |
A escopolamina é usada como coadjuvante no tratamento de Parkinson (associada à levodopa). |
|
Olhos |
Provocam midríase e paralisação da acomodação, devido ao bloqueio das respostas do músculo do esfíncter da íris e do músculo ciliar do cristalino. |
||
|
Coração |
Em doses usuais (0,4 - 0,6 mg), diminuem a frequência cardíaca transitoriamente. A pressão não se altera. Em altas doses, levam à taquicardia e à arritmia. |
||
|
Circulação periférica |
Em baixas doses, inibem a vasodilatação, mas com o aumento da dose, promovem a vasodilatação, em especial no rosto. Podem ser usadas para quedas abruptas da pressão arterial. |
||
|
Trato Gastrointestinal (TGI) |
Têm efeito antiespasmódico no estômago e intestino, o qual é aproveitado em casos de cólica e úlcera péptica. Muito usadas por diminuir as contrações peristálticas. A escopolamina é empregada na profilaxia de náuseas e vômitos, por inibir a motilidade gastrointestinal, na forma transdérmica. |
||
|
Sistema respiratório |
Os alcaloides inibem as secreções nasais, orofaríngeas e brônquicas. A atropina provoca estimulação respiratória e broncodilatação, de maneira mais intensa que a escopolamina, porém menor que a adrenalina. |
||
|
Secreções |
A secreção salivar, particularmente, é muito afetada e pode ser completamente abolida. A boca fica muito seca, e pode ser difícil deglutir e falar. |
||
|
Outros |
Usadas com antídoto para organofosforados e acetilcolinesterásicos. |
||
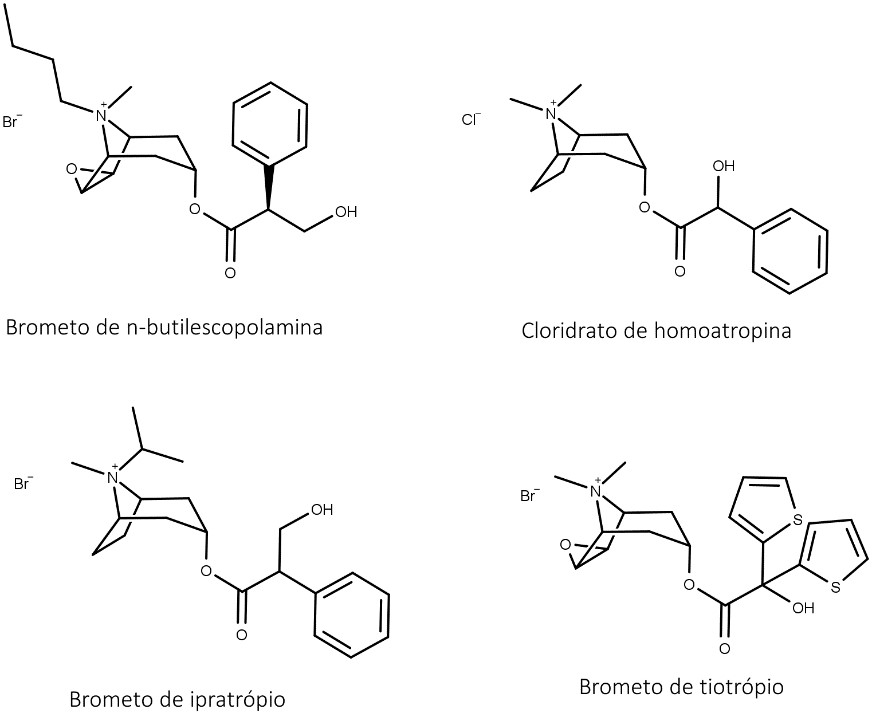
Por conta dos efeitos sobre o SNC, foram desenvolvidos diversos derivados semissintéticos com a intenção de manter os efeitos terapêuticos e diminuir os efeitos sobre o SNC. Dentre esses derivados (figura 16), podemos destacar:
Possuem ação espasmolítica sobre a musculatura lisa do aparelho gastrointestinal, provocando o alívio da dor abdominal. Não causam efeitos no SNC.
Possuem efeitos no trato respiratório, e, quando inalados, seus efeitos são sentidos quase que apenas na boca e nas vias respiratórias.
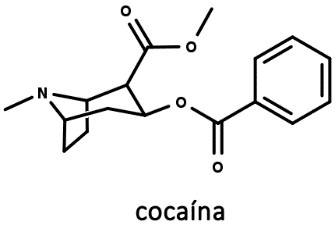
Cocaína
Alcaloide encontrado nas folhas de espécies do gênero Erythroxylum, usadas tradicionalmente entre os povos indígenas da América Central. A folha de coca é mastigada junto com limão, liberando a cocaína (figura 17). Na forma mastigada, ela promove um efeito estimulante no organismo, devido à melhoria da respiração e da oxigenação pulmonar, além de regular o consumo de glicose no sangue, diminuir a agregação plaquetária e reduzir a sensação de fome.
A cocaína foi isolada em 1859 e utilizada como analgésico para dor de dente e dor de garganta por alguns anos. Em 1880, foi incluída na lista oficial de drogas da farmacopeia americana como anestésico, e começou-se a indicar o consumo de cocaína para o tratamento da dependência da morfina.
Comentário
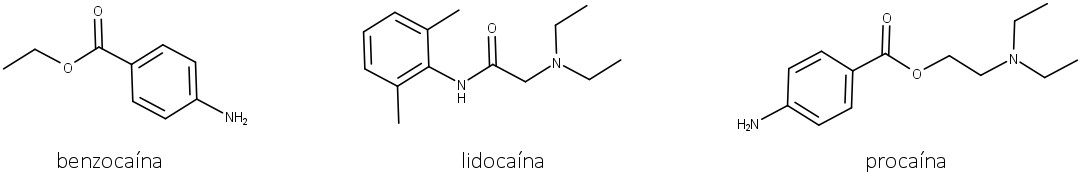
No início do século XX, vários anestésicos locais inspirados na cocaína foram sintetizados, como a benzocaína, lidocaína e procaína (figura 18), e o uso da cocaína foi proibido. A partir da década de 1960, o uso ilícito aumentou, e, até hoje, a cocaína é vendida ilegalmente na forma de cloridrato. Além do cloridrato de cocaína, também começaram a utilizar um resíduo de cocaína como base livre: o crack.
A cocaína bloqueia o transportador que remove a dopamina da fenda sináptica, prolongando seu efeito e aumentando sua concentração. Além disso, a cocaína também bloqueia a recaptação de norepinefrina e serotonina. O uso crônico provoca alteração na síntese desses neurotransmissores, gerando a dependência.
Saiba mais
Seus efeitos biológicos são dose-dependente: aumento da frequência cardíaca e da pressão arterial, excitação exacerbada, aumento da atenção e da sensação de autoconfiança e bem-estar. Doses mais altas produzem euforia, com curta duração, seguida da vontade de usar novamente a droga. O uso repetido pode levar à atividade motora involuntária, à paranoia e à irritabilidade.
A cocaína possui um tempo de meia-vida no plasma de 50 minutos, e sua metabolização envolve a hidrólise de seus grupos ésteres. Seu metabólito (benzoilecgonina) pode ser detectado na urina de 2 a 5 dias após o uso. Para usuários de grandes quantidades, é possível detectar em até 10 dias.
Além da dependência, a cocaína pode causar arritmias cardíacas, isquemia do miocárdio, miocardite, dissecção aórtica, vasoconstrição cerebral e convulsões. Ainda pode induzir o trabalho de parto e o descolamento da placenta. O uso crônico também pode causar ansiedade, depressão e psicose.
Drogas vegetais contendo alcaloides pirrolidínicos e tropânicos
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Beladona
Nome científico
Atropa belladonna L. (figura 19)
Droga vegetal
Folhas secas, íntegras ou rasuradas, de Atropa belladonna L., contendo, no mínimo, 0,25% de atropina.
Preparação padrão
Extrato fluido.
Composição química
Atropina e escopolamina – estes são cerca de 95% dos alcaloides totais.
Propriedades farmacológicas
As mesmas da atropina e da escopolamina, mas o extrato de beladona tem atividade superior aos alcaloides isolados devido ao sinergismo entre os alcaloides.
Indicação farmacêutica
Tratamento de desordens gastrointestinais.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Composição química |
| Propriedades farmacológicas |
| Observação |
Nome popular
Estramônio
Nome científico
Datura stramonium L. (figura 20)
Droga vegetal
Folhas, flores e sementes, coletadas na época de floração, contendo no mínimo 0,25% de alcaloides totais expressos em hiosciamina.
Composição química
A folha geralmente contém 0,2-0,45% de alcaloides, principalmente (-)-hiosciamina e (-)-hioscina em uma proporção de cerca de 2:1. Em plantas jovens, a (-)-hioscina pode predominar.
Propriedades farmacológicas
Semelhantes à Beladona, porém possui mais escopolamina do que as outras espécies. Por isso, a ação no SNC é menor.
Observação
Era usada para combater enfermidades pulmonares, mas causa efeitos alucinógenos comparáveis à paranoia.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Composição química |
| Propriedades farmacológicas |
| Observação |
Nome popular
Meimendro
Nome científico
Hyoscyamus niger L. (figura 21)
Droga vegetal
Folhas secas, podendo conter as flores.
Composição química
0,045-0,14%, com proporções semelhantes de (-)-hioscina e (-)-hiosciamina.
Propriedades farmacológicas
Semelhantes à Beladona.
Observação
Sua participação na composição de misturas herbais medievais e seu poder de induzir alucinações com visões de voo podem ter contribuído com a visão imaginária de bruxas em vassouras.
Nome popular
Coca
Nome científico
Erythroxylum coca (figura 22)
Droga vegetal
Folhas
Composição química
0,7-2,5% de alcaloides, estes entre 40 a 50% (-)-cocaína.
Propriedades farmacológicas
A coca mastigada é como um forte agente antifadiga e permite que trabalhadores ignorem a fome, o cansaço e o frio, aumentando a resistência.
Intoxicação atropínica
A intoxicação atropínica ocorre com o uso dos alcaloides tropânicos em doses maiores do que as terapêuticas, e seus efeitos aumentam à medida que a dose administrada aumenta.
De modo geral, os efeitos de uma intoxicação atropínica são:
- Taquicardia
- Aumento da temperatura corporal
- Boca seca
- Midríase e visão embaçada
- Constipação
- Retenção urinária
- Aumento da excitação
- Irritabilidade
- Hiperatividade
- Convulsão
- Alucinações e delírio
A depressão respiratória pode ocasionar coma e morte por parada respiratória.
Recomendação
Em caso de intoxicação, deve-se fazer lavagem gástrica com ácido tânico 4% ou produzir vômito, impedindo a absorção intestinal. Deve-se administrar fisostigmina, e, em caso de febre, nunca dar analgésicos, somente pano úmido e compressas com gelo. Se necessário, Diazepam para realizar sedação e controle das convulsões.
Alcaloides piridínicos
Os alcaloides piridínicos mais conhecidos são nicotina e anabasina, encontrados no tabaco. Suas estruturas contêm um anel de piridina com um anel de pirrolidina ou uma unidade de piperidina.
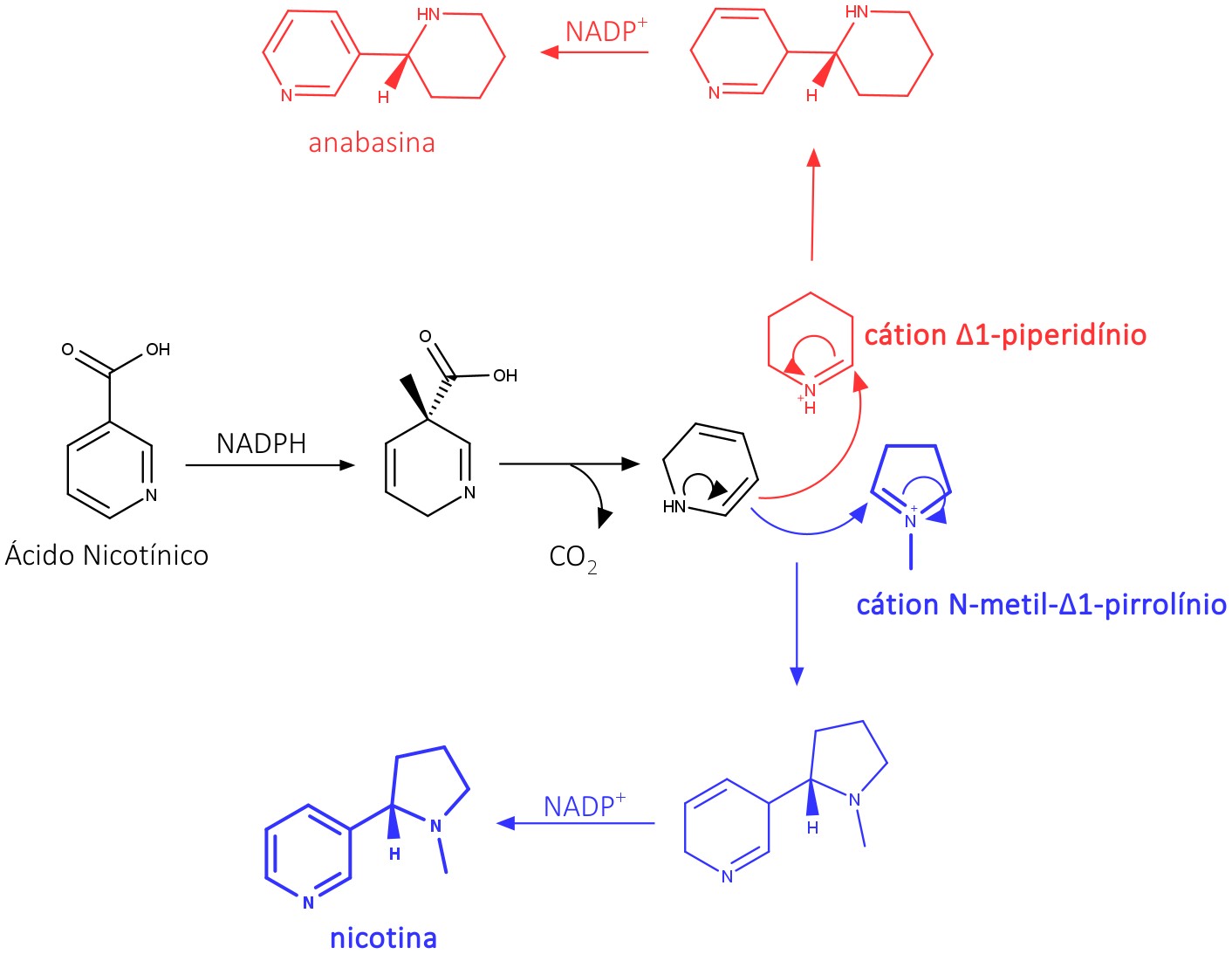
A biossíntese começa com a redução do ácido nicotínico, seguida por uma descarboxilação, originando a 1,2-dihidropiridina. Esta reage com o cátion N-metil-Δ 1-pirrolínio. Na sequência, uma oxidação da dihidropiridina cria novamente o sistema piridínico, compondo a nicotina. Anabasina é formada por um mecanismo semelhante, mas com a reação entre a 1,2-dihidropiridina e o cátion Δ1-piperidínio, a partir da L-lisina.
A figura 23 apresenta um esquema com essa biossíntese:
Comentário
A nicotina foi isolada pela primeira vez em 1828 por Posselt e Reiman. Em 1843, foram iniciados os estudos farmacológicos. Ela possui importância farmacológica devido a seus efeitos tóxicos, à sua presença no tabaco e à tendência em causar dependência.
A nicotina pode tanto estimular quanto dessensibilizar receptores. Doses pequenas estimulam as células ganglionares no Sistema Nervoso Periférico (SNP) e facilitam a transmissão dos impulsos nervosos. Já doses maiores bloqueiam a transmissão.
A nicotina também tem grande efeito sobre o SNC. Ela atua como agonista nos receptores colinérgicos nicotínicos, atravessa a barreira hematoencefálica e, por difusão passiva, distribui-se por todo o cérebro. Doses baixas provocam analgesia, enquanto doses altas provocam convulsões, seguidas de depressão respiratória e morte por insuficiência respiratória.
No sistema cardiovascular, pode ocorrer tanto o aumento da pressão arterial e da frequência cardíaca quanto a diminuição de ambos, dependendo do receptor que está ligado à nicotina. Também ocorrem vasoconstricção, taquicardia e hipertensão arterial. A nicotina ainda produz um aumento no peristaltismo, aumentando o tônus intestinal. Em pequenas doses, pode agir como um estimulante respiratório e, em doses maiores, causa depressão respiratória.
Você sabia
As principais intoxicações são em cultivadores de tabaco. Devido à lipofilicidade da nicotina, esta é absorvida pela pele e causa náuseas, vômitos, palidez, sudorese, vertigem e, em menor frequência, cólicas. Quando usada como pesticida, causa convulsões, hipotensão e parada respiratória. Em intoxicações, deve-se produzir vômito, lavagem gástrica e administração de carvão ativado, evitar soluções alcalinas e fornecer assistência respiratória.
A nicotina está disponível na forma de chicletes e adesivos transdérmicos para o auxílio do fim do hábito de fumar.
Drogas vegetais contendo alcaloides piridínicos
Nome popular
Tabaco
Nome científico
Nicotiana tabacum L. Solanaceae (figura 24)
Droga vegetal
Folhas.
Composição química
Entre 0,6-9% de (-)-nicotina e quantidades menores de outros alcaloides, como anabasina e nornicotina.
Observação
A fumaça do tabaco contém uma série de produtos químicos altamente cancerígenos, formados por combustão incompleta, incluindo benzopireno, 2-naftilamina e 4-aminobifenil. O metabolismo pelo sistema P-450 do organismo leva a mais intermediários reativos, que podem se combinar com o DNA e causar mutações. O tabagismo também contribui para aterosclerose, bronquite crônica e enfisema, e é considerado a causa de morte mais evitável na sociedade moderna.
O especialista Marco Rocha fala sobre a importância da via do acetato para a biossíntese dos alcaloides, as estruturas formadas e as plantas que os contêm.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 3
Descrever os alcaloides da via do chiquimato
Características gerais e origem biossintética dos alcaloides da via do chiquimato
Os alcaloides provenientes da via do chiquimato são aqueles formados a partir do ácido antranílico e dos aminoácidos L-tirosina, L-fenilalanina e L-triptofano.
A L-fenilalanina é precursora das feniletilaminas. A L-tirosina é precursora dos feniletilaminas, benziltetraidroisoquinolínicos e benziltetraidroisoquinolínicos modificados, fenetilisoquinolinas, tetraidroisoquinolínicos simples e derivados, e alcaloides da família Amaryllidaceae.

O L-triptofano é precursor dos alcaloides indólicos simples, β-carbolinas, pirroloindólicos, indolterpenoides, alcaloides do Ergot, quinolínicos e pirroloquinolínicos. O ácido antranílico é precursor dos alcaloides quinolínicos, quinazolínicos e acridínicos.
Feniletilaminas e alcaloides TETRAHIDROISOQUINOLÍNICOS
Feniletilaminas podem ser formadas tanto a partir da L-tirosina quanto da L-fenilalanina. Dentre as feniletilaminas de mais importância podemos destacar os neurotransmissores dopamina, noradrenalina e adrenalina, e os alcaloides mescalina e efedrina.
Mescalina
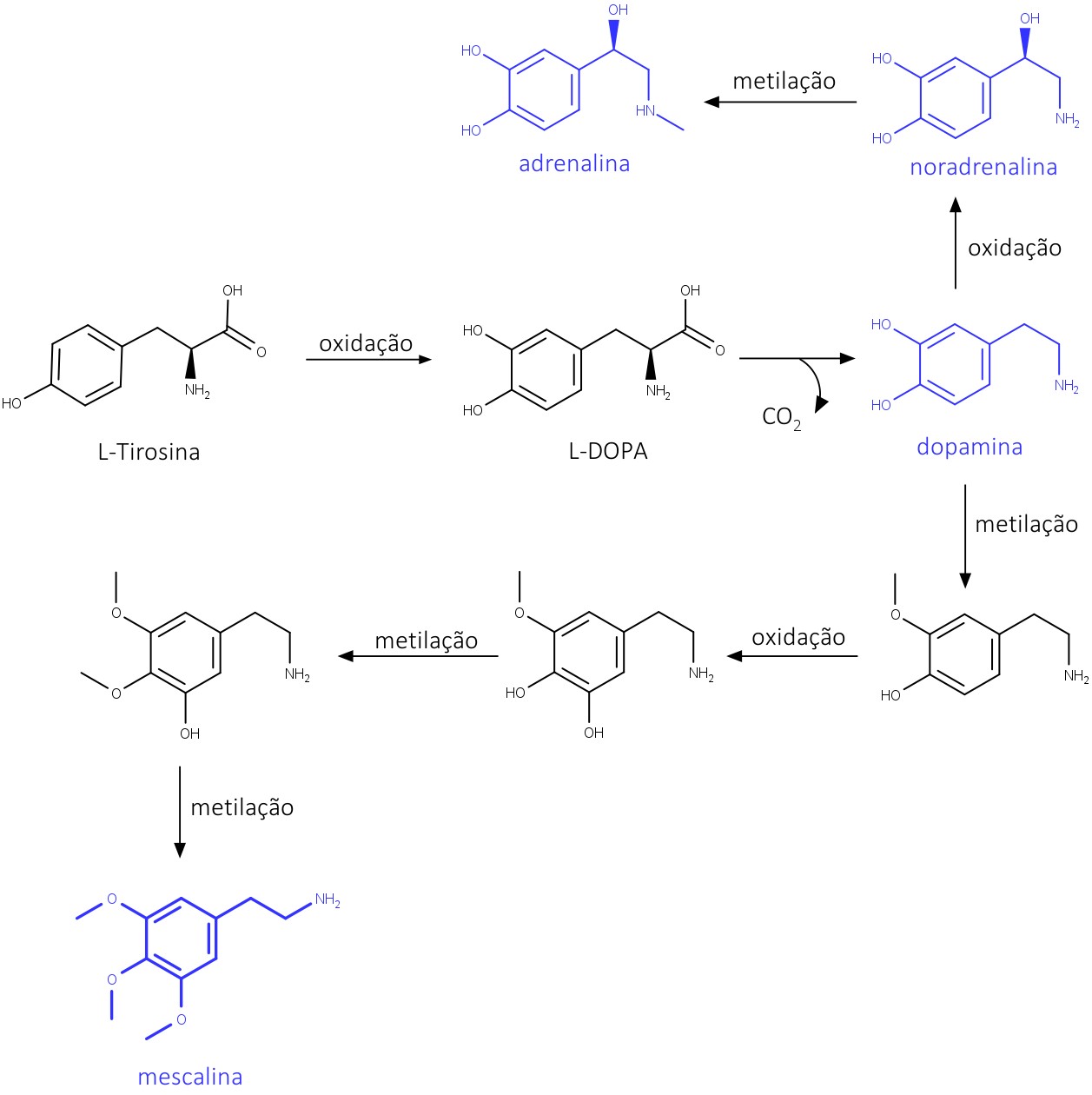
A biossíntese da mescalina ocorre com base na L-tirosina. A L-tirosina sofre uma oxidação, formando a L-DOPA, que sofre uma descarboxilação, gerando a dopamina. Esta sofre uma O-metilação e uma hidroxilação aromática, originando, então, a mescalina – um alcaloide com propriedades psicoativas e alucinógenas (figura 25).
A mescalina é encontrada nas espécies no Peiote e no Cacto de São Pedro. É utilizada em rituais religiosos e como droga recreativa.
Você sabia
A mescalina produz um estado psicótico agudo após 3 ou 4 horas. Em doses de cerca de 300 a 500 mg, produz alucinações visuais e, ocasionalmente, olfativas ou auditivas, ilusões, despersonalização e sintomas depressivos de ansiedade. O quadro total pode se assemelhar muito ao causado pela LSD, mas a LSD é aproximadamente 4.000 vezes mais potente do que a mescalina na produção de estados alterados de consciência.
A mescalina é rapidamente absorvida do TGI, e o início do efeito é observado cerca de 30 minutos após a ingestão.
O maior efeito psicodélico pode ser alcançado dentro de 2h da ingestão, mas o efeito pode durar até 8h.
A meia-vida plasmática da mescalina é de aproximadamente 6h.
Saiba mais
É necessária uma dose maior de mescalina para produzir o efeito psicodélico, não somente porque mescalina é um alucinógeno fraco, mas também por causa de sua polaridade: a mescalina não passa facilmente a barreira hematoencefálica.
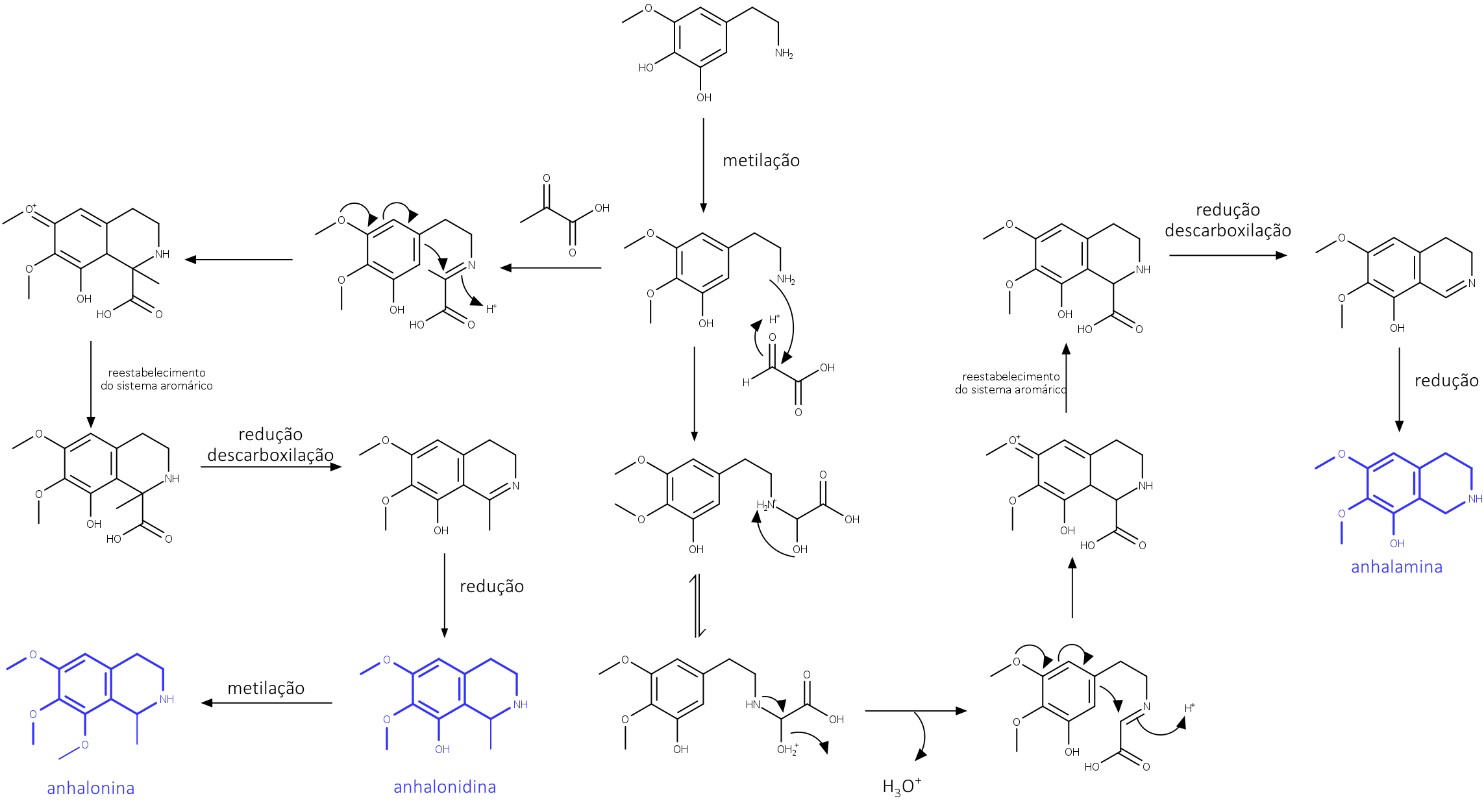
Um dos precursores da mescalina é o dos alcaloides tetrahidroisoquinolínicos anhalamina, anhalonina e anhalonidina. Os átomos de carbono adicionais das estruturas são oriundos do ácido pirúvico e do ácido glioxílico (figura 26).
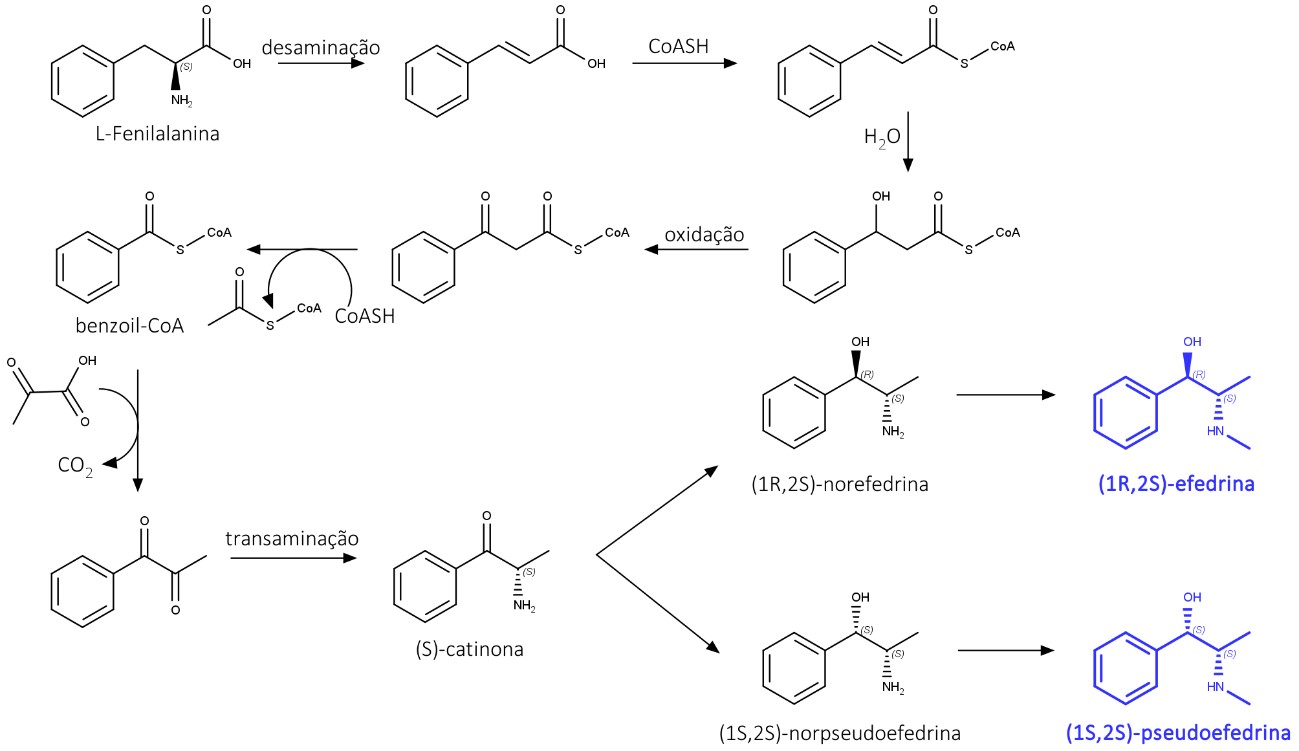
Efedrina é um alcaloide do tipo feniletilamina produzido a partir da L-fenilalanina. A L-fenilanalina é metabolizada, originando o Benzoil-CoA, que sofre uma adição de ácido pirúvico seguida de descarboxilação, formando uma dicetona, que sofre uma transaminação, e depois a (S)-catinona.
A redução da cetona resulta em dois isômeros: (1R,2S)-norefedrina e (1S,2S)-norpseudoefedrina. Estes sofrem uma N-metilação, e os isômeros (1R,2S)-efedrina e (1S,2S)-pseudoefedrina são formados (figura 27).
Pesquisadores da empresa farmacêutica Merck isolaram a efedrina e seus isômeros em 1923, e estes foram introduzidos na medicina ocidental em 1924.
Comentário
A efedrina é um agonista α e β-adrenérgico e intensifica a liberação de norepinefrina nos neurônios simpáticos. É considerada um agente simpatomimético de ação mista. Ela aumenta a frequência, o débito cardíaco e a resistência periférica, causando elevação da pressão arterial. Também promove broncodilatação e estimulação do SNC. Sua potência é menos marcada do que as anfetaminas e a noradrenalina.
Além disso, a efedrina tem ação descongestionante nasal por causar vasoconstricção na mucosa. O efeito dura cerca de 4 a 6 horas, mas, ao fim desse tempo, a congestão volta, fazendo com que o paciente venha a recorrer novamente a outras doses, o que o condiciona a um processo crônico. Por isso, vários derivados no Brasil têm seu uso controlado, não se devendo usar mais do que 4 ou 5 dias consecutivos. Para casos mais longos, recomenda-se a pseudoefedrina, por apresentar margem terapêutica maior.
Drogas vegetais contendo feniletilaminas e alcaloides tetraidroisoquinolínicos
| Nome popular |
| Nome científico |
| Droga vegetal |
| Principais constituintes |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Peiote
Nome científico
Lophophora williamsii Cactaceae (figura 28)
Droga vegetal
Talo com os botões florais e inflorescências.
Principais constituintes
Mescalina, N-acetil-mescalina, N-metil-mescalina, anhalina, anhalamina, anhalanina, anhalonina, anhalonidina, lofoforina, peiotina, entre outros.
Propriedades farmacológicas
Utilizada em rituais religiosos e como droga recreativa por conta de seus efeitos alucinógenos.
Indicação farmacêutica
O peiote não é usado de forma terapêutica.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Principais constituintes |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Cacto de São Pedro
Nome científico
Echinopsis pachanoi (Cactaceae) (figura 29)
Droga vegetal
Caule.
Principais constituintes
Mescalina (0,21-1,8%), 3,4-Dimetoxifeniletilamina, 4-hidroxi-3-metoxifeniletilamina, anhalonidina, anhalinina, hordenina.
Propriedades farmacológicas
Utilizado em rituais religiosos e como droga recreativa devido aos seus efeitos alucinógenos.
Indicação farmacêutica
O Cacto de São Pedro não é usado de forma terapêutica.
Nome popular
Efedra
Nome científico
Ephedra sinica Stapf. Ephedraceae (figura 30)
Droga vegetal
Talos que podem ser coletados em qualquer época do ano.
Principais constituintes
Alcaloides (0,5-2,0%): efedrina e seus isômeros pseudoefedrina, metilefedrina e metilpseudoefedrina, norefedrina, norpseudoefedrina (entre 30 e 90 % dos alcaloides totais).
Propriedades farmacológicas
A Efedra foi usada nos países orientais para tratar problemas respiratórios, em especial a asma. Nos países ocidentais, preparações de efedrina com outras plantas são usadas para promover a perda de peso e melhorar o desempenho atlético, mas esses medicamentos/suplementos causaram hipertensão, palpitações, taquicardia, AVC e morte, e foram proibidos em diversos países.
Alcaloides benziltetrahidroisoquinolínicos e
benziltetrahidroisoquinolínicos modificados
Como vimos anteriormente, a dopamina reage com o 4-hidroxifenilacetaldeído e compõe o esqueleto de alcaloides benziltetrahidroisoquinolínicos. Mudanças no esqueleto básico geram os alcaloides do tipo benziltetrahidroisoquinolinínicos modificados.
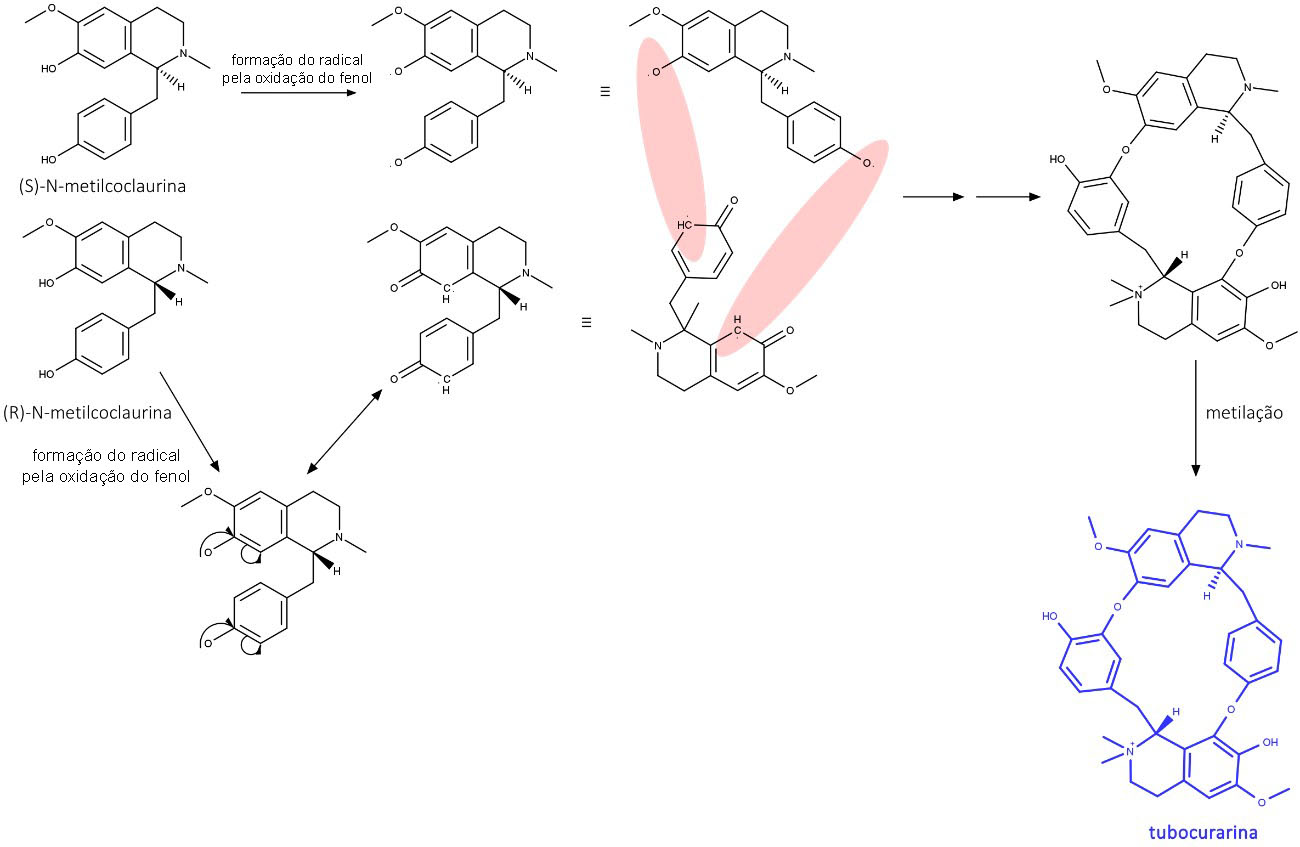
A tubocurarina é um alcaloide bisbenziltetrahidroisoquinolinínico composto a partir de pontes de éter formadas pelo acoplamento radicalar entre (S)-(N)-metilcoclaurina e (R)-N-metilcoclaurina (figura 31). A tubocurarina é o principal alcaloide presente no curare – um veneno feito com Chondrodendron tomentosum, colocado na ponta de flechas usadas para caçar pelos povos indígenas da Guiana e da Bacia do Amazonas.
O curare é um antagonista competitivo dos receptores nicotínicos da acetilcolina. Esses receptores são encontrados nas junções neuromusculares e promovem contração muscular quando ativados. O curare impede a ligação da acetilcolina com o receptor e causa paralisia muscular flácida, levando à morte por paralisia dos músculos respiratórios.
O SNC permanece praticamente intacto, e o músculo cardíaco também não é afetado. O curare só é eficaz se entrar na corrente sanguínea e não pode causar danos pela ingestão oral. Por isso, o consumo da presa atingida com o veneno da flecha é seguro.
Opioides
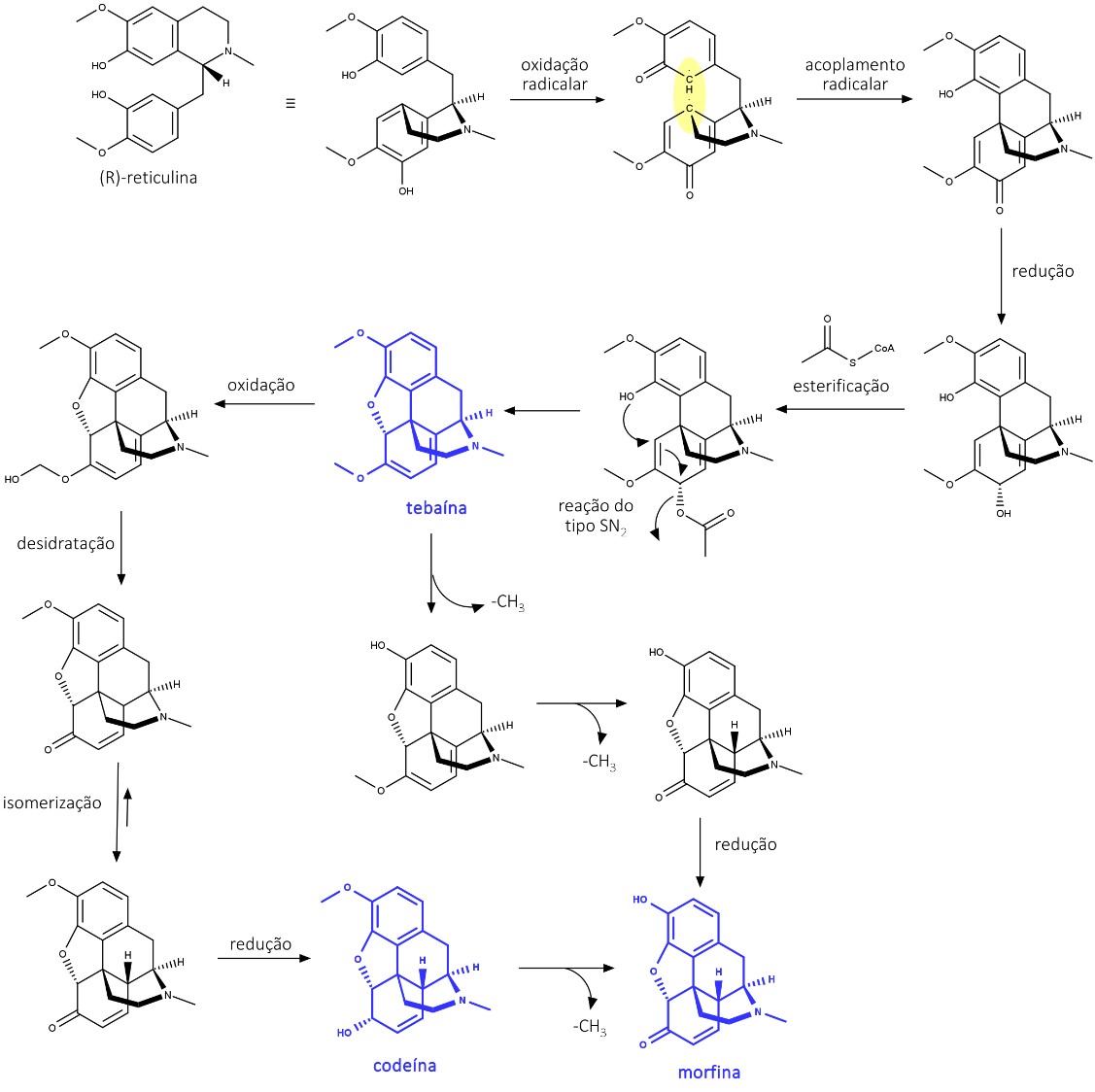
Outra modificação estrutural importante no esqueleto dos benziltetrahidroisoquinolinínicos ocorre pela ligação radicalar intramolecular da (R)-reticulina. Ela sofre uma oxidação, originando um radical em cada anel aromático e depois um diradical que se liga e forma a salutaridina – um intermediário que sofre uma redução na carbonila, seguida de esterificação e reação do tipo SN2, formando a tebaína – um dos alcaloides presentes no Ópio.
A tebaína cria a codeína a partir de reações que envolvem a formação da carbonila cetônica oriunda da oxidação, depois, uma desidratação seguida de isomerização e redução estereoespecífica da carbonila. Por meio de uma desmetilação, a codeína forma, então, a morfina.
Esses alcaloides encontrados no Ópio são chamados de opioides.
A biossíntese da morfina está descrita na figura 32:
Ópio
Látex seco extraído da papoula de Papaver somniferum.
Comentário
A morfina foi isolada em 1806, a codeína em 1832 e a papaverina em 1848. Desde a metade do século XIX, elas são utilizadas terapeuticamente. A morfina é uma droga analgésica muito eficaz para o alívio de dores moderadas a severas e é o padrão pelo qual todos os outros agentes analgésicos são medidos.
A morfina é relativamente hidrofílica e 90% de suas moléculas são ionizadas em pH oral normal. O início do efeito da morfina por via oral leva cerca de 20 a 40 minutos, e o pico da analgesia ocorre entre 60 e 90 minutos, com duração de 3 a 6 horas. A biodisponibilidade por via oral é baixa (cerca de 25%). Por isso, administra-se por via parenteral quando se busca um efeito mais acentuado.
Saiba mais
No SNC, ela promove forte analgesia, sonolência, menor alerta mental, sedação. Também causa euforia, tranquilidade e outras alterações de humor. Além disso, causa depressão respiratória, miose, náuseas e vômitos.
Diminui a motilidade intestinal e é usada para aliviar a diarreia. Isso ocorre porque ela aumenta o tônus muscular, contrai os esfíncteres pilórico, ileopilórico e anal e reduz as secreções. Um efeito importante utilizado clinicamente é a depressão do reflexo da tosse, o que permite derivados opioides, como antitussígenos.
A codeína também possui efeito analgésico. Sua absorção por via oral é superior à morfina (cerca de 60%), mas sua afinidade pelos receptores opioides é muito baixa. Sabe-se que o sistema microssomal hepático converte parte da codeína absorvida em morfina (10%), o que pode explicar sua ação analgésica.
É comumente associada com outros analgésicos, como paracetamol, ibuprofeno e salicilatos. Além disso, é muito utilizada como antitussígeno por via oral, porque é menos tóxica e depressora do que a morfina. Em doses de 15 mg, é ineficaz como analgésico, mas excelente antitussígeno.
A tebaína tem pouca ação analgésica e leva a crises epiléticas, mesmo em doses baixas. Seu uso hoje é como precursor da naloxona (antagonista opiáceo). A papaverina, por sua vez, na forma de cloridrato, é muito empregada como antiespasmódico e, atualmente, é obtida por síntese. Já a noscapina é um potente antitussígeno e é muito empregada na pediatria.
A morfina causa tolerância e dependência física e psíquica. Por isso, é utilizada apenas em âmbito hospitalar ou para casos de dores oncológicas. Doses muito elevadas podem levar à morte por parada respiratória. A morte depende de doses variadas e da sensibilidade do indivíduo. A síndrome de abstinência é caracterizada por sonolência, sudorese, excitação, dores musculares, ansiedade, insônia, náuseas, vômitos, cólicas abdominais, diarreia, midríase, taquicardia e agitação respiratória.
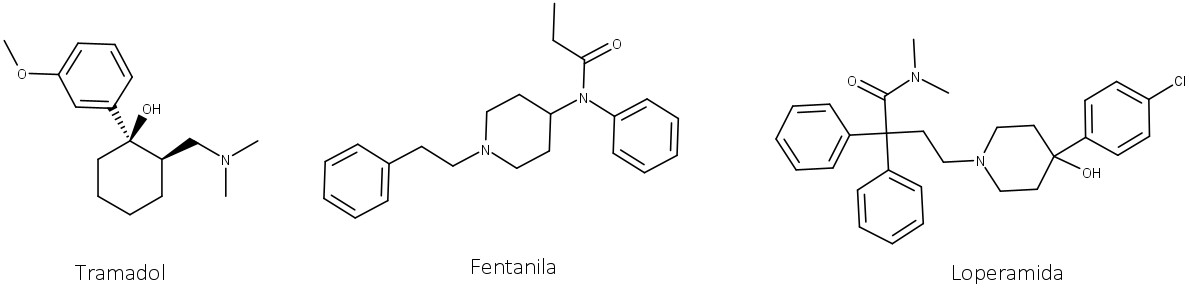
Diversos derivados semissintéticos ou totalmente sintéticos semelhantes à morfina foram desenvolvidos (figura 33). Muitos são narcóticos e analgésicos como a morfina, mas causam menos tolerância, como o Tramadol (analgésico), Fentanila (analgésico) e Loperamida (antidiarreico).
A heroína é o diacetato de morfina: um analgésico altamente viciante e hipnótico. Por causa do aumento da lipofilicidade, há transporte e absorção no SNC. Ela foi sintetizada originalmente para ser um supressor de tosse. Apesar de mais eficaz nesse papel, também apresenta altas propriedades viciantes e não é usada na clínica. Tornou-se um dos maiores narcóticos ilícitos no mundo.
Saiba mais
O tratamento da dependência e da abstinência de opioides é feito por meio da tolerância cruzada, em que se substitui o opioide de ação curta em uso (como a heroína, por exemplo) por outro de ação prolongada, vendido sob prescrição (metadona) e, depois, pela redução das doses, até que seja possível fazer uma desintoxicação com clonidina.
Drogas vegetais contendo alcaloides benziltetrahidroisoquinolínicos e benziltetrahidroisoquinolínicos modificados
| Nome popular |
| Nome científico |
| Droga vegetal |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Curare
Nome científico
Chondrodendron tomentosum (figura 34)
Droga vegetal
Cascas.
Composição química
O principal ingrediente ativo é a tubocurarina.
Propriedades farmacológicas
O curare é um antagonista competitivo dos receptores nicotínicos da acetilcolina, levando à morte por paralisia dos músculos respiratórios.
Indicação farmacêutica
É utilizado, juntamente com anestésico, para relaxamento do músculo esquelético durante cirurgias ou ventilação mecânica. Além disso, é veneno de flecha tóxico usado por partes da população indígena da América do Sul.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Papoula e Ópio
Nome científico
Papaver somniferum L. Papaveraceae (figura 35)
Droga vegetal
A droga é constituída pelo látex seco da cápsula imatura.
Preparação padrão
Látex seco.
Composição química
Morfina (10-20%), codeína (0,5%), tebaína (0,2%), papaverina (1%), noscapina (6%), principalmente.
Propriedades farmacológicas
Seus constituintes possuem propriedades analgésica, narcótica, antitussígena, entre outras.
Indicação farmacêutica
O látex não é usado terapeuticamente, e sim os alcaloides isolados.
Fenetilisoquinolinas
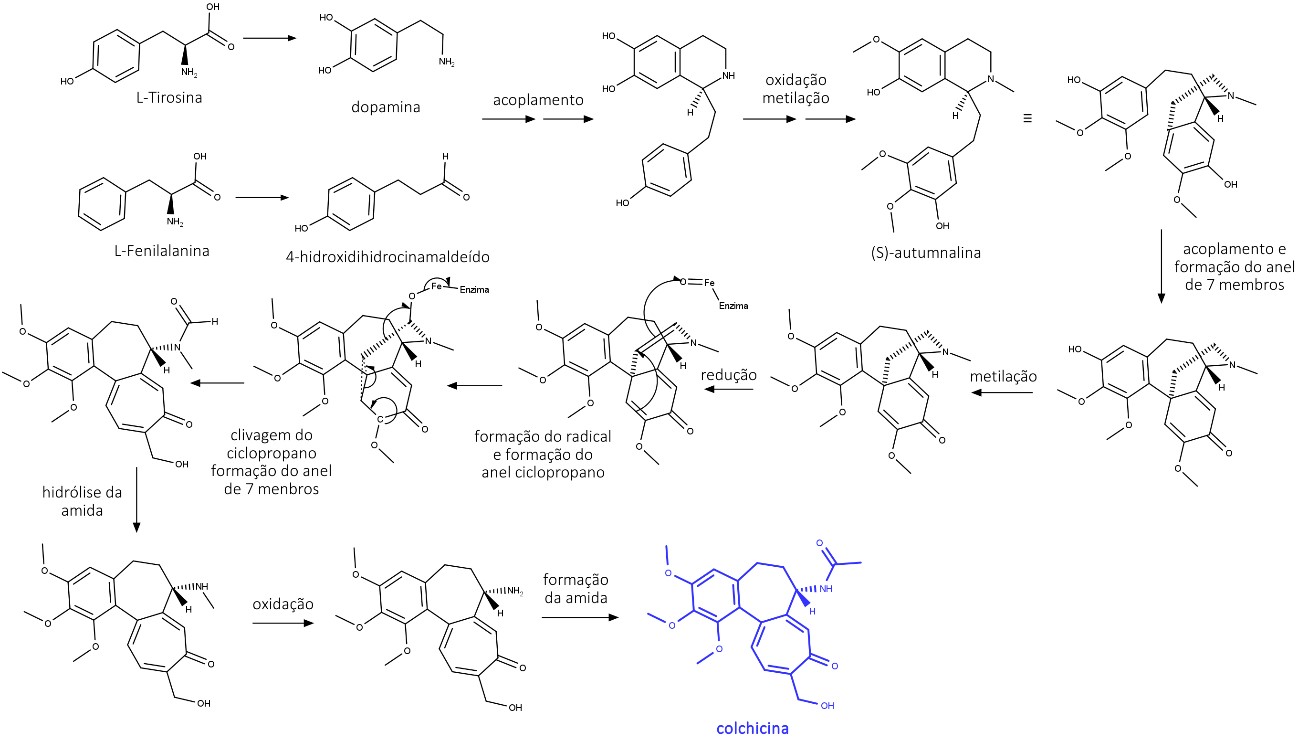
Fenetilisoquinolinas são formadas de maneira similar às benziltetrahidroquinolinas, mas a dopamina se liga a um esqueleto C6C3, do 4-hidroxidihidrocinamaldeido, ao invés do C6C2, como ocorre na formação das benziltetrahidroquinolinas. Após reações de hidroxilações e metilações, o produto final é a (S)-autumnalina, que é o precursor da colchicina (figura 36).
A colchicina é um alcaloide encontrado no Cólquico (Colchicum autumnale L. Liliaceae), isolado pela primeira vez em 1820 e purificado em 1887. Apesar de ser um alcaloide, não é básico, pois seu nitrogênio tem caráter amídico.
A colchicina tem sido utilizada no tratamento da gota e é eficaz, mas causa muitos efeitos colaterais, o que restringe seu uso. Não se sabe exatamente seu mecanismo de ação, mas ela é eficaz em cerca de 60% dos pacientes quando administrada em até 24h após o início da crise aguda e para a prevenção da gota recorrente, principalmente nos estágios iniciais da hiperuricemia.
Os sintomas da intoxicação aguda mais frequentes são: náuseas, vômitos, diarreia aquosa ou sanguinolenta e dor abdominal. Os efeitos colaterais graves são: mielossupressão, leucopenia, granulocitopenia, trombopenia e anemia aplásica.
Gota
Doença em que o metabolismo purínico comprometido leva a um acúmulo de cristais de ácido úrico nas juntas, diminuindo a mobilidade e causando dor.
Mielossupressão
Diminuição na atividade da medula óssea que resulta na redução da produção de células vermelhas e brancas e de plaquetas.
Anemia aplásica
Anemia caracterizada pela menor produção de células sanguíneas pela medula óssea.
Drogas vegetais contendo Fenetilisoquinolinas
Nome popular
Cólquico
Nome científico
Colchicum autumnale (figura 37)
Droga vegetal
Sementes e ocasionalmente bulbos.
Preparação padrão
Alcaloides da semente (0,5-1,0%): colchicina (70%), demecolcina, colchicosídeo, colchifolina e cornigerina.
Indicação farmacêutica
Tratamento da gota.
Observação
A planta é tóxica, e a colchicina isolada é utilizada.
Alcaloides da família Amaryllidaceae
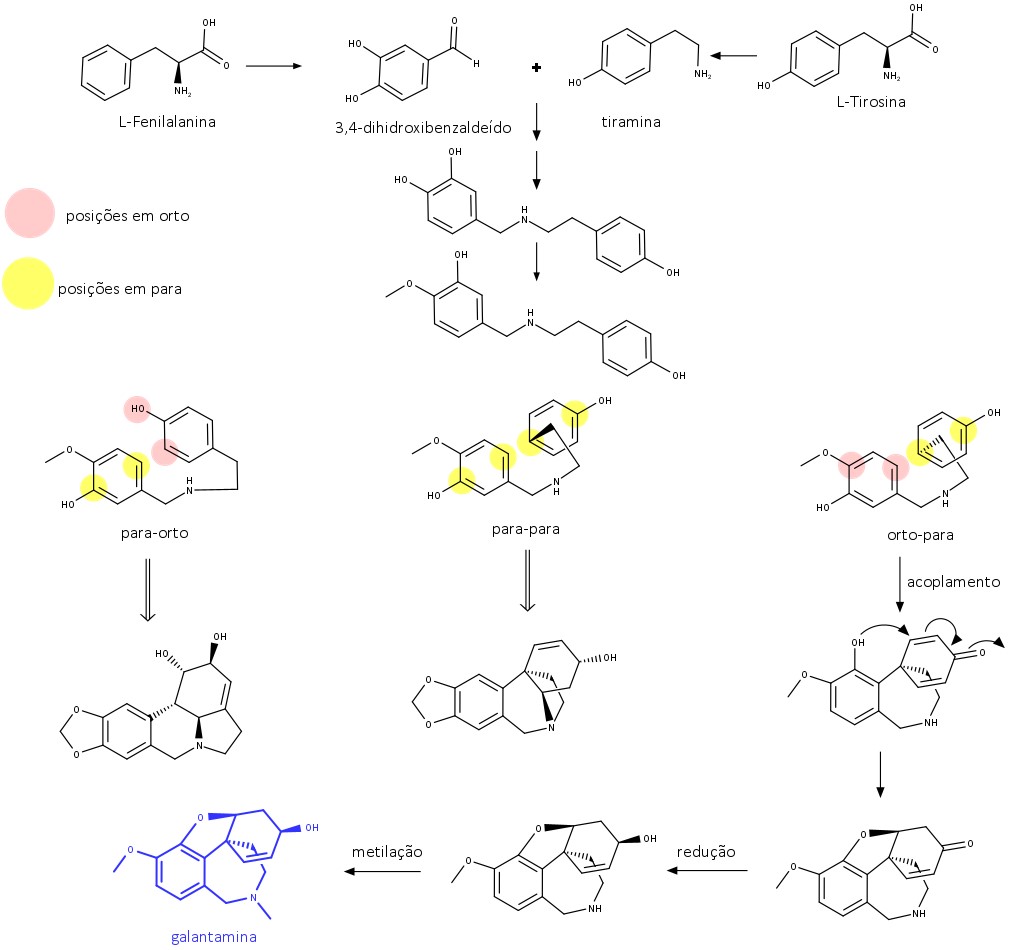
Os alcaloides encontrados na família Amaryllidaceae estão correlacionados mais pela biossíntese do que pela estrutura. Eles são formados por meio do acoplamento oxidativo intramolecular, e sua biossíntese começa pela combinação do 3,4-dihidroxibenzaldeído com tiramina, decorrentes, respectivamente, da fenilalanina e da tirosina.
Após a formação da 4-O-metilnorbeladina, três posições de acoplamento radicalar são possíveis: acoplamento para-orto, para-para e orto-para. A galantamina é um exemplo de alcaloide composto via acoplamento orto-para (figura 38).
Você sabia
Galantamina é um inibidor seletivo, reversível e competitivo de acetilcolinesterase, usado no tratamento do mal de Alzheimer. Também é o primeiro produto natural comercial da família Amaryllidaceae. Foi lançado no mercado na União Europeia e nos Estados Unidos em 2001.
Alcaloides indólicos
Alcaloides indólicos são aqueles que possuem o esqueleto indol em sua estrutura (figura 39).
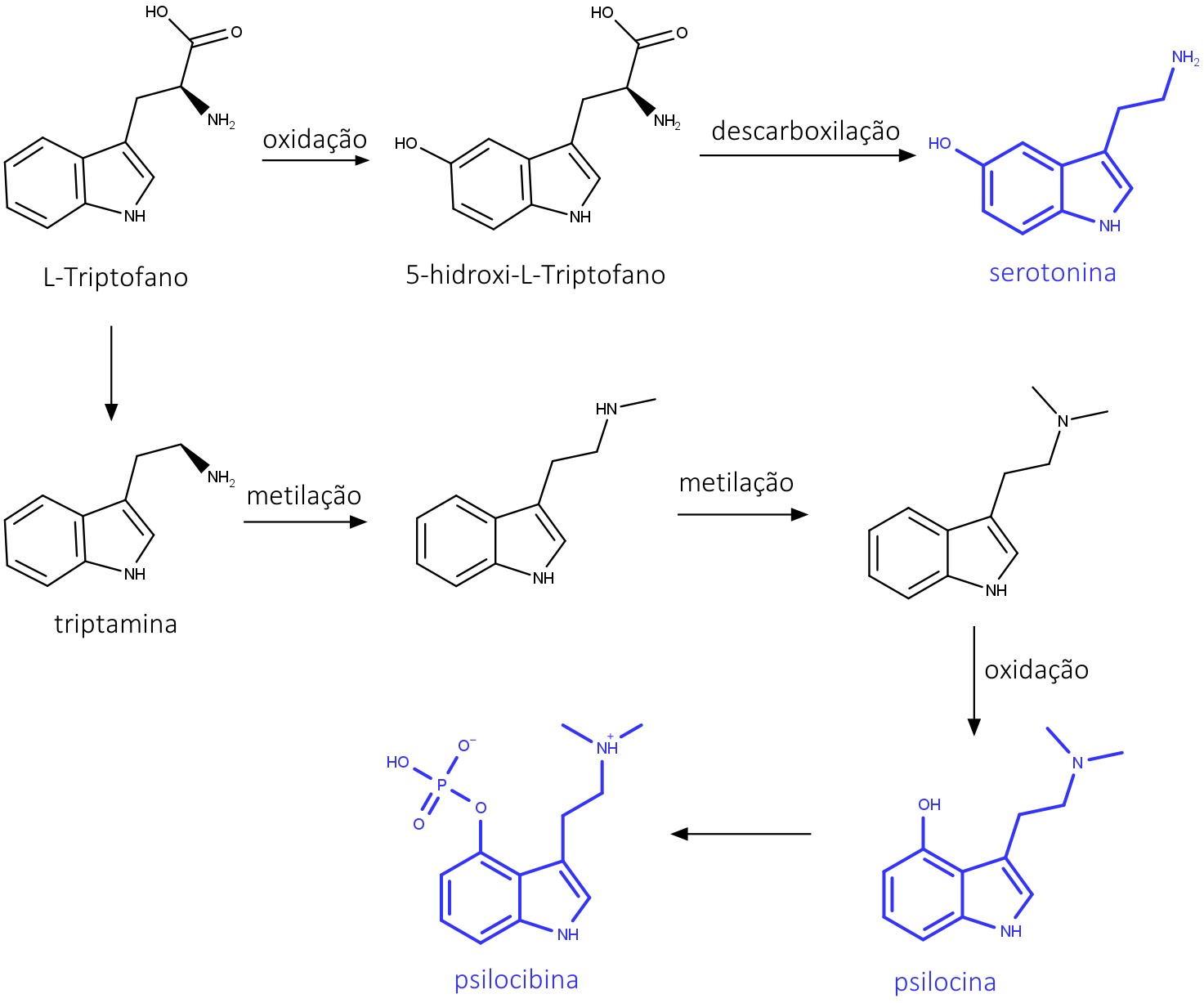
Indólicos simples
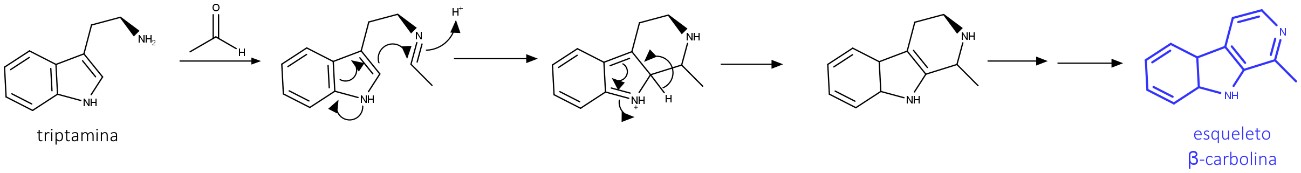
Triptamina e 5-hidroxitriptamina são alcaloides indólicos simples amplamente distribuídos nas plantas. Eles são formados pela descarboxilação e oxidação seguida de descarboxilação, respectivamente, do L-triptofano. A triptamina é o precursor da psilocina e da psilocibina, encontradas em cogumelos do gênero Psilocybe e responsáveis por seus efeitos alucinógenos.
A biossíntese desses alcaloides está descrita na figura 40:
β-carbolínicos
Alcaloides β-carbonílicos têm formação da base de Schiff, usando um aldeído/ácido. A ciclização ocorre por meio de uma reação intramolecular tipo Mannich, seguida de tautomerismo e oxidação dos carbonos para estabelecer a aromaticidade (figura 41).
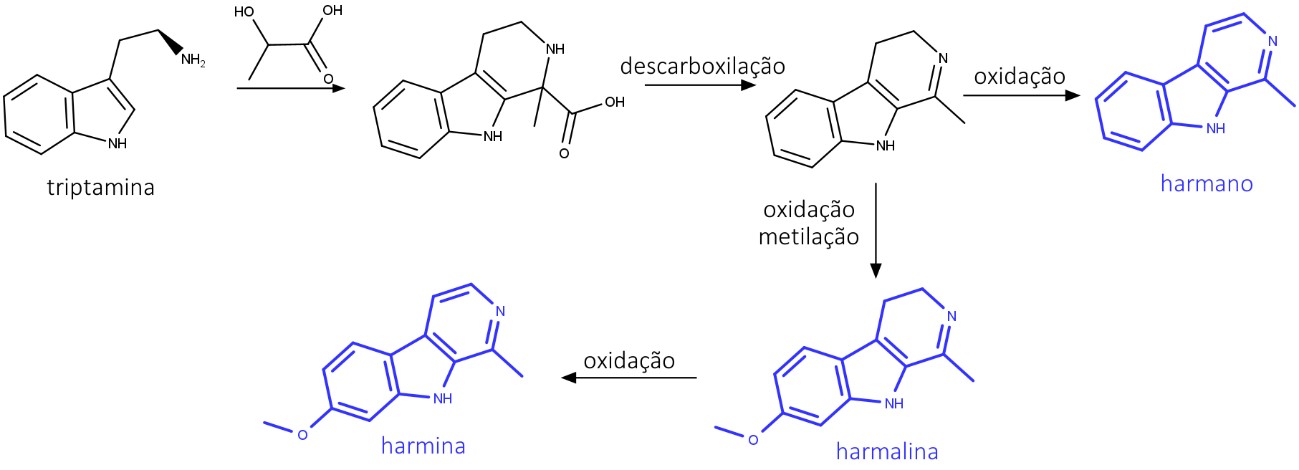
A harmina, a harmalina e tetrahidroharmina são formadas a partir da reação entre o L-triptofano e o piruvato (figura 42) e são alcaloides inibidores da MAO (Monoaminoxidase), fazendo com que a concentração de serotonina e noradrenalina aumentem na fenda sináptica. Esses alcaloides são encontrados em Banisteriopsis caapi: uma das espécies que compõem o Ayahuasca (chá de Santo Daime), juntamente com Psychotria virides.
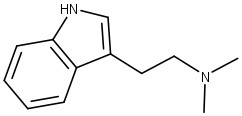
A P. virides possui em sua composição o alcaloide N,N-dimetiltriptamina (DMT) (figura 43): um agonista serotoninérgico que causa alucinações visuais, auditivas, táteis, dilatação profunda do tempo e distorções. O DMT é degradado pela MAO do TGI quando ingerido por via oral. Entretanto, quando associado à harmina, os efeitos alucinógenos acontecem por conta da inibição da MAO.
Você sabia
A intoxicação pelo Ayahuasca causa náuseas, sudorese, salivação, nervosismo, palidez e midríase. Em alguns casos, devido à grande quantidade de derivados triptamínicos, podem ocorrer taquicardia, convulsões e sensação de pânico.
Drogas vegetais contendo β-carbolínicos
Nome popular
Caapi
Nome científico
Banisteriopsis caapi (figura 44)
Droga vegetal
A droga é a madeira do talo e em menor proporção pelo corte do troco ou das sementes.
Composição química
Harmina (1-2%), tetrahidroharmina, harmalina, harmalol, vasicina.
Propriedades farmacológicas
Tradicionalmente, é utilizada juntamente com Psychotria viridis na preparação do Ayahuasca (Santo Daime) pelos xamãs e pajés da região amazônica, principalmente em cerimônias de cura e adivinhação.
Observação
A planta é tóxica, e a colchicina isolada é utilizada.
Indolterpenoides
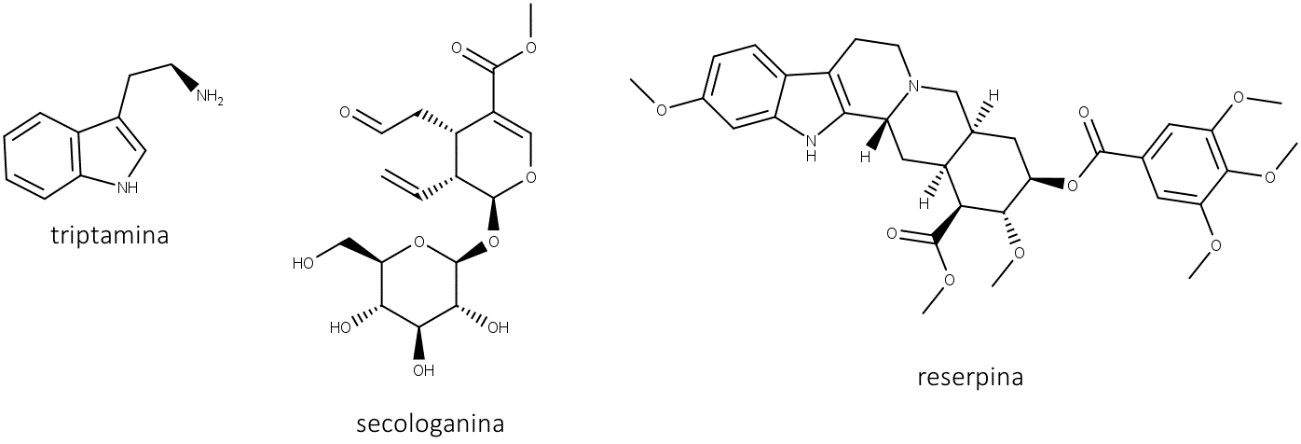
Alcaloides indolterpenoides são formados pela ligação entre o L-triptofano e terpenos e possuem grande variedade estrutural. Nessa classe, podemos destacar reserpina, vimblastina, vincristina, estricnina e ibogaína.
A reserpina, encontrada na Rauwolfia serpentina, é composta a partir da triptamina e da secologanina (figura 45). A reserpina e os alcaloides semelhantes são eficazes na redução da pressão arterial quando usados com um diurético, mas, com o passar do tempo, a reserpina pode gerar depressão, mesmo com doses baixas (0,25 mg/dia), levando a diversos casos de suicídio entre os pacientes. A depressão induzida pela reserpina pode persistir por vários meses após o tratamento.
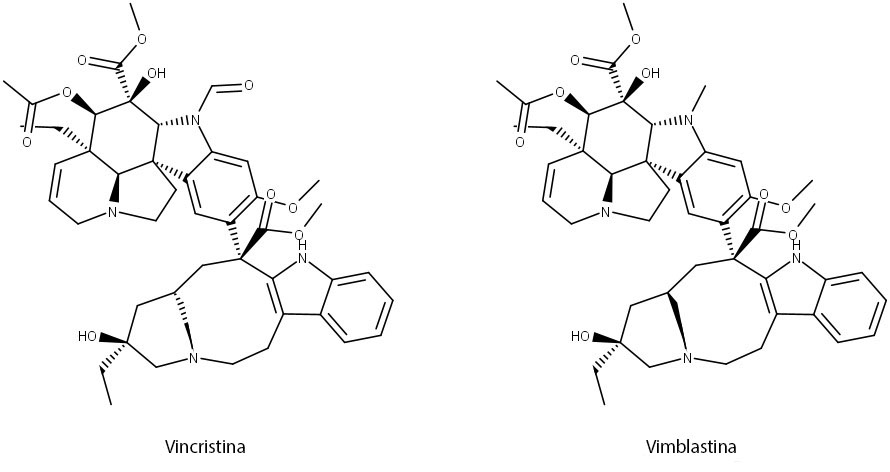
Vincristina e vimblastina (figura 46) são alcaloides encontrados em Catharanthus roseus (ou Vinca rosea) e formados a partir do acoplamento de dois alcaloides indolterpenoides (catharantina e vindolina) originados da triptamina e da secologanina.
A vimblastina é utilizada principalmente no tratamento de Linfoma de Hodgkin. A vincristina tem uma atividade antitumoral superior à da vimblastina, porém é mais neurotóxica. Apesar disso, é muito eficaz no tratamento de leucemia infantil. Também é usada em outros tipos de câncer, como linfomas, câncer de pulmão de pequenas células e cânceres cervicais e de mama. O mecanismo de ação desses alcaloides ocorre pela complexação com a tubulina, interferindo na formação dos microtúbulos e inibindo a mitose celular.
Comentário
Um problema associado ao uso clínico de vimblastina e vincristina é que a planta produz muito pouco desses alcaloides. São necessários 500 kg de planta para isolar 1g de vincristina. Além disso, a extração é cara e demorada. Uma alternativa é a síntese desses alcaloides a partir de intermediários, utilizando enzimas. O rendimento também não é alto, porém é mais alto que pelo processo extrativo vegetal.
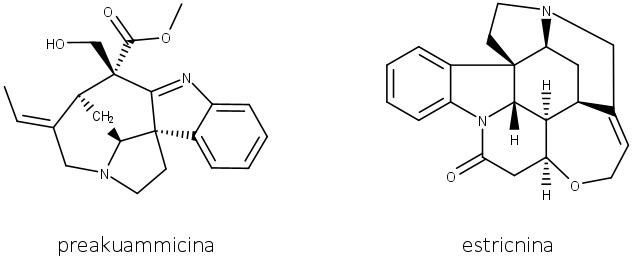
Estricnina é encontrada em Strychnos nux-vomicae e é muito tóxica. Sua estrutura, determinada em 1948, é complexa, e sua biossíntese é sugerida baseada na preakuammicina (figura 47). Devido à sua alta toxicidade, que causa convulsões e, em doses mais elevadas, a morte, a estricnina é de baixo valor terapêutico, mas é utilizada como veneno de rato.
Drogas vegetais contendo Indolterpenoides
Nome popular
Rauvolfia
Nome científico
Rauwolfia serpentina (figura 48)
Droga vegetal
Rizomas e raízes secos.
Composição química
Yohimbina e seus isômeros (α, β e γ-yohimbina), corinantina e Isorauhimbina, reserpina (0,1 a 0,2% na raiz), rescinamina e reserpoxidina.
Indicação farmacêutica
Já era usada na medicina hindu para mordidas de cobras (de onde veio o nome serpentina, devido à forma da raiz), serve para picadas de insetos e é aplicada como sedativo e antipsicótico.
Nome popular
Vinca
Nome científico
Catharanthus roseus sin. Vinca rosea (figura 49)
Droga vegetal
A droga é constituída pelas folhas.
Composição química
Alcaloides (0,07-1%). Os mais importantes são a vincristina e a vimblastina.
Indicação farmacêutica
O principal uso dos alcaloides da vinca é na terapia oncológica, mas nunca na forma de fitoterápicos, e sim a partir dos princípios ativos isolados.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Noz vômica
Nome científico
Strychnos nux-vomica L. (figura 50)
Droga vegetal
Sementes.
Preparação padrão
É empregada como fonte de estricnina e é conhecida como Fava de Santo Inácio.
Composição química
Alcaloides indólicos (1-5%), estricnina (40-50%), isoestricnina (5-8,5%), brucina (40-45%) e isobrucina (1,5%), além de outros alcaloides.
Propriedades farmacológicas
Causa convulsões e morte.
Quinolínicos
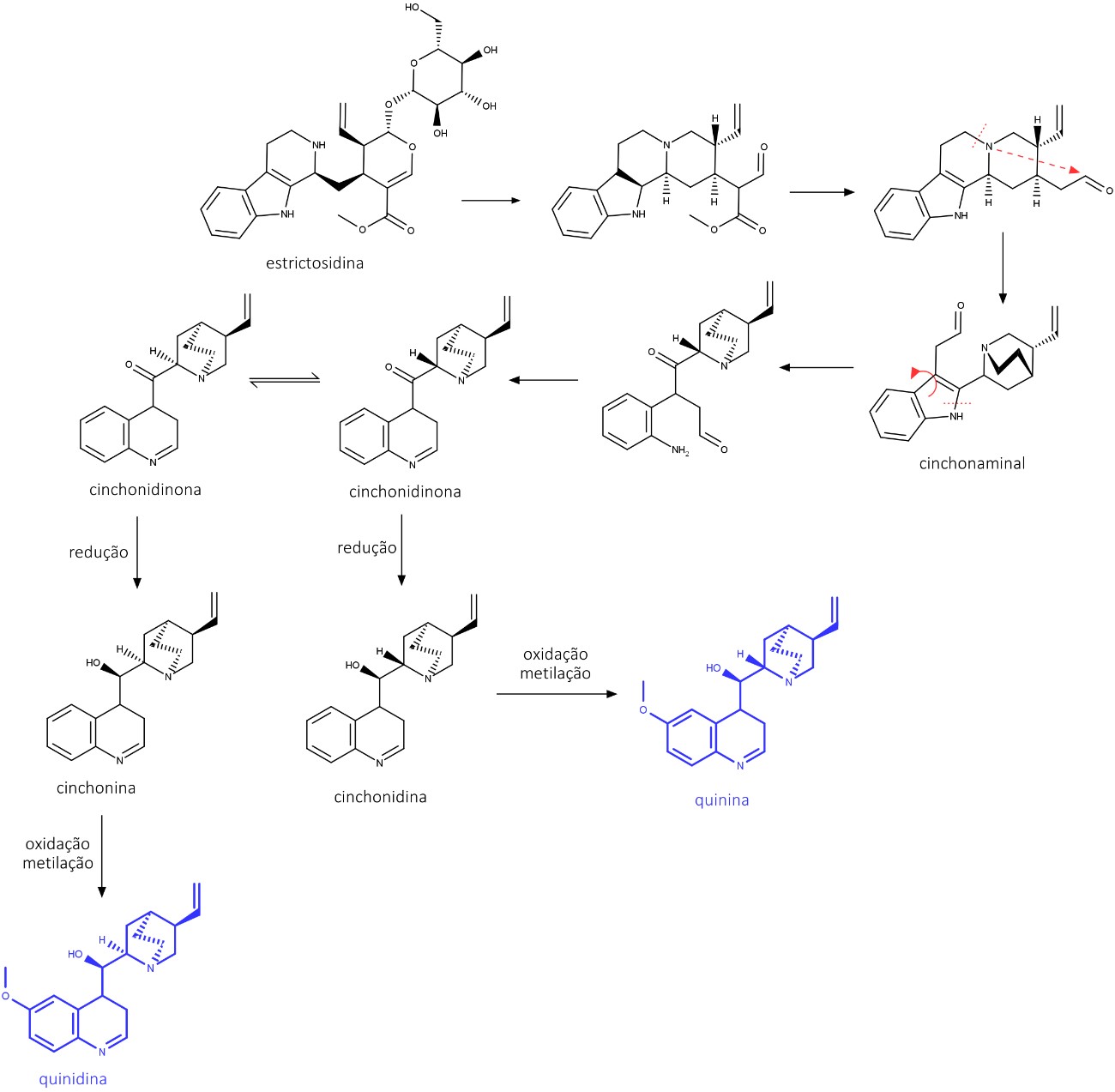
Alcaloides Quinolínicos são formados a partir do rearranjo do núcleo indol em um núcleo quinolínico. Nesta classe, destaca-se a quinidina e a quinina, encontradas em várias espécies do gênero Cinchona (Rubiaceae).
A biossíntese da quinidina e da quinina ocorre com base na estrictosidina, que, após algumas reações, cria o intermediário cinchonaminal.
Este sofre uma abertura no anel indol, originando uma amina e uma cetona.
O novo heterociclo de quinolina se forma a partir da amina com o aldeído produzido na clivagem da cadeia lateral da triptamina, gerando a cinchonidinona. Esta fica em um tautomerismo ceto-enol, formando dois isômeros: cinchonidinona e cinchoninona.
A redução da cetona compõe a cinchonidina e a cinchonina, que, após hidroxilação e metilação, formarão a quinina e a quinidina (figura 51).
A quinina é um pó branco e cristalino. Ela é amarga, pouco solúvel em água e solúvel em álcool e clorofórmio. É usada há muitos anos para o tratamento da malária. Os efeitos benéficos da casca da Quina (Cinchona officinalis L.) foram descobertos pela primeira vez na América do Sul por volta de 1630, e a casca foi levada para a Europa pelos jesuítas.
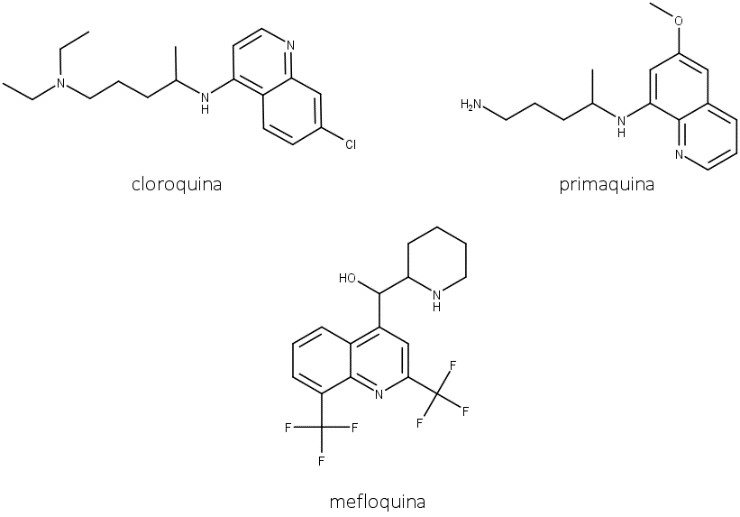
Durante muitos anos, a planta foi a fonte de quinina para uso medicinal. Entretanto, na Segunda Guerra Mundial, o fornecimento ficou comprometido, e diversas substâncias foram produzidas às pressas como alternativa à quinina, destacando-se entre elas a cloroquina, a primaquina e a mefloquina (figura 52). O desenvolvimento desses derivados resultou na diminuição do uso farmacológico da quinina, mas ela ainda é a mais eficiente contra a malária produzida pelo P. falciparum.
Malária
Doença causada por protozoários do gênero Plasmodium.
A quinidina é uma substância antiarrítmica de classe I e previne arritmias ventriculares. Ela bloqueia os canais de sódio dependentes de voltagem e alguns canais de potássio dependentes de voltagem. A quinina também apresenta propriedades depressoras cardíacas, mas com atividade 50% menor do que a quinidina.
A quinina em altas doses é depressora do SNC, considerando 8 g a dose para produzir a morte. Por via oral, pode gerar quadros de epigastralgia, náuseas e vômitos.
Drogas vegetais contendo alcaloides quinolínicos
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Quina
Nome científico
Cinchona officinalis L. Rubeaceae (figura 53)
Droga vegetal
Casca da madeira.
Preparação padrão
O teor de alcaloides não pode ser inferior a 5%.
Composição química
Alcaloides (3-15%): quinina, quinidina, cinchonina e cinchonidina, cupreína, quinicina, cinchonicina, epiquinamina, hidroquinina, hidroquinidina etc.
Propriedades farmacológicas
Antimalárico.
Indicação farmacêutica
Tradicionalmente, a quina foi empregada pelos indígenas do Equador que usavam a infusão das cascas para febres.
Pirroloindólicos
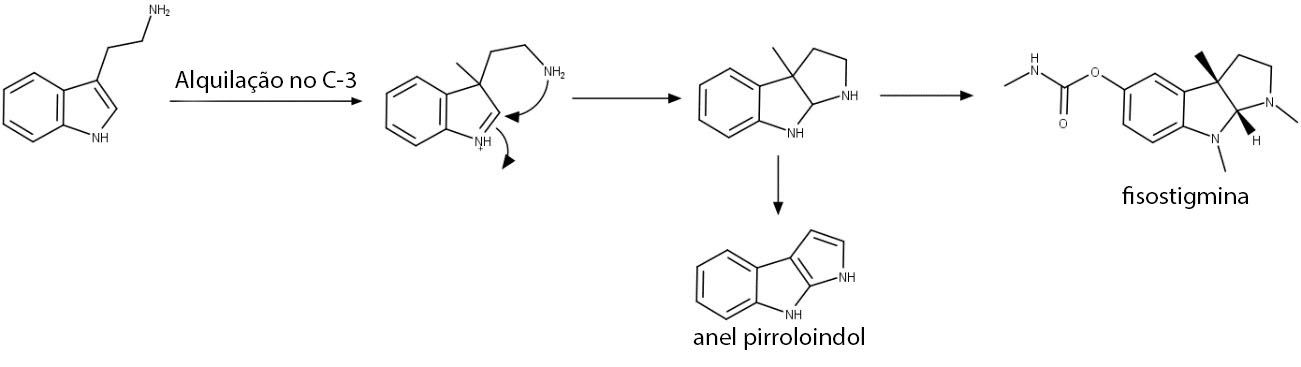
O anel indol dos alcaloides possui tanto o C-2 quanto o C-3 como nucleófilos, porém reações envolvendo o C-2 parecem ser as mais comuns na biossíntese dos alcaloides. Apesar disso, há alguns casos em que a reação ocorre pelo C-3, e o esqueleto pirroloindol da fisostigmina é um deles. Depois de outras modificações, temos a fisostigmina (figura 54).
Esqueleto Pirroloindol
O esqueleto pirroloindol é formado pela metilação em C-3 da triptamina, seguida de ataque nucleofílico intramolecular.
A fisostigmina é encontrada em sementes de Physostigma venenosum (Leguminosae) e possui atividade anticolinesterase. A fisostigmina inibe reversivelmente a acetilcolinesterase, impedindo a degradação da acetilcolina e aumentando a atividade colinérgica. Ela não é utilizada na clínica como medicamento, mas teve um papel fundamental na investigação da função da acetilcolina como um neurotransmissor.
Saiba mais
Como prolonga o efeito da acetilcolina endógena, a fisostigmina é usada como antídoto para intoxicações anticolinérgicas, como com a atropina, e reverte os efeitos de relaxantes musculares, como a tubocurarina. Análogos da fisostigmina foram desenvolvidos e testados para o tratamento da doença de Alzheimer e contra o mal de Parkinson.
Alcaloides do Ergot
O Ergot é uma doença que acomete grãos e é causada por espécies de Claviceps. Ela é caracterizada pela formação de ergots duros (chamados de esclerócios), que são o estágio de repouso do fungo, no lugar das sementes normais.
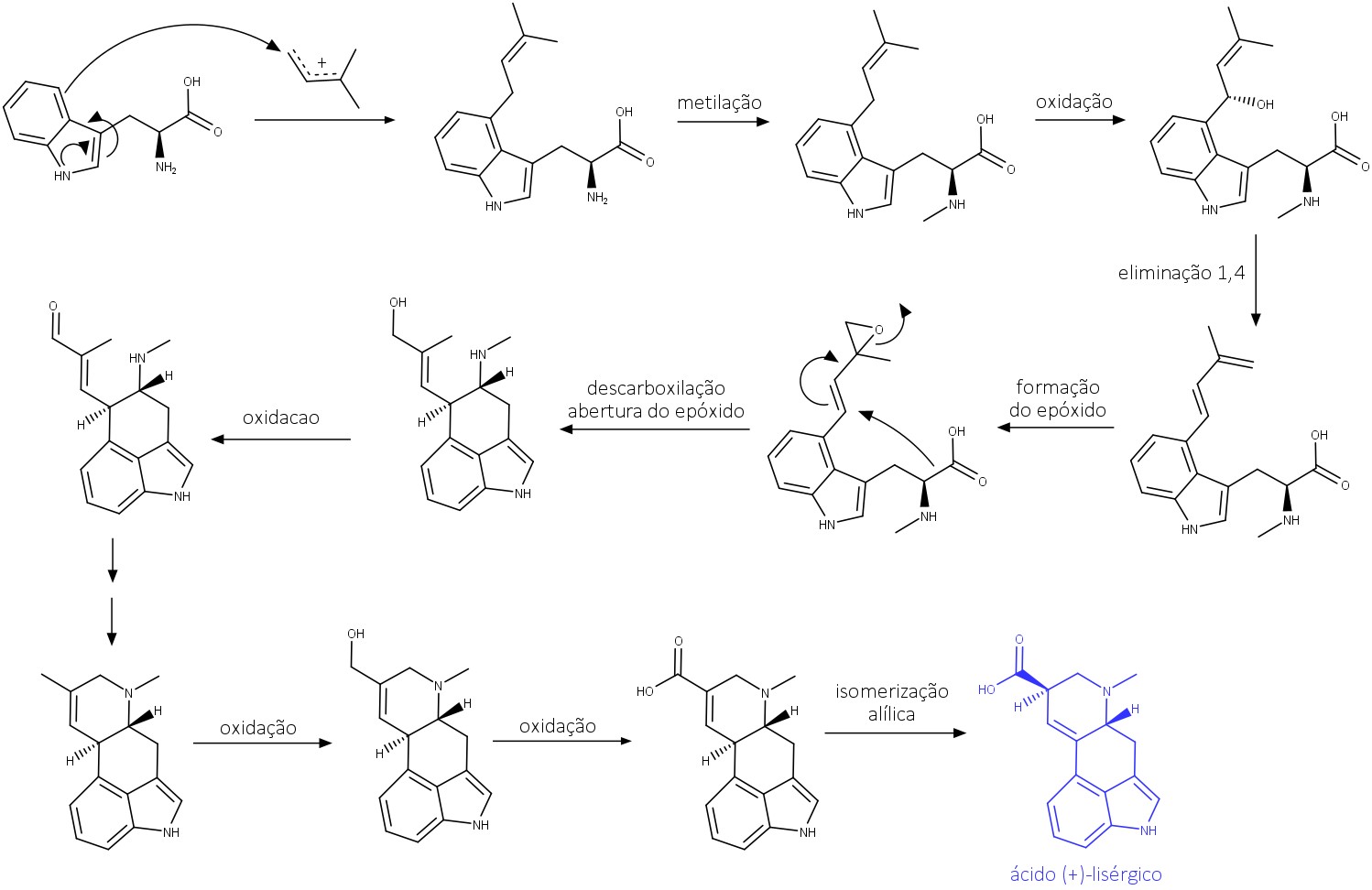
As propriedades venenosas do Ergot em grãos, especialmente o centeio, são conhecidas há muito tempo. Os chamados alcaloides do Ergot ou ergolinas são os responsáveis pela toxicidade. Eles possuem como precursor o ácido (+)-lisérgico, cuja biossíntese ocorre a partir do L-triptofano e do isopreno (figura 55). São divididos em dois grupos:
- Os derivados de aminoácidos solúveis em água (cerca de 20% dos alcaloides).
- Os derivados de peptídeos insolúveis em água (cerca de 80% dos alcaloides).
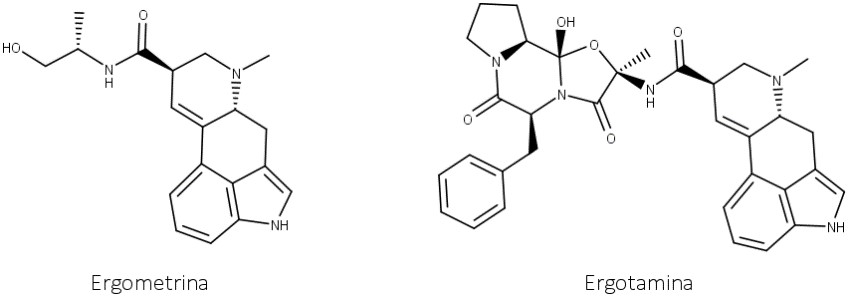
Apesar da toxicidade, estudos mostraram que alguns alcaloides derivados do ácido (+)-lisérgico possuem ações farmacológicas importantes e, por isso, são usados terapeuticamente. Dentre os alcaloides derivados de aminoácidos, a ergometrina é o mais importante, e, dentre os derivados do peptídeo, a ergotamina se destaca (figura 56).
A ergometrina possui ação vasoconstritora e é um forte estimulante de contração uterina. Ela é utilizada por via parenteral nas etapas finais do trabalho e imediatamente após o parto, especialmente se ocorrer hemorragia. Também é ativa por via oral e estimula o músculo uterino mais rapidamente do que os outros alcaloides do Ergot.
A ergotamina é um agonista parcial dos receptores α-adrenérgicos e 5-HT. Não é adequada para uso obstétrico, uma vez que também produz uma ação vasoconstritora periférica pronunciada. Ela é muito usada no tratamento da enxaqueca por reverter a dilatação dos vasos sanguíneos cranianos.
Atenção
É eficaz por via oral e pode ser combinada com cafeína para aumentar sua ação. Não produz nenhum efeito analgésico ou sedante. Disso resulta sua associação com o paracetamol, o ácido acetilsalicílico e a dipirona sódica.
LSD
O derivado do ácido lisérgico mais conhecido é a dietilamida do ácido lisérgico ou LSD (figura 57). Ela foi desenvolvida em 1943 por Albert Hoffman, que a experimentou em si mesmo, comprovando as alucinações. Após ingerido, o LSD promove mudanças de humor, alteração da sensação do tempo, distorção visual e auditiva, despersonalização e perda da realidade. Durante as viagens, podem surgir crises de pânico e paranoias.
O LSD atua principalmente como agonista dos receptores da serotonina, em especial os 5HT1 e 5HT2. Embora a droga não seja viciante, pode levar à esquizofrenia. Além disso, há o perigo de acidentes físicos graves ocorrerem enquanto o usuário está sob a influência da droga.
Drogas vegetais contendo alcaloides do Ergot
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Indicação farmacêutica |
Nome popular
Esporão do Centeio
Nome científico
Claviceps purpurea (figura 58)
Droga vegetal
Esclerócito.
Preparação padrão
Para promover efeitos farmacológicos, no Ergot, a quantidade de alcaloides totais deve ser superior a 0,15% (calculados como ergotamina), enquanto o conteúdo de alcaloides hidrossolúveis (calculados como ergometrina) deve ser superior a 0,023%.
Composição química
Ergometrina, ergometrinina, ergotamina.
Indicação farmacêutica
Não há uso terapêutico do Ergot, somente de alcaloides isolados.
Alcaloides provenientes da via do chiquimato e drogas vegetais correlacionadas
O especialista Marco Rocha fala sobre a importância da via do chiquimato para a biossíntese dos alcaloides, e discorre um pouco sobre as estruturas formadas e as plantas que os contêm.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
MÓDULO 4
Descrever os alcaloides de precursores não aminoácidos
Características gerais e origem biossintética dos alcaloides de precursores não aminoácidos
Os alcaloides provenientes de percussores não aminoácidos são aqueles formados por meio de reações entre o Acetil-CoA e o Malonil-CoA e a partir das bases púricas. Nesse grupo, destacam-se os alcaloides mono-, sesqui-, diterpenoides, esteroidais e os alcaloides púricos. Existem, ainda, os alcaloides imidazólicos, derivados da L-histidina – um aminoácido formado a partir da glicólise e não pela via do acetato ou chiquimato.

Alcaloides imidazólicos
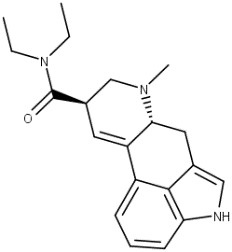
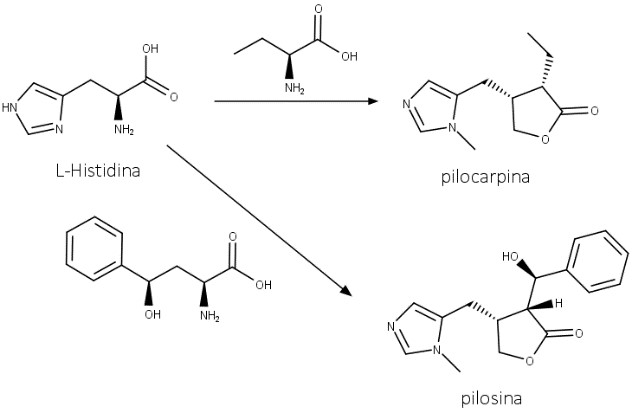
Pilocarpina e pilosina são alcaloides imidazólicos encontrados nas folhas de Jaborandi (Pilocarpus microphyllus e Pilocarpus jaborandi; Rutaceae) e derivados da L-histidina (figura 59).
Saiba mais
A pilocarpina é muito utilizada na oftalmologia. Ela é um agonista colinérgico, de ação predominantemente muscarínica, sem efeito nos receptores nicotínicos, usada no tratamento de glaucoma de ângulo aberto e, eventualmente, em glaucoma de ângulo fechado. Ela aumenta a drenagem do humor aquoso do olho, diminuindo a pressão intraocular.
A pilocarpina pode aumentar a secreção de glândulas salivares, lacrimais, bronquiais, gástricas, pancreáticas e intestinais, elevando a eliminação de água, ureia e cloreto de sódio. Aumenta, ainda, o tônus e as contrações estomacais. Ela pode causar broncoespasmos e é contraindicada para pacientes asmáticos. Também promove o aumento do tônus e motilidade nos ureteres, bexiga, vesícula e canais biliares. Não deve ser usada quando há a suspeita de cálculos.
Durante o tratamento, podem aparecer alterações da acomodação e dor no globo ocular, que passa em alguns dias. Caso haja intoxicação, deve-se administrar Diazepam para controlar os espasmos. Devido à sua capacidade de abrir os poros do cabeludo, o jaborandi, onde a pilocarpina é encontrada, também é utilizado em cosméticos, principalmente em xampus.
Drogas vegetais contendo alcaloides Imidazólicos
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Jaborandi
Nome científico
Pilocarpus microphyllus (figura 60)
Droga vegetal
Folhas e folíolos.
Preparação padrão
Deve conter no mínimo 0,3% de pilocarpina e no máximo 7% de impurezas.
Composição química
Alcaloides (0,5-1,0%): imidazólicos – pilocarpina (55%), pilocapidina, isopilocarpina, pilosina, isopilosina, epiisopilosina etc.
Propriedades farmacológicas
Estimula as secreções glandulares.
Indicação farmacêutica
Produtos cosméticos para estimular o crescimento dos cabelos.
Alcaloides derivados das reações de aminação
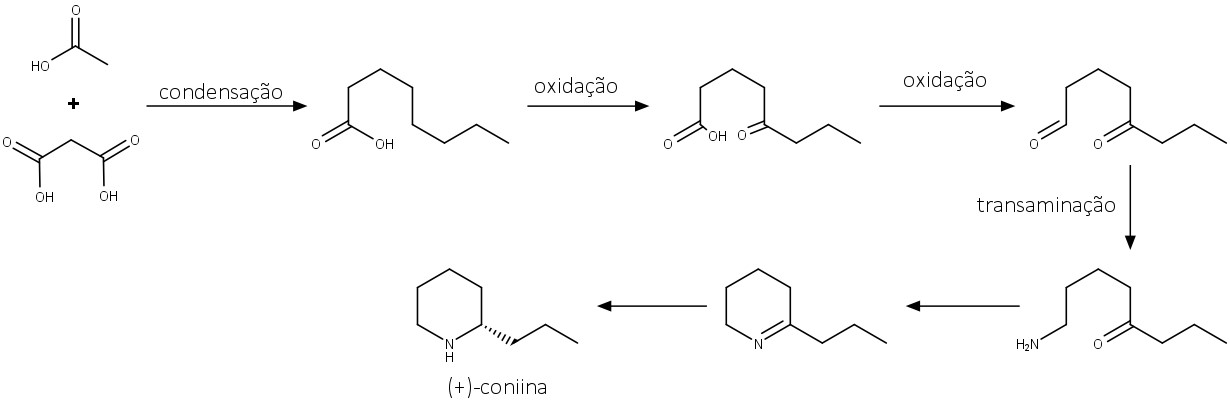
A coniina é um alcaloide com estrutura piperidínica que não é derivada da L-lisina, e sim do ácido cáprico, formado pelo acoplamento entre o acetato e o malonato (figura 61).
Você sabia
A coniina é encontrada na Cicuta (Conium maculatum) e foi isolada pela primeira vez em 1831. Antigamente, usavam-se os frutos secos não maduros como analgésico e sedativo, mas, atualmente, não há uso medicinal. A planta também era utilizada como veneno em execuções, uma vez que causa paralisia muscular gradual seguida de convulsões e morte por paralisia respiratória.
Todas as partes da planta são venenosas devido ao teor de alcaloides, embora a concentração mais alta de alcaloides seja encontrada na fruta verde (até 1,6%). O principal alcaloide (90%) é a coniina, com quantidades menores de outros alcaloides, como N-metilconiina e γ-coniceina.
A coniina é um antagonista de acetilcolina em receptor nicotínico na membrana pós-sináptica da junção neuromuscular. Sua ação resulta em toxicidade nicotínica. Como a coniina permanece ligada ao receptor, o nervo permanece despolarizado, inativando-o. Ocorre, então, uma paralisia flácida, semelhante à do curare, que leva à morte. Devido à sua lipofilicidade, é útil em aplicações tópicas para os casos de neuralgias.
Drogas vegetais contendo alcaloides derivados de reações de aminação
| Nome popular |
| Nome científico |
| Droga vegetal |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Cicuta
Nome científico
Conium maculatum (figura 62)
Droga vegetal
Fruto.
Composição química
Alcaloides piperidínicos (2%): coniina, γ-coniceína, metilcicutina, coniceína, conhidrina, pseudoconhidrina, paraconina.
Propriedades farmacológicas
A cicuta era usada na Antiguidade na execução de pessoas, inclusive na execução de Sócrates.
Indicação farmacêutica
A cicuta só pode ser usada de forma externa como analgésico ou anestésico. Seu uso interno é vetado devido às grandes quantidades de alcaloides tóxicos. Os alcaloides são analgésicos e anestésicos por conta do seu efeito nas terminações nervosas sensitivas.
Alcaloides terpenoides
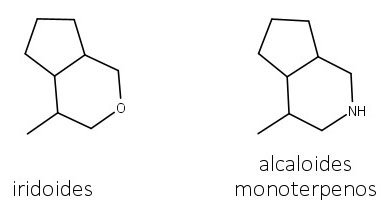
Diversos alcaloides com esqueletos mono, sesqui-, di- e tri-terpenoides já foram descritos, mas dados sobre sua biossíntese são escassos. Os alcaloides monoterpenos possuem estrutura relacionada aos iridoides. O heterociclo de oxigênio é substituído por um heterociclo com nitrogênio (figura 63).
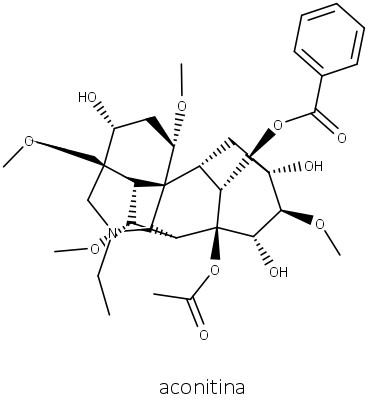
Um tipo de alcaloide terpenoide que se destaca são aqueles encontrados nos gêneros Aconitum (Ranunculaceae) e Delphinium (Ranunculaceae). As plantas de ambos os gêneros são altamente tóxicas devido à presença dos alcaloides diterpenoides. Acônito é extremamente tóxico por conta da aconitina (figura 64) e de outros alcaloides relacionados.
Aconitina abre os canais de sódio, fazendo com que estes não sejam repolarizados nos músculos e neurônios. Os efeitos produzidos pelo envenenamento por acônito são: sensação de queimação e formigamento na boca, nos lábios, na língua e na garganta, quase que instantaneamente, de 10 a 20 minutos.
Geralmente, esses efeitos são seguidos por náuseas, salivação, vômitos violentos, parestesias generalizadas, fraqueza e dor extrema de 2 a 6 horas. Diarreia com cólica, paralisia do músculo esquelético, distúrbios do ritmo cardíaco, convulsões e morte podem ocorrer em até 8 horas.
Atenção
A toxicidade cardíaca frequentemente complica o envenenamento por aconitina grave com hipotensão, atrasos de condução e arritmias em 6 horas. A paralisia respiratória costuma ser a causa da morte. A dose letal mínima de aconitina é de 3 a 6 mg. 1 g da planta fresca pode conter de 2 a 20 mg de aconitina. Portanto, pequenas quantidades dessa planta podem ser letais.
Espécies da família Solanaceae possuem alcaloides esteroidais com esqueleto colestano C27, como, por exemplo, solasodina e tomatidina (figura 65). Esses alcaloides são análogos nitrogenados de saponinas esteroidais. Os alcaloides esteroidais normalmente são glicosídeos, que são parecidos com as saponinas, mas são tóxicos se ingeridos.
Drogas vegetais contendo alcaloides terpenoides
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
| Indicação farmacêutica |
Nome popular
Acônito
Nome científico
Aconitum vulgaris DC. sin. A. napellus L. (figura 66)
Droga vegetal
Raiz.
Preparação padrão
A tintura é obtida a partir de raízes tuberosas de Aconitum napellus L., contendo, no mínimo, 0,05% de alcaloides totais expressos em aconitina.
Composição química
Alcaloides (0,5-1,5%): aconitina (30%), isoaconitina, mesaconitina, neopelina, napelina, napelonina, neolina, jesaconitina, entre outros.
Propriedades farmacológicas
A tintura é usada nos países orientais para analgesia.
Indicação farmacêutica
Devido à sua toxidez, raramente, é usado como medicinal.
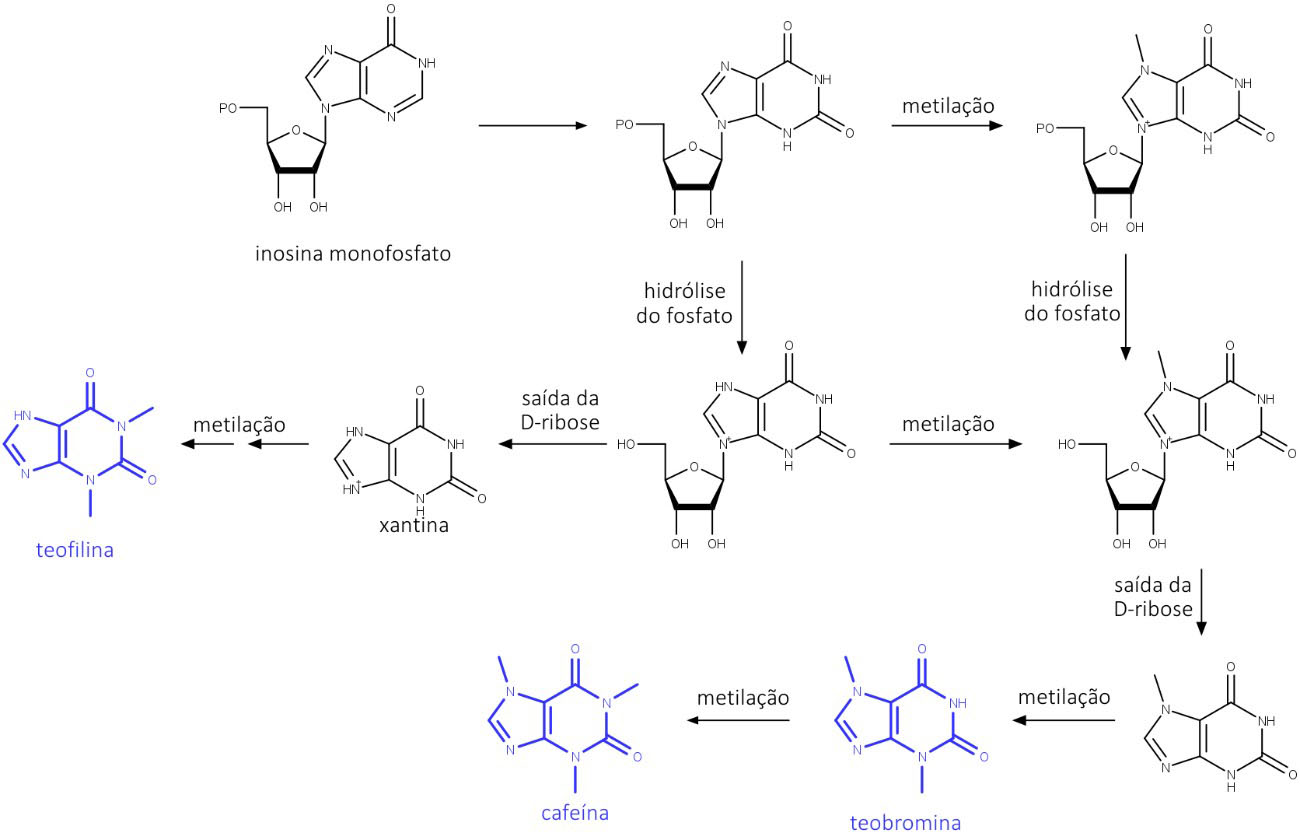
Alcaloides púricos (metilxantinas)
Conhecidos como metilxantinas, os alcaloides purínicos cafeína, teobromina e teofilina possuem biossíntese relacionada às das bases púricas adenina e guanina (figura 67) – componentes fundamentais dos nucleosídeos, nucleotídeos e ácidos nucléicos. Por isso, possuem esqueleto característico.
Com exceção da cafeína, que tem caráter básico, todas as demais metilxantinas são anfóteras. São encontradas em aproximadamente 60 espécies vegetais, distribuídas, especialmente, nos gêneros Coffea, Cola e Theobroma, Paullinia, Ilex e Camellia.
Saiba mais
De modo geral, as metilxantinas inibem a enzima fosfodiesterase, aumentando AMPc e, por consequência, a liberação de adrenalina. Isso leva à estimulação do SNC, ao relaxamento da musculatura lisa dos brônquios e à indução da diurese.
A cafeína, encontrada em espécies utilizadas para preparação de bebidas como chá, café e cola, tem efeito estimulante e é amplamente consumida. Entre as três metilxantinas, é a que possui maior atividade estimulante. De 150 a 300 mg de cafeína produzem um estímulo que resulta em maior estado de alerta, melhor associação de ideias e de atividades intelectuais, maior concentração e resistência ao cansaço, juntamente com uma sensação de bem-estar. Em doses altas, pode abolir o efeito de sedativos como os barbitúricos.
A teofilina possui propriedades relaxantes musculares e é utilizada para tratamento da asma brônquica. A teobromina, por sua vez, está presente no cacau e em produtos derivados do chocolate. Já as xantinas são irritantes para mucosa gástrica e são mais danosas quando associadas ao ácido acetilsalicílico. A superdosagem de metilxantinas produz insônia, nervosismo, taquicardia e ansiedade.
Drogas vegetais contendo metilxantinas
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Café
Nome científico
Coffea arabica L., C. canephora Pierre ex. A. Froehner, C. liberica Hiern (figura 68)
Droga vegetal
Sementes, de preferência não torradas.
Preparação padrão
Percolação aquosa à quente.
Composição química
As sementes de café contêm 1-2% de cafeína e traços de teofilina e teobromina. A cafeína normalmente está associada ao ácido clorogênico.
Propriedades farmacológicas
Estimulantes, iguais às da cafeína.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Guaraná
Nome científico
Paullinia cupana (figura 69)
Droga vegetal
Sementes secas.
Preparação padrão
Extrato fluido e tintura. A tintura deve conter, no mínimo, 0,35% de cafeína. O extrato fluido deve conter, no mínimo, 3,5% de cafeína.
Composição química
Cafeína (3-5%) e pequenas quantidades de teofilina (0-0,25%) e teobromina (0,02-0,06%).
Propriedades farmacológicas
Estimulantes, propriedades iguais às da cafeína.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Noz de cola
Nome científico
Espécies de Cola spp. (figura 70)
Droga vegetal
Sementes (cotilédones) de Cola nitida.
Preparação padrão
Extrato fluido contendo, no mínimo, 0,6% (p/v) de cafeína ou, no mínimo, 1,0% (p/v) de metilxantinas, expressos como cafeína.
Composição química
As sementes de cola contêm até 3% de cafeína e cerca de 0,1% de teobromina, parcialmente ligadas a taninos.
Propriedades farmacológicas
Estimulantes, propriedades iguais às da cafeína.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Chá Verde
Nome científico
Camellia sinensis (figura 71)
Droga vegetal
Folhas.
Preparação padrão
Existem duas espécies de chá: verde e preto, e ambos provêm da mesma espécie. O chá verde não sofre processo de fermentação, diferentemente do chá preto, cujo processo muda a composição química e as propriedades organolépticas.
Composição química
Cafeína (1-4%) e pequenas quantidades (até 0,05%) tanto de teofilina quanto de teobromina.
Flavonoides: Catequinas (Teoflavinas).
Propriedades farmacológicas
As catequinas são antioxidantes e promovem efeitos benéficos contra as doenças cardiovasculares, os cânceres e o processo de envelhecimento em geral.
O chá verde, em particular, contém quantidades significativas de epigalocatequina – um antioxidante muito eficaz.
Nome popular
Cacau
Nome científico
Theobroma cacao (figura 72)
Droga vegetal
Sementes.
Composição química
As sementes contêm 35-50% de óleo (manteiga de cacau), 1-4% de teobromina e 0,2-0,5% de cafeína, além de taninos e óleos voláteis.
| Nome popular |
| Nome científico |
| Droga vegetal |
| Preparação padrão |
| Composição química |
| Propriedades farmacológicas |
Nome popular
Erva Mate
Nome científico
Ilex paraguariensis (figura 73)
Droga vegetal
A droga é constituída das folhas secas.
Preparação padrão
Chá
Composição química
Metilxantinas: 0,8-1,7% de cafeína e quantidades menores de teobromina (0,3-0,9%) com pouca ou nenhuma teofilina. Ácido clorogênico: (10-16%).
Propriedades farmacológicas
Estimulantes, iguais às da cafeína.
Alcaloides provenientes de outras vias e drogas vegetais correlacionadas
O especialista Marco Rocha fala sobre a importância das demais vias para a biossíntese dos alcaloides, e discorre um pouco sobre as estruturas formadas e as plantas que os contêm.
Verificando o aprendizado
ATENÇÃO!
Para desbloquear o próximo módulo, é necessário que você responda corretamente a uma das seguintes questões:
O conteúdo ainda não acabou.
Clique aqui e retorne para saber como desbloquear.
Conclusão
Considerações Finais
Estudamos os alcaloides formados na biossíntese vegetal, suas classes e os principais representantes de algumas classes. Além disso, conhecemos suas características químicas, os métodos de extração e detecção.
Vimos ainda as propriedades biológicas dos alcaloides, alguns exemplos de plantas e como suas propriedades farmacológicas estão relacionadas a esses compostos.
Podcast
Agora, o Doutor em Biotecnologia Vegetal Marco Rocha encerra o tema respondendo perguntas sobre alcaloides.
CONQUISTAS
Você atingiu os seguintes objetivos:
Definiu a biossíntese, a distribuição e os principais métodos de extração e identificação dos alcaloides.
Descreveu os alcaloides da via do Acetil-CoA.
Descreveu os alcaloides da via do chiquimato.
Descreveu os alcaloides de precursores não aminoácidos.


.jpg)
.jpg)
.jpg)
.jpg)